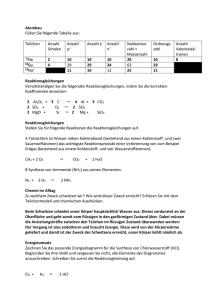
Klausur zur Vorlesung Anorganische Chemie I 1. (7 Punkte) Wie
Werbung

Klausur zur Vorlesung Anorganische Chemie I Kaiserslautern, 13. März 2009 Die Klausur besteht aus 13 Fragen, für deren Bearbeitung 120 Minuten Zeit zur Verfügung stehen. Es können 100 Punkte und zusätzlich bis zu zwei Bonuspunkte erreicht werden, wobei für das Bestehen der Klausur 40 Punkte erforderlich sind. Zur Beantwortung der Fragen genügen Formeln, Zeichnungen, Reaktionsgleichungen oder Stichpunkte. Bitte ordnen Sie Ihre Antworten in der durch die Nummerierung der Fragen vorgegebenen Reihenfolge an. Dies wird Ihnen gelingen, wenn Sie für zunächst nicht geläufige Antworten einige Zeilen freilassen 1. (7 Punkte) Wie kann man sich auf einfache Weise den Zusammenhalt zwischen Metallatomen vorstellen? (2 Punkte, Stichworte genügen, einfaches Modell, keine Diskussion von Orbitalwechselwirkungen). Warum leiten Metalle Wärme und elektrischen Strom sehr gut? (1 Punkt). Nennen Sie je eine natürlich vorkommende Verbindung für die drei leichtesten Alkalimetalle (3 P.) und geben Sie für ein Alkalimetall eine Reaktionsgleichung an zu dessen Herstellung durch chemische Reduktion (nicht durch Elektrolyse, 1 P.). 2. (3 Punkte) In der ersten Hauptgruppe des Periodensystems zeigen sich von oben nach unten folgende Trends (bitte richtige Antworten ankreuzen): Die Reaktivität nimmt ab nimmt zu bleibt gleich Der Schmelzpunkt nimmt ab nimmt zu bleibt gleich Das 1. Ionisierungspotenzial nimmt ab nimmt zu bleibt gleich 3. (3 Punkte) Welche Beobachtung macht man beim Eintragen von Alkali- oder Erdalkalimetallen in flüssiges Ammoniak? Geben Sie eine Reaktionsgleichung an für den Vorgang, der rasch abläuft und eine weitere Reaktionsgleichung für die nachfolgende langsame Zersetzung. 4. (8 Punkte) Beschreiben Sie anhand von Reaktionsgleichungen (je 1 P.) die Herstellung von Magnesiumhydrid und Calciumhydrid. Warum braucht man einmal ein Katalysatorsystem (welches, bitte angeben, 2 P.), im anderen Fall nicht? Geben Sie Folgereaktionen an für Calciumhydrid mit Wasser und mit Kohlenstoffdioxid. Welche technische Anwendung ist für Magnesiumhydrid denkbar, wofür wird Calciumhydrid verwendet? (bitte je eine Angabe) 5. (12 Punkte) Nennen Sie eine natürlich vorkommende Borverbindung (1 P.) und schlagen Sie eine Reaktionsfolge vor von der natürlichen Quelle bis zum Dinatriumdecaboranat Na2B10H10 (6 P.; je nach Auftrennung in Einzelschritte sieben Reaktionsgleichungen, eine davon lautet: 2 B2H6 + 2 NaH → 2 Na[BH4]. Falls Ihnen ein Zwischenschritt nicht einfällt, überspringen Sie diesen und setzen die Reaktionsfolge fort). Geben Sie an, wie viele Valenzelektronen am Aufbau des Decaboranat-Clustergerüstes beteiligt sind und erklären Sie anhand von Wechselwirkungen der Atomorbitale, warum diese Zahl so gut passt. (Fertigen Sie bitte keine ausgedehnten Clusterskizzen an, eine BH-Einheit mit den dazugehörigen Atomorbitalen und stichpunktartigen Angaben zur Verknüpfung mit anderen BH-Einheiten genügen; 4 P.). Nennen Sie ein Stichwort zur Struktur des Decaboranat-Anions (1 P.) 6. (5 Punkte) Skizzieren Sie das aus Boratomen bestehende Gerüst der Verbindungen B10H14, Cr3B4 und LaB6. Nennen Sie zwei Materialeigenschaften von Übergangsmetallboriden. 7) (4 Punkte) Welche Oxidationsstufe des Thalliums ist besonders stabil und welche Ähnlichkeit des entsprechenden Ions mit einem anderen, für den menschlichen Körper lebenswichtigen Ion (welches?) ist für die Toxizität der Thalliumsalze verantwortlich? Geben Sie für diese Ähnlichkeit ein chemisches Beispiel (Ähnliche Reaktivität oder ähnliche Eigenschaft einer Verbindung) an. 8) (8 Punkte) Geben Sie Reaktionsgleichungen an für zwei Verfahren zur Herstellung von Cyanwasserstoff sowie drei Reaktionsgleichungen zur Herstellung von Dicyan aus Cyanwasserstoff oder Cyanid-Ionen. Skizzieren Sie eine Valenzstrichformel für das aus Dicyan erhältliche Polymer (Paracyan) und beschreiben Sie in Stichworten dessen Verhalten beim Erhitzen. 9) (12 Punkte) Skizzieren Sie die Diamantstruktur (3 P.) und nennen Sie drei weitere chemische Elemente mit gleicher Struktur (1 P.). Vergleichen Sie die elektrische Leitfähigkeit der vier Elemente und begründen Sie die Unterschiede (2 P.). Welcher generell zu beobachtende Trend in der Chemie der Hauptgruppenelemente ist für diesen Unterschied verantwortlich? (1 P.). Eines der genannten Materialien ist die Grundlage der Mikroelektronik. Wie kann dessen Leitfähigkeit modifiziert werden? Geben Sie für zwei Arten der Modifizierung Valenzstrichformeln und die zur Beschreibung dieses Sachverhalts üblichen Energiediagramme an (5 P.). 10) (12 Punkte) Nennen Sie vier natürliche Arsenmineralien mit Namen und Formel (4 P.) und schlagen Sie zwei Reaktionsgleichungen vor zur Herstellung von Arsan (AsH3) aus Arsenverbindungen der Oxidationsstufe +III (4 P.). (Denken Sie an Ihre Erfahrungen aus dem AC I – Praktikum und an Methoden zur Herstellung von anderen Hydriden der Hauptgruppenelemente). Vergleichen Sie die Bindungswinkel im AsH3 mit denen im NH3 (keine genauen Zahlenangaben nötig) und begründen Sie den Unterschied (3 P.). Welche Spezies findet sich im Arsendampf knapp oberhalb des Siedepunktes? (Tip: Denken Sie an Phosphor) 11) (6 Punkte) Skizzieren Sie die Strukturen von P4O6 sowie von zwei P4S6-Isomeren, ordnen Sie den P-Atomen jeweils Oxidationsstufen zu und begründen Sie, warum in einem Fall nur eine und im anderen Fall fünf isomere Strukturen existieren. 12) (14 Punkte) Nennen Sie drei einfache Ausgangsverbindungen, aus denen in einer komplizierten Reaktion S4N4 entsteht (3 P.). Skizzieren Sie die Struktur von S4N4 und begründen Sie anhand eines MO-Diagramms, warum kein planarer Achtring gebildet wird (6 P.). Geben Sie fünf Reaktionsgleichungen an für Umsetzungen von S4N4 mit Reaktionspartnern Ihrer Wahl. 13) (6 Punkte) Formulieren Sie Reaktionsgleichungen zur Herstellung von Verbindungen der Halogene in folgenden Oxidationsstufen: +1/3, +1/2, +I, +III, +V und +VII. Für Abwechslung bei der Wahl der Oxidationsmittel (falls benötigt) und der Zusammensetzung der Produkte werden zwei Extrapunkte gewährt. Klausur zur Vorlesung Anorganische Chemie I Kaiserslautern, 9. April 2009 Die Klausur besteht aus 13 Fragen, für deren Bearbeitung 120 Minuten Zeit zur Verfügung stehen. Es können 100 Punkte und zusätzlich bis zu zwei Bonuspunkte erreicht werden, wobei für das Bestehen der Klausur 40 Punkte erforderlich sind. Zur Beantwortung der Fragen genügen Formeln, Zeichnungen, Reaktionsgleichungen oder Stichpunkte. Bitte ordnen Sie Ihre Antworten in der durch die Nummerierung der Fragen vorgegebenen Reihenfolge an. Dies wird Ihnen gelingen, wenn Sie für zunächst nicht geläufige Antworten einige Zeilen freilassen 1. (7 Punkte) Wie kann man Sodid-Ionen herstellen (eine Reaktionsgleichung) und welches Salz ist isostrukturell mit dem so hergestellten Salz? Geben Sie einen Grund an für die nahezu identischen Strukturen der beiden Verbindungen. Wie entstehen Elektride (zwei Reaktionsgeichungen)? Welche beiden Faktoren begünstigen die Bildung dieser salzartigen Verbindung (andere Formulierung: Wodurch wird die Ablösung eines Valenzelektrons ermöglicht bzw. erleichtert)? 2 Na + 2,2,2-crypt → [Na(2,2,2-crypt)]+ Na-; Iodid [Na(2,2,2-crypt)]+ I- isostrukturell, Iodid hat praktisch den gleichen Ionenradius wie Sodid. Elektride (zwei waren gefordert, nachstehend fünf Optionen): Cs + 2 18-Krone-6 → [Cs(18-Krone-6)2]+ e- ; Na + 2,2,2-crypt → [Na(2,2,2-crypt)]+ e-; (nur die Stöchiometrie ist anders als zuvor). Natrium in Ammoniak: Na + (x+y) NH3 → [Na(NH3)x]+ [e-( NH3)y]- ; Es gab noch zwei andere Möglichkeiten aus dem Vorlesungsstoff zur Auswahl: La + 6 B → LaB6 (Elektrid, die Bestandteile sind B62-, La3+ und e-) Ca3AuN ist ebenfalls ein Elektrid, welches aus Ca2+, Au- und N3- besteht und zwei Elektronen pro Formeleinheit aufweist, dies wurde von einigen Studierenden in der Klausur auch so dargestellt. 2. (3 Punkte) In der fünften Hauptgruppe des Periodensystems zeigen sich von oben nach unten folgende Trends (bitte richtige Antworten ankreuzen): Der metallische Charakter nimmt ab nimmt zu bleibt gleich Die Stabilität der Oxidationsstufe +V nimmt ab nimmt zu bleibt gleich Das 1. Ionisierungspotenzial nimmt ab nimmt zu bleibt gleich 3. (6 Punkte) Geben Sie Reaktionsgleichungen für die Herstellung (eine Gleichung) und Reinigung (zwei Reaktionsgleichungen, ein Stichwort zum eigentlichen Reinigungsvorgang) von Silizium sowie ein Stichwort für eine weitere Reinigungsstufe an. Geben Sie zwei Reaktionsgleichungen an für die Ätzung bzw. Politur der Oberfläche von Silizium. SiO2 + 2 C → Si + 2 CO Si + 3 HCl → HSiCl3 + H2 Trichlorsilan wird durch Destillation gereinigt HSiCl3 + H2 → Si + 3 HCl Silizium wird abgeschieden Stichwort zur weiteren Reinigung: Zonenschmelzen oder Tiegelziehen (Kristallisation aus der Schmelze) Si + 2 H2O + OH- → HSiO3- + 2 H2 Si + 4 HNO3 → SiO2 + 2 H2O + 4 NO2 Si + 6 HF → H2SiF6 + 2 H2 4. (5 Punkte) Geben Sie Reaktionsgleichungen an für die Herstellung einer Silizium- und einer Zinnverbindung mit Si=Si- bzw. Sn=Sn-Doppelbindung. Machen Sie stichwortartige Angaben zur Struktur und erläutern Sie die Bindungsverhältnisse in der Zinnverbindung anhand einer Skizze. Ar2Si(SiMe3)2 → ½ Ar2Si=SiAr2 + Me3Si-SiMe3 (UV-Bestrahlung bei -60 °C, Ar = Mesityl) 2 SnCl2 + 4 LiCH(SiMe3)2 → [(Me3Si)2HC]2Sn=Sn[CH(SiMe3)2]2 Pyramidale Struktur an Silizium und Zinn Die Skizze soll zeigen: sp2-Hybridisierung, Donor-Akzeptor-Wechselwirkung, als Donor fungiert ein gefülltes sp2-Hybridorbital, Akzeptor ist das leere pz-Orbital. 5. (7 Punkte) Skizzieren Sie die Silikat-Teilstrukturen (ohne Metallkationen oder HydroxidIonen) folgender Silikatmineralien: Mg2(SiO4), Pb3(Si2O7), Be3Al2(Si6O18), Mg(SiO3), Ca2Mg5(OH)2(Si4O11)2, Al2(OH)4(Si2O5). Tip: Ordnen Sie dem Silikat-Anion (stets in Klammern geschrieben) die korrekte Ladung zu, beachten Sie Metall- und Hydroxid-Ionen nicht weiter und erschließen Sie aus der Formel und der Ladung die Silikat-Teilstruktur. Geben Sie für eines der Mineralien den Mineralnamen an. [Si2O5]2Mineralnamen (ein Name war gefragt, für bis zu zwei weitere wurden Bonuspunkte erteilt): Forsterit: Mg2SiO4; Barysilit: Pb3[Si2O7]; Beryll: Be3Al2[Si6O18]; Enstatit: MgSiO3; Tremolit: Ca2Mg5(OH)2(Si4O11)2; Kaolinit: Al2(OH)4(Si2O5). 6. (15 Punkte) Beschreiben Sie anhand von Reaktionsgleichungen (je 1 P.) die Herstellung von Diimin (drei Rk.-gleichungen), Tetrazen und Hydroxylamin (je eine Rk.-gleichung). Welche Isomeren kennt man beim Diimin und nach welchen Reaktionsgleichungen zerfällt diese instabile Verbindung (drei Rk.-gleichungen)? Welche Reaktivität zeigt Diimin und welcher ungewöhnliche Aspekt ist daran bemerkenswert? Belegen Sie diese Reaktivität anhand von drei Reaktionsgleichungen. OOC-N=N-COO- + 2 H+ → HN=NH + 2 CO2 - N2H4 + H2O2 → HN=NH + 2 H2O (oder auch Oxidation mit O2) TosNH-NHM → trans-HN=NH + TosM (M = Li, Na, K) Tetrazen: (Me3Si)2N-N=N-N(SiMe3)2 + 4 F3C-COOH → H2N-N=N-NH2 Hydroxylamin: HNO2 + 2 SO2 + 3 H2O → H2NOH + 2 H2SO4 oder großtechnisch aus NO2 durch Hydrierung Isomere: Cis, trans und iso, Reaktivität starke Reduktionsmittel, die bereits bei sehr tiefen Temperaturen wirksam sind. Zerfall (drei Gleichungen waren gefordert): 2 N2H2 → N2 + N2H4 N2H2 → N2 + H2 2 N2H2 → NH3 + HN3 3 N2H2 → 2 NH3 + 2 N2 Reaktionen: (drei Gleichungen waren gefordert): O2 + N2H2 → H2O2 + N2 bei -196 °C H2SO4 + N2H2 → SO2 + 2 H2O bei -100 °C P4O10 + 10 N2H2 → P4 + 10 H2O bei -100 °C CCl4 + N2H2 → H2CCl2, HCCl3, HCl bei -196 °C 7. (14 Punkte) Nennen Sie drei einfache Ausgangsverbindungen, aus denen in einer komplizierten Reaktion S4N4 entsteht (3 P.). Skizzieren Sie die Struktur von S4N4 und begründen Sie anhand eines MO-Diagramms, warum kein planarer Achtring gebildet wird (6 P.). Geben Sie fünf Reaktionsgleichungen an für Umsetzungen von S4N4 mit Reaktionspartnern Ihrer Wahl. Ausgangsverbindungen: S2Cl2, SCl2, NH3 Sechs Reaktionsgleichungen zur Auswahl (fünf waren gefragt): S4N4 + 4 AgF → S4(NF)4 + 4 Ag S4N4 + 2 SnCl2 + 4 EtOH → S4(NH)4 + 2 SnCl2(OEt)2 S4N4 → 2 S2N2¸ (Erhitzen, Silberwolle als Katalysator) S4N4 + N3- → S3N3- + Nebenprodukte S4N4 + 3 SbCl5 → [S4N4]2+ [SbCl6]- + SbCl3 S4N4 + 2 SnCl2 + 4 EtOH → S4(NH)4 + 2 SnCl2 S4N4 + NH3 → [S4N5]- + Nebenprodukte 8. (11 Punkte) Nennen Sie eine natürlich vorkommende Phosphorverbindung (1 P.) und schlagen Sie eine Reaktionsfolge vor von der natürlichen Quelle bis zum Polyphosphazen [NP(OEt)2]x (fünf Reaktionsgleichungen). Falls Ihnen ein Zwischenschritt nicht einfällt, überspringen Sie diesen und setzen die Reaktionsfolge fort. Skizzieren Sie die Struktur der Zwischenstufe N3P3Cl6 und diskutieren Sie (knapp, in Stichworten), ob es sich um eine aromatische Verbindung handelt (4 Punkte). Nennen Sie eine Anwendungsmöglichkeit für das Polybis(ethoxy)phosphazen. Mineralien zur Auswahl (eines war gefragt): Ca5(PO4)3OH (Hydroxylapatit), Ca5(PO4)3F (Fluorapatit), Ca10(PO4)6(CO3) (Carbonatapatit), Fe3(PO4)2 . 8 H2O (Vivianit, Blaueisenerz) 2 Ca3(PO4)2 + 6 SiO2 + 10 C → P4 + 6 CaSiO3 + 10 CO P4 + 10 Cl2 → 4 PCl5 3 PCl5 + 3 NH4Cl → [NPCl2]3 + 12 HCl [NPCl2]3 → 3/x [NPCl2]x Polymerisation beim Erhitzen [NPCl2]x + 2x NaOEt → [NP(OEt)2]x + 2x NaCl Substitution Bei der Strukturskizze des cyclo-[NPCl2]3 bestand der häufigste Fehler darin, jedes P- und NAtom mit je einem Chloro-Substituenten zu versehen. Richtig ist: Cl Cl P Cl Cl N N P P N Cl Cl Stichpunkte für die Diskussion (drei Aspekte sollten genannt werden): PN-Abstände gleich, planarer Ring, Hückel-Regel erfüllt (sechs π-Elektronen), trotzdem kein Aromat wegen des Elektronegativitätsunterschieds zwischen P und N keine vollständige Delokalisierung, inselartige Delokalisierung. 9. (14 Punkte) Skizzieren Sie die Strukturen (je zwei Punkte) von Bornitrid (zwei Strukturtypen), Lithiumnitrid und Titannitrid. Geben Sie für jede der vier Verbindungen Stichworte zu den Eigenschaften an und schreiben Sie für eine der Verbindungen eine Reaktionsgleichung für die Umsetzung mit Wasser. Hexagonales BN: Schichten wie Graphit, alle senkrecht und deckungsgleich übereinander, B über N und N über B; farblos, Isolator, Schmiermittel Kubisches BN: Diamantstruktur, hart Lithiumnitrid: N in der Ebene von 6 Li umgeben, diese Schichten werden über linear verbrückende Li+-Ionen verknüpft. Salzartig, hydrolyseempfindlich Titannitrid: NaCl-Typ, goldgelb, hart, leitfähig, chemisch inert. 10. (18 Punkte) Geben Sie Reaktionsgleichungen an zur Herstellung folgender Verbindungen und beschreiben Sie für jede der hier genannten Verbindungen die Struktur mit einem Stichwort oder einer Skizze. Br3+, ClF3, BrF5, FIO2, F2IO2-, OIF5, Xe2F3+, XeO3 (aus Xenonhexafluorid), HXeO4- . 7 Br2 + BrF5 + 5 AsF5 → 5 Br3+ [AsF6]-; gewinkelt Cl2 + 3 F2 → 2 ClF3 (T-förmig, die beiden nicht bindenden Elektronenpaare stehen äquatorial) Cl2 + 5 F2 → 2 BrF5 (quadratische Pyramide, ein nicht bindendes Elektronenpaar wurde häufig vergessen) I2O5 + F2 → 2 FIO2 + ½ O2 (FIO2 ist pyramidal, ein n. b. Paar) OIF2 + F- → F2IO2- (F2IO2 ist bisphenoidal (Form einer Wippe), ein n. b. Paar in der Äquatorialebene) IF7 + POF3 → OIF5 + PF5 (OIF5 ist oktaedrisch) 2 XeF2 + AsF5 → Xe2F3+ [AsF6]- ([F-Xe-F-Xe-F]+, gewinkelt am zentralen Fluoratom, die Xenonatome sind linear von je zwei Fluoratomen umgeben) XeF6 + 3 H2O → XeO3 + 6 HF (XeO3 ist pyramidal, ein n. b. Paar) XeO3 + OH- → HXeO4- (H ist als OH gebunden, ein n. b. Paar in der Äquatorialebene einer trigonal-bipyramidalen Anordnung von vier bindenden und einem nicht bindenden Elektronenpaar; häufiger Fehler: H an Xe gebunden) Prof. Dr. Helmut Sitzmann Kaiserslautern, 23. März 2010 Klausur zur Vorlesung Anorganische Chemie I Die Klausur besteht aus 7 Fragen, die Bearbeitungszeit beträgt 75 Minuten. Von 75 möglichen Punkten sind für die Note 4.0 30 Punkte erforderlich. Bis zu drei Punkte aus den Übungen werden angerechnet. Bitte ordnen Sie Ihre Antworten in der durch Nummern angegebenen Reihenfolge an. Dies wird Ihnen gelingen, wenn Sie für zunächst nicht geläufige Antworten Platz freilassen. 1) (5 Punkte) Wasserstoff nimmt im Periodensystem der Elemente eine besondere Stellung ein. Nennen Sie ein Argument und eine Reaktionsgleichung, welche eine Zuordnung des Wasserstoffs zu den Halogenen unterstützen. Nennen Sie zwei Analogien zu den Alkalimetallen. Ein Wasserstoffmolekül kann zwei Elektronen aufnehmen, wobei die H-H-Bindung gespalten wird und zwei Hydrid-Anionen entstehen. Dieser Vorgang entspricht dem Reaktionsverhalten der Halogene. Wenn z. B. Natrium als Reaktionspartner verwendet wird, entsteht Natriumhydrid als ionische Verbindung. Dieses gehört dem NaCl-Strukturtyp an: H2 + 2 Na → 2 NaH Wasserstoffatome besitzen ein einzelnes s-Valenzelektron wie Alkalimetallatome. Wie Wasserstoff in Hydrid übergeführt werden kann, so kann z. B. auch Natrium in Sodid übergeführt werden. Wasserstoff bildet bei Oxidation ein Monokation wie Alkalimetalle. Hypothesen und theoretischen Rechnungen zufolge existiert bei sehr hohem Druck metallischer Wasserstoff. Dieser wird z. B. im Inneren des Planeten Jupiter vemutet. 2) (18 Punkte) Das folgende Formelschema gibt Reaktionsgleichungen an zur technischen Herstellung von Lithiumoxid aus Lithiumcarbonat. Ordnen Sie den fettgedruckten Zahlen die entsprechenden Reaktanden, Produkte oder Nebenprodukte zu und geben Sie dazu auch stöchiometrische Koeffizienten an. Li2CO3 + Ca(OH)2 → 2 LiOH + CaCO3 2 LiOH + 2 H2O2 → 2 LiOOH + 2 H2O 2 LiOOH → Li2O2 + H2O2 Li2O2 → Li2O + ½ O2 Geben Sie außerdem eine Reaktionsgleichung an für die Herstellung des Kaliumoxids K2O und beschreiben Sie anhand einer weiteren Reaktionsgleichung die Reaktion von Kalium beim Verbrennen an Luft. 2 KNO3 + 10 K → 6 K2O + N2 KNO3 + 5 KN3 → 3 K2O + 8 N2 K2O2 + 2 K → 2 K2O K + O2 → KO2 Zeichnen Sie die Struktur von einem Alkalimetallsuboxid, nennen Sie Summenformeln für zwei Alkalimetallsuboxide und nennen Sie zwei physikalische Eigenschaften von einem Vertreter dieser Substanzklasse. Struktur: Beispiel Rb9O2 (gezeigt sind die Rb+-Ionen, O2- befindet sich im Inneren der Oktaeder. Rb6O oktaedrisch, Cs11O3 analog, drei Oktaeder flächenverknüpft mit einem gemeinsamen Cs+-Kation. Summenformeln: Rb6O, Rb9O2, Cs11O3 Physikalische Eigenschaften: elektrisch leitfähig, metallisch glänzend, bronzefarben (Rb 6O), kupferfarben (Rb9O2), violett (Cs11O3). 3) (14 Punkte) Geben Sie für die Erdalkalimetalle außer Radium je ein natürlich vorkommendes Mineral mit Namen und Summenformel an. Nennen Sie stichpunktartig eine positive und drei negative Begleiterscheinungen des Vorkommens von Erdalkali-Kationen im Leitungswasser („Wasserhärte“). Wie unterscheidet sich die permanente von der temporären Wasserhärte? (Erwartet werden eine Reaktionsgleichung und ein kurzer Kommentar). Nennen Sie stichpunktartig drei Maßnahmen zur Beseitigung der Wasserhärte. Nur für Be, Mg, Ca, Sr, Ba ja ein Mineral; Auswahl: Be3Al2Si6O18 Beryll Mg6(O)8(Si4O10) Serpentin MgSO4 . H2O Mg2SiO4 Forsterit KCl . MgSO4 . 3 H2O Mg3(OH)2(Si4O10) Talk, Speckstein MgCl2. 6 H2O MgCO3 Magnesit, Bitterspat CaSO4 Anhydrit SrCO3 CaSO4 . 2 H2O Gips SrSO4 Ca5(PO4)3(F,OH) Apatit CaF2 Flussspat BaSO4 CaCO3 . MgCO3 Dolomit BaCO3 KCl . MgCl2 . 6 H2O Carnallit Kieserit Kainit Bischofit Strontianit Cölestin Baryt Witherit Hartes Wasser: Mineralien für den Körper ☺, Kalkflecken auf glatten Oberflächen , Kesselstein , Kalkseife macht Wäsche hart und kratzig , Haut auf Tee , hoher Waschmittelverbrauch , Defekte in Haushaltsgeräten (Kaffeemaschine, Waschmaschine, Spülmaschine) . Temporäre Härte verschwindet beim Erhitzen, weil lösliches Calcium- oder Magnesiumhydrogencarbonat in unlösliches Carbonat übergeht, ausfällt und abdekantiert oder abfiltriert werden kann: Ca(HCO3)2 → CaCO3 + H2O + CO2 Permanente Härte wird auch als Sulfathärte bezeichnet und verändert sich nicht beim Erhitzen. Beseitigung: Ionenaustauscher, Destillation, Komplexbildner 4) (8 Punkte) Nennen Sie drei der in der Technik geschätzten Materialeigenschaften von Übergangsmetallboriden und zeichnen Sie die Struktur der Verbindung LaB6. Stellen Sie knapp und übersichtlich dar, wie das Bor-Teilgitter dieser Substanz den Cluster-Elektronenzählregen von Wade genügt. Eigenschaften: hart, hitzestabil, chemisch inert, elektrisch leitfähig Struktur: CsCl-Typ, La3+ und B62- - Oktaeder, alle B-Atome auf den Achsen der Koordinatensystems. Bor-Teilgitter: B6-Oktaeder sind über 6 B-B-Bindungen mit jeweils sechs weiteren B6-Oktaedern verknüpft und tragen zwei negative Ladungen entsprechend der Formel [La 3+(B62-)(e-)] (Elektrid). Wir können demnach jedem Oktaeder 26 VE zuordnen (dabei sind die beiden B-B-Bindungselektronen der nach außen weisenden B-BBindungen jeweils mitgerechnet). Eigenbedarf 12 VE, es verbleiben 14 VE für den Cluster, das sind 7 GEP und entspricht dem closo-Typ nach der n+1 – Regel. 5) (11 Punkte) Welche Klassen von Carbiden kennt man (je ein Beispiel mit Summenformel angeben) und welche Carbide reagieren unter milden Bedingungen mit Wasser (zwei Beispiele mit Reaktionsgleichung)? Skizzieren Sie für zwei Beispiele aus verschiedenen Klassen die Struktur. Ionisch, CaC2 (NaCl-Strukturtyp mit verlängerter c-Achse, entlang dieser Achse orientieren sich die C22--Ionen) Kovalent SiC (ZnS-Strukturtyp) Metallisch NbC (NaCl-Strukturtyp), WC Ionische Carbide reagieren mit Wasser CaC2 + 2 H2O → Ca(OH)2 + C2H2 Al4C3 + 12 H2O → 4 Al(OH)3 + 3 CH4 6) (7 Punkte) Nennen Sie eine natürliche Quelle für das Element Tellur. Geben Sie eine Reaktionsgleichung an für die Herstellung einer Sauerstoffsäure des Tellurs. Wie kann man daraus die Verbindung F5TeOH herstellen (zwei Reaktionsgleichungen)? BiSeTe2 Kawazulith AuTe2 Calaverit Te oder TeO2 werden durch starke Oxidationsmittel wie KMnO4, CrO3 oder HClO3 in H6TeO6 übergeführt. Beispiel: 5 TeO2 + 2 KMnO4 + 12 H2O+ 6 H+ → 5 Te(OH)6 + 2 K+ + 2 Mn2+ H6TeO6 + Ba(OH)2 BaH4TeO6 + 2 H2O BaH4TeO6 + 5 FSO3H → F5TeOH + BaSO4 + 4 H2SO4 7) (12 Punkte) Skizzieren Sie die Struktur von vier der folgenden Moleküle und Ionen. Berücksichtigen Sie dabei nicht bindende Elektronenpaare am Zentralatom. Geben Sie Reaktionsgleichungen an für die Herstellung von vier geladenen Teilchen aus dieser Aufzählung: a) ClF3 Trigonale Bipyramide, zwei nicht bindende Elektronenpaare in der Äquatorialebene, b) I2Cl6 Planares Molekül, zwei nb-Paare pro Iodatom oberhalb und unterhalb der Molekülebene, c) BrF5 Quadratische Pyramide, dazu ein nb-Paar, d) IF7 Pentagonale Bipyramide e) Br5+ Z-Form, Br+ mit 3 nb-Paaren im Zentrum f) ClF2+ gewinkelt, g) BrF4+tbp, „Wippe“, ein nb-Paar in Äquatorialebene, h) IF6+ Oktaeder, i) IF2- linear, k) BrF4quadratisch planar, l) IF6- (pentagonale Pyramide oder Oktaeder wurden anerkannt), m) IF8- quadratisches Antiprisma, n) XeF2 linear, o) XeF82- (quadratisches Antiprisma). 5 Br2 7 Br2 + BrF5 + 5 AsF5 → 5 [Br3]+ [AsF6] - ⇄ 5 [Br5]+ [AsF6]2 ClF + BF3 → [Cl2F]+ [BF4]BrF5 + AsF5 → [BrF4]+ [AsF6] – IF7 + AsF5 → [IF6]+ [AsF6] – IF + F- → IF2BrF3 + F- → [BrF4]IF5 + F- → [IF6]IF7 + F- → [IF8]XeF6 + 2 NOF → [NO+]2 XeF82- Kaiserslautern, 27. April 2010 Klausur zur Vorlesung Anorganische Chemie I Die Klausur besteht aus 9 Fragen, die Bearbeitungszeit beträgt 80 Minuten. Von 75 möglichen Punkten sind für die Note 4.0 30 Punkte erforderlich. Bis zu drei Punkte aus den Übungen werden angerechnet. Bitte ordnen Sie Ihre Antworten in der durch Nummern angegebenen Reihenfolge an. Dies wird Ihnen gelingen, wenn Sie für zunächst nicht geläufige Antworten Platz freilassen. 1) (6 Punkte) Geben Sie zwei Reaktionsgleichungen an zur Herstellung von Alkalimetallen durch chemische Reduktion und eine Reaktionsgleichung zur Reduktion eines elementaren Alkalimetalls zum Anion. Cs2Cr2O7 + 2 Zr → 2 Cs + Cr2O3 + 2 ZrO2 2 NaN3 → 2 Na + 3 N2 (geht mit allen Alkalimetallen außer mit Lithium wegen Bildung von Li3N) 2 Na + 2,2,2-crypt → [Na(2,2,2-crypt)]+ Na- (Disproportionierung in Na+ und Sodid) 2) (11 Punkte) Ordnen Sie den Nummern chemische Verbindungen oder Elemente zu und geben Sie für 1 auch einen Mineralnamen an: 1 → CaO + 2; 1 = CaCO3 (Kalk, Kreide, Kalkspat, Calcit), 2 = CO2 3 CaO + 3 → 3 Ca + 4 3 = 2 Al; 4 = Al2O3 Begründen Sie in einer kurzen Formulierung die Richtung der zweiten Reaktion. Aluminium ist zwar edler als Calcium, doch ist Calcium von allen Reaktionspartnern am leichtesten flüchtig und wird aus dem Gleichgewicht abdestilliert. Zeichnen Sie ein Energieniveaudiagramm für ein elementares Erdalkalimetall. Wie heißt die Grenze zwischen besetzten und unbesetzten Zuständen? Tragen Sie diese Grenze in die Skizze ein. Beschreiben Sie in Stichworten die metallische Bindung: Metall-Kationen, dazwischen frei beweglich die Valenzelektronen des Metalls (Elektronengas). 3) (12 Punkte) Bor ist ein ungewöhnliches Element. Geben Sie Argumente an als Begründung für das relativ ungewöhnliche Verhalten von Bor (2 Punkte). Bor kann nicht leicht eine Edelgasschale erreichen. Es kann keine drei Valenzelektronen abgeben, weil das hypothetische Kation B 3+ sehr klein wäre und eine extrem hohe Ladungsdichte besäße. Um durch Aufnahme von fünf Elektronen eine Edelgasschale zu erreichen, ist Bor ebenfalls zu klein. Selbst bei größeren Atomen ist ein Anion M 5- nicht bekannt. Mit nur drei Valenzelektronen kann eine Edelgasschale auch nicht durch Bildung von kovalenten Bindungen erreicht werden. (Frustration). Nennen Sie je zwei Mineralien für Bor und Aluminium mit Namen und Formel (4 P.). Es folgt eine Auswahl: Na2[B4O6(OH)2] . 3H2O Kernit Na2[B4O5(OH)4] . 8H2O Borax Na[Mg3Al6(OH)4(BO3)3(Si6O18)] Turmalin (Dravit, braun bis grün) Na[FeII3(Al,Fe)6(OH)4(BO3)3(Si6O18)] Turmalin (Schörl, farblos bis tiefgrün, rot, blau) KAlSi3O8 Feldspat, Orthoklas NaAlSi3O8 Feldspat, Albit CaAl2Si2O8 Feldspat, Anorthit KAl3Si3O10(OH,F)2 Glimmer, Muskovit CaAl4Si2O10(OH)2 Glimmer, Margarit Al2O3 Korund Al2O3 mit Spuren von Cr2O3 Rubin Al2O3 mit Spuren von V2O5 oder TiO2 Saphir Aluminiumhydroxid-Mineralien Bauxit (Gemisch) -AlO(OH) Böhmit -AlO(OH) Diaspor -Al(OH)3 Hydrargillit Nennen Sie zwei physikalische Eigenschaften, in denen sich die beiden Elemente stark unterscheiden (2). Beispiele: Elektrische Leitfähigkeit, Härte, Schmelzpunkt, Siedepunkt, 1. Ionisierungsenergie Geben Sie eine Reaktionsgleichung an für die Herstellung von reinem, kristallinem Bor und eine für die Herstellung von rohem, amorphem Bor. 2 BCl3 + 3 H2 → 2 B + 3 HCl kristallines Bor 2 BI3 → 2 B + 3 I2 kristallines Bor B2O3 + 3 Mg → 2 B + 3 MgO amorphes Bor 4) (8 Punkte) Beschreiben Sie anhand von zwei aufeinander folgenden Reaktionsschritten die Herstellung von B4H10 aus BF3. 2 BF3 + 6 NaH → B2H6 + 6 NaF 2 B2H6 → B4H10 + H2 Skizzieren Sie die Struktur von B4H10 und zählen Sie Elektronen nach den Wade´schen Regeln. Um welchen Clustertyp handelt es sich? H H H B H B H H B H B H H H 43 + 101 = 22 VE. „Eigenbedarf“ 8 VE Für den Cluster bleiben 14 VE, das sind sieben GEP und entspricht dem n+3 – Typ (arachno). 5) (3 Punkte) Stellen Sie sich den Ausschnitt des Periodensystems der Elemente vor, der die Hauptgruppenelemente zeigt. Nennen Sie drei Eigenschaften, deren Ausprägung innerhalb einer Gruppe oder einer Periode kontinuierlich stärker oder schwächer wird. Beispiel: Der metallische Charakter nimmt von rechts nach links und von oben nach unten zu. Beispiele: Die Bindungsenergie nimmt von oben nach unten ab. Die Beständigkeit der höchsten Oxidationsstufe nimmt von oben nach unten ab. Die Basenstärke der Hydroxide nimmt von oben nach unten zu. Die Basenstärke der Hydroxide nimmt von links nach rechts zu. Die Säurestärke der Wasserstoffverbindungen nimmt von links nach rechts zu. Der Atomradius nimmt von links nach rechts ab. Der Atomradius nimmt von oben nach unten zu. Die Elektronegativität nimmt von links nach rechts zu. Die Elektronegativität nimmt von oben nach unten ab. Die erste Ionisierungsenergie nimmt von oben nach unten ab. 5) (12 Punkte) (Lösung: Übung 2 vom Vorjahr) Geben Sie Reaktionsgleichungen an für zwei Verfahren zur Herstellung von Cyanwasserstoff sowie zwei Reaktionsgleichungen zur Herstellung von Dicyan aus Cyanwasserstoff oder Cyanid-Ionen. Skizzieren Sie eine Valenzstrichformel für das aus Dicyan erhältliche Polymer (Paracyan) und beschreiben Sie in Stichworten dessen Verhalten beim Erhitzen. 6) (7 Punkte) Zeichnen Sie Strukturformeln für P 4O7 (2 P.) und für drei unterschiedliche Phosphorsulfide (3 P.). Warum zeigen Phosphorsulfide wesentlich mehr Strukturvarianten als die Oxide? Die Strukturen der bekannten Phosphorsulfide sind nachstehend zu sehen. Die Struktur von P 4O7 entspricht dem -P4S7. Die größere Vielfalt kommt aus der Ähnlichkeit der Elektronegativität von Phosphor und Schwefel. Die Strukturen zeigen, dass bei den Sulfiden durchaus P(V) neben P(II) im selben Molekül vorkommen kann, was bei den Oxiden wegen des großen EN-Unterschieds zwischen P und O nicht vorkommt. Bei den Oxiden werden zuerst alle vier P-Atome zu P(III) oxidiert, dann können die vier P-Atome nacheinander noch ein weiteres OAtom binden. 7) (7 Punkte) Nennen Sie eine natürliche Quelle für das Element Tellur. Geben Sie eine Reaktionsgleichung an für die Herstellung einer Sauerstoffsäure des Tellurs. Wie kann man daraus die Verbindung F 5TeOH herstellen (zwei Reaktionsgleichungen)? Antwort in der Musterlösung zur Klausur vom 23. 3. 2010. BiSeTe2 AuTe2 Kawazulith Calaverit Te oder TeO2 werden durch starke Oxidationsmittel wie KMnO4, CrO3 oder HClO3 in H6TeO6 übergeführt. Beispiel: 5 TeO2 + 2 KMnO4 + 12 H2O+ 6 H+ → 5 Te(OH)6 + 2 K+ + 2 Mn2+ H6TeO6 + Ba(OH)2 BaH4TeO6 + 2 H2O BaH4TeO6 + 5 FSO3H → F5TeOH + BaSO4 + 4 H2SO4 8) (5 Punkte) Skizzieren Sie die Struktur der folgenden Ionen: Cl3+, O2IF2-, Te64+, Se42+, S3N3-. O- + Cl Te Te 4+ Se Te Cl + I Cl F F O- Se N Te Se N 10 6 Te - S Se Te S S N 9) (4 Punkte) Wie werden Perbromat und Wasserstoffperoxid hergestellt? (Zwei Reaktionsgleichungen). BrO3- + F2 + 2 OH- → BrO4- + 2 F- + H2O; Perbromat: SeO42- → 83BrO4- + e- (-Zerfall) 83 Wasserstoffperoxid: O2 + H2 → H2O2 wurde anerkannt, das Anthrachinon-Verfahren macht´s möglich. O2 + N2H2 → H2O2 wurde anerkannt BaO2 + H2SO4 → H2O2 + BaSO4 Alternativen: H2S2O8 + 2 H2O → H2O2 + 2 H2SO4 Die Klausur wurde korrigiert und bewertet, die Bekanntgabe der Ergebnisse erfolgt am 5. April 2011. Von 75 TeilnehmerInnen haben 53 bestanden (70.7%) und 22 nicht bestanden (29.3%). Von den 43 TeilnehmerInnen mit drei Punkten aus drei Übungen haben 38 bestanden (88.4%) und 5 nicht bestanden (11.6%). Von den 15 TeilnehmerInnen mit null Punkten aus drei Übungen haben 7 bestanden (46.7%), 8 haben nicht bestanden (53.3%) . Nachfolgend finden Sie eine Musterlösung Klausur zur Vorlesung Anorganische Chemie I Kaiserslautern, 28. März 2011 Die Klausur besteht aus 7 Fragen, für deren Bearbeitung 90 Minuten Zeit zur Verfügung stehen. Es können 75 Punkte erreicht werden, bis zu drei Bonuspunkte aus den Übungen kommen hinzu. Für das Bestehen der Klausur sind 30 Punkte erforderlich. Zur Beantwortung der Fragen genügen Formeln, Zeichnungen, Reaktionsgleichungen oder Stichpunkte. Bitte achten Sie darauf, dass Ihre Antworten in der durch die Nummerierung der Fragen vorgegebenen Reihenfolge angeordnet sind. Dies wird Ihnen gelingen, wenn Sie für zunächst nicht geläufige Antworten einige Zeilen freilassen 1. (12 Punkte) Beschreiben Sie anhand von Reaktionsgleichungen - die Herstellung von elementarem Caesium durch chemische Reduktion (2) (Eine Gleichung genügte) Cs2Cr2O7 + 2 Zr → 2 Cs + 2 ZrO2 + Cr2O3 2 CsN3 → 2 Cs + 3 N2 2 CsOH + 2 Mg → 2 Cs + 2 MgO + H2 (Diese Gleichung wurde von einem Teilnehmer in Analogie zu dem formuliert, was für die Erzeugung von Natrium im Schulversuch an die Tafel geschrieben worden war. Ob es auch mit Caesium funktioniert, weiß ich nicht, finde aber die Idee faszinierend) - die Verbrennung von Caesium an der Luft (1) Cs + O2 CsO2 (Hier wird das Hyperoxid gebildet. Da unter kontrollierten Bedingungen auch das Peroxid erhalten werden kann, wurde auch anerkannt: 2 Cs + O2 Cs2O2) - die Herstellung von Cs2O aus Caesium (gelingt nicht in direkter Reaktion) (4) Hier hatte ich bei der Aufgabenstellung an ein zweistufiges Verfahren gedacht. In der ersten Stufe sollte aus Caesium eine geeignete Ausgangsverbindung hergestellt werden, die in der zweiten Stufe mit weiterem Caesium oder mit Caesiumazid zum Caesiumoxid reduziert werden sollte. Etwa so: 2 Cs + 2 HNO3 → 2 CsNO3 + H2 (natürlich mit verdünnter Salpetersäure unter guter Kühlung, eventuell auch über das Hydroxid: 2 Cs + 2 H2O → 2 CsOH + H2, dann CsOH + HNO3 CsNO2 + H2O). Alternativ war an Cs2O2 gedacht, das unter kontrollierten Bedingungen aus Caesium und Sauerstoff gebildet wird: 2 Cs + O2 → Cs2O2. Die Reduktion kann hernach mit dem Metall oder mit dem Azid erfolgen: 2 CsNO3 + 10 Cs → 6 Cs2O + N2 Cs2O2 + 2 Cs → 2 Cs2O CsNO3 + 5 CsN3 → 3 N2 + 3 Cs2O Cs2O2 + 2 Cs → 2 Cs2O Wenn jedoch jemand Cs2O2 mit Wasserstoff bei hoher Temperatur reduzieren wollte, wurde dies auch als Möglichkeit anerkannt. Allerdings wurden die vier Punkte zu dieser Teilaufgabe auch dann vergeben, wenn z. B. einfach dastand: CsNO3 + 5 Cs → 3 Cs2O + ½ N2. Die Bedingung, dass Cs2O aus Caesium hergestellt werden sollte, war erfüllt und die Gleichung korrekt. - die Herstellung eines Elektrids aus Caesium (2) Cs + 2 (18-Krone-6) → [Cs(18-Krone-6)2]+ + eWenn anstelle des Kronenethers ein Kryptand verwendet wurde, wurde dies auch anerkannt. Ein Fehler war es jedoch, zwei Äquivalente Caesium einzusetzen und etwa 2 Cs + 2 (18-Krone-6) → [Cs(18-Krone-6)2]+ + Cs- zu schreiben. Dies wäre ein Caesid und kein Elektrid. - die Umsetzung von Caesium mit Gold, beschreiben Sie das Reaktionsprodukt (3) Cs + Au → Cs+Au- (ein Salz) Hier gab es viele komplexere Lösungsversuche mit Einbeziehung von Stickstoff oder mit sehr viel mehr Gold, die leider nicht punkten konnten. 2. (16 Punkte) Nennen Sie Namen und Formel für ein in hexagonalen Säulen kristallisierendes Mineral, in dem das Element Beryllium enthalten ist (2). Beschreiben Sie den Aufschluss des Minerals und die Reaktionsfolge bis zur Gewinnung des elementaren Berylliums anhand von Reaktionsgleichungen (10 Punkte). Geben Sie zwei Kommentare zu Reaktionen ab, von denen einer die Fällung des Berylliums mit dem Trennungsgang im ACPraktikum verknüpft und einer eine besondere Affinität zwischen zwei Elementen betrifft, die eine der Reaktionen thermodynamisch ermöglicht (2). Geben Sie eine Valenzstrichformel für das Anion im betreffenden Beryllium-Mineral an und ordnen Sie dieses einer Gruppe ähnlicher Anionen zu (2). (Falls Ihnen das Mineral nicht geläufig sein sollte, retten Sie einen Teil der Punkte durch entsprechende Behandlung von Phenakit, Be2SiO4) Beryll, Be3Al2Si6O18 (Die Zusatzangaben in Klammern waren nicht erforderlich) Be3Al2Si6O18 + 6 H2SO4 → 3 BeSO4 + 2 Al2(SO4)3 + 6 SiO2 + 6 H2O (SiO2 fällt aus) (Durch Zusatz von Ammoniumsulfat wird Alaun gebildet, welcher auskristallisiert Al2(SO4)3 + (NH4)2SO4 → 2 NH4Al(SO4)2 (als Hydrat) BeSO4 + 2 NH3 + 2 H2O → Be(OH)2 + (NH4)2SO4 (Be(OH)2 fällt aus) Be(OH)2 + 2 NH4HF2 → (NH4)2BeF4 + 2 H2O (NH4)2BeF4 → BeF2 + 2 NH3 + 2 HF BeF2 + Mg → MgF2 + Be Beryllium gehört zur Urotropingruppe und bildet ein schwerlösliches Hydroxid (wie Aluminium, daher kommen die beiden auch im selben Mineral nebeneinander vor) Magnesium hat eine sehr hohe Affinität zum Fluor, daher eignet es sich als Reduktionsmittel. Wenige Klausurteilnehmer haben Phenakit gewählt, das Symbol sollte an Beryll erinnern. Zum Cyclohexasilicat Si6O1812- aus der Gruppe der Cyclosilicate gab es teilweise sehr schöne Zeichnungen. Eine Zeichnung, die auch die einzelnen Formalladungen korrekt platziert, sehen Sie hier: 3. (12 Punkte) Beschreiben Sie die Herstellung von elementarem Bor anhand einer Reaktionsgleichung (2) und nennen Sie vier Bor-Modifikationen (2), von denen Sie für eine die Struktur in einer schematischen Zeichnung darstellen (3) und die Bindungsverhältnisse im Licht der Elektronenzählregeln von Wade betrachten (2). Nennen Sie eine Anwendung für elementares Bor (1) und skizzieren Sie ein Strukturmotiv für das Borid-Teilgitter eines Metallborids (1). Nennen Sie zwei typische Eigenschaften der Metallboride (1). B2O3 + 3 Mg 2 B + 3 MgO 2 BCl3 + 3 H2 2 B + 6 HCl (auch mit BBr3 oder BI3) 2 BI3 2 B + 3 I2 (Zersetzung am heißen Draht aus Wolfram oder Tantal, geht aber nicht mit Bortrichlorid oder gar -fluorid) B2H6 2 B + 3 H2 Reduktion mit Kohlenstoff geht nicht, weil Borcarbid gebildet wird. Bor-Modifikationen! (Hier wurden sehr viele Borverbindungen wie Hydride oder Borate angeboten). Es handelt sich um verschiedene Formen des Elements wie z. B.: -rhomboedrisches Bor (rot) -rhomboedrisches Bor (grau, metallischer Glanz) -tetragonales Bor (schwarz) - tetragonales Bor (rot) Hochdruckmodifikation (tiefrot) Glasig-amorph (schwarz) Für die zeichnerische Darstellung zu empfehlen war das -rhomboedrische Bor, was auch meist gemacht wurde, hier ein Beispiel: Die korrekte Erkenntnis, dass von den 36 Valenzelektronen des betrachteten B12-Ikosaeders nur zehn VE für die zwölf nach außen orientierten Elektronenpaare des Clusters (den „Eigenbedarf“ der zwölf Bor-Atome) benötigt werden, wurde nicht immer so klar erkannt wie im Beispiel. Hier also noch einmal der Gedankengang: Die Elektronen für sechs in der Abbildung mit Strichen angedeutete 3Z2e-Bindungen werden je von drei Clustern gemeinsam aufgebracht. Der betrachtete Cluster steuert also ein Drittel der darin befindlichen Elektronen bei (4 VE), der Rest kommt von den Nachbarn (8 VE, siehe Eintrag in der abgebildeten Abrechnung). Die sechs 2Z2e-Bindungen erfordern hingegen eine 50%-Beteiligung des betrachteten Clusters (6 VE), den Rest steuern die Nachbarn bei (6 VE, siehe Eintrag in der Abrechnung). Der Rest ist dann genau so wie bei den Boranen. Auch am -rhomboedrischen Bor versuchten sich einige. Dies war nicht zu empfehlen, in den Materialien zur Vorlesung hatte auch ausdrücklich gestanden, dass diese Struktur nicht abgefragt wird. Wenn dann die Struktur nicht in voller Detailtiefe erläutert wurde, eine pentagonale Pyramide am zentralen B12-Ikosaeder gezeichnet und dazu gesagt wurde, dass dies für jede der zwölf Ecken gilt, konnten trotzdem die dafür vorgesehenen Punkte abgeräumt werden. Nach Wade ergeben sich für das Ikosaeder in diesem Fall nur 48 Valenzelektronen, was leider von keinem der so weit vorgedrungenen Teilnehmer als „hypercloso“ interpretiert wurde. Verwendung von Bor, einige Alternativen: Borfasern in Materialien für Luft- und Raumfahrt, Sportgeräte; Bremsstäbe in Kernreaktoren, Additiv für Pyrotechnik oder Raketentreibstoffe; Dotieren von Silicium in der Halbleitertechnik. Hier eine Auswahl von Borid-Strukturelementen sowie Angaben zu typischen Eigenschaften der Übergangsmetallboride: 4. (10 Punkte) Nennen Sie Namen und geben Sie Valenzstrichformeln an für vier verschiedene Verbindungen von Fluor und Stickstoff (2). Formulieren Sie für eine davon die Trennung zweier Isomeren als Reaktionsgleichung (2), für eine andere deren Dissoziation in zwei gleiche Teilchen (2) und eine Reaktion mit Stickstoffmonoxid (2). Beschreiben Sie die chemische Bindung in einer fünften Fluor-Stickstoff-Verbindung, für die bislang lediglich theoretische Berechnungen existieren (2). (letzteres wird auch Stickstofftrifluorid genannt), hinzu kommt das kovalent gebundene Fluorazid, FN3. Die beiden Difluordiimine gelten als eine Verbindung, nach den Isomeren wurde für zwei Punkte separat gefragt. Leider wurde häufig das nicht existierende Tetrafluortetrazen F2N-N=N-NF2 als N-F-Verbindung genannt. Weder im Holleman-Wiberg noch in der CAS-Datenbank findet sich ein Eintrag hierzu – und der Grund dafür dürfte folgender sein: F2N. ist ein relativ stabiles Radikal, das sich immerhin freiwillig durch thermische Dissoziation von N2F4 bereits unter milden Bedingungen bildet. Das hypothetische Tetrafluortetrazen kann also mit niedriger Aktivierungsenergie irreversibel in ein extrem stabiles N2-Molekül und 2 F2N. – Radikale zerfallen, die hernach zum Distickstofftetrafluorid (Tetrafluorhydrazin) dimerisieren können - reversibel. Die Isomerentrennung der beiden Difluordiimine: 3 cis-N2F2 + 2 AlCl3 → 2 AlF3 + 3 N2 + 3 Cl2 Wie kann man sich so eine Reaktionsgleichung merken? Man sollte nicht versuchen, sich genau diese Gleichung einzuprägen. Eher verbinde man eine Vorstellung damit: cis-N2F2 kann leichter in N2 und F2 zerfallen als das trans-Derivat, weil die geometrische Anordnung der Atome dem Zerfallsergebnis bereits relativ ähnlich ist. Die beiden Fluoratome sind bereits auf einer Seite des Moleküls und müssen nur noch eine kleine Strecke zurücklegen. Ein möglicher Gedankengang ist folgender: cis-Difluordiimin zerfällt in Fluor und Stickstoff und Fluor greift Aluminiumchlorid an. Die Reaktion, die sich dann abspielt, ist den meisten von Ihnen aus der Schulzeit bekannt: Das leichtere Halogen setzt das schwerere aus dem Halogenid frei, 2 AlCl3 + 3 F2 → 2 AlF3 + 3 Cl2. Was schließlich beim Lernen abgespeichert werden muss, ist nicht die relativ komplexe Gleichung, sondern die Vorstellung vom Zerfall. Das kann eine Art gedanklicher Videoclip sein: Ein gigantisch vergrößertes Molekül cisDifluordiimin schwebt durch den Raum und spaltet sich in F2 und N2. Das trans-Isomer windet sich und kann sich nicht spalten, weil die Fluoratome zu weit voneinander entfernt sind. Lässt man nun im Hintergrund noch eine Flasche mit farblosem, wasserfreiem, an der Luft rauchendem Aluminiumchlorid mit einem deutlich lesbaren Etikett auftauchen, hat man alles beisammen, um später die Gleichung zu formulieren. Für die Übernahme in das Langzeitgedächtnis ist es sinnvoll, den Gedankengang zwölf Stunden später und nochmals eine Woche danach zu wiederholen. Dissoziation von Distickstofftetrafluorid: N2F4 → 2 .NF2 Reaktion mit NO: N2F4 + 2 NO → 2 F2N-N=O (hier reagieren zwei Radikale miteinander). Hypothetische Verbindung NF5: 6. (12 Punkte) Beschreiben Sie anhand von Reaktionsgleichungen die Herstellung von S42+, Te64+ und S2I42+ (6). Geben Sie für die drei Kationen Valenzstrichformeln an oder skizzieren Sie die Struktur (3) und geben Sie Stichworte zur chemischen Bindung an (3). (Stützen Sie beim letztgenannten Kation Ihre stichwortartige Argumentation durch Angaben zu den Bindungslängen. Hierfür sind keine Zahlen erforderlich, eher qualitative Angaben wie kurz, sehr kurz, lang, typische Einfachbindung, wenig kürzer als die Summe der Van der WaalsRadien oder ähnliche Angaben). S8 + 2 S2O6F2 → 2 S42+ [SO3F]-2 (in Fluorsulfonsäure oder in flüssigem Schwefeldioxid) S8 + 6 SbF5 → 2 S42+ [SbF6]-2 + 2 SbF3 (in flüssigem Schwefeldioxid) 6 Te + 6 AsF5 → Te64+ [AsF6]-4 + 2 AsF3 ¼ S8 + 2 I2 + 3 AsF5 → S2I42+ [AsF6]-2 + AsF3 Wenn Arsenpentafluorid anstelle von Antimonpentafluorid verwendet wurde, war dies dem Punkterwerb nicht abträglich. Stark abweichende Oxidationsmittel wurden jedoch nicht anerkannt. 7. (9 Punkte) Skizzieren Sie die Struktur des Bromtrifluorid-Moleküls und berücksichtigen Sie dabei alle Valenzelektronen am Brom (2). Stellen Sie eine Molekülskizze eines Elementfluorids mit gleicher Valenzelektronenzahl daneben, dessen Zentralatom aus einer benachbarten Hauptgruppe des Periodensystems stammt. (2) Beschreiben Sie die in geringem Umfang ablaufende Dissoziation von reinem Bromtrifluorid (2) und ordnen Sie die Begriffe „Solvo-Säure“ und „Solvo-Base“ zu (1). Beschreiben Sie anhand einer Reaktionsgleichung eine Säure-Base-Titration im Bromtrifluorid-System. (2) Säure-Base-Titration: vergleichen Sie bitte mit [BF2]+ + [BrF4]- → 2 BrF3; H3O+ + OH- → 2 H2O. 8. (4 Punkte) Beschreiben Sie anhand zweier Reaktionsgleichungen die Herstellung einer kationischen Krypton-Verbindung, die als stärkstes bekanntes Oxidationsmittel gilt. Gehen Sie dabei von Krypton aus. Kr + F2 → KrF2 KrF2 + 2 SbF5 → KrF+ [Sb2F11](Auch hier durfte mit Arsenpentafluorid gearbeitet werden). Klausur zur Vorlesung Anorganische Chemie I Kaiserslautern, 6. Februar 2012 Die Klausur besteht aus 8 Fragen, für deren Bearbeitung 90 Minuten Zeit zur Verfügung stehen. Es können 75 Punkte erreicht werden, bis zu drei Bonuspunkte aus den Übungen kommen hinzu. Für das Bestehen der Klausur sind 30 Punkte erforderlich. Zur Beantwortung der Fragen genügen Formeln, Zeichnungen, Reaktionsgleichungen oder Stichpunkte. Bitte achten Sie darauf, dass Ihre Antworten in der durch die Nummerierung der Fragen vorgegebenen Reihenfolge angeordnet sind. Dies wird Ihnen gelingen, wenn Sie für zunächst nicht geläufige Antworten einige Zeilen freilassen. Hinweis: Mit Ihrer Teilnahme an der Klausur versichern Sie zugleich, dass Sie prüfungsfähig sind. Im Falle einer plötzlich während der Prüfung auftretenden Erkrankung sind Sie verpflichtet, das Aufsichtspersonal umgehend zu informieren. Der Rücktritt von der Prüfung muss anschließend beim zuständigen Prüfungsausschuss beantragt werden und ein ärztliches Attest - ausgestellt am Prüfungstag - ist unverzüglich nachzureichen. Wird die Prüfung hingegen in Kenntnis einer gesundheitlichen Beeinträchtigung regulär beendet, kann im Nachhinein kein Prüfungsrücktritt aufgrund von Krankheit beantragt werden. 1. (5 Punkte) Beschreiben Sie die Herstellung von Natriumhydrid und von Natriumozonid anhand zweier Reaktionsgleichungen und einer Zusatzbemerkung. 2 Na + H2 ⇌ 2 NaH 3 CsOH + 2 O3 ⇌ 2 CsO3 + CsOH.H2O + ½ O2 (Natriumverbindung durch Ionenaustausch an einer mit Na+ beladenen Säule erhältlich). 2. (10 Punkte) Beschreiben Sie die Herstellung von Berylliumacetat (2) und die technische Herstellung von Bortrifluorid aus Borax (4; zwei Reaktionsgleichungen). Skizzieren Sie die Strukturen von Berylliumacetat (2) und von dem Zwischenprodukt der Bortrifluorid-Synthese (1). Geben Sie Stichworte an zur chemischen Verwandtschaft zwischen den beiden Verbindungen (1). 3. (7 Punkte) Zeichnen Sie Strukturformeln für B4H10, B5H9 und B6H62- (3). Ermitteln Sie jeweils die Anzahl der Gerüstelektronenpaare (GEP) und den Clustertyp (3). Stellen Sie in einer kurzen Formulierung eine Beziehung zwischen den drei Clusterverbindungen her (1). 4. (12 Punkte) Beschreiben Sie anhand einer Reaktionsgleichung die Herstellung von Natriumhexafluoroaluminat (2) und skizzieren Sie die Struktur des Komplexsalzes (2). Machen Sie Angaben zur Art der Kugelpackung (2) und zu den Koordinationszahlen von Kationen und Anionen (2). Geben Sie für Natriumhexafluoroaluminat eine technische Anwendung (1) und den Mineralnamen (1) an. Skizzieren Sie außerdem Strukturmotive für Kaliumtetrafluoroaluminat und Kaliumpentafluoroaluminat (2; die Kalium-Kationen müssen nicht eingezeichnet werden). 5. (8 Punkte) Beschreiben Sie anhand von drei Reaktionsgleichungen den Weg vom elementaren Silicium zum Silicon (6). Skizzieren Sie eine Valenzstrichformel für ein Silicon, das die gleiche Struktur hat wie ein Silicat mit der Wiederholungseinheit [SiO32-] (1). Nennen Sie wenige Stichworte zur Ursache für diese Strukturanalogie (1). 6. (10 Punkte) Zeichnen Sie die Strukturen eines ionischen und eines metallischen Carbids (4). Beschreiben Sie die Herstellung von Acetylen aus anorganischen Ausgangsmaterialien in zwei Reaktionsgleichungen (4) und geben Sie eine Reaktionsgleichung zur Pionierleistung von Friedrich Wöhler an, der als erster die Umlagerung einer anorganischen in eine organische Verbindung beobachtete (2). 6. (5 Punkte) Skizzieren Sie die Gestalt des Tetraschwefeltetranitrid-Moleküls (2). Geben Sie eine mesomere Grenzformel für ein hypothetisches ringförmiges S4N4 an, aus der dessen Neigung zur Käfigbildung hervorgeht (1). Zeichnen Sie ein Molekülorbital dieses hypothetischen Achtrings und geben Sie an, ob dieses Orbital bei der Faltung des Rings zum Käfig energetisch angehoben oder abgesenkt wird (2). 7. (5 Punkte) Nennen Sie eine natürliche Quelle für das Element Tellur (1). Geben Sie eine Reaktionsgleichung für die Herstellung des Hexatellur-Tetrakations Te64+ an (2). Beschreiben Sie die Bindungsverhältnisse in diesem Kation anhand von mesomeren Grenzformeln und geben Sie einen Kommentar ab, der grob qualitativ die Bindungsordnung einschätzt (2). 8. (10 Punkte) Beschreiben Sie in einer möglichst kurzen Formulierung die unterschiedliche Stärke der sekundären Wechselwirkungen in den Strukturen der elementaren Halogene Chlor, Brom und Iod (2). Geben Sie in Stichworten an, wie man im Experiment eine Fortsetzung dieses Trends erzwingen kann und wohin solche Experimente beim Iod führen können (2). Geben Sie Reaktionsgleichungen an für die Herstellung von Kationen der Halogene der Zusammensetzung X2+, X3+ und X5+ (drei Gleichungen, 6 Punkte). 9. (3 Punkte) Formulieren Sie eine Reaktionsgleichung für eine chemische Reaktion mit elementarem Xenon (2). Skizzieren Sie die Struktur der so gebildeten Xenonverbindung und beziehen Sie auch eventuell vorhandene nichtbindende Elektronenpaare in Ihre Skizze ein(1). Klausur zur Vorlesung Anorganische Chemie I Kaiserslautern, 5. April 2012 Die Klausur besteht aus neun Fragen, für deren Bearbeitung 100 Minuten Zeit zur Verfügung stehen. Es können 75 Punkte erreicht werden, bis zu drei Bonuspunkte aus den Übungen kommen hinzu. Für das Bestehen der Klausur sind 30 Punkte erforderlich. Zur Beantwortung der Fragen genügen Formeln, Zeichnungen, Reaktionsgleichungen oder Stichpunkte. Bitte achten Sie darauf, dass Ihre Antworten in der durch die Nummerierung der Fragen vorgegebenen Reihenfolge angeordnet sind. Dies wird Ihnen gelingen, wenn Sie für zunächst nicht geläufige Antworten einige Zeilen freilassen. Hinweis: Mit Ihrer Teilnahme an der Klausur versichern Sie zugleich, dass Sie prüfungsfähig sind. Im Falle einer plötzlich während der Prüfung auftretenden Erkrankung sind Sie verpflichtet, das Aufsichtspersonal umgehend zu informieren. Der Rücktritt von der Prüfung muss anschließend beim zuständigen Prüfungsausschuss beantragt werden und ein ärztliches Attest - ausgestellt am Prüfungstag - ist unverzüglich nachzureichen. Wird die Prüfung hingegen in Kenntnis einer gesundheitlichen Beeinträchtigung regulär beendet, kann im Nachhinein kein Prüfungsrücktritt aufgrund von Krankheit beantragt werden. 1. (10 Punkte) Nennen Sie drei natürlich vorkommende Mineralien der Alkalimetalle mit Namen und Formel. (3) Geben Sie eine Reaktionsgleichung für die Herstellung eines Sodids (2) und eines Elektrids an (2). Geben Sie Namen und Summenformeln für die Oxidationsprodukte an, die beim Verbrennen von Lithium, Natrium und Kalium an der Luft entstehen (3). 2. (8 Punkte) Begründen Sie, warum Lithiumdampf zweiatomige Moleküle enthält, während Berylliumdampf einatomig ist. (2). Begründen Sie in Stichworten, warum Berylliumchlorid kein Ionengitter bildet (2). Nennen Sie ein Bormineral mit Namen und Formel (1) und geben Sie Gründe an, die Bor daran hindern, a) ein Metall zu sein, b) ein Nichtmetall zu sein, oder c) einfache Strukturen mit kovalenten Bindungen auszubilden (3). 3. (12 Punkte) Geben Sie zwei Reaktionsgleichungen für die Herstellung von elementarem Bor an (4). Skizzieren Sie die Struktur des -rhomboedrischen Bors (2). Zeigen Sie, dass hier wie auch im Lanthanhexaborid LaB6 (Skizze) (2) die Elektronenzählregeln von Wade gelten (4). 4. (8 Punkte) Formulieren Sie drei Reaktionsgleichungen für die Herstellung von Silicon aus einem in der Natur vorkommenden Mineral (6). Beschreiben Sie anhand einer Reaktionsgleichung die Vernetzung zum Silicongummi (2). 5. (6 Punkte) Begründen Sie, dass Diamant ist ein Isolator, Silicium ein Halbleiter ist (2). Nennen Sie die Orbitale, die am Übergang eines Elektrons vom Valenzband in das Leitungsband beteiligt sind (2). Beschreiben Sie den Ladungstransport im Halbleiter in Stichworten (2). 6. (3 Punkte) Über Hauptgruppenelemente kann man sagen: „Unter hohem Druck tendieren die leichteren Homologen dazu, die Strukturen der schwereren Homologen zu imitieren“. Skizzieren Sie passend zu dieser Aussage eine Hochdruckstruktur eines leichteren Homologen und geben Sie an, welches schwerere Homologe die analoge Struktur aufweist. 7. (10 Punkte) Skizzieren Sie die Struktur des Iodpentafluorid-Moleküls und berücksichtigen Sie dabei alle Valenzelektronen am Iod (2). Stellen Sie eine Molekülskizze eines Elementfluorids mit gleicher Zahl von Elektronenpaaren am Zentralatom daneben, wobei dieses Zentralatom aus einer benachbarten Hauptgruppe des Periodensystems stammen soll. (2) Formulieren Sie je eine Reaktionsgleichung für die Umsetzung von Iodpentafluorid mit Caesiumfluorid und mit Arsenpentafluorid (4). Beschreiben Sie die Oxidation eines Fluorid-Anions zum elementaren Fluor durch eine Interhalogenverbindung anhand einer Reaktionsgleichung (2). 8. (12 Punkte) Beschreiben Sie die Herstellung folgender Substanzen anhand von je einer Reaktionsgleichung und geben Sie für das Produkt eine Valenzstrichformel an (je 2 Punkte): a) Perbromat b) Tetraschwefel-Dikation c) Cyanwasserstoff d) Trikohlenstoffdioxid (Propadiendion) e) Dibortetrachlorid f) Berylliumacetat 9. (6 Punkte) Begründen Sie, warum Helium in der Erdatmosphäre nur in Spuren vorkommt und geben Sie an, aus welcher Quelle Helium gewonnen werden kann (2). Geben Sie eine einfache Reaktionsgleichung zur Herstellung von zwei Verbindungen EXn an (2). (E steht für zwei verschiedene nicht radioaktive Edelgase, Xn bezeichnet n Atome eines anderen Elements). Steigern Sie die oxidierende Kraft eines der beiden Moleküle durch eine geeignete Umsetzung (Reaktionsgleichung) (2). Klausur zur Vorlesung Anorganische Chemie I Kaiserslautern, 7. Februar 2013 Die Klausur besteht aus neun Fragen, für deren Bearbeitung 90 Minuten Zeit zur Verfügung stehen. Es können 60 Punkte erreicht werden, bis zu drei Bonuspunkte aus den Übungen kommen hinzu. Für das Bestehen der Klausur sind 24 Punkte erforderlich. Zur Beantwortung der Fragen genügen Formeln, Zeichnungen, Reaktionsgleichungen oder Stichpunkte. Bitte achten Sie darauf, dass Ihre Antworten in der durch die Nummerierung der Fragen vorgegebenen Reihenfolge angeordnet sind. Dies wird Ihnen gelingen, wenn Sie für zunächst nicht geläufige Antworten einige Zeilen freilassen. Hinweis: Mit Ihrer Teilnahme an der Klausur versichern Sie zugleich, dass Sie prüfungsfähig sind. Im Falle einer plötzlich während der Prüfung auftretenden Erkrankung sind Sie verpflichtet, das Aufsichtspersonal umgehend zu informieren. Der Rücktritt von der Prüfung muss anschließend beim zuständigen Prüfungsausschuss beantragt werden und ein ärztliches Attest - ausgestellt am Prüfungstag - ist unverzüglich nachzureichen. Wird die Prüfung hingegen in Kenntnis einer gesundheitlichen Beeinträchtigung regulär beendet, kann im Nachhinein kein Prüfungsrücktritt aufgrund von Krankheit beantragt werden. Anmerkung zur Musterlösung: In der Klausur sollte stichwortartig geantwortet werden. Wer korrigiert, kennt die Antwort und braucht nur Stichworte, keine Erklärungen. Hier könnten Stichworte jedoch für den einen oder die andere zu wenig sein, um den Gedankengang nachvollziehen zu können. Deshalb wurde gelegentlich ein Sachverhalt etwas ausführlicher dargestellt. 1. (8 Punkte) Geben Sie Reaktionsgleichungen an für - die Herstellung eines Alkalimetalls durch chemische Reduktion (2) 2 NaN3 → 2 Na + 3 N2 2 Cs2Cr2O7 + 3 Zr → 3 ZrO2 + Cr2O3 + 2 Cs2O 2 Cs2O + Zr ⇄ ZrO2 + 4 Cs 2 NaOH + 2 Mg → 2 Na + 2 MgO + H2 2 MH → 2 M + H2 Einige Teilnehmer haben völlig richtig die Zersetzung der Hydride angeführt, für die im Skript ja auch Zersetzungstemperaturen angegeben waren. - die Auflösung von Kalium in flüssigem Ammoniak zu einer blauen Lösung (2) die allmähliche Zersetzung der blauen Lösung (2) K/NH3(liq.) → [K(NH3)x]+ [e(NH3)y]2 [K(NH3)x]+ [e(NH3)y]- → 2 KNH2 + H2 - die Herstellung von Kaliumozonid (2) 3 MOH(s) + 2 O3(g) → MOH . H2O + 2 MO3(s) + ½ O2 (g) 2. (8 Punkte) Nennen Sie ein in der natürliches Mineral des Berylliums mit Namen und Formel. (1) Beryll, Be3Al2Si6O18 Skizzieren Sie die Struktur von Berylliumchlorid (1) beschreiben Sie in Stichworten die chemische (1) und Bindung. hoher Kovalenzanteil Geben Sie die Formel einer Bariumverbindung mit einer dem Berylliumchlorid sehr ähnlichen Struktur an. Beschreiben Sie diese Strukturverwandtschaft in einer kurzen Formulierung und ordnen Sie den beteiligten Atomen Oxidationsstufen zu. (1) +I +II -II NaBa2O(e-)3 Invers zum BeCl2-Strukturtyp: Ba2+ nimmt die Cl- -Positionen ein, O2- die Be2+Positionen Achtung, für die letzte Teilaufgabe zur Frage 2 stehen zwei Alternativen zur Auswahl: Formulieren Sie zwei Reaktionsgleichungen für die Gewinnung von Bariumhydroxid aus einem in der Natur vorkommenden Mineral des Bariums … (4) … oder formulieren Sie eine Reaktionsgleichung für die technische Herstellung von Bariumoxid aus einem anderen Barium-Mineral (2) und begründen Sie die Abweichung von der Prozedur, die für die analogen Calciumverbindungen üblich ist (zwei Argumente, je ein Punkt). BaSO4 + 4 C → BaS + 4 CO BaS + 2 H2O → Ba(OH)2 + H2S↑ oder BaCO3 + C → BaO + 2 CO gestattet niedrige Temperatur, verhindert Oxidation zum Peroxid 3. (7 Punkte) Formulieren Sie die Herstellung von Bornitrid aus Bor und aus Boroxid (jeweils eine Reaktionsgleichung, je 2 Punkte). 2 B + N2 → 2 BN (Weißglut) B2O3 + N2 + 3 C → 2 BN + 3 CO Skizzieren Sie die Struktur kubischen Bornitrids (2) und nennen Sie eine weitere Verbindung des Typs AB mit der gleichen Struktur. (1) Zinkblende, ZnS 4. (7 Punkte) Begründen Sie, dass Diamant ein Isolator, Silicium ein Halbleiter ist (2). Bandlücke zwischen Valenz- und Leitungsband beim Diamant groß, beim Silicium nicht. Nennen Sie die Orbitale, die am Übergang eines Elektrons vom Valenzband in das Leitungsband beteiligt sind. (2) Hier wurde sehr oft über s- und p-Orbitale spekuliert. Im elementaren Silicium sind alle Orbitale der Valenzschale an der Bildung von Si-Si-Bindungen beteiligt. Die bindenden Orbitale bilden deshalb das Valenzband, die antibindenden das Leitungsband. Die richtige Antwort lautet daher: und *. Beschreiben Sie den Ladungstransport im reinen Silicium in Stichworten (2) Ein Elektron im Leitungsband ist beweglich. Das entsprechende „Loch“ im Valenzband kann „wandern“. (Dies bedeutet, dass ein Si-Atom mit einem fehlenden Elektron und einer positiven Ladung ein Elektron vom Nachbarn übernehmen kann. Das „Loch“ wird so weitergereicht, es resultiert die so genannte „Löcherleitung“) Si Si . Si Si Si Si . + Si Si Si Si Si Si Si Si Si Si und geben Sie eine Valenzstrichformel für p-dotiertes Silicium an. (1) Die Valenzstrichformel ergibt sich aus den Gedanken zum Ladungstransport. Einem Si-Atom fehlt ein Valenzelektron. Es kann also nur drei Bindungen ausbilden und trägt eine positive Formalladung. Ein Nachbaratom findet für sein viertes Valenzelektron keinen Partner und besitzt daher ein ungepaartes Elektron. Das „fehlende“ Elektron befindet sich in einem antibindenden Orbital (also im Valenzband) an einem der umliegenden Si-Atome (dieses Elektron ist ja beweglich und kann deshalb umherwandern). 5. (3 Punkte) Geben Sie an, wie viele terminale und wie viele verbrückende Sauerstoffatome in einem Silicat aus zwei Mol SiO2 und einem Mol K2O auf jedes Siliciumatom entfallen. Skizzieren Sie die Wiederholungseinheit für ein solches Silicat. 2 SiO2 + K2O → K2Si2O5 Die Addition von einem halben Äquivalent O2- an SiO2 ergibt Anionen der Summenformel Si2O52-, deren Schichtstruktur die nebenstehende Abbildung zeigt. Anmerkung: Bei der Anzahl der Brückenatome wurden verschiedene Zählweisen anerkannt, wenn ein korrekter Grundgedanke erkennbar wurde. Eine mögliche Antwort: Für ein Si-Atom ergäbe sich die Silicat-Summenformel [SiO2.5]-. Von den zweieinhalb O-Atomen pro Si-Atom ist eines nur an dieses SiAtom gebunden. Die restlichen 1.5 O-Atome sind drei verbrückende O-Atome, die jeweils zur Hälfte dem betrachteten Si-Atom zugerechnet werden. 6. (8 Punkte) Beschreiben Sie anhand einer Skizze die Berry-Pseudorotation von PhosphorF F F F pentafluorid (2) und nennen Sie die Bindungsisomeren von F F Phosphorpentachlorid. (1) F P F P F P F F F PCl5 (molekular, trigonale Bipyramide wie PF5) oder F F F Ionenpaar PCl4+ PCl6-Skizzieren Sie auch den Bi95+-Cluster aus der früher als „Bismutmonochlorid“ bezeichneten Verbindung Bi24Cl28. (2) Zählen Sie Valenzelektronen und ermitteln Sie den Clustertyp nach Wade. (1) Vergleichen Sie die gefundene (gezeichnete) mit der erwarteten Struktur, nennen Sie die Namen der beiden Polyeder und geben Sie eine Formel für einen anderen homonuclearen (aus einer Atomsorte zusammengesetzten) Cluster an, der die gleiche Atomund Valenzelektronenzahl besitzt wie Bi95+ und die erwartete Struktur zeigt. (2) Bi95+ Sn94- Bi95+ besitzt 40 Valenzelektronen. Davon sind 18 in neun nicht bindenden Elektronenpaaren lokalisiert, die radial nach außen abstehen und nicht zum Clusterzusammenhalt beitragen. 22 Gerüstelektronen bleiben übrig, bilden 11 Gerüstelektronenpaare und begründen den n+2 (nido) – Typ. 7. (8 Punkte) Formulieren Sie eine Reaktionsgleichung für die Oxidation von Schwefel zum Tetraschwefel-Dikation und nennen Sie eine Bedingung, die das Oxidationsmittel erfüllen muss. (2) S8 + 2 S2O6F2 → 2 S42+ [FSO3-]2 Das Oxidationsmittel muss ein schwach koordinierendes Anion erzeugen. Formulieren Sie je eine Reaktionsgleichung für die Herstellung von Tetraschwefeltetranitrid und für dessen Thermolyse im Vakuum bei 200 – 300 °C mit Silberkatalyse. (4) Skizzieren Sie die Molekülstruktur von Tetraschwefeltetranitrid. (2) 2 S2Cl2 + 4 Cl2 + 4 NH3 → S4N4 + 12 HCl 6 S2Cl2 + 4 NH4Cl → S4N4 + 16 HCl + S8 8. (7 Punkte) Formulieren Sie eine Reaktionsgleichung für die Oxidation von Iod zum DiiodMonokation. (2) 2 I2 + 2 SO3 + H2SO4 → 2 I2+ HSO4- + SO2 2 I2 + S2O6F2 → 2 I2+ SO3F2 I2 + 5 SbF5 → 2 I2+ [Sb2F11]- + SbF3 2 I2 + 7 SbF5 → 2 I2+ [Sb3F16]- + SbF3 Skizzieren Sie die Strukturen folgender Moleküle und Ionen: I2Cl6, IF4+ und IF8-. Berücksichtigen Sie dabei auch nicht bindende Elektronenpaare, soweit vorhanden. Beim IF8- soll ein quadratisches Antiprisma erkennbar sein. Beschreiben Sie anhand einer Reaktionsgleichung die Herstellung einer Interhalogenverbindung, die Fluorid-Anionen zum elementaren Fluor oxidieren kann. (2) 2 ClF5 + 2 PtF6 → [ClF6]+ [PtF6]- + [ClF4]+ [PtF6]BrF5 + KrF+ [AsF6]- → [BrF6]+ [AsF6]- + Kr 9. (4 Punkte) Begründen Sie in Stichworten, warum sich die Gewinnung von Neon aus Luft nur in sehr großen Luftverflüssigungsanlagen lohnt. (1) Die Antworten wiesen häufig auf den geringen Neongehalt der Luft hin. Dieses Argument ist nicht stichhaltig, denn die Xenongewinnung lohnt sich, obwohl der Xenongehalt der Luft noch viel niedriger liegt. Bei Neon ist es anders, weil Neon viel niedriger siedet als alle anderen Luftbestandteile (außer Helium) und die Neongewinnung deshalb einen hohen technischen Aufwand und hohe Energiekosten mit sich bringt. Begründen Sie auch, warum das Abgas der Ammoniaksynthese für die Gewinnung von Edelgasen von Interesse ist. (1) Bei der Gewinnung von Stickstoff aus der Luft wird Luft getrocknet, verflüssigt und Stickstoff abdestilliert. Es kommt darauf an, den Sauerstoff abzutrennen. Für Argon gilt dies nicht. Vergleichen Sie die Siedepunkte: N2 -195.8 °C, O2 -182.97 °C, Ar -185.88 °C, NH3 -33 °C Ein Teil des Argons destilliert mit dem Stickstoff ab. Da jetzt Stickstoff mit Wasserstoff zu Ammoniak umgesetzt wird, reichert sich das Argon im Restgas auf einen Gehalt von ca. 10% an und kann daraus vorteilhaft gewonnen werden. Anmerkung: Zwei Antworten beruhen auf falschen Vorstellungen und sollen deshalb erwähnt und kommentiert werden. Falsche Antwort 1 (sinngemäß): Das Restgas der Ammoniaksynthese enthält den Sauerstoff und die Edelgase … Wir stellen uns einen Hochdruckreaktor vor, in den mit einem Druck von 200 300 bar ein Gemisch aus Wasserstoff und Luft hineingepumpt und erhitzt wird. Da soll nun der Stickstoff mit Wasserstoff zu Ammoniak abreagieren und Sauerstoff übrigbleiben. Der Reaktor ist solide gebaut (ein Exemplar liegt vor dem Chemiegebäude), aber die hier zu erwartende Knallgasexplosion würde er nicht aushalten. Falsche Antwort 2 (sinngemäß): Weil Wasserstoff unter hohem Druck und bei hoher Temperatur Helium bildet, findet man Helium im Restgas … Für die Kernfusion im Ammoniakreaktor reicht weder der Druck (in der Sonne ca. 200 Milliarden bar) noch die Temperatur (15.6 Millionen K im Sonnenzentrum). Geben Sie eine Reaktionsgleichung für die Fluorierung von Xenon mit einer binären Fluorverbindung (nicht mit elementarem Fluor) an. (2) Xe + 2 PtF6 → [XeF]+ [PtF6]- + PtF5 Auch akzeptiert wurde die Fluorierung mit OF2 oder mit O2F2, nicht jedoch mit weniger reaktiven Fluorverbindungen. Klausur zur Vorlesung Anorganische Chemie I Kaiserslautern, 5. April 2013 Die Klausur besteht aus elf Fragen, für deren Bearbeitung 90 Minuten Zeit zur Verfügung stehen. Es können 60 Punkte erreicht werden, bis zu drei Bonuspunkte aus den Übungen kommen hinzu. Für das Bestehen der Klausur sind 24 Punkte erforderlich. Zur Beantwortung der Fragen genügen Formeln, Zeichnungen, Reaktionsgleichungen oder Stichpunkte. Bitte achten Sie darauf, dass Ihre Antworten in der durch die Nummerierung der Fragen vorgegebenen Reihenfolge angeordnet sind. Dies wird Ihnen gelingen, wenn Sie für zunächst nicht geläufige Antworten einige Zeilen freilassen. Hinweis: Mit Ihrer Teilnahme an der Klausur versichern Sie zugleich, dass Sie prüfungsfähig sind. Im Falle einer plötzlich während der Prüfung auftretenden Erkrankung sind Sie verpflichtet, das Aufsichtspersonal umgehend zu informieren. Der Rücktritt von der Prüfung muss anschließend beim zuständigen Prüfungsausschuss beantragt werden und ein ärztliches Attest - ausgestellt am Prüfungstag - ist unverzüglich nachzureichen. Wird die Prüfung hingegen in Kenntnis einer gesundheitlichen Beeinträchtigung regulär beendet, kann im Nachhinein kein Prüfungsrücktritt aufgrund von Krankheit beantragt werden. 1. (6 Punkte) Geben Sie Reaktionsgleichungen an für - die Herstellung von Kaliumoxid K2O (2) - die Herstellung von Lithiumnitrid (2) - die Hydrolyse von Lithiumnitrid (2) KNO3 + 5 KN3 → 3 K2O + 3 N2 2 KNO3 + 10 K → 6 K2O + N2 K2O2 + 2 K → 2 K2O KO2 + 3 K → 2 K2O Nicht anerkannt wurden Lösungen mit kontrollierter Verbrennung von Kalium. Laut Holleman-Wiberg lässt sich die Verbrennung von Kalium zwar so kontrollieren, dass K2O2 gebildet wird, sie lässt sich jedoch nicht auf der K2O-Stufe anhalten. 6 Li + N2 → 2 Li3N Li3N + 3 H2O → 3 LiOH + NH3 2. (2 Punkte) Geben Sie die Koordinationszahl und die Koordinationsgeometrie für das Anion im Lithiumnitrid und im Lithiumbismutid an. Li3N: C.N. = 8; Koordinationsgeometrie: hexagonal-bipyramidal Li3Bi: C.N. = 14; Koordinationsgeometrie: kubisch plus oktaedrisch 3. (10 Punkte) Nennen Sie ein in der natürliches Mineral des Magnesiums mit Namen und Formel. (1) Hier wurden z. B. Dolomit / CaMg(CO3)2, Magnesit / MgCO3, Magnesiumoxid / MgO und Magnesiumchlorid / MgCl2, auch als Bischofit / MgCl2.6H2O genannt, weitere Möglichkeiten stehen im Skript. Skizzieren Sie die Struktur von Magnesiumhydrid (2) und nennen Sie Koordinationszahl und Koordinationsgeometrie für Kation und Anion. (2) Nennen Sie zwei Eigenschaften (1) und zwei chemische Reaktionen des Hydrid-Anions (zwei Reaktionsgleichungen, je 2 Punkte). Anerkannt wurden z. B.: Basisch, gutes Reduktionsmittel, farblos, leicht polarisierbar CaH2 + 2 H2O → 2 H2 + Ca(OH)2 CaH2 + 2 CO2 → Ca(OOCH)2 BF3 + 4 NaH → Na[BH4] + 3 NaF 4. (7 Punkte) Geben Sie Formel und Namen für ein natürlich vorkommendes Bormineral an (1). Am häufigsten wurden Borsäure / B(OH)3 (Sassolin) und Borax / Na2B4O7.10H2O genannt. Beim Borax wurden unterschiedliche Wassergehalte akzeptiert. Auch Avogadrit / CsBF4 bzw. KBF4 wurde genannt, weitere Möglichkeiten sind im Skript zu finden. Bortrioxid wurde nicht akzeptiert, weil eine kurze Überprüfung (Holleman-Wiberg, RÖMPP Chemielexikon, Wikipedia) keine Hinweise auf dessen Vorkommen als Mineral in der Natur ergab. Es wird als hygroskopische Masse beschrieben, die bei Kontakt mit Feuchtigkeit in Borsäure übergeht. Wer für Bortrioxid einen Punkt bekommen möchte, müsste dessen Vorkommen in der Natur belegen. Nennen Sie stichwortartig zwei Probleme, die Bor an der Ausbildung von Strukturen hindern, wie man sie bei anderen Elementen findet (2). Hier war eine Vorüberlegung zu den Strukturen anderer Elemente nützlich (diese musste nicht hingeschrieben werden, half aber bei der Beantwortung der Frage). Da es zwei Probleme gibt, könnte man an zwei Typen von Elementen denken und jeweils einen typischen Aspekt herausgreifen. Metalle – metallische Bindung und Nichtmetalle – kovalente Bindung. Bor ist kein Metall, weil ein so leichtes Atom mit nur fünf Elektronen nicht drei Valenzelektronen als Elektronengas freigeben und als B3+ stabil sein kann. B3+ wäre noch kleiner als Be2+ und hätte eine extrem hohe Ladungsdichte. Das Elektronengas hätte keine Chance, sich zwischen solchen Kationen frei zu bewegen. Bor kann mit drei Valenzelektronen drei kovalente Bindungen ausbilden. Das Problem besteht darin, dass Bor auf diese Weise kein Oktett erreicht. Skizzieren Sie die Struktur des -rhomboedrischen Bors (2) und wenden Sie auf die darin enthaltene Clustereinheit die Zählregeln von Wade an. (2) Diese altgediente Klausuraufgabe wurde überwiegend erfolgreich gelöst. Aus der Antwort sollte nicht nur das Ikosaeder als Strukturbaustein, sondern auch die Anordnung der Polyeder in Schichten und deren Stapelung im Raum sowie die Bindungsverhältnisse hervorgehen. Die Zeichung konnte einfach sein – ein Ikosaeder, die Nachbarn derselben Schicht schematisch, die Stapelung im Raum in einer Randnotiz erwähnt. Die Zählregel von Wade sollte B12 und nicht etwa B12H122- betreffen und die Beiträge der benachbarten Ikosaeder zu den nach außen orientierten Elektronenpaaren an jedem Boratom des Ikosaeders korrekt bilanzieren (siehe Skript oder die Musterlösung zur Übung 2 vom Wintersemester 2012/13 auf der Internetseite zur Vorlesung AC I). 5. (6 Punkte) Carbonitrid: Geben Sie zwei Valenzstrichformeln an. Eine soll einen Ausschnitt aus der Struktur des graphitischen Carbonitrids C3N4 beschreiben, die andere steht für die stickstoffhaltige Ausgangsverbindung, aus der dieses Material gewonnen wird (2). Nennen Sie stichwortartig zwei Probleme, welche die Herstellung von dreidimensional vernetztem Carbonitrid erschweren. (2) Geben Sie an, welche Materialeigenschaft man sich von diesem Carbonitrid erhofft. (1) Formulieren Sie eine Valenzstrichformel für das bekannte Molekül C5N4. (1) Diese Aufgabe ging völlig daneben und wurde praktisch nicht berücksichtigt. Die Klausur wurde für alle so bewertet, als wären nur 55 Punkte erreichbar gewesen. Wer also darauf gekommen war, dass man sich „Härte“ von diesem Material erhoffen kann, hat bei dieser Aufgabe keinen Punktverlust erlitten. Wer mehr als einen Punkt erreichte, konnte diese als Bonuspunkte verbuchen. Ein Kandidat hat fünf Punkte erreicht, hätte aber auch ohne diese die Note 1.0 bekommen. Hier die Antwort aus dem neuesten Skript vom Sommersemester 2013: Struktur des graphitischen Carbonitrids C3N4 Kondensation von Melamin zu Melem N N N N N N N N NH2 N N N N N NH2 N N 3 H2N N N N 450 °C N N NH2 N H2N Melamin N N N N N N NH2 Melem (Die Formel von Melamin oder Melem war erwünscht) Probleme: Trotz hoher Drücke entweicht N2 bei den Syntheseversuchen. Als unerwünschtes Nebenprodukt wird Diamant gebildet. Das Produkt, falls es überhaupt gebildet wird, ist schwer nachzuweisen. Erhoffte Eigenschaft: Härte Eine Valenzstrichformel für das Molekül mit der Summenformel C5N4 fällt Ihnen bestimmt ein, wenn Sie erfahren, dass es sich um Tetracyanomethan handelt, C(CN)4. 6. (8 Punkte) Beschreiben Sie anhand einer Skizze die Berry-Pseudorotation von Phosphorpentafluorid (2) und nennen Sie die Bindungsisomeren von Phosphorpentachlorid. (1) Skizzieren Sie auch den Bi95+-Cluster aus der früher als „Bismutmonochlorid“ bezeichneten Verbindung Bi24Cl28. (2) Zählen Sie Valenzelektronen und ermitteln Sie den Clustertyp nach Wade. (1) Vergleichen Sie die gefundene (gezeichnete) mit der erwarteten Struktur, nennen Sie die Namen der beiden Polyeder und geben Sie eine Formel für einen anderen homonuclearen (aus einer Atomsorte zusammengesetzten) Cluster an, der die gleiche Atomund Valenzelektronenzahl besitzt wie Bi95+ und die F F F F erwartete Struktur zeigt. (2) F F F P F F P F F F F P F F PCl5-Bindungsisomere: PCl5 (trigonale Bipyramide) und PCl4+ PCl6-. Bi95+ Sn94- Bi95+ besitzt 40 Valenzelektronen. Jedes Bismutatom beansprucht ein nicht bindendes Elektronenpaar für sich, das nach außen orientiert wird und nicht zum Clusterzusammenhalt beiträgt. Es bleiben 22 Elektronen für das Clustergerüst, das sind 11 Gerüstelektronenpaare. Es handelt sich also um einen Typ mit n+2 GEP, das entspricht der nido-Baureihe. Wir sehen aber ein closo-Gerüst, nämlich ein dreispitziges trigonales Prisma. Den nach Wade erwarteten nido-Cluster, ein einspitziges tetragonales Antiprisma, verkörpert der Cluster Sn94-. Die Erklärung für die Abweichung beim Bismut liegt darin, dass die Prismenkanten verlängert sind. Der Cluster besitzt ein schwach antibindendes Elektronenpaar, das in diesem Fall nicht zur Spaltung einer Bindung (und damit zum nido-Typ) führt, sondern stattdessen drei Bindungen verlängert, ohne diese zu spalten. 7. (4 Punkte) Skizzieren Sie die Molekülgestalt von S12 (1) und beschreiben Sie die Oxidation von S8 mit Wasserstoffperoxid/Trifluoressigsäure anhand einer Reaktionsgleichung (2) und anhand einer Valenzstrichformel des S S O Oxidationsprodukts. (1) S S S S S S S H2O2 F3C-COOH S S S S S S S 7. (4 Punkte) Formulieren Sie eine Reaktionsgleichung für die Oxidation von Tetraschwefeltetranitrid zum Tetraschwefeltetranitrid-Dikation. (2) S4N4 + 3 SbCl5 → [S4N4]2+ + 2 [SbCl6]- + SbCl3 S4N4 + S2O6F2 → [S4N4]2+ + 2 FSO3- Skizzieren Sie die Struktur von S4N4 und formulieren sie eine Valenzstrichformel für das Dikation [S4N4]2+. (2) 9. (5 Punkte) Formulieren Sie eine Valenzstrichformel für den Charge-Transfer-Komplex von Brom mit Aceton. (2) Beschreiben Sie in knapper Form den „Charge Transfer“ in diesem Komplex, indem Sie angeben, was beim „Charge Transfer“ passiert und welche Beobachtung sich daraus ergibt. (2) Nennen Sie auch das bekannteste Beispiel eines Charge Transfer-Komplexes aus einem Halogen und einem Lebensmittel. (nur Name, 1 Punkt) Beim Charge Transfer wird ein Elektron aus einem nicht bindenden HC CH C Elektronenpaar am Sauerstoffatom (Donor) in das energetisch O 28 22 2p 8p günstigste leere Molekülorbital des Br2-Moleküls (Akzeptor) m Br m Br Br Br angehoben. Dies ist das *-MO. Dieser Vorgang wird durch O Lichtabsorption möglich und erteilt dem Komplex eine intensive C HC CH Farbe. Das bekannteste Beispiel ist der Iod-Stärke-Komplex. 3 3 3 3 10. (5 Punkte) Begründen Sie, dass das Br2+-Kation in Gegenwart eines Fluorsulfat-Ions nicht stabil ist. (Stichwort und Reaktionsgleichung, 3 Punkte). Fluorsulfat greift nucleophil an und führt zur Disproportionierung: Gleichung aus dem Skript: 8 Br2+ + 3 X- ⇋ 5 Br3+ + BrX3 (X- = FSO3-) Formulieren Sie eine Valenzstrichformel für das Br3+-Kation und begründen Sie dessen höhere Stabilität im Vergleich mit Br2+. (2) Br Br + Br Br + Br Br Im Br3+-Kation kann die Ladung auf drei Bromatome delokalisiert werden. Außerdem handelt sich um ein Molekül, bei dem jedes der beteiligten Atome ein Elektronenoktett erreichen kann. Br2+ ist ein Radikalkation mit einer ungeraden Valenzelektronenzahl. Daher können nicht beide Atome ein Elektronenoktett erreichen. (Ein brauchbares Argument war erwünscht). 11. (2 Punkte) Skizzieren Sie die Molekülstrukturen von Xenondifluorid und von Xenontetrafluorid. (2) Klausur zur Vorlesung Anorganische Chemie I Kaiserslautern, 9. August 2013 1. (8 Punkte) Skizzieren Sie einen Natrium-Schwefel-Akkumulator. (2) Gehen Sie vom geladenen Zustand aus und formulieren Sie eine Reaktionsgleichung für den Entladevorgang. (2) 2 Na + 1/8 S8 ⇌ Na2S Geben Sie an, welche Materialien zur Lösung folgender Probleme verwendet werden: Schwefel leitet den elektrischen Strom nicht. (Graphit wird zugesetzt) Für den Strom der Elektronen von einer Halbzelle in die andere Halbzelle muss ein Ladungsausgleich geschaffen werden. (NaAlO2 – Hülse als Ionenleiter für Na+) Nennen Sie einen Vorteil und einen Nachteil des Natrium-Schwefel-Akkumulators. (2) Vorteil: hohe Kapazität, sehr gute Leistung Nachteil: arbeitet nur bei hohen Temperaturen 2. (8 Punkte) Geben Sie Namen und Formel für je ein natürlich vorkommendes Mineral des Bariums und des Strontiums an. (2) Beschreiben Sie anhand von Reaktionsgleichungen die Herstellung von Calciumoxid und Bariumoxid. (Zwei Reaktionsgleichungen, vier Punkte). CaCO3 → CaO + CO2 BaCO3 + C → BaO + 2 CO Begründen Sie die unterschiedlichen Verfahren. (Zwei Gründe, zwei Punkte). BaO ist luftempfindlich und wird leicht zu Bariumperoxid oxidiert, CO fungiert als Schutzgas. Die thermische Zersetzung von BaCO3 erfordert sehr hohe Temperaturen. 3. (9 Punkte) Nennen Sie je ein natürlich vorkommendes Mineral für Gallium und Indium. (2) Geben Sie für die Herstellung von B10H102- eine Reaktionsgleichung an. (2) Skizzieren Sie das Gerüst des B10H102- - Clusters. (1) Nennen Sie stichwortartig die Grundidee für eine Beschreibung der Bindungsverhältnisse. (2) (Anregung: Es gibt zu wenig Elektronen, um jede Bindung als normale kovalente Bindung auszubilden). Bor ist sp-hybridisert. Die zur Clustermitte orientierten sp-Hybridorbitale bilden ein bindendes MO. Die tangential orientierten p-Orbitale (zwei pro Boratom) bilden ebenso viele bindende wie nichtbindende Molekülorbitale. Insgesamt ergeben sich für n Boratome n+1 bindende Cluster-Gerüstorbitale. Zählen Sie die Valenzelektronen nach den Regeln von Wade und ordnen Sie das Ergebnis einem Clustertyp zu. (2) 42 VE – 20 VE („Eigenbedarf“, die beiden Elektronen der B-HBindung an jedem Boratom) = 22 GE = 11 GEP, entspricht dem n+1 – Typ („closo“). 4. (5 Punkte) Nennen Sie die unterschiedlichen Klassen von Carbiden und geben Sie je ein Beispiel mit Namen und Formel an. (3) Ionisch, CaC2; kovalent, SiC; metallisch, WC. Beschreiben Sie eine Synthese von Methan aus anorganischen Materialien, indem Sie eine Gleichung für die Reaktion eines geeigneten Carbids mit Wasser formulieren. (2) Al4C3 + 12 H2O → 3 CH4 + 4 Al(OH)3 5. (3 Punkte) Geben Sie an, wie viele terminale und wie viele verbrückende Sauerstoffatome in einem Silicat aus vier Mol SiO2 und drei Mol K2O auf die vier Siliciumatome entfallen. Skizzieren Sie die Wiederholungseinheit für ein solches Silicat. K6Si4O11; das Anion trägt sechs negative Ladungen und enthält daher sechs terminale OAtome. Die übrigen fünf O-Atome sind verbrückend. (Bandstruktur, siehe Skript). 6. (3 Punkte) Skizzieren Sie die Struktur des Hittorf´schen violetten Phosphors, indem Sie die P22-Wiederholungseinheit zeichnen und anhand einer grob schematischen Skizze mit kurzen Kommentaren den dreidimensionalen Aufbau darstellen. 7. (3 Punkte) Formulieren Sie eine Reaktionsgleichung für die Herstellung von Phosphan (2) und geben Sie Stichworte und eine Begründung für dessen von Ammoniak in charakteristischer Weise abweichende Struktur. (1) P4 + 6 H2 4 PH3 (auch andere Gleichungen möglich, etwa aus Mg3P2 und Wasser oder Säure) 8. (7 Punkte) Formulieren Sie eine Reaktionsgleichung für die Herstellung des S2I42+-Kations. (2) Skizzieren Sie die Struktur dieses Kations und verteilen Sie die Beschriftungen „183 pm“, „320 pm“ und „260 pm“ auf die unterschiedlichen Bindungen im Kation. (2) Interpretieren Sie diese Bindungsabstände, indem Sie eine Bindungsordnung zuordnen oder auf andere Weise die Stärke der Wechselwirkung zum Ausdruck bringen. (2) Das S22+ - Kation mit SS – Dreifachbindung wird von zwei Iodmolekülen locker koordiniert. 320 pm ist knapp unter dem Van der Waals-Abstand, 260 pm entspricht einer I-IEinfachbindung und 183 pm entsprechen einer SS – Dreifachbindung. 9. (7 Punkte) Innerhalb einer Hauptgruppe nimmt der metallische Charakter der betreffenden Elemente von oben nach unten zu. Begründen Sie diese Hypothese anhand der Strukturen der Halogene Fluor, Chlor, Brom und Iod. (2) Dazu benötigen Sie keine Zahlenwerte, sondern lediglich einen Trend, der sich aus den Bindungslängen im Verhältnis zu den nicht bindenden Abständen im Kristall ergibt. Die Bindungen und die nichtbindenden Abstände sind bei Fluor und Chlor sehr unterschiedlich und nähern sich beim Iod einander an. Sind alle Abstände gleich, liegt ein Metall vor. Iod ist immer noch ein Nichtmetall. Unter welchen Bedingungen zeigt Iod metallischen Charakter? (1) Bei hohem Druck. Formulieren Sie eine Gleichung für die Reaktion von Platinhexafluorid mit Chlorpentafluorid (2) und skizzieren Sie eine Strukturformel für das ClF4+ - Kation (das ist eines der Reaktionsprodukte). (1) 2 ClF5 + 2 PtF6 → ClF4 PtF6- + ClF6+ PtF6-. Skizzieren Sie auch die Struktur von Chlortrifluorid. (1) (T-Form) 10. (7 Punkte) Begründen Sie in Stichworten, warum sich die Gewinnung von Neon aus Luft nur in sehr großen Luftverflüssigungsanlagen lohnt. (1) Neon siedet bei wesentlich niedrigeren Temperaturen als die Hauptbestandteile der Luft. Die Verflüssigung von Neon verursacht deshalb einen großen technischen Aufwand, der sich nur bei sehr großen Anlagen lohnt. Falsch ist der Hinweis auf den geringen Neonanteil der Luft. Dies trifft nämlich auch für Xenon zu, das auch in kleineren Anlagen rentabel gewonnen werden kann. Begründen Sie auch, warum das Abgas der Ammoniaksynthese für die Gewinnung von Edelgasen von Interesse ist. (1) Für die Ammoniaksynthese wird die Luft getrocknet und von Sauerstoff befreit. Die Ammoniaksynthese selbst befreit die Luft vom größten Teil des darin enthaltenen Stickstoffs. Das Restgas ist deshalb reich an Edelgasen. Geben Sie eine Reaktionsgleichung für die Fluorierung von Xenon mit einer binären Fluorverbindung (nicht mit elementarem Fluor) an. (2) Xe + O2F2 → XeF2 + O2 Geben Sie eine Reaktionsgleichung für die Herstellung von Xenonhexafluorid an (2) und machen Sie einen Vorschlag zur Ausbildung von sechs Xe-F-Bindungen neben einem nicht bindenden Elektronenpaar am Xenon-Zentralatom, wenn nur vier Valenzorbitale zur Verfügung stehen. (1) Formulieren Sie bitte so knapp wie möglich. Xe + 6 F2 → XeF6 Nichtbindendes Elektronenpaar im s-Orbital Drei 3Z4e-Bindungen über die p-Orbitale. Klausur zur Vorlesung Anorganische Chemie I Kaiserslautern, 23. Oktober 2013 Die Klausur besteht aus neun Fragen, für deren Bearbeitung 100 Minuten Zeit zur Verfügung stehen. Es können 60 Punkte erreicht werden, bis zu drei Bonuspunkte aus den Übungen kommen hinzu. Für das Bestehen der Klausur sind 24 Punkte erforderlich. Zur Beantwortung der Fragen genügen Formeln, Zeichnungen, Reaktionsgleichungen oder Stichpunkte. Bitte geben Sie Ihre Antworten in der durch die Nummerierung der Fragen vorgegebenen Reihenfolge, indem Sie für zunächst nicht geläufige Antworten einige Zeilen freilassen. Hinweis: Mit Ihrer Teilnahme an der Klausur versichern Sie zugleich, dass Sie prüfungsfähig sind. Im Falle einer plötzlich während der Prüfung auftretenden Erkrankung sind Sie verpflichtet, das Aufsichtspersonal umgehend zu informieren. Der Rücktritt von der Prüfung muss anschließend beim zuständigen Prüfungsausschuss beantragt werden und ein ärztliches Attest - ausgestellt am Prüfungstag - ist unverzüglich nachzureichen. Wird die Prüfung hingegen in Kenntnis einer gesundheitlichen Beeinträchtigung regulär beendet, kann im Nachhinein kein Prüfungsrücktritt aufgrund von Krankheit beantragt werden. 1. (10 Punkte) Beschreiben Sie die Gewinnung von elementarem Lithium aus dem natürlich vorkommenden Mineral Spodumen (LiAlSi2O6) in drei Schritten anhand von drei Reaktionsgleichungen. (6) Skizzieren Sie einen Lithium-Ionen-Akkumulator. (2) Gehen Sie vom geladenen Zustand aus und formulieren Sie eine Reaktionsgleichung für den Entladevorgang. (2) 2. (8 Punkte) Geben Sie Namen und Formel für je ein natürlich vorkommendes Mineral des Bariums und des Strontiums an. (2) Beschreiben Sie anhand von Reaktionsgleichungen die Herstellung von Calciumoxid und Bariumoxid. (Zwei Reaktionsgleichungen, vier Punkte). Begründen Sie die unterschiedlichen Verfahren. (Zwei Gründe, zwei Punkte). 3. (12 Punkte) Beschreiben Sie die Herstellung von B10H102- aus Bortrifluorid (drei Reaktionsgleichungen) (6). Behandeln Sie den Cluster B10H102- nach den Elektronenzählregeln von Wade und geben Sie an, um welchen Clustertyp es sich handelt (2). Skizzieren Sie einen Ausschnitt aus der Struktur von Borsäure (2). Nennen Sie ein in der Natur vorkommendes Borat mit Namen und Formel (1). Geben Sie auch für das schwerste Homologe des Bors ein natürliches Mineral an (1). 4. (10 Punkte) Beschreiben Sie die Herstellung folgender Substanzen anhand von Reaktionsgleichungen: Acetylen aus anorganischen Materialien in zwei Reaktionsschritten (4). Silan (Monosilan, zwei Verfahren, zwei Reaktionsgleichungen) (4). Dimethyldichlorsilan (Müller-Rochow-Synthese) (2). 5. (5 Punkte) Skizzieren Sie die Struktur des faserförmigen Phosphors, indem Sie die P21Wiederholungseinheit zeichnen und anhand einer grob schematischen Skizze mit kurzen Kommentaren den dreidimensionalen Aufbau darstellen(3) . Beschreiben Sie in Stichworten und ohne Zeichnung eine der Hochdruck-Strukturen der Elemente der Stickstoffgruppe (2). 7. (6 Punkte) Skizzieren Sie die Struktur und beschreiben Sie die Bindungsverhältnisse im Phosphorpentafluorid. Orientieren Sie sich dabei an der theoretisch berechneten Bindungssituation im hypothetischen Stickstoffpentafluorid (3). Phosphorpentafluorid zeigt nur ein Signal im 19F-NMR-Spektrum. Erklären Sie diesen Befund anhand der Moleküldynamik (Skizze, Kommentar, 3 Punkte). 8. (5 Punkte) Skizzieren Sie Valenzstrichformeln für zwei aromatische Ringe, die Schwefelatome enthalten (2). Formulieren Sie für einen der genannten Ringe eine Reaktionsgleichung für dessen Herstellung (2). Begründen Sie anhand einer Valenzstrichformel, warum Tetraschwefeltetranitrid keinen aromatischen Ring bildet (1). 9. (4 Punkte) Skizzieren Sie die Struktur von Chlortrifluorid und nennen Sie eine Eigenschaft dieser Substanz (2). Chlorheptafluorid konnte bislang nicht hergestellt werden. Formulieren Sie die nicht gelungene chemische Reaktion, mit der man sich Chancen auf die Synthese von ClF7 ausrechnete (2). Klausur zur Vorlesung Anorganische Chemie I Kaiserslautern, 13. Februar 2014 Die Klausur besteht aus zehn Fragen, für deren Bearbeitung 100 Minuten Zeit zur Verfügung stehen. Es können 60 Punkte erreicht werden, bis zu drei Bonuspunkte aus den Übungen kommen hinzu. Für das Bestehen der Klausur sind 24 Punkte erforderlich. Zur Beantwortung der Fragen genügen Formeln, Zeichnungen, Reaktionsgleichungen oder Stichpunkte. Bitte geben Sie Ihre Antworten in der durch die Nummerierung der Fragen vorgegebenen Reihenfolge, indem Sie für zunächst nicht geläufige Antworten einige Zeilen freilassen. Hinweis: Mit Ihrer Teilnahme an der Klausur versichern Sie zugleich, dass Sie prüfungsfähig sind. Im Falle einer plötzlich während der Prüfung auftretenden Erkrankung sind Sie verpflichtet, das Aufsichtspersonal umgehend zu informieren. Der Rücktritt von der Prüfung muss anschließend beim zuständigen Prüfungsausschuss beantragt werden und ein ärztliches Attest - ausgestellt am Prüfungstag - ist unverzüglich nachzureichen. Wird die Prüfung hingegen in Kenntnis einer gesundheitlichen Beeinträchtigung regulär beendet, kann im Nachhinein kein Prüfungsrücktritt aufgrund von Krankheit beantragt werden. 1. (9 Punkte) Nennen Sie zwei natürlich vorkommende Kaliumverbindungen mit Namen und Formel.(2) Geben Sie für die Herstellung von elementarem Kalium aus einer Kaliumverbindung eine Reaktionsgleichung an (2) und formulieren Sie zwei Reaktionsgleichungen für die Herstellung von Kaliumoxid (K2O) in einem zweistufigen Prozess. (2) Hinweis: Dabei wird zuerst eine leicht erhältliche Verbindung produziert, die in einer Folgereaktion zum Kaliumoxid umgesetzt wird. Skizzieren Sie die Struktur von Kaliumoxid.(2) Hinweis: Die Oxide Li2O – Cs2O kristallisieren im gleichen Gittertyp. Nennen Sie einen Namen für diesen Gittertyp.(1) 2. (8 Punkte) Definieren Sie den Begriff der Wasserhärte und unterscheiden Sie zwei verschiedene Typen der Wasserhärte.(2) Belegen Sie diese Unterscheidung anhand einer Reaktionsgleichung.(2) Nennen Sie die eindrucksvolle Naturerscheinung, die in unterirdischen Hohlräumen als Folge dieser Reaktion entstehen kann.(1) Nennen Sie drei Nachteile, die durch hartes Wasser verursacht werden und drei Maßnahmen zur Verringerung oder Vermeidung der Wasserhärte.(3) 3. (11 Punkte) Nennen Sie ein natürlich vorkommendes Bormineral mit Namen und Formel. (2) Beschreiben Sie die technische Herstellung von Bortrichlorid anhand einer Reaktionsgleichung (2 Punkte, Hinweis: Bitte nicht Bor in Chlor verbrennen, das wäre zu teuer). Nennen Sie eine Anwendung von Borfasern (1) und geben Sie eine Reaktionsgleichung zu deren Herstellung aus Bortrichlorid an.(2) Skizzieren Sie das zentrale Strukturelement des -rhomboedrischen Bors und geben Sie in Stichworten an, wie dieses mit den benachbarten Strukturelementen verknüpft ist.(2) Wenden Sie auf dieses Strukturelement die Elektronenzählregeln nach Wade an und bezeichnen Sie den Clustertyp.(2) 4. (5 Punkte) Nennen Sie die unterschiedlichen Klassen von Carbiden und geben Sie je ein Beispiel mit Namen und Formel an. (3) Beschreiben Sie eine Synthese von Acetylen (Ethin) aus anorganischen Materialien, indem Sie eine Gleichung für die Reaktion eines geeigneten Carbids mit Wasser formulieren. (2) 5. (2 Punkte) Wählen Sie, welche von zwei Reaktionsgleichungen Sie lieber formulieren möchten. Entweder: Beschreiben Sie die Herstellung von Silicon-Polymerketten aus einem Produkt der Müller-Rochow-Synthese. (Hinweis: Nicht die Müller-Rochow-Synthese, sondern die nachfolgende Herstellung des Polymers ist gefragt).(2) Oder: Beschreiben Sie die Herstellung des Vernetzers Triacetyl(methyl)silan, der in den handelsüblichen Silicon-Kartuschen enthalten ist, anhand einer Reaktionsgleichung.(2) 6. (3 Punkte) Außer dem N2-Molekül konnten beim Stickstoff weitere Modifikationen beobachtet werden. Beschreiben Sie eine dieser Stickstoffmodifikationen. Hinweis: Für die einfachste dieser Modifikationen wäre die Valenzstrichformel gefragt. Für die ausgedehnte Festkörperstruktur, die in der Vorlesung nicht abgebildet wurde, wären Stichworte zum räumlichen Aufbau erwünscht.(2) Geben Sie eine nähere Information zu der von Ihnen beschriebenen Modifikation an (z. B. zur Herstellung oder zu deren Eigenschaften).(1) 7. (7 Punkte) Formulieren Sie Reaktionsgleichungen für die Herstellung von Distickstofftetrafluorid und von Distickstoffdifluorid.(4) Nennen Sie die Besonderheit, die zu einer intensiv blauen Farbe von Distickstofftetrafluorid bei erhöhter Temperatur führt.(1) Geben Sie eine Reaktionsgleichung für eine Folgereaktion von Distickstofftetrafluorid an.(2) 8. (4 Punkte) Formulieren Sie eine Reaktionsgleichung für die Oxidation von elementarem Schwefel zum S82+-Kation. (2) Skizzieren Sie die Struktur dieses Kations und geben Sie an, wo neben den S-S-Abständen zwischen 205 und 207 pm ein Abstand von 283 pm gefunden wurde.(1) Lokalisieren Sie auch die beiden positiven Ladungen und interpretieren Sie die unterschiedlichen Abstände. (1) 9. (8 Punkte) Formulieren Sie Reaktionsgleichungen für die Herstellung von Iodheptafluorid, Octafluoroiodat(VII) und [IF6]+ [AsF6-]. (Drei Gleichungen, sechs Punkte). Skizzieren Sie zwei der beiden Reaktionsprodukte und bezeichnen Sie den Strukturtyp jeweils mit einem Stichwort.(2) 10. (3 Punkte) Geben Sie eine Reaktionsgleichung für die Herstellung von Xenondifluorid an (2) und skizzieren Sie eine Valenzstrichformel für das dreiatomige Molekül.(1) Klausur zur Vorlesung Anorganische Chemie I Kaiserslautern, 10. April 2014 Die Klausur besteht aus neun Fragen, für deren Bearbeitung 90 Minuten Zeit zur Verfügung stehen. Es können 50 Punkte erreicht werden, bis zu drei Bonuspunkte aus den Übungen kommen hinzu. Für das Bestehen der Klausur sind 20 Punkte erforderlich. Zur Beantwortung der Fragen genügen Formeln, Zeichnungen, Reaktionsgleichungen oder Stichpunkte. Bitte achten Sie darauf, dass Ihre Antworten in der durch die Nummerierung der Fragen vorgegebenen Reihenfolge angeordnet sind. Dies wird Ihnen gelingen, wenn Sie für zunächst nicht geläufige Antworten einige Zeilen freilassen. Hinweis: Mit Ihrer Teilnahme an der Klausur versichern Sie zugleich, dass Sie prüfungsfähig sind. Im Falle einer plötzlich während der Prüfung auftretenden Erkrankung sind Sie verpflichtet, das Aufsichtspersonal umgehend zu informieren. Der Rücktritt von der Prüfung muss anschließend beim zuständigen Prüfungsausschuss beantragt werden und ein ärztliches Attest - ausgestellt am Prüfungstag - ist unverzüglich nachzureichen. Wird die Prüfung hingegen in Kenntnis einer gesundheitlichen Beeinträchtigung regulär beendet, kann im Nachhinein kein Prüfungsrücktritt aufgrund von Krankheit beantragt werden. 1. (8 Punkte) Beschreiben Sie die Herstellung von Lithiumoxid (Li2O) aus Lithiumcarbonat in vier aufeinander folgenden Schritten anhand von vier Reaktionsgleichungen (je 2Punkte). 2. (5 Punkte) Skizzieren Sie die Struktur von Calciumfluorid (Fluorit) (2) und geben Sie Koordinationszahlen und Koordinationsgeometrie für die Ionen an (2). Nennen Sie auch ein Beispiel für den Antityp zu diesem Strukturtyp (Namen und Formel, 1 Punkt). 3. (4 Punkte) Beschreiben Sie anhand einer Reaktionsgleichung (2) die Herstellung des Caesiumsalzes eines schwach koordinierenden Anions, das aus einem Käfig aus elf Boratomen und einem Kohlenstoffatom besteht. (Es geht hier um den letzten Schritt, der eine geeignete Vorstufe mit den passenden Substituenten ausstattet. Wählen Sie zur Beantwortung eine von mehreren im Skript beschriebenen Varianten dieses Typs von Anionen). In mehreren Schritten, die hier nicht gefragt sind, kann aus dem Caesiumsalz die freie Brønstedt-Säure hergestellt werden. Veranschaulichen Sie anhand einer Reaktionsgleichung die extreme Acidität dieser Säure (2). 4. (5 Punkte) Skizzieren Sie die Strukturen, die sich beim Erhitzen von Kalium mit der achtfachen bzw. 24fachen molaren Menge an Kohlenstoff in Form von Graphit ausbilden (3). Machen Sie Angaben zum Verbleib der Valenzelektronen des Kaliums und zur Reaktivität des Kaliumgraphits (2). 5. (7 Punkte) Nennen Sie Namen und Formeln von vier Arsenmineralien (2) und skizzieren Sie Strukturen zweier Modifikationen des Arsens (3). (Tipp: Analoge Modifikationen sind auch beim Phosphor bekannt). Bestimmen Sie für die molekulare Form des Arsens (oder für die gleiche Phosphormodifikation) den Clustertyp nach den Wade´schen Regeln (2). 6. (5 Punkte) Beschreiben Sie anhand einer Reaktionsgleichung die Umsetzung von S8 mit Wasserstoffperoxid und Trichloressigsäure (2). Skizzieren Sie das molekulare Reaktionsprodukt (2) und begründen Sie die Stereochemie (1). 7. (5 Punkte) Geben Sie Formeln für die Hydrolyseprodukte folgender Substanzen an: a) KH, b) CaC2, c) B2H6, d) ClSiMe3 (Me steht für die Methylgruppe, CH3), e) Mg3N2. 8. (7 Punkte) Beschreiben Sie anhand zweier Reaktionsgleichungen die Umsetzungen von Iodpentafluorid mit Caesumfluorid oder Phosphorpentafluorid (4). Skizzieren Sie die Struktur des Iodpentafluorid-Moleküls sowie der beiden Reaktionsprodukte und berücksichtigen Sie jeweils alle Valenzelektronen am Iodatom (3). 8. (4 Punkte) Beschreiben Sie anhand zweier Reaktionsgleichungen die Herstellung einer kationischen Krypton-Verbindung, die als stärkstes bekanntes Oxidationsmittel gilt. Gehen Sie dabei von Krypton aus. Klausur zur Vorlesung Anorganische Chemie I Kaiserslautern, 15. August 2014 Die Klausur besteht aus neun Fragen, für deren Bearbeitung 90 Minuten Zeit zur Verfügung stehen. Es können 50 Punkte erreicht werden, bis zu sechs Bonuspunkte aus den Übungen kommen hinzu. Für das Bestehen der Klausur sind 22.5 Punkte erforderlich. Zur Beantwortung der Fragen genügen Formeln, Zeichnungen, Reaktionsgleichungen oder Stichpunkte. Bitte achten Sie darauf, dass Ihre Antworten in der durch die Nummerierung der Fragen vorgegebenen Reihenfolge angeordnet sind. Dies wird Ihnen gelingen, wenn Sie für zunächst nicht geläufige Antworten einige Zeilen freilassen. Hinweis: Mit Ihrer Teilnahme an der Klausur versichern Sie zugleich, dass Sie prüfungsfähig sind. Im Falle einer plötzlich während der Prüfung auftretenden Erkrankung sind Sie verpflichtet, das Aufsichtspersonal umgehend zu informieren. Der Rücktritt von der Prüfung muss anschließend beim zuständigen Prüfungsausschuss beantragt werden und ein ärztliches Attest - ausgestellt am Prüfungstag - ist unverzüglich nachzureichen. Wird die Prüfung hingegen in Kenntnis einer gesundheitlichen Beeinträchtigung regulär beendet, kann im Nachhinein kein Prüfungsrücktritt aufgrund von Krankheit beantragt werden. 1. (6 Punkte) Beschreiben Sie ein organisches Molekül mit Namen und Valenzstrichformel, das Kalium-Kationen in organischen Lösungsmitteln löslich machen kann. (2) 18-Krone-6 Beschreiben Sie in Stichworten die Funktionsweise der Kaliumkanäle einer Nervenzelle und gehen Sie dabei auf die Koordinationssphäre der K+ - Ionen im Kanal und in der umgebenden wässrigen Lösung (2) sowie auf die Selektivität für K+ und den Ausschluss von Na+ ein. (1) Geben Sie auch an, wie der Kanal geschlossen wird. (1) Acht O-Donoratome in passender Anordnung: tetragonal antiprismatisch wie die acht Wasserliganden des K+ - Ions in wässriger Lösung. Die O-Donoratome im Kanal sind für Na+ zu weit auseinander. Dieses erhält keinen angemessenen Ausgleich für den Verzicht auf seine Wasserliganden. Na+ verbleibt daher in seiner Hydrathülle und kann nicht in den Kanal eindringen. Der Kanal wird durch ein Bündel Proteinhelices geschlossen, sobald ein entsprechendes chemisches Signal eine Konformationsänderung herbeiführt. 2. (7 Punkte) Geben Sie eine Reaktionsgleichung an für die Herstellung von Berylliumchlorid aus Berylliumoxid in einem Reaktionsschritt. (2) Skizzieren Sie die Struktur von Berylliumchlorid (2) und vergleichen Sie die Bindungssituation der Chloratome mit derjenigen der Wasserstoffatome im Berylliumhydrid (2). Nennen Sie die Summenformel einer Bariumverbindung, in der eine sehr ähnliche Struktur auftritt. (Dort ist die Position von Kationen und Anionen vertauscht und das betreffende Strukturelement ist geladen). (1) BeO + C + Cl2 → BeCl2 + CO (reduzierende Chlorierung) Cl Cl Cl Be Cl Cl Be Cl Cl Be Cl Be Cl Cl Hydrid: 3Z2e-Bindungen, Chlorid: zwei Elektronenpaarbindungen Oder: Hydrid – Einelektronendonor; Chlorid - Dreielektronendonor 3. (3 Punkte) Formulieren Sie eine Reaktionsgleichung für die Herstellung des Decahydridodecaborats Na2B10H10 (2) und zeichnen Sie die Struktur des Anions. (1) 4. Kreuzen Sie an (je 1 Punkt, insgesamt 7 Punkte): falsch richtig Graphit hat eine höhere Dichte als Silicium Diamant fühlt sich fettig an Bei 1000 °C ist Borcarbid härter als Diamant Diamant leitet Wärme besser als Kupfer Kohlenstoff-Nanoröhren leiten Wärme besser als Diamant Wolframcarbid ist eine elektrisch leitfähige Ionenverbindung Germanium ist durchscheinend im Sonnenlicht Bei Germanium wurde beides anerkannt. Es sieht aus wie Silicium, ist also eigentlich undurchsichtig. Es wurde jedoch keine Dicke angegeben. Vermutlich wäre ein hauchdünnes Germaniumblättchen doch durchscheinend im Sonnenlicht … 5. (4 Punkte) Geben Sie die Zusammensetzung der blau metallisch glänzenden, würfelförmigen Kristalle an, die beim Erhitzen von Gold und Calcium in einer Stickstoffatmosphäre entstehen (1) und skizzieren Sie die Struktur dieser Verbindung. (2) Weisen Sie den beteiligten Atomen Oxidationsstufen zu und berücksichtigen Sie dabei die nicht an Atomen lokalisierten Elektronen dieses Elektrids. (1) Ca3AuN Au- (Aurid) in der Würfelmitte, Ca2+ auf den Kantenmitten, N3- auf den Würfelecken, zwei bewegliche Elektronen pro Formeleinheit 6. (6 Punkte) Formulieren Sie Reaktionsgleichungen für die dreistufige Herstellung von Tetrazen aus Tris(trimethylsilyl)hydrazin. (Zwei Punkte pro Reaktionsgleichung) (Me3Si)2N-NHSiMe3 → Me3SiN=NSiMe3 + HSiMe3 2 Me3SiN=NSiMe3 → (Me3Si)2N-N=N-N(SiMe3)2 (Me3Si)2N-N=N-N(SiMe3)2 + 4 F3C-COOH → H2N-N=N-NH2 + 4 F3C-COOSiMe3 7. (7 Punkte) Beschreiben Sie anhand zweier Reaktionsgleichungen die Umsetzungen von Iodpentafluorid mit Caesiumfluorid oder Phosphorpentafluorid (4). Skizzieren Sie die Struktur des Iodpentafluorid-Moleküls sowie der beiden berücksichtigen Sie jeweils alle Valenzelektronen am Iodatom (3). Reaktionsprodukte und IF5 + CsF → Cs+ [IF6]IF5 + PF5 → [IF4]+ [PF6]IF5 Oktaeder; eine Ecke mit einem nicht bindenden Elektronenpaar besetzt IF4+ Trigonale Bipyramide, ein nicht bindendes Paar equatorial (Wippe) IF6-: verzerrtes Oktaeder mit einem zusätzlichen (7., nicht bindenden) Elektronenpaar 8. (4 Punkte) Nennen Sie ein Molekül, in dem eine lineare Einheit der Zusammensetzung F-E-F vorkommt, die durch eine Dreizentren-Vierelektronen-Bindung verbunden ist. (E steht dabei für ein Atom eines Hauptgruppenelements). Skizzieren Sie die Molekülorbitale für diese lineare Anordnung dreier Atome und geben Sie auch deren Besetzung mit Elektronen an. 9. (6 Punkte) Nennen Sie Summenformeln und skizzieren Sie Strukturen selbst gewählter Beispiele für folgende Clustertypen: a) ein closo-Cluster mit elf Ecken. (2) b) ein nido-Cluster mit neun Ecken. (2) c) ein arachno-Cluster mit vier Ecken. (2) Klausur zur Vorlesung Anorganische Chemie I Kaiserslautern, 29. Oktober 2014 Die Klausur besteht aus zwölf Fragen, für deren Bearbeitung 90 Minuten Zeit zur Verfügung stehen. Es können 50 Punkte erreicht werden, bis zu sechs Bonuspunkte aus den Übungen kommen hinzu. Für das Bestehen der Klausur sind 22.5 Punkte erforderlich. Zur Beantwortung der Fragen genügen Formeln, Zeichnungen, Reaktionsgleichungen oder Stichpunkte. Bitte achten Sie darauf, dass Ihre Antworten in der durch die Nummerierung der Fragen vorgegebenen Reihenfolge angeordnet sind. Dies wird Ihnen gelingen, wenn Sie für zunächst nicht geläufige Antworten einige Zeilen freilassen. Hinweis: Mit Ihrer Teilnahme an der Klausur versichern Sie zugleich, dass Sie prüfungsfähig sind. Im Falle einer plötzlich während der Prüfung auftretenden Erkrankung sind Sie verpflichtet, das Aufsichtspersonal umgehend zu informieren. Der Rücktritt von der Prüfung muss anschließend beim zuständigen Prüfungsausschuss beantragt werden und ein ärztliches Attest - ausgestellt am Prüfungstag - ist unverzüglich nachzureichen. Wird die Prüfung hingegen in Kenntnis einer gesundheitlichen Beeinträchtigung regulär beendet, kann im Nachhinein kein Prüfungsrücktritt aufgrund von Krankheit beantragt werden. 1. (6 Punkte) Beschreiben Sie die Auflösung von Natrium in flüssigem Ammoniak anhand einer Reaktionsgleichung (2). Beschreiben Sie auch den sichtbaren Effekt (1) und bezeichnen Sie die Substanzklasse (1), zu der die gelöste Verbindung gehört. Unterteilen Sie diese Substanzklasse in zwei Gruppen nach deren physikalischen Eigenschaften (2). 2. (8 Punkte) Definieren Sie den Begriff der Wasserhärte und unterscheiden Sie zwei verschiedene Typen der Wasserhärte (2). Belegen Sie diese Unterscheidung anhand einer Reaktionsgleichung (2). Nennen Sie die eindrucksvolle Naturerscheinung, die in unterirdischen Hohlräumen als Folge dieser Reaktion entstehen kann (1). Nennen Sie drei Nachteile, die durch hartes Wasser verursacht werden und drei Maßnahmen zur Verringerung oder Vermeidung der Wasserhärte (3). 3. (3 Punkte) Formulieren Sie eine Reaktionsgleichung zur Herstellung von Bortribromid (2) und geben Sie den Trend der Lewis-Säurestärke für die Reihe BF3 / BCl3 / BBr3 / BI3 an (1). 4. (3 Punkte) Flüssiges Aluminium reagiert bei Temperaturen über 1000 °C mit Wasserstoff in endothermer Reaktion zum Aluminiumtrihydrid AlH3. Nennen Sie das Nebenprodukt dieser Reaktion mit Namen und Formel (1). Beschreiben Sie anhand einer Reaktionsgleichung, mit welchem Zusatz die Reaktion von Aluminium mit Wasserstoff bereits bei 150 °C durchgeführt werden kann (2). 5. (4 Punkte) Nennen Sie das Bauprinzip der Fullerene (1) und geben Sie stichwortartig die Reaktionsbedingungen an, unter denen Fullerene gebildet werden (2). Begründen Sie, warum unter diesen Bedingungen kein Graphit entsteht (1). 6. (3 Punkte) Die Wiederholungseinheit eines Silicat-Anions enthält vier Siliciumatome und elf Sauerstoffatome. Ermitteln Sie die Ladung dieser Wiederholungseinheit (1) und skizzieren Sie die Struktur des Silicat-Anions. 7. (6 Punkte) Vergleichen Sie die Geometrie von Phosphan (PH3) mit der Geometrie des Ammoniaks und begründen Sie den Unterschied (2). Geben Sie zwei Reaktionsgleichungen für die Herstellung von Phosphan an (4). 8. (4 Punkte) Nennen Sie ein Molekül, in dem eine lineare Einheit der Zusammensetzung F-E-F vorkommt, die durch eine Dreizentren-Vierelektronen-Bindung verbunden ist (1). (E steht dabei für ein Atom eines Hauptgruppenelements). Skizzieren Sie die Molekülorbitale für diese lineare Anordnung dreier Atome und geben Sie auch deren Besetzung mit Elektronen an (3). 9. (6 Punkte) Nennen Sie je ein Mineral des Tellurs und des Selens mit Namen und Formel (2). Beschreiben Sie für beide Elemente das Aussehen im festen und im flüssigen Zustand (2). Geben Sie eine Reaktionsgleichung für die Oxidation von elementarem Selen mit einem Oxidationsmittel an, das schwach koordinierende Anionen bildet (2). 11. (4 Punkte) Skizzieren Sie einen Ausschnitt aus einer Schicht der Kristallstruktur von elementarem Iod (2). Nennen Sie den Trend, der sich in den Kristallstrukturen von Chlor, Brom und Iod zu erkennen gibt (1). Geben Sie an, wie dieser Trend experimentell weiter verfolgt werden kann und zu welchem Strukturtyp dieses Experiment geführt hat (1). 12 (3 Punkte) Geben Sie eine Reaktionsgleichung für die Fluorierung von Krypton an (2) und nennen Sie das stärkste bekannte Oxidationsmittel (1). Klausur zur Vorlesung Anorganische Chemie I Kaiserslautern, 19. Februar 2015 Die Klausur besteht aus acht Fragen, für deren Bearbeitung 90 Minuten Zeit zur Verfügung stehen. Es können 50 Punkte erreicht werden, bis zu sechs Bonuspunkte aus den Übungen kommen hinzu. Für das Bestehen der Klausur sind 22.5 Punkte erforderlich. Zur Beantwortung der Fragen genügen Formeln, Zeichnungen, Reaktionsgleichungen oder Stichpunkte. Bitte achten Sie darauf, dass Ihre Antworten in der durch die Nummerierung der Fragen vorgegebenen Reihenfolge angeordnet sind. Dies wird Ihnen gelingen, wenn Sie für zunächst nicht geläufige Antworten einige Zeilen freilassen. Hinweis: Mit Ihrer Teilnahme an der Klausur versichern Sie zugleich, dass Sie prüfungsfähig sind. Im Falle einer plötzlich während der Prüfung auftretenden Erkrankung sind Sie verpflichtet, das Aufsichtspersonal umgehend zu informieren. Der Rücktritt von der Prüfung muss anschließend beim zuständigen Prüfungsausschuss beantragt werden und ein ärztliches Attest - ausgestellt am Prüfungstag - ist unverzüglich nachzureichen. Wird die Prüfung hingegen in Kenntnis einer gesundheitlichen Beeinträchtigung regulär beendet, kann im Nachhinein kein Prüfungsrücktritt aufgrund von Krankheit beantragt werden. 1. (9 Punkte) Formulieren Sie eine Reaktionsgleichung für die Zersetzung einer Verbindung eines Alkalimetalls mit nur einem anderen chemischen Element (also einer binären Verbindung) in die beiden Elemente (2). Kommentieren Sie kurz, warum diese Methode im Fall der Lithiumverbindung nicht gelingt (1). Skizzieren Sie die Struktur des Zersetzungsproduktes der Lithiumverbindung (2). Geben Sie je eine Reaktionsgleichung für eine chemische Reduktion zur Herstellung von elementarem Natrium und Calcium an (4). Verwenden Sie dabei bitte nicht das gleiche Reduktionsmittel wie zuvor. 2 NaN3 → 2 Na + 3 N2 Lithiumnitrid wird gebildet: Struktur 2 NaOH + 2 Mg → 2 Na + 2 MgO + H2 3 CaO + 2 Al → 3 Ca + Al2O3 Weiteres Reduktionsmittel für Na+ - Ionen: Zirconium 2. (6 Punkte) Nennen Sie ein Mineral mit Namen und Formel, aus dem beim Erhitzen auf ca. 900 – 1000 °C eine äquimolare Mischung aus Calcium- und Magnesiumoxid entsteht (1). Beschreiben Sie in Stichworten und anhand einer Gleichung für eine Fällungsreaktion (2), wie der Calcium-Anteil entfernt und der Magnesiumgehalt des Rückstands auf preiswerte Weise verdoppelt werden kann (1). Nennen Sie den Strukturtyp des Magnesiumoxids (Stichwort, keine Skizze, 1 Punkt) und eine Anwendung. (1) Dolomit, CaMg(CO3)2 Ca(OH)2 + Mg2+ → Ca2+ + Mg(OH)2 (mit Meerwasser, das Magnesiumionen enthält). NaCl-Strukturtyp, Anwendung: feuerfeste Keramik, Isolatoren, Herstellung von wasserfreiem Magnesiumchlorid mit Koks und Chlor durch reduzierende Chlorierung 3. (9 Punkte) Formulieren Sie zwei Reaktionsgleichungen zur Herstellung von Bortrifluorid (4) und zwei Reaktionsgleichungen zur Herstellung von Dibortetrafluorid aus Bortrichlorid (4). Geben Sie den Trend der Lewis-Säurestärke für die Reihe BF3 / BCl3 / BBr3 / BI3 an (1). B2O3 + 6 HF → 2 BF3 + 3 H2O Na2B4O7 + 12 HF → Na+2[O(BF3)4]2- + 6 H2O Na+2[O(BF3)4]2- + 2 H2SO4 → 2 NaHSO4 + H2O + 4 BF3 [Ar-NN]+ BF4- → ArF + BF3 + N2 (Ar = Aryl) 2 BCl3 + 2 Cu → B2Cl4 + 2 CuCl 3 B2Cl4 + 4 SbF3 → 3 B2F4 + 4 SbCl3 Die Lewis-Säurestärke nimmt vom Bortrifluorid zum Bortriiodid zu. 4. (5 Punkte) Geben Sie in Stichworten eine Ursache für den gleichen Kovalenzradius von 125 pm für Aluminium und Gallium an (1). Nennen Sie den Stabilitätstrend für die Beständigkeit der Oxidationsstufen +III und +I bei den Elementen der Gruppe 13 (1). Geben Sie einen Grund für die Giftwirkung von Thallium an (1) und nennen Sie eine Substanz mit Namen (keine Formel verlangt), die hilft, das Gift aus dem Körper zu entfernen (1). Der Staub aus den Abgasen der Röstprozesse von sulfidischen Zink- oder Bleierzen enthält Thalliumoxid und –sulfat, die daraus mit Schwefelsäure extrahiert und als Thallium(I)chlorid gefällt werden. Durch Elektrolyse wird daraus Thallium mit Cadmium als Nebenbestandteil gewonnen. Geben Sie in Stichworten an, wie aus dieser Legierung reines Thallium gewonnen wird (1). 5. (12 Punkte) Beschreiben Sie anhand von Reaktionsgleichungen a) die Herstellung von Acetylen aus Kalk, Kohle und Wasser (3 Gleichungen, 6 Punkte) CaCO3 → CaO + CO2 CaO + 3 C → CaC2 + CO CaC2 + H2O → Ca(OH)2 + HCCH b) die Reinigung von Rohsilicium durch Umwandlung in eine Flüssigkeit und die Rückgewinnung des Siliciums in sehr reiner Form nach der Destillation (2 Gleichungen, 4 Punkte). Si + 3 HCl → HSiCl3 + H2 HSiCl3 + H2 → Si + 3 HCl c) Formulieren Sie eine Reaktionsgleichung zum Verhalten von Aluminium in dem unter b) genannten Prozess, das als Verunreinigung im Rohsilicium enthalten ist (2 Punkte). 2 Al + 6 HCl → 2 AlCl3 + 3 H2 6. (5 Punkte) Skizzieren Sie für eine von drei 3Z4e-Bindungen des Schwefelhexafluorids die Überlappung der drei beteiligten Atomorbitale und geben Sie die Besetzung der resultierenden Molekülorbitale mit Elektronen an (3). Stellen Sie dar, wie alle sechs Fluoratome mit je einem Orbital mit dem 3s-Orbital des Schwefels überlappen und so eine „7Z2e-Bindung“ entsteht (2). (Die nachstehend auch abgebildete 7Z2e-Bindung war nicht gefragt) 7. (2 Punkte) Nennen Sie je ein Mineral für die Elemente Antimon und Iod mit Namen und Formel. 8. (2 Punkte) Skizzieren Sie die Molekülgestalt für a) Schwefeltetrafluorid b) Xenontetrafluorid