Atombau Füllen Sie folgende Tabelle aus: Teilchen Anzahl Schalen
Werbung

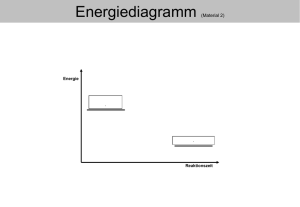
Atombau Füllen Sie folgende Tabelle aus: Teilchen Anzahl Schalen Anzahl p+ Anzahl e- Anzahl n° 20Ne 2 4 10 29 11 10 29 10 10 34 12 63Cu 23Na+ Nukleonenzahl = Massenzahl 20 63 23 Ordnungszahl 10 29 11 Anzahl Valenzelektronen 8 Reaktionsgleichungen Vervollständigen Sie die folgenden Reaktionsgleichungen, indem Sie die korrekten Koeffizienten einsetzen: 4 Al + 3 CO2 2 SO3 2 Mg + SiO2 2 Al2O3 + 3 C 2 SO2 + O2 2 MgO + Si Reaktionsgleichungen Stellen Sie für folgende Reaktionen die Reaktionsgleichungen auf. A Tatsächlich ist Wasser neben Kohlendioxid (bestehend aus einem Kohlenstoff- und zwei Sauerstoffatomen) das wichtigste Reaktionsprodukt einer Verbrennung von zum Beispiel Erdgas (bestehend aus einem Kohlenstoff- und vier Wasserstoffatomen). CH4 + 2 O2 CO2 + 2 H 2O B Synthese von Ammoniak (NH3) aus seinen Elementen. N2 + 3 H2 2 NH3 Chemie im Alltag Zu welchem Zweck schwitzen wir? Wie wird dieser Zweck erreicht? Erklären Sie mit dem Teilchenmodell und chemischen Ausdrücken. Beim Schwitzen scheidet unser Körper hauptsächlich Wasser aus. Dieses verdunstet an der Oberfläche und geht somit vom flüssigen in den gasförmigen Zustand über. Dabei müssen die Anziehungskräfte zwischen den Teilchen im flüssigen Zustand überwunden werden: Der Vorgang ist also endotherm und braucht Energie. Diese wird von der Körperwärme geliefert und damit ist der Zweck des Schwitzens erreicht, unser Körper kühlt nämlich ab. Energieumsatz Zeichnen Sie das passende Energiediagramm für die Synthese von Chlorwasserstoff (HCl). Begründen Sie Ihre Wahl und vergessen Sie nicht, alle Elemente des Diagrammes anzuschreiben. Schreiben Sie zuerst die Reaktionsgleichung auf. Cl2 + H2 2 HCl Bei der Bildung von Verbindungen aus Elementen wird (in den allermeisten Fällen) Energie frei, es sind also exotherme Reaktionen. Damit ist folgendes Energiediagramm passend: Quelle: http://www.kst-chemie.ch/chicd/kap6/kap63.htm Atommodell Zeichnen Sie ein Modell für folgendes Nuklid: 14C Sehr kleiner Kern mit 6 Protonen und 8 Neutronen. 2 Schalen Innere Schale: 2 Elektronen, Valenzschale: 4 Elektronen Kochsalz lösen Kochsalz wird in Wasser aufgelöst, dabei kühlt sich die Lösung ab. Zeichnen Sie ein Teilchenmodell für diesen Vorgang und das passende Energiediagramm. Festes Kochsalz: Teilchen nahe beieinander und hochgeordnet. Gelöstes Kochsalz: Teilchen sehr gut im Wasser verteilt (keines kommt dem anderen mehr nahe), dessen Teilchen als Flüssigkeit zwar noch Anziehungskräfte hat, aber nicht mehr so viele, dass sie geordnet wären. Es hat viel mehr Wasserteilchen als Salzteilchen, sonst kann sich nicht alles lösen. Da eine Temperaturerniedrigung messbar ist, wissen wir, dass dieser Vorgang endotherm ist. Das passende Diagramm: Quelle: http://w-hoelzel.de/extern/chemie/Neigungskurs12-13/chemie_neigungskurs_inhalt.html Chemische Formeln 1.5 g Magnesium werden verbrannt. Ein helles Leuchten begleitet die Reaktion und es entstehen 2.5 g eines weissen Pulvers. Zeichnen Sie das passende Energiediagramm und stellen Sie die zugehörige Reaktionsgleichung auf, indem Sie jeden Ihrer Schritte kommentieren und begründen. Exotherme Reaktion, da Energie in Form von Licht und Wärme frei wird. Energiediagramm siehe Aufgabe Energieumsatz. Magnesium + Sauerstoff Magnesiumoxid 1.5 g 2.5 g : daraus ergibt sich, dass 1 g Sauerstoff reagiert. Die Massen von Magnesium und Sauerstoff reagieren im Verhältnis 1.5:1 Das Atommassenverhältnis ist auch 1.5:1 (aus PSE 24.3:16). Damit ist das Verhältnis der Magnesium- zu Sauerstoffatomen in Magnesiumoxid 1:1. Die chemische Formel ist also MgO. Damit lässt sich die Reaktionsgleichung aufstellen: 2 Mg + O2 2 MgO