Planung der 1
Werbung

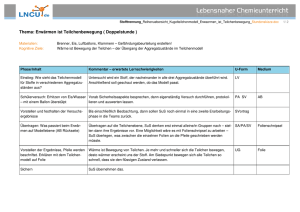
22.UE, am 12.11.14 Bei allen chemischen Reaktionen ist Energie beteiligt! Entweder wird Energie frei (Wärme, Licht, Elektrizität) oder es entstehen energiereiche Substanzen (innere Energie), z.B. Wasserstoff. Energiediagramme erklären blauer Pfeil nach oben: endotherme Reaktion zu einem energiereicheren Produkt. roter Pfeil nach unten: exotherme Reaktion zu einem energieärmeren Produkt. Dazu passt der Versuch „Kupfersulfathydrat“: Versuchsbeschreibung: Kupfersulfathydrat (blau) wird über der Flamme „geröstet“, d.h. das Wasser verdunstet aus der Verbindung – somit verschwindet auch die blaue Farbe. Energetisch gesehen besitzt das entstandene Kupfersulfat mehr Energie, denn bei der Reaktion von Kupfersulfat mit H2O entsteht unter exothermer Reaktion (Thermometer ~40°C) wieder blaues Kupfersulfathydrat. Lehrsatz: Die bei der Bildung einer bestimmten Portion einer Verbindung aus den Elementen frei werdende Energie muss bei der Zerlegung dieser Verbindungsportion in die Elemente wieder aufgewendet werden. „stabil“ werden Verbindungen bezeichnet, bei deren Bildung aus den Elementen besonders viel Energie freigesetzt wird. Die Zerlegung stabiler Verbindungen in die Elemente erfordert einen hohen Energieaufwand. 1 Versuch Zinksulfid: Unter dem Abzug vermischt man Zn mit S, zeiht Handschuhe an, dann erhitzt man das Gemisch mit einer Flamme explosionsartige Reaktion. Zeichnen der Energiediagramme: - Kupfersulfid langer roter Pfeil nach unten im Energiediagramm; d.h. stark exotherme Reaktion zu energieärmeren Produkt. - Zinksulfid kurzer roter Pfeil nach unten im Energiediagramm; d.h. schwach exotherme Reaktion zu energieärmeren Produkt. Aktivierungsenergie: ist die zur Auslösung einer chemischen Reaktion erforderliche Energie. (anfängliche Energiezufuhr!) NEUES THEMA: Atome – Moleküle – Ionen Überschrift: Das Teilchenmodell 1. Alle Stoffe bestehen aus kleinsten Teilchen. Dazu gehören Atome, Ionen und Moleküle. 2. Diese Teilchen haben je nach der Temperatur eine mehr oder weniger starke Eigenbewegung. Wärmezufuhr bedeutet eine Erhöhung, Wärmeentzug eine Erniedrigung der Bewegungsenergie der Teilchen. 3. Die Bewegungsenergie der Teilchen im gasförmigen Zustand einer Substanz am größten, ebenso der mittlere Abstand der Teilchen voneinander. Mit sinkender Temperatur nimmt dieser Abstand ab. 4. Bei sehr kleinen Abständen zwischen den Teilchen wirken zwischen ihnen starke Anziehungskräfte – Kohäsionskräfte. 2 Teilchenmodell und Aggregatzustände Die Durchmischung von Stoffen infolge der Teilchenbewegung nennt man Diffusion. Im gasförmigen Zustand geschieht das schnell, in Flüssigkeiten dauert es länger, in Feststoffen ist es nicht (kaum) möglich. 3