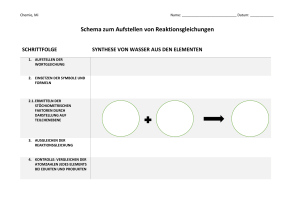
Übungsfragen zur Vorlesung "Anorganische Chemie“
Werbung

Übungsfragen zur Vorlesung "Anorganische Chemie“
SS 2007
1.
Wie kommt Stickstoff in der Natur vor? Nennen Sie fünf anorganische und drei
organische Verbindungen, in denen Stickstoff gebunden ist!
2.
Formulieren Sie für die Darstellung von Stickstoff im Labor eine Reaktionsgleichung!
3.
Beschreiben Sie das HABER-BOSCH-Verfahren (Reaktionsgleichung)!
4.
Beschreiben Sie den Bau des Ammoniakmoleküls anhand der LEWIS-Formel! Welche
Struktur hat das Ammonium-Ion? Mit welchen anderen Ionen ist es chemisch ähnlich
und warum?
5.
Formulieren Sie die Gleichungen zur Herstellung folgender Düngemittel:
a) Ammoniumnitrat (Was ist Kalkammonsalpeter) ?
b) Ammoniumsulfat !
6.
Warum kann Ammoniumhydrogencarbonat als Treibmittel verwendet werden?
(Gleichung angeben)!
7.
Formulieren Sie die Reaktionsgleichung für die photometrische Kupfer-Bestimmung mit
Ammoniak!
8.
Erläutern Sie anhand von Gleichungen die chemischen Grundlagen der
Harnstoffsynthese.
9.
Geben Sie die Reaktionsgleichungen an:
a) für den explosionsartigen Zerfall von Hydrazin in der Wärme
b) für die Reduktion von Silber-Ionen mit Hydrazin!
10.
Beschreiben Sie den Bau des N2O- Moleküls anhand einer LEWIS-Formel! Warum ist
es isoelektronisch mit Kohlendioxid?
11.
Formulieren Sie die Reaktionsgleichungen
a) für die Bildung von NO bei hohen Temperaturen, z. B. im Ottomotor
b) für die katalytische Oxidation von Ammoniak (OSTWALD-Verfahren)
c) für den Nachweis von NO mit Eisen(II)-sulfat-Lösung!
12.
Nennen Sie zwei Hauptschadstoffe, die bei der unvollständigen Verbrennung bzw. bei
hohen Temperaturen im Verbrennungsmotor entstehen! Geben Sie 4 Gleichungen an,
die ihre Beseitigung durch Oxidation an einem Katalysator beschreiben! Warum wird
dem Katalysator eine Sonde vorgeschaltet?
13.
Ein Standzylinder mit NO und ein Standzylinder mit O2 (der außerdem etwas Wasser
enthält) werden zusammengeführt. Anschließend werden einige Tropfen Methylrot
zugegeben. Erklären Sie die Farb- und Druckeffekte (zwei Gleichungen)!
14.
Begründen Sie anhand einer LEWIS-Formel die Neigung der Azide explosionsartig zu
zerfallen! Geben Sie eine entsprechende Reaktionsgleichung als Beispiel an!
15.
Salpetrige Säure existiert nur im stark verdünnten Zustand und in der Kälte. Es
disproportioniert zu Salpetersäure und Stickstoffmonoxid. Geben Sie dafür die
entsprechende Gleichung an!
16.
Formulieren Sie die Reaktionsgleichungen
a) für die Oxidation von Iodid mit Nitrit (Braun/Violett-Färbung)
b) für die Reduktion von Permanganat mit Nitrit (Entfärbung)!
17.
Was ist Nitritpökelsalz? Wozu dient es?
18.
Formulieren Sie die Reaktionsgleichungen für das Auflösen von Kupfer in
konzentrierter Salpetersäure! (Warum reagiert verdünnte Salpetersäure nicht?)!
19.
Was ist Scheidewasser und was ist Königswasser? Wozu werden diese Lösungen
verwendet ? Formulieren Sie zwei Reaktionsgleichungen, aus denen die Wirkung von
Königswasser hervorgeht!
20.
Formulieren Sie die Reaktionsgleichungen
a) für den thermischen Zerfall von Kaliumnitrat
b) für den Nachweis von HNO3 mit der Ringprobe!
21.
Welche allotropen Modifikationen des Phosphors gibt es ? Ordnen Sie diese nach der
thermodynamischen Stabilität! Beschreiben Sie die Struktur des weißen Phosphors !
Inwiefern unterscheidet er sich strukturell von den anderen Modifikationen.
In welcher Eigenschaft spiegelt sich diese Besonderheit wider?
22.
Was sind "Irrlichter"? Wie entstehen sie (Gleichung angeben!)?
23.
Wieso existiert PCl5, NH5 dagegen nicht ? Wie können PCl3 und PCl5 dargestellt
werden?
24.
Phosphorpentachlorid existiert in verschiedenen Bindungsisomeren. Geben Sie die
Strukturen der entsprechenden Isomeren an!
25.
Wie entsteht Phosphor(III)-oxid und wie entsteht Phosphor(V)-oxid (Gleichungen
angeben!)? Vergleichen Sie die Giftigkeit und den Energieinhalt beider Verbindungen! Skizzieren Sie die Struktur beider Oxide!
26.
Wofür kann P4O10 verwendet werden? Geben Sie zwei Gleichungen an, die die
entsprechenden Reaktionen beschreiben!
27.
Was versteht man unter primären, sekundären bzw. tertiären Phosphaten ? Vergleichen
Sie die Löslichkeit dieser Verbindungen! Nennen Sie für jede Verbindungsklasse eine
typische Eigenschaft und je eine entsprechende Verwendungsmöglichkeit!
28.
Berechnen Sie die pH-Werte folgender Lösungen, wenn die Stoffmengenkonzentration
0,5 mol/l beträgt
a) (ortho)Phosphorsäure
b) Natriumdihydrogenphosphat
c) Dinatriumhydrogenphosphat
d) Natriumphosphat
pKS1 = 2;
pKS2 = 7;
pKS3 = 12;
29.
Was ist Superphosphat und was ist Doppelsuperphosphat? Wie werden diese
Düngemittel hergestellt (Gleichungen angeben!)?
30.
Formulieren Sie die Reaktionsgleichungen für die Bildung von Diphosphorsäure,
Triphosphorsäure und Trimetaphosphorsäure!
31.
Warum ist die Verwendung von Phosphaten in Waschmitteln aus ökologischer Sicht
bedenklich?
32.
Geben Sie die Strukturformel von ATP an! Welche herausragende Bedeutung besitzt
es im Stoffwechsel?
33.
Nennen Sie drei Stoffgruppen, in denen Arsen, Antimon und Bismut in der Natur
vorkommen und je ein Beispiel (Name und Formel)!
34.
Beschreiben Sie die Marsh'sche Probe anhand der Reaktionsgleichungen! Wie kann
man As und Sb unterscheiden (Gleichung angeben!)?
35.
Welche Tendenz gibt es innerhalb der V. Hauptgruppe hinsichtlich der Stabilität der
Oxidationsstufe +III? Nennen Sie eine Eigenschaft, bei dem dieser Sachverhalt
deutlich wird!
36.
Beim Verdünnen einer BiCl3-Lösung fällt ein weißer Niederschlag aus. Bei
Säurezusatz löst er sich wieder auf. Erklären Sie diese Beobachtungen mit Hilfe der
Reaktionsgleichung!
37.
Beschreiben Sie die Struktur und die Bindungsverhältnisse im Diamant und im
Graphit (KOZ, Geometrie, Bindungslängen und -winkel im Vergleich, Hybridisierung,
Art der Bindung)! Welche Eigenschaften und Anwendungen ergeben sich daraus?
38.
Welche Gruppen von Carbiden gibt es ? Nennen Sie je eine Verbindung als Beispiel
(Name und Formel)!
39.
Wie wird SiC hergestellt (Gleichung angeben!)? Nennen Sie zwei
Verwendungsmöglichkeiten!
40.
Wie kann CaC2 hergestellt werden (Gleichung angeben!)? Wofür wird es verwendet
(für eine Verwendungsmöglichkeit die entsprechenden Gleichungen angeben!)?
41.
Nennen Sie je drei Eigenschaften und zwei Verwendungsmöglichkeiten für CCl4 und
CS2!
42.
Geben Sie die LEWIS-Formel von CO an! Formulieren Sie die Reaktionsgleichung
für die Darstellung von CO im Labor!
43.
Was versteht man unter dem Boudouard-Gleichgewicht? Wie wirken sich Temperatur
und Druck auf die Lage des Gleichgewichts aus? Begründen Sie den Einfluss!
44.
Nennen Sie vier Eigenschaften von Kohlenmonoxid! Worauf beruht die hohe
Toxizität? Welche Gegenmaßnahmen sind bei CO-Vergiftungen notwendig?
45.
Formulieren Sie die Reaktionsgleichungen für die Herstellung von
a) Generatorgas
b) Wassergas (Synthesegas )!
46.
Wie kann Kohlendioxid im Labor hergestellt und nachgewiesen werden? Was
geschieht, wenn CO2 im Überschuss eingeleitet wird?
Hinweis: drei Gleichungen erforderlich
47.
Was versteht man unter temporärer Härte? Wie bildet sich Kesselstein (Gleichung
angeben!)?
48.
Was versteht man unter dem natürlichen und dem anthropogenen Treibhauseffekt?
Wie kommt er zustande und was sind die Folgen?
49.
Welche Vorgänge sind notwendig, um aus Siliciumdioxid monokristallines ReinstSilicium herzustellen (5 Stufen, 3 Gleichungen angeben!)?
50.
Was sind Silane? Wie entsteht Monosilan und wie reagiert es
a) mit Sauerstoff
b) mit Wasser?
(insgesamt drei Gleichungen)!
51.
Was sind Silicate?
52.
Nennen Sie je zwei Beispiele für Gerüst- und Schichtsilikate!
53.
54.
Was sind Zeolithe? Wozu werden sie verwendet?
Erklären Sie Eigenschaften von Quarz- und Laborglas. Wodurch unterscheiden sich
beide?
55.
Geben Sie eine Reaktionsgleichung zur Gewinnung von Zinn an!
56.
Erläutern Sie anhand von 2 Reaktionsgleichungen die Darstellung von Blei!
57.
Beschreiben Sie mit Hilfe von 2 Reaktionsgleichungen die Säure-Base-Amphoterie
von Zinnhydroxid!
58.
Welche chemischen Reaktionen laufen im Bleiakkumulator bei der Entladung und
Ladung ab? (Reaktionsgleichungen)!
59.
Formulieren Sie für den Freiberger Aufschluss die Reaktionsgleichungen!
60.
Welche Struktur hat Borsäure?
61.
Worauf beruht die saure Wirkung der Borsäure in Wasser? (auch Reaktionsgleichung)
62.
Wie kann man Borate nachweisen?
63.
Wie wirkt Natriumperborat bleichend?
64.
Warum sind Borhalogenide und andere Borverbindungen Lewis-Säuren? Erklärung
am Beispiel von Bortriflurid.
65.
Beschreiben Sie mit Hilfe einer Reaktionsgleichung die Boraxperle als Vorprobe auf
Schwermetallsalze.
66.
Beschreiben Sie die Struktur und die Bindungen im Diboran.
67.
Umschreiben Sie das amphortere Säure-Base-Verhalten von Aluminumhydroxid mit
zwei Reaktionsgleichungen!
68.
Wie erhält man γ-Al2O3 und welche Eigenschaften hat es?
69.
Wie erhält man Thénards Blau? (Reaktionsgleichung)
70.
Erklären Sie den Goldschmidt-Versuch! ( Reaktionsgleichung, Bildungsenthalpie)
71.
Wie wird Aluminiumsulfat hergestellt?
72.
Erklären Sie die saure Wirkung von Aluminiumsalzen mit Hilfe einer
Reaktionsgleichung!
73.
Wie wird wasserfreies Aluminiumchlorid hergestellt?
74.
Welche Eigenschaften machen Aluminium zum wichtigsten Gebrauchsmetall nach
Eisen?
75.
Was ist eloxiertes Aluminium?
76.
Beschreiben Sie das Bayer-Verfahren (5 Reaktionsgleichungen)!
77.
Unter welchen Bedingungen wird die Schmelzflusselektrolyse von Al2O3
durchgeführt?
78.
Geben Sie die Formeln für folgende Mineralien an: Beryll, Dolomit, Magnesit, Calcit,
Gips, Anhydrit, Flussspat, Schwerspat!
79.
Warum dürfen Magnesiumbrände nicht mit Wasser gelöscht werden (Gleichung
angeben )?
80.
Erläutern Sie den Sulfatnachweis mit Ba2+-Ionen!
81.
Wie wird Bariumoxid technisch hergestellt?
82.
Geben Sie die entsprechenden Reaktionsgleichungen an!
a) Kalkbrennen
b) Kalklöschen
c) Abbinden des Mörtels
83.
Was ist gebrannter Gips?
84.
Formulieren Sie eine Darstellungsmöglichkeit für eine Grignardverbindung!
85.
Welche Masse an Magnesiumcarbonat wird zur Herstellung von 50 kg Sintermagnesia
benötigt?
86.
Auf welche Ionen ist die Wasserhärte zurückzuführen? Was versteht man unter
temporärer und was unter permanenter Härte?
87.
Formulieren Sie die chemische Reaktionsgleichung für das Kalkgleichgewicht!
88.
Wie wird Wasser enthärtet?
89.
Wie reagiert Lithium mit Wasser?
90.
Wie reagieren die Alkalimetalle mit dem Sauerstoff der Luft (Reaktionsgleichungen)?
91.
Beschreiben Sie das Solvay-Verfahren mit Reaktionsgleichungen!
92.
Warum reagiert Soda in Wasser basisch?
93.
Warum sind die Alkalimetallhydroxide die stärksten Basen?
94.
Warum sind Edelgase chemisch sehr inaktiv?
95.
Wo werden Edelgase verwendet?
96.
Welche Edelgasverbindungen sind thermodynamisch stabil und wie werden sie
hergestellt?
97.
Erklären Sie mit Hilfe des VSEPR-Modells die Strukturen der Xenonfluoride:
XeF2, XeF4 und XeF6!
98.
Die Nebengruppen 1-4 werden abgefragt!
99.
Vergleich von Hauptgruppenmetallen und Nebengruppenelementen:
Valenzelektronenkonfigurationen
Oxidationszahlen (3d-Elemente)
100.
Geben Sie die Elektronenkonfiguration für folgende Nebengruppenelemente an:
Cr , Mn, Cu, Mo, Ag und Au
101.
Welche Gemeinsamkeiten und welche Unterschiede bestehen zwischen den Metallen
der 1. HG und der 1. NG?
102.
Nennen Sie die wichtigsten Oxidationsstufen der Metalle der 1. NG!
103.
Erläutern Sie den Begriff „Zementation“ am Beispiel der Kupferabscheidung mit
Eisen!
104.
Warum eignet sich Kupfersulfat als Nachweismittel für Wasserspuren?
105.
Erläutern Sie den Glucosenachweis mit Fehling’scher Lösung!
106.
Wie weist man Cd2+-Ionen neben Cu2+-Ionen nach?
107.
Erläutern Sie die iodometrische Kupferbestimmung!
108.
Formulieren Sie die Reaktionsgleichung für das Auflösen von Silber in Salpetersäure!
109.
Welche Reaktionen laufen beim Versetzen einer Ag+ - Ionen -Lösung mit einer NH3Lösung ab?
110.
Wie wird AgNO3 dargestellt?
111.
Warum kann AgI mit CN-Ionen gelöst werden?
112.
Beschreiben Sie die Schwarz-Weiß-Silberfotografie mit Hilfe von vier
Reaktionsgleichungen!
113.
Wozu dient Tollenz-Reagenz?
114.
Bei der Cyanidlaugerei geht Gold in Lösung. Das Redoxpotential E des Redoxpaares
Au/Au+ beträgt 0,20 V {E° (Au/Au+) = 1,69 V}.
Wie groß ist die Konzentration der Au+ -Ionen in der CN- -Lösung?
115.
Warum kann man mit Salpetersäure Silber von Gold trennen?
116.
Warum löst sich Gold in Königswasser (2 Reaktionsgleichungen und kurze
Erläuterung)?
117.
Nennen sie einen empfindlichen analytischen Nachweis für Au3+-Ionen
(Reaktionsgleichung)!
118.
Die Metalle der 2. Nebengruppe sind wichtige Schwermetalle. Geben sie einen
Überblick über einige physikalische und chemische Eigenschaften {Schmelzpunkte,
unedel oder edel (Redoxpotentiale), Verhalten an der Luft, bevorzugte
Oxidationsstufen, Radien der wichtigsten Ionen, Neigung zur Komplexbildung
(häufigste Koordinationszahlen), Art der Bindung in Salzen MX2, zu erwartende
Farbigkeit der Verbindungen}.
119.
Wie wird Zink aus Zinkerzen gewonnen (mindestens zwei Reaktionsgleichungen)?
120.
Im Labor kann Wasserstoff durch die Reaktion von Zinkgranalien mit verd. Salzsäure
gewonnen werden. Warum verstärken wenige Tropfen CuSO4 -Lösung die
Wasserstoffentwicklung?
121.
Zink löst sich auch in starken Basen. Formulieren Sie die Reaktionsgleichung!
122.
Zinkhydroxid ist amphoter.
Reaktionsgleichungen!
Begründen
Sie
diese
Aussage
mit
zwei
123.
Welche Reaktionen laufen beim Versetzen einer Zn2+-Lösung mit einer NH3-Lösung
nacheinander ab (Reaktionsgleichung)?
124.
Wie wird Zinkoxid in der Technik hergestellt (Reaktionsgleichung)?
125.
Wie werden Zn2+-Ionen nachgewiesen (Reaktionsgleichung)?
126.
Welche drei Leuchtstoffe befinden sich auf den Farbfernsehbildschirmen?
127.
Synthetisieren Sie wasserfreies Zinkchlorid (3 Reaktionsgleichungen)!
128.
Welche Reaktionen laufen in einer Zink-Mangan-Zelle bei Stromentnahme ab (2
Reaktionsgleichungen)?
129.
Eisen kann durch eine Zinkschicht vor Korrosion geschützt werden. Was passiert,
wenn die Zinkschicht zerstört wird?
130.
Wie werden Cd2+-Ionen nachgewiesen?
131.
Welche Reaktionen laufen bei der Stromentnahme und beim Laden in einem Ni-CdAkkumulator ab?
132.
Vervollständigen Sie folgende Gleichungen:
Hg2+ + 2 OH- →
Hg2+ + 4 I-
→
133.
Wie reagiert Nesslers Reagenz mit Ammoniak (Reaktionsgleichung)?
134.
Wie werden Quecksilber(II)-und Quecksilber(I)-Verbindungen nachgewiesen (zwei
Reaktionsgleichungen)?
135.
Warum nennt man Quecksilber(I)-chlorid Kalomel?
136.
Was sind Amalgame?
137.
Worauf beruht die Giftigkeit von Hg-Verbindungen?
138.
Vergleichen Sie die Elemente der Eisengruppe hinsichtlich Elektronenkonfiguration,
Normalpotentialen (M/M2+ sowie M2+/M3+) und stabilen Oxidationsstufen!
139.
Berechnen Sie das Redoxpotential für das Redoxpaar Fe2+/Fe3+ bei pH=14!
140.
Vervollständigen Sie folgende Reaktionsgleichungen:
Fe(OH)2 + NO3-
+ H2O
Fe2+
+ NO3-
+ H+
Fe3+
+ HSO3- + H2O
141.
Wie werden Eisen(II)- und Eisen(III)-Ionen nachgewiesen?
142.
Erläutern Sie das d-Auspaltungsdiagramm und seine Besetzung im oktaedrischen
Fe(III)-Komplex (d5-Fall) im starken und schwachen Ligandenfeld! Nennen Sie die
Zahl der ungepaarten Elektronen und schließen Sie auf das magnetische Verhalten!
143.
Erläutern Sie die technische Eisenherstellung (Hochofenprozeß)!
144.
Vergleichen Sie die Stabilität von Cobalt(II)- und Cobalt(III)-Komplexen mit Hilfe der
Ligandenfeldtheorie!
145.
Erläutern Sie die Nickelbestimmung mit Diacetylglyoxim!