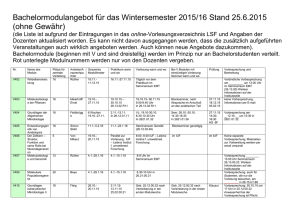
Ablaufplan des Moduls Genetik 2
Werbung
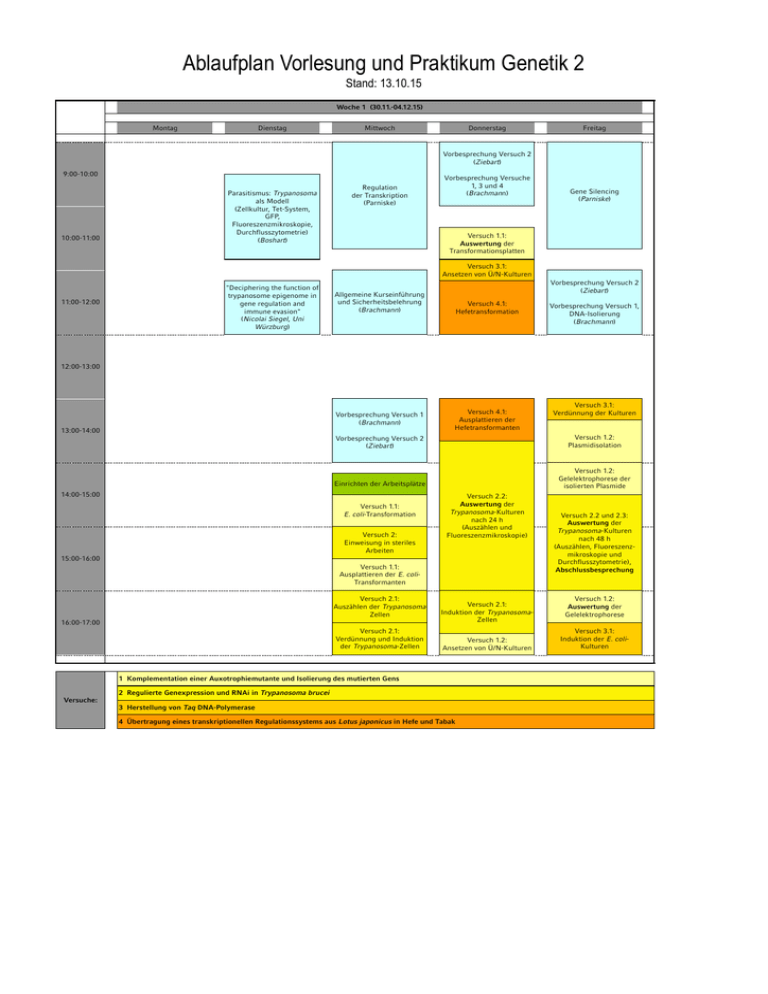
Ablaufplan Vorlesung und Praktikum Genetik 2 Stand: 13.10.15 Woche 1 (30.11.-04.12.15) Montag Dienstag Mittwoch Donnerstag Freitag Vorbesprechung Versuch 2 (Ziebart) 9:00-10:00 10:00-11:00 Parasitismus: Trypanosoma als Modell (Zellkultur, Tet-System, GFP, Fluoreszenzmikroskopie, Durchflusszytometrie) (Boshart) Regulation der Transkription (Parniske) Vorbesprechung Versuche 1, 3 und 4 (Brachmann) Gene Silencing (Parniske) Versuch 1.1: Auswertung der Transformationsplatten Versuch 3.1: Ansetzen von Ü/N-Kulturen 11:00-12:00 "Deciphering the function of trypanosome epigenome in gene regulation and immune evasion" (Nicolai Siegel, Uni Würzburg) Vorbesprechung Versuch 2 (Ziebart) Allgemeine Kurseinführung und Sicherheitsbelehrung (Brachmann) Versuch 4.1: Hefetransformation Vorbesprechung Versuch 1, DNA-Isolierung (Brachmann) 12:00-13:00 Vorbesprechung Versuch 1 (Brachmann) 13:00-14:00 Versuch 4.1: Ausplattieren der Hefetransformanten Versuch 3.1: Verdünnung der Kulturen Vorbesprechung Versuch 2 (Ziebart) Versuch 1.2: Plasmidisolation Einrichten der Arbeitsplätze Versuch 1.2: Gelelektrophorese der isolierten Plasmide 14:00-15:00 Versuch 1.1: E. coli-Transformation Versuch 2: Einweisung in steriles Arbeiten Versuch 2.2: Auswertung der Trypanosoma-Kulturen nach 24 h (Auszählen und Fluoreszenzmikroskopie) 15:00-16:00 Versuch 1.1: Ausplattieren der E. coliTransformanten Versuch 2.1: Auszählen der TrypanosomaZellen 16:00-17:00 Versuch 2.1: Verdünnung und Induktion der Trypanosoma-Zellen Versuch 2.1: Induktion der TrypanosomaZellen Versuch 1.2: Ansetzen von Ü/N-Kulturen 1 Komplementation einer Auxotrophiemutante und Isolierung des mutierten Gens 2 Regulierte Genexpression und RNAi in Trypanosoma brucei Versuche: 3 Herstellung von Taq DNA-Polymerase 4 Übertragung eines transkriptionellen Regulationssystems aus Lotus japonicus in Hefe und Tabak Versuch 2.2 und 2.3: Auswertung der Trypanosoma-Kulturen nach 48 h (Auszählen, Fluoreszenzmikroskopie und Durchflusszytometrie), Abschlussbesprechung Versuch 1.2: Auswertung der Gelelektrophorese Versuch 3.1: Induktion der E. coliKulturen Ablaufplan Vorlesung und Praktikum Genetik 2 Stand: 13.10.15 Woche 2 (07.-11.12.15) Montag Dienstag Mittwoch Donnerstag Freitag Splicing (Parniske) Chromatin Restructuring (Parniske) Transcription Factors (Parniske) 9:00-10:00 10:00-11:00 Vorbesprechung Versuch 3 (Ott) 11:00-12:00 Vorbesprechung Versuch 1 (Brachmann) Vorbesprechung Versuch 3 (Ott) Vorbesprechung Versuch 1 Restriktionsanalyse (Brachmann) DNA-Sequenzierung und Sequenzanalyse (Brachmann) 12:00-13:00 13:00-14:00 Versuch 3.1: Zellaufschluß Versuch 1.3: Ansetzen von Restriktionsreaktionen Versuch 1.3: Gelelektrophorese der Restriktionsansätze Versuch 3.2: Gelelektrophorese der TestPCR Versuch 3.1: SDSPAGE der Proteinfraktionen Versuch 1.3 und 1.4: Auswertung der Restriktionsansätze und der Sequenzierungsreaktionen; Bestimmung der potentiell mutierten Gene 14:00-15:00 Versuch 1.4: Ansetzen von Sequenzierungsreaktionen Versuch 3.2: Test-PCR zur Bestimmung der Polymeraseaktivität Versuch 4.1: Vereinzelungsausstriche der Hefetransformanten 15:00-16:00 Versuch 3.1: Aufreinigung von Taq DNAPolymerase und Dialyse Versuch 1.3: Auswertung der Gelelektrophorese Versuch 3.1 und 3.2: Auswertung der Gelelektrophoresen; Bestimmung der spezifischen Aktivität der Taq-Polymerase; Abschlussbesprechung 16:00-17:00 Versuch 3.1: Coomassiefärbung der SDSGele Versuch 1.5: Amplifikation von Genen 1 Komplementation einer Auxotrophiemutante und Isolierung des mutierten Gens 2 Regulierte Genexpression und RNAi in Trypanosoma brucei Versuche: 3 Herstellung von Taq DNA-Polymerase 4 Übertragung eines transkriptionellen Regulationssystems aus Lotus japonicus in Hefe und Tabak PCRE. coli- Ablaufplan Vorlesung und Praktikum Genetik 2 Stand: 13.10.15 Woche 3 (14.-18.12.15) Montag Dienstag Mittwoch Donnerstag Praktikumsvorbesprechung (Katzer) Praktikumsvorbesprechung (Katzer) Versuch 4.1: OD600-Messung und Überimpfen der Hefekulturen Versuch 4.2: Ansetzen der Färbung zur Bestimmung der β-Glucuronidaseaktivität Tutorium zum Praktikum (Brachmann) Tutorium zum Praktikum (Brachmann) Freitag 9:00-10:00 Tutorium zur Vorlesung (Parniske) Symbiose (Parniske) 10:00-11:00 11:00-12:00 Praktikumsvorbesprechung (Katzer) 12:00-13:00 Versuch 4.2: Ernte der Agrobakterienkulturen 13:00-14:00 Versuch 1.5: Aufreinigung der PCRProdukte CRISPR/Cas und Gentechnologie (Parniske) Versuch 1.5: Gelelektrophorese der PCRProdukte Versuch 1.6: Auswertung der Sequenzierungsreaktionen, Abschlussbesprechung Kursraum aufräumen 14:00-15:00 Versuch 4.2: Transformation von Tabakpflanzen 15:00-16:00 Versuch 1.5: Auswertung der Gelelektrophorese Versuch 4.1: Bestimmung und Auswertung der βGalaktosidaseaktivität Versuch 1.6: Ansetzen von Sequenzierungsreaktionen Gemeinsame Abschlussbesprechung 16:00-17:00 Versuch 4.1: Ansetzen von Übernachtkulturen Versuch 4.2: Bestimmung der βGlucuronidaseaktivität; Auswertung und Abschlussbesprechung Zeit für Dokumentation, Auswertung, Fragen, etc. 1 Komplementation einer Auxotrophiemutante und Isolierung des mutierten Gens 2 Regulierte Genexpression und RNAi in Trypanosoma brucei Versuche: 3 Herstellung von Taq DNA-Polymerase 4 Übertragung eines transkriptionellen Regulationssystems aus Lotus japonicus in Hefe und Tabak "CRISPR/Cas-assisted genome engineering: strategies and apllications" (Sebastian Bultmann, AG Leonhardt)