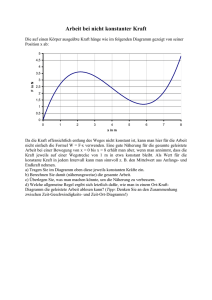
T4p: Thermodynamik und Statistische Physik Prof. Dr. H. Ruhl
Werbung
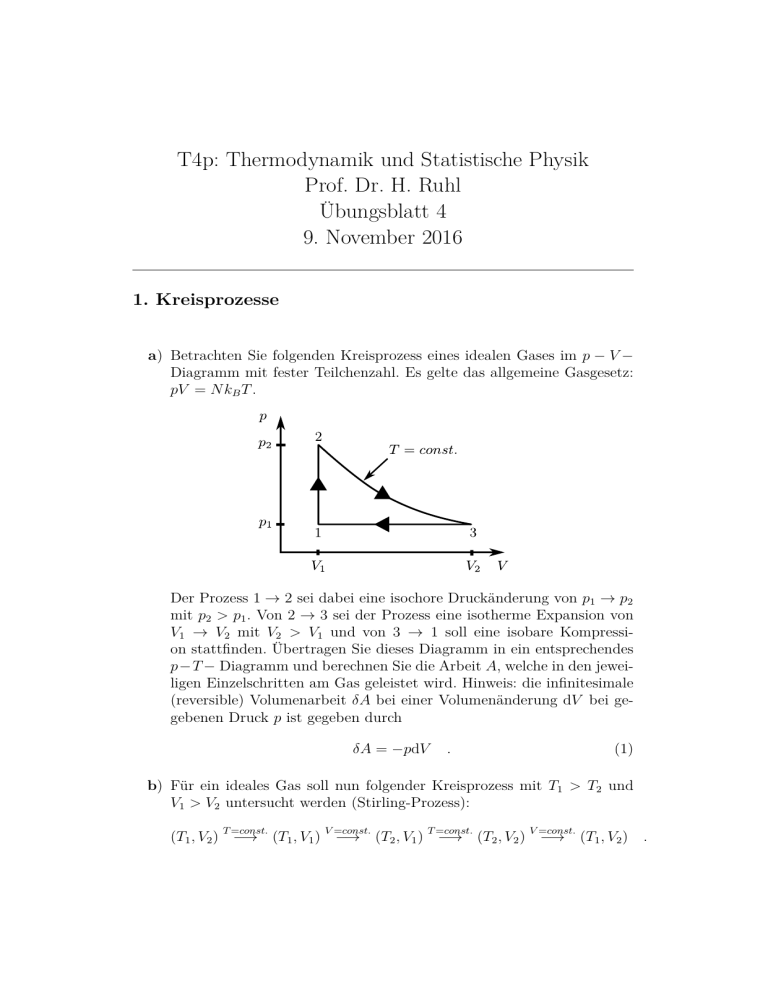
T4p: Thermodynamik und Statistische Physik Prof. Dr. H. Ruhl Übungsblatt 4 9. November 2016 1. Kreisprozesse a) Betrachten Sie folgenden Kreisprozess eines idealen Gases im p − V − Diagramm mit fester Teilchenzahl. Es gelte das allgemeine Gasgesetz: pV = N kB T . Der Prozess 1 → 2 sei dabei eine isochore Druckänderung von p1 → p2 mit p2 > p1 . Von 2 → 3 sei der Prozess eine isotherme Expansion von V1 → V2 mit V2 > V1 und von 3 → 1 soll eine isobare Kompression stattfinden. Übertragen Sie dieses Diagramm in ein entsprechendes p−T − Diagramm und berechnen Sie die Arbeit A, welche in den jeweiligen Einzelschritten am Gas geleistet wird. Hinweis: die infinitesimale (reversible) Volumenarbeit δA bei einer Volumenänderung dV bei gegebenen Druck p ist gegeben durch δA = −pdV . (1) b) Für ein ideales Gas soll nun folgender Kreisprozess mit T1 > T2 und V1 > V2 untersucht werden (Stirling-Prozess): T =const. V =const. T =const. V =const. (T1 , V2 ) −→ (T1 , V1 ) −→ (T2 , V1 ) −→ (T2 , V2 ) −→ (T1 , V2 ) . • Zeichnen sie für diesen Kreisprozess jeweils das entsprechende T − V − Diagramm und das entsprechende p − V − Diagramm. • Berechnen Sie die Arbeit, die das Gas in jedem Zyklus verrichtet. • Der erste Hauptsatz der Thermodynamik besagt, dass sich der Energieinhalt eines Körpers aus der Summe der an ihm geleisteten Arbeit und der ihm zugeführten Wärmemenge zusammensetzt: dE = δQ + δA . (2) Für den betrachteten Kreisprozess wird in jedem der vier Schritte Wärme abgegeben oder aufgenommen. Berechnen Sie jeweils die Wärmemenge und überlegen Sie, wann Wärme zugeführt und wann Wärme abgegeben wird. Hinweis: Nehmen Sie an, dass Wärmekapazität bei konstantem Volumen, CV = ∂E ∂T ! , (3) V über den zu integrierenden Temperaturbereich konstant und gegeben sei. 2. Van-der-Waals-Gas Wie wir bereits hatten, ist die Zustandsgleichung für ein ideales Gas gegeben durch: pv = kB T , (4) wobei wir v := V /N als Volumen pro Teilchen definiert haben. Für stark verdünnte Gase stellt diese Gleichung eine gute Näherung an das Verhalten realer Gase dar. Wird jedoch die Dichte des Gases größer, wird die Gleichung ungültig und man muss berücksichtigen, dass die Moleküle ein Eigenvolumen aufweisen und die Teilchen auch miteinander wechselwirken. Um das Eigenvolumen zu berücksichtigen, führt man ein (für jedes Gas unterschiedliches und empirisch zu bestimmendes) Eigenvolumen b in (4) ein: v →v−b . (5) Um die gegenseitige Wechselwirkung zu berücksichtigen, geht man davon aus, dass der effektive Druck als Korrektur zum allgemeinen Gasgesetz geschrieben werden kann: a preal = pideal − 2 . (6) v Hierbei ist a wieder ein phänomenologischer Parameter, der von Gas zu Gas verschieden ist. Damit ergibt sich die Zustandsgleichung des van-der-WaalsGases zu: f (p, v, T ) = p − a kB T + 2 =0 . v−b v (7) Überprüfen Sie die Identität ! ∂x ∂y z ! ! ∂y ∂z = −1 ∂z x ∂x y (8) von Blatt 2 mit x = p, y = T und z = v anhand des van-der-Waals-Gases. benötigen. Dafür ist es vermutlich Hinweis: Sie werden die Ableitung ∂v ∂p T am einfachsten, ∂f (p, v, T ) ∂p zu berechnen. ! (9) T