2 Zytoplasma - 2 -- 02-04
Werbung

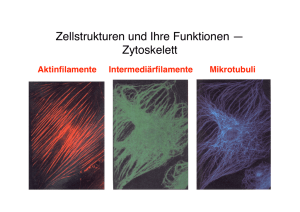
Zytologische Grundlagen der FEM-Modellierung 2 Zytologische Grundlagen der FEM Modellierung Lebende Zellen sind hochorganisierte dynamische Einheiten, in denen wichtige zelluläre Makromoleküle spontan zu komplexen Proteinstrukturen aggregieren und wieder dissoziieren können [12]. Dabei kommt es zu häufigen lokalen Änderungen des Aggregatzustandes. Die geschilderten Tatsachen führen zu, in den klassischen Ingenieurwissenschaften wenig bekannten, biologischen Materialeigenschaften. Abbildung 2-1 enthält die 3D-Computerrekonstruktion einer Lungenepitelzelle. Die Abbildung zeigt den Zellkern (blau), Zytoplasma (hellblau), die Plasmamembranen (schwarz), Zellorganellen (grün) und Erythrozyten (rot). Im Allgemeinen haben Eukariontenzellen folgende Organellen: Endosplasmatisches Retikulum Golgi-Apparat Mitochondrien Lyosomen Peroxisomen Zellkern Die Organellen nehmen ca. 50% des Zellvolumens ein. Die restlichen 50% des Zellvolumens bilden das Zytosol. Die wichtigsten Proteinsynthese-Prozesse finden im Zytosol statt. Eukariontenzellen bestehen zu 70% aus Wasser, zu 18% aus Proteinstrukturen, zu 3% aus Pospholipiden. Die Zelltrockenmasse besteht zu mehr als 50% aus Protein. Proteine sind aus einer Vielfalt unterschiedlicher Aminosäuren aufgebaut. Der Zellkern ist das ausgeprägteste Organ der Zelle. Er enthält das von einer Lipiddoppelschicht eingeschlossene Kernplasma und einen oder mehrere Nucleoli. Das Kernplasma besteht aus dem Kernfasernetzwerk und der Kernflüs- Seite 2 - 1 Zytologische Grundlagen der FEM-Modellierung sigkeit. Die Kernfaserschicht ist wahrscheinlich mit in der inneren Kernmembran eingebetteten Verbindungsproteinen verankert und trägt entscheidend zu der Kernform und der Kernsteifigkeit bei. Die Kernhülle ist eine ca. 40 nm dicke Doppelschichtmembran. Der Stoffwechsel zwischen Zytoplasma und Kernplasma erfolgt über Poren in der Kernmembran. Der mittlere Durchmesser der Kernmembranporen beträgt ca. 100 nm. Im Bereich der Kernmembranporen sind die beiden Doppelschichtmembranen durch verstärkende Membranproteine miteinander verbunden. Wesentlichen Einfluß auf die Zellsteifigkeit hat die Form und Steifigkeit des Zellkerns. Die Kernsteifigkeit wird von dem Kerngerüst und der doppelschichtigen Kernmembran bestimmt. Dabei spielen die vielen Porenverstärkungen in der Kernmembran und das Netzwerk der Lamina eine entscheidende Rolle. Bei vielen Eukariontenzellen hat die Kernfaserschicht eine mittlere Dicke von 20 bis 40 nm. Das Chromatin säumt die Innenseite der inneren Membrandoppelschicht. Dem Kernfasernetzwerk wird eine ordnende Rolle bei der Positionierung und Formgebung der Chromosomen zugesprochen [12]. Nucleoli enthalten hohe Mengen an Proteinen und RNA. Sie werden nicht von einer Membran begrenzt. Im Nucleolus lassen sich drei Regionen definieren: Lagune Pars granulosa 15 nm dicke ribosomale Vorläufer Pars fibrosa 5 nm Ribonucleoproteinfaser Die Größe des Nucleolus schwankt bei Eukariontenzellen in erheblichem Umfang und hat bei aktiven, proteinsynthetisierenden Zellen ein relatives, temporäres Maximum. Die meisten Tumorzellen weisen normalen Zellen gegenüber strukturelle und funktionelle Unterschiede auf. Es sind funktionelle Unterschiede der Plasmamembran und strukturelle Unterschiede des Zytoskelettes sowie der extrazellulären Matrix. Maligne Zellen weisen in der Regel einen verstärkten Stoffwech- Seite 2 - 2 Zytologische Grundlagen der FEM-Modellierung seltransport durch die Plasmamembran auf. In der Lipiddoppelschicht maligner Zellen kann oft eine verstärkte Blasenbindung konstatiert werden [29]. Die prägnanteste strukturelle Charakteristik maligner Zellen ist eine geänderte Organisation der zellulären und extrazellulären Filament-Aggregatanordnung. Es wird angenommen, daß durch den Verlust der mikrotubulären Kontrollmechanismen die Aggregation zytoplasmatischer und extrazellulärer Filamentstrukturen gestört ist [12]. Es kommt zu einer diffusen, wenig gebündelten Anordnung zellulärer Aktin-Filamente. Aktinfaserstränge haben eine formerhaltende und formbestimmende Rolle. Der zelluläre Kraftfluß in normalen Zellen erfolgt weitgehend über gebündelte Aktinstränge. Eine Störung der Aktinbündelung und der makromolekularen Verbindungsproteine führt zu einem Verlust der funktionellen Steifigkeit der zytoplasmatischen Skelettordnung. Von entscheidender Bedeutung für die Modellierung zellulärer Strukturen ist die Steifigkeit und Viskosität der Zelle als auch die formbestimmende Anordnung der extrazellulären Matrix. Die Zellsteifigkeit und damit die Zellform wird hauptsächlich von der Steifigkeit der Zytoskelettfilamente, ihrer Vernetzungsform und Bündelung sowie ihrer Verankerung an den Proteineinlagerungen in der Plasmamenbran bestimmt. Das Zytoplasma ist aus dem Zytoskelett und der Zellflüssigkeit aufgebaut. Es ist eine dynamische Anordnung hochorganisierter Proteinketten, in denen Zellflüssigkeit eingelagert ist. Es gibt drei wichtige zelluläre Skelettfilamente: -Mikrofilamente ( besonders Aktinfilamente ) Durchmesser ca. 7 nm -Mikrotubuli Durchmesser ca. 25 nm -Intermediärfilamente Durchmesser ca. 10 nm In Abbildung 2-2 ist die Elementdiskretisierung für das 2D-FEM Berechnungsmodell einer Lymphknoten-Metastasenzelle des Mammakarzionoms dar- Seite 2 - 3 Zytologische Grundlagen der FEM-Modellierung gestellt. Die Abbildung zeigt das Kernfilamentgerüst und das zytoplasmatische Skelett mit Mikrotubuli, Intermediärfilamenten und Aktinfilamenten. Zusätzlich zu den drei Hauptgruppen zellulärer Proteinfilamente enthalten die meisten Eukariontenzellen weitere makromolekulare Proteinstrukturen. Diese können Proteinfilamente bündeln und Verbindungen zwischen Filamentsträngen und Proteineinlagerungen in der Plasmamembran herstellen. Es gibt kontraktionsauslösende Verbindungsproteine, wie Myosin und Nicht- Muskelmyosin, gelbildende Verbindungsproteine (Filamin und Actinin), polymersisationshemmdende Proteine (Profilin), Bündelungsproteine (Fimbrin) und Fragmentierungsproteine (Villin und Gelsolin). Aktinfilamente sind in vielen zellulären Strukturen anzutreffen. Sie werden über unterschiedliche Vernetzungsproteine miteinander verbunden. Die Strukturform aktinbindender Proteine beeinflußt den Aggregationszustand des Zytoplasmas. Aktin-Filamente bestehen aus zwei, in Helix-Anordnung aneinandergekoppelte Makromoleküle globulärer Form. Die Ankopplungskräfte beruhen auf Wasserstoffbrücken und bestimmen typischen Helixanordnungen oder Faltanordnungen. So entstandene Aktinstränge können durch zusätzliche Verbindungsproteine miteinander verbunden sein. Dabei wird die Steifigkeit erheblich gesteigert. Aktinmakromoleküle haben eine durchschnittliche Länge von ca. 6 nm. Aktinstränge ordnen den zellulären und extrazellulären Kraftfluß. Die zytoplasmatische Aktinfilamentstruktur bestimmt die jeweilige zytoplasmatische Viskosität. Die dreidimensionale Anordnung zellulärer Proteinmakromoleküle werden durch nichtkovalente Wechselwirkungen der Polipeptidketten stabilisiert. Viele Proteine sind aus globulären Untereinheiten gebildet. Diese sind durch kurze Polypeptidketten miteinander verbunden. Makromolekulare Bindungskräfte halten Proteinaggregatstrukturen zusammen. Die in der Fachliteratur mehrfach zitierte Anhäufung von Aktinfilamenten im Bereich der LipiddoppelschichtInnenmembran [12 bis 20] wird durch eine entsprechende FEM-Diskretisierung der Aktinelemente (Abbildung 2-2) berücksichtigt. Seite 2 - 4 Zytologische Grundlagen der FEM-Modellierung Abbildung 2-1 3D-Computerrekonstruktion einer Lungenepitelzelle. Die Abbildung zeigt den Zellkern (blau), Zytoplasma (hellblau), die Plasmamembranen (schwarz), Zellorganellen (grün) und Erythrozyten (rot). Seite 2 - 5 Zytologische Grundlagen der FEM-Modellierung Kernfilament Zytoplasmatisches Filament Abbildung 2-2 Elementdiskretisierung für das 2D-FEM Berechnungsmodell einer LymphknotenMetastasenzelle des Mammakarzinoms. Die Abbildung zeigt das Kernfilamentgerüst und das zytoplasmatische Skelett mit Mikrotubuli, Intermediärfilamenten und Aktinfilamenten. Seite 2 - 6 Zytologische Grundlagen der FEM-Modellierung Das Ausstrecken der Mikrovilli erfolgt durch die Aggregation von AktinFilamenten. Durch den Abbau von Aktin-Filamenten kommt es zu einer Schrumpfung und Rückbildung der Mikrovilli. Mikrotubuli sind 25 nm dicke Tubulinmakromoleküle in Hohlkörperanordnung. Dabei sind Protofilamente um einen zentralen Bereich zylindrisch angeordnet. Mikrotubuli sind aus 13, zentrisch angeordneten Tubulin-Polipeptiden aufgebaut. Diese sind durch zahlreiche Zusatzproteine miteinander stabilisiert und an angrenzende Organellen Abb. 2-2.1 Zytoplasmatische Mikrotubulistruktur und Membranen gebunden. Ohne zusätzliche Vernetzungsproteine und Verankerung an angrenzende Membranen und Organellen sind Mikrotubuli biegeweiche Hohlzylinder. In Abbildung 2-3 wird die zytoplasmatische Organisation des Mikrotubuli-Netzes gezeigt. In der Interphase verlaufen Mikrotubuli zentrisch, ausgehend von dem Zellzentrum (Centriol) durch das Zytoplasma. Dabei kann eine Konzentration von Mikrotubuli um den Zellkern herum beobachtet werden. Es ist wahrscheinlich, daß Mikrotubuli für die Organisation der gesamten intrazellulären und extrazellulären Skelettfilamente verantwortlich sind [12]. Das Zytoplasma der Eukariontenzellen enthält im Durchschnitt 50% nichtaggregiertes Tubulin. Durch die Zugabe bestimmter Wirkstoffe aggregieren Tubulinmoleküle zu äußerst labilen mikrotubulären Makrostrukturen. Durch die Einwirkung bestimmter Wirkstoffe dissoziieren Mikotubuli- Aggregate spontan. Andere Wirkstoffe blockieren die Aggregation mikrotubu- Seite 2 - 7 Zytologische Grundlagen der FEM-Modellierung lärer Strukturen oder fördern die Aggregation tubulärer Strukturen. Durch die Zugabe von Conchilin in das Zytoplasma einer sich teilenden Zelle werden die Mikrotubuli der mitotischen Spindel aufgelöst. Die Zellteilung wird blockiert. Die Zelle verharrt in der Mitose. Die Entfernung des Wirkstoffes erlaubt die Rückbildung der mitotischen Spindel und den Fortgang der Zellteilung. In der Mitose bewirkt Vinblastin bei vielen Zellen eine Blockierung der MikrotubuliAggregation. Dadurch verharrt die Zelle in Mitose und der Teilungsprozess ist blockiert. Ein anderer Wirkstoff Taxon bewirkt eine verstärkte Aggregation von Mikrotubuli. Es entstehen steifere mitotische Spindeln. Dadurch wird die sich teilende Zelle auch in der Mitose blockiert. Sie stirbt. Schweres Wasser hat die gleiche Wirkung. Kommt es zu einer Störung der Bildung von mitotischen MTSpindeln werden hauptsächlich schnellteilende Zellen geschädigt. Man konnte beobachten, daß bei einigen Eukariontenzellen die Dissoziation mikrotubulärer Makrostrukturen bei niedrigen Temperaturen schneller verläuft [12]. Wahrscheinlich werden Mikrotubuli durch hohe Ca2+ Konzentrationen abgebaut und bei geringen Calciumkonzentrationen wieder aufgebaut [12]. Bei einigen Eukariontenzellen werden Mikrotubuli bei Unterkühlung schneller abgebaut und bei Erwärmung wieder aufgebaut. Die Modellierung zellulärer Strukturen muß sowohl der äußerst komplexen Anordnung unterschiedlicher Makromolekül-Strukturen Rechnung tragen als auch die häufigen Gel-Sol-Gel Übergänge zytoplasmatischer Komponenten berücksichtigen. Intermediärfilamente sind makromolekulare Proteinstrukturen mit durchschnittlichen Größen von ca. 10 nm im Durchmesser. Anders als Mikrotubuli und Mikrofilamente können Intermediärfilament nach ihrer Aggregation nur schwer oder gar nicht dissoziieren. Es gibt Kreatinfilamente, Neurofilamente (Neurone) und Vimentinfilamente (Fibroblasten, einige Gliazellen und Muskelzellen). Neben Mikrotubuli und Aktinfilamenten haben auch Intermediärfilamente strukturelle, spannungsübertragende Funktionen. Die Zellsteifigkeit und damit die Zellform wird hauptsächlich von der Steifigkeit der Zytoskelettfilamente, ihrer Vernetzungsform und Bündelung sowie ihrer Verankerung an den Proteineinla- Seite 2 - 8 Zytologische Grundlagen der FEM-Modellierung gerungen in der Plasmamenbran bestimmt. Wesentlichen Einfluß auf die Zellsteifigkeit hat auch die Steifigkeit und die Form des Zellkerns. Die Kernsteifigkeit wird von dem Kerngerüst und der doppelschichtigen Kernmembran bestimmt. Dabei spielen die vielen Porenverstärkungen in der Kernmembran und das Netzwerk der Lamina eine entscheidende Rolle. Von entscheidender Bedeutung für die Modellierung zellulärer Strukturen sind die Steifigkeit, die Viskosität und die formbestimmende Anordnung der extrazellulären Matrix. Diese besteht aus Filamentnetzwerken in denen extrazelluläre Flüssigkeit eingelagert ist. Viele extrazelluläre Filamentstränge sind mit Verbindungsproteinen der zellulären Lipiddoppelschicht verbunden und bilden mit dem Zytoskelett einen geschlossenen Kraftschluß. Es wird angenommen, daß sich die Orientierung der extrazellulären Filamentbündel an dem zytoplasmatischen Mikrotubuli-Netzwerk ausrichtet. Desgleichen vermutet man eine reziproke Beeinflussung der Aktinbündel im Zytoplasma durch die extrazelluläre Matrix. Im Golgi-Apparat werden zytoplasmatische und extrazelluläre Proteinstrukturen in ihre endgültige Form gebracht. Dabei erfahren die Initialproteine spezifische kovalente Bindungsänderungen. Die Änderunsmechanismen sind noch weitgehend unbekannt. Für die Modellierung der zu analysierenden Zellen müssen detaillierte Angaben zu den formbestimmenden Parameter der entsprechenden subzellulärer Strukturen (Orientierung und Stärke der Aktinbündel, Mikrotubulianordnungen, Verbindungsproteine und Intermediärfilamente) vorliegen. Desgleichen sind Angaben zu der Steifigkeit und Viskosität der extrazellulären Filamentanordnungen erforderlich. Die Mikofilamente für das Berechnungsmodell in Abb. 2-2 sind dreiecksförmig angeordnet und haben eine durchschnittliche Länge von ca. 65 nm . Im Bereich der Kernmembran sind den Kernfaser-Elementen (Feder-Dämpfungselemente) steifere Materialwerte zugeordnet. Damit wird der Kernmembrandoppelschicht mit der an ihr anhaftenden, versteifenden Lamina Rechnung getragen. Im FEM- Seite 2 - 9 Zytologische Grundlagen der FEM-Modellierung Berechnungsmodell der Lymphknoten-Metastasenzelle (Abb. 2-2) werden extrazellulären Protein-Filamente mit stabförmigen Feder-Dämpfungselementen simuliert. Die Elemente sind durch die Membrandoppelschicht mit dem plasmatischen Skelett der Zelle verbunden. Die Abbildungen 2-4 und 2-5 zeigen die FEM-Anordnung der zytoplasmatischen und extrazellulären Proteinfilament-Elemente bei LymphknotenMetastasenzellen des Mammakarzinoms in peripherem lymphoiden Gewebe. Im FEM-Berechnungsmodell sind den malignen Proteinfilament-Elementen (links) reduzierte Steifigkeiten zugeordnet. Die zytologische Begründung ist der Verlust der zytoplasmatischen und extrazellulären Skelettordnung maligner Metastasenzellen. In der Abbildung 2-6 ist der Kern- Deteilbereich der Elementdiskretisierung des FEM-Berechnungsmodelles einer Lymphknoten-Metastasenzelle des Mammakarzinoms dargestellt. Abbildung 2-3. Zelluläre Anordnung zytoplasmatischer Mikrotubuli. Die Oranisation der Mikrotubuli verläuft radial durch das Zytoplasma, vom Zellzentrum (Zentriol) aus, um den Zellkern. Seite 2 - 10 Zytologische Grundlagen der FEM-Modellierung Abbildung 2-4 Elementdiskretisierung für das 2D-FEM Berechnungsmodell von Lymphknoten-Metastasenzellen des Mammakarzinoms in peripherem lymphoiden Gewebe. Das zytoplasmatische Skelett der Metastasenzelle (grün) hat eine tumorspezifische Organisation und Steifigkeit. Das extrazelluläre Skelett (blau) ist ebenfalls anders organisiert und weicher als bei nichtentarteten Zellen. Aus Gründen der Übersichtlichkeit ist die zytoplasmatische und extrazelluläre Flüssigkeit nicht dargestellt. In der Abbildung sind die Zellmembranen rot eingezeichnet. Seite 2 - 11 Zytologische Grundlagen der FEM-Modellierung Abbildung 2-5 Die Abbildung zeigt die Anordnung der zytoplasmatischen und extrazellulären Proteinfilamente von Lymphknoten-Metastasenzellen des Mammakarzinoms. Durch den Verlust der zytoplasmatischen und extrazellulären Skelettordnung ist die funktionelle Steifigkeit der Zelle gestört. Den Zytoskelettfilamentelementen sind im Berechnungsmodell reduzierte Steifigkeiten zugeordnet. In der Abbildung ist das Zytoplasma grün, das Kernplasma rot und die extrazelluläre Flüssigkeit hellblau dargestellt. Seite 2 - 12 Zytologische Grundlagen der FEM-Modellierung Kernlamina Zytoskelett Plasmamembran extrazelluläres Skelettfilament Abbildung 2-6 Elementnetzwerk des 2D-FEM Berechnungsmodelles einer Lymphknoten- Metastasenzelle des Mammakarzinoms. Detailbereich des Zellkerns mit Kernlamina, Kernmembran und zytoplasmatischem Skelett. Seite 2 - 13









![16.de.PPT [Kompatibilis mód]](http://s1.studylibde.com/store/data/001039061_1-3773ce69dfc1d489efdf5ffc83a8a5c0-300x300.png)
