Infomappe Pathologie
Werbung

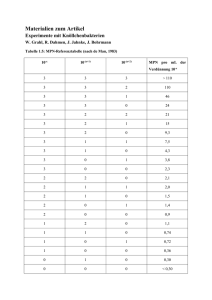
Leitfaden für die ­T ier-Pathologie Leitfaden für die Tier-Pathologie Pathologie Auf dem Gebiet der Pathologie spielen labordiagnostisch insbesondere die Zytologie und die Histologie eine Rolle. Bei der zytologischen Untersuchung ­werden in zytologischen Ausstrichen Einzelzellen beurteilt, während bei der histologischen Untersuchung ganze Gewebeproben beurteilt werden. Auf den folgenden Seiten soll auf Vor- und Nachteile der Zytologie und Histologie, die Probengewinnung, Probenaufbereitung und Fixierung dieser beiden ­Untersuchungsmethoden eingegangen werden, um Ihnen im täglichen Praxisalltag eine Hilfe zu geben. Vor- und Nachteile von Zytologie und Histologie Probengewinnung Die Zytologie bietet gegenüber der Histologie den ­Vorteil, dass die Probengewinnung schnell, minimal invasiv und in der Regel ohne Narkose möglich ist. Die Entnahme einer histologischen Gewebeprobe ist aufwändiger, es ist eine chirurgische Exzision oder Biopsie­ entnahme unter Vollnarkose oder lokaler Anästhesie notwendig. Dauer bis zur Beurteilung Die zytologischen Präparate können direkt nach Anfertigung und Färbung in der Praxis beurteilt werden. Bei Versand in ein Labor erfolgt die Beurteilung des Präparates noch am Eingangstag der Probe. Die histologische Gewebeprobe muss zunächst zugeschnitten und über Nacht eingebettet werden, bevor am nächsten Tag die Beurteilung erfolgen kann. Daher ist die Bearbeitungszeit für die Histologie einen Tag länger als für die Zytologie. Aussagekraft Bei der zytologischen Untersuchung erfolgt eine Beurteilung von Einzelzellen hinsichtlich ihrer Morphologie, Anzahl und Anordnung. Damit lassen sich Aussagen treffen, ob ein entzündlicher oder tumoröser Prozess vorliegt und ob es sich eher um einen benignen oder malignen Tumorprozess handelt. Dabei ist allerdings nur ein positiver, zytologischer Befund beweisend, falsch negative Befunde sind z. B. dadurch möglich, dass der Tumor oder die Entzündung bei der Punktion nicht getroffen wurde oder nicht aspiriert werden konnte. Ferner kann bei der zytologischen Untersuchung nicht beurteilt werden, ob invasives oder expansives Wachstum vorliegt oder ob sonstige Gewebeschädigungen vorliegen. 2 Da man bei der histologischen Untersuchung ganze Gewebeverbände beurteilt, können mit dieser Methode sehr viel weitreichendere und genauere Aussagen getroffen werden als bei der Zytologie. So kann man histologisch z. B. das Wachstumsverhalten von Tumoren (expansiv, invasiv), Gewebeschädigungen (Begleitentzündungen, Nekrosen), Metastasierung in Lymphgefäße oder die vollständige oder unvollständige Beur­ teilung von Tumoren beurteilen. Ferner kann man nur im histologischen Präparat das Fehlen von Strukturen (z. B. fehlende Talgdrüsen bei Sebadenitis) beurteilen. Die Zytologie bietet damit ein schnelles und einfaches diagnostisches Werkzeug zur ersten Diagnosestellung, das auch für das weitere diagnostische und therapeutische Vorgehen nützlich sein kann. Häufig muss aber eine Zytologie im weiteren Verlauf durch eine Histologie ergänzt werden, um genauere Aussagen treffen zu können. Bitte beachten Sie, dass wir aus räumlichen Gründen keine Sektionen von ganzen Tier­ körpern durchführen können. Wenden Sie sich für Tierkörpersektionen ­daher bitte an das zuständige Veterinär­ untersuchungsamt oder das entsprechende Institut für Pathologie der nächsten tier­ ärztlichen Hochschule. Leitfaden für die Tier-Pathologie Zytologie Die Zytologie ist eine Untersuchung von Einzelzellen, die an gefärbten Ausstrichen durchgeführt wird. Wichtige Punkte, um ein gutes Ergebnis bei der Zytologie zu gewährleisten ■■ Die Entnahmelokalisation und ein kurzer Vor­ bericht müssen angegeben werden, damit eine aussagekräftige Beurteilung erfolgen kann! ■■ Bei der Anfertigung der Ausstriche dürfen die ­Präparate nicht gequetscht oder mit zu viel Druck aufgebracht werden, da sonst die ­Zellen zerstört werden! ■■ Die angefertigten Präparate sollten nur luft­ getrocknet werden, auf keinen Fall darf eine ­Hitzefixierung erfolgen, da dies zur Zerstörung der Zellen führt! ■■ Die Objektträger sollten gut beschriftet sein, insbesondere bei mehreren Entnahmelokalisationen, um Verwechslungen zu vermeiden! Entnahme zytologischer Proben und Herstellung von Präparaten Feinnadelaspiration von Geweben Bei der Feinnadelaspiration handelt es sich um die am häufigsten angewandte Technik zur Gewinnung zytologischer Proben. Für eine Feinnadelaspiration eignen sich besonders oberflächliche Umfangsvermehrungen (Haut, Unterhaut), Lymphknoten, innere Organe sowie intraabdominale oder intrathorakale Umfangsvermehrungen. Technik Das zu punktierende Gewebe (z. B. Hauttumor) wird nach Rasur und Desinfektion mit einer Hand fixiert, bei der Punktion von inneren Organen oder Umfangs­ vermehrungen muss die Kontrolle der Punktion über Ultraschall erfolgen. Mit der anderen Hand wird die Spritze mit aufgesetzter Kanüle in das zu punktierende Gewebe gestochen. Dann wird unter stetiger Aspiration die Kanüle einige Male in verschiedene Richtungen vor- und zurück­ bewegt, um möglichst viel Material zu sammeln. Bevor man die Kanüle herauszieht, lässt man den Stempel der Spritze wieder vorsichtig zurückgleiten oder setzt die Kanüle von der Spritze ab, damit beim Herausziehen der Kanüle das gesammelte Material nicht in den Spritzenkonus gesaugt wird. Nach Herausziehen der Kanüle wird diese von der Spritze abgesetzt. In die Spritze wird Luft aufgezogen bevor die Kanüle wieder aufgesetzt und das gesammelte Material aus der Kanüle mit der Luft aus der Spritze auf einen Objektträger ausgeblasen wird (­siehe Abb. 1 auf der nächsten Seite). Wenn viel Material gesammelt wurde, sollte man es auf mehrere Objektträger verteilen, damit die Aus­ striche nicht zu dick werden. Um das Material auszustreichen, legt man vorsichtig einen zweiten Objektträger auf den Objektträger mit dem Material und wartet, bis sich das Material durch die Kapillarkräfte zwischen den beiden Objektträger verteilt. Dann zieht man die beiden Objektträger – ­ohne Druck aufzuwenden – in Längsrichtung auseinander (­siehe Abb. 2 auf der nächsten Seite). Material Alternativ kann man den Ausstrich auch mit einem aufgesetzten, zweiten Objektträger, wie bei einem Blutausstrich, anfertigen. Für die Entnahme von Feinnadelaspirationen verwendet man eine sterile Einwegspritze mit Volumina von 2 – 10 ml. Je derber das zu aspirierende Gewebe ist, desto größer sollte das Spritzenvolumen sein, um genügend Unterdruck aufbauen zu können. Im Idealfall stellt man mit dieser Technik mehrere, dünne Ausstriche her. Die Ausstriche lässt man nun an der Luft trocknen (nicht hitzefixieren!) und schickt die luftgetrockneten Ausstriche in einer Objektträgerversandhülle in das Labor. Die Durchmesser der aufgesetzten Kanülen sollten zwischen 0,6 und 0,9 mm (23 – 20 G) liegen. Auch hier gilt, je derber das Gewebe ist, desto größer sollte der Kanülendurchmesser sein. Man kann zunächst mit ­einem kleinen Kanülendurchmesser beginnen und bei schwer zu aspirierenden Geweben (z. B. Bindegewebe) dann auf größere Kanülen ausweichen. Ferner sollten drei bis fünf saubere Objektträger bereit­ liegen. 3 Leitfaden für die Tier-Pathologie Feinnadelaspiration 1a) Punktion mit aufgesetzter Spritze. 2a) 3a) Aspiration von 3 bis 5 ml Vakuum. Sammeln von Gewebe durch ­Vorwärts- und Zurückbewegen ­innerhalb der Läsion. Dazwischen Läsion nicht verlassen und ­Vakuum aufrecht erhalten. 4a) Absetzen der Kanüle von der Spritze. 5a) Herausziehen der ­Kanüle aus der Läsion Aufsetzen der Kanüle und »Ausblasen« des Kanülen­ inhaltes auf Objektträger. Alternative 1b) Punktion mit aufgesetzter Spritze. 2b) 3b) Aspiration von 3 bis 5 ml ­ akuum. Sammeln von V ­Gewebe durch Vorwärts- und Zurückbewegen inner­ halb der Läsion. Dazwischen Läsion nicht verlassen und Vakuum aufrecht erhalten. 4b) ufheben des A ­Vakuums durch Verbringen des Spritzen­stempels in »Nullposition«. 5b) Herausziehen der Kanüle mit auf­ gesetzter Spritze aus der Läsion. Abnahme der ­Kanüle und Füllen der Spritze mit Luft. 6b) Aufsetzen der Kanüle und »Ausblasen« des Kanülen­inhaltes auf Objektträger. Abb. 1: Durchführung einer Feinnadelaspiration; nach: Reinhard Mischke, Zytologisches Praktikum für die Veterinärmedizin, Schlütersche Verlagsgesellschaft mbH & Co. KG, 2005 Zytologischer Ausstrich B A A A B A 1) 2) 3) Auflegen eines zweiten Objekt­trägers (B) auf den unten befindlichen ­Objektträger mit der Probe (A) in Längsrichtung und ggf. Anwendung ­eines geringen Anpressdruckes bei Gewebeproben. Verteilung der Gewebeprobe auf dem Objektträger durch Hinwegziehen des aufliegenden zweiten Objektträgers (B). Zur Untersuchung kann insbesondere der unten liegende ­Objektträger (A) herangezogen werden. Abb. 2: Anfertigung eines zytologischen Ausstrichs; nach: Reinhard Mischke, Zytologisches Praktikum für die Veterinärmedizin, Schlütersche Verlagsgesellschaft mbH & Co. KG, 2005 4 B Leitfaden für die Tier-Pathologie Tupftechnik Abstrichtechnik Die Tupftechnik eignet sich besonders für chirurgisch entfernte Gewebe oder für oberflächlich zugängliche Läsionen (z. B. ulzerierte Haut oder Tumoroberfläche). Ein Abstrich kann mittels eines Tupfers oder einer kleinen Bürste erfolgen. Sie kommen vor allem bei der Probenentnahme von der Konjunktive, der Nase oder aus der Vagina zum Einsatz. Material Für die Tupftechnik benötigt man eine saubere Skalpellklinge, saugfähiges Papier und mehrere, saubere Objektträger Technik Mit der Skalpellklinge wird eine frische Oberfläche ­geschaffen und diese mit dem saugfähigen Papier abgetupft. Bei in situ verbleibenden Hautläsionen wird die Oberfläche gereinigt und abgetupft. Material Für die Entnahme benötigt man einen sauberen Tupfer oder eine Kunststoff- oder Stahlbürste, ggf. sterile, isotone Kochsalzlösung sowie mehrere, saubere Objektträger. Technik Schabetechnik Zur Gewinnung von Material wird der Tupfer, bzw. das Bürstchen (v. a. bei Konjunktivalabstrichen) vorsichtig über die Läsion oder die Schleimhaut gerollt. Bei einer relativ trockenen Oberfläche empfiehlt es sich, den Tupfer vorher mit etwas Kochsalzlösung anzufeuchten. Nachdem man die Abstrichprobe genommen hat, wird der Tupfer, bzw. das Bürstchen vorsichtig und ohne Druck auf einem oder mehreren Objektträgern abgerollt. Auf keinen Fall sollte man den Tupfer auf dem Objektträger hin und her reiben, da dabei viele Zellen zerstört werden. Die Schabetechnik eignet sich besonders bei äußerlich zugängliche Läsionen (oberflächliche Tumore, Ulzerationen) oder für chirurgisch entferntes Material. Sie wird aber insgesamt seltener angewendet. Gewinnung und Aufbereitung von Flüssigkeiten Material Punktate Für die Schabetechnik benötigt man eine saubere Skalpellklinge, saugfähiges Papier und mehrere, saubere Objektträger. Punktate aus Brusthöhlenflüssigkeit, Bauchhöhlen­ flüssigkeit oder Synovia werden direkt mittels Spritze und Kanüle (0,7 – 0,9 mm Durchmesser) gewonnen. Dann drückt man die frische Schnittfläche mehrmals auf einen sauberen Objektträger, bzw. man drückt den Objektträger auf die Hautläsion. Die Objektträger lässt man lufttrocknen und versendet sie in einer Objektträgerversandhülle. Technik Zunächst schafft man mit dem saugfähigen Papier ­eine trockene und möglichst saubere Oberfläche auf dem zu beprobenden Gewebe. Dann schabt man mit der Skalpellklinge im 90°-Winkel mehrmals über das Gewebe, bis sich Material am Klingenrand angesammelt hat. Das Material kann dann entweder direkt mit der Skalpellklinge auf den Objektträgern ausgestrichen werden, oder das Material wird auf einen Objektträger verbracht und mit einem zweiten Objektträger, wie zuvor beschrieben, ausgestrichen. Dann lässt man die Ausstriche lufttrocknen und versendet sie in einer Objektträgerversandhülle. Nach der Gewinnung sollte das Punktat in ein EDTARöhrchen überführt werden, um eine Gerinnselbildung zu vermeiden. Für eventuelle, bakteriologische Untersuchungen sollte die gewonnene Flüssigkeit in ein ­steriles Röhrchen verbracht werden. Tracheale oder bronchioalveoläre Lavage Zur Gewinnung einer trachealen oder bronchioalveolären Lavage werden 0,5 – 1,0 ml/kg Körpermasse isotone Kochsalzlösung instilliert (perkutan, über einen Tubus oder über ein Endoskop). Anschließend wird so viel Flüssigkeit wie möglich wieder zurückgewonnen und in ein EDTA-Röhrchen, bzw. in ein steriles Röhrchen verbracht. 5 Leitfaden für die Tier-Pathologie Histologie Harn Harn sollte möglichst steril, z. B. über einen Katheter, gewonnen werden. Da der pH-Wert im Harn eine schnelle Autolyse der Zellen begünstigt, sollten noch direkt in der Praxis Ausstriche angefertigt werden. Liquor Liquor sollte möglichst schnell nach der Entnahme aufgearbeitet werden, da die Zellen im Liquor bereits 4 Stunden nach Entnahme in Autolyse übergehen. Da die für korrekte Ausstriche benötigte Liquorzentrifuge in den meisten Praxen nicht vorhanden ist, empfiehlt es sich, zumindest einen direkten Ausstrich aus dem Liquor anzufertigen und den restlichen Liquor möglichst schnell in das Labor zu senden. Aufbereitung der gewonnenen Flüssigkeiten Es sollten schon direkt in der Praxis 1 – 2 Ausstriche von der gewonnen Flüssigkeit angefertigt werden, da die Zellen in der Flüssigkeit häufig auf dem Transportweg in das Labor in Autolyse übergehen. Zellreiche oder zähflüssige Punktate (trüb) können dabei direkt ausgestrichen werden, bei zellarmen Punktaten (klar) empfiehlt es sich, die Proben schnell nach Entnahme zu zentrifugieren (z. B. 5 Minuten bei 500 × g oder 3 Minuten bei 1500 × g). Der Überstand wird abpipettiert und das Sediment nach Resuspension mit einer geringen Menge Flüssigkeit (ca. 0,5 ml) ausgestrichen. Die angefertigten Ausstriche werden luftgetrocknet und in einer Objektträgerversandhülle in das Labor geschickt. Zusätzlich kann auch die gewonnene Flüssigkeit nativ mit in das Labor geschickt werden, um dort weitere Ausstriche anzufertigen oder z. B. eine bakteriologische Untersuchung einzuleiten. Färbung Wenn die angefertigten Präparate direkt in der Praxis beurteilt werden sollen, kann man kommerziell verfügbare Färbungen, wie z. B. Diff-Quik® verwenden, um die Ausstriche zu färben. Im Labor wird in der ­Regel eine Pappenheim-Färbung als zytologische Färbung verwendet. Problemlos können auch bereits vorgefärbte ­Ausstriche in unser Labor eingesandt werden. 6 Die Histologie ist eine Untersuchung von Gewebe­ proben, die durch Biopsieentnahme oder chirurgische Exzision gewonnen werden. Im Vergleich zur Zytologie dauert die histologische ­Beurteilung zwar einen Tag länger, bietet dafür aber häufig präzisere und weitreichendere Aussagen. Wichtige Punkte, um ein gutes Ergebnis bei der Histologie zu gewährleisten ■■ Die Entnahmelokalisation und ein kurzer Vorbericht müssen angegeben werden, damit eine ­aussagekräftige Beurteilung erfolgen kann! ■■ Bei der Entnahme der histologischen Gewebe­ proben sollte das Gewebe nicht gequetscht oder durch Elektrokoagulation versengt werden, da dann das Gewebe stark geschädigt wird und nicht mehr zu beurteilen ist. Auch das Einfrieren von Gewebe führt zu einer starken Gewebe­ schädigung! ■■ Das Gewebe sollte direkt nach der Entnahme in ausreichend 4 – 10 %-iges Formalin eingelegt ­werde, um eine Autolyse zu vermeiden! Entnahme histologischer Proben und Fixierung Entnahme Die Entnahme histologischer Proben erfolgt in der ­Regel in Narkose oder unter örtlicher Betäubung. Zum einen können Gewebeproben, wie z. B. Hauttumore partiell oder vollständig entnommen werden, zum ­anderen können Biopsien, wie z. B. Haut- oder Organbiopsien entnommen werden. Bei der Entnahme von histologischen Proben ist darauf zu achten, das Gewebe möglichst wenig zu beschädigen. Quetschung, Elektrokoagulation oder Einfrieren führen zu starken Gewebeschäden, die zu einer starken Beeinträchtigung der Beurteilbarkeit führen. Wahl der Entnahmelokalisation und Probengröße Die Proben sollten aus repräsentativen Lokalisationen entnommen werden, wobei je nach Fragestellung verschiedene Aspekte zu berücksichtigen sind. Leitfaden für die Tier-Pathologie Tumore Organbiopsien Tumore sollten, soweit möglich, vollständig entnommen und eingesandt werden, damit neben der Beurteilung des Tumors auch die Beurteilung der Entnahmeränder erfolgen kann. Sollte der Tumor nur partiell entnommen oder eingesandt worden sein, geben Sie dies bitte an, damit es bei der Beurteilung der Probenränder berücksichtigt werden kann. Bei Organbiopsien sollten unter Ultraschallkontrolle repräsentative Lokalisationen entnommen werden. Gerade bei Biopsien aus dem Magen-Darm-Trakt oder der Nasenschleimhaut sollte nicht nur die oberfläch­ liche Schleimhaut, sondern auch die Submucosa mit entnommen werden, da sich dort häufig die meisten Entzündungszellen finden. Falls nur ein Teil des Tumors oder Biopsien aus dem Tumor entnommen werden können, ist es wichtig, dass insbesondere Lokalisationen aus dem Randbereich oder vom Übergang in das gesunde Gewebe genommen werden, damit das Wachstumsverhalten zum gesunden Gewebe beurteilt werden kann. Es macht häufig keinen Sinn, bei großen Tumoren Material aus dem Tumorzentrum zu entnehmen, da dort zumeist große Nekrosen vorliegen und das Gewebe daher dort nicht beurteilbar ist. Ein Probendurchmesser von 0,2 cm sollte dabei nicht unterschritten werden, um eine aussagekräftige Beurteilung zu gewährleisten. Sollten Lymphknoten im Bereich des Tumors vergrößert sein, empfiehlt es sich, auch diese zu entnehmen und einzusenden, um sie in Bezug auf eine Metastasierung zu untersuchen. Wenn es sich um sehr große Umfangsvermehrungen handelt, sollten diese vor der Fixierung geteilt werden, damit sie vollständig durchfixieren. Hautbiopsien Für die Interpretation von Hautbiopsien ist ein ausführlicher Vorbericht sehr wichtig. Ferner sollten die Hautbiopsien aus repräsentativen Lokalisationen mit typischen Läsionen entnommen werden. Wenn ein Tier verschiedene, klinische Ausprägungen einer Haut­ erkrankung zeigt sollten mehrere Hautbiopsien aus verschiedenen Lokalisationen entnommen werden und diese in verschiedenen, entsprechend gekennzeichneten Behältern eingesandt werden. Fixierung Direkt nach der Entnahme sollten die entnommenen Gewebeproben in 4 – 10 %-iges Formalin verbracht werden. Dabei ist darauf zu achten, dass das Verhältnis von Formalin zu Gewebe ausreichend ist, im Idealfall beträgt das Verhältnis von Formalin zu Gewebe 10:1. Da die Fixationsgeschwindigkeit des Gewebes ca. 1 cm pro Stunde beträgt, ist eine ausreichend lange Fixationsdauer des Gewebes notwendig. Bei einer Einsendung von unfixiertem Gewebe kommt es zur Autolyse, die wiederum die histologische Beurteilung deutlich einschränkt. Auch eine Fixierung in Alkohol führt zu Artefakten und eingeschränkter Beur­ teilbarkeit. Wenn zusätzlich zu der histologischen Untersuchung auch noch eine andere, weiterführende Untersuchung erfolgen soll (z. B. Bakteriologie, PCR), muss ein Teil der Probe separat und unfixiert mit eingesandt werden. Vor der Biopsieentnahme sollte die Haut nicht gereinigt und desinfiziert werden, da dadurch eventuell oberflächliche Erreger (Pilze, Parasiten) entfernt werden. Die Hautbiopsien sollten einen Mindestdurchmesser von 0,4 cm, besser 0,6 cm haben, um eine aussagekräftige Beurteilung zu gewährleisten. Quellen Literatur Zytologie: Reinhard Mischke, ­Zytologisches ­Praktikum für die ­Veterinärmedizin, ­Schlütersche ­Verlagsgesellschaft mbH & Co. KG, 2005 7 Kontaktadresse Labor MVZ Diamedis Diagnostische Medizin Sennestadt GmbH Dunlopstraße 50, 33689 Bielefeld Telefon05205.729 90 Telefax 05205.729 91 15 E-Mail [email protected] Ansprechpartnerin Pathologie Dr. med. vet. Stefanie Deppenmeier Fachtierärztin für Pathologie MVZ Diamedis Diagnostische Medizin Sennestadt GmbH Dunlopstraße 50, 33689 Bielefeld Telefon0 52 05.729 92 24 Telefax 0 52 05.729 92 55 E-Mail [email protected]