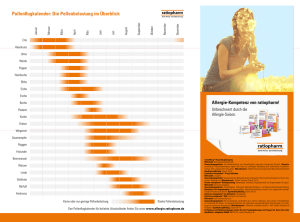
„Es ist wichtig, kritische Pathologien, wie etwa Paresen
Werbung

h ulter und Arm insbesondere der Bandscheiben, mit dem Lebensalter zunimmt. Eine Schwäche im Bereich des M. trapezius könnte bei Frau D. auch ein Hinweis auf eine radikuläre motorische Läsion C4 und eine Schwäche des M. deltoideus ein Hinweis auf eine radikuläre Läsion C5 sein. In diesem Fall ist ein MRT (weniger auch CT) der Segmente C3/4 bzw. der Segmente C4/5 rechts und der benachbarten Segmente durchzuführen, um eine entsprechende Wurzelkompression auszuschließen. Bei der Beurteilung der Schnittbilder ist insbesondere auch darauf zu achten, ob der Befund im Einklang mit der Klinik steht – i.e. Seite der Läsion, Segmenthöhe etc. Eine Zuweisung zum Neuro- bzw. WS-Chirurgen wäre im Fall der Übereinstimmung erforderlich. Wenn die Beschwerden unspezifisch sind und sich wiederholen und/oder in Kombination mit unspezifischen LWS-Schmerzen auftreten, dann sollte Frau D. ein regelmäßiges und kontrolliertes Muskelaufbautraining durchführen. Dieses sollte unter ärztlicher Aufsicht und unter Überwachung durch medizinisch qualifiziertes Personal auf dafür zertifizierten medizinischen Trainingsgeräten erfolgen. „Im Fall eines zervikalen Syndroms käme eine Neuraltherapie in Frage“ Dr. Horace Sampson FA f. Neurologie & Psychiatrie, Psychotherapeut, Akupunktur, Linz Die Patientin klagt seit Wenn die Beschwerden nach sechs Womehr als drei Wochen chen trotz Therapie weiter bestehen, ist über Schmerzen in der zunächst ein konventionelles Röntgen zu Halswirbelsäule mit beschaffen. Dieses sollte die „Red Flags“ Ausstrahlungen in die rechte Schulter und (= spezifische Ursachen) ausschließen. zeitweise in den rechten Oberarm, über Diese sind Tumorerkrankungen, schwere Gefühlsstörungen in diesem erweiterten Osteoporose mit Wirbeleinbrüchen, Fehl- Schmerzbereich und über eine Schwäche bzw. Missbildungen, entzündliche bzw. des Oberarmes, wobei jedoch der Faustinfektiöse Erkrankungen im Bereich der schluss unauffällig ist. HauptlokalisationsWS, Verletzungen oder Traumata, Hin- punkte sind der Rücken und die Schulterweise auf metabolische Knochenerkran- muskulatur. Als Folge der Schmerzen und kungen und bestimmte degenerative WS- der Schwäche in den oben erwähnten BeErkrankungen wie z.B. schwere Vertebro- reichen besteht eine Abduktionshemmung stenose. Degenerative Zeichen haben nur des rechten Armes. einen sehr losen Kausalzusammenhang zu Wegen der Schmerzen in der HalswirRückenschmerzen. Das Häufigkeitsmaxi- belsäule mit Ausstrahlung in den Oberarm mum der Rückenschmerzen ist in der und der daraus resultierenden Bewegungsvierten und fünften Lebensdekade, wohin- einschränkung würde ich zwecks Ausgegen die Degeneration der Wirbelsäule, schlusses eines Bandscheibenvorfalles ärztemagazin 5/2009 (Diskusprolaps) in der Halswirbelsäule ein Röntgen respektive eine MRT (Magnetresonanztomografie) der Halswirbelsäule vorschlagen. Sollte sich auf Grund der MRT kein anderer pathologischer Befund ergeben, so käme für mich als Diagnose ein zervikales Syndrom in Frage. Im Fall eines zervikalen Syndroms würde ich entweder mit einer schulmedizinischen Neuraltherapie oder alternativ mit einer gezielten Akupunkturtherapie vorgehen. Im Fall der schulmedizinischen Neuraltherapie würde ich eine gezielte Infiltration der Halswirbelsäule mit anschließender Interferenz und Ultraschallbehandlung durchführen. Als weitere Behandlungsmöglichkeit bietet sich ein Zweizellenbad mit Nackenplatte und anschließender Ultraschallbehandlung der Halswirbelsäule an. Bei der alternativen Akupunkturtherapie würde ich den Nackenschmerzen und der eingeschränkten Bewegungsfreiheit mit den Akupunkturpunkten PaM 108 und G 39 entgegenwirken. Gegen die akuten Schmerzen würde ich die Nadeln bei DI 4 und MA 36 setzen und dabei MA 36 kräftig stimulieren. Für den Rücken und die Schultermuskulatur wird die Akupunktur bei den Punkten DI 15 und DI 10 vorgenommen. Sollte der gewünschte Effekt nicht eintreten, so würde ich MA 36 entfernen und durch MA 38 ersetzen. Normalerweise müsste die Patientin nach Abschluss der Therapie wieder vollkommen schmerzfrei und uneingeschränkt in ihrer Bewegung sein. „Es ist wichtig, kritische Pathologien, wie etwa Paresen, auszuschließen“ Dr. Thomas Drekonja FA f. Orthopädie und orthopädische Chirurgie, Salzburg Nacken-Arm-Schmerzen werden meist durch endlagige Rotationsund Extensionsbewegungen der HWS ausgelöst. Oft beginnen sie als intermittierende Schmerzen, die sich aber zu einem Dauerschmerz entwickeln können. Die häufig begleitende Hyp- oder Dysästhesie am Arm kann bei der Zuordnung der betroffenen Etage sehr hilfreich sein. Der schmerzgeplagte Patient hat meist schon eine Schonhaltung eingenom15 medizin Fa l l d e r Woche men, sodass eine Überprüfung der groben Kraft der oberen Extremitäten zum Ausschluss einer beginnenden Parese unerlässlich ist. Die häufigste Ursache einer Zervikobrachialgie ist die zervikale Bandscheibenvorwölbung oder der Vorfall, welche den ausstrahlenden Armschmerz durch Druck auf die Nervenwurzel verursachen. Meist können die Schmerzen durch Kopfbewegungen oder durch Zug am betroffenen Arm verstärkt werden. Es ist wichtig, kritische Pathologien auszuschließen. Zu den „Red Flags“ gehören Paresen, welche eine traumatische, radikuläre oder sekundäre Genese (Tumor) haben können. Die periphere Durchblutung muss intakt sein, und eine Infektgenese sollte klinisch ausgeschlossen werden. Auch bei Verdacht auf das Vorliegen einer der oben angeführten Situationen sollte der Patient unverzüglich an eine entsprechende Fachabteilung zugewiesen werden. Weniger kritische, aber häufig auftretende Differenzialdiagnosen sind das subakromiale Inpingement der Schulter, Ansatztendinosen am Ellenbogen, das Karpaltunnelsyndrom und kostoklavikuläre transiente Ischiämien. Nach Anamneseerhebung und der klinischen Untersuchung ist eine weiterführende Diagnostik in den meisten Fällen nicht notwendig. Es soll eine kombinierte Physiotherapie und medikamentöse Therapie mit NSAR, Analgetika und Myotonolytika begonnen werden. Erst bei Nichtansprechen der Therapiemaßnahmen oder Auftreten einer Parese ist eine weiterführende radiolo- gische Diagnostik mit Röntgen der HWS ap, seitlich und Schrägaufnahmen sowie ein MRT der HWS erforderlich. Nach radiologischer Absicherung einer Nervenwurzelirritation durch einen Diskus oder beginnender Neuroforaminal­ stensosen können epidurale Steroidinfiltrationen an der HWS eine deutliche Besserung der Beschwerden herbeiführen. Die zuerst genannten konservativen The- rapien sollen begleitend fortgesetzt werden. Sollte es trotzdem zu keiner Besserung kommen oder es entwickelt sich eine Parese, ist die mikrochirurgische Dekompression kombiniert mit dem Einbringen eines Cages zur Fusion oder einer zervikalen Bandscheibenprothese zum Schutz der angrenzenden Bandscheiben eine sehr erfolgreiche operative Therapie mit ausn gezeichneten Langzeitergebnissen. Fachkurzinformation Aldara 5% Creme. Qualitative und quantitative Zusammensetzung: Jeder Beutel enthält 12,5 mg Imiquimod in 250 mg Creme (5%). Hilfsstoffe: Isostearinsäure, Benzylalkohol, Cetylalkohol, Stearylalkohol, weißes Vaselin, Polysorbat 60, Sorbitanstearat, Glycerol, Methyl(4hydroxybenzoat) (E218), Propyl(4-hydroxybenzoat) (E216), Xanthan-Gummi, gereinigtes Wasser. Anwendungsgebiete: Imiquimod-Creme ist bestimmt für die topische Behandlung von: äußerlichen Feigwarzen im Genital- und Perianalbereich (Condylomata acuminata) bei Erwachsenen, kleinen superfiziellen Basalzellkarzinomen (sBCC) bei Erwachsenen, klinisch typischen, nicht hyperkeratotischen, nicht hypertrophen aktinischen Keratosen (AKs) im Gesicht oder auf der Kopfhaut bei immunkompetenten Erwachsenen, wenn die Größe oder die Anzahl der Läsionen die Wirksamkeit und/oder die Akzeptanz einer Kryotherapie begrenzen und andere topische Behandlungsmöglichkeiten kontraindiziert oder weniger geeignet sind. Gegenanzeigen: Überempfindlichkeit gegen Imiquimod oder einen der sonstigen Bestandteile. Pharmakodynamische Eigenschaften: Pharmakotherapeutische Gruppe: topische Chemotherapeutika, antivirale Mittel, ATC-Code: D06BB10. Pharmazeutischer Unternehmer: Meda AB, Box 906, 17009 Solna, Schweden. Verschreibungspflicht / Apothekenpflicht: Rezept- und apothekenpflichtig. Angaben über Warnhinweise und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkung mit anderen Mitteln, Nebenwirkungen und Gewöhnungseffekte entnehmen Sie bitte der veröffentlichten Fachinformation. BLOPRESS® 8 mg Plus- Tabletten, BLOPRESS® 16 mg Plus- Tabletten. Zusammensetzung: 1 Tablette enthält 8 mg bzw. 16 mg Candesartan Cilexetil und 12,5 mg Hydrochlorothiazid. Hilfsstoffe: Carmellose Calcium, Hydroxypropylcellulose, Lactose-Monohydrat, Magnesiumstearat, Maisstärke, Macrogol und Eisenoxid rot (E172 - nur bei 16 mg). Anwendungsgebiete: Essentielle Hypertonie, wenn eine Monotherapie mit Candesartan Cilexetil oder Hydrochlorothiazid nicht ausreichend ist. Gegenanzeigen: Überempfindlichkeit gegenüber den Wirkstoffen oder einem der sonstigen Bestandteile des Präparates oder gegenüber Sulfonamidderivaten. Schwangerschaft und Stillzeit; schwere Nierenschädigung; schwere Leberschädigung und/oder Cholestase. Refraktäre Hypokaliämie und Hyperkalzämie; Gicht. Pharmakologisch-therapeutische Gruppe: Angiotensin-II-Antagonisten und Diuretika. Abgabe: Rp, apothekenpflichtig. Packungsgröße: 28 Stück. Stand der Information: Mai 2007. Zulassungsinhaber: Takeda Pharma Ges.m.b.H., 1070 Wien, Seidengasse 33-35, Tel. 01/524 40 64, Fax: 01/524 40 66. Weitere Angaben zu Nebenwirkungen, Wechselwirkungen und zu den besonderen Warnhinweisen und Vorsichtsmaßnahmen zur sicheren Anwendung sind der veröffentlichten Fachinformation zu entnehmen. BLOPRESS® 4 mg - Tabletten, BLOPRESS® 8 mg - Tabletten, BLOPRESS® 16 mg - Tabletten, BLOPRESS® 32 mg - Tabletten. Zusammensetzung: 1 Tablette enthält 4 mg, bzw. 8 mg, 16 mg oder 32 mg Candesartan Cilexetil. Hilfsstoffe: Carmellose Calcium, Hydroxypropylcellulose, Lactose-Monohydrat, Magnesiumstearat, Maisstärke, Macrogol und Eisenoxid rot (E172 - nur bei 8 mg und 16 mg). Anwendungsgebiete: Essentielle Hypertonie. Behandlung von Patienten mit Herzinsuffizienz und eingeschränkter linker Ventrikelfunktion (linksventrikuläre Auswurf-Fraktion ≤40%) als Zusatztherapie zu ACE-Hemmern oder wenn ACE-Hemmer nicht vertragen werden. Gegenanzeigen: Überempfindlichkeit gegenüber einem Bestandteil von Blopress®; Schwangerschaft und Stillzeit; schwere Leberfunktionsstörungen und/oder Cholestase. Pharmakologisch-therapeutische Gruppe: Angiotensin-II-Antagonisten. Abgabe: Rp, apothekenpflichtig. Packungsgröße: 28 Stück. Stand der Information: März 2007. Zulassungsinhaber: Takeda Pharma Ges.m.b.H., 1070 Wien, Seidengasse 33-35, Tel. 01/524 40 64, Fax: 01/524 40 66. Weitere Angaben zu Nebenwirkungen, Wechselwirkungen und zu den besonderen Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung sind der veröffentlichten Fachinformation zu entnehmen. BLMA08071 Literatur: 1. Bönner G, Fuchs W. Fixed combination of candesartan with hydrochlorothiazide in patients with severe primary hypertension. Curr Med Res Opin. 2004; 20:597-602 2. König W. Comparison of the efficacy and tolerability of combination tablets containing candesartan cilexetil and hydrochlorothiazide or losartan and hydrochlorothiazide in patients with moderate to severe hypertension. Results of the CARLOS-Study. Clin Drug Invest. 2000; 19:239-246 Gabapentin ratiopharm 300 mg- und 400 mg-Kapseln. Qualitative und quantitative Zusammensetzung: Jede 300 mg Hartkapsel enthält 300 mg Gabapentin. Sonstige Bestandteile: Jede 300 mg Hartkapsel enthält 67,5 mg Lactose-Monohydrat (wasserfrei). Jede 400 mg Hartkapsel enthält 400 mg Gabapentin. Sonstige Bestandteile: Jede 400 mg Hartkapsel enthält 90,0 mg Lactose-Monohydrat (wasserfrei). Anwendungsgebiete: Epilepsie: Gabapentin ist als Zusatztherapie bei Erwachsenen und Kindern von 6 Jahren und älter mit partiellen Anfällen mit und ohne sekundäre Generalisierung indiziert. Gabapentin ist als Monotherapie bei Erwachsenen und Jugendlichen von 12 Jahren und älter mit partiellen Anfällen mit und ohne sekundäre Generalisierung indiziert. Behandlung von peripheren neuropathischen Schmerzen: Gabapentin ist zur Behandlung von peripheren neuropathischen Schmerzen wie schmerzhafter diabetischer Neuropathie und postherpetischer Neuralgie bei Erwachsenen indiziert. Gegenanzeigen: Überempfindlichkeit gegenüber dem Wirkstoff oder einem der sonstigen Bestandteile. Pharmakotherapeutische Gruppe: andere Antiepileptika ATC-Code: N03AX12. Liste der sonstigen Bestandteile: Lactose-Monohydrat, wasserfrei (Gabapentin ratiopharm 300 mg-Kapseln: 67,5 mg pro Kapsel; Gabapentin ratiopharm 400 mg-Kapseln: 90 mg pro Kapsel), Maisstärke,Talkum, Gelatine, Titandioxid (E-171), gelbes Eisenoxid (E-172); Die Drucktinte (OPACODE S-1-8152HV BLACK) enthält: Schellack (E-904), Soja-Lecithin, Dimeticon, schwarzes Eisenoxid (E-172). Art und Inhalt des Behältnisses: PVC-Aluminium – Blisterpackung; 100 Stück. Inhaber der Zulassung: ratiopharm Arzneimittel Vertriebs-GmbH, Albert-Schweitzer Gasse 3, A-1140 Wien, Tel. Nr.: +43/1/97007-0, Fax-Nr.: +43/1/97007-66, e-mail: [email protected]. Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig. Stand der Information: September 2008. Gabapentin ratiopharm 600 mg – und 800 mg-Filmtabletten. Qualitative und quantitative Zusammensetzung: Jede 600 mg Filmtablette enthält 600 mg Gabapentin. Jede 800 mg Filmtablette enthält 800 mg Gabapentin. Anwendungsgebiete: Epilepsie: Gabapentin ist als Zusatztherapie bei Erwachsenen und Kindern von 6 Jahren und älter mit partiellen Anfällen mit und ohne sekundäre Generalisierung indiziert. Gabapentin ist als Monotherapie bei Erwachsenen und Jugendlichen von 12 Jahren und älter mit partiellen Anfällen mit und ohne sekundäre Generalisierung indiziert. Behandlung von peripheren neuropathischen Schmerzen: Gabapentin ist zur Behandlung von peripheren neuropathischen Schmerzen wie schmerzhafter diabetischer Neuropathie und postherpetischer Neuralgie bei Erwachsenen indiziert. Gegenanzeigen: Überempfindlichkeit gegenüber dem Wirkstoff oder einem der sonstigen Bestandteile. Pharmakotherapeutische Gruppe: andere Antiepileptika ATC-Code: N03 AX 12. Liste der sonstigen Bestandteile: Kern: Mikrokristalline Cellulose, Hydroxypropylcellulose, Hydroxypropylcellulose LH-21, Hydriertes Rizinusöl, Natriumdodecylsulfat, Magnesiumstearat; Filmüberzug: Klarlack (bestehend aus: mikrokristalliner Cellulose, Carrageen, Macrogol, Hydroxyethylcellulose und Maltodextrin), Titandioxid (E 171). Art und Inhalt des Behältnisses: PVC-/PVDC-/Al – Blisterpackung, 100 Stück. Inhaber der Zulassung: ratiopharm Arzneimittel Vertriebs-GmbH, Albert-Schweitzer Gasse 3, A-1140 Wien, Tel.Nr.: +43/1/97007-0, Fax-Nr.: +43/1/97007-66, e-mail: [email protected]. Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig. Stand der Information: September 2008. Weitere Hinweise zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Mitteln, Nebenwirkungen und zutreffendenfalls Angaben über die Gewöhnungseffekte sind der veröffentlichten Fachinformation zu entnehmen. Losartan “1A Pharma” 50 mg – Filmtabletten. Zusammensetzung: 1 Filmtablette enthält 50 mg Losartan-Kalium. Sonstiger Bestandteil: 28,52 mg Lactose-Monohydrat. Wirkstoffgruppe: Pharmakotherapeutische Gruppe: Angiotensin II – Antagonisten. ATC-Code: C09CA01. Anwendungsgebiete: -Essentielle Hypertonie, -Risikoreduktion der kardiovaskulären Morbidität und Mortalität bei Hypertonikern mit linksventrikulärer Hypertrophie, -Chronische Herzinsuffizienz (NYHA II und III), im Allgemeinen zusätzlich zu Diuretika und Digitalis, wenn die Anwendung eines ACE-Hemmers nicht geeignet ist, -Nephroprotektion bei Patienten mit Typ II-Diabetes und Proteinurie: zur Verzögerung der Progression der Nierenerkrankung und Reduktion der Proteinurie. Gegenanzeigen: -Überempfindlichkeit gegen den Wirkstoff Losartan-Kalium oder einen der sonstigen Bestandteile des Präparates. -Schwangerschaft und Stillzeit. Inhaber der Zulassung: 1A Pharma GmbH, 1235 Wien. Zulassungsnummer: 1-27051. Packungsgrößen: 10 und 30 Stück. Abgabe: Rezept- und apothekenpflichtig. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Verwendung, Wechselwirkungen mit anderen Mitteln und Nebenwirkungen sind der veröffentlichten Fachinformation zu entnehmen. Nebivolol Actavis 5 mg Tabletten. Zusammensetzung: Eine Tablette enthält 5,45 mg Nebivololhydrochlorid, entsprechend 5 mg Nebivolol. Hilfsstoffe: Siliciumdioxid, kolloidal, wasserfrei. Magnesiumstearat. Croscarmellose-Natrium. Macrogol 6000. Lactose-Monohydrat (192,4 mg Lactose-Monohydrat/Tablette). Anwendungsgebiete: Hypertonie; zur Behandlung der essenziellen Hypertonie. Chronische Herzinsuffizienz; zusätzlich zu den üblichen Behandlungsmaßnahmen zur Behandlung der leichten bis mäßig ausgeprägten chronischen Herzinsuffizienz bei Patienten ≥ 70 Jahre. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff odereinen der sonstigen Bestandteile. Leberinsuffizienz oder Leberfunktionsstörungen. Akutes Herzversagen, kardiogener Schock oder akute Dekompensation einer Herzinsuffizienz mit erforderlicher i.v. inotroper Therapie. Sick-Sinus-Syndrom, einschließlich sinoatrialer Block. AV-Block 2. oder 3. Grades (ohne Schrittmacherversorgung). Anamnestisch bekannter Bronchialspasmus und Bronchialasthma. Unbehandeltes Phäochromozytom. Metabolische Azidose. Bradykardie (Herzfrequenz < 60/min vor Therapiebeginn). Hypotonie (systolischerBlutdruck < 90 mm Hg). Schwere periphere Durchblutungsstörungen. Gleichzeitige Behandlung mit Floctafenin. Gleichzeitige Behandlung mit Sultoprid. Zulassungsinhaber: Actavis Group PTC ehf. Reykjavikurvegur 76-78. 220 Hafnarfjördur. Island. Verschreibungspflicht: Rezept- und apothekenpflichtig. Weitere Angaben zu den Warnhinweisen, Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Mitteln und Nebenwirkungen sowie mögliche Gewöhnungseffekte entnehmen Sie bitte der veröffentlichten Fachinformation. Weitere Informationen erhalten Sie bei Actavis GmbH, Münchner Bundesstraße 142, 5020 Salzburg, Österreich. 16 ärztemagazin 5/2009