Influenza-Virus-induzierte Signalkaskaden
Werbung
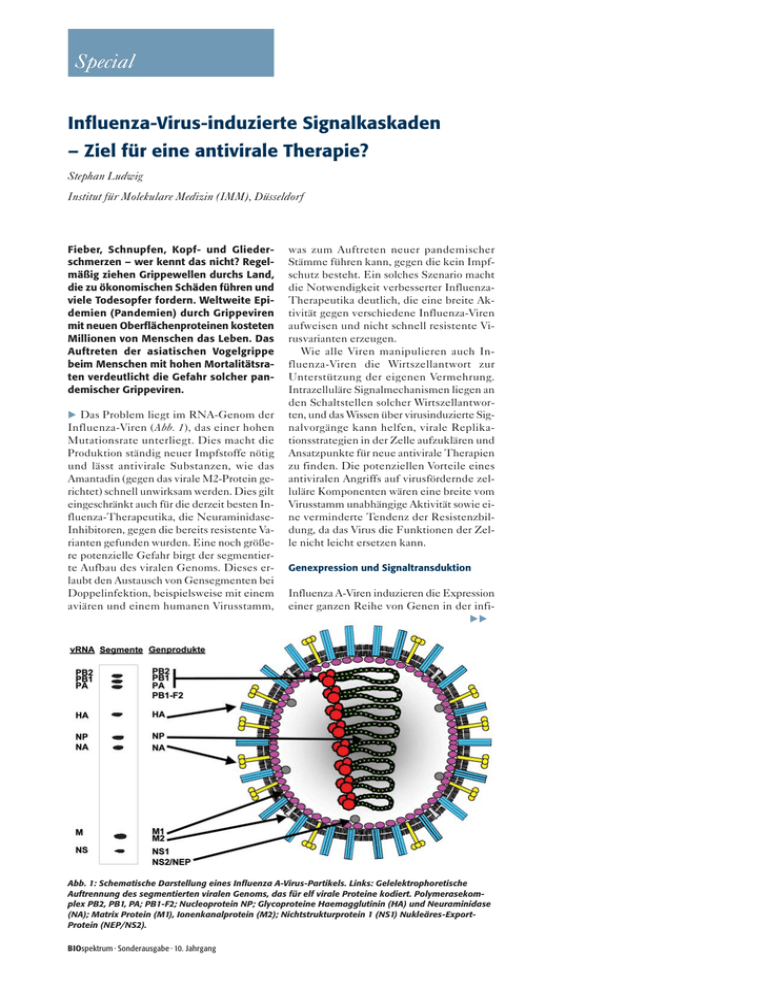
Special Influenza-Virus-induzierte Signalkaskaden – Ziel für eine antivirale Therapie? Stephan Ludwig Institut für Molekulare Medizin (IMM), Düsseldorf Fieber, Schnupfen, Kopf- und Gliederschmerzen – wer kennt das nicht? Regelmäßig ziehen Grippewellen durchs Land, die zu ökonomischen Schäden führen und viele Todesopfer fordern. Weltweite Epidemien (Pandemien) durch Grippeviren mit neuen Oberflächenproteinen kosteten Millionen von Menschen das Leben. Das Auftreten der asiatischen Vogelgrippe beim Menschen mit hohen Mortalitätsraten verdeutlicht die Gefahr solcher pandemischer Grippeviren. Das Problem liegt im RNA-Genom der Influenza-Viren (Abb. 1), das einer hohen Mutationsrate unterliegt. Dies macht die Produktion ständig neuer Impfstoffe nötig und lässt antivirale Substanzen, wie das Amantadin (gegen das virale M2-Protein gerichtet) schnell unwirksam werden. Dies gilt eingeschränkt auch für die derzeit besten Influenza-Therapeutika, die NeuraminidaseInhibitoren, gegen die bereits resistente Varianten gefunden wurden. Eine noch größere potenzielle Gefahr birgt der segmentierte Aufbau des viralen Genoms. Dieses erlaubt den Austausch von Gensegmenten bei Doppelinfektion, beispielsweise mit einem aviären und einem humanen Virusstamm, was zum Auftreten neuer pandemischer Stämme führen kann, gegen die kein Impfschutz besteht. Ein solches Szenario macht die Notwendigkeit verbesserter InfluenzaTherapeutika deutlich, die eine breite Aktivität gegen verschiedene Influenza-Viren aufweisen und nicht schnell resistente Virusvarianten erzeugen. Wie alle Viren manipulieren auch Influenza-Viren die Wirtszellantwort zur Unterstützung der eigenen Vermehrung. Intrazelluläre Signalmechanismen liegen an den Schaltstellen solcher Wirtszellantworten, und das Wissen über virusinduzierte Signalvorgänge kann helfen, virale Replikationsstrategien in der Zelle aufzuklären und Ansatzpunkte für neue antivirale Therapien zu finden. Die potenziellen Vorteile eines antiviralen Angriffs auf virusfördernde zelluläre Komponenten wären eine breite vom Virusstamm unabhängige Aktivität sowie eine verminderte Tendenz der Resistenzbildung, da das Virus die Funktionen der Zelle nicht leicht ersetzen kann. Genexpression und Signaltransduktion Influenza A-Viren induzieren die Expression einer ganzen Reihe von Genen in der infi Abb. 1: Schematische Darstellung eines Influenza A-Virus-Partikels. Links: Gelelektrophoretische Auftrennung des segmentierten viralen Genoms, das für elf virale Proteine kodiert. Polymerasekomplex PB2, PB1, PA; PB1-F2; Nucleoprotein NP; Glycoproteine Haemagglutinin (HA) und Neuraminidase (NA); Matrix Protein (M1), Ionenkanalprotein (M2); Nichtstrukturprotein 1 (NS1) Nukleäres-ExportProtein (NEP/NS2). BIOspektrum · Sonderausgabe · 10. Jahrgang Special 518 Abb. 2: Influenza-Virus-induzierte Signalprozesse und ihre Funktion in der infizierten Wirtszelle. PAK, p21-aktivierte Kinase; IKK, Inhibitor der κB-Kinase, NF-κB, Nukleärer Faktor κB, IRF-3, Interferon-regulatorischer Faktor-3, TBK-1, TANK-Bindekinase 1, MKK, Mitogen-aktivierte Proteinkinase (MAPK); SAPK, Stress-aktivierte Proteinkinase; ATF-2, aktivierender Transkriptionsfaktor 2, MEK, MAPK-/ERK-Kinase, PKC, Proteinkinase C (s. Text). zierten Zelle, was auf eine intensive Aktivierung zellulärer Signaltransduktionsprozesse hindeutet[5, 6]. Vermutlich wird diese Signalinduktion zunächst von der Zelle als antivirale Antwort initiiert. Dies ermöglicht dem Virus, die Signale für die eigene Vermehrung zu nutzen. Ein Beispiel für das Ausnutzen solcher Signale früh im Replikationszyklus ist die virale Aktivierung der Protein-Kinase C (Isoform betaII), die für die endozytotische Aufnahme des Virus benötigt wird (Abb. 2)[11]. Mitogen-aktivierte Proteinkinase-Kaskaden MAP-Kinase-Kaskaden sind wichtige intrazelluläre Signalüberträger und regulieren viele zelluläre Entscheidungsprozesse. Vier verschiedene MAP-Kinase-Familien, in unterschiedlichen Kinasekaskaden organisiert, wurden bislang identifiziert: Extrazellulär-Signal-regulierte Kinasen (ERKs), JunN-terminale Kinasen (JNKs), die p38-Isozyme und die „Big“ MAP-Kinase (BMK1/ERK5) (Abb. 2). Alle vier Kaskaden werden nach Influenza-Virus-Infektion aktiviert. Während die Bedeutung des p38 und des BMK-1-Signalwegs in Influenza-Virus-infizierten Zellen noch im Unklaren liegt, scheint die Aktivierung der JNK-Kaskade eine antivirale Antwort darzustellen[4], welche durch die für IFNß-Expression notwendigen Transkriptionsfaktoren c-Jun und ATF-2 vermittelt wird (Abb. 2). Es verwundert daher nicht, dass das Virus diese Funktion bis zu einem tolerierbaren Limit unterdrückt. Das virale NS1-Protein ist ein Antagonist von Doppelstrang-RNA(dsRNA)-abhängigen antiviralen Antworten in der Zelle und reduziert die RNA-abhängige Aktivierung von JNK[7]. Im Gegensatz hierzu wirkt der ERK-aktivierende Signalweg, die Raf/MEK/ERKKaskade, eher virusfördernd[10]. Bei Inhibition des Signalwegs, etwa mit dem MEK-Inhibitor U0126, werden signifikant weniger Viren gebildet, was auf eine Funktionshemmung des viralen nukleären Exportproteins NEP/NS2 und dem Zurückhalten viraler Ribonukleoprotein (RNP)-Komplexe im Kern der infizierten Zelle beruht[10]. Untersuchungen zeigten, dass auch andere Viren von der Aktivität des Signalwegs abhängen[5]. Interessanterweise erfüllen Hemmstoffe der Signalkaskade weitere wichtige Voraussetzungen für eine potenzielle Verwendung als Influenza-Therapeutika: Breite Wirksamkeit gegen alle bislang untersuchten aviären und humanen Influenza-Viren[8, 10], Wirksamkeit im Tiermodell, sehr geringe Toxizität in Zellkultur und Tier[2, 9, 10], überraschend geringe Nebenwirkungen in klinischen Studien für andere Indikationen[2] und keinerlei erkennbare Tendenz zur Induktion resistenter Varianten[8]. κB Die Rolle von NF-κ Der Transkriptionsfaktor NF-κB ist ein wichtiger Regulator der proinflamatorischen und apoptotischen Genexpression. NF-κB Aktivierung erfolgt durch eine IκB-Kinase (IKK), welche durch Phosphorylierung des Inhibitors von NF-κB (IκB) dessen proteasomalen Abbau induziert (Abb. 2). Influenza-Viren aktivieren IKK und NFκB[5] sowohl nach produktiver Infektion als auch durch virale Komponenten wie dsRNA oder Expression der Proteine HA, NP und M1[1, 3]. Da viele antivirale Zytokine durch NF-κB reguliert werden, besteht die Lehrmeinung, dass NF-κB-Aktivierung eine rein antivirale Antwort auf Virusinfektion darstellt[1]. Jedoch scheint NF-κB auch virusfördernde Funktionen zu haben. Die Influenza-Virus-Vermehrung lässt sich durch dominant-negative Mutanten aus dem NFκB-Signalweg oder durch pharmakologische Inhibitoren von NF-κB hemmen, was vermutlich auf die NF-κB regulierte Expression BIOspektrum · Sonderausgabe · 10. Jahrgang Special pro-apoptotischer Faktoren zurückzuführen ist (eigene unveröffentlichte Daten). Weitere Untersuchungen werden zeigen, ob sich NF-κB auf Grund dieser Befunde als Ziel einer antiviralen Therapie eignet. Apoptose – Die zentrale Rolle von Caspase 3 Eine weitere Signalantwort in infizierten Zellen ist die Induktion des apoptotischen Zelltodes. Apoptose wird dabei hauptsächlich als antivirale Antwort betrachtet, da viele Viren anti-apoptotische Proteine exprimieren, um diese zelluläre Reaktion zu unterdrücken. Die zentrale Komponente der Apoptose-Maschinerie ist ein proteolytisches System von kaskadenartig hintereinander geschalteten Proteasen, den Caspasen. Obwohl Influenza-Viren in vitro und in vivo Apoptose induzieren, sind die Konsequenzen dieser zellulären Antwort weitgehend unklar. Neuere Untersuchungen zeigen, dass Inhibition von Caspasen, insbesondere von Caspase 3 zur effizienten Hemmung der Influenza-Virus-Vermehrung führt[12]. Auch hier zeigte sich ein Zurückhalten der viralen RNP-Komplexe im Kern der infizierten Zelle, ein Schritt im viralen Replikationszyklus, der abhängig vom zellulären Raf/MEK/ERK-Signalweg ist[10]. Dies war zunächst überraschend, da Caspaseaktivität nie mit aktiven Kernexportprozessen korreliert gefunden wurde. Es ist jedoch bekannt, dass Caspasen durch Spaltung von Proteinen in der Kernmembran die Ausschlussgrenze für passive Diffusion erhöhen. Dies legt die Hypothese nahe, dass der RNP-Transport durch zwei unabhängige induzierbare Mechanismen gefördert werden kann, wobei der aktive Raf/MEK/ERK-abhängige Transport graduell durch den passiven Caspase-vermittelten Export ersetzt wird. Entsprechend lässt sich die durch MEK-Inhibitoren erreichbare Hemmung der Virusvermehrung durch Kombination mit Caspase-Inhibitoren noch steigern[12]. Influenza-Viren scheinen die Fähigkeit erlangt zu haben, antivirale Signalantworten der Zelle teilweise für die eigene Vermehrung zu missbrauchen. Dies schafft jedoch Abhängigkeiten, die man für antivirale Ansätze ausnutzen könnte. Der zelluläre Raf/MEK/ERK-Signalweg ist ein viel versprechendes Beispiel, das Hoffnungen auf die mögliche Entwicklung einer neuen Form von Anti-Influenza-Medikamenten weckt. BIOspektrum · Sonderausgabe · 10. Jahrgang Literatur [1] Chu, W. M., Ostertag, D., Li, Z. W., Chang, L., Chen, Y., Hu, Y., Williams, B., Perrault, J., Karin, M. (1999): JNK2 and IKKbeta are required for activating the innate response to viral infection. Immunity 11:721–31. [2] Cohen, P. (2002): Protein kinases-the major drug targets of the twenty-first century? Nat Rev Drug Discov 1:309–15. [3] Flory, E., Kunz, M., Scheller, C., Jassoy, C., Stauber, R., Rapp, U. R., Ludwig, S. (2000): Influenza virus-induced NF-kappaB-dependent gene expression is mediated by overexpression of viral proteins and involves oxidative radicals and activation of IkappaB kinase. J Biol Chem 275:8307–14. [4] Ludwig, S., Ehrhardt, C., Neumeier, E. R., Kracht, M., Rapp, U. R., Pleschka, S. (2001): Influenza virus-induced AP-1-dependent gene expression requires activation of the JNK signalling pathway. J Biol Chem 276:10990–8. [5] Ludwig, S., Planz, O., Pleschka, S., Wolff, T. (2003): Influenza-virus-induced signalling cascades: targets for antiviral therapy? Trends Mol Med 9:46–52. [6] Ludwig, S., Pleschka, S., Wolff, T. (1999): A fatal relationship-influenza virus interactions with the host cell. Viral Immunol 12:175–96. [7] Ludwig, S., Wang, X., Ehrhardt, C., Zheng, H., Donelan, N., Planz, O., Pleschka, S., Garcia-Sastre, A., Heins, G., Wolff, T. (2002): The influenza A virus NS1 protein inhibits activation of Jun N-terminal kinase and AP-1 transcription factors. J Virol 76:11166–71. [8] Ludwig, S., Wolff, T., Ehrhardt, C., Wurzer, W. J., Reinhardt, J., Planz, O., Pleschka, S. (2004): MEK inhibition impairs influenza B virus propagation without emergence of resistant variants. FEBS Lett 561:37–43. [9] Planz, O., Pleschka, S., Ludwig, S. (2001): MEKspecific inhibitor U0126 blocks spread of Borna disease virus in cultured cells. J Virol 75:4871–7. [10] Pleschka, S., Wolff, T., Ehrhardt, C., Hobom, G., Planz, O., Rapp, U. R., Ludwig, S. (2001): Influenza virus propagation is impaired by inhibition of the Raf/MEK/ERK signalling cascade. Nat Cell Biol 3:301–5. [11] Sieczkarski, S. B., Brown, H. A., Whittaker, G. R. (2003): Role of protein kinase C betaII in influenza virus entry via late endosomes. J Virol 77:460–9. [12] Wurzer, W. J., Planz, O., Ehrhardt, C., Giner, M., Silberzahn, T., Pleschka, S., Ludwig, S. (2003): Caspase 3 activation is essential for efficient influenza virus propagation. EMBO J 22:2717–28. Korrespondenzadresse: Prof. Dr. Stephan Ludwig Institut für Molekulare Medizin (IMM) Universitätstraße 1 D-40225 Düsseldorf Tel.: 0211-811 5893 Fax: 0211-811 5892 [email protected] www.uniklinik-duesseldorf.de




