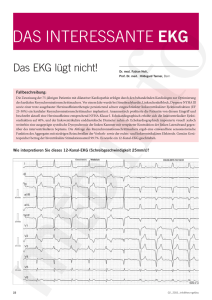
Untersuchungen zur biologischen Wirkung von Onchocerca
Werbung

Aus der Abteilung für klinische Chemie (ehem. Leiter: PD. Dr. F. W. Tischendorf) des Bernhard-Nocht-Instituts für Tropenmedizin Hamburg Institutsdirektor: Prof. Dr. B. Fleischer Untersuchungen zur biologischen Wirkung von Onchocerca-volvulus-Proteinen auf Monozyten / Makrophagen in vitro Dissertation zur Erlangung des Grades eines Doktors der Medizin dem Fachbereich Medizin der Universität Hamburg vorgelegt von Florestan Gerald Höckh geboren in Wiesbaden Hamburg 2005 Inhaltsverzeichnis Fragestellung 1 Einleitung 2 1. Ätiologie und Epidemiologie der Onchozerkose 2 2. Parasitologie des Erregers der Onchozerkose 3 3. Parasit-Wirt-Interaktion bei der Onchozerkose 6 4. Klinisches Erscheinungsbild der Onchozerkose 7 4.1 Hautveränderungen 8 4.2 Onchozerkombildung 9 4.3 Augenläsionen 10 5. Diagnostik der Onchozerkose 11 6. Bekämpfungs- und Therapiemaßnahmen bei der Onchozerkose 11 7. Immunantwort gegenüber Onchocerca volvulus 13 7. 1 Zelluläre Abwehrmechanismen 13 7. 2 Humorale Abwehrmechanismen 14 7. 3 Klassische und alternativ aktivierte Makrophagen 16 Material und Methodik 19 1. Reagenzien 19 2. Gewinnung von Onchocera-volvulus-Extrakt 23 2. 1 Materialgewinnung 23 2. 2 Nodulektomie und Isolierung von adulten O. volvulus 23 2. 3 Extraktherstellung 23 Inhaltsverzeichnis 3. Gewinnung humaner mononukleärer Zellen 24 3.1 Probanden 24 3.2 Blutabnahme 24 3.3 Erythrozytensediment und Gewinnung mononukleärer Zellen 24 4. Monozytenreinkultur 26 5. Zellkultur 26 6. Vollblutkultur 27 7. Durchflußzytometrie 28 8. ELISA 30 9. Auswertung und kommerzielle Computersoftware 33 Ergebnisse 34 1. Expression des Scavenger-Rezeptors CD163 auf stimulierten Monozyten 34 1.1 Optimierung der Bedingungen der Expression von CD163 im Durchflußzytometer 1.2 34 Expression des Scavenger-Rezeptors CD163 nach Stimulation mit Lipopolysaccharid 37 1.3 CD163-Expression nach Stimulation mit dem Steroid Ecdyson 38 1.4 CD163-Expression nach Stimulation mit Onchocerca-volvulus-Extrakt 40 1.4.1 CD163-Expression nach Stimulation mit Onchocerca-volvulus-Extrakt von Patienten, die mit Doxycyclin behandelt worden waren 44 1.5 CD163-Expression nach Stimulation mit Onchocerca-ochengi-Extrakt 45 1.6 CD163-Expression nach Stimulation mit den Onchocerca-volvulus-Antigenen Ov17, Ovv17 und Ov33 1.7 48 CD163-Expression nach Stimulation mit Wolbachienoberflächenprotein des Parasiten Dirofilaria immitis 49 Inhaltsverzeichnis 1.7.1 CD163-Expression nach Stimulation mit Fragmenten des Wolbachienproteins des Parasiten Brugia malayi 50 2. Interleukin-10-Freisetzung stimulierter Monozyten 51 2.1 IL-10-Freisetzung nach Stimulation mit Onchocerca-volvulus-Extrakt 51 2.1.1 IL-10-Freisetzung nach Stimulation mit Onchocerca-volvulus-Extrakt von Patienten, die mit Doxycyclin behandelt worden waren 52 2.2 IL-10-Freisetzung nach Stimulation mit Onchocerca-ochengi-Extrakt 53 2.3 IL-10-Freisetzung nach Stimulation mit Wolbachienoberflächenprotein des Parasiten Dirofilaria immitis 55 3. Expression des Makrophagen-Mannose-Rezeptors auf Monozyten 55 3.1 Expression des Makrophagen-Mannose-Rezeptors nach Stimulation mit Onchocerca-volvulus-Extrakt 55 3.1.1 Expression des Makrophagen-Mannose-Rezeptors nach Stimulation von gereinigten Monozyten mit Onchocerca-volvulus-Extrakt von mit Doxycyclin behandelten Patienten 3.2 Expression des Makrophagen-Mannose-Rezeptors nach Stimulation mit Onchocerca-ochengi-Extrakt 3.3 4. 57 59 Expression des Makrophagen-Mannose-Rezeptors nach Stimulation mit Wolbachienoberflächenprotein des Parasiten Dirofilaria immitis 60 Zentrale Ergebnisse 61 Diskussion 63 Zusammenfassung 73 Literaturverzeichnis 75 Anhang 95 1. Lebenslauf 95 2. Danksagung 96 3. Erklärung 97 Abkürzungen AaM Alternativ aktivierte Makrophagen AMAC-1 Asoziiertes CC-Chemokin alterantiv aktivierter Makrophagen Bm V1 V1-Peptid des Wolbachienoberflächenantigens von Brugia malayi Bm V3 V3-Peptid des Wolbachienoberflächenantigens von Brugia malayi CD Cluster of Differentiation DTH Immunantwort der verzögerten Überempfindlichkeit EDTA Ethylendiamintetraessigsäure ELISA Enzyme Linked Immunosorbent Assay FCS Fetales Kälberserum FITC Fluoresceinisothiocyanat GM-CSF Granulozyten-/Makrophagenkolonie stimulierender Faktor HEPES N-2-Hydroxyethylpiperazin-N-2-ethansulphonsäure IFN Interferon Ig Immunglobulin IL Interleukin IL-10 Interleukin-10 IL-1 RA Interleukin-1-Rezeptorantagonist LPS Lipopolysaccharid MIF Makrophagen-inhibierender Faktor MMR Makrophagen-Mannose-Rezeptor NO Stickoxid Ov Onchocerca volvulus Ov17 Onchocystatin Ovv17 Fragment des Onchocystatins Ov33 Asparaginproteaseinhibitor, 33kDa-Antigen von O. volvulus OvE Extrakt aus adulten Onchocerca volvulus unbehandelter Patienten OvE/D Extrakt aus adulten Onchocerca volvulus von Patienten, die vor Nodulektomie mit Doxycyclin behandelt worden waren OoE Onchocerca-ochengi-Extrakt PAF Thrombozyten-aktivierender Faktor PBS Phosphate Buffered Saline PGE Prostaglandin E PM Polymyxin B R-PE / PE R-Phycoerythrin RPMI Roswell Park Memorial Institute TNF Tumor-Nekrose-Faktor TGF Tumor-Wachstums-Faktor WSP Wolbachienoberflächenprotein (Wolbachia Surface Protein) von Dirofilaria immitis Fragestellung Alternativ aktivierte Makrophagen spielen bei der Immunantwort gegen Helminthen eine bedeutende regulierende Rolle (Maizels & Yazdanbakhsh, 2003). Trotz hoher Mikrofilariendichte kommt es bei der generalisierten Form der Onchozerkose nicht zu einer massiven Inflammation, wie es bei der Sowda-Form der Onchozerkose zu beobachten ist. Bei der Immunantwort der generalisierten Form der Onchozerkose stellt sich die Frage, ob Proteine des Parasiten O. volvulus alternativ aktivierte Makrophagen dahingehend stimulieren, daß diese eine antiinflammatorische Reaktion herbeiführen. In der vorliegenden Arbeit sollte experimentell geprüft werden, ob Onchocerca-volvulusProteine antiinflammatorische Faktoren in und auf Monozyten/Makrophagen induzieren können. Es sollten mononukleäre Zellen und Monozyten gesunder Probanden in Gegenwart von Extrakt adulter O. volvulus und einzelnen rekombinant exprimierten Proteinen in vitro kultiviert werden. Anschließend sollte die Expression von, für alternativ aktivierte Makrophagen charakteristischen Rezeptoren (CD163, MMR) auf den Zellen gemessen und im Überstand dieser Zellkulturen das Produkt von aaM, IL-10, bestimmt werden. 1 Einleitung 1. Ätiologie und Epidemiologie der Onchozerkose Die Onchozerkose ist weltweit die zweithäufigste infektiöse Erblindungsursache (WHO, 1995). So sind in der Republik Zentralafrika 2,2% von 6086 Individuen erblindet (Schwartz et al., 1997). Die Mehrheit der Erblindungen ist dort durch Onchozerkose bedingt (73,1%), der übrige Teil durch Katarakt (16,4%), Trachom (4,5%) oder Glaukom (2,2%). Ursache dieser chronisch verlaufenden Erkrankung (Flußblindheit) ist der Fadenwurm Onchocerca volvulus (Ordnung Spirurida, Überfamilie Filaroidea); er stellt eine der wichtigsten humanpathogenen Filarien dar. Onchocerca volvulus als Erreger der Onchozerkose wurde erstmals von einem deutschen Missionar in Ghana beschrieben. 1893 gab Leuckart dem Parasiten seinen Namen. Der Parasit kommt in 34 tropischen Ländern vor (Abb. 1). Vorwiegend kann O. volvulus auf dem afrikanischen Kontinent, an der Südspitze der arabischen Halbinsel sowie in Zentral- und Südamerika gefunden werden. Von den insgesamt über 120 Millionen weltweit in Risikogebieten lebenden Menschen sind ca. 18 Millionen mit O. volvulus infiziert (WHO, 1995). Abbildung 1: Epidemiegebiete der Onchozerkose (freundlicherweise von Prof. D. W. Büttner zur Verfügung gestellt) 2 Einleitung 2. Parasitologie des Erregers der Onchozerkose Je nach Region sind unterschiedliche Arten von Simulien (Kriebelmücken) für die Übertragung verantwortlich. In Westafrika wird O. volvulus durch Simulien des Simulium damnosum-Komplexes übertragen. Innerhalb des Komplexes kann man 25 Typen unterscheiden (WHO, 1995). Simulien leben und brüten bevorzugt an schnell fließenden Gewässern. Sie sind tagaktiv, exophil und können auf der Suche nach Brutplätzen Entfernungen bis zu 500 km zurücklegen (Garms, Walsh and Davies, 1979). Normalerweise ernähren sich Simulien von Pflanzensäften. Zum Heranreifen ihrer Eier benötigen die Weibchen jedoch Blut. Um an eine Blutmahlzeit zu gelangen, orientieren sie sich an Duftstoffen im Schweiß von Säugetieren. Bei der Blutmahlzeit nimmt das Simulienweibchen durch ihren kurzen Saugrüssel nach Setzen von Gewebszerstörungen Mikrofilarien mit der Gewebsflüssigkeit des Wirtes auf. Der Saugakt dauert ungefähr vier Minuten, bei dem die Simulie eine anästhetisch wirksame Substanz abgibt, um vom Wirt nicht gestört zu werden. Die aufgenommene Blutmenge beträgt ca. einen Mikroliter. Simulien fliegen dicht über der Erde und stechen Erwachsene vorwiegend in den Unterkörper, Kinder auch in den Oberkörper und Kopf (Duke & Beesley, 1958). Die Saugaktivität in Westafrika ist in den Morgenstunden und am späten Nachmittag am höchsten, d.h. wenn die Außentemperatur zwischen 18°C und 35°C liegt. In einigen Gebieten sind mehr als 90% der Erwachsenen mit O. volvulus infiziert (McMahon & Simonsen, 1996). Bevor die aufgenommenen Mikrofilarien die Flugmuskulatur der Simulie erreichen, müssen sie die Pharynxleiste und die peritrophische Membran des Insektenmagens überwinden und in das Haemocoel gelangen. Dabei sterben ca. 25-33% der Mikrofilarien (Brinkmann, 1982). In der Flugmuskulatur beginnen die Mikrofilarien sich intrazellulär zu ernähren. Nach zwei Häutungen wandern die dritten infektiösen Larvenstadien (L3) in den Kopf der Simulie. Von den Larvenstadien sterben ca. 15%. Die Infektionslarven sammeln sich in den Mundwerkzeugen und werden bei einem erneuten Blutmahl an den Wirt abgegeben. Die Entwicklung zur infektiösen Larve dauert je nach Umgebungstemperatur ein bis zwei Wochen. Nach Beobachtungen von B. Philippon und B. Quillevere (Philippon & Quillevere, 1977) sterben bis zu einem Drittel der Parasiten bei Nachttemperaturen von unter 18°C. 3 Einleitung Die L3 wandern durch das subkutane Fettgewebe des infizierten Menschen, häuten sich innerhalb von zwei bis sechs Tagen zum vierten Larvenstadium (Bianco et al., 1989; Strote & Bonow 1991). An dem komplexen Häutungsprozeß sind proteolytische Enzyme beteiligt, die die alte Kutikula von der neuen trennen (Lustigman et al., 1996). Aus dem vierten Larvenstadium entwickelt sich innerhalb von neun Monaten ein adulter Parasit. Es bilden sich fibröse Knoten (Onchozerkome) um weibliche Filarien, die in der Regel oberflächlich im Unterhautbindegewebe (Nelson, 1970; Albiez, 1978; Albiez et al., 1978), aber auch in tieferen Gewebsschichten (Kilian, 1988) liegen können. In diesen Knoten wachsen die weiblichen Filarien bis auf eine Länge zwischen 23 - 70 cm und einen maximalen Durchmesser von ca. fünf Millimeter heran. Sie liegen allein oder zu mehreren in diesen Knoten, die durch die Aggregation von Satellitenknoten im Lauf der Zeit immer größer werden. Stadium Adultes Weibchen Adultes Männchen Mikrofilarien Vorkommen Lebensdauer Subkutanes Bindegewebe und Onchozerkom (Mensch) Subkutanes Bindegewebe und Onchozerkom (Mensch) Vorwiegend in der Haut und selten im Bindegewebe (Mensch) bis zu 15 Jahre bis zu 15 Jahre ca. 1 bis 1,5 Jahre 1. Larvenstadium Flugmuskulatur (Simulie) ca. 4 Tage 2. Larvenstadium Flugmuskulatur (Simulie) ca. 2 Tage 3. Larvenstadium Kopf und Thorax (Simulie) ca. 2 bis 6 Tage 4. Larvenstadium Subkutanes Bindegewebe (Mensch) Präpatenz 1 Jahr Tabelle 1: Entwicklungsstadien und Lebensdauer (Duke, 1990). Männchen hingegen werden nur zwischen 6 - 13 cm lang und haben einen Durchmesser von ca. 0,15 mm (Burchard & Bierther, 1978; Burchard et al., 1979; Franz, 1979; Omar & Büttner, 1979). Sie leben ebenfalls in den Knoten und wandern nach der Befruchtung der Weibchen aus, um andere Knoten aufzusuchen. Der Mechanismus, der den Männchen die Wanderung durch die Bindegewebskapsel ermöglicht, ist noch nicht geklärt. Adulte Würmer leben bis zu 15 Jahre. In einem Zeitraum von 10 bis 15 Jahren 4 Einleitung bildet ein Weibchen Millionen von Mikrofilarien (WHO, 1995). Diese ca. 0,3 mm langen und im Durchmesser ca. 0,007 mm breiten Filarienlarven (Franz, 1979) können in der Haut des Menschen 6 bis 24 Monate überleben. Eine Übersicht über das Vorkommen und die Lebensdauer der Entwicklungsstadien von O. volvulus gibt die Tabelle 1 wieder. Der Kreislauf beginnt von neuem, sobald Mikrofilarien bei einem erneuten Saugakt von einer Kriebelmücke aufgenommen werden. Die Abbildung 2 zeigt den Lebenszyklus von O. volvulus. Lebenszyklus von O. volvulus Abbildung 2: Lebenszyklus von O. volvulus (nach A. Renz, Universität Stuttgart und WHO) 5 Einleitung 3. Parasit-Wirt-Interaktion bei der Onchozerkose Die Mikrofilarie ist das am häufigsten vorkommende Stadium des Parasiten im Menschen. Pro Tag und Weibchen schlüpfen durchschnittlich 700-1500 Mikrofilarien. Die Anzahl der adulten Weibchen ist auf 60 beschränkt. Ein infizierter Mensch kann über 12 Millionen Mikrofilarien beherbergen (Schulz-Key, 1990). In infizierten Menschen nimmt die Mikrofilariendichte von den Füßen zum Kopf hin ab. Die Mikrofilarien können durch die Kornea wandern und führen dort durch enzymale Reaktionen zu einer Sklerosierung und Entzündung der Kornea. Mikrofilarien von O. volvulus zeigen keine ausgeprägte Periodizität, wie sie bei anderen Filarien bekannt ist (z.B.: Wuchereria bancrofti). Die maximale Dichte wurde in Afrika und Guatemala mittags und am frühen Nachmittag gefunden (Duke, 1973; Duke & Moore, 1974; Anderson et al., 1975). Die Krankheitsmanifestationen werden überwiegend durch die inflammatorischen Reaktionen gegenüber Mikrofilarien hervorgerufen. Veränderungen der Haut, der Augen sowie der Lymphknoten können festgestellt werden. Erstaunlicherweise ist in den meisten Fällen trotz hoher Mikrofilariendichte die inflammatorische Reaktion eher schwach ausgeprägt (generalisierte Form der Onchozerkose; Ottesen, 1995). Die Sowda-Form der Onchozerkose (Sowda aus dem Arabischen „aswad“= schwarz) mit stark ausgeprägter Immunantwort gegen Antigene von Mikrofilarien tritt wesentlich seltener auf. Im Vergleich zu der generalisierten Form ist bei der Sowda-Form die Mikrofilariendichte weitaus geringer. Ottesen (1995) unterscheidet drei exponierte Personengruppen: I. Endemisch normale (mutmaßlich immune) Personen: Menschen, die in Endemiegebieten gewohnt haben oder noch wohnen, bei denen jedoch keine Infektion nachweisbar ist II. Patienten mit generalisierter Mikrofilardermie (generalisierte Form) der Onchozerkose: Sie zeigen Mikrofilarien in der Hautbiopsie, meist ohne klinische Hautmanifestationen III. Patienten mit chronisch-hyperreaktiver Form der Infektion (Sowda-Form): Die Patienten weisen eine lokalisierte Entzündung der Haut mit geringer Mikrofilariendichte auf 6 Einleitung Die Abtötungsrate von Mikrofilarien in einem Patienten ist abhängig von der bestehenden Parasitenlast, der Vitalität der Mikrofilarien und der Immunkompetenz des Wirtes. Mikrofilarien können von Entzündungszellen attackiert werden (Büttner & Rácz, 1983; Wildenburg et al., 1996). Die humorale Immunantwort auf parasitäres Antigen ist weitaus prominenter als die zelluläre Zellantwort (Ottesen, 1995). Sterbende Mikrofilarien lösen im Gegensatz zu lebenden Mikrofilarien lokale Entzündungsreaktionen aus. Es besteht eine Interaktion zwischen den Mikrofilarien und dem Immunsystem des Wirts auf der Basis von exkretorischen und sekretorischen Produkten. Der Parasit O. volvulus lebt in einer Symbiose mit Wolbachien, die zur Familie der Rickettsien gehören (Taylor & Hoerauf, 1999). Diese intrazellulär lebenden, gramnegativen Bakterien werden in der Hypodermis, den Oozyten, allen embryonalen Stadien und im Uterus des adulten Wurms sowie in Mikrofilarien gefunden und führen bei ihrem Fehlen oder ihrer Eliminierung nach Behandlung mit Doxycyclin zu einer langanhaltenden Sterilität des weiblichen Wurms (Hoerauf et al., 2000). Fast alle Filarienspezies beherbergen Wolbachien, die vertikal übertragen werden (Taylor et al., 1999). Es gibt vier Wolbachiengruppen, die mit A-D benannt werden. Verschiedene Individuen einer Untergruppe der gleichen Wirtsspezies zeigen eine identische Gensequenz des Wolbachienoberflächenproteins (WSP). In Nematoden kommen die Gruppen C und D vor (Bazzocchi et al., 2000). 4. Klinisches Erscheinungsbild der Onchozerkose Die Onchozerkose zeigt klinisch ein breites, fließend ineinander übergehendes Formenspektrum (Ottesen 1995, Brattig 2004), von der häufigen hyporeaktiven generalisierten Form mit geringer bis hoher Mikrofilariendichte der Haut bis hin zur seltenen hyperreaktiven Sowda-Form mit niedriger Mikrofilariendichte. Die Onchozerkose geht mit Knotenbildung (Onchozerkomen), Hautveränderungen wie Depigmentierung (Leopardenhaut), Atrophie (Papierhaut) und Pruritus einher. Der Korneabefall mit Mikrofilarien kann zur Erblindung führen, weshalb die Erkrankung auch den Namen Flußblindheit bekommen hat (Schäfer & Gümbel, 2004). 7 Einleitung 4.1 Hautveränderungen Die Hautveränderungen stehen in direkter Beziehung zur Mikrofilariendichte der Haut (Kreshaw et al., 1954). Das erste Zeichen ist oft starker Juckreiz und eine akute unspezifische Dermatitis mit stecknadelkopfgroßen, gleichförmigen Papeln. Bei längerem Bestehen der Infektion kann sich eine chronische Dermatitis ausbilden. „Craw Craw“ ist der ursprüngliche afrikanische Name dieses Krankheitsbildes, auch „Gale filarienne“ oder Onchodermatitis genannt. In Zentralamerika, wo die Veränderungen bevorzugt im Gesicht auftreten, nennt man dieses Krankheitsbild „Erisipela de la costa“. Abbildung derung 3: der Verän- Haut bei Onchozerkose (www.who.int) Bei handelt der es wesentlichen Schädigung Papierhaut sich im um eine und Ver- minderung der retikulären und elastischen Fasern in der oberflächlichen Kutisschicht. Eine dadurch bewirkte Lockerung der Haftstellen zwischen Epidermis und Kutis verursacht Reliefveränderungen, die makroskopisch zunächst als sogenannte „lizard skin“ und später bei ausgeprägter Atrophie mit papierdünner Haut das Bild der „crushed tissue paper skin“ bietet (Abb. 3). In Liberia traten diese Veränderungen ähnlich der normalen Hautalterung ohne gleichzeitige oder vorherige Dermatitis auf (Reber & Hoeppli, 1964; Schumacher, 1965). Wenn die Hautfaltenbildung über den ursprünglich vergrößerten inguinalen und femoralen Lymphknoten besonders ausgeprägt ist, spricht man von „hanging groins“ (Nelson, 1958; Büttner, 1998). Am Eindrucksvollsten ist die unregelmäßige Depigmentierung der Haut, vorwiegend prätibial (Browne, 1960). Differentialdiagnostisch müssen eine tuberkuloide Lepra, Depigmentierungen bei Treponematosen, insbesondere Framboesia tropica, eine Vitiligo, ein Arzneimittelexanthem und andere Dermatitiden abgegrenzt werden. 8 Einleitung 4.2 Onchozerkombildung Onchozerkome sind linsen- bis pflaumengroße Tumore, die über der Unterlage verschieblich und als rundliche bis ovale Knoten getastet werden können (Abb. 4). Die Sensitivität des palpatorischen Befundes von Onchozerkomen liegt bei 94-99% (Weiss, 1978; Albiez, 1978). Sie sind meist fester als Lymphknoten und Lipome, jedoch nicht so fest wie verkäsende Lymphknoten. Onchozerkome kommen in nahezu allen Körperregionen vor. Je nach Endemiegebiet wurden typische Verteilungsmuster beschrieben. An den Händen und Füßen, sowie im Gesicht kommen Onchozerkome praktisch nicht vor. Auch sind sie äußerst selten im Bereich der Unterschenkel und im Bereich der Bauchhaut anzutreffen. Vorwiegend im Hüftbereich verschmelzen oft mehrere Knoten zu größeren Konglomeraten mit unregelmäßiger Oberfläche. Geschwollene Lymphknoten können inguinal, femoral und auch axillär (Senker et al., 1973) oder generalisiert (Browne, 1959; Connor et al., 1970) vorkommen und die Folge einer lokalen Lymphadenitis sein. Abbildung 4: Vier bis fünf cm großes Onchozerkom über den linken Rippen eines ca. vier Jahre alten Jungen. (www.who.int) 9 Einleitung 4.3 Augenläsionen Lebende und tote Mikrofilarien können mittels Spaltlampe in der Kornea beobachtet werden (Boithias, 1958; Anderson & Fuglsang, 1973). Der Tod von Mikrofilarien in der Kornea führt zu einer begrenzten entzündlichen Reaktion, die eine unscharf begrenzte graue Trübung hinterläßt (Garner, 1976; Thylefors, 1978; Schäfer & Gümbel, 2004). Beschrieben als „flockige“ oder „schneeflockenartige“ Trübung präsentiert sich das Bild einer Keratitis punctata. Im frühen Stadium ist diese Augenveränderung noch reversibel (Lagraulet, 1971). Massive Invasion führt zur irreversiblen sklerosierenden Keratitis (Garner, 1976). Sie beginnt gewöhnlich am unteren Limbus der Kornea als grauer ödematöser Bezirk, in dem zahlreiche Mikrofilarien enthalten sind. Erreicht die sklerosierende Fläche die zentrale pupilläre Zone und wächst darüber hinaus, so erblindet das Auge (Abb. 5). Meist leiden Patienten mit einer sklerosierenden Keratitis gleichzeitig an einer Uveitis der vorderen Abschnitte (Anderson & Fuglsang, 1977). Abbildung 5: Sklerosierende Keratitis (www.stanford.edu) 10 Einleitung 5. Diagnostik der Onchozerkose Neben der Klinik sind die Palpation von Onchozerkomen sowie „skin snips“ (kleine Hautbiopsien) mittels Sklerastanze nach Walser zur Diagnoseerhebung entscheidend. Nach der Entnahme wird die Biopsie für 24 Stunden in 0,9 % NaCl-Lösung gegeben. Die Mikrofilarien verlassen das Biopsat und können anschließend mittels Mikroskop ausgezählt werden (Braun-Munzinger et al., 1977). Wenn die Hautbiopsie und die Palpation von Onchozerkomen negativ ausfallen, könnte man bei bestehendem Verdacht auf Onchozerkose den Mazzotti-Test (Mazzotti, 1948) anwenden. Dieser Test wird mittels einer einmaligen Dosis von 50 mg Diäthylcarbamazin (DEC) durchgeführt. Nach frühestens 15 Minuten, spätestens jedoch nach einem Tag, tritt ein starker Juckreiz und eventuell eine Urtikaria mit asymmetrischem Erythem auf. Die Reaktion ist an den Stellen am stärksten ausgeprägt, an denen die Konzentration der Mikrofilarien am höchsten ist. Gelegentlich kommt es zu leichtem Fieber, Unwohlsein und Schwellung der örtlichen Lymphknoten. Die Hauterscheinungen und der Juckreiz lassen im Verlauf von 3 bis 5 Tagen nach. Der Test ist negativ, sofern keine Mikrofilarien vorhanden sind. Bei hoher Filariendichte der Haut sollte aufgrund des massiven Untergangs von Mikrofilarien und einer daraus resultierenden Gefährdung des Patienten durch Schwindel, Atemnot und Kollaps kein Test angewandt werden. Der Test ist nicht spezifisch für O. volvulus. 6. Bekämpfungs- und Therapiemaßnahmen bei der Onchozerkose 1974 wurde in dem von Onchozerkose am schwersten betroffenen Gebiet Westafrikas (ca. 1 235 000 km2) ein Onchozerkose-Kontrollprogramm (OCP) gestartet. Die Bevölkerung des OCP-Gebietes betrug zu Beginn des Programms (1974) ca. 10 Millionen Einwohner, von denen mehr als eine Million an Onchozerkose litten; über 100 000 zeigten schwere Augenmanifestationen, 35 000 weitere waren bereits an den Parasiten erblindet. 1986 wurde das OCP-Gebiet erweitert. Die Strategie der WHO bezweckt die Reduktion der Simulienpopulation. Durch die Minimierung des Vektors wird die Häufigkeit der Transmission von Mikrofilarien auf 11 Einleitung den Menschen verringert. Per Flugzeug wurden über einen Zeitraum von 14 Jahren regelmäßig Insektizide über den Brutplätzen versprüht. Sieben Insektizide (Toxin von Bacillus shaericus und Bacillus thuringiensis var israelensis (B.t und H-14), Temephos (Abate), Pyraclofos, Phoxim, Permethrin, Carbosulfan und Vectron) wurden unter ständiger Kontrolle von Flora und Fauna in dem Programm eingesetzt. 1988 wurde das Programm auf Guinea, Sierra Leone, Südghana, Togo und Benin ausgeweitet, um die Reinvasion der Simulien in die OCP-Gebiete zu eliminieren. In den achtziger Jahren tauchte erstmals das Problem der zunehmenden Resistenz der Simulien gegen die verwendeten Insektizide auf. Daraufhin wurden als Konsequenz verbesserte Insektizide abwechselnd verwendet. In den frühen achtziger Jahren begann das erste medizinisch kontrollierte Therapieprogramm mit Ivermectin (Mectizan® Merck). Es wurde mit der Intention verabreicht, einer Erblindung der Erkrankten vorzubeugen. Im Jahre 1996 sind mehr als 2,6 Millionen Menschen mit Ivermectin im Gebiet des Programms behandelt worden (www.who.int). Hierbei kommt es zu einer Eliminierung der Wolbachien im weiblichen Wurm sowie zu einer massiven Abnahme der Mikrofilariendichte in der Haut. Nach 18 Monaten zeigten sich bei 90% der so behandelten Patienten keine Mikrofilarien mehr in der Haut (Hoerauf et al., 2001). Bei der Verabreichung von 150 µg/kg Körpergewicht Ivermectin werden nur Mikrofilarien, nicht aber adulte Filarien abgetötet. Da die geschlechtsreifen Würmer erneut Mikrofilarien hervorbringen, muß meist nach 6-12 Monaten erneut mit Ivermectin behandelt werden (Eddelston & Pierini, 1999). Nach neueren klinischen Studien führt eine Gabe von 100 mg/Tag Doxycyclin über sechs Wochen, verbunden mit einer einmaligen Gabe von 150 µg/kg Körpergewicht Ivermectin, zu einer weitgehenden Sterilisation des weiblichen Wurms (Hoerauf et al., 2001). 12 Einleitung 7. Immunantwort gegenüber Onchocerca volvulus 7.1 Zelluläre Abwehrmechanismen Die Immunmechanismen gegen O. volvulus sind komplex. Bei unbehandelten Patienten mit variierender Mikrofilariendichte der Haut kann eine massive Infiltration von eosinophilen Granulozyten und Makrophagen im Gewebe um sterbende oder tote Mikrofilarien beobachten werden (Büttner & Rácz, 1983). Die ansteigende Akkumulation von eosinophilen Granulozyten in Onchozerkomen hängt von der Mikrofilarienpräsenz ab (Wildenburg et al., 1996). Immunreaktionen gegen lebende, agile Mikrofilarien treten in histologischen Hautbiopsien von Patienten mit Mikrofilardermie meist nur nach mikrofilarizider Medikation auf (Darge et al., 1991). Neben eosinophilen Granulozyten und Makrophagen wird die Beteiligung von neutrophilen Granulozyten an der zellulären Immunantwort auf Mikrofilarien in der Haut beschrieben (Gutiérrez-Peña et al., 1996). Anhand der erhöhten Bluteosinophilie und der steigenden Konzentration zirkulierender kationischer eosinophiler Proteine (Tischendorf et al., 1996) kann die Beteiligung des Immunsystems am täglichen Umsatz von Mikrofilarien gezeigt werden. Bei Patienten mit gesicherter Sowda-Form zeigt sich im Gegensatz zur generalisierten Form ein Untergang von Mikrofilarien auch ohne mikrofilarizide Medikation (Büttner & Rácz, 1983). Sowda-Patienten haben eine verminderte Parasitenlast sowie wenige große Onchozerkome mit einem charakteristischerweise massiven inflammatorischen Infiltrat von Lymphozyten, Mastzellen, eosinophilen Granulozyten, neutrophilen Granulozyten und Makrophagen (Korten et al., 1998). Ein ähnliches Muster zeigt sich auch in den vergrößerten Lymphknoten. Eosinophile Granulozyten, neutrophile Granulozyten und Makrophagen besitzen die Fähigkeit, Mikrofilarien abzutöten (Büttner & Rácz, 1983; Korten et al., 1998). Bei der Sowda-Form, im Gegensatz zur generalisierten Form, kommt es zum Untergang von Mikrofilarien in vivo durch das Zusammenspiel von aktivierten inflammatorischen Zellen. Bei der generalisierten Form ist die Immunantwort supprimiert. T-Zellen und Antigen-präsentierende Zellen spielen offensichtlich eine wichtige Rolle in der Wegweisung der Immunantwort. 13 Einleitung Verschiedene In-vitro-Studien bestätigen das Vermögen eosinophiler und neutrophiler Granulozyten, Mikrofilarien und L3 zu bekämpfen (Greene et al., 1981; Johnson et al., 1994). Während eosinophile Granulozyten nach Aktivierung L3 direkt immobilisieren, werden zur Adhärenzreaktion an Mikrofilarien spezifische Antikörper zur Opsonierung benötigt. Nach der Häutung von L3 werden die L4-Stadien nicht mehr attackiert (Brattig et al., 1991). Im Tiermodell führen antikörperabhängige eosinophile Granulozyten kurz nach ihrem Eindringen in den Wirt zur Zerstörung von L3. Das Vorhandensein von Antikörpern und Effektorzellen scheint essentiell für die Immunantwort zu sein. Die Abhängigkeit von Interleukin-4 (IL-4) und IL-5 kennzeichnet diese Reaktion als T-Helfer2-Antwort (Th2-Antwort). Unter Berücksichtigung der vorherrschenden T-Helferzellen bei der Regulation der Immunantwort gegen Mikrofilarien und L3 zeigte sich ein Unterschied bei putativ Immunen (PI), Patienten mit Sowda und Patienten mit generalisierter Onchozerkose. Bei der generalisierten Form dominierte eine Th2-Antwort. Einzelne Berichte beschrieben eine Th1-Antwort für putativ Immune (PI; Elson et al., 1995). Die Mehrzahl der Publikationen beschreibt jedoch für PI oder endemisch unauffällige Personen eine gemischte Th1/Th2- Antwort (Soboslay et al., 1997; Brattig et al., 1997; Doetze et al., 1997; Turaga et al., 2000). Interferon-γ (IFN-γ) und IL-5 sind die bei PI am häufigsten gefundenen Zytokine. Im Vergleich zu Patienten mit der Sowda-Form und putativ immunen Personen zeichnen sich Patienten mit einer generalisierten Onchozerkose, besonders bei Patienten mit hoher Parasitenlast, durch einen Status der Suppression des Immunsystems aus (Cooper et al., 1998). Bei Patienten mit generalisierter Form wurde, im Gegensatz zu Patienten mit Sowda und putativ immunen Personen, eine geringe Proliferation peripherer mononukleärer Blutzellen als Antwort auf Onchocerca-volvulus-Extrakt (OvE) beobachtet (Steel & Nutman, 1993; Elson et al., 1995; Soboslay et al., 1997; Doetze et al., 2000). 7.2 Humorale Abwehrmechanismen Die Aufgabe der humoralen Abwehr ist die Neutralisierung und Eliminierung körperfremder Antigene und Pathogene. Bei der Aktivierung der B-Zellen zu 14 Einleitung Plasmazellen spielen Th2-Zellen eine entscheidende Rolle. Die Antigenbindungsstellen bestimmen die Spezifität der Antikörper. Die Isotypen der konstanten Domäne der schweren Ketten bestimmen hingegen die Wirkungsfunktion. Zunächst werden IgM und IgD, gefolgt von IgG und IgE exprimiert. Bereits einen Monat nach Infektion mit O. volvulus können Immunglobuline nachgewiesen werden (Taylor, 1994). Isotypen von IgG weisen Unterschiede in ihrer funktionellen Eigenschaft auf. IgG1 und IgG3 können die Komplementkaskade aktivieren und reagieren nach Bindung des spezifischen Antigens mit Fc-Rezeptoren auf der Effektorzelle der antikörperabhängigen zellulären Zytotoxizität (Van de Winkel & Capel, 1993). Komplementproteine (C3b) spielen eine wichtige Rolle bei der Adhäsionsreaktion von eosinophilen und neutrophilen Granulozyten (Medina de la Garza et al., 1990; Brattig et al., 1991). IgG4 kann weder Komplement aktivieren noch vermag es Fc-Rezeptoren von Effektorzellen nach Bindung von Antigendeterminanten zu aktivieren. Die Konzentration der Fc-Rezeptor- und Komplement-bindenden IgG3 sind bei putativ immunen Personen in einer höheren Konzentration nachweisbar als bei Patienten mit der generalisierten Form der Onchozerkose (Boyer et al., 1991). Patienten mit generalisierter Onchozerkose bilden hingegen charakteristischerweise in hoher Konzentration IgG4, die mit Hilfe von Extrakt der Onchocerca-volvulus-Würmer (OvE) nachgewiesen wurden (Bradley & Unnasch, 1996). Patienten mit hoher Mikrofilariendichte zeigen hohe IgG4-Titer, die mit einer supprimierten T-Zellantwort korrelieren (Maizels et al., 1995). Die Bildung von IgG4 wird durch IL-4 induziert, das von Th2-Zellen sezerniert wird (Wierenga et al. 1990). Im Gegensatz zu putativ immunen Patienten mit einer gemischten Th1/Th2-Antwort wurde eine stark ausgeprägte Th2-Antwort gegen OvE in Sowda-Patienten beobachtet (Brattig et al., 1997; Turaga et al., 2000). Sowda-Patienten produzieren hohe Konzentrationen von IgG1, IgG3 (Brattig et al, 1994) und IgE (Mpagi et al., 2000) gegen Onchocerca-volvulus-Antigene. Die IgG3-Antwort gegen OvE korrelierte negativ mit der Mikrofilariendichte (Dafa’alla et al., 1992). Es wird angenommen, daß eine Th2-vermittelte, Antikörper- und Granulozyten-abhängige Immunantwort zur Zerstörung von Mikrofilarien, aber auch zur Inflammation der Haut wie bei der Sowda-Form führt. 15 Einleitung 7.3 Klassische und alternativ aktivierte Makrophagen Antigen-präsentierende dendritische Zellen (DZ) haben den ersten Kontakt mit Parasiten und reagieren daraufhin mit generischen Reaktionen, wie z.B. Zytokinfreisetzung und Antigenpräsentation, mit denen eine T-Zellantwort eingeleitet wird (Reis e Sousa, 2001). Die klassische Aktivierung von Makrophagen wird durch Interferon-γ (IFN-γ) induziert, welches getriggert durch mikrobiologische Substanzen wie Lipopolysaccharid zu einer Produktion von proinflammatorischen Zytokinen wie Interleukin-6, Tumor-Nekrose-Faktor und IL-1 sowie Stickoxid (NO) führt. Neben klassisch aktivierten, Immunantwort-stimulierenden DZ ist auch seit einigen Jahren bekannt, daß die Immunantwort supprimierende Zellen bei chronisch infizierten Menschen (Piessens et al., 1980) und Tieren (Lammie & Katz, 1983) aufweist. Spätere Studien zeigten die Rolle von IL-10, das bei der Suppression der Immunreaktion von Makrophagen freigesetzt wird (Allen & Loke, 2001). Akzessorische Zellen, wie Makrophagen, die keine Antigen-spezifischen Rezeptoren exprimieren, üben eine immunmodulierende Wirkung auf die Antigen-spezifische Immunantwort von Lymphozyten aus. Durch Nematoden aktivierte Makrophagen sind größer, haben mehr Vakuolen und ein anderes Profil exprimierter Gene als klassische Makrophagen (Maizles & Yazdanbakhsh, 2003). An Stelle der Produktion von inflammatorischem NO wird in diesen Zellen die Expression von Arginase (die mit dem Substrat der Stickstoffoxidsynthase konkurriert) hochreguliert. Eine alternative Aktivierung von Monozyten/Makrophagen (aaM) wird im Gegensatz zur klassischen Aktivierung durch antiinflammatorische Substanzen wie IL-4 (Stein et al., 1992; Schebesch et al., 1997), Glukokortikoide, wie Dexamethason (Kodelja et al., 1994; Djemadji-Oudjiel et al., 1996; Sorg et al., 2000), IL-10 (Zlotnik & Moore, 1992; Kodelja et al., 1998; Williams et al., 2002), IL-13 (Gordon, 2003) und TGF-ß (Takeuchi et al., 1997) ausgelöst. AaM sezernieren funktionell relevante Moleküle und exprimieren Rezeptoren mit Spezifität für Pathogen-assoziierte molekulare Muster (PAMP). Diese Muster werden dem angeborenen Immunsystem zugerechnet (Gordon 2003). Der cysteinreiche Scavenger-Rezeptor Typ1 CD163 (Djemadji-Oudjiel et al., 1996; Kodelja et al., 1997; Högger et al., 1998; Droste et al., 1999), der ß-Glukan-Rezeptor 16 Einleitung (Mosser & Handman, 1992) sowie der Makrophagen-Mannose-Rezeptor (Stein et al., 1992; Kodelja et al., 1997) werden bei diesen Makrophagen vermehrt exprimiert und sind Marker für aaM. CD163 ist ein membranständiger Rezeptor von aaM, der auch in löslicher Form vorkommen kann (Droste et al., 1999). IL-6, Glukokortikoide wie Dexamethason und antiinflammatorisches IL-10 induzieren die Expression von CD163 auf Monozyten/ Makrophagen. Herunterreguliert wird der Rezeptor von proinflammatorischen Mediatoren wie LPS, IFN-γ und TNF-α (Högger et al., 1998; Büchler et al., 2000). Der cysteinreiche Scavenger-Rezeptor CD163 besteht aus einem aminoterminalen Signalelement, einer transmembranen Domäne von 24 Aminosäuren und neun kurzen, zytoplasmatischen Domänen (Van den Heuvel et al., 1999; Møller et al., 2002). CD163 ist beteiligt bei der Adhäsion des Monozyten an Endothelzellen (Wenzel & Sorg, 1996; Van den Heuvel et al., 1999) sowie bei der Kalzium-Mobilisation, der Inositoltriphosphatproduktion und Sekretion von IL-6 und GM-CSF (Van den Heuvel et al., 1999). CD163 wirkt als Schlüsselmolekül, wie das Plasmaprotein Haptoglobin bei der Clearance und Wiederverwertung von Hämoglobin zerstörter Erythrozyten. An CD163 gebundenes Haptoglobin und Hämoglobin wird vom Makrophagen endozytiert (Madsen et al., 2001). Die Rezeptor-Ligand-Interaktion ist kalziumabhängig und weist eine hohe Affinität auf (Kristiansen et al., 2001). CD163 ist am stärksten auf Makrophagen und nur zu 50% auf den peripheren Blutmonozyten exprimiert (Sulahian et al., 2000). Der Makrophagen-Mannose-Rezeptor (MMR) gehört zu der Gruppe der c-Typ-Lectine und dient der Erkennung, Bindung und Phagozytose von einfachen exprimierten Zuckern von Pathogenen (Lipoglykane und Glykoproteine) (Stein et al., 1992). MMR bestehen aus fünf Domänen. Eine lektinreiche Domäne, die aus 8-10 Kohlenhydratbindenden Regionen besteht, ist für die Erkennung von Mannose und Fruktose verantwortlich (Stahl et al., 1998; Napper et al., 2001). MHC Klasse II-Moleküle werden zusammen mit dem MMR durch Stimulation des Makrophagen mit IL-4 heraufreguliert (Stein et al., 1992; Kodelja et al., 1997). Die Erhöhung der Expression beider Rezeptoren führt zu einer Verbesserung der Antigenpräsentation. Weitere Mediatoren und Induktoren von aaM sind in der Diskussion dargestellt (Tabelle 2). 17 Einleitung Zur Identifizierung von aaM in vitro können monoklonale Antikörper, z.B. gegen CD163 oder MMR eingesetzt werden. Es zeigte sich ein gehäuftes Vorkommen von aaM in der Plazenta (Mues et al., 1989) und Lunge (Fireman et al., 1988), während der Heilphase akuter Entzündungen, bei chronisch entzündlichen Erkrankungen wie Psoriasis und rheumatischem Fieber, in Wundheilungsgewebe (Schebesch et al., 1997) und in Fremdkörpergranulomen (Goerdt & Kodelja, 1994). Es wird angenommen, daß aaM eine systemische Gegenregulation zu inflammatorischen Prozessen darstellt. So scheint bei einer Sepsis die massive Ausschüttung proinflammatorischer Zytokine (IL-1 und TNF-α) durch Freisetzung von Glukokortikoiden, welche zu einer alternativen Aktivierung von Makrophagen führt, unter Kontrolle gebracht zu werden (Wilckens & de Rijk, 1997). 18 Material und Methodik 1. Reagenzien Medien und Zusätze: HEPES Sigma-Aldrich Company, Deisenhofen RPMI 1640 Sigma Ficoll-Hypaque ICN Biomedicals Inc. Ohio, USA Percoll Pharmacia Biotech, Amsterdam, Niederlande Penicillin 100 IU/ml und Streptomycin 100µg/ml GIBCO/BRL, Karlsruhe Fetales Kälberserum Biochrom KG, Berlin Plasmasteril Fresenius Kabi Deutschland GmbH PBS Sigma Humanes Serum AB-Serum, Universitätsklinikum Eppendorf, Hamburg Polymyxin Sigma Stimulanzien: Interleukin-4 Biomol, Hamburg, Interleukin-10 R&D Systems, Wiesbaden GM-CSF Borstel, Hamburg LPS von E. coli Sigma PGE2 Cayman, Ann Arbor, USA Dexamethason und Ekdyson Sigma 19 Material und Methodik Parasitenextrakte und -proteine: Onchocerca volvulus-Extrakt (OvE) BNI, Hamburg Onchocerca ochengi-Extrakt (OoE) BNI, Hamburg Aspartylproteaseinhibitor (Ov33) Dr. R. Lucius, Humboldt Universität, Berlin Onchocystatin (Ov17) Dr. R. Lucius Ov17-Fragment (Ovv17) Dr. R. Lucius O. volvulus-Extrakt von Patienten mit Doxycyclinbehandlung vor Nodulektomie Drs. A. Hoerauf & D. W. Büttner, BNI OvE-Lipid Dr. D. Steinhart, BNI Wolbachienoberflächenproteine (WSP) Dr. C. Bandi, Istituto di Patologia aus Dirofilaria immitis Generale Veterinaria, Mailand, Italien Fragment V1 und V3 des Wolbachien- Dr. G. Tzertzinis, New England Bioleps, oberflächenproteins aus Brugia malayi Beverly, USA Monoklonale Antikörper: Anti-CD163-Antikörper und RM 3/1 BMA Biomedicals AG, Augst, Schweiz Anti-Makrophagen-Mannose-Rezeptor Becton Dickinson PharMingen, USA Anti-Human-IL-10-Antikörper Becton Dickinson PharMingen, Anti-CD14-Antikörper Cymbus Biotechnology, Hants, UK Antikörper-Enzym-Konjungate: Biotinylierter Ratten-Antikörper gegen humanes IL-10, konjungiert mit AvidinMeerrettichperoxidase (Becton Dickinson PharMingen) 20 Material und Methodik Weitere Reagenzien: Essigsäure Merck, Darmstadt, Deutschland Salzsäure Merck Tween20 Sigma Substrat für ELISA, Reagenz A und B Becton Dickinson PharMingen 0,1 M Carbonat, pH 9,5 Merck Plastik- und Glaswaren: Koagulationsröhrchen Monovette, Sarstedt, Nümbrecht, D Serumröhrchen Monovette, Sarstedt Heparinröhrchen Monovette, Sarstedt Einwegpipetten Monovette, Sarstedt FACS-Röhrchen Becton Dickinson, Mountain View, USA Mikrotiterplatten Nunclon, Dänemark 96-Napf Polystyrol-FlachbodenMikrotiterplatte Maxi-Sorp, NUNC, Wiesbaden Einwegpipetten Greiner Labortechnik, Frickenhausen Kanülen Becton Dickinson, Dublin, Irland Kryotube NUNC, Wiesbaden Pipettenspitzen Sarstedt Spritzen Sarstedt Sterilfilter 0,2µm Schleicher & Schuell, Dassel 50ml, 14ml, 1ml Reagenzröhrchen Falcon, N.J., USA 21 Material und Methodik Laborgeräte und Software: Brutschrank Inkubator IG 150, Jouan FACscan Flow Cytometer (Durchflußzytometer) Becton Dickson, Mountain View CellQuest (V3.3) FACS-Software Becton Dickson Glashomogenisator Ten Broek-Homogenisator Mikroskop HBO 50 Zeiss ph-Meter CG 840 Schott Plattenphotometer Dynatech MR 5000, Denkendorf Pipette Eppendorf, Hamburg Schüttler MTS 2 Janke & Kunkel StatView SAS Institute Inc., www.statview.com Sterile Arbeitsbank NUNC, Wiesbaden Zentrifugen Hettich, Rotanta/RP & Eppendorf 22 Material und Methodik 2. Gewinnung von Onchocerca-volvulus-Extrakt 2.1 Materialgewinnung Die Onchozerkomata wurden in Benin in der Feldforschungsstation Covè des BernhardNocht-Instituts für Tropenmedizin operativ entfernt. Die Patienten wurden vor Nodulektomie in ihrer Sprache über den Verbleib der Knoten informiert. 2.2 Nodulektomie und Isolierung von adulten Onchocerca volvulus Onchozerkomata wurden chirurgisch entfernt und die Würmer durch Kollagenaselösung nach der Methode von Schulz-Key et al. 1977 bei 35°C auf dem Schüttler zur Verdauung der Bindegewebskapsel inkubiert. Je nach Knotendurchmesser wurde bei <1,5 cm großen Knoten 0,5%-ige, bei Knoten mit einem Durchmesser von >1,5 cm 1%-ige Kollagenaselösung verwendet. Aus kleineren Knoten wurden Würmer nach achtstündiger Inkubation, bei größeren erst nach 12-20 h vorsichtig durch Wegspülen der Knotenreste unter dem Stereomikroskop isoliert. Die Würmer wurden in flüssigem Stickstoff gefroren und in Stickstoffcontainern direkt nach Hamburg in das Bernhard-Nocht-Institut für Tropenmedizin transportiert. 2.3 Extraktherstellung 40 Weibchen wurden einzeln unter der Sterilbank jeweils vier Stunden in sterilem PBS gewaschen, um die noch übriggebliebene Kollagenase zu entfernen. Nach dem Waschen wurden die Weibchen auf ein steriles Filterpapier gelegt, um abtropfende PBS zu minimieren. Danach wurden die Weibchen in einem mit Stickstoff gekühlten Mörser unter wiederholter Zugabe von flüssigem Stickstoff zerrieben und anschließend als Pulver in 2 ml PBS gelöst. 23 Material und Methodik Nach 30 Minuten Kühlung und Überführung in ein gekühltes, 4,5 ml fassendes Kryotube wurde das Tube 10-mal mit Ultraschall jeweils mit einer Minute Pause behandelt. Die Suspension wurde 3-mal in flüssigem Stickstoff eingefroren und wieder aufgetaut. Schließlich wurde die Wurmsuspension für eine Stunde bei 4°C mit 100 000 x g in der Ultrazentrifuge zentrifugiert und der Überstand entnommen, die Proteinkonzentration nach Bradford bestimmt und der Extrakt bei einer Konzentration von 1 mg/ml bei minus 30°C in Portionen eingelagert. Der Extrakt wurde auf einer Blutagarplatte auf Sterilität geprüft. 3. Gewinnung humaner mononukleärer Zellen 3.1 Probanden Das Blut von gesunden Probanden zwischen 23 und 40 Jahren wurde zur Blutkultur verwendet. 3.2 Blutabnahme Dem Probanden wurden 30 bis 40 ml Blut in „Coagulation-9NC-Röhrchen“ sowie 10 ml Blut in Serumröhrchen abgenommen. Das nicht koagulierte Blut wurde unter der Sterilbank in zwei 50 ml fassende Tubes unter sterilen Bedingungen überführt und 1:2 mit Kulturmedium (RPMI 1640) verdünnt. 3.3 Erythrozytensediment und Gewinnung mononukleärer Zellen Das verdünnte Blut wurde unter der Sterilbank vorsichtig auf 15 ml einer 58%-igen sterilen Percoll-Suspension in PBS geschichtet und in einer Zentrifuge (Rotanta/RP, 24 Material und Methodik Hettich) bei 600 x g und bei 4°C für 20 bis 30 Minuten ohne Bremse auslaufend in drei Phasen aufgetrennt. Die obere Phase enthält das Plasma, oberhalb der mittleren Phase (Percoll) liegen die mononukleären Zellen. Diese wurden mittels einer Einwegpipette aus Plastik in ein 50 ml fassendes Tube gegeben. Die untere Phase stellt die Fraktion der Erythrozyten dar und konnte verworfen werden. RPMI 1640 wurde unter sterilen Bedingungen mit Penicillin 100 IU/ml und Streptomycin 100 µg/ml sowie 5%-igem autologen humanen Serum versehen. Das Tube mit den vom Percollgradienten abpipettierten Zellen wurde mit diesem Kulturmedium bei 400 x g für zehn Minuten bei Raumtemperatur in der Laborzentrifuge gewaschen, das Sediment in ein 12 ml fassendes Tube unter der Sterilbank überführt und mit Kulturmedium auf 10 ml aufgefüllt. Die Zellen wurden ein weiteres Mal bei 400 x g für zehn Minuten bei Raumtemperatur zentrifugiert, das Sediment steril mit zwei Milliliter Kulturmedium resuspendiert und auf Eis gelagert. In den ersten Versuchen wurden die Zellen mit Hilfe eines Ficollgradienten aufgetrennt. Unter diesen Bedingungen setzten die isolierten, unstimulierten Zellen verstärkt Interleukin-1-Rezeptor-Antagonisten (IL-1-RA) frei. Ficoll wurde auf Grund dessen nicht weiter zum Auftrennen der Zellen verwendet. Beim Ficollgradienten wurde das Blut 1:2 in zwei 50 ml fassenden Tubes unter der Sterilbank mit Kulturmedium (RPMI 1640) verdünnt. Es wurden 15 ml Ficoll in ein 50 ml fassendes Tube gefüllt und das verdünnte Blut unter der Sterilbank vorsichtig auf das Ficoll pipettiert. Der Gradient wurde bei 600 x g und 20°C für 20 bis 30 Minuten in der Laborzentrifuge (Rotanda/RP, Hettich) ungebremst auslaufend zentrifugiert. Die mononukleären Zellen oberhalb der Ficollphase wurden mit einer Einwegpipette unter sterilen Bedingungen abgesaugt, mit Kulturmedium (RPMI 1640) verdünnt, bei 400 x g für 10 Minuten bei Raumtemperatur zentrifugiert und auf Eis gelagert. 20 µl der Zellsuspension wurden mit 3%-iger Essigsäure in einer Neubauer-Zählkammer (Boxer) gezählt. 25 Material und Methodik 4. Monozytenreinkultur Periphere mononukleäre Zellen (PBMC) wurden im Forschungszentrum Borstel (AG Dr. M. Ernst) aus heparinisiertem Vollblut gesunder Blutspender mittels Ficoll (1,077 g/ml, Pharmacia, Freiburg) und Dichtegradientenzentrifugation (465 x g, 45 Min., 22°C) isoliert (Grage-Griebenow et al., 1993). Die mononukleären Zellen wurden über der Ficollphase abgenommen, in HBSS (Biochrom) (465 x g, 15 Min., 4°C) gewaschen und ein zweites Mal in HBSS mit fetalen Kälberserum (FCS, 298 x g, 15 Min., 4°C) zentrifugiert, um die Zellfragmente von intakten Zellen zu trennen. PBMC wurden in Monozyten und Lymphozyten unter Verwendung des LE-6BElutriationssystems (Beckman Instruments Inc., Palo Alto, CA, USA) durch Gegenstromzentrifugation getrennt. Maximal 2 Millionen Zellen/ml wurden in HBSS mit 0,1% BSA verdünnt und in einer standardisierten Kammer bei initialer Durchflußrate von 25 ml/Min., 1720 x g und 12°C zentrifugiert. Im Anschluß daran wurde die Durchflußrate schrittweise gesenkt, um elutriierte Lymphozyten- und Monozytenfraktionen zu erhalten. Die isolierten Monozyten wurden innerhalb von drei Stunden kultiviert. Als Kulturmedium wurde FCS oder humanes AB-Serum verwendet. 5. Zellkultur Die Zellen wurden in einer Mikrotiterplatte im Kulturmedium mit Antibiotika und 5% FCS (reine Monozyten) oder mit autologem Serum (mononukleäre Zellen) kultiviert. Zu den Zellen wurde GM-CSF in einer finalen Konzentration von 1000 U/ml (Van den Heuvel et al., 1999) hinzugefügt. Pro Kavität wurden anfangs 0,6 Millionen mononukleäre Zellen, später die gleiche Anzahl gereinigter Monozyten in 100 µl verwandt. Zu Optimierung der Kultivierungsbedingungen wurden Petrischalen mit hydrophober Bodenfolie „PetriPerm“ (Vivascience, Göttingen) getestet (Buechler et al., 2000). Sie ergaben in den Versuchen jedoch keine Verbesserung. Es wurden der jeweilige 26 Material und Methodik Stimulus unter der Sterilbank und anschließend 0,6 Millionen Zellen pro Ansatz steril in das Mikrotiterloch pipettiert. Diese Zellen wurden bei 37°C und einem Luftanteil im Brutschrank von 5% Kohlendioxyd für einen Zeitraum von ein bis sechs Tagen inkubiert (Van den Heuvel et al., 1999). In den meisten Fällen wurden die Kulturen nach drei oder sechs Tagen beendet, die Mikrotiterplatte mit den Zellen auf Eis gelagert und durch Zentrifugation bei 400 x g für 10 Minuten der Überstand von den zellulären Bestandteilen getrennt. Der Überstand wurde bei minus 28°C eingefroren, um später für den ELISA zur Verfügung zu stehen. Sofern die Zellen nicht anschließend im Durchflußzytometer zur Rezeptorbestimmung verwendet wurden, erfolgte eine Fixierung mit 8% Paraformaldehyd. Anfangs wurde mit mononuklearen Zellen gesunder Spender gearbeitet, mit denen Testdurchläufe der verschiedenen Stimuli durchgeführt wurden. Im Anschluß an die Testdurchläufe und bei Stimuli, wie z. B. Wolbachienproteine, wurden gereinigte Monozyten aus dem Forschungszentrum Borstel verwendet. 6. Vollblutkultur Zu 10 ml Heparinblut wurden 90 ml Iscove Medium mit 50 IU/ml Na-Heparin und 0,1% Humanserum unter der Sterilbank hinzugegeben. Anschließend wurden je 200 µl in eine Mikrotiterplatte pipettiert und mit den jeweiligen Stimulanzien versehen. Die Kultur wurde drei und sechs Tage im Brutschrank bei 37°C mit 5% Kohlendioxydanteil der Luft und gesättigter Raumfeuchtigkeit inkubiert. Um grobe bakterielle Verunreinigungen auszuschließen, wurde die Titerplatte mikroskopiert. Nach dem Zentrifugieren der Zellen wurde der Überstand abgenommen und bei minus 28°C eingefroren. Die Zellen wurden 15 Minuten im Dunkeln und bei 4°C mit 10 µl des Antikörpers inkubiert, danach wurde 0,5 ml FACS Lyselösung (1:10) zugegeben, die Erythrozyten im Dunkeln 15 Minuten lysiert und anschließend im Durchflußzytometer gemessen. 27 Material und Methodik 7. Durchflußzytometrie Das Durchflußzytometer mißt die Intensität der Fluoreszenz, die von einer Zelle mit Fluorescein-markierten Antikörpern ausgeht. Die Intensität reflektiert die Expression des getesteten Rezeptors. Nach dem Waschen in PBS mit anschließendem Abzentrifugieren wurden die Zellen in ein 5 ml fassendes Reagenzröhrchen überführt und mit dem jeweiligen Antikörper inkubiert. Pro Ansatz wurden folgende mit Fluorescein-Isothiocyanat (FITC) und R-Phycoerythrin (R-PE) markierte Antikörper (10 µl pro Ansatz) verwendet: (1) FITC-markierte Antikörper gegen CD14 und CD163 sowie Kontroll-FITCReagenz (2) R-PE-markierte Antikörper gegen CD163, RM3/1 und Makrophagen-MannoseRezeptor sowie Kontroll-PE-Reagenz. Inkubiert wurde auf dem Schüttler über 15 Minuten bei 4°C im Kühlschrank. Die ungebundenen Antikörper wurden danach ausgewaschen und der Überstand nach Zentrifugieren (400 x g / 10 Minuten) verworfen. Das Pellet wurde aufgeschüttelt und die Intensität der Fluoreszenz je Zelle mit dem Durchflußzytometer (FACS: Fluorescence Activated Cell Sorter) gemessen. Die Zellen wurden zuvor auf eine Konzentration von ca. 0,1 Millionen Zellen pro ml gebracht. Bei der Messung im FACS werden die Zellen über ein Schlauchsystem durch einen Meßkopf (Abb. 6) gedrückt, der eine enge Kapillare (zwischen 50 und 100 µm) besitzt. Der laminare Flüssigkeitsstrom ermöglicht nur jeweils einer einzelnen Zelle die Passage der Öffnung. Etwa in die Mitte dieses Flußkanals wird ein Laserstrahl fokussiert, der auf die vorbeifließenden Zellen trifft. Er wird durch die Zellen kleinwinklig oder großwinklig abgelenkt. Dabei werden durch den Laserstrahl Fluoreszenz- oder Lumineszenzerscheinungen aktiviert. 28 Material und Methodik Abbildung 6: Durchflußzytometer (FACS) 29 Material und Methodik Verarbeitet werden die Ablenkungen des Laserstrahls durch einen nachgeschalteten Digital-Analogwandler zusammen mit einem Computer, der mit der dafür notwendigen Software (ZellQuest) ausgestattet ist. So können die Größe, das Volumen und die Struktur der Zellen sowie Oberflächenbindungen wie Rezeptorbindungen mit fluoreszierenden Antikörpern gemessen werden. Die Daten werden im Computer aufgearbeitet und können auf dem Bildschirm in unterschiedlicher Darstellung, beispielsweise als Histogramm oder als „Dot Blot“ dargestellt und gespeichert werden. Hierbei wird der quantitative Anteil eines Parameters in Relation zur Stärke des Signals dargestellt. Weiter können diese Histogramme untereinander zu sogenannten Zytogrammen kombiniert werden, wobei die unterschiedlichsten Parameter miteinander kombiniert werden können. Durch das Ausblenden mittels „Gaten“, d.h. isoliertes Betrachten der Monozyten/ Makrophagen- und Granulozytenpopulation im Zytogramm wurden Zelltrümmer weitgehend bei der Messung ausgegrenzt. Somit konnte die Rezeptorexpression auf unzerstörten Zellen genauer ermittelt und Störeffekte beseitigt werden. Die Granularität der Zellen wird durch den Sideward-Scatter und die Größe der Zellen mit dem ForwardScatter dargestellt, die in einem „Dot Blot“ zur Beurteilung der Zellen dienen. Das Ergebnis wurde jeweils mit dem unstimulierten Wert, einer Positivkontrolle und einer Negativkontrolle, betrachtet. 8. ELISA Immunchemisch wurde IL-10 in Zellkulturüberständen mit Hilfe der semiquantitativen ELISA-Technik („enzyme linked immunosorbent assay“, Abb. 7) nachgewiesen. Bei diesem Verfahren wird in der Probe vorhandenes Interleukin durch spezifische Antikörper („coating antibody“) an die Wand einer 96-Well-Flachboden-Mikrotiterplatte gebunden (1). Über einen biotinylierten Ratten-Antikörper gegen andere Epitope des humanen IL-10 wird die IL-10-Konzentration semiquantitativ durch die Absorption im Plattenphotometer (Dynatech MR 5000, Denkendorf) gemessen. Der biotinylierte Ratten-Antikörper wird mit Avidin-Meerrettichperoxidase kombiniert (2), um nach 30 Material und Methodik Abbildung 7: ELISA-Technik („enzyme linked immunosorbent assay“) Inkubation und Waschen das Substrat hinzuzugeben (3). Das Enzym des Konjungates führt mit dem Substrat zu einer meßbaren Farbstoffreaktion (4). 31 Material und Methodik Zur Konzentrationsbestimmung der Probe wurden IL-10-Eichkurven verwendet. Als Positivkontrolle wurde eine Probe einer über drei Tage stimulierten Kultur mit 1 ng/ml LPS verwendet. Es wurden 10 µl, 50 µl und 75 µl der Probe pro 100 µl Kavität eingesetzt und Doppelbestimmungen durchgeführt. Die Beschichtung der Mikrotiterplatten erfolgte jeweils am Vortag des Testes. Der monoklonale Anti-Human-IL-10Antikörper der Ratte wurde in 0,1 M Carbonatpuffer pH 9,5 verdünnt. Je Kavität wurden 100 µl in die Mikrotiterplatte pipettiert und über Nacht inkubiert. Nach anschließendem dreimaligen Waschen mit PBS/Tween (0,05% Tween-20 in PBS) wurden mit 200 µl 10% FCS in PBS pro Kavität freie Bindungsstellen geblockt und über eine Stunde bei Raumtemperatur inkubiert. Die Proben- bzw. Antigenzugabe (1) erfolgt nach weiterem dreimaligen Waschen mit 200 µl PBS/Tween pro Kavität. Anschließend wurde die absteigende Verdünnungsreihe des Standards pipettiert. Zwei Kavitäten dienten als Leerkontrolle für das Substrat. Von den Proben wurden jeweils 50 µl und 10 µl verwendet. Die Proben inkubierten zwei Stunden bei Raumtemperatur, bevor die Platte wieder mit 200 µl PBS/Tween pro Kavität dreimal gewaschen wurde. Als Konjugat wurden pro Kavität 100 µl Lösung verwendet. Das Konjugat setzt sich zusammen aus biotinyliertem Ratten-Antikörper gegen humanes IL-10 gebunden an Avidin-Meerrettichperoxidase als Enzym in 10% FCS in PBS im Verhältnis von 1:250. Nach einer weiteren Stunde Inkubation wurde die Mikrotiterplatte siebenmal mit je 200 µl PBS/Tween gewaschen. Nach dem Waschen wurden pro Kavität 100 µl Substrat eingesetzt. Die nach ca. 10 Minuten einsetzende Enzymreaktion, erkennbar an der Blaufärbung, wurde mit je 50 µl 1M Salzsäure gestoppt. Es trat eine sichtbare Farbreaktion von blau zu gelb ein. Innerhalb von 10 Minuten nach der Säurezugabe wurde die Extinktion des Produkts bei 450 nm und der Referenzwellenlänge von 570 nm gemessen. Mit Hilfe der Referenzansätze von Interleukin-10 wurde aus den Extinktionswerten die jeweilige Konzentration bestimmt. Je Probe und Konzentration wurden Doppelbestimmungen durchgeführt, deren Mittelwert verwendet wurde. Mittelwerte verschiedener Versuchsreihen mit gleichen Ansätzen wurden berechnet und als Durchschnittswert angegeben. 32 Material und Methodik 9. Auswertung und kommerzielle Computersoftware Die Mittelwerte der verschiedenen Versuchsreihen wurden tabellarisch nach Kulturdauer und Zellart aufgelistet. Zur Auswertung und Berechnung der Daten wurde das Programm STAT View (Abacus Concepts, USA) und als Werte die Mittelwerte des jeweiligen Stimulus verwendet. Die Darstellung erfolgte über Box Plot mit Standardabweichung sowie deskriptiver Statistik. Die Validität wurde mittels gepaarten t-Tests überprüft. Ausgedruckte FACS-Histogramme die im FACS-Computer durch das Programm CellQuest (USA) erstellt wurden, wurden wie Bilder mittels Scanner (Epson Perfection 1260) als Dateien im Computer mit Photoshop 6.0 (USA) verarbeitet. 33 Ergebnisse 1. Expression des Scavenger-Rezeptors CD163 auf stimulierten Monozyten 1.1 Optimierung der Bedingungen der Expression von CD163 im Durchflußzytometer Eine Exposition von mononukleären Zellen mit Dexamethason führt zur signifikanten Expression von CD163 auf der Zellmembran von Monozyten und diente in den folgenden Versuchen als Positivkontrolle. Die optimale Dexamethasonkonzentration wurde mit Hilfe von Verdünnungsreihen mit den Konzentrationen 10, 20, 40, 100, 200, 300 und 400 ng/ml ermittelt. Nach drei und sechs Tagen Kultur mit Dexamethason wurde die Intensität der Rezeptorexpression auf Monozyten bestimmt (Van den Heuvel et al., 1999). Die optimale Konzentration von Dexamethason liegt zwischen 40 und 200 ng/ml (Abb. 8; Van den Heuvel et al., 1999; Büchler et al., 2000). Für die Rezeptorexpression (U) Konzentration 40 ng/ml war die Expression nach drei Tagen am stärksten (Abb. 9). 200 Abbildung 8: Dargestellt ist die Dosiswirkungskurve der 150 Expression von CD163 nach zwei 100 Tagen Kultur von mononukleären Zellen mit 50 dem Stimulus Dexamethason. Es wurde der Median 0 0 100 200 300 400 Dexamethason (ng/ml) der CD163-Expression Abwesenheit methason von vom in Dexa- jeweiligen Median nach Stimulation mit Dexamethason subtrahiert, so daß die induzierte Expression abzüglich der konstitutiven Expression dargestellt wird. 34 Ergebnisse Expression (U) Expression (U) 1000 1000 100 100 10 10 1 0 40 1 200 Dexamethason (ng/ml) 0 40 200 Dexamethason (ng/ml) Abbildung 9: Die Abbildungen präsentieren Boxplots mit Perzentilen (10, 25, 50, 75 und 90%) und Ausreißerwerten (o) der Medianwerte der FACS-Analyse der CD163Rezeptorexpression. Mononukleäre Zellkulturen wurden mit 40 ng/ml und 200 ng/ml Dexamethason (Dex) über drei (linke Abbildung) und sechs Tage (rechte Abbildung) stimuliert und im Vergleich zu unstimulierten Zellkulturen dargestellt. Links: t-Test: Dexamethason 40 P: 0,059; Dexamethason 200 P: 0,043; rechts: t-Test: Dexamethason 40 P: 0,232; Dexamethason 200 P: 0,025 In den Histogrammen der Abbildungen 10 und 11 sieht man eine Rechtsverlagerung des Fluoreszenz-Peaks, d.h. die Zunahme der Fluoreszenz und somit der Rezeptorexpression nach Stimulation mit Dexamethason. Nach Stimulation mit 40 ng/ml und 200 ng/ml Dexamethason über drei Tage ist die Rezeptorexpression von CD163 annähernd gleich (Abb. 10). Abbildung 10: Die mittels FACS bestimmte Rezeptorexpression von CD163 auf Monozyten mononukleärer Zellkulturen nach drei Tagen Stimulation mit 40 ng/ml Dexamethason (rote Fläche), 200 ng/ml Dexamethason (grüne Linie) im Verhältnis zu unstimulierten Zellen (schwarze Linie) ist in dieser Abbildung dargestellt. Versuchsnummern: Links 140400 404+405+403; Mitte 170400 504+505+503; rechts 140700 006+008+001 35 Ergebnisse 200 ng/ml Dexamethason über sechs Tage Kultur ergab die größte Rechtsverschiebung der CD163-Expression auf Monozyten mononukleärer Zellkulturen (Abb. 11). Abbildung 11: Die CD163-Expression von gereinigten Monozyten nach sechs Tagen Stimulation mit 40 ng/ml (rote Fläche) und 200 ng/ml Dexamethason (grüne Linie) sind hier dargestellt. Das rechte Histogramm zeigt die Expression nach Stimulation mit 10 ng/ml LPS (rote Fläche) und 5 ng/ml IL-4 (grüne Linie) im Vergleich zu unstimulierten Zellen (schwarze Linie). Versuchsnummern: links 170400 204+205+203; Mitte 270400 106+107+103; rechts 190201 014+013+008 Dexamethason 200 ng/ml mit zusätzlich 5 ng/ml IL-10 oder IL-4 bzw. 5 ng/ml IL-4 zusammen mit IL-10 wurden in den Versuchen ebenso wie 5 ng/ml IL-4 (Abb. 11 rechts) getestet. Die mit den genannten Stimulanzien kultivierten Monozyten exprimierten deutlich mehr CD163, als unstimuliert kultivierte Monozyten. Des weiteren wurden 400 ng/ml Cortison mit 2,5 pg/ml IL-4 als Positivkontrolle erfolgreich verwendet. Cortison mit IL-4 hatte jedoch keinen so starken Effekt auf die Rezeptorexpression wie Dexamethason 40 oder 200 ng/ml (Abb. 12). Dexamethason ergab in den Konzentrationen 40-200 ng/ml die besten Ergebnisse (Abb. 9) und wurde in diesen Konzentrationen als Positivkontrolle verwendet. Abbildung 12: Gereinigte Monozyten drei wurden über (linkes Histogramm) bzw. sechs Tage (rechtes Histogramm) mit 10 ng/ml Lipopolysaccharid (LPS, rote Fläche) oder 400 ng/ml Cortison mit 2,5 pg/ml IL-4 (grüne Linie) stimuliert und im Vergleich mit unstimulierten Zellen (schwarze Linie) dargestellt. Versuchsnummern: links 230201 008+007+001; rechts 190201 014+013+008 36 Ergebnisse 1.2 Expression des Scavenger-Rezeptors CD163 nach Stimulation mit Lipopolysaccharid Als Negativkontrolle wurde Lipopolysaccharid (LPS) in der Konzentration 1 und 10 ng/ml verwendet (Djemadji Ondjiel et al., 1996; Van den Heuvel, 1999; Büchler et al., 2000). Lipopolysaccharid ergab in der Konzentration von 1 ng/ml nach drei Tagen eine leichte und nach sechs Tagen keine signifikante CD163-Rezeptorexpressionserhöhung mehr (Abb. 13 und 14). Expression (U) Expression (U) 1000 1000 100 100 10 10 1 1 Leerwert LPS Leerwert Dex LPS Dex Abbildung 13: Dargestellt sind die Boxplots der CD163-Expression auf Monozyten der mononukleären Zellfraktion nach dreitägiger (linke Abbildung) und sechstägiger Stimulation (rechte Abbildung) mit LPS 1 ng/ml (LPS), Dexamethason 200 ng/ml (Dex) und ohne Stimulus (Leerwert). Rechts: t-Test: LPS P: 0,875; Dex P: 0,043; links: t-Test: LPS P: 0,319; Dex P: 0,025 37 Ergebnisse Abbildung 14: Keine erhöhte CD163-Expression auf Monozyten der mononukleäre Zellfraktion zeigte sich nach dreitägiger (obere drei Histogramme) bzw. sechstägiger (untere drei Histogramme) Stimulation mit 1 ng/ml LPS (rote Fläche) im Vergleich zu unstimulierten Zellen (schwarze Linie). Versuchsnummern: oben links 070400 213+203; oben Mitte 170400 511+503; oben rechts 140400 111+103; unten links 160300 062+058; unten Mitte 170400 211+203; unten rechts 050500 111+103 1.3 CD163-Expression nach Stimulation mit dem Steroid Ecdyson Neben Dexamethason wurde geprüft, ob das Steroid Ecdyson zu einer vermehrten CD163-Expression führt. Verwendet wurden die Konzentrationen 20 bis 400 ng/ml in bis zu sieben Tage dauernden Kulturen. Nach Stimulation ergab sich jedoch nur eine geringe CD163-Rezeptorexpressionserhöhung auf Monozyten der mononukleären Zellfraktion. Die Stimulation mit 40 ng/ml bzw. 200 ng/ml Ecdyson in sechstägiger Kultur zeigte im Durchschnitt die höchste Expression des CD163-Rezeptors auf den Monozyten der mononukleären Zellkulturen (Abb. 15). 38 Ergebnisse Expression (U) Expression (U) 100 1000 100 10 10 1 0 20 40 1 200 Ecdyson (ng/ml) Leer 20 40 200 Ecdyson (ng/ml) Abbildung 15: Medianwerte und Boxplots nach dreitägiger (links) und sechstägiger Kultur (rechts) mononukleärer Zellen stimuliert mit Ecdyson (Ecd) Links: t-Test: Ecd 20 P: 0,719; Ecd 40 P: 0,338; Ecd 200 P: 0,374; rechts: t-Test: Ecd 20 P: 0,759; Ecd 40 P: 0,285; Ecd 200 P: 0,206 Die Histogramme zeigen nach sechs Tagen Stimulation mit 200 ng/ml Ecdyson in Einzelfällen eine geringfügige Expressionszunahme für CD163 auf Monozyten der mononukleären Zellfraktion. Nach dreitägiger Kultur war keine signifikante Zunahme erkennbar (Abb. 16). Dexamethason, das ein potenteres Glukokortikoid als Ecdyson ist, ergab nach Stimulation mononukleärer Zellen eine erhöhte Expression des Rezeptors CD163 auf Monozyten. Aufgrund der geringfügigen Erhöhung der CD163-Expression (Abb. 16) nach drei und sechs Tagen Stimulation mononukleärer Zellen mit verschiedenen Ecdysonkonzentrationen wurde Ecdyson nicht bei Versuchen mit gereinigten Monozyten verwendet. 39 Ergebnisse Abbildung 16: CD163-Rezeptorexpression auf Monozyten der mononukleären Zellfraktion nach dreitägiger Stimulation (obere drei Histogramme) mit 200 ng/ml Ecdyson (rote Fläche) im Vergleich zu 200 ng/ml Dexamethason (grüne Linie) und unstimulierten Zellen (schwarze Linie) Versuchsnummern: oben links 140400 109+105+103; oben Mitte 140400 409+405+403; oben rechts 240400 305+307+303; unten links 160300 035+027+025; unten Mitte 170400 209+205+203; unten rechts 270400 105+107+103 1.4 CD163-Expression nach Stimulation mit Onchocerca-volvulus-Extrakt Onchocerca-volvulus-Extrakt stimulierte dosisabhängig die Expression von CD163 auf Monozyten. Sie war am deutlichsten ausgeprägt bei den Konzentrationen 20 bis 50 µg/ml. Nach einer Kultivierungsdauer von drei und sechs Tagen ergab sich eine erhöhte Expression des Rezeptors CD163 auf Monozyten der mononukleären Zellfraktion sowie auf gereinigten Monozyten, die deutlich über dem Kontrollwert, jedoch unter der Positivkontrolle (Dexamethason 40 ng/ml) lag (Abb. 17). Der Mittelwert der Rezeptorexpression von CD163 auf Monozyten der mononukleären Zellfraktion nach drei und sechs Tagen Stimulation mit 50 µg/ml Onchocerca-volvulusExtrakt war rund viermal höher als der Mittelwert der Leerwerte (Abb. 17). Ebenso 40 Ergebnisse zeigte sich nach Stimulation von reinen Monozyten mit 20-30 µg/ml Onchocercavolvulus-Extrakt über drei Tage eine statistisch signifikante Erhöhung der CD163Expression um das Vierfache des Leerwertes, wobei sich nach sechstägiger Kultur nur das Dreifache des Leerwertes darstellte (Abb. 17). Expression (U) Expression (U) 1000 1000 100 100 10 10 1 1 Leerwert OvE Dex Leerwert OvE Dex Expression (U) Expression (U) 100 100 10 10 1 1 Leerwert Leerwert OvE OvE Abbildung 17: CD163-Expression auf Monozyten der mononukleären Zellfraktion (obere Abbildung) nach Stimulation mit 50 µg/ml Onchocerca-volvulus-Extrakt (OvE) und auf gereinigter Monozyten nach Stimulation mit 20-30 µg/ml OvE (untere Abbildung) über drei Tage (links) bzw. sechs Tage (rechts) im Vergleich zu Medianwerten unstimulierter (Leerwert) und Medianwerten mit Dexamethason 40 ng/ml (Dex) stimulierter Zellen Oben links: t-Test: OvE P: 0,569; Dex P: 0,087; oben rechts: t-Test: OvE P: 0,369; Dex P: 0,544; unten links: t-Test: OvE P: 0,059; unten rechts: t-Test: OvE P: 0,193 41 Ergebnisse In den Histogrammen erkennt man eine Rechtsverschiebung der Fluoreszenz, d. h. eine Zunahme der Expression des CD163-Rezeptors auf den kultivierten Monozyten. Sie war nach sechstägiger Kultur stärker ausgeprägt als nach drei Tagen Kultur (Abb. 18). Des Weiteren kann man häufig eine Zweigipfligkeit nach Stimulation von Monozyten mit OvE erkennen, die auf zwei Monozytenpopulationen, eine mit hoher und eine mit geringer CD163-Expression hindeutet. Abbildung 18: Die Histogramme zeigen die monozytäre CD163-Rezeptorexpression jeweils dreier Versuche nach dreitägiger (obere Histogramme) bzw. sechstägiger Stimulation (untere Histogramme) von reinen Monozytenkulturen mit 30 µg/ml (links und Mitte, rote Fläche) und 20 µg/ml Onchocerca-volvulus-Extrakt (rechts, rote Fläche) im Vergleich zu unstimulierten Zellen (schwarze Linie). Versuchsnummern: oben links 230201 004+001; oben Mitte 081200 002+001; oben rechts 240800 031+029; unten links 050301 013+009; unten Mitte 260201 006+001; unten rechts 111200 002+001 In der Zellverteilung reiner Monozyten verlagert sich nach Stimulation mit Onchocercavolvulus-Extrakt im Verlauf von sechs Tagen die Hauptzellpopulation in einen Bereich höherer Granularität. Es fällt auf, daß sich nach Stimulation mit Onchocerca-volvulusExtrakt eine CD163-exprimierende Population abgespalten hat (Abb. 19 und 20), die im Vergleich zu den anderen zwei Populationen eine größere Granularität (FSC-H) aufweist. 42 Ergebnisse Abbildung 19: Die drei Bilder links zeigen jeweils die Zellverteilung von unstimulierten Monozyten. Auf der rechten Seite ist die Verteilung der Zellen nach Stimulation mit OvE (oben und Mitte 30 µg/ml, unten 100 µg/ml) nach dreitägiger Kultur dargestellt. FSC-H: Zellgröße; SSC-H: Zellgranularität Abbildung 20: Gereinigte Monozyten wurden mit Onchocerca-volvulus-Extrakt (jeweils rechtes Bild) über sechstägig kultiviert, wobei das jeweilig linke Histogramm unstimuliert kultivierte Zellen repräsentiert. FSC-H: Zellgröße; Zellgranularität 43 SSC-H: Ergebnisse 1.4.1 CD163-Expression nach Stimulation mit Onchocerca-volvulus-Extrakt von Patienten, die mit Doxycyclin behandelt worden waren Für gereinigte Monozyten, die mit Onchocerca-volvulus-Extrakt von Doxycyclin behandelten Patienten über drei und sechs Tage stimuliert worden waren, ergab sich keine vermehrte Expression des CD163-Rezeptors auf Monozyten (Abb. 21). Expression (U) Expression (U) 100 100 10 10 1 1 Leerwert OvE Leerwert OvE/D OvE OvE/D Abbildung 21: Abgebildet sind die Medianwerte der CD163-Rezeptorexpression nach Stimulation von gereinigten Monozyten über drei Tage mit 20-30 µg/ml Extrakt aus Würmern unbehandelter Patienten mit Onchozerkose (OvE) und Extrakt von mit Doxycyclin behandelten Patienten (OvE/D) im Vergleich zu unstimulierten Zellen (Leerwert) Links: t-Test: OvE P: 0,059; OvE/D P: 0,357; rechts: t-Test: OvE P: 0,193; OvE/D P: 0,109 Die unterschiedliche Expression des CD163-Rezeptors nach Stimulation mit Onchocerca-volvulus-Extrakt (OvE) und Extrakt von Patienten, die mit Doxycyclin behandelt wurden (OvE/D), wird in den Histogrammen der Abbildung 22 verdeutlicht. Es zeigt sich keine deutliche Rechtsverschiebung des Fluoreszenzmaximums und somit keine Erhöhung der Expression von CD163 auf Monozyten nach Stimulation mit OvE/D, während sie nach Stimulation mit OvE vorhanden ist. 44 Ergebnisse Abbildung 22: Gereinigte Monozyten wurden über drei Tage mit Onchocercavolvulus-Extrakt von Patienten, die mit Doxycyclin behandelt wurden (OvE/D, rote Fläche) bzw. mit Onchocerca-volvulus-Extrakt von unbehandelten Patienten (OvE, grüne Linie) in einer Konzentration von 30 µg/ml (oben links und unten Mitte), 20 µg/ml (oben Mitte und unten rechts) bzw. 50 µg/ml (oben rechts) stimuliert und mit den unstimulierten Zellen (schwarze Linie) verglichen. Versuchsnummern: oben links 081200 003+002+001; oben Mitte 240800 034+031+029; oben rechts 240800 033+030+029; unten links 111200 003+002+001; unten Mitte 260201 005+006+001; unten rechts 120301 015+014+010 1.5 CD163-Expression nach Stimulation mit Onchocerca-ochengi-Extrakt Nach Stimulation mit Extrakt aus O. ochengi (OoE) zeigte sich eine geringe Expression von CD163 auf den stimulierten Monozyten. Die CD163-Rezeptorexpression war nach drei Tagen Stimulation mit Onchocerca-ochengi-Extrakt ca. Zweieinhalbmahl höher als die unstimulierter Monozyten. Nach sechs Tagen hatten die Expression von CD163 wieder abgenommen und belief sich auf das Zweifache des Leerwertes (Abb. 23, 24 und 25). 45 Ergebnisse Expression (U) Expression (U) 100 100 10 10 1 1 Leerwert OoE Leerwert OoE Abbildung 23: Dargestellt sind die Medianwerte der CD163-Expression von gereinigten Monozyten nach drei Tagen (linke Abbildung) und sechs Tagen Kultur (rechte Abbildung) mit 30-50 µg/ml (linke Abbildung) bzw. 30 µg/ml (rechte Abbildung) OoE im Vergleich zu unstimulierten Kulturen (Leerwert). Links: t-Test: OoE P: 0,083; rechts: t-Test: OoE P: 0,280 Abbildung 24: Expression von CD163 auf gereinigten Monozyten, die über drei (obere Histogramme) und sechs Tage (untere Histogramme) mit 30 µg/ml (rechtes oberes Histogramm mit 50 µg/ml) mit OoE stimuliert worden waren (rote Fläche). Die Expression von CD163 auf unstimulierten Zellen, ebenfalls über sechs Tage kultiviert, ist durch die schwarze Linie dargestellt. Versuchsnummern: oben links 240800 037+029; oben rechts 230201 006+001; unten links 260201 007+001; unten Mitte 190201 012+008; unten rechts 050301 014+009 46 Ergebnisse Expression (U) Expression (U) 100 100 10 10 1 1 Leerwert OoE Dex Leerwert OoE Abbildung 25: Die linke Abbildung zeigt die Expression von CD163 auf Monozyten der mononukleären Zellfraktion nach sechstägiger Stimulation mit 50 µg/ml OoE, die rechte Abbildung, die gereinigte Monozyten mit 30-50 µl/ml OoE. Die Medianwerte werden mit denen unstimulierter Zellen (Leerwert) und denen der Positivkontrolle Dexamethason 40 ng/ml (Dex), verglichen. Links: t-Test: OoE P: 0,369; Dex P: 0,544; rechts: t-Test: OoE P: 0,095 Monozyten mononukleärer Zellfraktionen zeigten gegenüber dem Leerwert nach drei und sechs Tagen Kulturdauer keine signifikante Erhöhung der Rezeptorexpression von CD163 nach Stimulation mit 50 µg/ml Onchocerca-ochengi-Extrakt (Abb. 26). Abbildung 26: Es wurden mononukleäre Zellen über drei Tage (oben) bzw. sechs Tage (unten) mit OoE (oben links 10 µg/ml; unten links 20 µg/ml; oben rechts, unten Mitte und unten rechts 50 µg/ml, rote Fläche) und 200 ng/ml Dexamethason (grüne Linie) stimuliert und im Vergleich zu unstimulierten Zellen (schwarze Linie) dargestellt. Versuchsnummern: oben links 140400 414+405+403; oben rechts 140400 415+405+403; unten links 040900 004+001; unten Mitte 210200 004+002; unten rechts 210200 008+006 47 Ergebnisse 1.6 CD163-Expression nach Stimulation mit den Onchocerca-volvulus-Antigenen Ov17, Ovv17 und Ov33 Die als Stimuli eingesetzten Onchocerca-volvulus-Antigene Onchocystatin bzw. Onchocystatinfragment (Ov17 bzw. Ovv17) und Asparaginproteaseinhibitor (Ov33) ergaben keine signifikante Erhöhung der Expression von CD163 auf gereinigten Monozyten nach zwei, drei und sechs Tagen Stimulation (Abb. 27) in den Konzentrationen 5, 50, 100, 150 und 200 nM pro Kulturansatz. Aufgrund dessen wurden diese Onchocerca-volvulus-Antigene aus den Versuchen herausgenommen. Abbildung 27: Dargestellt ist die CD163-Expression nach drei Tagen Kultur von gereinigten Monozyten mit Ov17 (oben) bzw. Ovv17 (Mitte) und Ov33 (unten, rote Fläche) zu unstimulierten Zellen (schwarze Linie). Als Stimuli wurden jeweils 5 nM (linkes Histogramm) und 150 nM (rechtes Histogramm) der Antigene verwendet. Versuchsnummern: oben links 161299 069+067; oben rechts 161299 068+067; Mitte links 161299 074+067; Mitte rechts 161299 075+067; unten links 161299 071+067; unten rechts 161299 072+067 48 Ergebnisse 1.7 CD163-Expression nach Stimulation mit Wolbachienoberflächenprotein des Parasiten Dirofilaria immitis Die CD163-Rezeptorexpression wurde auch auf mit Oberflächenprotein von Wolbachien (WSP) stimulierten Monozyten untersucht. Wolbachien sind in Symbiose mit der Filarie O. volvulus lebende Endobakterien. WSP von Dirofilaria immitis zeigt eine mit Onchocerca identische Gensequenz (Bazzocchi et al., 2000). Gereinigte Monozyten wurden mit WSP in den Konzentrationen 3, 10, 20 µg/ml über drei Tage stimuliert. Bei der Konzentration 10 µg/ml ergab sich nach drei Tagen die höchste CD163-Expression (Abb. 28). Nach sechs Tagen Stimulation mit einer Konzentration von 20-25 µg/ml WSP waren die Mediane der CD163-Rezeptorexpression bedeutend höher, bei der Konzentration von 10 µg/ml WSP nur leicht höher als die des Leerwertes (Abb. 29). 35 30 kurve von WSP. Es wurden Monozyten über drei Tage mit 3, 10 und 20 µg/ml WSP Expression (U) Abbildung 28: Dosiswirkungs- 25 20 15 10 stimuliert und anschließend die 5 Rezeptorexpression von CD163 0 0 bestimmt. 5 10 15 20 25 WSP (µg/ml) Expression (U) Abbildung 29: In dieser Abbildung 100 sind die Medianwerte der CD163Expression von Monozyten nach sechs Tage Kultur mit WSP in den 10 Konzentrationen von 10 µg/ml und 20-25 µg/ml und von unstimulierten 1 0 10 Zellen dargestellt. 20-25 WSP (µg/ml) t-Test: WSP 10 P: 0,39; WSP 20-25 P: 0,194 Nach Stimulation mit 10 µg/ml WSP über sechs Tage zeigt sich eine Rechtsverschiebung der Fluoreszenz und somit eine vermehrte Expression des CD16349 Ergebnisse Rezeptorens auf Monozyten (Abb. 30). Eine zweigipflige Expression deutet auf das Vorliegen zweier Monozytenpopulationen hin, wie sie auch nach Stimulation mit OvE auftreten. Eine dieser Populationen zeigt eine hohe CD163-Expression. Abbildung 30: Abgebildet sind die Ergebnisse von drei Versuchen mit reinen Monozyten, die über sechs Tage mit WSP (rote Fläche) in einer Konzentration von 10 µg/ml stimuliert wurden. Zum Vergleich sind unstimulierte Zellen eingesetzt (schwarze Linie). Versuchsnummern: links 260201 003+001; Mitte 190201 010+008; rechts 120301 015+014+010 1.7.1 CD163-Expression nach Stimulation mit Fragmenten des Wolbachienproteins des Parasiten Brugia malayi Die Fragmente V1 und V3 des Wolbachienoberflächenproteins von Brugia malayi (Bm V1 und Bm V3) ergaben nach Stimulation von mononukleären Zellen sowie gereinigten Monozyten in der Konzentration 4, 5, 20 und 50 µg/ml über drei und sechs Tage Kultur (Abb. 31) keine vermehrte Expression des ScavengerRezeptors CD163 auf Monozyten. Der Versuch wurde deshalb nicht weiter verfolgt. Abbildung 31: Gereinigte Monozyten wurden über sechs Tage mit Bm V1 (oberes Histogramm) und Bm V3 (unteres Histogramm) in einer Konzentration von 50 µg/ml (rote Fläche) stimuliert. Die CD163Rezeptorexpression unstimulierter Zellen ist zum Vergleich (schwarze Linie) dargestellt. Versuchsnummern: oben 11120 005+001; unten 11120 006+001 50 Ergebnisse 2. Interleukin-10-Freisetzung stimulierter Monozyten 2.1 IL-10-Freisetzung nach Stimulation mit Onchocerca-volvulus-Extrakt Mononukleäre Zellen wurden Abbildung 32: IL-10-Produktion über fünf Tage mit Onchocerca- von Monozyten nach Stimulation volvulus-Extrakt (OvE) stimuIL-10 (pg/ml) mit 20 µg/ml OvE liert. Nach einem bzw. drei Tagen des 500 Interleukins im Überstand am 400 stärksten ausgebildet. Im Verlauf 300 nahm von 200 IL-10 im Überstand wieder ab 100 (Abb. 32). Monozyten der mono- 0 war die die nukleären Konzentration Konzentration Zellfraktion OvE 1d 4h sowie 3d 5d Std./Tage gereinigte Monozyten bilden nach Stimulation mit OvE vermehrt IL-10. Nach einem Tag Stimulation von gereinigten Monozyten gesunder Spender ist die Expression am höchsten und lag im Mittel bei 450 pg/ml. Die Konzentration von IL-10 im Kulturüberstand von gereinigten Monozyten, die mit OvE stimuliert wurden, lag unter dem Mittelwert der IL-10-Konzentration nach Stimulation mit 10 ng/ml Lipopolysaccharid (Abb. 33). IL-10 (pg/ml) 10000 Abbildung 33: Es wurden die IL-10- 1000 Konzentrationen im Kulturüberstand von über einen Tag mit 20-30 µg/ml 100 Onchocerca-volvulus-Extrakt (OvE) 10 bzw. 10 ng/ml Lipopolysaccharid 1 (LPS) stimulierten Monozyten gemessen. 0,1 Leerwert LPS t-Test: LPS P: 0,008; OvE P: 0,103 OvE 51 Ergebnisse Die mittlere Konzentration von IL-10 nahm nach drei bzw. sechs Tagen Kultur reiner Monozyten ab (Abb. 34). IL-10 (pg/ml) IL-10 (pg/ml) 1000 1000 100 100 10 10 1 0,1 1 Leerwert OvE LPS Leerwert OvE LPS Abbildung 34: Dargestellt ist die IL-10-Expression von Monozyten, die über drei (linke Abbildung) und sechs Tage (rechte Abbildung) mit 20-30 µg/ml Onchocercavolvulus-Extrakt (OvE) bzw. 10 ng/ml Lipopolysaccharid (LPS) stimuliert wurden, im Verhältnis zur Expression unstimulierter Zellen (Leerwert). Links: t-Test: OvE P: 0,059; LPS P: 0,405; rechts: t-Test: OvE P: 0,120; LPS P: 0,047 2.1.1 IL-10-Freisetzung nach Stimulation mit Onchocerca-volvulus-Extrakt von Patienten, die mit Doxycyclin behandelt worden waren Monozyten wurden mit Onchocerca-volvulus-Extrakt von unbehandelten Patienten (OvE) sowie von Patienten, die vor der Nodulektomie mit Doxycyclin behandelt worden waren (OvE/D), stimuliert. Der Mittelwert der IL-10-Konzentration im Überstand war nach Stimulation mit OvE über einen Tag um etwa 900 pg/ml höher als bei Verwendung von OvE/D. Eindrucksvolle Ergebnisse ergaben Kulturen von gereinigte Monozyten, die über einen Tag kultiviert wurden (Abb. 35). Der Mittelwert der IL-10-Konzentration im Überstand nach Stimulation der Monozyten mit OvE/D lag nach einem und drei Tagen Kultur unter der IL-10-Konzentration nach Stimulation mit OvE (Abb. 35). 52 Ergebnisse IL-10 (pg/ml) IL-10 (pg/ml) 1000 1000 100 100 10 10 1 1 0,1 0,01 0,1 Leerwert Leerwert OvE/D OvE OvE OvE/D Abbildung 35: Gereinigte Monozyten wurden mit jeweils 20-30 µg/ml OvE und mit OvE/D über einen (linke Abbildung) bzw. drei Tage (rechte Abbildung) kultiviert und zum Vergleich mit unstimulierten Zellen (Leerwert, LW) dargestellt. Links: t-Test: LW-OvE P: 0,103; LW-OvE/D P: 0,244; OvE-OvE/D P: 0,114; rechts: t-Test: OvE P: 0,176; OvE/D P: 0,384 Mononukleäre Zellen zeigen nach drei Tagen Stimulation mit OvE eine höhere IL-10Konzentration im Überstand als nach Stimulation mit Onchocerca-volvulus-Extrakt von Patienten, die vor Nodulektomie mit Doxycyclin behandelt worden waren (Abb. 36). IL-10 (pg/ml) Abbildung 1000 36: Dargestellt sind die IL-10-Konzentrationen der Überstände mono- 100 nukleärer Zellen nach drei10 tägiger Stimulation mit 20 µg/ml OvE bzw. OvE/D. 1 t-Test: 0,1 Leerwert OvE OvE/D 53 P: 0,368 OvE P: 0,234; OvE/D Ergebnisse 2.2 IL-10-Freisetzung nach Stimulation mit Onchocerca-ochengi-Extrakt Die Stimulation mit Onchocerca-ochengi-Extrakt (OoE) führte zu stark erhöhten IL-10Konzentrationen im Überstand gereinigter Monozyten nach einem Tag Kultur. Der Mittelwert lag bei 392 pg/ml (Abb. 37). Analoge Konzentrationen wurden nach drei Tagen Kultur gemessen. Die IL-10-Konzentrationen im Überstand stimulierter Monozyten lag nach sechs Tagen niedriger als nach ein bis drei Tagen Kultur (Abb. 37). IL-10 (pg/ml) IL-10 (pg/ml) 10000 1000 1000 100 100 10 10 1 1 0,1 Leerwert OoE Leerwert LPS OoE LPS Abbildung 37: IL-10-Konzentrationen der Überstände von Monozyten nach einem Tag (linke Abbildung) und sechs Tagen Kultur (rechte Abbildung), stimuliert mit 20-30 µg/ml OoE, 10 ng/ml LPS bzw. unstimuliert (Leerwert). Links: t-Test: OoE P: 0,011; LPS P: 0,008; rechts: t-Test: OoE P: 0,024; LPS P: 0,047 Mononukleäre Zellen gesunder Spender zeigten nach einem Tag Kultur mit OvE bzw. LPS, im Vergleich zu unstimulierten Zellen, ebenfalls einen erhöhten IL-10-Spiegel. Die Mediane der IL-10-Konzentrationen mit 10 ng/ml LPS stimulierter mononukleärer Zellen lag höher als nach Stimulation mit OoE (Abb. 38), anders als bei reinen Monozyten, die gleich hohe Medianwerte für beide Stimuli zeigten (vgl. Abb. 37). IL-10 (pg/ml) 10000 Abbildung 38: IL-10-Konzentrationen 1000 mononukleärer Zellen nach eintägiger Stimulation mit 20-30 µg/ml OoE bzw. 100 10 ng/ml LPS. t-Test: OoE P: 0,189; LPS P: 0,023 10 1 Leerwert OoE LPS 54 Ergebnisse 2.3 IL-10-Freisetzung nach Stimulation mit Wolbachienoberflächenprotein des Parasiten Dirofilaria immitis Wolbachienoberflächenprotein (WSP) stimuliert dosisabhängig nach einem Tag Kultur die IL-10-Expression in Monozyten (Abb. 39). Nach sechs Tagen Kultur nahm die IL-10-Konzentration im Überstand der Monozyten bei Stimulation mit 20 µg/ml WSP auf etwa 300 pg/ml zu (Abb. 39). IL-10 (pg/ml) IL-10 (pg/ml) 1000 10000 100 1000 10 100 1 10 0.1 1 0 3 10 20-25 WSP (ng/ml) Leerwert WSP Abbildung 39: Darstellung der IL-10-Konzentrationen im Zellüberstand. Gereinigte Monozyten wurden mit 3, 10 und 20-25 µg/ml WSP (linke Abbildung) bzw. 20 µg/ml WSP (rechte Abbildung) und ohne Stimulus (Leerwert) über einen Tag kultiviert. Links: t-Test: WSP 3 P: 0,237; WSP 10 P: 0,065; WSP 20-25 P: 0,360; rechts: t-Test: WSP P:0,273 3. Expression des Makrophagen-Mannose-Rezeptors auf Monozyten 3.1 Expression des Makrophagen-Mannose-Rezeptors nach Stimulation mit Onchocerca-volvulus-Extrakt Der Makrophagen-Mannose-Rezeptor (MMR) gehört wie der CD163-Rezeptor zu den Markern von alternativ aktivierten Makrophagen (Stein et al., 1992; Kodelja et al., 1997). Die Stimulation von Monozyten mit Onchocerca-volvulus-Extrakt über drei Tage führte zu einer nachweisbaren Expression von MMR. Die Expression des MMR auf den Zellen war am dritten Tag stärker ausgeprägt als nach sechstägiger Kultur (Abb. 40). Die erhöhte Expression zeigt sich im Histogramm (Abb. 41) als Rechts- 55 Ergebnisse verschiebung entsprechend einer Zunahme der Fluoreszenz und damit der Rezeptorexpression auf Monozyten. Expression (U) Expression (U) 100 100 10 10 1 1 Leerwert OvE LPS Leerwert OvE Abbildung 40: Dargestellt sind Medianwerte der MMR-Expression auf Monozyten, über drei (linke Abbildung) bzw. sechs Tage (rechte Abbildung) stimuliert mit 30 µg/ml Onchocerca-volvulus-Extrakt (OvE) bzw. 10 ng/ml LPS (LPS) oder ohne Stimulus (Leerwert). Links: t-Test: OvE P: 0,165; LPS P: 0,136; rechts: t-Test: OvE P: 0,221 Abbildung 41: Abgebildet ist die MMR-Expression auf Monozyten, die über drei (oben) bzw. sechs Tage (unten) mit 30 µg/ml Onchocerca-volvulus-Extrakt (rote Fläche) stimuliert worden waren. Die schwarze Linie gibt das Expressionsverhalten unstimulierter Zellen wieder. Versuchsnummern: oben links 230201 012+009; oben rechts 081200 010+009; unten links 111200 010+009; unten Mitte 260201 015+010; unten rechts 170701 018+017 56 Ergebnisse 3.1.1 Expression des Makrophagen-Mannose-Rezeptors nach Stimulation von gereinigten Monozyten mit Onchocerca-volvulus-Extrakt von mit Doxycyclin behandelten Patienten Bei den Versuchen mit Onchocerca-volvulus-Extrakt von Patienten, die vor Nodulektomie mit Doxycyclin behandelt worden waren (OvE/D), konnte keine Expressionserhöhung des MMR auf Monozyten nachgewiesen werden (Abb. 42). Nach Stimulation von Monozyten mit Onchocerca-volvulus-Extrakt unbehandelter Patienten (OvE) war die Differenz der Expression des MMR nach drei Tagen deutlich größer als nach sechs Tagen Kultur (Abb. 40). Expression (U) Expression (U) 100 100 10 10 1 1 Leerwert OvE OvE/D Leerwert OvE OvE/D Abbildung 42: Die Abbildung zeigt die Medianwerte der Expression für den Makrophagen-Mannose-Rezeptor auf drei (linke Abbildung) bzw. sechs Tage (rechte Abbildung) mit 30 µg/ml OvE/D stimulierten reinen Monozyten im Vergleich zu OvE und zu unstimulierten Zellen (Leerwert). Aufgrund der Begrenztheit des Materials konnten nur drei Bestimmungen durchgeführt werden. Links: t-Test: OvE P: 0,240; OvEoB P: 0,204; rechts: t-Test: OvE P: 0,221; OvE/D P: 0,416 57 Ergebnisse Die folgenden Histogramme zeigen die Fluoreszenzwerte kultivierter Monozyten, die mit OvE über drei, sechs und sieben Tage stimuliert wurden (Abb. 43 und 44). Mit OvE/D stimulierte und unstimulierte Monozyten zeigten eine äquivalente MMRExpression. Auch nach sieben Tagen Stimulation mit OvE/D von gereinigten Monozyten zeigt sich keine erhöhte MMR-Expression (Abb. 44). Abbildung 43: Dargestellt ist die MMR-Expression nach drei (obere Histogramme) und sechs Tagen Stimulation (untere Histogramme) von gereinigten Monozyten mit 30 µg/ml OvE/D (rote Fläche) bzw. Onchocerca-volvulus-Extrakt unbehandelter Patienten (grüne Linie) im Vergleich zu unstimulierten Zellen (schwarze Linie). Versuchsnummern: oben links 081200 011+010+009; oben rechts 230201 013+012+009; unten links 111200 011+010+009; unten rechts 260201 014+015+010 Abbildung 44: Dargestellt ist die MMR-Expression nach Stimulation von gereinigten Monozyten über sieben Tage mit 30 µg/ml OvE (rote Fläche) bzw. OvE/D (grüne Linie) im Vergleich zu unstimulierten Zellen (schwarze Linie). Versuchsnummer: 271200 015+014+013 58 Ergebnisse 3.2 Expression des Makrophagen-Mannose-Rezeptors nach Stimulation mit Onchocerca-ochengi-Extrakt Gereinigte Monozyten zeigten in Relation zu unstimulierten Monozyten nach sechs Tagen Kultur mit Onchocerca-ochengi-Extrakt (OoE) keine signifikante Erhöhung der Expression des MMR (Abb. 45 und 46). Abbildung Expression (U) Dargestellt 8 sind 7 MMR-Expression auf gerei- 6 nigten Monozyten, die über 5 sechs Tage mit 30 µg/ml 4 OoE 3 waren, verglichen mit unsti- 2 mulierten Monozyten (Leer- 1 Leerwert die 45: Medianwerte stimulierten der worden wert). OoE t-Test: OoE P: 0,159 Histogramm 46: Stimulation von gereinigten Monozyten mit 30 µg/ml OoE über sechs Tage (rote Fläche) im Vergleich zu unstimulierten Zellen (schwarze Linie) Versuchsnummern: links 260201 016+010; Mitte 170701 019+017; rechts 260302 057+051 59 Ergebnisse 3.3 Expression des Makrophagen-Mannose-Rezeptors nach Stimulation mit Wolbachienoberflächenprotein des Parasiten Dirofilaria immitis Der Makrophagen-Mannose- Rezeptor (MMR) wurde auf mit protein Wolbachienoberflächen(WSP) gereinigten stimulierten Monozyten ver- mehrt exprimiert. Mononukleäre Zellen sowie gereinigte Abbildung 47: Dosiswirkungskurve von WSP Expression (U) 8 6 4 2 0 0 10 20 WSP (µg/ml) Monozyten wurden über sechs Tage mit Konzentrationen zwischen 3 und 30 µg/ml stimuliert (Abb. 48); hierbei ergab sich die stärkste Expression bei 10 µg/ml (Abb. 47). Abbildung 48: MMR-Expression auf gereinigten Monozyten nach sechstägiger Stimulation mit 3 µg/ml (links), 10 µg/ml (Mitte) und 20 µg/ml WSP (rechts; rote Fläche) sowie MMR-Expression unstimulierter gereinigter Monozyten nach sechs Tagen Stimulation (schwarze Linie) Versuchsnummer: links 260201 013+010; Mitte 260201 012+010; rechts 260201 011+010 60 Ergebnisse 4. Zentrale Ergebnisse Monozyten zeigen nach drei- Abbildung 49: Stimulation gereinigter Monozyten mit OvE führt zu einer erhöhten Expression von CD163 und MMR auf diesen Zellen (nach drei Tagen) und zu einer erhöhten IL-10-Freisetzung im Monozytenüberstand (nach einem Tag). tägiger Stimulation mit Onchocerca-volvulus-Extrakt eine erhöhte (OvE) Expression des Scavenger-Rezeptors CD163 und 100 des Makrophagen-Mannose-Rezeptors (MMR, Abb. 49). Im Gegensatz zu OvE führt Oncho- 10 cerca-volvulus-Extrakt aus Würmern von Patienten, die vor Nodulektomie mit Doxycyclin 1 behandelt worden waren, zu CD163 keiner unstim ulierte Zellen bzw. nur geringer MMR IL-10 stim uliert m it 20-30 µg/m l OvE/D Erhöhung der Rezeptoren. Im Überstand stimulierter stim uliert m it 20-30 µg/m l OvE Mono- zyten läßt sich eine erhöhte IL-10-Konzentration nach Stimulation mit OvE nachweisen. OvE/D führt nicht zu einer erhöhten Expression von CD163, MMR und IL-10. Abbildung 50: Erhöhung der Rezeptorexpression für CD 163 und MMR bw. IL-10-Freisetzung nach Kultur gereinigter Monozyten mit WSP über sechs Tage (CD163, MMR) und einen Tag (IL-10) Nach Stimulation reiner Monozyten mit Wolbachienober- flächenprotein (WSP) des Parasiten Dirofilaria immitis 100 zeigte sich eine Expressionserhöhung der Rezeptoren CD163 und MMR sowie eine 10 Erhöhung der Konzentration von IL-10 im Kulturüberstand 1 (Abb. 50). Der MMR zeigt nach Stimulation mit WSP eine geringere Expression als der Scavenger-Rezeptor CD163 MMR IL-10 unstimulierte Zellen stimulierte Zellen mit 20-25 µg/ml WSP CD163. 61 Ergebnisse Die Gensequenz des WSP von Dirofilaria immitis ist identische mit der des WSP aus Onchocerca (Bazzocchi et al., 2000). Onchocerca-ochengi-Extrakt Abbildung 51: Darstellung der Ergebisse der Rezeptorexpression und IL-10Freisetzung auf bzw. durch gereinigte Monozyten nach drei (CD163), sechs Tagen (MMR) bzw. einem Tag (IL-10) Stimulation mit OvE (OoE) führte nach dreitägiger Stimulation von Monozyten zu einer vermehrten Expression des CD163-Rezeptors. Nach 1000 einem Tag Stimulation mit OoE zeigt sich im Überstand 100 eine signifikate IL-10-Erhöhung (Abb. 51). 10 1 CD163 MMR unstim ulierte Zellen stim uliert m it 30-50 µg/m l OoE 62 IL-10 Diskussion Die klinischen Manifestationen der Infektion mit Onchocerca volvulus variieren stark. Unterschiede umfassen die generalisierte und die seltenere Sowda-Form, die fließend ineinander übergehen können (Spektrum). Es zeigen sich bei der generalisierten Form keine oder nur geringe Entzündungsreaktionen, obwohl z. T. eine große Anzahl von Mikrofilarien in der Haut vorhanden sein kann. Die Sowda-Form präsentiert sich hingegen als hyperreaktive, klinisch ausgeprägte Form der Erkrankung, meist mit einer an den Gliedmaßen lokalisierten, juckenden, papulösen, hyperpigmentierten chronischen Dermatitis mit regionaler Lymphadenopathie. Sowda-Patienten zeigen im Unterschied zur generalisierten Form in vitro stark ausgeprägte zelluläre Reaktionen. Es stellt sich die Frage, weshalb das Immunsystem von Patienten mit der generalisierten Form vitale Filarien von O. volvulus toleriert und nicht bekämpft, wie es bei der SowdaForm zu beobachten ist. Patienten mit der generalisierten Form der Onchozerkose zeigen eine nur geringe Lymphozytenproliferation und geringe Konzentrationen inflammatorischer Zytokine wie IL-2, Tumor-Nekrose-Faktor und IL-6 bei Stimulation mit Onchocerca-volvulusExtrakt (Ottesen, 1995). Immunreaktionen gegenüber adulten Filarien und Mikrofilarien sind kaum nachweisbar. Degenerierte Mikrofilarien führen jedoch auch bei der generalisierten Form vor allem bei hoher Mikrofilariendichte zu massiven Entzündungsreaktionen (Ottesen, 1995). Eine Abtötung der Mikrofilarien erfolgt insbesondere nach Gabe des mikrofilariziden Therapeutikums Diethylcarbamazin. Dies bedeutet, daß die eingeschränkte Immunreaktivität unter bestimmten Bedingungen durchbrochen werden kann. Die Entzündungsreaktion scheint von endobakteriellen Molekülen sowie von prädominanten Th2-aktivierenden Molekülen von Filarien hervorgerufen zu werden, die auf das native Immunsystem aktivierend einwirken. Die stetige Exposition des Wirts mit Onchocerca-assoziierten Molekülen sowohl von Filarien als auch filariellen Endobakterien provoziert mit steigender Filarienanzahl inflammatorische Mechanismen. Immunpathologische Schäden werden durch T-Zellen und alternativ aktivierten Makrophagen (aaM) minimiert (Hoerauf & Brattig, 2002; Brattig, 2004). Von den lebenden Parasiten scheint eine immunmodulierende Aktivität auszugehen. So kommt es zum Beispiel bei den Infektionen mit Brugia malayi, Nippostrongylus und 63 Diskussion Toxocara canis zu einer Hemmung der T-Zellproliferation und Th2-Zellantwort. Die Hemmung dieser Antworten wirkt einer Entzündungsreaktion durch die Freigabe von IL-4, IL-10, Prostaglandinen und Proteinen wie Fizz1 und Ym1 entgegen (Maisels et al., 2003). Ein großer Fortschritt war die Entdeckung einer neuen Form von Makrophagen bzw. dendritischen Zellen, die bei Infektionen mit Nematoden beobachtet wurde. Diese Makrophagen schlagen einen IL-10 unabhängigen Weg ein (MacDonald et al., 1998; Allen & Loke, 2001). Mit B. malayi infizierte Mäuse präsentierten diese Makrophagen im Peritoneum. Im Mausmodell verhindern Makrophagen die Proliferation von T-Zellen und wirken durch einen kontaktabhängigen Mechanismus. Der Mechanismus ist unabhängig von den bekannten Inhibitoren wie NO, Prostaglandinen oder Zytokinen wie IL-10 und TGF-ß (Loke et al., 2000). Diese Makrophagen induzieren die Differenzierung von naiven T-Zellen zu Th2-Zellen (Allen et al., 1996) und können möglicherweise als Typ-2-Makrophagen klassifiziert oder als ein wichtiges In-vivoBeispiel von alternativ aktivierten Makrophagen (aaM) dargestellt werden (Gordon, 2003). Durch Helminthen stimulierte dendritische Zellen aus dem Knochenmark von Mäusen zeigten eine vermehrte Expression von CD80, CD86 und MHC Klasse II (Jankovic et al. 2001; MacDonald et al., 2001). Für die Th2-Antwort spricht auch die vermehrte Expression des OX40-Liganden auf humanen dendritischen Zellen, welche ausschlaggebend für die OX40-vermittelte Th2-Differenzierung ist (Flynn et al., 1998). Später wurden auch ähnliche Zellen bei anderen Tieren, welche verschiedenen Nematoden und deren sekretorischen Produkten ausgesetzt wurden, gefunden (Allen & MacDonald, 1998). Ym1, ein Protein, das zur Familie der Chitinase-Proteine gehört und von Makrophagen zur Bindung von Glykosaminoglykanen wie Heparin im Rahmen einer Inflammation poduziert wird, wurde als chemotaktischer Faktor für eosinophile Granulozyten identifiziert (Loke et al., 2002; Nair et al., 2003). Die begleitende lokale Infiltration eosinophiler Granulozyten bei Onchozerkose kann somit durch die chemotaktische Wirkung von Ym1 entstehen. Immunmodulierende Moleküle wie z. B. FilarienCystatin, Migrations-inhibierender-Faktor und ein dem TGF-ß-ähnliches Molekül, führen mit zu einer Suppression des Immunsystems. Nach Injektion von OvE zeigte sich eine Einschränkung der Immunantwort der verzögerten Überempfindlichkeit 64 Diskussion (DTH) (Maizels & Yazdanbakhsh, 2003); diese war jedoch nicht bei Patienten mit einer Sowda-Form sowie putativ Immunen zu beobachten (Burchard et al., 1999). Die Antigen-induzierte DTH gilt als Th1-vermittelte Immunreaktion (Burchard et al., 1999). Neueste Studien zeigen, daß bei Th2-abhängigen Reaktionen eine DTH des Typs II mit einem klinischen Bild ähnlich dem der klassischen DTH auftreten kann. Frühere Versuche, die verminderte Immunantwort bei der generalisierten Form der Onchozerkose als eine Th2-Antwort zu beschreiben, werden heute als eine zu große Vereinfachung angesehen. Gegen eine ausschließliche Th2-Antwort spricht das Auftreten verschiedener Zellreaktionen bei putativ Immunen sowie die Zunahme der zellulären Proliferation nach mikrofilarizider Behandlung mit Ivermectin bei Patienten mit der Sowda-Form (Soboslay et al., 1997, Henry et al., 2001). Neben Th1- und Th2-Antworten wurde kürzlich die Antwort einer dritten ThZellpopulation, der Th3- oder regulatorischen T-Zelle Typ 1 (Tr1) beschrieben. Bei Onchozerkose war die Th3-Antwort mit der OvE-spezifischen Verminderung der Zellproliferation assoziiert. Th3-Reaktionen können die Th1- und Th2-Antwort unterdrücken (Doetze et al., 2000). Th3-Zellen produzieren IL-10 und TGF-ß und sind möglicherweise für eine Toleranzinduktion verantwortlich (Kapselberg et al., 1999). Die Produktion von IL-10 ist assoziiert mit der verminderten zellulären Antwortfähigkeit (Elson et al., 1995; Brattig et al., 1997; Soboslay et al., 1997; Cooper et al., 1998; Doetze et al., 2000; Henry et al., 2001). Sie ist bei Patienten mit generalisierter Form nach mikrofilarizider Behandlung mit Ivermectin vermindert, und es läßt sich als Konsequenz eine verstärkte Zellproliferation nachweisen (Henry et al., 2001). Die Neutralisation von IL-10 durch spezifische Antikörper ergab in vitro noch keine Zunahme der Lymphozytenproliferation bei Patienten mit generalisierter Onchozerkose (Soboslay et al, 1999; Doetze et al., 2000). Erst bei gleichzeitiger Zugabe von Antikörpern gegen TGF-ß zeigte sich eine Zunahme der Zellproliferation (Doetze et al., 2000). Onchozerkose-spezifische T-Zellklone bilden bei Patienten mit generalisierter Onchozerkose Zytokine, die für den Th3-Suppressorzelltyp charakteristisch sind (Doetze et al., 2000). Bei lymphatischen Filariosen und bei Schistosomiasis ist die T-Zellantwort durch gemischte Th1- und Th2-Zellreaktionen (Sartono et al., 1997; Grogan et al., 1998) sowie durch eine durch IL-10 und TGF-ß vermittelte verminderte Zellproliferation gekennzeichnet (King et al., 1993; Mahanty et al., 1996). Die Abbildung 52 zeigt ein Modell, wie man sich aufgrund der neueren 65 Diskussion Forschungsergebnisse die Balance zwischen den Effektor- und Suppressormechanismen bei der generalisierten Form der Onchozerkose im Vergleich zur Sowda-Form und zu putativ Immunen vorstellt. Abbildung 52: Balancemodell zwischen den Effektor- und Suppressormechanismen bei Onchozerkose. (nach Hoerauf & Brattig 2002) 1. Bei generalisierter Onchozerkose werden die Th1- und Th2-abhängigen Effektorreaktionen durch IL-10 und TGF-ß supprimiert, und antigenspezifische supprimierende Zellen (Th3/Tr1) treten auf. 2. Bei putativ immunen Individuen und Patienten mit der hyperreaktiven Form der Onchozerkose (Sowda) zeigt sich eine ausgeprägte Th1/2-Effektorantwort, die zu einer Immunantwort gegen infektiöse Larven bei putativ Immunen oder gegen Mikrofilarien bei Sowda führt. Somit kann durch freigesetztes IL-10 (z. B. aus aaM) eine Th3/Tr-1-Antwort ausgelöst werden (Gomez-Escobar et al. 1998; Pastrana et al. 1998; Schönemeyer et al. 2001; Hoerauf & Brattig, 2002). Th1- und Th2-Immunantworten können durch Fragmente untergehender Mikrofilarien oder in Symbiose mit O. volvulus lebender Wolbachien verursacht werden. Noch nicht identifizierte Wolbachienprodukte führen zunächst zu proinflammatorischen Reaktionen (Brattig et al 2000; Taylor et al. 2000). Oligosaccharide (Fucosyl) und Phosphorylcholin hingegen lösen eher eine zelluläre Th2Antwort aus (Velupillai et al. 1996; Al-Qaoud et al. 1998; Whelan et al. 2000). Eine 66 Diskussion Modulation der Immunantwort scheint auch durch In-utero-Exposition mit dem parasitären Antigen bedingt zu sein, wobei entweder eine Toleranzbildung oder eine verstärkte humorale Immunreaktion stattfindet. Im Rahmen von inflammatorischen Reaktionen werden sequentiell auch antiinflammatorische Mechanismen hochreguliert, um einer unkontrollierten sich verstärkenden Entzündungsreaktion entgegenzuwirken (Kodelja & Goerdt, 1994; Kodelja et al., 1997; Goerdt & Orfanos 1999; Gratchev et al., 2001). Hierbei spielen alternativ aktivierte Monozyten/Makrophagen (aaM) eine Rolle (Kodelja et al., 1997; Gordon 2003), die bei chronischen Entzündungsreaktionen vermehrt nachgewiesen wurden (Kodelja & Goerdt, 1994; Djemadji-Ondjiel et al., 1996; Schebesch et al., 1997). Da es für die Onchozerkose kein Tiermodell gibt, habe ich In-vitro-Untersuchungen mit menschlichen Zellen durchgeführt. Vollblut zu kultivieren war wegen des geringen Anteils an Monozyten ungeeignet (nur 2-6% der peripheren Leukozyten im Blut). Aus diesem Grund wurden mononukleäre Zellen isoliert oder gereinigte Monozyten eingesetzt. Untersucht wurden zwei wichtige Rezeptoren von aaM (CD163 und MMR) sowie das Zytokin IL-10, das von aaM vermehrt gebildet wird. Die Rezeptorexpression von CD163 und MMR wurde im Durchflußzytometer (FACS), die IL-10-Konzentration im Kulturüberstand mittels ELISA analysiert. Der MMR wurde erst zu einem späteren Zeitpunkt der Versuche als charakteristischer Marker hinzugenommen. Um das In-vivoVorkommen von aaM zu überprüfen wären auch immunhistologische Untersuchungen von Hautbiopsien für den Nachweis der Expression von CD163 und MMR interessant gewesen. Immunchemische Untersuchungen der kultivierten Zellen unter Anwendung der Zytospinmethodik waren aufgrund des hohen Zellverbrauchs nicht ökonomisch. Außerdem erwiesen sich die Ergebnisse der Rezeptorbestimmung durch die Durchflußzytometrie als objektiver im Vergleich zur Zytospinmethodik. Die Selektion der zu untersuchenden Zellpopulation durch das sogenannte „gaten“ stellt eine mögliche Fehlerquelle beim FACS dar. Hierdurch werden Zelltrümmer und andere Zellpopulationen aus der Analyse mit möglichem Informationsverlust ausgegrenzt. Bei den Versuchen wurden Negativ- und Positivkontrollen eingeschlossen. Bei jedem Versuch wurde stets ein Leerwert ohne Einsatz der monoklonalen Antikörper gegen die Rezeptoren mitgeführt. Die MMR-Ergebnisse stellen aufgrund der Materialknappheit 67 Diskussion der Reagenzien zum Teil nur einen Trend dar. Alternativ aktivierte Makrophagen werden im Gegensatz zu klassisch aktivierten Makrophagen durch antiinflammatorische Substanzen wie IL-4, Glukokortikoide, IL-10, IL-13 und TGF-ß aktiviert und präsentieren ein bestimmtes Muster an Zytokinen wie IL-10 und TGF-ß sowie Rezeptoren wie MMR und CD163. Tabelle 2 zeigt eine Zusammenfassung der bis jetzt bekannten biologischen Eigenschaften alternativ aktivierter Makrophagen. Diese gehen aus mit IL-4 und Glukokortikoiden stimulierten Monozyten hervor. Bestimmte weitere Stimuli induzieren in diesen Monozyten eine präferentielle Freisetzung oder Expression von z. B. Zytokinen, Chemokinen, Rezeptoren, Enzymen und anderen Produkten. Auslösender Stimulus Rezeptorexpression Glukokortikoide, IL-4 (Kodelja & Goerdt, 1994; DjemadjiOndjiel et al., 1996; Kodelja et al., 1997; Van den Heuvel et Scavenger-Rezeptor CD163 al., 1999) IL-4, Dexamethason (Cowan et al., 1992; Stein et al., 1992 ; Kodelja et al., 1997) IgG2a (Stein et al., 1992) Bacille-Calmette-Guerin, Endotoxin/Phorbolester (Cowan Makrophagen-Mannose-Rezeptor et al., 1992) Glukokortikoide (Cowan et al., 1992; Stein et al., 1992) Glukokortikoide (Woiciechowsky et al., 1999) Erniedrigte Expression von HLA- IL-10 (Steinbrink et al., 1997) DR,CD83,CD86,CD58 Auslösender Stimulus Produktexpression IL-4 (Loke et al., 2002; Nair et al., 2003) Fizz1 IL-4 (Loke et al., 2002; Nair et al., 2003) Eosinophiles Dermotoxin Ym1/2 IL-4 (Chizzolini et al. 2000) Matrix-Metalloproteinase MMP-1 Auslösender Stimulus Enzymexpression IL-4, IL-13 (Gordon, 2002) L-Arginase 1 Glukokortikoide, IL-4 (Kodelja et al. 1997) 15-Lipoxigenase Auslösender Stimulius Chemokinfreisetzung IL-13, IL-10 u. IL-4 (Kodelja et al., 1998) AMAC-1 (CCL18) Karzinome, Allergien und inflammatorische Erkrankungen (Psoriasis u. Asthma), HIV MIP-4/DC-CK1 (Guan et al., 1999) Tabelle 2: Charakteristika von alternativ aktivierten Makrophagen 68 Diskussion Auslösender Stimulus Zytokinfreisetzung TNF-α (Asadullah et al., 1999 ; Ito et al., 1999) cAMP (Asadullah et al., 1999) Glukokortikoide (Franchimont et al., 1999) UV-Stahlen (Asadullah et al., 1999; Ullrich, 1994) Katecholamine (Woiciechowsky et al., 1998 & 1999) IL-10 Leishmania major, Toxoplasma gondii, Listeria monocytogenes, Mykobacterium tuberculosis (Carrera et al., 1996) Neuropeptide : α-Melanocten-stimulierendes Hormon β-Endorphin (Carrera et al., 1996) IFN-β (Lin et al., 1998) IL-4 /LPS (Lin et al., 1998; Fenton et al., 1992) IL-1-Rezeptorantagonist IL-10 (Jenkins et al., 1994) TNF-α (Giri et al., 1994 ; Franchimont et al., 1999) Phagozytose von apoptotischen Zellen (Fadok et al., 1998) TGF-β ACTH, geringe Konzentration von Glukokortikoiden (Calandra et al., 1995) Brugia-malayi-Larve, Wucheria bancrofti, Onchocerca MIF (Bm-MIF) volvulus (Pastrana et al., 1998) IL-4, IL-10, IL-13, TGF-β (Sutterwale et al., 1997) Leishmania major, Toxoplasma gondii, Listeria monocytogenes, Mycobacterium tuberculosis (Carrera et al., 1996) Erniedrigte Freisetzung von IL-12 Schistosoma-mansoni-Eier (Kalinski et al., 1999) Fcγ-Bindung, HIV (Sutterwale et al., 1997) PGE, Cholecalciferol (Kapsenberg et al., 1999) Phagozytose apoptotischer Zellen (Fadok et al., 1998) PAF Tabelle 2: Charakteristika von alternativ aktivierten Makrophagen AaM besitzen keine Fähigkeit, Mikroorganismen abzutöten. Das von aaM verstärkt exprimierte Enzym Arginase ist ein Gegenspieler der NO-Synthase; beide konkurrieren um das limitierte Substrat L-Arginin (Modolell et al., 1995). Die Arginase bildet L-Ornithin aus L-Arginin und führt über die Erhöhung von Prolin mittels der Ornithinaminotransferase zur Kollagenproduktion (Gordon, 2003). Eine erhöhte Kollagenproduktion findet sich auch als Antwort auf O. volvulus in Onchozerkomen. Die Sauerstoff- und NO-Synthaseproduktion ist erniedrigt. Von besonderer Bedeutung 69 Diskussion ist die zunehmende Hemmung der Proliferation CD4-positiver T-Zellen im peripheren Blut durch aaM, die zur Immunsuppression führt (Schebesch et al., 1997). Alle drei in dieser Studie untersuchten Marker (MMR, CD163 und IL-10) kennzeichnen eine alternative Aktivierung von Makrophagen bei Onchozerkose. Nach Stimulation isolierter peripherer Monozyten mit Onchocerca-volvulus-Extrakt zeigte sich nach eintägiger Kultur eine Erhöhung der IL-10-Konzentration im Überstand. Neben der IL-10-Konzentration im Kulturüberstand erhöhte sich auf den stimulierten Monozyten nach dreitägiger Stimulation die Expression des Scavenger-Rezeptors CD163 signifikant. Die Stimulation mit Onchocerca-volvulus-Extrakt hatte ebenfalls eine geringfügige Erhöhung des Makrophagen-Mannose-Rezeptors auf den Zellen zur Folge. Die gesteigerte Expression dieser Rezeptoren sowie die geringe IL-6- und TNF-αKonzentration nach Stimulation mit Onchocerca-volvulus-Extrakt in vitro unterstützen die Annahme der alternativen Aktivierung von Monozyten/Makrophagen bei der generalisierten Form der Onchozerkose. Exposition der Monozyten mit Extrakt von O. ochengi führte nach drei Tagen zu einer vermehrten Expression von CD163 und einer deutlich stärkeren Sekretion von IL-10 im Vergleich zu mit Onchocerca-volvulusExtrakt stimulierten Zellen. Der Makrophagen-Mannose-Rezeptor (MMR), der nach sechs Tagen gemessen wurde, ergab nach Exposition mit Extrakt von O. ochengi keine signifikante Erhöhung. Es ist nicht auszuschließen, daß nach drei Tagen Stimulation eine erhöhte Expression eintritt, wie es bei der Expression des CD163-Rezeptors nach Stimulation mit Onchocerca-volvulus-Extrakt der Fall war. In weiteren Untersuchungen wurden Monozyten mit rekombinanten Antigenen von O. volvulus getestet. Dazu gehörten Onchocystatin (Ov17) (Schönemeyer et al., 2001; Schierack et al., 2003), ein verkürztes Ov17-Fragment (Ovv17) sowie der Aspartylproteaseinhibitor Ov33 (Lucius et al., 1992). Onchocystatin führte zu einer Hemmung der T-Zellproliferation und zu einer verstärkten Freisetzung von IL-10 (Hartmann et al., 1997). Es ließ sich in den Versuchen mit Onchocystatin nur der Trend zu verstärkter CD163-Expression nachweisen. Weiterhin wurden einige Versuche mit Ecdyson, welches unter anderem bei O. volvulus gefunden wurde (Mereer et al., 1989; Yates et al., 1995), durchgeführt. Ecdyson ist ein weniger potentes Steroid als Dexamethason und kommt vor allem bei Insekten und Würmern vor. Es löste eine geringe Erhöhung 70 Diskussion der CD163-Expression aus, die sich am stärksten bei einer Konzentration zwischen 40-200 ng/ml nach einem Zeitraum von sechs Tage Stimulation zeigte. Beim Zerfall von Mikrofilarien, der eine ausgeprägte inflammatorische Immunreaktion auslösen kann, werden Moleküle aus den Filarien und Wolbachien freigesetzt (Bryceson et al., 1977; Francis et al., 1985; Ali et al., 2003). Kürzlich wurde wiederholt gezeigt, daß Oberflächenantigene der Wolbachien eine inflammatorische Immunantwort auslösen, deren Ausprägung mit der Menge der zirkulierenden bakteriellen DNA und von TNF-α korreliert (Keiser et al., 2002; Brattig, 2004). Die Stimulation von Monozyten mit dem Wolbachienoberflächenprotein WSP aus Dirofilaria immitis, das eine identische Gensequenz wie WSP aus Onchocerca aufweist (Bazzocchi et al., 2000), ergab eine ausgeprägte Erhöhung der Expression aller drei Marker, was auf eine alternative Aktivierung von Makrophagen hindeutet. Die stärkste Expression fand sich für eine Konzentration von 10 µg/ml WSP. Interessanterweise zeigte sich im Gegensatz zum Extrakt von unbehandelten Patienten bei Stimulation mit Onchocerca-volvulusExtrakt von Patienten, die zur Eliminierung der Wolbachien mit Doxycyclin behandelt worden waren, keine erhöhte Expression der untersuchten Marker. Wolbachienmoleküle scheinen daher neben proinflammatorischen Eigenschaften auch an der Differenzierung von Monozyten zu aaM beteiligt zu sein. Die Onchozerkose ist eine chronische Erkrankung der Haut und führt zu Granulombildung in der Subkutis. AaM wurden in Fremdkörpergranulomen und bei chronischen Erkrankungen wie der Psoriasis vermehrt beobachtet (Djemadji-Oudjiel et al., 1996). Sie regulieren unter anderem die Fibroblastenaktivität durch Induktion von Zytokinen und Wachstumsfaktoren, die die Proliferation und Kollagensynthese von Fibroblasten modulieren (Sang et al., 2000). AaM können daher auch an der starken Fibrosierung bei der Onchozerkose beteiligt sein. Scavenger-Rezeptoren sind charakteristisch für sogenannte Schaumzellen, welche sich auch bei Arteriosklerose in der Gefäßwand aus einwandernden Monozyten entwickeln. Diese Makrophagen nehmen oxydierte Lipide auf und speichern sie. Schaumzellen sind ebenfalls bei der Onchozerkose beobachtet worden (Burchard et al., 1979; de Villiers & Smart, 1999; Madsen et al., 2001). IL-10 weist nicht nur immunsuppressive, sondern auch B-Lymphozyten-fördernde Effekte auf. IL-10 führt nicht zu einer Hemmung der IL-4-induzierten IgE-Sekretion, 71 Diskussion sondern zu einer verstärkten B-Zellproliferation. Die Expression von CD40, IL-4 und IL-10 bewirkt neben der verstärkten B-Zellproliferation eine Immunglobulinsekretion und einen Isotypenwechsel zur IgE-Synthese (Rousset et al., 1992). Hohe Konzentrationen von IgE stellen ein Hauptcharakteristikum der Filarieninfektion wie Onchozerkose dar (Ottesen, 1995; Tischendorf et al., 1999). Gordon (2003) unterscheidet fünf Aktivierungsformen von Makrophagen, wobei neben Glukokortikoiden nur IL-4 und IL-13 Makrophagen alternativ aktivieren. IL-10, TGF-ß, IL-1-Rezeptor-Antagonist führen danach zu einer Deaktivierung von Makrophagen, die ihrerseits IL-10 und TGF-ß bilden. CD163 wird von Gordon als Charakteristikum alternativ aktivierter Makrophagen aufgeführt. In anderen Veröffentlichungen führen IL-10, Glukokortikoide und IL-4 in Verbindung mit Glukokortikoiden zu einer Induktion von CD163 (Kodelja & Goerdt, 1994; Kodelja et al., 1997; Högger et al., 1998). Über die Rolle von IL-4 und IL-13 als Stimuli gibt es sich widersprechende Berichte. Die Veröffentlichung von Djemadji-Ondjiel et al. (1996) beschreibt eine vermehrte Expression des Rezeptors, die unter IL-4 nicht so stark ausfällt wie nach Stimulation mit IL-10. In anderen Artikeln (van den Heuvel et al., 1999; Sulahian et al., 2000) wird IL-4 und IL-13 hingegen kein Einfluß auf die Induktion des CD163Rezeptors eingeräumt. IL-10 führt laut Gordon zur Deaktivierung von Makrophagen, was im Gegensatz zur vermehrten CD163- und MMR-Expression steht (DjemadjiOndjiel et al., 1996; Büchler et al., 2000; Sulahian et al., 2000). Insgesamt sprechen die Ergebnisse meiner In-vitro-Studie erstmalig für die Ausbildung von alternativ aktivierten Makrophagen unter Stimulation mit Onchocerca-volvulusund Onchocerca-ochengi-Extrakt. Die Frage, ob und inwieweit WSP in vivo an der Immunreaktion beteiligt ist, ist noch zu klären. In vitro bewirkt die Exposition von Monozyten mit Onchocerca-volvulus-Extrakt und Wolbachienoberflächenprotein eine erhöhte Expression von CD163, MMR und IL-10. Immunhistologische Studien haben gezeigt, daß Mikrofilarien das WSP enthalten und daß Gewebsmakrophagen Mikrofilarien bzw. Fragmente der Mikrofilarien und mit diesen WSP aufnehmen können und dieses auch tatsächlich enthalten (Brattig et al., 2004). Eine mögliche intensive Interaktion zwischen Makrophagen, Mikrofilarien und Wolbachien ist daher bei der Auseinandersetzung des Wirts mit der Filarie O. volvulus auch in vivo anzunehmen. 72 Zusammenfassung Die Onchozerkose ist eine chronische Infektionskrankheit, bei der die Stadien der Filarie O. volvulus im immunkompetenten Wirt für lange Zeit überleben. Entzündliche Reaktionen werden durch ein System von antiinflammatorischen Mechanismen kontrolliert. Ein Mechanismus repräsentiert dabei die Differenzierung von Monozyten in alternativ aktivierte Makrophagen. Die durch Suppressormechanismen alternativ aktivierter Makrophagen bedingte eingeschränkte Immunantwort ist charakteristisch für die Chronizität der Parasitose. In der vorliegenden Studie wurden periphere mononukleäre Zellen und gereinigte Monozyten gesunder Spender mit Onchocerca-volvulus- und Onchocerca-ochengiExtrakt stimuliert und die Expression bestimmter Rezeptoren auf Monozyten/ Makrophagen sowie das immunmodulierende Zytokin IL-10 bestimmt. Untersucht werden sollte, ob es durch Onchocerca-volvulus-Antigene zu einer erhöhten Expression des Scavenger-Rezeptors CD163, des Makrophagen-Mannose-Rezeptors sowie von IL-10 kommt. Diese Merkmale sind Indikatoren von alternativ aktivierten Makrophagen. Die Membranrezeptoren CD163 und MMR wurden auf den stimulierten Monozyten mit Hilfe von monoklonalen Antikörpern im Durchflußzytometer (FACS) untersucht. IL-10 wurde im Kulturüberstand mittels ELISA bestimmt. Die Expression von CD163 auf Monozyten/Makrophagen und die Konzentration von IL-10 im Zellkulturüberstand waren nach Stimulation mit Onchocerca-volvulus- und Onchocerca-ochengi-Extrakt signifikant erhöht. Eine höhere Expression des MMR war unter den Testbedingungen nur als Trend nachweisbar. Diese Ergebnisse sprechen für eine Onchocerca-assoziierte Stimulation von Monozyten zu alternativ aktivierten Makrophagen. Weiterhin konnte nach Stimulation der gereinigten Monozyten mit dem endobakteriellen Wolbachienoberflächenprotein WSP nach drei Tagen auf den Zellen eine stark erhöhte CD163-Rezeptorexpression und eine nur leicht erhöhte Expression des MMR sowie eine erhöhte IL-10-Konzentration im Kulturüberstand festgestellt werden. Die Stimulation von gereinigten Monozyten mit Onchocerca-volvulus-Extrakt, der von mit Doxycyclin behandelten Patienten stammte (Eliminierung der Endobakterien), zeigte dagegen eine signifikant niedrigere 73 Zusammenfassung Rezeptorexpression und IL-10-Freisetzung als die Stimulation mit Extrakt von unbehandelten Patienten. Die Ergebnisse weisen daraufhin, daß WSP eine wesentliche Rolle bei der Induktion einer alternativen Aktivierung von Monozyten/Makrophagen durch Onchocercavolvulus-Extrakt spielt. Alternativ aktivierte Makrophagen können nach diesen neuen Ergebnissen neben regulatorischen T-Zellen (Th3/Tr1) eine Rolle bei der verminderten Immunreaktivität der generalisierten Form der Onchozerkose spielen. 74 Literaturverzeichnis Albiez, E. J., 1978: Klinische und parasitologische Untersuchungen der Knoten bei der Onchozerkose in Westafrika. Dissertation, Hamburg Albiez, E. J., Schulz-Key, H., Brinkmann, U. K., 1978: Comparative studies on the quantitative assessment of microfilarial densities in onchocerciasis. Trans. Roy. Soc. Trop. Med. Hyg. 72, 417-419 Ali, M. M., Baraka, O. Z., Abdel Rahman, S. I., Sulaiman, S. M., Williams, J. F., Homeida, M. M., Mackenzie, C. D., 2003: Immune response directed against microfilariae correlated with severity of clinical onchodermatitis and treatment history. J. Infect. Dis. 187, 714-717 Allen, J. E., Lawrence, R. A. & Maizels, R. M., 1996: Antigen presenting cells from mice harbouring the filarial nematode, Brugia malayi, prevent cellular proliferation but not cytokine production. Int. Immunol. 8, 143-151 Allen, J. E. & MacDonald, A. S., 1998: Profound suppression of cellular proliferation mediated by the secretion of nematodes. Parasite Immunol. 20, 241-247 Allen, J. E. & Loke, P., 2001: Divergent roles for macrophages in lymphatic filariasis. Parasite Immunol. 23, 345-352 Al-Qaoud, K. M., Fleischer, B., Hoerauf A., 1998: The Xid defect imparts susceptibility to experimental murine filariosis – association with a lack of antibody and IL-10 production by B cells in response to phosphorylcholine. Int. Immunol. 10, 17-25 Anderson, J., Fuglsang, H. 1973: Variation in numbers of microfilariae of O. volvulus in the anterior chamber of the human eye. Trans. Roy. Soc. Trop. Med. Hyg. 67, 544-548 Anderson, J., Fuglsang, H., Hamilton, P. J. S., de Marshall, T. F. C., 1975: The prognostic value of head nodules and microfilariae in the skin in relation to ocular onchocerciasis. Tropenmed. Parasit. 26, 191-195 75 Literaturverzeichnis Anderson, J., Fuglsang, H., 1977: Ocular onchocerciasis. Tropical Diseases Bulletin 74, 257-272 Asadullah, K., Döcke, W.-D., Sabat, R., Eberling, M., Volk, H.-D., Sterry, W., 1999: IL-10 in der Dermatologie. Der Hausarzt 50, 12-19 Bazzocchi, C., Jamnongluk, W., O’Neill, S. L., Anderson, T. J. C., Genchi, C., Bandi, C., 2000: Wsp gene sequences from the Wolbachia of filarial nematodes. Current Microbiology 41, 96-100 Bianco, A. E., Mustafa, M. B., Ham, P. J., 1989: Fate of developing larvae of Onchocerca lienalis and Onchocerca volvulus in micropore chambers implanted into laboratory hosts. J. Helminthol. 63, 218-226 Boithias, R., 1958: Quelques aspects de l’onchocercose Africaine. Bull. Soc. Franc. Ophthal. 71, 248-257 Boyer, A. E., Tsang, V.C., Eberhardt M.L., Zea-Flores G., Hightower, A., Pilcher, J.B., Zea-Flores, R., Zhou, W., Reimer, C.B., 1991: Guatemalan human onchocerciasis. II. Evidence for IgG3 involvement in acquired immunity to Onchocerca volvulus and identification of possible immune-associated antigens. J. Immunol. 68, 4001-4010 Bradley, J. E. and Unnasch, T. R., 1996: Molecular approaches to the diagnosis of onchocerciasis. Adv. Parasitol. 37, 57-106 Brattig, N. W., Tischendorf, F. W., Strote, G. & Medina de la Garza, C. E., 1991: Eosinophil-larval-interaction in onchocerciasis: heterogeneity of in vitro adherence of eosinophils to infective third and fourth stage larvae and microfilariae of Onchocerca volvulus. Parasit. Immunol. 13, 13-22 Brattig, N. W., Kranietz, I., Abakar, A.Z., Erttmann, K.D., Kruppa, T.F., Massougbodji, A., 1994: Strong IgG isotypic antibody response in sowda type oncocerciasis. J. Infect. Dis. 170, 955-961 76 Literaturverzeichnis Brattig, N. W., Nietz, C., Hounkpatin, S., Lucius, R., Seeber, F., Pichelmeier, U., Pogonka, T., 1997: Differences in cytokine responses to Onchocerca volvulus extract and recombinant Ov33 and OvL3-1 proteins in exposed subjects with various parasitological and clinical states. J. Infect. Dis. 176, 838-842 Brattig, N. W., Rathjens, U., Ernst, M., Geisinger, F., Renz, A., Tischendorf, F.W., 2000: Lipopolisacharide-like molecules derived from Wolbachia endobacteria of the filaria Onchocerca volvulus are mediators in the sequence of inflammatory and antiinflammatory responses of human monocytes. Microbes Infect. 2, 1147-1157 Brattig, N. W., Büttner, D. W., Hoerauf, A., 2001: Neutrophil accumulation around Onchocerca worms and chemotaxis of neutrophils are dependent on Wolbachia endobacteria. Microbes and Infection 3, 439-446 Brattig, N. W., 2004: Pathogenesis and host responses in human onchocerciasis: impact of Onchocerca filariae and Wolbachia endobacteria. Microbes Infect. 6 (1), 113-28. Braun-Munzinger, R. A., Schreiber, P., Southgate, B. A., 1977: Simplifying modifications of the microtitration plate technique for onchocerciasis surveys. Trans. Roy. Soc. Trop. Med. Hyg. 71, 548-549 Brinkmann, U. K., Kräer, P., Presthus, G. T., Sawadogo, B., 1976: Transmission in utero of microfilaria of O. volvulus. Bull. WHO 54, 708-709 Brinkmann, U. K., 1982: Onchozerkose in Westafrika. Frankfurt am Main: Lang Verlag Browne, S. G., 1959: Incidence and clinical manifestations of onchocerciasis in a focus in the Oriental Province of the Belgian Congo. Ann. Trop. Med. Parasit. 53, 421-429 Browne, S. G., 1960: Onchocercal depigmentation. Trans. roy. Soc. Trop. Med. Hyg. 54, 325-334 Bryceson, A. D., Warrell, D. A., Pope, H. M., 1977: Dangerous reactions to treatment of onchocerciasis with diethylcarbamazine. Br. Med. J. 1, 742-744 77 Literaturverzeichnis Büchler, C., Ritter, M., Orsó, E., Langmann, T., Klucken, J. and Schmitz, G., Jan. 2000: Regulation of scavenger receptor CD163 expression in human monocytes and macrophages by pro- and antiinflamatory stimuli. J. Leukocyte Biol. Vol. 67, 97-103 Burchard, G. D., Bierther, M., 1978: Electron microscopical studies on onchocerciasis. I. Mesenchym reactions in untreated onchocercal keratitis and ultrastructure of microfilariae. Tropenmed. Parasit. 29, 451-461 Burchard, G. D., Büttner, D. W., Bierther, M., 1979: Electron microscopical studies on onchocerciasis. III. The onchocerca-nodule. Tropenmed. Parasit. 30, 103-112 Burchard, G. D., Brattig, N.W., Kruppa, T.F., Horstmann, R.D., 1999: Delayed-type hypersensitivity reaction to Onchocerca volvulus antigen in exposed and non-exposed African individuals. Trans. R. Soc. Trop. Med. Hyg. 93, 103-105 Büttner, D. W., Rácz, P., 1983: Macro- and microfilariae in nodules from onchocerciasis patients in the Yemen Arab Republic. Tropenmed. Parasitol. 34, 113121 Büttner, D. W., 1998: Loiasis, Onchozerkose. In: Tischendorf, F. W. (Hrsg.), Der diagnostische Blick. Atlas und Textbuch der Differentialdiagnostik. Stuttgart, New York: Schattauer Calandra, T., Bernhagen, J., Metz, C. N., Spiegel, L. A., Bacher, M., Donnelly, T., Cerami, A., Bucala, R., 1995: IL-4 reciprocally regulates IL-1 and IL-1ra expression in human monocytes. J. Immunol. 149, 1283-1288 Carrera, L., Gazzinelli, R. T., Badolato, R., Hieny, S., Müller, W., Kühn, R., Sacks, D. L., 1996: Leishmania promastigotes selectively inhibit IL-12 induction in bone marrowderived macrophages from susceptible and resistant mice. J. Exp. Med. 183, 515-526 Chizzolini, C., Rezzonico, R., De Luca, R., Burger, D., Dayer, J.-M., 2000: Th2 cell membrane factors in association with IL-4 enhance matrix metalloproteinase-1 78 Literaturverzeichnis (MMP-1) while decreasing MMP-9 production by granulocyte-macrophage colonystimulating factor-differentiated human monocytes. J. Immunol. 164, 5952-5960 Connor, D. H., Morrison, N. E., Kerde-Vegas, F., Berkoff, H. A., Johnson, F., Tunnicliffe, R., Falling, F. C., Hale, L. N., Lindquist, K., 1970: Onchocercal dermatitis, lymphadenitis, and elephantiasis in the Ubangi Territory. Human Pathology 1, 553-579 Cooper, P. J. Espinel, I., Paredes, W., Guderian, R.H., Nutman, T.B., 1998: Impaired tetanus-specific cellular and humoral response following tetanus vaccination in human onchocerciasis: a possible role for interleukin-10. J. Infect. Dis. 178, 1133-1138 Cowan, H. B., Vick, S., Conary, J. T., Shepherd, V. L., 1992: Dexamethasone upregulates mannose receptor activity by increasing mRNA levels. Arch. Biochem. Biophy. 296, 314-320 Dafa’alla, T. H., Ghalib, H.W., Abdelmageed, A., Williams, J.F., 1992: The profile of IgG and IgG subclasses of onchocerciasis patients. Clin. Exp. Immunol. 88, 258-263 Darge, K., Lucius, R., Monson, M.H., Behrendsen, J., Büttner, D.W., 1991: Immunohistological and electron microscopic studies of microfilariae in skin and lymph nodes from onchocerciasis patients after ivermectin treatment. Trop. Med. Parasitol. 42, 361-367 de Villiers and Smart, E. J., 1999 : Macrophage scavenger receptor and foam cell formation. Leukoc. Biol. 66, 740-746 de Waal Malefyt, R., Yssel, H., Roncarolo, M-G., Spits, H., de Vries, J. E., 1992 : Inteleukin-10. Curr. Opin. Immunol. 4, 314-320 Djemadji-Ondjiel, N.D., Goerdt, S., Kodelja, V., Schmuth, M., Orfanos, C. E., 1996: Immunhistochemical indentification of type II alternatively activated dendritic macrophages (RM 3/1+++, MS-1+/-, 25F9-) in psoriatic dermis. Arch. Dermatol. Res. 288, 757-764 79 Literaturverzeichnis Duke, B. O. L., Beesley, W. N., 1958: The vertical distribution of Simulium damnosum bites on the human body. Ann. Trop. Ed. Parasit. 52, 274-281 Duke, B. O. L., 1973: Studies on the factors influencing the transmission of onchocerciasis. VIII. The escape of infective O. volvulus larvae from feeding „forest“ S. damnosum. Ann. Trop. Med. Parasit. 23, 354-368 Duke, B. O. L., Moore, P. J., 1974: The concentration of microfilariae of a Guatemalan strain of O. volvulus in skin snips taken from chimpanzees over 24 hours. Tropenmed. Parasit. 25, 153-159 Duke, B. O. L., Moore, P. J., Vincelette, J., 1975: Factors influencing the passage of O. volvulus microfilariae into the urine. Tropenmed. Parasit. 26, 449-468 Duke, B. O. L., 1990: Human onchocerciasis - an overview of the disease. Acta Leidensia 59, 9-24 Duke, B. O. L., 1993: The population dynamics of Onchocerca volvulus in the human host. Trop. Med. Parasitol. 44, 61-68 Droste, A., Sorg, C., Högger, P., 1999: Shedding of CD163 a novel regulatory mechanism for a member of the scavenger receptor cystein-rich family. Biochem. & Biophys. Res. Com. 256, 110-113 Eddelston, M., Pierini, S., 1999: Oxford Handbook of Tropical Medicine, Oxford University Press Elson, L. H., Calvopina, M., Paredes, W., Aranjo, E., Bradley, J.E., Guderian, R.H., Nutman, T.B., 1995: Immunity to onchocerciasis: putative immune persons produce a Th1-like response to Onchocerca volvulus. J. Infect. Dis. 171, 652-658 Fadok, V. A., Bratton, D. L., Konowal, A., Freed, P. W., Westcott, J. Y., Henson, P. M., 1998: Macrophages that have ingested apoptotic cells in vitro inhibit proinflammatory 80 Literaturverzeichnis cytokine production through actocrin/paracrine mechanisms involving TGF-γ, PGE2 and PAF. J. Clin. Invest. 101, 890-898 Fenton, M. J., Buras, J. A., Donnelly, R. P., 1992: IL-4 reciprocally regulates IL-1 and IL-1ra expression in human monocytes. J. Immunol. 149, 1283-1288 Fireman, E. M., Ephraim, S. B., Greif, J., Kivity, S., Topilski, M. R., 1988: Suppressor cell activity of human alveolar macrophages in interstitial lung diseases. Clin. Exp. Immunol. 73, 111-116 Flynn, S., Toellner, K.-M., Raykundalia, C., Goodall, M. & Lane, P., 1998: CD4+ T cell cytokine differentiation: the B cell activation molecule, OX40-Ligand, instructs CD4+ T cells to express interleukin 4 and up regulates expression of the chemokine receptor, Bir-1. J. Exp. Med. 188, 297-304 Franchimont, D., Martens, H., Hagelstein, M., Louis, E., Dewe, W., Chrousos, G. P., Belaiche, J., Geenen, V., 1999: TNFα decrease, and IL-10 increase, the sensitivity of human monocytes to dexamethasone: potential regulation of the glucocorticoide receptor. J. Clin. Endocrin. Metabol. 84, 2834-2839 Francis, H., Awadzi, K, Ottesen, E. A., 1985: The Mazzotti reaction following treatment of onchocerciasis with diethylcarbamazine: clinical severity as a function of infection intensity. Am. J. Trop. Med. Hyg. 34, 529-536 Franz, M., 1979: Elektronenoptische Untersuchungen der Oberflächenstrukturen von O. volvulus. Dissertation, Fachbereich Biologie, Hamburg Garms, R., Ochoa, J. O., 1979: Further studies on the relative importance of Guatemalan blackfly species as vectors of O. volvulus. Tropenmed. Parasit. 30, 120-128 Garms, R., Walsh, J. F., Davies, J. B., 1979: Studies on the reinvasion of the Onchocerciasis Control Programme in the Volta River Basin by S. damnosum s. l. with emphasis on the south-western areas. Tropmed. Parasit. 30, 345-361 81 Literaturverzeichnis Garner, A., 1976: Pathology of ocular onchocerciasis: human and experimental. Trans. Roy. Soc. Trop. Med. Hyg. 70, 374-377 Giri, J. G., Wells, J., Dower, S. K., McCall, C. E., Guzman, R. N., Slack, J., Bird, T. A., Shanebeck, K., Grabstein, K. H., Sims, J. E., Alderson, M. R., 1994: Elevated levels of shed type II IL-1 receptor in sepsis. J. Immunol. 153, 5802-5809 Goerdt, S., Orfanos, C. E., 1999: Other functions, other genes: Alternative activation of antigen-presenting cells. Immunity 10, 137-142 Gomez-Escobar, N., Lewis, E., Maizels, R.M., 1998: A novel member of the transforming growth factor-beta (TGF-beta) superfamily from the filarial nematodes Brugia malayi and B. pahangi. Exp. Parasitol. 88, 200-209 Gordon, S., 2003: Alternative activation of macrophages. Nature Rev. Immunology 3, 23-35 Grage-Griebenow, E., Lorenzen, D., Fetting, R., Flad, H. D., Ernst, M., 1993: Phenotypical and functional characterization of Fc-gamma-receptor I (CD 64)-negative monocytes a minor human monocyte subpopulation with high accessory and antiviral activity. Eur. J. Immunol. 23 (12) 3126-35 Gratchev, A., Schledzewski, K., Guillot, P., Goerdt, S., 2001: Alternatively activated antigen-presenting cells: Molecular repertoire, immune regulation, and healing. Skin Pharm. Appl. Skin Physiol. 14, 272-279 Greene, B. M., Taylor, H.R., Aikawa, M., 1981: Cellular killing of microfilariae of Onchocerca volvulus: eosinophil and neutrophil mediated immune serum dependent destruction. J. Immunol. 127, 1611-1618 Grogan, J. L., Kremsner, P.G., Deelder, A.M., Yazdanbakhsh, M., 1998: Antigenspecific proliferation and interferon-gamma and interleukin-5 production are downregulated during Schistosoma haematobium infection. J. Infect. Dis. 177, 1433-1437 82 Literaturverzeichnis Guan, P., Burghes, A. H. M., Cunningham, A., Liva, P., Brissette, W. H., Neote, K., McColl, S. R., 1999: Genomic organisation and biological characterisation of the novel human CC-chemokine DC-CK-1/PARC/MIP-4/SCYA18. Genomics 56, 296-302 Gutiérrez-Peña, E. J., Knab, J., Büttner, D.W., 1996: Neutrophil granule proteins: evidence for the participation in the host reaction to skin microflariae of Onchocerca volvulus after diethylcarbamazine administration. Parasitology 113, 403-414 Hartmann, S., Kyewski, B., Sonnenburg, B., Lucius, R., 1997: A filarial cystein protease inhibitor down-regulates T-cell proliferation and enhances interleukin-10 production. Eur. J. Immunol. 27, 2253-2260 Henry, N. L., Law, M., Nutman, T.B., Klion, A.D., 2001: Onchocerciasis in a nonendemic population: clinical and immunologic assessment before treatment and the time of presumed cure. J. Infect. Dis. 183, 512-516 Högger, P., Dreier, J., Droste, A., Buck, F., Sorg, C., 1998: Identification of the integral membrane protein RM 3/1 on human monocytes as a glucocorticoid-inducible member of the scavenger receptor cysrein-rich family (CD163). J. Immunol. 161, 1883-1905 Hoerauf, A., Volkmann, L., Hammelmann, C., Adjei, O., Auterieth, I.B., Fleischer, B., Büttner, D. W., 2000: Endosymbiontic bacteria in worms as targets for a novel chemotherapy in filariasis. Lancet 355, 1245-1243 Hoerauf, A., Mand, S., Adjei, O., Fleischer, B., Büttner, D.W., 2001: Depletion of Wolbachia endobacteria in Onchocerca volvulus by doxycycline and microfilaridermia after treatment. Lancet 357, 1415-1416 Hoerauf, A., Brattig, N.W., 2002: Resistance and susceptibility in human onchocerciasis – beyond Th1 vs. Th2. Trends Parasitol. 18, 25-31. Ito, S., Ausri, P., Sakatsume, M., Dickensheets, H., Vazquez, N., Donnelly, R. P., Larner, A. C., Finbloom, D. S., 1999: IL-10 inhibits expression of both IFN-α and 83 Literaturverzeichnis IFN-γ-induced genes by suppressing tyrosine phosphorylation of STAT1. Blood 93, 1456-1463 Jankovic, D., Liu, Z. & Gause, W. C., 2001: Th1- and Th2-cell commitment during infectious disease: asymmetry in divergent pathways. Trends Immunol. 22, 450-457 Jenkins, J. K., Malyak, M., Arend, W. p., 1994: The effect of IL-10 on IL-1ra and IL-1ß production in human monocytes and neutrophils. Lymphocine Cytokine Res. 13, 47-54 Johnson, E. H.,Irvine, M., Kass, P.H., Browne, J., Abdullai, M., Prince, A.M., Lustigman, S., 1994 : Onchocerca volvulus: in vitro cytotoxic effects of human neutrophils and serum on third-stage larvae. Trop. Med. Parasitol. 45, 331-335 Kalinski, P., Hilkens, C. M., Wierenga, E. A., Kalinski, P., 1999: T-cell priming by type-1 and type-2 polarized dendritic cells: the concept of a third signal. Immunol. Today 20, 561-567 Kapselberg, M. L., Hilkens, C.M., Wierenga, E. A., Kalinski, P., 1999: The paradigm of type 1 and type 2 antigen-presenting cells. Implication of atopic allergy. Clinical and Experimental Allergy 29, 33-36 Keiser, P. B., Reynolds, S. M., Awadzi, K., Ottensen, E. A., Taylor, M. J., Nutman, T. B., 2002: Bacterial endosymbionts of O. volvulus in the pathogenesis of posttreatment reactions. J. Infect. Dis. 185, 805-811 Kilian, H. D., 1988: Deep onchocercomata close to the thigh bones of a Liberian patient. Trop. Ed. Parasit. 39, 247-348 King, C. L., Mahanty, S., Kumaraswami, V., Abrams, J.S., Regunathan, J., Jayaraman, K., Ottesen, E.A., Nutman, T.B., 1993: Cytokine control of parasite-specific anergy in human lymphatic filariasis. Preferential induction of a regulatory T helper type 2 lymphocyte subset. J. Clin. Invest. 92, 1667-1673 84 Literaturverzeichnis Kodelja, V., Goerdt, S., 1994: Dissection of macrophages differentiation pathways in cutaneous macrophage disorders and in vitro. Exp. Dermatol. 3, 257-268 Kodelja, V., Müller, C., Tenorio, S., Schebesch, C., Orfanos, C. E., Goerdt, S., 1997: Differences in angiogenic potential of classically vs alternatively activated macrophages. Immunobiol. 197, 478-493 Kodelja, V., Müller, C., Politz, O., Hakij, N., Orfanos, C. E., Goerdt, S., 1998: Alternative macrophage activation-associated CC-chemokine-1, a novel structural homologue of macrophage inflammatory protein-1α with a Th2-associated expression pattern. J. of Immunology 160, 1411-1418 Korten, S., Wildenburg, G., Darde, K., Büttner, D.W., 1998: Mast cells in onchocercomas from patients with hyperreactive onchocerciasis (sowda). Acta Trop. 70, 217-231 Kristiansen, M., Graversen, J. H., Jacobsen, C., Sonne, O., Hoffman, H-J., Alex Law, S. K., Moestrup, S. K., 2001: Identification of the haemoglobin scavenger receptor. Nature 409, 198-201 Lagraulet, J., 1971: Évolution de l’onchocercose en dehors des zones d’endémie. Bull. Soc. Path. Exot. 64 (1) 100-103 Lammie, P. J. & Katz, S. P., 1983: Immunoregulation in experimental filariasis. In vitro suppression of mitogen-induced blastogenesis by adherent cells from Jirds chronically infected with Burgia pahangi. J. Immunol. 130,1381-1385 Lin, J. S. H., Amaral, T. D., Brosnan, C. F., Lee, S. C., 1998: IFNs are critical regulators of IL-1 receptor antagonist and IL-1 expression in human microglia. J. Immunol. 161, 1989-1996 Loke, P., MacDonald, A. S., Robb, A., Maizels, R. M. & Allen, J. E., 2000: Alternative activated macrophages induced by nematode infection inhibit proliferation via cell to cell contact. Eur. J. Immunol. 30, 2669-2678 85 Literaturverzeichnis Loke, P., Nair, M.G., Parkinson, J., Guiliano, D., Blaxter, M., Allen, J.E., 2002: IL-4 dependent alternatively activated macrophages have a distinctive in vitro gene expression phenotype. BMC Immunol. 3, 7 Lucius, R., Kern, A., Seeber, F., Pogonka, T., Willenbucher, J., Taylor, H. R., Pinder, M., Ghalib, H. W., Schulz-Key, H., Soboslay, P., 1992: Specific and sensitive IgG4 immunodiagnosis of onchocerciasis with a recombinant 33 kD Onchocerca volvulus protein (Ov33).Trop. Med. Parasitol. 43, 139-45 Lustigman, S., Mc Kerrow, J. H., Shah, K., Lui, J., Huima, T., Hough, M., Brotman, B., 1996: Cloning of a cysteine protease required for the moulting of Onchocerca volvulus third stage larvae. J. Biol. Che. 271, 46-72 MacDonald, A. S., Maizels, R. M., Lawrence, R. A., Dransfield, I., Allen, J. E., 1998: Requirement for in vivo production of IL-4, but not IL-10, in the induction of proliferative suppression by filarial parasites. J. Immunol. 160, 4124-4132 MacDonald, A. S., Strw, A. D., Bauman, B. & Pearce, E. J., 2001: CD8- dendritic cell activation status plays an integral role in influencing Th2 response development. J. Immunol. 167, 1982-1988 Madsen, M., Graverson, H. J., Moestrup, S. K., 2001: Haptoglobin and CD163: captor an receptor gating haemoglobin to macrophage lysosomes. Redox Report Vol. 6, No. 6, 386-388 Mahanty, S., Mollis, S.N., Ravichandran, M., Abrams, J.S., Kumaraswami, V., Jayaraman, K., Ottesen, E.A., Nutman, B., 1996: High levels of spontaneous and parasite antigen-driven interleukin-10 production are associated with antigen-specific hyporesponsiveness in human lymphatic filariasis. J. Infect. Dis. 173 769-773 Maizels, R. M., Sartono, E., Kurniawan, A., Partono, F., Selkirk, M. E. & Yazdanbakhsh, M., 1995: T-cell activation and the balance of antibody isotypes in human lymphatic filariasis. Parasitol. Today 11, 50-56 86 Literaturverzeichnis Maizels, R. M., Yazdanbakhsh, M., 2003: Immune regulation by helminth parasites: cellular and molecular mechanisms. Nature Reviews 3, 733-744 Mazzotti, L., 1948 : Possibilidad de útilizar como medio diagnóstico en la onchocercosis las rectiones alérgicas consecutivas a la administración de Hetrazan. Rev. Inst. Salubr. Enferm. Trop. (Mex) 9, 235-237 McMahon, J. E., Simonsen, P. E., 1996: Filariases. In: Manson’s tropical diseases. G. C. Cook (ed), W. B. Saunders (London) 20 ed 1321-1368 Medina de la Garza, C. E., Brattig, N. W., Tischendorf, F. W., 1990: Serum-dependent interaction of granulocytes with Onchocerca volvulus microfilariae in generalized and chronic hyperreactive onchocerciasis and its modulation by diethylcarbamazine. Trans. Roy. Soc. Trop. Med. Hyg. 84, 701-706 Mereer, J. G., Barker, G. C., Howells, R. E., Rees, H. H., 1989: Analysis of ecdysteroids in O. volvulus and nodule tissues. Trop. Med. Parasit. 40, 434-439 Modolell, M., Corraliza, I. M., Link, F., Soler, G., Eichmann, K., 1995: Reciprocal regulation of the nitric oxide synthase/arginase balance in mouse bone marrow-derived macrophages by Th1 and Th2 cytokines. Eur. J. Immunol. 25, 1101-1104 Møller, H. J., Aerts, H., Grøub, Æ. K., Peterslund, N. A., Hyltoft Petersen, P., Horunng, N., Rejnmark, L., Jabbarpour, E., Moestrup, S. K., 2002: Soluble CD163: a marker molecule for monocyte/macrophage activity in disease. Scand. J. Clin. Lab. Invet. 62, 386-388 Mosser, D. H., Handman, E., 1992: Treatment of murine macrophages with interferon-γ inhibits their ability to bind leishmania promastigotes. J. Leukoc. Biol. 52, 369-376 Mpagi, J. L., Büttner, D.W., Tischendorf, F.W., Erttmann, K.D., Brattig, N.W., 2000: Use of the recombinant Onchocerca volvulus protein Ov20/OvS1 for the immunodiagnostic differentiation between onchocerciasis and mansonelliasis and for 87 Literaturverzeichnis the characterization of hyperreactive onchocerciasis (sowda). Trop. Med. Int. Health 5, 891-897 Mues, B., Langer, D., Zwadlo, G., Sorg, G., 1989: Phenotypic characterisation of macrophages in human term placenta. Immunol. 67, 303-307 Nair, M. G., Cochrane, D. W. & Allen, J. E., 2003: Macrophages in chronic type 2 inflammation have a novel phenotype characterized by the abundant expression of Ym1 and Fizz1 that can be partly replicated in vitro. Immunol. Lett. 85, 173-180 Nelson, G. S., 1958: “Hanging groin” and hernia, complications of onchocerciasis. Trans. roy. Soc. Trop. Med. Hyg. 52, 272-275 Nelson, G. S., 1970: Onchocerciasis. Avd. Parasit. 8, 173-224 Nepper, C. E., Dyson, M. H., Taylor, M. E., 2001: An extended conformation of the makrophage mannose receptor. JBC Papers in Press Feb. 8, 2001 Omar, M. S., Franz, M., Büttner, D. W., 1979: Some observations on onchocerciasis including sowda in the Yemen Arab Republic. Tropenmed. Parasit. 30, 113-119 Ottesen, E. A., 1995: Immune responsiveness and the pathogenesis of human onchocerciasis. J. Infect. Dis. 171, 659-671 Pastrana, D. V., Raghavan, N., Fitzgerald, P., Eisinger, S. W., Metz, C., Bucala, R., Schleimer, R. P., Nickel, C., Scott, A. L., 1998: Filarial nematode parasites secrete a homologue of the human cytokine macrophage migration inhibitory factor. Infect. Immunol. 66, 5955-5963 Philippon, B., Quillevere, B., 1977: Influence of Simulium cytotypes in the transmission of O. volvulus in the OCP area. OCP / SAP / 77 / WP / 8 88 Literaturverzeichnis Piessens, W. F., Ratiwayanto, S., Tuti, S., Palmieri, J.H., Piessens, P.W., Koiman, I., Dennis, D.T., 1980: Antigen specific suppressor cells and suppressor factors in human filariasis with Brugia malayi. New Eng. J. Med. 302, 833-837 Reber, E. W. & Hoeppli, R., 1964: The relationship between macroscopic skin alterations, histological changes and microfilariae in one hundred Liberians with onchocercal dermatitis. Z. Tropenmed. Parasit. 15, 153-163 Reis e Sousa, C., 2001: Dendritic cells as sensors of infection. Immunity 14, 495-498 Rousset, F., Garcia, E., Defrance, T., Péronne, C., Di-Hwei Hsu, N., Kastelein, R., Moore, K. W., Banchereau, J., 1992 : Interleukin 10 is a potent growth and differentiation factor for activated human B lymphocytes. Proc. Natl. Acad. Sci. USA 88, 1890-1893 Sang, E., Ouyang, N., Hörbelt, M., Antus, B., Wang, M., Exton, M. S., 2000: Influence of alternatively and classically activated macrophages on fibrogenic activities of human fibroblasts. Cell. Imunnol. 204, 19-28 Sartono, E., Kruize, Y.C., Kurniawan, A., Maizels, R.M., Yazdandakhsh, M., 1997: Depression of antigen-specific interleukin-5 and interferon-gamma responses in human lymphatic filariasis as a function of clinical status and age. J. Infect. Dis. 175, 12761280 Schäfer, H.-G., Gümbel, H. O. C., 2004: Infektionen des Auges. In: Tischendorf, F. W., Meyer, C. H., Spraul, C. W.: Auge und Innere Medizin. Okuläre Veränderungen bei systemischen Erkrankungen. Tischendorf, F.W. (Hrsg.), Stuttgart, New York: Schattauer Schebesch, C., Kodelja, V., Müller, C., Hakij, N., Bisson, S., Orfanos, C.E., Goerdt, S., 1997: Alternatively activated macrophages actively inhibit proliferation of peripheral blood lymphocytes and CD4+ T cells in virto. Immunol. 92, 478-486 89 Literaturverzeichnis Schierack, P., Lucius, R., Sonnenkrug, B., Schilling, K., Hartmann, S., 2003: Parasitespecific immunomodulatory functions of filarial cystatin. Infec. & Immun. 71, No.:5 Schönemeyer, A., Lucius, R., Sonnenkrug, B., Brattig, N., Sabat, R., Schilling, K., Bradley, J., Hartmann, S., 2001: Modulation of human T cell responses and macrophage function by onchocystatin, a secreted protein of the filarial nematode Onchocerca volvulus. J. Immunol. 167, 3207-3215 Schulz-Key, H., Albiez, E. J. and Büttner, D.W., 1977: Isolation of living adult Onchocerca volvulus from nodules. Tropmed. Parasitol. 28, 428-430 Schulz-Key, H., 1990: Observation on the reproductive biology of Onchocerca volvulus. Acta Leidensia 59, 27-43 Schumacher, H., 1965: Zur Morphologie und Pathogenese der Hautveränderung bei menschlicher Onchozerkose. Z. Tropenmed. Parasit. 16, Heft 3 Schwartz, E. C., Huss, R., Hopkins, A., Dajim, B., Madjitoloum, P., Henault, H.C., Klauss, V., 1997: Blindness and visual impairment in a region epidemic for onchocerciasis in the Central African Republic. British Journal of Ophthalmology 81, 443-447 Senker, C., Noamesi, G. K., McRae, T. M., 1973: Onchocerciasis survey in the basin of the White Volta River and the Kupawn River in northern Ghana. Ghana med. J. 12, 5665 Soboslay, P. T., Geiger, S.M., Drabner, B., Baula, M., Batchassi, E., Kowu, L.A., Stadler, A., Schulz-Key, H., 1997: The diverse expression of immunity in humans at distinct states of Onchocerca volvulus infection. Immunology 90, 592-599 Soboslay, P. T., Luder, C.G., Riesch, S., Geiger, S.M:, Baula, M., Batchassi, E., Stadler, A., Schulz-Key, H., 1999: Regulatory effects of Th1-type (IFN-γ, IL-12) and Th2-type cytokines (IL-10, IL-13) on parasite-specific cellular responsiveness in Onchocerca volvulus-infected humans and exposed endemic controls. Immunology 97, 219-225 90 Literaturverzeichnis Song, E. Ouyang, N., Horbelt, H., Antus, B., Wang, M., Exton, M. S., 2000: Influence of alternatively and classically activated macrophages on fibrogenic activities of human fibroblasts. Cellular Immunology 204, 19-28 Stahl, P. D., Alan, R., Ezekowitz, B., 1998: The mannose receptor is a pattern recognition receptor involved in host defence. Curr. Opin. In Immunol. 10, 50-55 Steel, C. and Nutman, T. B., 1993: Regulation of IL-5 in onchocerciasis. A critical role for IL-2. J. Immunol. 150, 5511-5518 Stein, W., Keshav, S., Harris, N., Gordon, S., 1992: Interleukin 4 potently enhances murine macrophages mannose receptor activity: a marker of alternative immunologic macrophage activation. J. Exp. Med. 176, 287-292 Steinbrink, K., Wölf, M., Jonnleit, H., Knop, J., Enk, A. H., 1997: Induction of tolerance by IL-10 treated dendritic cells. J. Immunol. 159, 4772-4780 Strote, G., Bonow, I., 1991: Morphological demonstration of essential functional changes after in vitro and in vivo transition of infective Onchocerca volvulus to the postinfective stage. Parasitol. Res. 77, 526-535 Sulahian, T. H., Högger, P., Wahner, A. E., Wardwell, K., Goulding, N. J., Sorg, C., Droste, A., Stehling, M., Wallace, P. K., Morganelli, P. M., Guyre, P. M., 2000: Human monocytes express CD163 which is upregulated by IL-10 and identical to P155. Cytokine vol. 12, No. 9, 1312-1321 Sutterwale, F. S., Noel, G. J., Clynes, R., Mosser, D. M., 1997: Selective suppression of IL-12 induction after macrophage receptor ligation. J. Exp. Med. 185, 1977-1985 Takeuchi, M., Kosiewicz, M. M., Alard, P., Streilein, J. W., 1997: On the mechanisms by which transforming growth factor-ß2 alters antigen-presenting abilities of macrophages on T cell activation. Eur. J. Immunol. 27, 1648-1656 91 Literaturverzeichnis Taylor, M. J., 1994: Onchocerca volvulus infection in chimpanzees: an assessment of the requirements for vaccination trials. J. Helminthol. 68, 3-6 Taylor, M. J., Bilo, K., Cross, H. F., Archer, J. P., Underwood, A.P., 1999: 16S rDNA phylogeny and ultrastructural characterisation of Wolbachia intracellular bacteria of the filarial nematodes Brugia malayi, B. pahangi and Wuchereria bancrofti. Experimental Parasitol. 91, 356-361 Taylor, M. J., Hoerauf, A., 1999: Wolbachia bacteria of filarial nematodes. Parasitol. Today 15, 437-442 Taylor, M. J., Cross, H.F:, Bilo, K., 2000: Inflammatory responses induced by the filarial nematode Brugia malayi are mediated by lipopolysaccharide-like activity from endosymbiotic Wolbachia bacteria. J. Exp. Med. 191, 1429-1436 Thylefors, B., 1978: Ocular onchocerciasis. Bull. Wld. Hlth. Org. 56, 63-73 Tischendorf, F.W., Brattig, N.W., Büttner, D.W., Pieper, A., Lintzel, M., 1996: Serum levels of eosinophil cationic protein, eosinophil-derived neurotoxin and myeloperoxidase in infections with filariae and schistosomes. Acta Tropica 62, 171-182 Tischendorf, F. W., Brattig, N. W., Burchard, G. D., Kubica, T., Kreuzpaintner, G., Lintzel, M., 1999: Eosinophils, eosinophil cationic protein and eosinophil-derived neurotoxin in serum and urine of patients with onchocerciasis coinfected with intestinal nematodes and in urinary schistosomiasis. Acta Tropica 172, 157-173 Turaga, P.S., Tierney, T.J., Bennett, K.E., McCarthy, M.C., Simonek, S.C., Enyong, P.A., Monkatte, D.W., Lustigman, S., 2000: Immunity to onchocerciasis: cells from putatively immune individuals produce enhanced levels of interleukin-5, Interferon-γ, and granulocyte-macrophage colony-stimulating factor in response to Onchocerca volvulus larval and male worm antigen. Infect. Immunol. 68, 1905-1911 92 Literaturverzeichnis Turner, F., Rockett, K. A., Ottesen, E. A., Francis, H., Awadzi, K., Clark, I. A., 1994: IL-6 and TGF in the pathogenesis of adverse reaction following treatment of lymphatic filariasis and onchocerciasis. J. Infect. Dis. 169, 1071-1075 Ullrich, S. E., 1994: Mechanism involved in the systemic suppression of antigenpresenting cell function by UV irradiation. J. Immunol. 152, 3410-3416 Van den Heuvel, M. M., Tensen, C. P., van As, J. H., Van den Berg, T. K., Fluitsma, D. M., Dijkstra, C., Döpp, E. A., Droste, A., Van Gaalen, F. A., Sorg, C., Högger, P. and Beelen, R. H. J., Nov 1999: Regulation of CD163 on human macrophages: cross-linking of CD 163 induces signalling and activation. J. Leukocyte Biol. Vol. 66, 858-866 Van de Winkel, J. G. & Capel, P. J., 1993: Human IgG Fc receptor heterogeneity: molecular aspects and clinical implications. Immunol. Today 14, 215-221 Velupillai, P., Sypek, J., Harn, D.A., 1996: B-cell outgrowth and ligand-specific production of IL-10 correlate with Th2 dominance in certain parasitic diseases. Exp. Parasitol. 84, 168-177 Weiss, U., 1978: Anzahl und Verteilung der Knoten und Würmer bei Kindern mit Onchozerkose in Liberia und Obervolta/Westafrika. Dissertation, Fachbereich Medizin, Hamburg Wenzel, I., Sorg, C., 1996: Identification of a novel surface molecule, RM3/1, that contributes to the adhesion of glucocorticoid-induced human monocytes to endothelial cells. Eur. J. Immonol. 26, 2758-2763. Whelan, M., Harnett, M.M., Houston, K.M., Patel, V., Harnett, W., Rigley, K.P., 2000: A filarial nematode–secreted product signals dendritic cells to acquire a phenotype that drives development of Th2 cells. J. Immunol. 164, 6453-6460 Wierenga, E. A., Snoek, M., Bos, J. D., Jansen, H. M. & Kapselberg, M. L., 1990: Comparison of diversity and function of house dust mite specific T lymphocyte clones from atopic and non-atopic donors. Eur. J. Immunol. 20, 1519-1526 93 Literaturverzeichnis Wilckens, T., de Rijk, R., 1997: Glucocorticoids and immune function: unknown dimensions and new frontiers. Immunol. Today, Vol. 18, No. 9, 418-424 Wildenburg, G., Krömer, M., Büttner, D. W., 1996: Dependence of the eosinophil granulocyte infiltration into nodules on the presence of microfilariae producing Onchocerca volvulus. Parasitol. Res. 82, 117-124 Williams, L., Jarai, G., Smith, A., Finan, P., 2002: IL-10 expression profiling in human monocytes. J. of Leukocyte Biology 72, 800-809 Woiciechowsky, C., Asadullah, K., Nestler, D., Eberhardt, B., Platzer, C., Schöning, B., Glöckner, F., Lanksch, W. R., Döcke, W., Volk, H., 1998: Sympathetic activation triggers systemic IL-10 release in immunodepression induced by brain injury. Nature Med. 4, 808-813 Woiciechowsky, C., Schöning, B., Lauksch, W. R., Volk, H.-D., Döcke, W.-D., 1999: Mechanisms of brain-mediated systemic anti-inflammatory syndrome causing immunodepression. J. Mol. Med. 77, 769-780 World Health Organisation (WHO) 1995: Onchocerciasis and its control. Report of a WHO Expert Committee on Onchocerciasis Control. Geneva. WHO Tech. Rep. Ser. 852, 1-96 Yates, R. A., Tuank, R. S., Shepley, K. J., Unnasch, T. R., 1995: Characterisation of genes encoding members of the nuclear hormone receptor superfamily from O. volvulus. Mol. Biochem. Parasitol. 70, 19-31 Zlotnik, A., Moore, K. W., 1992: Interleukin 10. Cytokine 3, 366-371 94 Anhang Curriculum vitae Name: Florestan Gerald Höckh Geburtsdatum: 19. März 1976 Geburtsort: Wiesbaden / Sonnenberg Schulen und Studium 1982 bis 1986 Grundschule Musberg, Leinfelden-Echterdingen 1986 bis 1992 Albert-Schweitzer-Realschule, Tübingen, Abschluß: Mittlere Reife 1992 bis 1995 Wirtschaftsgymnasium Tübingen, Abschluß: Allgemeine Hochschulreife 1997 bis 2003 2003 bis 2004 Studium der Humanmedizin, Universität Hamburg März 1999 Physikum März 2001 Erstes Staatsexamen März 2003 Zweites Staatsexamen Studium der Humanmedizin, Universität Freiburg Praktisches Jahr: Innere Medizin, Universitätsklinikum Freiburg Chirurgie, Universitätsklinikum Sevilla/Spanien Wahlfach: Pädiatrie, Universitätsklinikum Freiburg Nov. 2004 1999 Drittes Staatsexamen Beginn der Medizinischen Doktorarbeit am Bernhard-NochtInstitut für Tropenmedizin, Abteilung für Klinische Chemie Auslandsaufenthalte Feb. bis Mai 2004 Chirurgie, Hospital Virgen de Macarena, Univ. Sevilla / Spanien Sept. 2003 Praktikum, Hospital for Tropical Diseases, London / England Sept. 1999 Famulatur Pädiatrie, Hospital Heodra, León / Nicaragua Sprachen Englisch und Spanisch fließend, Französisch: Anfängerniveau 95 Anhang Danksagung: Herrn Priv.-Doz. Dr. med. F. W. Tischendorf danke ich für seine Unterstützung meiner Arbeit und für die hilfreiche und kritische Beratung bei der Anfertigung der Dissertation. Herrn Priv.-Doz. Dr. N. W. Brattig danke ich für die durchgehende Betreuung dieser Arbeit sowie für die anregenden Gespräche und Diskussionen. Herrn Prof. Dr. H. Schmitz, Leiter der Abteilung Virologie, danke ich für die Bereitstellung des Arbeitsplatzes am Durchflußzytometer. Herrn Dr. M. Ernst, des Forschungszentrums Borstel in Hamburg, danke ich für die Versorgung mit gereinigten Monozyten. Besonderer Dank geht an meine Mitdoktoranden Arline Schwohl und Antje Wagner sowie an Maren Lintzel, Wilfried Grönwoldt und Frank Geisinger für ihre technische Hilfe und das freundliche Arbeitsklima sowie den Kaffee zwischendurch. Mein spezieller Dank gilt meiner Familie, die mir nicht nur das Studium der Medizin ermöglichte. Ein weiterer Dank gilt meinem Freundeskreis für die anregenden Gespräche und den Zusammenhalt im Studium. 96 Anhang Eidesstattliche Versicherung Ich versichere ausdrücklich, daß ich die Arbeit selbständig und ohne fremde Hilfe verfaßt, andere als die von mir angegebenen Quellen und Hilfsmittel nicht benutzt und die aus den benutzten Werken wörtlich oder inhaltlich entnommenen Stellen einzeln nach Ausgabe, Auflage und Jahr des Erscheinens des benutzten Werkes kenntlich gemacht habe. Ferner versichere ich, daß ich die Dissertation bisher nicht einem Fachvertreter an einer anderen Hochschule zur Überprüfung vorgelegt oder mich anderweitig um Zulassung zur Promotion beworben habe. Tübingen, den 12. Februar 2005 97