Extrazelluläre Kontrolle der Zellteilung, Zellwachstum und Apoptose
Werbung
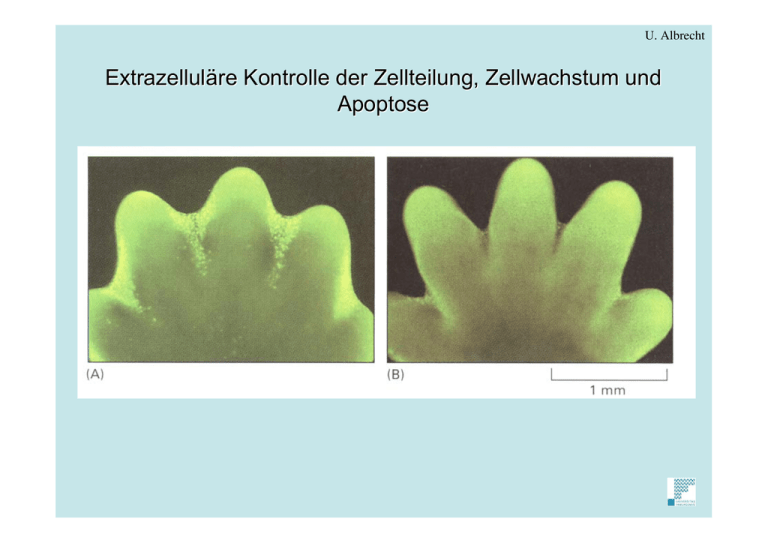
U. Albrecht Extrazelluläre Kontrolle der Zellteilung, Zellwachstum und Apoptose U. Albrecht 1. Extrazelluläre Kontrolle der Zellteilung, Zellwachstum Einzelliger Organismus -> Teilung -> neues Individuum -> natürliche Selektion begünstigt die Zellen welche: 1) am schnellsten wachsen 2) schlechte Zeiten am besten überleben. -> Proliferation ist beeinflusst nur von Nährstoffangebot und Sex. Mehrzellige Organismen -> Selektion nicht auf Ebene jeder Einzelzelle sondern auf dem Zellverband -> Zellverband unterliegt strikten Kontrollen welche Proliferation verhindern. -> im adulten Organismus teilen sich Zellen nicht -> in Ruhephase -> Ausführen spezialisierter Funktionen. -> Nährstoffe normalerweise im Ueberfluss -> Zellen müssen gebremst werden nicht zu proliferieren, dagegen würden Bakterein und Hefen unter diesen Bedingungen prolifereiern. -> was ist Unterschied in der Regulation? Für mehrzellige Organismen Nahrung für Zellen alleine nicht genug für Zellteilung -> Zellen müssen positives Signal von anderen Zellen erhalten. -> Wachstumsfaktoren -> binden an Rezeptoren der Zelloberfläche -> intrazelluläre negative Signale werden übergangen. Hefe: Zelleproliferiert ausser negatives Signal wird erhalten Tierzelle: Zelle stopt ausser postives Signal wird erhalten. U. Albrecht 4 Fragen: 1) Wie ist Säugerzellzykluskontrollsystem 2) Wie ist Proliferation kontrolliert 3) Was sind die Extrazellulären Signale 4) Wie überstimmen diese Signale das intrazelluläre Blockiersystem? U. Albrecht Regulation des Säugerzellzyklus wird mit kultivierten Zellinien studiert Säugerzellen teilen sich in Kultur nur etwa 50 mal, dann Zelltod -> senescence Allerdings: in Kulturen -> wenige Zellen entrinnen Zelltod -> teilen sich unbegrenzt => Zelllinie -> sehen aus wie normale Zellen aber Achtung: Nachteil: Abnormal -> mindestens 1 Mutation Vorteil: Unlimitiertes Zellmaterial -> standardisiert und genetisch homogen Wachstumsfaktoren stimulieren die Proliferation von Säugerzellen Säugerzellen -> Kulturmedium mit Nährstoffen -> wachsen nicht !! -> + Serum -> Wachstum ! Vergleiche: Hefe keine Nährstoffe -> Zellzyklusarrest Säugerzellen kein Serum -> Zellzyklus arrest -> G0 Was ist Serum ? -> Wachstumsfaktoren in geringer Konzentration (10-9 - 10-11 M) Einer der ersten aufgereinigten Wachstumsfaktoren = platelet-derived growth factor (PDGF) U. Albrecht Platelets sind kleine Zellen ohne Nukleus. Sie zirkulieren im Blutstrom und helfen die Blutgerinnung an geschädigtem Gewebe zu stimulieren. Dadurch wird übermässiges Bluten verhindert. Platelets sezernieren auch Faktoren die Heilung stimulieren. Im Bild ist ein aufgeschnittenes Platelet (Blutplättchen) gezeigt um die sekretorischen Vesikel zu zeigen. Einige dieser Vesikel enthalten den sogenannten platelet derived growth factor (PDGF). Serum Serum = Ueberstand nach Koagulation Plasma Plasma = Ueberstand ohne Koagulation Warum dieser Unterschied? Platelets sekretieren ihren Inhalt, wenn sie in den Blood Clot eingeschlossen werden -> PDGF gelangt ins Serum U. Albrecht Mitogene -> Zellteilung Wachstumsfaktoren -> Zellwachstum Survival Factors -> suprimieren Apoptose U. Albrecht Wachstumsfaktoren haben spezifische Rezeptoren Growth Factor Receptor Kombination von mehreren Faktoren wichtig für viele Zelltypen Wachstumsfaktoren in geringer Konzentration -> Isolation über Identifikation der DNA U. Albrecht Serum Deprivation verhindert Durchgang von G1 Checkpoint Zellkulturen -> beobachten mit time-lapse Video -> experimentelle Behandlung -> Effekt z.B. -> Serum weg für 1 Stunde -> dramatischer Effekt Videographischer Referenzpunkt: Mitose 3.5 h nach Mitose Serumentzug gehen in G0 + Serum mehr als 3.5 h nach Mitose Serumentzug Cycle geht weiter Zellen sind commited dauert 8 Stunden G1 checkpoint ist 3.5 Stunden von Mitose weg! Wachstumsfaktoren kritisch zwischen Mitose und G1-Checkpoint ! -> wenn Serum entfernt -> Protein Synthese geht runter weil Protein Synthese inhibitoren (Cycloheximide) in später G2 -> Zellen durch Mitose -> Stop in G1 U. Albrecht 3.5 h Serumentzug S G2 M G1 Cycloheximide G1-Checkpoint Maschinerie ist nötig für G1-S Transition aber nicht für Mitose U. Albrecht Benachbarte Zellen kompetitieren für Wachstumsfaktoren Zellproliferation muss reguliert weil damit: Regulation abhängig von: 1) Anzahl Zellen 2) räumliche Anordnung sichergestellt ist. 1) Zell-Zell Interaktionen 2) Kontakt zu extracellulärer Matrix z.B. Epithel -> Zellen sterben -> müssen ersetzt werden und in Platz passen. Nur Zellen die in Kontakt sind mit basal lamina proliferieren -> messen 1) Zelldichte 2) Kontakt zu basal lamina Meiste Experimente mit Fibroblasten -> nur bedingt übertragbar auf Organe. U. Albrecht Dissozierte Zellen -> kultivieren in Schale -> heften sich an -> wachsen zu konfluentem Monolayer -> dann Stop => zelldichteabhängige Inhibition der Zellteilung Wounding experiment: Kontakt Inhibition? U. Albrecht -> nicht nur Kontakt sondern Menge von Wachstumsfaktoren ist wichtig Zelldichte abhängige Inhibition -> Fähigkeit der Zelle lokale Wachstumsfaktorkonzentration zu ändern. z.B. PDGF -> 10-10M = ca. 1 Molekül in Kugel mit 3 m Durchmesser Fibroblast hat etwa 105 PDGF Rezeptoren -> kann alles PDGF in der Umgebung von Kugel mit 150 m Durchm. binden. eine Zelle kann Umgebung von PDGF befreien -> Kompetition zwischen Zellen -> viele Zellen -> kein freies PDGF mehr -> Proliferationsstop. U. Albrecht Normale Tierzellen müssen verankert sein um Start zu passieren Kompetition für Wachstumsfaktoren nicht einziger Einfluss auf Proliferation -> Form der Zelle wichtig! Fibroblasten und Epithelzellen -> teilen sich nicht wenn in Suspension Anchorage dependence of cell division Gut ausgebreitete Zellen -> grössere Oberfläche -> mehr Wachstumsfaktoren und Nahrung -> teilen sich besser Focal adhesion point genügt -> Intracelluläre actin filamente + extracelluläre matrix Moleküle Proliferation ist gekoppelt an die Organisation des Zytoskelets. Lamin und Fibronektin -> können als Wachstumsfaktoren wirken. Zelle in Zyklus -> M-Phase rund -> G1 flach -> attachement und detachement -> wichtig um neugenerierte Tochterzellen in den Zellverband einzubetten. U. Albrecht Das Studium von Krebszellen offenbahrt Gene wichtig für Zellzykluskontrolle Externe Einflüsse wie Wachstumsfaktoren und Zellform -> Wie übersetzt in molekulare Sprache? Effekte auf Zellkern und Proliferation Wachstumsfaktor Bindet an Rezeptoren Studium von Krebszellen die ein Gen mutiert haben oder mehrere können proliferative Gene sein -> Assembly control System oder antiproliferative Gene -> Disassambly of control System Mutiertes Gen = Oncogen (gleiches Gen ohne Mutation = Proto-oncogen) Wenn mutiert = Tumor-suppressor Gene U. Albrecht Zellzyklus Progression ist koordiniert mit Zellwachstum in Hefe In Hefe Nahrungsangebot und Zellgrösse gekoppelt an Zellteilung (siehe vorher) Wie kann Grösse gemessen werden? In Hefe möglicherweise über messen von G1 cyclin das parallel zum Wachstum synthetisiert wird. Hypothet. Cln3 Bindeprotein auf DNA konstant -> von gewisser Grösse an Cln3 frei -> Zellteilung. U. Albrecht Zellwachstum und Zellteilung kann unabhängig reguliert werden in Säuger Zellen Hefe: Verhältnis Cytoplasma/DNA starr Säuger: Verschiedene Zelltypen mit spezialisierter Funktion -> Verhältnis Cytoplasma/DNA variabel Wie wird dann in Säugerzellen Zellteilung Reguliert? spezielle Wachstumsfaktoren die entweder Wachstum oder Replikation beeinflussen. z.B. Neuronen -> können sehr viel wachsen ohne sich zu teilen -> nerve growth factor (NGF) von zu enervierenden Zellen sezerniert -> Wachstum des Neurons in die Richtung der sezernierenden Zelle. Grösse eines Organs: Anzahl Zellen + Grösse der Zellen Reguliert durch Zellwachstum, Zellteilung und Zelltod (Apoptose) Moleküle die dies regulieren: Sekretierte Proteine, Zelloberflächen Strukturen, Extrazelluläre Matrix Eingeteilt in: 1) Mitogene -> Zellteilung 2) Wachstumsfaktoren -> Zellwachstum 3) Survival Factors -> suprimieren Apoptose U. Albrecht Zellen können Teilung verzögern durch Eintritt in Ruhephase Säugerzellen in Kultur -> kein Serum (Growth factors) -> machen Zyklus fertig bis G1, dann Stop -> G0 G0 -> Protein Synthese reduziert, nur noch ca. 20% Auch Nahrungsmangel führt zu Stop -> G0 Hefe -> G1 checkpoint -> Start Säugerzellen -> Nahrung im Ueberfluss -> Wachstumsfaktoren kritisch -> Eintritt in G0 -> Variabilität in Zellzyklus verschiedener Zelltypen z.B. Neuronen, Muskelzellen teilen sich nie Leberzellen ca. 1x im Jahr Epithelzellen, Darm 2x pro Tag Diese Angaben aber variabel -> abhängig von Umständen (z.B. Verletzungen) -> Variation im Zellzyklus in Säugerzellen zwischen M und G1 aber S-Phase bis Mitose sehr konstant (ca 12-24 h) G1 checkpoint spezifische Kontrolle U. Albrecht Zellteilung: Mitogene stimulieren G1-Cdk und G1/S-Cdk Aktivitäten + Max -> heterodimer formation to activate target genes. U. Albrecht Abnormale Proliferationssignale führen zu Zellzyklusstop oder Zelltod Krebsfördernde Gene = Onkogene z.B. Ras, Myc Mutationen in diesen Genen ->Ueberproliferation in Experiment jedoch nicht beobachtet -> Checkpoints -> abnormale Proliferation wird erkannt -> wie dies genau geschieht ist nicht bekannt. Assoziation mit p19ARF Krebs entsteht nur dann, wenn auch Schutzmechanismus inaktiviert wird. d.h. mehrere Mutationen müssen akkumulieren z.B. in Ras + p53 oder Myc + p19ARF U. Albrecht Zellwachstum: Wachstumsfaktoren stimulieren Zellwachstum Beispiel für Signaltransduktion von äusserem Signal zum Zellkern. 1. aktivierte Kinase 2. aktivierte Kinase early response und delayed reesponse genes. U. Albrecht Wahrscheinlichkeit in G0 einzutreten wächst mit der Anzahl von Zellteilungen einer Zelle: Zellalterung - Senescence Zellproliferation: 1) Umgebung 2) Langzeitgeschichte der Zelle Dies gilt für somatische Zellen, Stammzellen sind davon ausgenommen z.B. Fibroblasten (Mensch) -> embryonal -> 50 Teilungen 40 - Jährig -> 40 Teilungen 80 - Jährig -> 30 Teilungen Teilungsfähigkeit korreliert mit Alter. Verschiedene Erklärungen für Zellalterung: 1) 2) 3) Akkumulation von Mutationen (Replikation unpräzise) Mechanismus der vor Krebs schützen soll da alte Zellen sterben Telomere am Ende der Chromosomen werden verkürzt durch jede Zellteilung Nur in Stammzellen Telomerase welche die Verkürzung repariert. Alterung der Zelle jedoch nicht strikt vorprogrammiert, da aus derselben Population einige sich mehr teilen können als andere. U. Albrecht Aufheben der replikativen Zellalterung durch Expression von Telomerase Menschliche Zellen haben ein eingebaute Limitation für Teilung Fibroblasten teilen sich 25-50 mal -> dann nicht replikativer Zustand = replikative Senescence Telomere -> werden bei jeder Replikation verkürzt -> Telomerase behebt Verkürzung Aber im Menschen Telomerase in meisten Zellen inaktiviert = Schutz vor unendlicher Replikation (Krebszellen haben Telomerase re-aktiviert) U. Albrecht 2. Programmierter Zelltod - Apoptosis Multizellulärer Organismus -> Kontrolle der Zellteilung und des Zelltodes -> ungebrauchte Zellen sterben Entwickelndes Nervensystem: mehr als die Hälfte der Zellen stirbt Erwachsener Mensch: billionen von Zellen sterben im Knochenmark und im Darm jede Stunde Wozu ist dieser massive Zelltod gut? U. Albrecht 1) im entwickelnden Organismus Ausbildung der Finger in der entwickelnden Mauspfote durch Apoptose Die Pfote wurde mit Farbstoff behandlet der spezifisch Zellen in Apoptose grün färbt. Die apoptotischen Zellen erscheinen als leuchtend grüne Punkte zwischen den Fingern. Dieser Zelltod eliminiert das Gewebe zwischen den sich entwickelnden Fingern. U. Albrecht in der Qaulquappe des Frosches stirbt der Schwanz während der Entwicklung ab U. Albrecht entwickelndes Nervensystem: Regulation der Zellzahl -> Anzahl Nervenzellen = Anzahl Zielzellen Kompetition der Zellen (Neuronen) für Ueberlebendsfaktoren welche von Zielzellen sezerniert werden. U. Albrecht 2) im erwachsenen Organismus Zelltod um Zellteilung auszugleichen damit die Zellzahl konstant bleibt. -> sonst würden Gewebe und Organe wachsen oder schrumpfen. Leber -> entfernen eines Teils -> wächst nach (Proliferation wird angeregt) -> Behandlung von Ratten mit Pentobarbital -> induziert Zellwachstum in der Leber -> Leber vergrössert sich -> absetzen von Pentobarbital -> Leber apoptosis -> Ausgangsgrösse Regulation der Todes und Geburtsrate von Zellen wichtig für mehrzellige Organismen U. Albrecht Zelltod - Nekrose oder Apoptose in Kulturschale NeKrose: Zelle platzt und schüttet den Inhalt in die Umgebung -> Inflammation dies geschieht z.B. bei Verletzungen im Gewebe Apoptose: Zelle stirbt kontrolliert. Inhalt gelangt nicht in die Umgebung -> Nachbarzellen werden nicht beschädigt. Zytoskelet kollabiert, Nuklearmembran löst sich auf, DNA fragmentiert -> Zelloberfläche verändert sich -> Signal für Phagocytose durch benachbarte Zellen -> Zellinhlat wird recycliert. U. Albrecht U. Albrecht Maschinerie der Apoptose Proteolytische Kaskade durch Caspasen Caspasen = Proteasen mit Cys in aktivem Zentrum -> spaltet Zielproteine an Asparaginsäure Resten => Name Caspasen Caspasen werden synthetisiert als Procaspasen aktiviert durch andere Caspasen => amplifizierende proteolytische Kettenreaktion Zielproteine: nukleäre Lamine DNAsen => effizienter Selbstzerstörungsmechanismus -> vergleichbar einem Zustand im Zellzyklus -> alles oder nichts Entscheid -> irreversibel U. Albrecht Die Caspase - Kaskade in Apoptosis Jede Zelle hat Quelle für Selbstzerstörung in sich in Form der Procaspase Wie werden sie aktiviert ? -> Adaptorproteine die initiator Procaspasen in einen Komplex aggregieren. 2 möglichkeiten der Aktivierung: 1) jede Procaspase kleine Aktivität -> in Komplex -> reicht um sich gegenseitig zu aktivieren -> Lawine 2) Aggregation -> Konformationsänderung -> Aktivierung der Procaspasen -> Amplifikation des Death Signals U. Albrecht Die Aktivierung von Procaspasen kann von aussen induziert werden Death Rezeptoren: z.B. Fas Killer Lymphocyten -> Fas - Ligand -> binden an Zellen mit Fas U. Albrecht Aktivieren der Apoptose von innen = intrinsischer Pathway bei Zellschädigungen oder Stress (z.B. Radikale) -> initiation des Selbstzerstörungsprogramms -> wichitges Organell in diesem Zusammenhang sind die Mitochondrien. DNA Beschädigung kann auch Apoptose induzieren -> p53 aktiviert transkription von Genen deren Produkte das Entrinnen von Cytochrom C aus dem Mitochondrium begünstigen. => Bcl-2 family members U. Albrecht Bcl-2 = anti-apoptotic p53 = pro-apoptotic U. Albrecht Wie survival Faktoren Apoptose unterdrücken siehe Neuronale apoptose