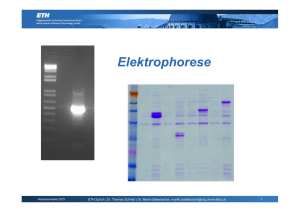
Elektrophorese
Werbung

Analytische Chemie (für Biol. / Pharm. Wiss.) Teil: Trenntechniken (Chromatographie, Elektrophorese) Dr. Thomas Schmid HCI D323 [email protected] http://www.analytik.ethz.ch/ ETH Zurich | Dr. Thomas Schmid | [email protected] Herbstsemester 2011 Elektrophorese Herbstsemester 2011 ETH Zurich | Dr. Thomas Schmid | [email protected] 2 Elektrophorese Allgemein: Wanderung geladener Teilchen im elektrischen Feld Analytische Chemie: Trennung von Ionen im elektrischen Feld Elektrophoretische Trenntechniken zählen im Allgemeinen nicht zur Chromatographie Herbstsemester 2011 ETH Zurich | Dr. Thomas Schmid | [email protected] 3 „Chromatographie-Check“ Damit eine Technik eine Chromatographie ist, müssen folgende Punkte vorhanden bzw. erfüllt sein: • Trenntechnik • Zwei nicht mischbare Phasen • Eine mobile und eine stationäre Phase • Trennung beruht auf der Verteilung von Substanzen zwischen den Phasen • Kontinuierliche Abfolge von Gleichgewichtseinstellungen Herbstsemester 2011 ETH Zurich | Dr. Thomas Schmid | [email protected] 4 Elektrophorese • Gel-Elektrophorese • Agarose-Gelelektrophorese, Polyacrylamid-Gelelektrophorese (PAGE) • Natriumdodecylsulfat-PAGE (SDS-PAGE) • Kapillarelektrophorese (CE) • Kapillarzonenelektrophorese (CZE) • Mizellare Elektrokinetische Chromatographie (MEKC) Herbstsemester 2011 ETH Zurich | Dr. Thomas Schmid | [email protected] 5 Gel-Elektrophorese Herbstsemester 2011 ETH Zurich | Dr. Thomas Schmid | [email protected] 6 Gel-Elektrophorese Gel-Elektrophorese: http://www.youtube.com/watch?v=qMxQ-65qYDk „Genetischer Fingerabdruck“: http://www.youtube.com/watch?v=W5HeXufSFE4 Herbstsemester 2011 ETH Zurich | Dr. Thomas Schmid | [email protected] 7 Agarose-Gelelektrophorese, Polyacrylamid-Gelelektrophorese (PAGE) Standard Probe – • Moleküle wandern entsprechend ihrer Ladung im elektrischen Feld • Das Gel behindert die Moleküle bei ihrer Wanderung • Kleine Moleküle wandern schneller als grosse • Detektion: chemische Anfärbemethoden (z.B. Fluoreszenz) • Trennung aufgrund von Ladung und Molekülgrösse • z.B. Auftrennung von DNA-Fragmenten (z.B. „Genetischer Fingerabdruck) + Probe: DNA-Fragment mit 522 Basenpaaren (bp) Herbstsemester 2011 ETH Zurich | Dr. Thomas Schmid | [email protected] 8 Agarose-Gelelektrophorese, Polyacrylamid-Gelelektrophorese (PAGE) • Trennung nach Ladung und Grösse • Grösse: hydrodynamischer Durchmesser • d.h.: Proteine werden nach Ladung, Molekulargewicht und Faltung getrennt • Bei Proteinen wird häufig die SDS-PAGE angewandt Herbstsemester 2011 ETH Zurich | Dr. Thomas Schmid | [email protected] 9 SDS-PAGE SDS = sodium dodecyl sulfate Natriumdodecylsulfat Natriumlaurylsulfat C12H25NaO4S Tensid SDS bildet Mizellen SDS denaturiert Proteine SDS bildet negativ geladene Komplexe mit Proteinen Herbstsemester 2011 ETH Zurich | Dr. Thomas Schmid | [email protected] 10 SDS-PAGE • Trennung von negativ geladenen Komplexen von SDS mit denaturierten, entfalteten Proteinen • Faltung beeinflusst nicht die Trennung • Zahl der SDS-Moleküle pro Protein hängt nur vom Molekulargewicht ab, Eigenladung der Proteine spielt keine Rolle • Trennung von Proteinen nur aufgrund des Molekulargewichts Herbstsemester 2011 ETH Zurich | Dr. Thomas Schmid | [email protected] 11 SDS-PAGE • Trennung von negativ geladenen Komplexen von SDS mit denaturierten, entfalteten Proteinen • Faltung beeinflusst nicht die Trennung • Zahl der SDS-Moleküle pro Protein hängt nur vom Molekulargewicht ab, Eigenladung der Proteine spielt keine Rolle SDS-PAGE-Trennung verschiedener Proteine (1-8) gemäss ihres Molekulargewichts. Links: Gemisch von Proteinen bekannter Grösse als Molekulargewichtsstandard (14–97 kDa) Herbstsemester 2011 • Trennung von Proteinen nur aufgrund des Molekulargewichts ETH Zurich | Dr. Thomas Schmid | [email protected] 12 Kapillarelektrophorese (capillary electrophoresis = CE) Herbstsemester 2011 ETH Zurich | Dr. Thomas Schmid | [email protected] 13 CE: Theoretische Grundlagen Elektrophoretische Mobilität µEP eines Ions im elektrischen Feld E η ... Viskosität der Pufferlösung z ... Ladung des Ions r ... Hydrodynamischer Durchmesser des Ions Herbstsemester 2011 ETH Zurich | Dr. Thomas Schmid | [email protected] Ion (Analyt) e ... Elementarladung Pufferlösung Konstante µEP v Geschwindigkeit eines Ions e 1 z = = = " " E Elektrische Feldstärke 6! # r Trennung aufgrund von Ladung und Grösse der Ionen 14 CE: Theoretische Grundlagen Elektroosmotischer Fluss (EOF) Quarzkapillare (SiO2) EOF Quarzkapillare (SiO2) – Kathode Anode + Aufgrund der negativ geladenen Innenwand der Quarzkapillare bildet sich ein Fluss der Pufferlösung in Richtung Kathode aus, der elektroosmotische Fluss (EOF). Herbstsemester 2011 ETH Zurich | Dr. Thomas Schmid | [email protected] 15 Kapillarzonenelektrophorese (CZE) • Trennung von Kationen und Anionen Herbstsemester 2011 Anionen Neutrale Moleküle (ungetrennt) Kationen • Neutrale Moleküle verlassen ungetrennt mit dem EOF die Kapillare • Detektor wegen EOF kathodenseitig angebracht • Nur Anionen, die schneller als der EOF wandern, erreichen den Detektor nicht ETH Zurich | Dr. Thomas Schmid | [email protected] 16 Mizellare Elektrokinetische Chromatographie (MEKC) Abhängig von ihrer Polarität halten sich die Analyten v.a. in der Pufferlösung (polar) oder in den Mizellen (unpolar) auf. Dem Puffer wird ein Tensid (z.B. SDS) zugegeben, welches Mizellen bildet. • Trennung ungeladener Analyten (keine Ionen) • Chromatographie • Mobile Phase: Pufferlösung (polar) • Pseudo-stationäre Phase: Mizellen (unpolar) Herbstsemester 2011 ETH Zurich | Dr. Thomas Schmid | [email protected] 17 Mizellare Elektrokinetische Chromatographie (MEKC) • Trennung von ungeladenen Analyten • Pufferlösung (mobile Phase) bewegt sich wegen EOF in Richtung Kathode • Mizellen (pseudo-stationäre Phase) bewegen sich langsamer • Elutionsreihenfolge wie in RP-HPLC: polare Moleküle eluieren vor unpolaren hoch Herbstsemester 2011 Polarität der Analyten gering • Detektor wegen EOF kathodenseitig angebracht ETH Zurich | Dr. Thomas Schmid | [email protected] 18 Zusammenfassung: Elektrophorese • Gel-Elektrophorese • Agarose-Gelelektrophorese, Polyacrylamid-Gelelektrophorese (PAGE) • Trennung geladener Makromoleküle (z.B. DNA-Fragmente) • Trennung aufgrund von Ladung und Grösse (Faltungszustand) • Natriumdodecylsulfat-PAGE (SDS-PAGE) • Trennung von Proteinen (als SDS-Protein-Komplex) • Trennung nur aufgrund des Molekulargewichts • Kapillarelektrophorese (CE) • Kapillarzonenelektrophorese (CZE) • Trennung geladener, kleiner Moleküle (z.B. Aminosäuren, Ionen) • Trennung von Kationen und Anionen (wegen EOF) • Mizellare Elektrokinetische Chromatographie (MEKC) • Trennung ungeladener, kleiner Moleküle • Trennung aufgrund der Polarität (Elutionsreihenfolge analog RP-HPLC) Herbstsemester 2011 ETH Zurich | Dr. Thomas Schmid | [email protected] 19