T Zellen
Werbung

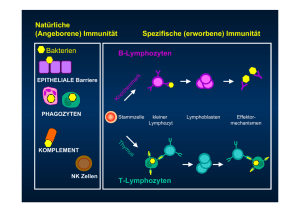
T-Zellrezeptoren Durchflußzytometrie Dr. Daniela Wesch [email protected] T-Zell-Rezeptor Durchflußzytometrie Immunität angeboren (innate) Komplementsystem Zytokine Granulozyten Makrophagen NK-Zellen erworben (adaptive) humoral zellulär B-Zellen T-Zellen SPEZIFISCH (Antigen-)Spezifische Rezeptoren TZR Antikörper MHC mIgM Ti CD3 class I class II γεεδ ζ ζ Igβ Igα Igα Igβ α2 α1 α1 β1 α3 β2m α2 β2 Struktur des T-Zell-Rezeptors (TZR) β-Kette α-Kette V V C C Gelenk + + + Transmembranregion zytoplasmatischer Anteil ~ 30.000 Ag-Rezeptoren/ T -Zelle T-Lymphozyten αβ T-Lymphozyten Vα TZR γδ T-Lymphozyten Vβ Cβ Cα Vγ CD 3 Cγ Cδ Vδ TZR 3 D C ~ 80-95 % epitheliales Gewebe: ~20% Blut: ~1-5% Organisation und Rearrangement der Gene für die α/β Kette des TZR n = ~70~70-80 n = 52 n=2 n = 61 n=1 n = 13 n=2 Immunologie, Janeway, 2002 Organisation der Gene für die γ/δ Kette des TZR δ-Kette γ-Kette V: n = ~8 n=3 n=3 n=1 n = 14 n=5 n=5 Immunologie, Janeway, 2002 Antigen-Rezeptor Vielfalt bei B-Lymphozyten (Immunglobulin) und T-Lymphozyten Kristallstruktur: αβ TZR CDR 1-3 : Antigenbindende Stellen (CDR = complementarity determining region) Immunologie, Janeway, 2002 TZR/CD3 Komplex αβ TZR γδ TZR Vα Vβ Vγ Vδ Cα Cβ Cγ Cδ CD3 εγ δε ζζ εγ δε CD3 ζζ CD = Cluster of Differentiation TZR-assoziierte Proteine: CD3 und ζ-Ketten TZR S S CD3 ε γ S S CD3 ε δ S S S S S S S S S S S S ζ ζ aussen Plasmamembran innen TZR/CD3-Komplex und Ko-Rezeptoren akzessorische und kostimulatorische Moleküle Signal 2 CD80 CD86 Signal 1 MHC Antigen CD4 CD8 TZR CD28 ε γ ζ Grb2 P P P δ ε P p59fyn P SLP-76 CD3/ζ ζ Nck PI 3-kinase GADS p56lck ZAP-70 p85 PI 3-kinase P ζ WASP WIP Aktin intrazellulärer Aktivierungskomplex aus Adapterproteinen, Enzymen und Zytoskelettproteinen Ohne CD3 kein TZR Eigenschaften von αβ und γδ T-Zellen αβ T-Zellen γδ T-Zellen Häufigkeit ~ 95% ~ 1-5% KeimbahnRepertoire groß (~ 70 Vα / ~ 50 Vβ) klein (6 Vγ / 6 Vδ) Oberflächenmarker 60% CD4 30% CD8 <1% CD4- CD8- < 5% CD4 ~ 20% CD8 ~ 60% CD4-CD8- Funktion spez. zellulär Antigen/MHC unspez. zellulär PAMP/ ? Funktion von CD4+ αβ T-Zellen · Antigen (Peptid)-Erkennung im Kontext von MHC Klasse II Molekülen („Helferzellen“) · Produktion von Zytokinen · Differenzierung von B-Zellen · Th1: IFN-γ, GM-CSF, TNF-α · Th0 · Th2: IL-4, IL-5, IL-6, IL-10, TGF-β Funktion von CD8+ αβ T-Zellen · Antigen (Peptid)-Erkennung im Kontext von MHC Klasse I Molekülen („Killerzellen“) · Eliminierung von Virus-infizierten und entarteten Zellen · Freisetzung von Perforin und Granzymen · Expression FasL, Freisetzung TNF-α · Abstoßungsreaktion von Organtransplantaten Effektorfunktion der T-Lymphozyten Perforine Granzyme A/B T-Zelle Granulysin TNF-α IFN-γ Chemokine FasL Fas Apoptose z.B. Tumorzelle oder Bakterien-infizierter Makrophage (αβ)-T-Zellaktivierung AG-spezifisch Superantigen MHC II MHC II CD4 CD45 CD4 CD45 SAg TZR/CD3 <1% ~15 % T-Zellaktivierung Anti-TCR/CD3 mAb Phorbolester/Ca-Ionophore CD4 CD4 CD4 TZR/CD3 Lektin (PHA, PWM, ConA) CD45 TZR/CD3 Ca2+ PKC 90-95 % CD45 TZR/CD3 CD45 Funktion von γδ T-Zellen · Zytotoxität: · z.B. gegenüber M. tb.-infizierten Makrophagen · z.B. Lyse von Tumorzellen · Zytokinproduktion: · z.B. IFN-γ, TNF-α, CC-Chemokine Mögliche Funktionen von γδ T-Zellen · Immunabwehr gegen Antigene, welche von αβ T-Zellen nicht erkannt werden (Phosphoantigene, Aminobisphosphate, Alkylamine) · Immunregulatorische Interaktion mit αβ T-Zellen und B-Zellen · Bindeglied zwischen angeborener und erworbener Immunität Liganden der γδ T-Lymphozyten Mevalonat Pyruvat Eukaryonten Prokaryonten DOXP Mevalonat -P MEP Mevalonat -PP IPP Aminobisphosphonate GAP phosphorylierte Antigene GPP FPP Synthase Protein GeranylGeranylation Cholesterol FPP Dolichol Farnesol Ubiquinone Protein Farnesylation Altincicek et al, J Immunol 166: 3655, 2001 (modifiziert) Unterschiedliche Antigenerkennung αβ T-Lymphozyten CD4 γδ T-Lymphozyten prozessierte Peptide phosphorylierte Antigene (pAg) Mykobacterium tuberculosis (M. tb.) Antigen-präsentierende Zelle (z.B. Makrophage) Mögliche Funktionen von γδ T-Zellen · Immunabwehr gegen Antigene, welche von αβ T-Zellen nicht erkannt werden (Phosphoantigene, Aminobisphosphate, Alkylamine) · Immunregulatorische Interaktion mit αβ T-Zellen und B-Zellen · Bindeglied zwischen angeborener und erworbener Immunität γδ T-Zellen als Bindeglied? Angeborene Immunität · · · · limitiertes Keimbahnrepertoire präferentielle Expression von Vγ9Vδ2 MHC unabhängige Erkennung Erkennung von PAMP´s Erworbene Immunität · · · · Genrearrangement notwendig TZR-Diversität T-Zelleffektorfunktion/ „memory“-Phänotyp Expression kostimulatorischer Moleküle Toll-like Rezeptoren und deren Liganden z.B. PGN, LTA, Lipoproteine, Zymosan HCV, HSV-1 LPS, HSPs, RSV F, Taxol ssRNA, Imidazoquinoline (anti virale Komponenten) Flagellin ds RNA, Diazyl„polyinosiniclösliche lipobakterielle polycytidylic acid“, peptide poly(I:C) Faktoren TLR1 TLR2 TLR3 TLR4 TLR5 TLR6 TLR7 + TLR2 (+ TLR6) + TLR2 PAMPs bakterielle DNA (CpG DNA) virale DNA unbekannt TLR8 TLR9 TLR10 PRR Indirekter TLR-Ligand Effekt auf die Aktivierung humaner γδ T Zellen CD11c- BCDa-4+ plasmacytoide DC Poly(I:C) CpG ODN CD11c+ BDCA-4myeloide DC TLR9 TLR3 Phosphoantigen (IFN-α) IFN-β CD69 Hochregulation γδ γδ Phosphoantigen IFN-α IFN-β CD69 Hochregulation IFN-γ Sekretion γδ Kunzmann et al, Immunology, 2004, 112: 369-377 γδ γδ γδ Rothenfusser et al , Eur J Immunol 2001, 31: 3525-3534 Direkter TLR-Ligand Effekt auf die Aktivierung humaner γδ T Zellen CD11c+ BDCA-4myeloide DC Poly(I:C) ? TLR3 PAg TLR3 (IFN-α) Poly(I:C) Integriertes Signal über TLR3 and TZR induzieren zusammen einen antivirale Effektorfunktion von γδ T-Zellen IFN-β γδ T cells γδ T cells γδ T cells CD69 Hochregulation verstärkte Zytokin-Sekretion (z.B. IFN-γ) Wesch et al , J Immunol 2005, eingereicht Kostimulatorischer Effekt der TLR-Liganden TLR-8 Ligand: Maus: Oligonucleotide mit Guanosin Nucleotiden (Poly-G10, Poly-G2) Mensch: ssRNA40, ssRNA33 „memory“ CD4+ CD45RO+ T Zellen anti-CD3 anti-CD2 or IL-2 TLR-7/8 Ligand: Resiquimod (R-848, Modifikator von Imidazoquinolin) anti-CD3 TLR-5 Ligand: Flagellin TLR-2 Ligand: Pam3CSK4 IFN-γ, IL-8, IL-10 Produktion keine IL-4 Produktion Proliferation Komai-Koma et al., PNAS, 2004, 101: 3029-3034 Caron et al., J. Immunol., 2005, 175:1551-1557 - CD4+ CD25- CD4+ CD25- CD4+ CD25high TLR8 + CD4+ CD25Aufhebung der Suppression durch CD4+ CD25+ (Treg) Peng et al. , Science 2005, 309: 1381-1384 T-Zell-Rezeptor Durchflußzytometrie Grundlagen der Durchflußzytometrie Was ist Durchflußzytometrie? Die Durchflußzytometrie ist eine Methode zur Analyse von Einzelzellen in Suspension auf der Grundlage von Fluoreszenz und/oder Streulichteigenschaften (auch: Zytofluorometrie) Optischer Aufbau eines Durchflußzytometers Probenzuführung am Durchflußzytometer Welche Informationen gibt uns die Durchflußzytometrie von einer Zelle? • relative Größe • relative Granularität • relative Fluoreszenz-Intensität Prinzip der Streulicht-und Fluoreszenzmessung Die Zelle interagiert mit dem einfallendem Licht, wobei die Richtung des anregenden Lichts verändert wird. Die Lichtstreuung wird beeinflusst durch: - Zellgröße - Zellmembranstruktur - intrazelluläre Bestandteile Seitwärtsstreulicht Diskriminierung der Zellen nach Streulicht Lymphozyten Vowärtsstreulicht Relative Fluoreszenz-Intensität • Zellen werden mit Fluoreszenzfarbstoffgekoppelten Antikörpern markiert. • Die Farbstoffmenge ist direkt proportional zur Anzahl der Bindungstellen (z.B. an DNA oder an Oberflächenantigene). • Die Intensität der emittierten Fluoreszenz ist ein Mass für die zellulären Bindungsstellen. Relative Fluoreszenz-Intensität Absorptions und Fluoreszenzspektren λ = 488 nm eingestrahlte Lichtenergie FITC λ = 530 nm emittierte Fluoreszenz 530 585 615 655 Fluorescein-isothiocyanat (FITC), Phycoerythrin (PE), Propidiumjodid (PI), 7-Amino-Actinomycin (7AAD) Analysen am Durchflußzytometer Derzeit bei BD verfügbare Farbstoff/Laser-Kombinationen Optischer Aufbau eines Durchflußzytometers sample nozzle sheet flow red fluorescence prism green fluorescence laser right angle scatter forward scatter sorted cells Fluorescence Activated Cell Sorter Analysen am Durchflußzytometer • Phänotypisierung (Oberflächenmarkierung) • Bestimmung Absolutzellzahl (SCDA) • Bestimmung der Zellteilungsrate (CSFE) • Intrazelluläre Zytokinmessung • Apoptose- bzw. Zelltodmessung • Zellzyklus-Analyse • Calzium-Messung • DNA/RNA Gehalt • Phagozytose & „oxidativer burst“ • Transmembranpotential Fluoreszenzanalyse der Lymphozytenpopulation R1 anti-TZR γδ-PE anti-CD3-PE R1 6,2% 72,9% anti-TZR αβ-FITC Durchflußzytometrie in der Diagnostik z.B. Lymphozytendifferenzierung/-aktivierung Analyse Messprinzip Masseinheit Referenzbereich HLA-B27 Zytofluorometrie qualitativ positiv/negativ Lymphozyten Zytofluorometrie Zellen/µl 1200-2800 CD3 absolut Zytofluorometrie Berechnung Zellen/µl % der Lymphozyten 690-2540 55-84 CD4 absolut Zytofluorometrie Berechnung Zellen/µl % der Lymphozyten 410-1590 31-60 CD8 absolut Zytofluorometrie Berechnung Zellen/µl % der Lymphozyten 190-1140 13-41 NK-Zellen Zytofluorometrie Berechnung Zellen/µl % der Lymphozyten 90-590 5-27 B-Zellen Zytofluorometrie Berechnung Zellen/µl % der Lymphozyten 90-660 6-25 bei Immundefizienzen (HIV) oder Immunsuppression Bestimmung der Absolutzellahl (Zellproliferation) Standardzellverdünnungsanalyse (SCDA) γδ T-Zellen Tag 5 nach Stimulation Standardzellen a) d) R1 e) -PJ b) -PJ R1 R2 R2 -FITC R3 f) -PE c) -PE -FITC R3 61 % 3,7 % R4 -FITC -FITC Bestimmung der Zellteilungsrate mittels Carboxyfluoreszein Diacetat, Succinimidyl Ester (CFDA, SE) O O O CH3-C-O O-C-CH3 Esterase O O -O O O -O Protein NH2 O O O O N-O-C O C-OO O CFDA, SE farblos N-O-C Protein NH-C O O O Zellmembran C-OO CFSE CFSE + Amine fluoresziert CFSE Fluoreszenz in γδ T Zellen nach Stimulation mit Isopentenylpyrophosphat (IPP) Tag 4 Medium IPP 4 3 2 1 unbehandelte behandelte CFSE CFSE Intrazelluläre Zytokinmessung Zytokinproduktion von γδ T-Zellen • Lymphozyten kultiviert mit Stimulus und Monensin für 4-6 Stunden • (Oberflächenmarkierung) • Permeabilisierung und Fixierung der Zellen • Markierung mit Fluochrom-konjugierten anti-Zytokin-Antikörpern IFN-γ IL-4 95,6 % 4% TH1 γδ + IPP 8,7% TH2 80% Apoptosemessung mittels Annexin-V und 7AAD Bindung von Annexin-V Zelltodmessung mittels Propidium-Jodid Zellzyklus-Analysen mittels Propidium-Jodid 97,46 0,57 1,76 G1 Apo S G2/M 93,56 5,20 Apo 70,68 1,49 G1 S G2/M 3,91 Apo 25,89 G1 S G2/M 92,09 49,27 5,12 Apo 2,97 G1 S G2/M unstimuliert 4,22 Apo 47,24 G1 S G2/M OKT3 + α-CD28 Calziummessung mittels FLUO-3-AM λ = 488 nm Esterase FLUO-3-AM Fluo-3 (Acetoxymethyl (AM)-Ester) Ca 2+ Fluo-3 Ca 2+ MIP-1β RANTES Ca2+ Mobilisation Ca2+ Mobilisation CCR5 Ca2+ Mobilisation CD4+ αβ T-Zellklon Vδ2 Vγ9 T-Zellklon Vδ1 Vγ3 T-Zellklon Zellmembran Zeit: 40 sec MIP-1α Fluo-3 Ca 2+ Literatur Davis M.M., Lindsten T., Gascoigne N.R., Goodnow C., Chien Y.H., T-cell receptor gene structure and function. Cell Immunol. 1986; 99(1):24-8. Kronenberg M., Siu G., Hood L.E., Shastri N., The molecular genetics of the T-cell antigen receptor and T-cell antigen recognition. Annu Rev Immunol. 1986; 4:529-91. Review. Szamel M., Resch K., T-cell antigen receptor-induced signal-transduction pathwaysactivation and function of protein kinases C in T lymphocytes. Eur J Biochem. 1995 Feb 15; 228(1):1-15. Review Hayday A.C., γδ cells: a right time and a right place for a conserved third way of protection. Annu Rev Immunol. 2000; 18:975-1026. Review. Janeway C. A., Travers P., Walport M., Shlomchik M., Immunolgie, 5. Auflage, 2002, Spektrum Akademischer Verlag GmbH, ISBN 3-8274- 1079-7 (Deutsche Ausgabe) Janeway, C.A., Travers P., Immunbiology, 5th edition, 2001, Garland Publishing