Fachinformation 30 Zellulärer Immunstatus
Werbung

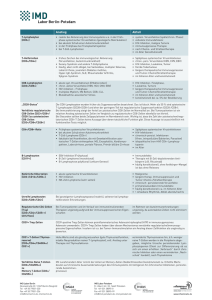
Fachinformation 30 Labor Diagnostik Zellulärer Immunstatus / Lymphozytenphänotypisierung/ Durchflusszytometrie (FACS) Immunstatus Der Immunstatus gibt Auskunft über die absoluten und proportionalen Verhältnisse der Lymphozyten-Subpopulationen im peripheren Blut, er dient somit als Erweiterung der zellulären Differenzierung des großen konventionellen Blutbildes. Viele Erkrankungen stehen in direktem Zusammenhang mit Störungen im Immunsystem und gehen mit Verschiebungen innerhalb der Lymphozytensubpopulationen einher. Indikation: - Primäre / Sekundäre Immundefekte - Infektanfälligkeit - Diagnostik und Therapie-Monitoring bei HIV-Infektion - Infektion mit lymphotropen Erregern (bspw. EBV, CMV, T. gondii) - Infektionen mit prolongiertem Verlauf - Lymphozytose/Lymphopenie im peripheren Blutbild - Tumorerkrankungen insbes. bei Therapie - Monitoring von Autoimmunerkrankungen - Iatrogene Immunsuppression (Immunsuppressiva, anti-CD20-Therapie) - Überwachung einer Immunrekonstitution Im Gegensatz zu den Untergruppen der Granulozyten (Eosinophile, Basophile, Neutrophile), die mittels panoptischer Färbung nach Pappenheim und anschließender Mikroskopie klar zugeordnet werden können (siehe Abb. 1 u. 2), lassen sich die Lymphozyten, bis auf Ausnahmen, so nicht näher einteilen. Hierzu dient die Durchflusszytometrie, eine Methode, die es ermöglicht, Antigene auf der Zelloberfläche darzustellen und somit die Zellen immunologisch zu zuordnen. Leukozyten Granulozyten Basophile, Eosinophile, Neutrophile Lymphozyten T-Lymphozyten (CD3) B-Lymphozyten (CD19) Monozyten NK-Zellen (CD16/56) T-Helferzellen (CD4) CD8 - positive T-Zellen Abb. 1: Leukozyten-/Lymphozytenuntergruppen M V Z für Laboratoriumsmedizin Koblenz – Mittelrhein Dr. med. Dipl.-Chem. Rüdiger Walscheid • Axel Thuy • Dr. med. Martin Kirsch • Dr. med. Thomas Mertes Laboratoriumsmedizin • Humangenetik • Mikrobiologie • Infektionsepidemiologie • Bluttransfusionswesen Deutscher Akkreditierungs Rat DAR DAC-ML-0126-01-10 Akkreditiert nach DIN EN ISO 15189 Viktoriastraße 39 • 56068 Koblenz • Tel: 0261 / 30 40 50 • Fax: 0261 / 30 40 5 -944 • www.labor-koblenz.com Seite /3 a) basophiler b) eosinophiler Granulozyt Granulozyt c) neutrophiler Granulozyt (Segmentkernig) f) Lymphozyt d) Monozyt e) Lymphozyt Abb. 2: Zelluläre Bestandteile des peripheren Blutes im mikroskopischen Bild Die T-Lymphozyten (CD3 positiv) sind für die spezifische Abwehr notwendig, sie agieren insbes. bei viralen Infektionen. Unterteilt werden sie klassisch in zwei Subpopulationen: T-Helferzellen (CD4 positiv) und T-Suppressor/Zytotoxische T-Zellen (CD8 positiv). Hierbei handelt es sich z. T. um geschichtliche Begriffe, die heute nicht mehr so ganz zutreffend sind. Das Verhältnis wird in Form der CD4/CD8-Ratio ausgedrückt. Mit einer modernen 6-Farb-Messung gelingt auch die Darstellung von CD4/CD8-doppeltpositiven-Zellen. Diese Markierung klassifiziert Vorstufen, die in der Regel im Lymphorgan anzutreffen und nur selten peripher nachweisbar sind. Die B-Zellen (CD19 positiv) sind für die (humorale) Antikörper-Antwort zuständig. Die Fraktion der NK-Zellen (CD16/56 positiv) stellt die sog. unspezifische zelluläre Immunabwehr dar; sie spielen insbes. in der viralen Abwehr und der Zerstörung von Tumorzellen eine Rolle. Über den Aktivierungszustand der Lymphozyten informieren uns Antigene wie bspw. HLA-DR und CD38, die erst bei Aktivierung/immunstimulierenden Ereignissen auf der Zelloberfläche erscheinen und im Gegensatz zu den beschriebenen Markern nicht mit Konstanz exprimiert werden. So wird bspw. die CD38 Coexpression insbes. zur Beurteilung der Aktivität von HIV-Infektion herangezogen. Methode (Immunphänotypisierung) Die einzelnen Subpopulationen lassen sich getrennt mit fluoreszenzmarkierten monoklonalen Antikörpern bestimmen, die gegen linienspezifische Antigene auf der Oberfläche der Zellen gerichtet sind. Zur Vereinfachung/Klassifizierung wurden diese auf internationalen Workshops einem ‚Cluster of Differentiation’ (CD) zugeordnet. Die eigentliche Messung erfolgt mittels Laserlicht auf leistungsfähigen Durchflusszytometern (FACS), wobei gleichzeitig auch die Eigenschaften, Zellgröße (FSC) und Granularität (SSC) miterfasst werden. Die Auswertung erfolgt dann mittels einer immunologischen Gating-Strategie (CD45/SSC). Die Analyse beinhaltet zusätzlich die Bestimmung eines großen Blutbildes (sog. dual-platform-Methode) sowie eine eingehende Befundung. M V Z für Laboratoriumsmedizin Koblenz – Mittelrhein Dr. med. Dipl.-Chem. Rüdiger Walscheid • Axel Thuy • Dr. med. Martin Kirsch • Dr. med. Thomas Mertes Laboratoriumsmedizin • Humangenetik • Mikrobiologie • Infektionsepidemiologie • Bluttransfusionswesen Deutscher Akkreditierungs Rat DAR DAC-ML-0126-01-10 Akkreditiert nach DIN EN ISO 15189 Viktoriastraße 39 • 56068 Koblenz • Tel: 0261 / 30 40 50 • Fax: 0261 / 30 40 5 -944 • www.labor-koblenz.com Seite /3 Abb. 3: Labor-Report BD FACSCanto II ™ 6-Farb-Panel /Aktivierungsmarker Referenzwerte Immunstatus Erwachsene (für Kinder liegen gesonderte Werte vor) Zelltyp Oberflächenmarker Referenzbereich in % absolut/μl T-Lymphozyten CD3+ 59-85 720-2330 B-Zellen CD19+ 6.4-23 100-600 NK-Zellen CD16/56+ 5.6-31 80-600 T-Helferzellen CD4+ 29-61 500-1760 Suppressor-/Zytotox. T-Zellen CD8+ 11-38 CD4/CD8-Ratio 170-1050 0.9 - 3.6 T-Lymphozyten-Vorstufen CD4+ u. CD8+ <4 Aktivierte T-Zellen CD3/CD8/CD38+ < 25 CD3/CD8/HLA-DR+ < 20 Die Bewertung der im Befund mitgeteilten Ergebnisse sollte immer unter Berücksichtigung klinischer Gesichtspunkte erfolgen. Klinische Verdachtsdiagnose daher bitte unbedingt auf Anforderungsschein vermerken. Über die ‚Funktionsfähigkeit’ der einzelnen Fraktionen/Populationen erlaubt der Test leider keine Informationen. Hierfür existieren gesonderte Testverfahren. HINWEIS: Sollte der klinische Verdacht auf eine lymphoproliferative Erkrankung/Lymphom bestehen, so bitten wir um Anforderung einer Leukämie-/Lymphomtypisierung. Hierfür stellen wir Ihnen gerne einen gesonderten Anforderungsbogen zur Verfügung, dem sie auch weitere durchflusszytometrische Spezialuntersuchungen entnehmen können, die in unserem Labor durchgeführt werden. Bitte in Kombination mit Überweisungsschein Muster 10 einsenden. Material: frisches EDTA-Blut 1 Röhrchen Material muss spätestens 24 Std. nach Entnahme im Labor verarbeitet werden. Analyse Mo-Fr; nicht an Feiertagen Hinweise zur Abrechnung: EBM (1x32520, 1x32521, 1x32522, 1x32523, 1x32524, 2x32525, 1x32527) 72,30 € Privat GOÄ 1,15 (3x3696, 5x3697,1xA4003) 225,22 € IGEL GOÄ 1,0 (3x3696, 5x3697,1xA4003) 195,83 € Ausblick: Die T-Zellfamilie wächst. So gewinnt die Bestimmung weiterer T-Zell-Untergruppen immer mehr an Bedeutung. Hier eröffnet sich die Möglichkeit der Phänotypisierung sog. Regulatorischer T-Zellen (T-Reg). Diese Zellfraktion dient der Aufrechterhaltung der Harmonie zwischen Immunsystem und körpereigenem Gewebe. Sie fungiert im Rahmen der Immunregulation bspw. bei Autoimmunität, allergischen Erkrankungen sowie bei Tumorerkrankungen. Natürlich vorkommende T-Regs werden nicht durch einen einzelnen spezifischen Marker, sondern durch Detektion mehrerer Antigene erfasst (CD4+, CD25++, FOXP3+, CD127low/-). Literatur: - Manual Hämatologie, R. Fuchs et al., 21. Auflage 2011, S. 85-95 u. S. 115-116 - Bedeutung der Bestimmung der Lymphozyten-Subpopulationen in der Umweltmedizin; Bundesgesundheitsblatt, 2006, 49: S. 468-484 M V Z für Laboratoriumsmedizin Koblenz – Mittelrhein Dr. med. Dipl.-Chem. Rüdiger Walscheid • Axel Thuy • Dr. med. Martin Kirsch • Dr. med. Thomas Mertes Laboratoriumsmedizin • Humangenetik • Mikrobiologie • Infektionsepidemiologie • Bluttransfusionswesen Koblenz im August 2011 Deutscher Akkreditierungs Rat DAR DAC-ML-0126-01-10 Akkreditiert nach DIN EN ISO 15189 Viktoriastraße 39 • 56068 Koblenz • Tel: 0261 / 30 40 50 • Fax: 0261 / 30 40 5 -944 • www.labor-koblenz.com Seite /3