2.5 Dimorphe Pilze
Werbung
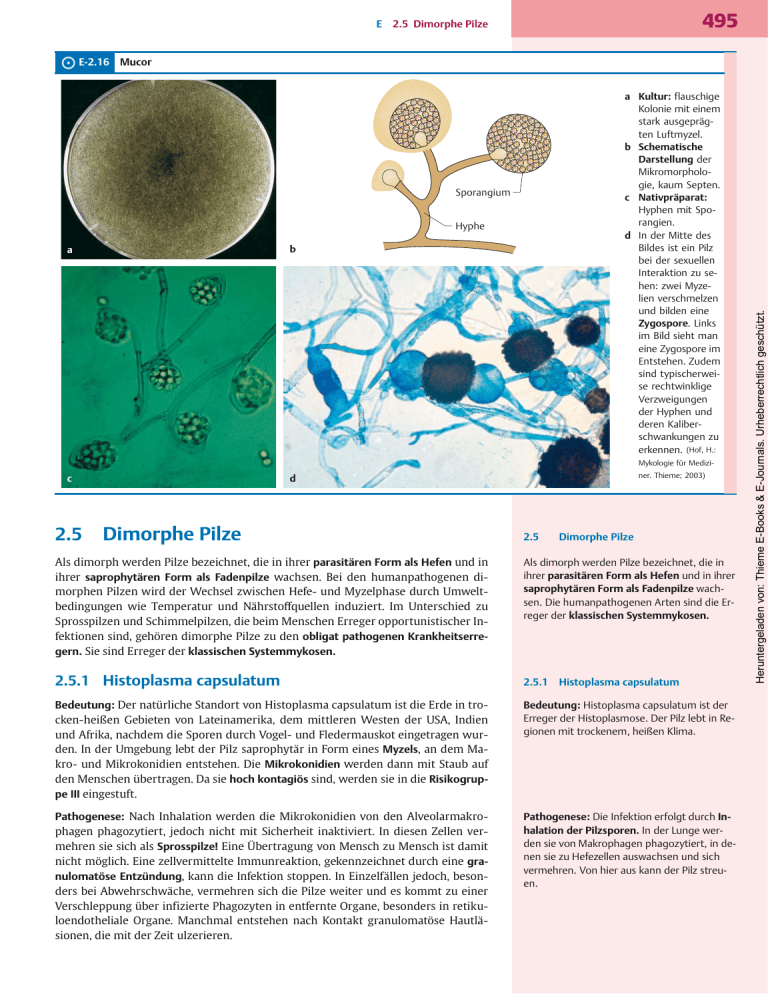
E Mucor a Kultur: flauschige Kolonie mit einem stark ausgeprägten Luftmyzel. b Schematische Darstellung der Mikromorphologie, kaum Septen. c Nativpräparat: Hyphen mit Sporangien. d In der Mitte des Bildes ist ein Pilz bei der sexuellen Interaktion zu sehen: zwei Myzelien verschmelzen und bilden eine Zygospore. Links im Bild sieht man eine Zygospore im Entstehen. Zudem sind typischerweise rechtwinklige Verzweigungen der Hyphen und deren Kaliberschwankungen zu erkennen. (Hof, H.: Sporangium Hyphe a b c d Mykologie für Medizi- 2.5 Dimorphe Pilze ner. Thieme; 2003) 2.5 Dimorphe Pilze Als dimorph werden Pilze bezeichnet, die in ihrer parasitären Form als Hefen und in ihrer saprophytären Form als Fadenpilze wachsen. Bei den humanpathogenen dimorphen Pilzen wird der Wechsel zwischen Hefe- und Myzelphase durch Umweltbedingungen wie Temperatur und Nährstoffquellen induziert. Im Unterschied zu Sprosspilzen und Schimmelpilzen, die beim Menschen Erreger opportunistischer Infektionen sind, gehören dimorphe Pilze zu den obligat pathogenen Krankheitserregern. Sie sind Erreger der klassischen Systemmykosen. Als dimorph werden Pilze bezeichnet, die in ihrer parasitären Form als Hefen und in ihrer saprophytären Form als Fadenpilze wachsen. Die humanpathogenen Arten sind die Erreger der klassischen Systemmykosen. 2.5.1 Histoplasma capsulatum 2.5.1 Bedeutung: Der natürliche Standort von Histoplasma capsulatum ist die Erde in trocken-heißen Gebieten von Lateinamerika, dem mittleren Westen der USA, Indien und Afrika, nachdem die Sporen durch Vogel- und Fledermauskot eingetragen wurden. In der Umgebung lebt der Pilz saprophytär in Form eines Myzels, an dem Makro- und Mikrokonidien entstehen. Die Mikrokonidien werden dann mit Staub auf den Menschen übertragen. Da sie hoch kontagiös sind, werden sie in die Risikogruppe III eingestuft. Bedeutung: Histoplasma capsulatum ist der Erreger der Histoplasmose. Der Pilz lebt in Regionen mit trockenem, heißen Klima. Pathogenese: Nach Inhalation werden die Mikrokonidien von den Alveolarmakrophagen phagozytiert, jedoch nicht mit Sicherheit inaktiviert. In diesen Zellen vermehren sie sich als Sprosspilze! Eine Übertragung von Mensch zu Mensch ist damit nicht möglich. Eine zellvermittelte Immunreaktion, gekennzeichnet durch eine granulomatöse Entzündung, kann die Infektion stoppen. In Einzelfällen jedoch, besonders bei Abwehrschwäche, vermehren sich die Pilze weiter und es kommt zu einer Verschleppung über infizierte Phagozyten in entfernte Organe, besonders in retikuloendotheliale Organe. Manchmal entstehen nach Kontakt granulomatöse Hautläsionen, die mit der Zeit ulzerieren. Pathogenese: Die Infektion erfolgt durch Inhalation der Pilzsporen. In der Lunge werden sie von Makrophagen phagozytiert, in denen sie zu Hefezellen auswachsen und sich vermehren. Von hier aus kann der Pilz streuen. Histoplasma capsulatum Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ⊙ E-2.16 495 2.5 Dimorphe Pilze 496 ⊙ E-2.17 E 2 Medizinisch relevante Pilze Histoplasma capsulatum a b Klinik: Viele Infektionen verlaufen inapparent. Beschränkt sich die Infektion auf die Lunge, sind Symptome und klinische Befunde einer Tbc ähnlich. Primäre Manifestationen der Histoplasmose sind außerdem in der Haut und im Knochen möglich. Bei Immunsupprimierten kann der Pilz in Milz, Leber und Knochenmark streuen. Klinik: Die meisten Infektionen mit Histoplasma capsulatum verlaufen subklinisch bzw. inapparent. Wenn sich die Histoplasmose in der Lunge manifestiert, tritt sie zunächst als tuberkuloseähnliche Erkrankung in Erscheinung, die spontan ausheilen kann. Bei Inhalation großer Mengen infektiösen Staubes kann sich aber auch eine akute Pneumonie entwickeln. Ein chronischer Verlauf der Pneumonie ist ebenfalls möglich. Vorrangig bei immunsupprimierten Patienten (z. B. AIDS-Patienten) besteht die Gefahr einer hämatogenen Streuung aus der Lunge mit nachfolgendem Befall von Lymphknoten, Milz, Leber und Knochenmark. Wird bei dieser Verlaufsform nicht rechtzeitig therapiert, ist die Letalität sehr hoch. Nachweis: Die akute Lungenhistoplasmose wird meist klinisch als Ausschlussdiagnose gestellt, da die Anzucht schwierig ist. Eine Erregeranzüchtung gelingt eher bei chronischen oder disseminierten Verläufen (Abb. E-2.17). Nachweis: Die akute Lungenhistoplasmose wird in der Regel klinisch als Ausschlussdiagnose gestellt, da sich der Erreger aus Sputum oder Bronchialsekret nur selten kulturell nachweisen lässt. Röntgenologisch stellen sich die Granulome in der Lunge oder auch im Knochen als Rundherde dar, die als Karzinommetastasen fehlgedeutet werden. Bei chronischen oder disseminierten Formen kann der mikroskopische Direktnachweis aus geeignetem Material (Sputum, Bronchialsekret, Eiter, Urin, Biopsiematerial) versucht werden. Allerdings werden die typischen „Morgenstern“-förmigen Makrokonidien nur selten gefunden. Sehr viel häufiger sind die untypischen Mikrokonidien (Abb. E-2.17). ▶ Merke. ▶ Merke. Bei der kulturellen Anzucht ist zu beachten, dass die Kulturen sehr lange bebrütet werden müssen (> 1 Woche) und dass der Pilz dann wieder als Fadenpilz wachsen kann, der Pilzsporen absondert (extreme Infektionsgefahr für das Laborpersonal). 2–5 Wochen nach der Infektion können Antikörper nachgewiesen werden. Der Histoplasmin-Hauttest kann für die Diagnostik der Infektion außerhalb von Endemiegebieten eingesetzt werden. 2–5 Wochen nach der Infektion können mit serologischen Methoden (Komplementbindungsreaktion, EIA) Antikörper nachgewiesen werden. Diese Untersuchungen sind aber Speziallabors vorbehalten. Darüber hinaus steht ein Histoplasmin-Hauttest zur Verfügung (ähnlich dem Tuberkulintest bei Tuberkulose), der außerhalb von Endemiegebieten für die Diagnostik einer Histoplasmose hilfreich sein kann. In Endemiegebieten hilft er nur bei der Feststellung des Durchseuchungsgrades der Bevölkerung. Therapie: Mittel der Wahl bei schweren Verläufen ist Amphotericin B. Therapie: Es gibt spontane Heilungen. Schwere und disseminierte Verlaufsformen der Histoplasmose werden mit Amphotericin B, alternativ mit Voriconazol oder Posaconazol behandelt. 2.5.2 2.5.2 Blastomyces dermatitidis Blastomyces dermatitidis Bedeutung: Erreger der nordamerikanischen Blastomykose. Übertragungen von Mensch zu Mensch sind eine Rarität. Bedeutung: Blastomyces dermatitidis ist der Erreger der nordamerikanischen Blastomykose. Er lebt im Erdboden als Fadenpilz. Die Blastomykose tritt vor allem im Mississippibecken sowie im Osten und Süden der USA auf. Einzelne Erkrankungen in Afrika und Mittelamerika sind beschrieben. Übertragungen von Mensch zu Mensch sind bisher nur in ganz wenigen Fällen berichtet worden. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. a Im peripheren Blut einer 17-Jährigen aus den Südstaaten der USA konnten Histoplasma-Zellen als Aussparungen im Zytoplasma von Granulozyten nachgewiesen werden. b Zahlreiche Histoplasmen in einem Makrophagen. 497 2.5 Dimorphe Pilze Pathogenese: Nach aerogener Aufnahme befällt Blastomyces dermatitidis zunächst die Lunge, wo sich der Pilz als Hefe vermehren kann. Eine Infektion kann aber auch transkutan bei Verletzung der Haut erfolgen. Pathogenese: Die Infektion erfolgt entweder aerogen oder perkutan. Klinik: Die pulmonale Form der Blastomykose beginnt mit uncharakteristischen grippalen Symptomen, im Anschluss daran kann sich eine tuberkuloseähnliche Symptomatik entwickeln. Obwohl es auch symptomlose Verläufe gibt, kommt es häufig zur Dissemination vor allem in die Knochen mit Ausbildung von Fisteln in die Haut. Auch in andere Organe wie ZNS und Urogenitalsystem kann der Erreger streuen. Die kutane Form kann entweder durch Erregeraussaat vom primären Herd in der Lunge oder durch direkte Erregerinokulation bei Verletzungen der Haut entstehen. Im Krankheitsverlauf schmelzen die kleinen, granulomartigen Knötchen ulzerös ein, vernarben zentral und hinterlassen ein charakteristisches Bild auf der Haut. Die Letalität der unbehandelten Blastomykose ist hoch. Klinik: Es entwickelt sich eine Lungenmykose, die bevorzugt in Knochen und Haut disseminiert. Hautinfiltrationen können aber auch direkt durch Inokulation kontaminierter Erde entstehen. Die Letalität der unbehandelten Blastomykose ist hoch. Nachweis: Blastomyces dermatitidis lässt sich aus dem Eiter der Hautläsionen, aus bioptischem Material und Sputum bzw. Bronchiallavage mikroskopisch im Direktpräparat als dickwandige, runde Hefezellen nachweisen und auf geeigneten Nährböden anzüchten. Die Kultur entwickelt sich dann nach ca. 3–4 Wochen Bebrütungszeit. Nachweis: Im Direktpräparat als dickwandige, runde Hefezellen oder in Kultur. Therapie: Mittel der Wahl ist liposomales Amphotericin B, alternativ Itraconazol. Therapie: Mittel der Wahl ist liposomales Amphotericin B. 2.5.3 Coccidioides immitis 2.5.3 Bedeutung: Coccidioides immitis ist der Erreger der Kokzidioidomykose, auch Wüstenrheumatismus genannt. Natürlicher Standort von Coccidioides immitis ist der Erdboden. Dort zerfallen die Hyphen in die infektiösen Arthrosporen. Die Kokzidioidomykose ist endemisch im Südwesten der USA (Wüstenregionen, z. B. Death Valley), ebenso in Süd- und Zentralamerika. Das Infektionsrisiko ist in diesen Gebieten während Sandstürmen besonders hoch. Eine Übertragung von Mensch zu Mensch gibt es nicht. Bedeutung: Erreger der Kokzidioidomykose, die im Südwesten der USA und in Süd- und Zentralamerika endemisch ist. Eine Übertragung von Mensch zu Mensch gibt es nicht. Pathogenese: Die Arthrosporen von Coccidioides immitis werden mit dem Staub eingeatmet. In der Lunge entwickelt sich dann bei ca. 40 % der exponierten Personen eine primäre Kokzidioidomykose, die entweder spontan ausheilt oder Herd für eine hämatogene Streuung wird. Aus den Sporen entwickeln sich im Gewebe Sphärulen. Diese sporangienartigen Pilzgebilde, die von einer dicken Wand umgeben sind und eine Größe von 30–60 μm erreichen, sind mit zahlreichen Endosporen gefüllt. Nach dem Aufplatzen der Sphärulen werden die Endosporen ins umgebende Gewebe freigesetzt, wo sich aus jeder Endospore wieder eine neue Sphärule entwickeln kann (Abb. E-2.18). Pathogenese: Die Infektion erfolgt aerogen durch hoch kontagiösen Staub. Aus den Sporen entwickeln sich im Gewebe Sphärulen, die mit zahlreichen Endosporen gefüllt sind (Abb. E-2.18). ⊙ E-2.18 Sphaerulae bei Kokzidioidomykose (Grocott-Gomori-Färbung) viele Pilzsporen liegen zusammen im Haufen a b a Sekrekt. b Histologie (Lunge): Sphärulen mit dicker Wand und vielen – auch einzelnen – Endosporen. Coccidioides immitis Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. E E 2 Medizinisch relevante Pilze Klinik: Bei vielen Exponierten verläuft die Infektion klinisch unauffällig. Eine primäre klinische Manifestation in der Lunge ist die Pneumonie. Chronische Verläufe sind möglich (Differenzialdiagnose: Tuberkulose). Eine hämatogene Streuung in andere Organe ist als Komplikation der Pneumonie oder Reaktivierung subklinischer Verläufe (infolge Immunsuppression oder Schwangerschaft) zu werten und mit einer hohen Letalität einhergehend. Klinik: Ca. 60 % aller Infektionen verlaufen inapparent oder subklinisch unter den Symptomen einer banalen Erkältung. Bei klinisch manifesten Verläufen kommt es zu einer schweren Pneumonie mit begleitender Pleuritis und blutig-eitrigem Auswurf. Diese Pneumonie kann ausheilen oder in weniger als 5 % der Fälle einen chronischen Verlauf mit Lungengewebeuntergang und Kavernenbildung nehmen. Eine Dissemination ist als Komplikation der primären Lungenkokzidioidomykose oder als Reaktivierung einer primär subklinischen Infektion in der Folge einer Immunsuppression möglich und mit einer hohen Letalität behaftet. Häufigste Manifestationen bei hämatogener Streuung sind Läsionen der Haut und des subkutanen Gewebes, Osteomyelitis, Arthritis, aber auch Meningitis und Befall der Nebennieren. Bevorzugt bei Frauen findet sich in der Folge der primären Lungenmanifestation ein Erythema nodosum oder Erythema multiforme. In der Schwangerschaft treten disseminierte Verläufe der Kokzidioidomykose häufiger auf. Nachweis: Das typische morphologische Erscheinungsbild im Untersuchungsmaterial sind die Sphaerulae (Abb. E-2.18). Nachweis: Die typischen Sphaerulae finden sich bei geeignetem Untersuchungsmaterial (Sputum, Bronchialsekret) bereits im mikroskopischen Direktpräparat (Abb. E-2.18). Auch histologisch lassen sich diese Pilzstrukturen in Biopsiematerial mit einfachen Färbetechniken eindeutig nachweisen. Der kulturelle Nachweis ist zwar problemlos möglich, die Kulturen sind aber hoch infektiös. Der serologische Antikörpernachweis ist möglich. Therapie: Mittel der Wahl ist Itraconazol, bei schweren Verläufen auch Amphotericin B. Therapie: Das Anfangsstadium einer pulmonalen Kokzidioidomykose heilt oftmals spontan aus, weshalb eine spezifische Therapie meist nicht erforderlich ist. Bei einer klinisch symptomatischen pulmonalen Infektion wird am häufigsten Itraconazol verwendet (monatelange Gabe notwendig). Mittel der Wahl bei schweren und disseminierten Verlaufsformen ist Amphotericin B. 2.5.4 2.5.4 Sporothrix Sporothrix Bedeutung: Weltweites Vorkommen auf Holz und Pflanzen, Infektionen treten hauptsächlich in den (Sub-)Tropen auf. Sporothrix schenckii verursacht Verletzungsmykosen. Bedeutung: Sporothrix schenckii ist ein weltweit verbreiteter Pilz, der auf Holz und Pflanzen lebt. Besonders häufig konnte er von Buchenholz und Schachtelhalm isoliert werden. Infektionen treten, von sporadischen Fällen in Südfrankreich und Spanien abgesehen, in der Regel nur in subtropischen und tropischen Regionen auf. Sporothrix schenckii verursacht nach Inokulation kontaminierten Materials in die Haut eine sogenannte Verletzungsmykose. Pathogenese: Über eine Verletzung mit Splittern und Dornen gelangt der Pilz in die Haut. Entlang der Lymphbahnen entwickeln sich geschwürige Herde mit der Tendenz zur Fistelbildung. Pathogenese: Der Pilz gelangt durch Verletzung mit Holzsplittern (Buchenholz) und Dornen in die Haut. Nach einigen Wochen entwickelt sich an dieser Stelle subkutan ein Knoten, der ulzerös einschmilzt, Fisteln in benachbartes Gewebe ausbilden kann und Anschluss an das lokale Lymphsystem findet. Schließlich entstehen entlang der Lymphbahnen Ketten solcher geschwüriger Herde. Eine Dissemination des Pilzes über das Lymph- und Blutsystem in andere Organe ist möglich. Klinik: Die kutane Form verläuft chronisch, ohne Spontanheilung. Die extrakutane Form nach hämatogener Aussaat manifestiert sich in der Regel als Arthritis. Klinik: Die kutane Form der Sporotrichose ist eine chronisch verlaufende, fistelnde Infektion, die differenzialdiagnostisch von einer Aktinomykose (S. 351) abgegrenzt werden muss. Spontanheilungen sind selten. Eine extrakutane Manifestation der Sporotrichose entwickelt sich nach hämatogener Aussaat des Pilzes und betrifft bevorzugt Knochen und Gelenke, seltener auch innere Organe. Nachweis: Asteroidkörper im Gewebe sind der Nachweis für eine Infektion mit Sporothrix schenckii. Bei Raumtemperatur wachsen die Pilze in Form von Schimmelpilzen (Abb. E-2.19). Nachweis: Der direkte Nachweis des Erregers im eitrigen Exsudat aus den Läsionen oder im Gewebe gelingt selten aufgrund der geringen Erregerdichte und Unauffälligkeit des Erregers selbst. Dagegen gilt der Nachweis strahlenförmiger Rundkörper, sog. Asteroidkörper (Konglomerat aus Pilzzellen und körpereigenen Materialien), als beweisend für eine Infektion mit Sporothrix schenckii. Die kulturelle Anzucht gelingt auf Sabouraud-Glukose-Agar. Nach 3–7 Tagen und einer Bebrütungstemperatur von 37 °C werden Pilzkolonien sichtbar, die später ein dunkles Pigment produzieren. Bei Raumtemperatur wachsen diese dimorphen Pilze in Form von Schimmelpilzen (Abb. E-2.19). Therapie: Die kutane Form wird lokal mit Kaliumjodid behandelt (systemische Ausbreitung: Amphotericin B). Therapie: Die Chemotherapie der kutanen Sporotrichose erfolgt lokal mit Kaliumjodid oder systemisch mit Itraconazol über viele Monate, manchmal sind chirurgische Maßnahmen erforderlich. Eine hyperthermische Behandlung der befallenen Hautareale kann eine Ausheilung unterstützen. Bei extrakutaner Manifestation ist Amphotericin B Mittel der Wahl. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 498 E ⊙ E-2.19 499 2.6 Außergewöhnliche Pilze Sporothrix schenkii, ein dimorpher Pilz a Bei 37 °C Wachstum in Form von Hefe mit glatten, glänzenden Kolonien. b Bei Raumtemperatur Wachstum in Form von Schimmelpilzen mit flauschigen Kolonien. 2.6 b Außergewöhnliche Pilze 2.6.1 Pneumocystis jirovecii (Pneumocystis carinii) ▶ Merke. Die Pneumocystis-Spezies Pneumocystis carinii findet sich, wie man in- 2.6 Außergewöhnliche Pilze 2.6.1 Pneumocystis jirovecii (Pneumocystis carinii) ▶ Merke. zwischen weiß, ausschließlich bei Ratten. Dagegen tritt beim Menschen Pneumocystis jirovecii auf, der nach seinem Entdecker Otto Jirovec benannt ist. Bedeutung: Pneumocystis jirovecii ist ein weltweit verbreiteter saprophytär lebender Organismus. Die Exposition ist demnach häufig und die Durchseuchungsrate sehr hoch. Im Alter von 2 Jahren haben schon > 80 % der Kinder Kontakt gehabt. Die Erkrankung dagegen ist relativ selten. Da aber die Zahl der anfälligen Personen durch moderne medizinische Maßnahmen, wie Immunsuppression, zunimmt, steigen auch die Erkrankungszahlen. Einerseits bildet Pneumocystis jirovecii in bestimmten Entwicklungsstadien Trophozoiten und Zysten, d. h. für Protozoen typische Strukturen. Andererseits finden sich auf der 16s-ribosomalen RNA in hohem Maße Sequenzhomologien mit Pilzen aus der Gruppe der Askomyzeten. Im Unterschied zur Pilzzelle enthält die zytoplasmatische Membran aber kein Ergosterin, was erklärt, dass dieser Organismus gegenüber Antimykotika (Polyene, Azole) unempfindlich ist. Bedeutung: Pneumocystis jirovecii ist ein besonderer Pilz, weil er keine Ergosterinbausteine in der Zytoplasmamembran besitzt. Er lebt in der Umwelt. Klinik: Als typischer Opportunist kann Pneumocystis jirovecii bei einer bestehenden T-zellulären Abwehrschwäche (Frühgeborene, Organtransplantation, AIDS) eine interstitielle, atypische Pneumonie hervorrufen (Abb. E-2.20a), die mit einem starken Sauerstoffmangel wegen der Gasaustauschstörung in der Lunge einhergeht. Wenn die Erkrankung nicht rechtzeitig erkannt wird, ist die Prognose schlecht (Mortalität Klinik: Bei Abwehrschwäche (z. B. AIDS) kann Pneumocystis jirovecii eine interstitielle, atypische Pneumonie erzeugen (Abb. E-2.20a). ⊙ E-2.20 a Pneumocystis jirovecii b a Histologisches Bild einer atypischen Pneumonie: In den Lungenalveolen ist ein entzündliches Exsudat mit schwarz angefärbten Zysten zu erkennen (Grocott-Gomori-Färbung: Versilberung). b Immunfluoreszenznachweis in BAL: Die runden Zysten werden durch spezifische Antikörper, die mit einem Fluoreszenzfarbstoff grün markiert sind, erkannt. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. a











