42 Hantavirusinfektionen
Werbung
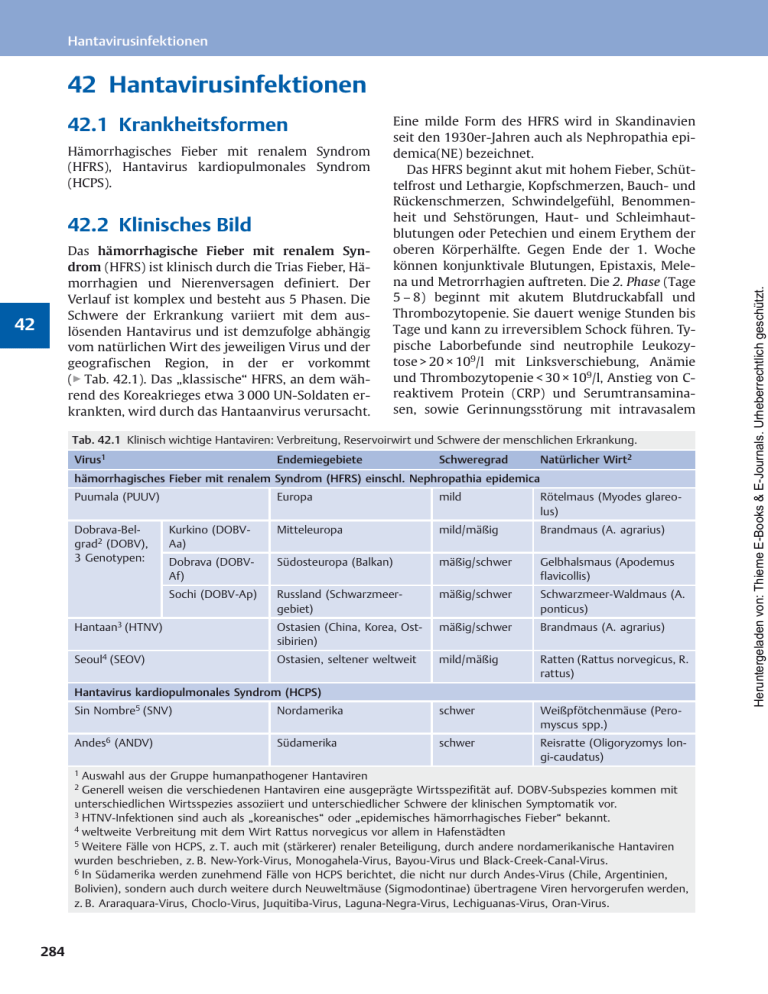
Hantavirusinfektionen 42.1 Krankheitsformen Hämorrhagisches Fieber mit renalem Syndrom (HFRS), Hantavirus kardiopulmonales Syndrom (HCPS). 42.2 Klinisches Bild Das hämorrhagische Fieber mit renalem Syndrom (HFRS) ist klinisch durch die Trias Fieber, Hämorrhagien und Nierenversagen definiert. Der Verlauf ist komplex und besteht aus 5 Phasen. Die Schwere der Erkrankung variiert mit dem auslösenden Hantavirus und ist demzufolge abhängig vom natürlichen Wirt des jeweiligen Virus und der geografischen Region, in der er vorkommt (▶ Tab. 42.1). Das „klassische“ HFRS, an dem während des Koreakrieges etwa 3 000 UN-Soldaten erkrankten, wird durch das Hantaanvirus verursacht. 42 Eine milde Form des HFRS wird in Skandinavien seit den 1930er-Jahren auch als Nephropathia epidemica(NE) bezeichnet. Das HFRS beginnt akut mit hohem Fieber, Schüttelfrost und Lethargie, Kopfschmerzen, Bauch- und Rückenschmerzen, Schwindelgefühl, Benommenheit und Sehstörungen, Haut- und Schleimhautblutungen oder Petechien und einem Erythem der oberen Körperhälfte. Gegen Ende der 1. Woche können konjunktivale Blutungen, Epistaxis, Melena und Metrorrhagien auftreten. Die 2. Phase (Tage 5 – 8) beginnt mit akutem Blutdruckabfall und Thrombozytopenie. Sie dauert wenige Stunden bis Tage und kann zu irreversiblem Schock führen. Typische Laborbefunde sind neutrophile Leukozytose > 20 × 109/l mit Linksverschiebung, Anämie und Thrombozytopenie < 30 × 109/l, Anstieg von Creaktivem Protein (CRP) und Serumtransaminasen, sowie Gerinnungsstörung mit intravasalem Tab. 42.1 Klinisch wichtige Hantaviren: Verbreitung, Reservoirwirt und Schwere der menschlichen Erkrankung. Virus1 Endemiegebiete Schweregrad Natürlicher Wirt2 hämorrhagisches Fieber mit renalem Syndrom (HFRS) einschl. Nephropathia epidemica Puumala (PUUV) Europa mild Rötelmaus (Myodes glareolus) Kurkino (DOBVAa) Mitteleuropa mild/mäßig Brandmaus (A. agrarius) Dobrava (DOBVAf) Südosteuropa (Balkan) mäßig/schwer Gelbhalsmaus (Apodemus flavicollis) Sochi (DOBV-Ap) Russland (Schwarzmeergebiet) mäßig/schwer Schwarzmeer-Waldmaus (A. ponticus) Hantaan3 (HTNV) Ostasien (China, Korea, Ostsibirien) mäßig/schwer Brandmaus (A. agrarius) Seoul4 (SEOV) Ostasien, seltener weltweit mild/mäßig Ratten (Rattus norvegicus, R. rattus) Dobrava-Belgrad2 (DOBV), 3 Genotypen: Hantavirus kardiopulmonales Syndrom (HCPS) Sin Nombre5 (SNV) Nordamerika schwer Weißpfötchenmäuse (Peromyscus spp.) Andes6 (ANDV) Südamerika schwer Reisratte (Oligoryzomys longi-caudatus) 1 Auswahl aus der Gruppe humanpathogener Hantaviren Generell weisen die verschiedenen Hantaviren eine ausgeprägte Wirtsspezifität auf. DOBV-Subspezies kommen mit unterschiedlichen Wirtsspezies assoziiert und unterschiedlicher Schwere der klinischen Symptomatik vor. 3 HTNV-Infektionen sind auch als „koreanisches“ oder „epidemisches hämorrhagisches Fieber“ bekannt. 4 weltweite Verbreitung mit dem Wirt Rattus norvegicus vor allem in Hafenstädten 5 Weitere Fälle von HCPS, z. T. auch mit (stärkerer) renaler Beteiligung, durch andere nordamerikanische Hantaviren wurden beschrieben, z. B. New-York-Virus, Monogahela-Virus, Bayou-Virus und Black-Creek-Canal-Virus. 6 In Südamerika werden zunehmend Fälle von HCPS berichtet, die nicht nur durch Andes-Virus (Chile, Argentinien, Bolivien), sondern auch durch weitere durch Neuweltmäuse (Sigmodontinae) übertragene Viren hervorgerufen werden, z. B. Araraquara-Virus, Choclo-Virus, Juquitiba-Virus, Laguna-Negra-Virus, Lechiguanas-Virus, Oran-Virus. 2 284 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 42 Hantavirusinfektionen Faktorenverbrauch, Prothrombin- und partieller Thromboplastinzeitverlängerung und Fibrinogenspaltproduktvermehrung. Die 3., oligurische Phase (Tage 9 – 12) ist durch eine akute tubulointerstitielle Nephritis und Nierenversagen mit obligat tubulärer Proteinurie und Hämaturie gekennzeichnet, gelegentlich mit Lungenödem oder „acute respiratory distress syndrome“ (ARDS). Die Nierenfunktion bessert sich bei den überlebenden Patienten in der Regel nach 3 – 10 Tagen mit Übergang in die polyurische Phase. Eine chronische Niereninsuffizienz ist selten. Das komplette Bild des HFRS mit Haut-, Schleimhaut- und internen Blutungen tritt nur bei einem Drittel der Patienten mit Hantaanvirusinfektion auf (Tage 13 – 21). Die Letalität des durch Hantaanvirusinfektion bedingten HFRS beträgt 5 – 20 %. Todesursachen sind hauptsächlich Schock oder Nierenversagen, seltener Lungenödem. Milde, durch Infektionen mit dem Puumalavirus ausgelöste, klinische Verläufe des HFRS werden auch als Nephropathia epidemica (NE) bezeichnet. Der klinische Verlauf imponiert als 2-phasige grippeähnliche Krankheit. Häufige Symptome sind Fieber, kolikartige, oft einseitige Flankenschmerzen, Übelkeit und Diarrhoe, Kopfschmerzen und Nackensteifigkeit, gelegentlich mit Sehstörungen (Myopie, Fotophobie) und konjunktivalen Einblutungen. Generalisierte Blutungsneigungen sind extrem selten. Transiente Proteinurie (0,1 – > 20 g/l) und Mikrohämaturie werden fast immer gefunden. Eine akute Nierenfunktionseinschränkung tritt im Mittel nach 7 (3 – 19) Tagen auf mit generell mäßigem Anstieg von Serumkreatinin, CRP und Leukozytenzahl, und Thrombozytopenie < 100 × 109/l sowie tubulärer Proteinurie mit Vermehrung von α-1-Mikroglobulin. Histologisch findet sich eine interstitielle Nephritis mit mononukleärem Infiltrat und, gelegentlich, interstitieller (medullärer) Hämorrhagie. Bei unkompliziertem Verlauf ist in der Regel eine Nierenbiopsie nicht erforderlich. Dialyse ist in < 10 % der Fälle indiziert. Die Letalität ist < 1 %. In jüngerer Zeit wurden in Nord- und Ostdeutschland auch ähnliche Krankheitsbilder nach Infektion mit Dobravaviren (Genotyp DOBV-Aa) beschrieben. Bei Kindern mit HFRS/NE stehen initial Fieber, Kopf- und Halsschmerzen, Myalgien, gastrointestinale Symptome mit Bauch- und Flankenschmerzen, Erbrechen, Oligurie und Bluthochdruck im Vordergrund. Haut- und Schleimhautblutungen (Petechien, gastrointestinale Blutungen) sowie schweres Nierenversagen sind die Ausnahme. Es muss angemerkt werden, dass Kinder relativ selten an HFRS erkranken und dass auch die Seroprävalenz (Vorkommen von Hantavirus-Antikörpern) im Kindesalter noch gering ist. Das Hantavirus kardiopulmonale Syndrom (HCPS) ist die typische Krankheitsform in Nordund Lateinamerika durch dort endemische Hantaviren (siehe ▶ Tab. 42.1). Die oft akut verlaufende Erkrankung ist charakterisiert durch Fieber und Myalgien, Schüttelfrost, gastrointestinale Symptome wie Übelkeit, Erbrechen, Bauchschmerzen und Diarrhoe gefolgt von Dyspnoe, Thrombozytopenie, Kreislaufinstabilität und Lungenödem. Trotz verlängerter PTT und PT sind manifeste Blutungen selten. Eine renale Beteiligung mit tubulärer Proteinurie und/oder Hämaturie, aber nur geringer Nierenfunktionseinschränkung, findet sich bei etwa 50 % der Patienten. Die Erkrankung hat eine Letalität von ca. 35 %. HCPS kommt in Europa nur als importierte Erkrankung vor. Pathogenese und klinischen Manifestation von HFRS und HCPS ähneln sich, zumal auch HFRS-Fälle mit schweren Lungenkomplikationen und HCPS-Fälle mit Nierenbeteiligung auftreten. Deshalb wird vorgeschlagen, übergreifend den Begriff Hantavirus-Erkrankung zu verwenden, wie es auch das Robert Koch-Institut schon seit Jahren tut. 42 42.3 Ätiologie HFRS und HCPS werden durch einzelsträngige RNA-Viren aus der Familie der Bunyaviridae, Genus Hantavirus, hervorgerufen. Hantaviren variieren hinsichtlich der geografischen Verteilung, des spezifischen Nagetierreservoirs und des Verlaufs der assoziierten Erkrankung. Die Puumala-Viren und verschiedene Dobravavirus-Subtypen sind die Erreger des europäischen HFRS. Details sind in ▶ Tab. 42.1 aufgeführt. In vitro führen Infektionen mit Hantaviren nur zu geringer Zellschädigung. In vivo beeinflussen sie vor allem die Funktion der Endothelzellen und induzieren Infiltrate aus aktivierten (CD8+-)T-Zellen, Monozyten und Makrophagen im Interstitium. Der Krankheitsentstehung liegen wahrscheinlich immunpathologische Mechanismen zugrunde, die eine Störung der Endothel-Barrierefunktion in den Kapillaren durch zytotoxische T-Zellen und inflammatorische Zytokine bedingen. Außerdem 285 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 42.3 Ätiologie können Hantaviren mit Megakaryozyten und auch den Thrombozyten selbst interagieren. HFRS und HCPS hinterlassen wahrscheinlich eine lang andauernde, zell- und antikörpervermittelte Immunität und damit einen Schutz vor erneuter Erkrankung. 42.4 Epidemiologie Hantaviren sind in weiten Gegenden Eurasiens endemisch. Bekannte europäische Endemiegebiete sind Skandinavien, der europäische Teil Russlands und der Balkan, vor allem Serbien und Nordgriechenland. Zunehmend werden Fälle auch aus Deutschland, der Tschechischen Republik, der Slowakei, Belgien und Nordfrankreich berichtet. Mit 1688 gemeldeten Erkrankungen im Jahr 2007, 2017 Fällen in 2010 und 2500 Fällen im Jahre 2012 bereits bis September des Jahres gehören Hantavirus-Erkrankungen in diesen Jahren zu den 5 häufigsten meldepflichtigen Viruserkrankungen in Deutschland. Die meisten Erkrankungen in Deutschland werden durch das Puumalavirus ausgelöst. Im Norden und Osten Deutschlands führt außerdem eine Variante des Dobrava-Belgrad-Virus (DOBV-Aa) zu Erkrankungen. Zu den Regionen mit der höchsten Inzidenz gehören die Schwäbische Alb, der Bayerische Wald und der Spessart. Schwere Formen mit Letalitätsraten bis zu 12 % sind vor allem im ehemaligen Jugoslawien beschrieben worden. Auf dem Balkan sind DobravaBelgrad- und Puumalaviren endemisch. Die schweren Verläufe werden durch eine dort vorkommende Variante des Dobrava-Belgrad-Virus (DOBV-Af) ausgelöst. Das Reservoir der Hantaviren sind in der Regel Nagetiere der Unterfamilien Murinae (DOBV, HTNV, SEOV), Arvicolinae (PUUV) und Sigmodontinae (SNV, ANDV). Hantaviren sind an spezifische Nager adaptiert, bei denen sie eine vermutlich symptomlose, chronische Infektion verursachen. Die Übertragung geschieht über Exkremente, insbesondere Urin und Speichel der Nager, die vom Menschen über Aerosole aufgenommen werden. Hantaviren werden nicht von Mensch zu Mensch übertragen. Eine mögliche Ausnahme ist das Andesvirus, für das einzelne Fälle einer Übertragung zwischen Menschen beschrieben wurden. Für Laborpersonal besteht Infektionsgefahr durch Kontakt mit Material von Patienten oder infizierten Versuchstieren. Weitere Wirte, z. B. Bisamratten, Spitzmäuse, Maulwürfe und Fledermäuse, können 42 286 infiziert sein, ohne dass bisher eine humanpathogene Bedeutung der entsprechenden Hantavirustypen bekannt ist. Die Inzidenz der Erkrankung ist in ländlichen Gegenden höher als in urbanen Gebieten. Wahrscheinlich bedingt durch Exposition und berufliche Tätigkeiten sind Männer häufiger als Frauen betroffen (2:1 bis 3,5:1), bevorzugt im Alter zwischen 20 und 49 Jahren. Infektionen treten zu jeder Jahreszeit mit einem Häufigkeitsgipfel im Sommer auf. Es wird angenommen, dass die Infektion in bis zu 90 % der Fälle asymptomatisch verläuft. Die Inkubationszeit wird mit 7–40 Tagen angegeben. 42.5 Diagnose Wenn eine Leptospirose ausgeschlossen ist, lässt sich die Verdachtsdiagnose HFRS gelegentlich aufgrund der klinischen und epidemiologischen Angaben stellen, jedoch ist das klinische Bild oft unvollständig, und die Symptome sind nicht spezifisch. Die Virusanzucht ist schwierig und meist erfolglos. Infolgedessen gewinnt der Nachweis virusspezifischer Nukleinsäuren in Blut, Speichel oder Urin sowie Gewebeproben mittels PolymeraseKettenreakion (RT-PCR), ggf. mit nachfolgender Sequenzierung, zunehmende Bedeutung. Die Virämiephase bei HFRS-Patienten ist jedoch sehr kurz, sodass der Nachweis von viraler RNA aus dem Blut nur während der akuten Phase und auch hier nur bei einem Teil der Patienten gelingt. Zur retrospektiven Diagnostik bieten sich immunhistologische Techniken an, z. B. in fixiertem Gewebe. Die Diagnose wird daher in der Regel serologisch durch den Nachweis spezifischer Immunglobulin (Ig)M- und IgG-Antikörper mittels Enzymimmunoassay (ELISA) oder Western-Blot gestellt, unter Verwendung von (rekombinanten) Nukleokapsid-(N-)Proteinen als diagnostischem Antigen oder mittels indirektem Immunfluoreszenztest (IFA). Dabei muss in Europa sowohl mit Puumala- als auch mit Dobrava-Antigenen getestet werden. Die Mehrzahl hantavirusinfizierter Patienten hat bereits bei Beginn der klinischen Symptome nachweisbare IgM-Antikörper. IgG-Antikörper werden in 80 – 90 % der in den ersten 5 Tagen entnommenen Serumproben gefunden. Der IgM-Nachweis ist vor allem in Endemiegebieten wichtig aufgrund der Prävalenz virusspezifischer IgG-Antikörper. Mit hochsensitiven Tests lassen sich IgM-Antikörper noch bis zu 2 Jahre nach der Erkrankung Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Hantavirusinfektionen 42.7 Prophylaxe 42.6 Therapie Die Behandlung konzentriert sich auf die Beherrschung von Blutungen, die Stabilisierung des Kreislaufs und die Korrektur der Folgen der akuten Niereninsuffizienz. Patienten sollten frühzeitig in ein Zentrum mit allen Möglichkeiten der intensivmedizinischen Betreuung und Nierenersatztherapie verlegt werden. Eine wirksame antivirale Therapie des HFRS ist mit Ribavirin möglich. In einer prospektiven, randomisierten, placebokontrollierten Studie zwischen 1985 und 1987 an 242 chinesischen Patienten mit serologisch gesichertem HFRS führte eine frühzeitige intravenöse Ribavirin-Therapie zur signifikanten Senkung der Inzidenz von Nierenversagen, hämorrhagischen Komplikationen und Letalität. Der „loading dose“ mit 30 mg/kgKG folgte die Gabe von 15 mg/kgKG alle 6 h über 4 Tage, dann 8 mg/kgKG alle 8 h über weitere 3 – 6 Tage. Ribavirin wurde über 30 Minuten intravenös infundiert. Systemische Ribavirin-Therapie kann dosisabhängig zu einer reversiblen hämolytischen Anämie und Knochenmarksuppression führen. Der Nutzen der virostatischen Therapie bei der in der Regel leichteren mitteleuropäischen Form des HFRS (NE) und beim HCPS ist nicht bewiesen. Alpha-Interferon scheint das Risiko der Hämorrhagien, nicht jedoch die Letalität zu beeinflussen. 42.7 Prophylaxe Aktive oder passive Impfstoffe stehen in Europa bisher nicht zur Verfügung. Südkorea hat 1992 eine Hantaanvirus-Vakzine aus formalininaktiviertem Hirnextrakt von infizierten Mäusen (Hantavax) in das nationale Impfprogramm aufgenommen (2 Dosen im Abstand von 1 Monat, Auffrischimpfung nach 12 Monaten; über 6 Mio. Dosen verimpft). Nach der 2. und 3. Dosis wurden neutralisierende Antikörper nur bei 17 % bzw. 33 – 50 % der freiwilligen Impflinge erzielt. Adäquate, kontrollierte und randomisierte Studien fehlen bisher. Der Schutzeffekt in der Bevölkerung ist unbekannt und Kosten-Nutzen-Analysen stehen noch aus. Zwar wurde derselbe Impfstoff während der Jahre 1996 – 1998 in einer Feldstudie im früheren Jugoslawien mit „gutem Erfolg“ an insgesamt 3 900 Probanden getestet, erhebliche methodische Mängel mindern jedoch den Wert dieser Untersuchung. In China und Südkorea sind noch weitere Impfstoffe auf der Basis inaktivierter Viren (China: HTNV/SEOV, Südkorea: HTNV) im Einsatz. Klinische Studien mit einem rekombinanten Vakzinia-Lebendimpfstoff mit HTNV-Membranglykoproteinen G1 und G2 und dem Nukleokapsidantigen wurden in den USA nicht weitergeführt. Eine Schutzwirkung gegenüber der in Mitteleuropa vorherrschenden Hantavirus-Erkrankung durch Puumula- und Dobrava-Viren ist mit keinem der oben genannten Impfstoffe zu erwarten. Erste tierexperimentelle Studien zeigen, dass eine passive Immunisierung mit hantavirusspezifischen (monoklonalen) Antikörpern die Induktion von Zytokinen und Krankheitssymptomen mildert. Die Expositionsprophylaxe (Vermeidung des Kontakts mit Mäusen und deren Ausscheidungen) ist von zentraler Bedeutung für die Verhinderung von Infektionen mit Hantaviren. Dazu gehört die Bekämpfung von Mäusen innerhalb und in der Umgebung von Wohn- und Arbeitsplätzen. Bei Tätigkeit in Räumlichkeiten, in denen Mäuse gehaust haben können (z. B. Stallungen, Schuppen, Reinigung von Sommerhäusern nach der Winterpause) sollten Einweghandschuhe und möglichst Mundschutz getragen werden; eine Aufwirbelung von Staub bei der Entfernung von Mäusekot oder Nestmaterial ist zu vermeiden. Beim Aufenthalt im Freien (z. B. Camping, Tätigkeit in Wald und Feld) sollten ebenfalls Kontakte mit Mäusenestern und Mäuseausscheidungen vermieden werden. Weitere Maßnahmen sind die sichere Aufbewahrung 42 287 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. nachweisen. Mit zunehmendem Wissen um die Epidemiologie der Hantaviren wird es möglich und nötig sein, trotz der ausgeprägten Kreuzreaktionen vor allem zwischen den Viren der Hantaan-Gruppe (HTNV/SEOV/DOBV) virusspezifische Antigene einzubeziehen. Zur definitiven Differenzierung von Hantavirus-Antikörpern müssen aufwendige Neutralisationstests durchgeführt und/ oder auf RT-PCR-Ergebnisse zurückgegriffen werden. Prinzipiell wird die akute Infektion durch den Nachweis von IgM und IgG oder signifikantem Titeranstieg (Serumpaar) von IgG diagnostiziert. In Nichtendemiegebieten wird schon der 1-malige gesicherte Nachweis von IgG im Zusammenhang mit der klinischen Symptomatik als beweisend für die Infektion angesehen. Die Bestätigung von ELISA-Daten durch ein unabhängiges Verfahren zum Antikörpernachweis (Immunoblot, IFA) wird empfohlen. Hantavirusinfektionen 42 288 Koordinator: D. H. Krüger Z ● Mitarbeiter: R. Beetz, M. Panning 42.8 Weiterführende Informationen Centers for Disease Control and Prevention: www. cdc.gov > A–Z Index: H > Hantavirus Pulmonary Syndrome (HPS) Institut für Virologie der Charité: virologie-ccm. charite.de > Institut > Konsiliarlaboratorium für Hantaviren: Maßnahmen zur Vermeidung von Hantavirusinfektionen (pdf) Konsiliarlaboratorium für Hantaviren Institut für Medizinische Virologie Charité-Universitätsmedizin Berlin Charitéplatz 1 10 117 Berlin Ansprechpartner: Prof. Dr. D.H. Krüger Tel.: 030 450–525 092 oder -525 084 Fax: 030 450–525 907 E-Mail: [email protected] Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. von Nahrungsmitteln innerhalb und außerhalb menschlicher Wohnungen sowie die Desinfektion und Entsorgung von gefangenen bzw. toten Mäusen. Einzelheiten können einem gemeinsamen Informationsblatt des Nationalen Konsiliarlaboratoriums für Hantaviren an der Charité, des Robert Koch-Institutes und weiterer Einrichtungen entnommen werden. Schwangerschaft. Die Zahl publizierter Fälle von Hantavirusinfektionen in der Schwangerschaft ist gering und lässt keine zuverlässige Risikoeinschätzung zu. In Einzelberichten wurden vaginale Blutungen, spontaner Abort, Frühgeburt mit Atemnotsyndrom und Tod des Neugeborenen unmittelbar nach der Geburt in Verbindung mit einer Hantavirus-Erkrankung der Mutter während der Schwangerschaft gebracht. In einer Studie zu Puumula- und Dobravavirusinfektion während der Schwangerschaft wurden jedoch keine vertikale Virusübertragung und keine offensichtlichen Auswirkungen auf den Fetus oder das Neugeborene dokumentiert. Meldepflicht nach § 6 und 7 IfSG. Namentliche Meldung an das Gesundheitsamt innerhalb von 24 Stunden durch das Labor bei direktem oder indirektem Nachweis einer akuten Infektion durch Hantaviren. Namentliche Meldepflicht durch den behandelnden Arzt bei virusbedingtem hämorrhagischem Fieber (VHF).











