TCR α/β ANTIKÖRPER MONOKLONALE ANTIKÖRPER
Werbung

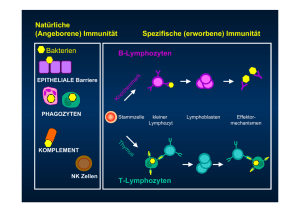
MONOKLONALE ANTIKÖRPER GEGEN HUMANE LEUKOZYTEN ANTIGENE TCR α/β ANTIKÖRPER Phycoerythrin Konjugat Spezifikation Spezifität: Klon: Isotyp: Spezies: Reinigung: Form: Aufbewahrungspuffer: Kat. Nr.: GM-4183 2ml 100 Tests PB: Leukogate T-cell receptor alpha/beta complex BMA 031 IgG2b Maus Säulenchromatographie PE-konjugiert PBS pH7.2,1 mg/ml BSA, 0.05% NaN3 side scatter Form: TCR α/β - PE Einleitung T-Lymphozyten erkennen fremde Antigene mit Hilfe ihrer clonotypischen T-Zellen Rezeptoren (TCR). Der TCR besteht aus zwei TCR Ketten umgeben von CD3 Molekülen, und wird üblicherweise als TCR/CD3 Komplex bezeichnet. Unter den TCR Heterodimeren können zwei Formen unterschieden werden: α/β TCRs und γ/δ TCRs. α/β TCR exprimierende TLymphozyten machen den Großteil der T-Zellen in peripherem Blut und Knochenmark aus und werden von γ/δ TCR exprimierenden γ/δ TLymphozyten unterschieden. Bei normaler T-Zell-Entwicklung, kann α/β TCR erst im Stadium der kortikalen Thymozyten nachgewiesen werden. Eine Vielzahl von Studien haben die Nützlichkeit und Verlässlichkeit von anti-TCR mAk für die Klassifizierung von akuten T-Zellen Leukämien (T-ALL) aufgezeigt. Gemäß der EGIL Klassifizierung ist bei T-ALL die Oberflächen-Expression von α/β TCR charakteristisch für den T-ALL IVa Subtyp. Verwendungszweck Der mAk BMA 031 bindet an α/β TCR/CD3 Komplex exprimierende TLymphozyten. Der α/β T-Zell Rezeptor (TCR) ist der spezifische Antigen Rezeptor des Großteils humaner T-Lymphozyten. Er findet sich auf Thymozyten und peripheren T-Zellen, die nicht den γ/δ TCR exprimieren. Dieser α/β TCR mAk erlaubt die Erkennung und Quantifizierung normaler und leukämischer T-Zell Populationen in biologischen Proben (Blut, Knochenmark u.a.) mittels Durchflusszytometrie. Die Resultate müssen in Zusammenhang mit anderen diagnostischen Tests, ebenso wie mit dem klinischen Krankheitsverlauf des Patienten gesehen werden. Das gesamte Procedere muss von einer dazu bevollmächtigten, ausgebildeten und adäquat geschulten Fachkraft durchgeführt werden. Alle Analysen, die mit diesem mAk durchgeführt werden, müssen parallel von positiven und negativen Kontrollen begleitet werden. Sollten dennoch unerwartete Ergebnisse erzielt werden, welche nicht auf modifizierte Arbeitsschritte zurück zu führen sind, kontaktieren Sie uns bitte umgehend! Spezifität Der Antikörper BMA 031 reagiert mit einer konstanten Determinante, welche auf der Oberfläche von allen α/β TCR exprimierenden T-Lymphozyten vorkommt. Lagerung Monoklonale Antikörper-Reagenzien von AN DER GRUB enthalten optimale Konzentration von affinitätschromatographisch gereinigten Antikörpern. Aus Gründen der Haltbarkeit enthält diese monoklonale-Antikörper-Lösung Natriumazid. Diese Reagenzien sollen bei Temperaturen zwischen 2 und 8 °C gelagert werden (NICHT EINFRIEREN) und vor direkter Sonneneinstrahlung geschützt werden. Die Haltbarkeit des Reagens entnehmen Sie bitte der Aufschrift auf der Verpackung. Von der Verwendung des Reagens nach Ablauf des Haltbarkeitsdatums wird dringend abgeraten. Proben Biologische Proben müssen unter sterilen Bedingungen entnommen werden. Antikoagulation mit EDTA oder Heparin wird empfohlen. Die Proben sollten bis zu ihrer Verwendung bei Raumtemperatur gelagert werden. Für optimale Resultate empfehlen wir, die Proben innerhalb von 24 Stunden zu bearbeiten und auszuwerten. Proben mit einer großen Zahl an nicht lebensfähigen Zellen können zu fehlerhaften Ergebnissen führen. Die Feststellung der Lebensfähigkeit der Zellen mit z.B. Propidiumjodid kann hierbei notwendig sein. Alle biologischen Proben müssen mit Vorsicht behandelt und gehandhabt werden – und immer als potentiell infektiös angesehen werden. Verwenden Sie entsprechende Vorsichtsmaßnahmen wie Handschuhe, Laborkleidung, etc. Färbeprotokoll Direkte Immunfluoreszenz ADG’s Fluorochrom markierte Antikörper sind für die Verwendung von Vollblut oder isolierten mononukleären Zellen (MNC) optimiert. Empfohlene Kurzanleitung für Färbung mit Vollblut: - Für jede Probe 50µl antikoaguliertes EDTA Vollblut in ein 3-5ml Röhrchen geben - 20µl des gewünschten AN DER GRUB monoklonalen Antikörperkonjugats hinzufügen - Inkubation im Röhrchen für 15 Minuten bei 4°C oder bei Raumtemperatur, lichtgeschützt - Pro Röhrchen werden 100µl ADG Lyse (Kat.Nr. GAS-003) zugefügt und für 10 Minuten bei Raumtemperatur inkubiert - Zusatz von 3-4 ml destilliertem Wasser, sofort schütteln, Inkubation für 5-10 Minuten bei Raumtemperatur - Zenrifugation für 5 Minuten bei 300g - Überstand entfernen und Zellen in 0,3 ml „sheath-fluid“ resuspendieren - Entweder sofortige Analyse oder Aufbewahrung der Probe bei 2-8°C und Analyse innerhalb von 24 Stunden Für „No-Wash“ Methode siehe www.andergrub.com Empfohlenes Färbeverfahren für MNC: - Vorsichtig 20µl Antikörper-Konjugat und 50-100µl MNC in ein geeignetes Röhrchen geben - Mit langsamer Geschwindigkeit 1-2 Sekunden vortexen - 15-30 Minuten bei 2-8°C oder Raumtemperatur lichtgeschützt inkubieren - Die Röhrchen für 5 Minuten bei 300g zentrifugieren - Den Überstand entfernen, die Zellen in 2-5ml PBS resuspendieren und neuerlich für 5 Minuten bei 300g zentrifugieren - Den Überstand entfernen, die Zellen in „sheath fluid“ für die unmittelbar anschließende Analyse resuspendieren. Alternativ, Herstellung: AN DER GRUB Bio Research GmbH • Austria • www.andergrub.com Vertrieb und Beratung: dianova GmbH • D-20148 Hamburg • Tel. 040-450670 • [email protected] • www.dianova.de Zellen in 0.5ml 1% Formaldehyd resuspendieren und bei 2-8°C, lichtgeschützt lagern. Die fixierten Zellen innerhalb von 24 Stunden analysieren. Hinweise und Vorsichtsmaßnahmen Sensivität Die Sensitivität des monoklonalen Antikörpers α/β TCR wird durch Färbungen definierter Blutproben repräsentativer Spender bestimmt. Mittels schrittweiser Verdünnungen wird eine Titrationskurve erstellt, die es erlaubt die Ak-Konzentration in Relation zum Prozentsatz gefärbter Zellen sowie geometrischer MFI (mittlere Fluoreszenz-Intensität) zu sehen. Für diesen Zweck wird eine Antikörper-Konzentration gewählt, welche sowohl den Sättigungspunkt (d.h. die notwendige Antikörperkonzentration, um alle Epitopen der Ziel-Zelle zu binden) als auch den Schwellenwert (d.h. die niedrigste Antikörperkonzentration, welche zur Erkennung eines identen Prozentsatzes von Zellen notwenig ist). In der Praxis werden 50µl Leukozyten (107 Zellen/ml beinhaltend) mit 20µl verschiedener AntikörperVerdünnungen inkubiert und zur Ermittlung einer Titrationskurve sowie zur Identifizierung des Sättigungspunktes und des Schwellenwertes analysiert. Die Endkonzentration des Produktes wird so adjustiert, dass sie zumindest 3fach über dem ermittelten Schwellenwert liegt. Zudem wird, auch um Lot-zu-Lot Schwankungen zu kontrollieren, der aktuelle Lot mit definierten Fluoreszenz-Standards verglichen und angepasst. Nur für professionellen Gebrauch! Dieses Produkt enthält Natriumazid. Zur Vermeidung von Gefahren sollen Azid-hältige Reagenzien vor der Entsorgung unter laufendem Wasser verdünnt werden. Wie auch bei der Arbeit mit anderen biologischen Produkten werden entsprechend angemessene Arbeitsverfahren empfohlen. Garantie Eine Garantie für dieses Produkt besteht nur für die zum Zeitpunkt der Auslieferung an den Kunden auf dem Etikett angegebenen Mengenund Inhaltsangaben. Eine über die Beschreibung auf dem Verpackungsetikett hinausgehende Garantie besteht nicht, weder ausdrücklich noch impliziert. ADG verpflichtet sich lediglich zum Ersatz des Produktes oder zur Refundierung des Kaufpreises. ADG haftet nicht für Sachschäden, Personenschäden oder wirtschaftliche Schäden bzw. Verluste, die durch dieses Produkt verursacht wurden. Ausgewählte Referenzen Sämtliche Arbeitsschritte und Tätigkeiten mit Durchflusszytometrie sollten ausschließlich von qualifiziertem Fachpersonal durchgeführt werden. Ungenaue und unsachgemäße Einstellungen am Durchflusszytometer, ungenaue Kompensation von Fluoreszenz, als auch die unkorrekte Positionierung von Gates können zu falschen Resultaten führen. Die ausreichende Lysierung roter Blutkörperchen kann aus verschiedenen Gründen nicht möglich sein. In solchen Fällen wird geraten, mononukleäre Zellen vor dem Färben mittels Dichtegradient zu isolieren. Die Resultate sind solange korrekt und reproduzierbar, als die angewendeten Prozeduren den technischen Empfehlungen und der befolgten guten Labor-Praxis entsprechen. Dieser Antikörper liegt in einer Konzentration vor, die es ermöglicht spezifische Zellen eindeutig zu erkennen. Es wird daher sehr empfohlen, sich an das Färbeprotokoll bezüglich der Konzentrationen und Mengenangaben zu halten. Der therapeutische Gebrauch von Antikörpern kann die Erkennung von ZielAntigenen durch diesen Antikörper beeinflussen. Das Reaktionsmuster von α/β TCR alleine ist nicht ausreichend, um ‚Leukämie’ zu diagnostizieren. Die Kombination mit anderen Antikörpern in Multi-Color Färbungen wird stark empfohlen. Das Färbeverhalten dieses monoklonalen Antikörpers wurde unter Verwendung von EDTA antikoaguliertem peripherem Blut ermittelt. Bene, M. C., Castoldi, G., Knapp, W., Ludwig, W. D., Matutes, E., Orfao, A. & van't Veer, M. B. (1995) Leukemia 9, 1783-6. Borst, J., van Dongen, J. J., de Vries, E., Comans-Bitter, W. M., van Tol, M. J., Vossen, J. M. & Kurrle, R. (1990) Hum Immunol 29, 175-88. Davodeau, F., Peyrat, M. A., Romagne, F., Necker, A., Hallet, M. M., Vie, H. & Bonneville, M. (1995) J Exp Med 181, 1391-8. Janssen, O., Wesselborg, S., Heckl-Ostreicher, B., Pechhold, K., Bender, A., Schondelmaier, S., Moldenhauer, G. & Kabelitz, D. (1991) J Immunol 146, 35-9. Kabelitz, D., Bender, A., Schondelmaier, S., da Silva Lobo, M. L. & Janssen, O. (1990) J Immunol 145, 2827-32. Knight, R. J., Kurrle, R., McClain, J., Racenberg, J., Baghdahsarian, V., Kerman, R., Lewis, R., van Buren, C. T. & Kahan, B. D. (1994) Transplantation 57, 1581-8. Miossec, C., Faure, F., Ferradini, L., Roman-Roman, S., Jitsukawa, S., Ferrini, S., Moretta, A., Triebel, F. & Hercend, T. (1990) J Exp Med 171, 1171-88. Nashan, B., Wonigeit, K., Schwinzer, R., Schlitt, H. J., Kurrle, R. & Pichlmayr, R. (1987) Transplant Proc 19, 4270-2. Peyrat, M. A., Davodeau, F., Houde, I., Romagne, F., Necker, A., Leget, C., Cervoni, J. P., Cerf-Bensussan, N., Vie, H., Bonneville, M. & et al. (1995) J Immunol 155, 3060-7. Schwinzer, R., Schlitt, H. J. & Wonigeit, K. (1992) Cell Immunol 140, 3141. Thibault, G. & Bardos, P. (1995) J Immunol 154, 3814-20. IVD Nur für geschultes Fachpersonal Grenzen des Verfahrens Explanation of symbols/ REF Catalog number/ IVD In vitro diagnostic medical device/ Consult instructions for use/ 2˚-8˚ Temperature limitation/ Erläuterung der Symbole Bestellnummer In-Vitro-Diagnostikum Gebrauchsanweisung beachten Zulässiger Temperaturbereich Keep away from sunlight/ Batch code/ Use by/ Lichtgeschützt lagern Chargenbezeichnung Verwendbar bis Contains sufficient for (N) Tests/ Manufacturer/ Enthält (N) Tests Hersteller LOT Herstellung: AN DER GRUB Bio Research GmbH • Austria • www.andergrub.com Vertrieb und Beratung: dianova GmbH • D-20148 Hamburg • Tel. 040-450670 • [email protected] • www.dianova.de