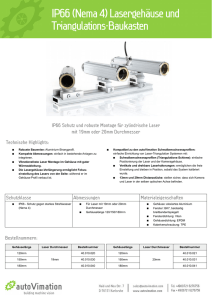
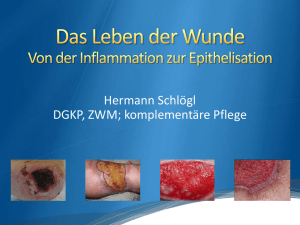
Optische Identifikation von Tumorgewebe unter dem Einfluss der
Werbung

Optische Identifikation von Tumorgewebe unter dem Einfluss der Laserablation: Grundlagenstudie für die Etablierung einer gewebespezifisch gesteuerten Tumorerkennung und Lasertumorresektion im Kopf-Hals-Bereich der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg zur Erlangung des Doktorgrades Dr. med. dent. Vorgelegt von Andreas Amann aus Nürnberg Als Dissertation genehmigt von der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg Tag der mündlichen Prüfung: 15. Juli 2014 Vorsitzender des Promotionsorgans: Prof. Dr. Dr. h.c. J. Schüttler Gutachter: Priv.-Doz. Dr. Dr. F. Stelzle Prof. Dr. Dr. E. Nkenke Meinen lieben Eltern gewidmet Inhaltsverzeichnis 1 2 3 Zusammenfassung ................................................................. 1 1.1 Hintergrund und Ziele ................................................................ 1 1.2 Methoden ................................................................................... 1 1.3 Ergebnisse und Beobachtungen ............................................... 2 1.4 Praktische Schlussfolgerungen ................................................. 2 Summary ................................................................................ 3 2.1 Background................................................................................ 3 2.2 Methods ..................................................................................... 3 2.3 Results ....................................................................................... 4 2.4 Practical Conclusions ................................................................ 4 Einleitung ................................................................................ 5 3.1 Epidemiologie ............................................................................ 5 3.2 Konventionelle Diagnostik und Behandlungsmethoden ............ 6 3.3 Lasertherapie ............................................................................. 7 4 Ziele ........................................................................................ 9 5 State of the Art ...................................................................... 10 5.1 5.1.1 Licht-Biogewebe-Wechselwirkungen: Autofluoreszenz ............ 10 5.1.2 Autofluoreszenzbasierte Differenzierung von pathologischem Gewebe .................................................................................... 11 5.2 6 Optische Gewebedifferenzierung ............................................ 10 Laser ........................................................................................ 14 5.2.1 Vorteile des Lasers................................................................... 16 5.2.2 Nachteile des Lasers ................................................................ 17 5.2.3 Gewebeveränderungen durch die Ablation .............................. 18 Material und Methode ........................................................... 20 6.1 Gewebe ................................................................................... 20 6.2 Versuchsaufbau ....................................................................... 22 6.2.1 Setup Laser .............................................................................. 22 6.2.2 Setup Lichtfaser ....................................................................... 23 6.2.3 Anregung und Detektion ........................................................... 26 6.3 6.3.1 Festlegung der Messpunkte ..................................................... 27 6.3.2 Rote Messpunkte ..................................................................... 29 6.3.3 Blaue Messpunkte .................................................................... 29 6.3.4 Datenerhebung ........................................................................ 30 6.4 7 8 9 Versuchsdurchführung ............................................................ 27 Statistik .................................................................................... 38 Ergebnisse............................................................................ 40 7.1 Histopathologische Auswertung .............................................. 40 7.2 Autofluoreszenz vor Laserablation .......................................... 42 7.3 Autofluoreszenz nach Laserablation ....................................... 46 7.4 Vergleich vor und nach Laserablation ..................................... 50 Diskussion ............................................................................ 51 8.1 Diskussion der Ergebnisse ...................................................... 51 8.2 Schlussfolgerung ..................................................................... 59 Literaturverzeichnis ............................................................... 60 10 Abkürzungsverzeichnis ......................................................... 67 11 Danksagung ......................................................................... 68 12 Lebenslauf………………………………………………………..69 1 1 Zusammenfassung 1.1 Hintergrund und Ziele Plattenepithelkarzinome stellen mehr als 90% der bösartigen Neoplasien der Mundhöhle dar. Bei der Therapie dieser Tumoren mit einem Laser wird dieser meist handgesteuert, der Operateur muss sich dabei auf visuelle Eindrücke sowie auf seine Erfahrung verlassen. Mit optischen Analyseverfahren zur Gewebedifferenzierung könnte ein objektiver und zuverlässiger Feedbackmechanismus geschaffen werden, der den Laser während der Ablation präzise steuert. Es ist bislang jedoch unklar, ob Tumorgewebe auch dann noch differenziert werden kann, wenn sich dessen optische Eigenschaften durch die Laserablation verändern. Ziel dieser Studie ist es, die optische Identifikation von Tumorgewebe unter dem Einfluss der Laserablation zu untersuchen. 1.2 Methoden Die Versuche wurden an oraler plattenepithelialer gesunder Schleimhaut (im Randbereich des Tumorresektates) und an oralen Plattenepithelkarzinomen durchgeführt. Das Gewebe stammte von 12 Resektaten, welche von der Mund-, Kiefer- und Gesichtschirurgischen Klinik des Universitätsklinikums Erlangen im Zuge einer Tumoroperation entfernt wurden. An jedem Resektat wurden Autofluoreszenzdaten an nicht mit dem Laser abladiertem und an abladiertem Gewebe erhoben. Es wurden 4 Messpunkte in tumorfreier epithelialer und 4 Messpunkte in maligner epithelialer Schleimhaut gewählt. Jeweils 2 der 4 Punkte wurden vor der Laserablation und die anderen 2 nach der Ablation gemessen. Das Ausmaß der Laserablation sowie Malignität und Dignität der Messpunkte wurden histopathologisch überprüft. Die histopathologische Auswertung gilt hierbei als Goldstandard bei der Beurteilung der Gewebeeigenschaften. Für die Ablation wurde ein Er:YAG-Laser (2,94 µm, Glissando) mit einer Energie von 500 mJ, einer Frequenz von 10 Hz, einer Pulsdauer von 350 µs und einer Pulszahl von 30 Pulsen verwendet. Das Gewebe wurde durch eine Lichtquelle (200 Watt Hg) zur Autofluoreszenz angeregt, die Daten wurden mit einem Spektrometer (QE 65000, 2 200–950 nm) detektiert. Die Weiterleitung des Lichts erfolgte mit einem Lichtfasersystem (QR600-7-SR125BX, 200–1100 nm). Die detektierten Autofluoreszenzspektren wurden mit einer principal component analysis (PCA), gefolgt von einer linear discriminant analysis (LDA) analysiert und differenziert. Um die Differenzierbarkeit des Gewebes darzustellen, wurden die area under the curve (AUC), die Spezifität und die Sensitivität berechnet. 1.3 Ergebnisse und Beobachtungen An nicht abladiertem Gewebe konnte gesunde Schleimhaut von Plattenepithelkarzinomen mit einem Klassifikationsfehler von 23%, einer AUC von 0.82, einer Sensitivität von 76% und einer Spezifität von 78% unterschieden werden. Bei den mit dem Laser abladierten Messpunkten war diese Differenzierung mit einem Klassifikationsfehler von 13%, einer AUC von 0.92, einer Sensitivität von 84% und einer Spezifität von 90% möglich. 1.4 Praktische Schlussfolgerungen Auch nach der Laserablation, die Veränderungen am Gewebe verursacht, kann mit der Autofluoreszenzspektroskopie gesunde epitheliale Schleimhaut von oralen Plattenepithelkarzinomen differenziert werden. Die vorgelegte Arbeit legt die Grundlage für die optische Identifikation von Plattenepithelkarzinomen auch nach der Laserablation und für einen optischen Feedbackmechanismus zur Lasersteuerung. Weitere Untersuchungen müssen durchgeführt werden, um zu überprüfen, wie diese Ergebnisse von ex vivo nach in vivo übertragen werden können. 3 2 Summary 2.1 Background More than 90 % of oral neoplasia turn out to be oral squamous cell carcinomas. If these tumors are medicated with a laser, which is usually controlled manually, the surgeon must rely on visual impressions as well as on his experience. Optical analysis methods could provide an objective and reliable feedback mechanism, which controls the laser precisely during ablation. So far, however, it has been unclear whether tumor tissue can still be differentiated when changing its optical features by laser ablation. The aim of this study is to examine the optical identification of tumor tissue under the influence of laser ablation. 2.2 Methods The experiments were performed on oral squamous healthy mucosa (in the border area of the resected tumor) and on oral squamous cell carcinomas. The tissue originated from 12 resections that were removed by the Clinic of Oral and Maxillofacial Surgery of the University Hospital Erlangen in the course of tumor surgery. At each tissue resected, autofluorescence data were taken from both not ablated and with an Er:YAG-laser ablated tissue. 4 measuring points in tumor-free epithelial mucosa and 4 measuring points in malignant epithelial mucosa were chosen. Of these 4 points 2 were measured before and the other 2 after ablation. The degree of laser ablation as well as malignancy and dignity of the measuring points were examined histopathologically. The histopathological evaluation is the gold standard in the assessment of tissue properties. For ablation, an Er:YAG laser (2.94 µm, Glissando) was used with an energy of 500 mJ, a frequency of 10 Hz, a pulse duration of 350 µs and a pulse rate of 30 pulses. The tissue was excited by a light source (200 watt Hg) for autofluorescence, the data was detected with a spectrometer (QE 65000, 200-950 nm). The forwarding of the light was performed with a light fiber system (7-QR600 SR125BX, 200-1100 nm). The detected autofluorescence spectra were analyzed and differentiated with 4 a principal component analysis (PCA) followed by a linear discriminant analysis (LDA). To show the differentiability of the tissue, the area under the curve (AUC), specificity and sensitivity were calculated. 2.3 Results At non-ablated tissue, healthy mucosa could be distinguished from squamous cell carcinoma with a classification error of 23%, an AUC of 0.82, a sensitivity of 76% and a specificity of 78%. At the laser ablated measuring points this differentiation was possible with a classification error of 13%, an AUC of 0.92, a sensitivity of 84% and a specificity of 90%. 2.4 Practical Conclusions Even after laser ablation, which causes changes in the tissue, healthy epithelial mucosa can be differentiated from oral squamous cell carcinoma with autofluorescence spectroscopy. The work presented here set the base for the optical identification of squamous cell carcinomas even after laser ablation and for an optical feedback mechanism to control the laser. Further research has to be done to prove how these results can be transferred from ex vivo to in vivo. 5 3 Einleitung 3.1 Epidemiologie Bösartige Tumoren gehören zu den häufigsten Todesursachen weltweit. 2008 gab es 12,7 Millionen Neuerkrankungen und mehr als 7,6 Millionen Todesfälle [28]. Die wachsende Zahl der Weltbevölkerung, eine höhere Lebenserwartung sowie der erhöhte Konsum kanzerogener Stoffe werden als Gründe für eine steigende Zahl der Neuerkrankungen angegeben [48]. Oropharyngeale Tumoren gehören zu den häufigsten Tumoren überhaupt, sie stellen die sechsthäufigste bösartige Neoplasie dar. Mehr als 90 % der bösartigen Neoplasien der Mundhöhle sind Plattenepithelkarzinome [4, 50]. Die 5-Jahres-Überlebensrate der Plattenepithelkarzinome liegt bei 40 bis 50%, wobei sich die Prognose bei zunehmendem Tumorstadium deutlich verschlechtert [43, 51]. Plattenepithelkarzinome können verschiedene Entstehungsursachen haben. So können Papillomviren zu oralen Plattenepithelkarzinomen führen, ebenso gilt ein jahrelanger Tabak- und Alkoholkonsum als Entstehungsursache [33, 70]. In 11% bis 67% der Fälle entstehen Tumoren der Mundhöhle aus Präkanzerosen [93]. Diese Präkanzerosen treten häufig als Leukoplakie und Erythroplakie auf. Das potentielle Entartungsrisiko dieser prämalignen Veränderungen beläuft sich auf 10% bis 90% [95, 105]. Früherkennung und eine schnelle Therapieeinleitung führen zu einer besseren Heilungschance und zu einer signifikant höheren Lebensqualität der Patienten [43]. Nur 22% der Tumoren befinden sich bei Erstvorstellung im T1-Stadium, der Großteil oraler Plattenepithelkarzinome wird erst in einem späteren Stadium erkannt (T2 bis T4) [42]. Durch die Diagnose in einem späten Stadium werden meist große operative Eingriffe mit einem ausgedehnten Gewebsverlust nötig. Die Metastasierung erfolgt meist lymphogen in die regionären Lymphknoten, die 5-Jahres-Überlebensrate ist bei Lymphknotenmetastasen signifikant niedriger [115]. 6 3.2 Konventionelle Diagnostik und Behandlungsmethoden Nach aktuellen Behandlungsrichtlinien gilt die klinische Kontrolle der Mundhöhle als das Mittel der Wahl zur Früherkennung oraler pathologischer Veränderungen [41, 84]. Bei verdächtigen Schleimhautveränderungen wird zunächst eine Anamnese erhoben. Danach sollten mögliche auslösende Faktoren der Veränderung minimiert oder ausgeschaltet werden. Nach zwei Wochen wird eine erneute Kontrolle der verdächtigen Veränderung vorgenommen. Als behandlungsnotwendig gelten diejenigen Läsionen, die nach zwei Wochen keine Rückbildungstendenz zeigen und sich keiner anderen Grunderkrankung zuordnen lassen [23]. Besteht ein klinischer Verdacht oder ist nach zwei Wochen keine Rückbildungstendenz zu erkennen, sind weitere Schritte anzugehen, zentral sind hier die Biopsie sowie bildgebende Verfahren [58]. Das Tumorstaging erfolgt nach histologischer Sicherung, wenn ein Karzinom nachgewiesen wurde. Nachdem ein Plattenepithelkarzinom diagnostiziert und die notwendigen Voruntersuchungen inklusive Staging abgeschlossen wurden, erfolgt die Therapie. Die Therapie kann aus einer reinen chirurgischen Behandlung, einer alleinigen Strahlentherapie, einer Kombination von Strahlen- und Chemotherapie oder aus der Kombination von chirurgischer, Strahlen- und Chemotherapie bestehen (abhängig von Tumorgröße und –lokalisation, Allgemeinzustand, funktionellen und ästhetischen Konsequenzen, Behandlungserfolg). Bei der operativen Therapie wird eine R0 Resektion (tumorfreie Resektionsränder) angestrebt, die intraoperativ mit der Schnellschnittdiagnostik verifiziert werden kann. Eine verfehlte R0 Resektion verschlechtert die Prognose signifikant, deshalb kann eine Nachresektion nötig sein. Selbst bei klinisch unauffälligem Halsbefund besteht das Risiko einer okkulten Metastasierung. Deshalb wird die elektive Halslymphknotenausräumung generell empfohlen [58]. Das genaue Ausmaß der Ausräumung der Lymphknoten (Neck Dissection) richtet sich nach Lage und Größe der Tumoren. Die vollständige Exzision des Tumors ist das wesentliche Ziel der kurativen Tumortherapie. Ohne weitere Hilfsmittel wie der Schnellschnittdiagnostik ist meist nicht klar, ob die Resektionsränder tumorfrei sind, dies beeinflusst aber wesentlich die Rezidiv- und Überlebensrate des Patienten [116]. Der Opera- 7 teur weiß durch die präoperative Diagnostik, wie sich die ungefähre Tumorausdehnung darstellt, jedoch muss er sich während der Operation auf seine Erfahrung und andere, zeitaufwändige diagnostische Verfahren wie die Schnellschnittdiagnostik verlassen, um sicher zu gehen, dass er den Tumor komplett entfernt hat. Diese Verfahren sind zeitintensiv, der aufwändige Prozess der histologischen Aufbereitung zur Klassifikation der Malignität gilt aber als Goldstandard [27]. Insbesondere dann, wenn die Schnellschnittdiagnostik ergibt, dass sich noch Tumorgewebe im Operationssitus befindet, ist eine Verlängerung der Operationszeit zu erwarten. Es muss dann das restliche pathologische Gewebe entfernt und anschließend das Procedere der Schnellschnittdiagnostik wiederholt werden. 3.3 Lasertherapie Laser werden bei pathologischen Veränderungen der Mundschleimhaut zum einen bei der Entfernung gutartiger Veränderungen wie Fibrome, Lipome, Papillome oder bei prämalignen Veränderungen wie Leukoplakien oder Lichen angewendet [108]. Es konnte gezeigt werden, dass nach der Behandlung oraler Leukoplakien mit einem Laser in 89% der Fälle keine Rezidive auftraten [110]. Zum anderen werden Laser bei der Resektion kleiner, intraepithelialer Tumoren angewendet [49, 50]. Hierbei wird der Laser vor allem als ein oberflächlich abtragendes Instrument eingesetzt, das durch visuelle Kontrolle des Chirurgen gesteuert wird. In allen medizinischen Fachbereichen wird die Laserablation meist mit der menschlichen Hand gesteuert [96]. Bei Karzinomen, die in tiefere Gewebeschichten reichen, kann die Lasertherapie aufgrund des fehlenden visuellen und taktilen Zugangs durch den Chirurgen zu iatrogenen Schäden an gesundem Gewebe führen. Die laserchirurgische Behandlung hat sich deshalb bisher nur für die oberflächliche Entfernung von Tumoren klinisch durchgesetzt, weil nur dabei der Laserabtrag durch visuelle Kontrolle des Operateurs durchgeführt werden kann [40, 110, 114]. 8 Wenn der Laser auch bei in tiefere Gewebeschichten reichende Tumoren angewendet werden soll, sollte die Laserablation unabhängig von der visuellen und taktilen Kontrolle des Chirurgen gesteuert werden können. In der Industrie werden Laser im Gegensatz zur Medizin meist computer- oder robotergestützt eingesetzt [66, 79, 90]. Es gibt nunmehr in der Medizin erste Ansätze zur computergestützten Laserablation, mit der eine objektive und sichere Kontrolle der Ablation gewährleistet werden soll [5, 11]. 9 4 Ziele Bei der konventionellen Tumorresektion mit einem Skalpell wird durch die Einhaltung eines Sicherabstandes, die intraoperative Schnellschnitt- diagnostik sowie die postoperative histologische Aufarbeitung des Gewebes eine vollständige Entfernung des malignen Gewebes angestrebt. Wenn der Laser in der Tumorchirurgie als Alternative zu einem Skalpell als universell einsetzbares Instrument angewendet werden soll, sollte ein Feedbacksystem geschaffen werden, mit dem der Laser tumorspezifisch gesteuert werden kann. Mit diesem System sollte nicht nur oberflächlich, sondern auch in tieferen, nicht einsehbaren Gewebeschichten noch vorhandenes Tumorgewebe identifiziert werden können. So könnte die Laserablation gesteuert und dann gestoppt werden, wenn das Tumorgewebe komplett entfernt wurde. Als Feedbacksystem zur Identifikation von pathologischem Gewebe können Voraussetzung ist, berührungslose, dass optische pathologisches Analyseverfahren Gewebe auch dienen. nach der Laserablation mit diesen optischen Analyseverfahren identifiziert werden kann. Dann kann der Laser in Verbindung mit optischen Messmethoden berührungslos und tumorspezifisch Gewebe abladieren. Ziel der ex vivo Studie an humanen oralen Geweberesektaten war es deshalb, gegenüber die Differenzierbarkeit von oralem pathologischem Epithel oralem gesundem Epithel unter dem Einfluss einer Er:YAG- Laserablation mit optischen Messmethoden zu untersuchen. Als optisches Analyseverfahren wurde die Autofluoreszenzspektroskopie gewählt. 10 5 State of the Art 5.1 Optische Gewebedifferenzierung 5.1.1 Licht-Biogewebe-Wechselwirkungen: Autofluoreszenz Die Anwendung der Autofluoreszenz in der Medizin als diagnostisches Hilfsmittel gehört zu den spektroskopischen Analyseverfahren. Mit Licht bestrahlte Atome und Moleküle werden in einen Zustand höherer Energie versetzt. Beim Übergang vom Zustand höherer Energie zurück in den Grundzustand wird die zuvor aufgenommene Energie in Form von elektromagnetischer Strahlung frei. Fluorophore sind solche Atome und Moleküle, die zuerst Energie aufnehmen, um diese dann in Form von elektromagnetischer Strahlung wieder freizusetzen. Fluorophore des Gewebes sind NADH, Tryptophan oder Porphyrine [47]. Jene Eigenschaften können bei der Untersuchung von Gewebe mit Autofluoreszenz genutzt werden. Die Eigenschaften der frei werdenden elektromagnetischen Strahlungen sind gewebespezifisch. Durch Detektion und Darstellung der verschiedenen Wellenlängen mittels Spektrometer können Rückschlüsse auf das bestrahlte Gewebe gezogen werden. Die Fluoreszenzspektren ändern sich, wenn sich die Konzentration der Fluorophore ändert. Darüber hinaus kommt es zu Intensitäts- und Formänderungen abhängig vom Zellmetabolismus, der Epitheldicke oder der bakteriellen Besiedelung [70, 94]. Die Absorptionseigenschaften des eingestrahlten Lichts sind abhängig vom Oxy- und Desoxyhämoglobingehalt [76]. Tumorzellen haben einen erhöhten Zellmetabolismus, der zu einer Veränderung des NADH und NAD+ Gehaltes führt. Der Nachweis vermehrter NADH-Bildung mit Autofluoreszenz kann als Nachweis eines erhöhten Zellstoffwechsels dienen und Rückschlüsse auf malignes Gewebe geben [14, 26, 80]. Das Mononukleotid Flavin ist ein Koenzym bei der aeroben Glykolyse und fluoresziert stark, wenn es durch blaues Licht angeregt wird. Bei bösartig verändertem Gewebe läuft die Glykolyse meist anaerob ab, somit kann die verstärkte Fluoreszenz ein Hinweis auf malignes Gewebe sein [27]. Pathologische Pro- 11 zesse führen zu veränderten optischen Eigenschaften des Gewebes durch Veränderungen der Epitheldicke und/oder des Kollagengehaltes [80]. Außerdem können maligne Transformationen und ein damit einhergehender vergrößerter Zellkern zu einer verstärkten Streuung des eingestrahlten Lichts führen [16, 18]. Zum Beispiel kann das eingestrahlte Licht bei einer Hyperkeratose die stark fluoreszendierende Kollagenschicht weniger stark zur Autofluoreszenz anregen, da die über der Kollagenschicht liegende verbreiterte Epithelschicht einen großen Teil der ausgesandten Strahlung absorbiert [21]. Studien zeigten, dass verschiedene Fluorophore wie Porphyrine in Tumorgewebe vermehrt vorkommen, vermehrtes Fluorophorvorkommen kann damit Hinweise auf malignes Gewebe geben [45, 117]. Autofluoreszenz ist also ein optisches Analyseverfahren, mit dem Rückschlüsse auf malignes Gewebe gezogen werden können. Das Verfahren ist schmerzfrei für den Patienten, kostengünstig und berührungslos, was zu einer verbesserten Hygiene beiträgt. Es ist in seiner Wiederholbarkeit kaum beschränkt, gesundheitliche Risiken sind nicht zu erwarten. Insgesamt ist das Verfahren schnell und einfach durchzuführen, auch eine klinische Anwendung im Sinne einer Mundhöhlenkontrolle mit Autofluoreszenzverfahren ist technisch umsetzbar [106]. 5.1.2 Autofluoreszenzbasierte Differenzierung von pathologischem Gewebe Die Früherkennung von prämalignem und malignem Gewebe ist sehr bedeutend, da die Heilungschance erhöht, die Invasivität des Eingriffs verringert und die Lebensqualität für den Patienten verbessert werden können [43, 44]. Bei der Therapie maligner Veränderungen gewährleistet eine vollständige Entfernung des Tumors beste Heilungschancen für den Patienten [83]. Grundsätzlich besteht die Gefahr der Feldkanzerisierung, was der Forderung nach einer vollständigen Tumorentfernung zusätzlichen Ausdruck verleiht [43, 120]. In einer Arbeit von Yang et al. wurde das Gewebe zur Autofluoreszenz durch einen Xenon Laser bei einer Wellenlänge von 365 nm angeregt. Die ex vivo Studie an humanem resiziertem Gewebe umfasste über 50 Resektate, darunter Magen, Zunge, Unterkiefer und Speiseröhre. Im Gegensatz zu peripherem Tumorgewebe konnten bei Gewebe im Tumorzentrum wegen 12 der zunehmenden Zellnekrose keine für Epithel gewebespezifischen Autofluoreszenzpeaks festgestellt werden. Dennoch konnten in malignem Gewebe zwei charakteristische Peaks bei 630 und 690 nm der detektierten Autofluoreszenzdaten gefunden werden. Diese Peaks entstehen laut Yang et al. nicht durch die Tumorzellen selbst, sondern durch Porphyrine, die beim Zerfall von Hämoglobin entstehen. Diese Porphyrine lagern sich in Tumorgewebe an und können als Nachweis von malignem Gewebe dienen. Mit dieser Methode konnte eine Übereinstimmung der Tumordifferenzierung von 89% mit der traditionellen Biopsie erreicht werden [117]. In einer Studie von Gillenwater et al. wurde Licht mit den Wellenlängen von 337, 365 und 410 nm zur Autofluoreszenzanregung ausgesendet. Eine Lichtfaser bestrahlte das orale Gewebe mit Licht und detektierte gleichzeitig die Autofluoreszenzspektren. Die in vivo Studie wurde an 8 gesunden Patienten durchgeführt und an 15 Patienten, die unter einer prämalignen Veränderung oder einem Plattenepithelkarzinom litten. Die Intensität der Autofluoreszenzspektren war bei gesundem Gewebe höher als bei bösartig verändertem. Die beste Differenzierung zwischen gesundem Gewebe und Plattenepithelkarzinomen gelang bei den Anregungswellenlängen von 337 und 410 nm. Bei 337 nm konnte eine Sensitivität von 88% und eine Spezifität von 100% erreicht werden [31]. In einer in vivo Studie mit 70 gesunden Patienten und 155 Patienten mit gutoder bösartigen Veränderungen, von denen 16 Läsionen Plattenepithelkarzinome waren, erfolgte die Anregung zur Autofluoreszenz über eine Xenonlampe bei den Wellenlängen 365, 385, 405, 420, 435 und 450 nm. Die Weiterleitung des Anregungslichts und die Detektion der Spektren erfolgte über eine Lichtfaser. Die Unterscheidung von Tumor und gesundem Gewebe gelang mit einer Sensitivität von 94% und einer Spezifität von 94%. Die Wellenlänge des eingestrahlten Lichts veränderte die Ergebnisse nicht signifikant [20]. Tabelle 1 zeigt weitere Methoden und Ergebnisse, mit denen gesundes orales Gewebe von malignen Veränderungen durch die Autofluoreszenzspektroskopie differenziert werden kann. 13 Autor und Wellenlänge ex vivo/ Läsio- Jahr Anregung in vivo nen Coghlan, L. 350-370 nm In vivo 31 et al. (2000) 400- 450 nm Tiere [17] Methode Ergebnis Auswertung Sens. 90 % einer Fluores- Spez. 90 % zenzAnregungsEmissionsMatrix Kolli, V. R. 200- 430 nm et al. (1995) In vivo 19 Mensch [55] Auswertung des Sign. Un- Wellenlängen- terschied verhältnisses von Emission und Anregung Inaguma, 410 nm M. et al. In vivo 121 Mensch (1999) Auswertung Porphyrinty- porphyrin- pische Fluo- typischer Peaks reszenz bei [45] 85% der Tumoren und 3% des gesunden Gewebes Schantz, 290- 415 nm S.P. et al. In vivo 35 Mensch Maximum der Maximum Anregung geringer bei (1998) Verlust der [92] Tumordifferenzierung Betz, C. S. 375- 440 nm et al. (1999) In vivo 36 Mensch [7] Messen der Geringere Intensität bei Intensität der 511 nm Spektren bei Tumoren Onizawa, K. et al. (1996) [73] 360 nm In vivo Mensch 32 Aufnahme der Sens. 88% Autofluoreszenz Spez. 94 % mit einer Kamera Tabelle 1: Differenzierung von oralen Tumoren und gesundem Gewebe mit der berührungslosen Autofluoreszenzspektroskopie 14 In einer Arbeit von Roblyer et al. konnte bei einer Anregungswellenlänge von 405 nm mit einer Sensitivität von 100% und einer Spezifität von 91% orale gesunde Schleimhaut von einer Dysplasie beziehungsweise einem invasiven Tumor differenziert werden. Die in vivo Studie mit 67 Patienten beschreibt die Möglichkeit, mit der Autofluoreszenzspektroskopie eine „optische Landkarte“ des Gewebes zu entwerfen. Damit konnte präoperativ die Lokalisation und Ausdehnung der Gewebeveränderung dargestellt werden [88]. Die Übertragung dieser Technik - der optischen Differenzierung von physiologischem und pathologischem Gewebe - von der präoperativen in eine intraoperative Diagnostik wurde bislang nicht ausreichend wissenschaftlich untersucht. 5.2 Laser Moderne Laser basieren auf dem System einer selektiven Photothermolyse. Hierbei werden Laser mit einer Wellenlänge und einer bestimmten Pulsdauer eingesetzt, die spezifisch von sogenannten Zielmolekülen absorbiert werden. Diese Zielmoleküle heißen Chromophore und können zum Beispiel Melanin, Hämoglobin oder Wasser sein. Bei Lasern, deren ausgesandte Wellenlängen weniger spezifisch für Chromophore sind, also nicht so spezifisch für bestimmte Gewebearten, kommt es häufiger zu Schäden an umliegendem Gewebe [1, 71]. Der Er:YAG-Laser hat eine Wellenlänge von 2.94 µm. Diese Wellenlänge entspricht fast dem Absorptionsmaximum von Wasser (3 µm), der Absorptionskoeffizient für die Wellenlänge des Er:YAG-Lasers von Wasser beträgt ca. 10.000/cm [36]. Wasser ist der Chromophor, der in biologischem Gewebe am häufigsten vorkommt, der Wassergehalt bestimmt maßgeblich die optischen und thermischen Eigenschaften des Gewebes [36, 113]. Die Energie des Lasers wird sehr gut und schnell von Wasser, das sich im beschossenen Gewebe befindet, aufgenommen [25]. Die Temperatur steigt dabei sehr schnell an, bis das Wasser kocht. Es kommt zu einer Mikroexplosion im beschossenen Gewebe, da der Dampfdruck durch das Kochen des Wassers 15 schlagartig ansteigt [9, 82]. In Folge dessen lösen sich kleine Mikropartikel aus dem Gewebe. Mit einem Er:YAG-Laser können ausreichende Ablationsraten pro Puls erreicht werden (über 400 µm für Weichgewebe und 90 µm für Hartgewebe), die ein schnelles chirurgisches Schneiden gewährleisten [112]. Bei diesem Vorgang wird fast die gesamte Laserenergie in Wärme umgewandelt, die dann das Wasser zum Kochen bringt. Die Energie wird nur selektiv von dem direkt beschossenen Gewebe aufgenommen, dadurch kommt es im umliegenden Gewebe kaum zu thermischen Schäden mit einem sehr kleinen Nekrosebereich. Dieser Nekrosebereich kann auf maximal 50 µm um die Ablationsstelle herum beschränkt werden [39]. Dies führt zu einer schnellen Wundheilung von Hart- und Weichgewebe mit nur geringem Risiko einer Narbenbildung [52, 72, 119]. Studien zeigen, dass bei der Laserablation der Wundheilungsprozess der Haut durch die entstehende Wärme sogar positiv beeinflusst werden kann [13]. In einer Arbeit von Pourzarandian et al. konnte sieben Tage nach der Ablation mit einem Er:YAG-Laser an abladiertem Knochengewebe eine zellreiche Granulationsschicht mit Fibroblasten und Osteoblasten festgestellt werden, 14 Tage nach Ablation war eine signifikant höhere Knochenneubildung zu sehen als nach der Ablation mit einem CO2-Laser oder nach rein mechanischem Bohren [81]. Des Weiteren können durch die Ablation mit einem Er:YAG-Laser sehr präzise Schnitte sowohl für Hart- als auch für Weichgewebe durchgeführt werden [46, 56]. Obwohl Studien gezeigt haben, dass die Koagulation auch in tieferen Bereichen unter der Epidermis-DermisGrenze durch die Ablation mit einem Er:YAG-Laser leicht unterstützt werden kann, gilt der fehlende blutstillende Effekt als Nachteil des Er:YAG-Lasers [63]. Trotzdem kann der Er:YAG-Laser als Alternative zu kaltschneidenden Methoden bei minimaler mechanischer und thermischer Belastung fungieren [29]. Aufgrund seiner kurzen Pulsdauer kann mit dem Er:YAG- Laser zuverlässig und ohne große Nekroserisiken Knochen geschnitten werden [11, 85]. 16 5.2.1 Vorteile des Lasers Das Standardwerkzeug zum Entfernen eines Tumors ist das Skalpell. Jedoch bietet das Schneiden mit einem Skalpell einige Nachteile. Zum einen kann die Sicht für den Operateur auf das Operationsgebiet durch das Skalpell verschlechtert oder unmöglich gemacht werden. Zum anderen kann es durch eine mechanische Irritation des Gewebes dazu kommen, dass Tumorzellen in andere Gewebeschichten verteilt werden [62]. Eine alternative Methode zum Skalpell bietet die chirurgische Laserablation von Tumorgewebe. Mit dieser Methode können vor allem oberflächliche Behandlungen von oralem pathologischem Gewebe durchgeführt werden [50, 108]. Tierexperimentelle Studien zeigten, dass der therapeutische Effekt bei Anwendung eines Lasers größer ist als beim Schneiden mit einem Skalpell. Die laseroperierten Tiere hatten sowohl eine längere Überlebensrate als auch längere Intervalle ohne Rezidive [62, 109]. Die Behandlung mit einem Laser hat weitere Vorteile gegenüber dem Schneiden mit einem Skalpell. Die Laserablation ist berührungslos und es kommt nicht zur Kompression von Gewebe in der unmittelbaren Umgebung zur Schnittstelle. Darüber hinaus lassen sich durch einen Laser grazilere Schnitte durchführen, was gerade im Bereich des Kopfes ein wesentlicher Vorteil ist. Durch berührungsloses Arbeiten wird die Hygiene verbessert. Der Operateur hat eine bessere Übersicht über die Operationsstelle, da im Moment des Schneidens kein Skalpell die Sicht auf die Schnittstelle verschlechtert [107]. Ein weiterer Vorteil der Laserchirurgie ist die flexible Schnittgeometrie, die es auch erlaubt, schwer zugängliche Bereiche zu erreichen [11, 102]. Deswegen werden Laser auch in der endoskopischen Chirurgie eingesetzt [97]. Außerdem konnte gezeigt werden, dass die Überlebenswahrscheinlichkeit verbliebener Tumorzellen in dem Gewebe, das vorher mit einem Laser abladiert wurde, sehr gering ist [74]. 17 5.2.2 Nachteile des Lasers Trotz der vielen Vorteile der Laserchirurgie gibt es einen wesentlichen Nachteil. Beim Schneiden mit einem Skalpell kann der Operateur sehr gut abschätzen, in welchem Gewebe er sich befindet, da er direkt mit seiner Hand am Skalpell schneidet und beispielsweise merkt, wenn er auf Knochen trifft. Bei der Laserchirurgie schneidet der Lichtstrahl berührungsfrei, das heißt, dem Operateur fällt es schwer, den Laserabtrag genau zu steuern. Der Operateur kann nur bei oberflächlicher Anwendung des Lasers durch direkte visuelle Kontrolle des Ablationsfeldes beurteilen, in welchem Gewebe der Laser gerade schneidet. Die Anwendung von Lasern in der Medizin hat sich daher momentan nur bei der Behandlung von oberflächlichen Gewebeschichten klinisch durchgesetzt. So werden zum Beispiel die Hornhaut und Netzhaut des Auges [57], die respiratorische Schleimhaut [54], die parodontale Schleimhaut und Zähne [22, 30, 60, 89], die äußere Haut [12, 68] und kleinere oberflächliche Tumoren [40, 110, 114] mit einem Laser behandelt. Soll das Schneiden mit einem Skalpell durch das mit einem Laser ersetzt werden, sollte auch in tieferen Gewebeschichten abladiert werden. Der Operateur hat dann keine visuelle Kontrolle, in welchen Gewebeschichten gerade mit dem Laser geschnitten wird [56, 102]. Dies kann zu ungewollten Schäden an tieferen gesunden Gewebeschichten führen [78]. Insbesondere im Kopfund Halsbereich befinden sich viele anatomische Strukturen wie Nerven und Blutgefäße, die sehr nahe nebeneinander liegen und geschont werden müssen [109]. Werden diese Strukturen zerstört, kann es zu motorischen, ästhetischen und sensorischen Einschränkungen sowie zu Einschränkungen der Sensibilität kommen [6, 67, 75]. Bei der Behandlung von Tumoren mit einem Laser muss sich der Operateur auf seine Erfahrung, die visuellen Eindrücke während der Operation und auf die präoperativ diagnostizierte Tumorausdehnung verlassen, um den gesamten Tumor zu entfernen. Nach der Laserablation ist es nicht immer möglich, die Tumorfreiheit durch eine histopathologische Untersuchung zu überprüfen, da das Gewebe karbonisiert ist. Somit fehlen objektive Kriterien zur Sicherstellung, dass das pathologische Gewebe komplett entfernt wurde. Die voll- 18 ständige Exzision des Tumors ist aber, wie bereits erläutert, ein wesentlicher Aspekt in der kurativen Tumortherapie. Nur dadurch werden beste Heilungschancen für den Patienten gewährleistet [83]. 5.2.3 Gewebeveränderungen durch die Ablation Durch die Ablation kommt es zu Veränderungen am Gewebe. Diese Veränderungen sind histologisch feststellbar. Autor und Jahr Gewebeveränderung nach Laserablation Chen, B. et al. (2008) Nekrose der epidermalen Zellen, intravaskuläre [15] Thrombosen, perivaskuläre Entzündung, Ödeme in Blutgefäßen Rico, P. J. et al. (2000) Pyknose, Verlust der Zellstruktur, Koagulations- [87] nekrose Zaffe, D. et al. (2004) Bläschen, Erosionen, Ödeme [119] D'Arcangelo, C. et al. Wundheilung verzögert, Kollagendenaturierung (2007) [19] Luomanen, M. (1987) Entzündungszellen, verzögerte Revaskularisie- [61] rung Tabelle 2: Gewebeveränderungen nach Laserablation Vaporisation, Karbonisation und Koagulation sind Vorgänge, die während der Laserablation am Gewebe stattfinden. In einer Studie von McKenzie et al. konnten nach der Laserablation diese drei Zonen beobachetet werden: Karbonisations-, Vakuolisierungs- und Koagulationszone [65]. Die Veränderungen des Gewebes durch eine Laserablation sind nicht nur histologisch feststellbar, sondern es ändern sich auch die optischen Eigenschaften des beschossenen Gewebes. So können bei hohen Energiedosen wegen der Karbonisationszone die Absorptionsquote des eingestrahlten Lichts erhöht und das optische Spektrum geschwächt werden. Dagegen kann es bei geringer 19 Koagulation des Gewebes zu einer Erhöhung der Reflexionsrate des eingestrahlten Lichts kommen [118]. Die Vakuolisierungszone besteht aus Blasen und Aufwölbungen, die durch das kochende Wasser bei der Laserablation entstehen. Die Koagulationszone entsteht durch die Koagulation von Proteinen. Durch die entstehende Koagulation von Blutgefäßen entsteht ein hämostatischer Effekt [34]. Die daraus resultierende Veränderung der Gewebedurchblutung kann auch zu einer Veränderung der optischen Eigenschaften des Gewebes führen, da die Absorptionsquote wesentlich vom Oxy- und Desoxyhämoglobingehalt des Gewebes abhängt [76]. Die genannten Veränderungen sind auch an pathologischem Gewebe zu erkennen [21, 88]. 20 6 Material und Methode 6.1 Gewebe Die Versuche wurden ex vivo an Resektaten von Plattenepithelkarzinomen der Mundhöhle durchgeführt. Das für die Versuche benötigte Gewebe stammte von Patienten der Mund-, Kiefer- und Gesichtschirurgischen Abteilung des Universitätsklinikums Erlangen, alle Patienten befanden sich zur Behandlung eines oralen, primär aufgetretenen Plattenepithelkarzinoms in stationärer Behandlung und wurden einer Operation unterzogen. Als für die Studie geeignet galten alle erstmals aufgetretenen oralen Plattenepithelkarzinome (also keine Rezidive oder Nachresektionen), die operativ entfernt werden mussten. Außerdem musste auf dem Resektat genug Platz sein, um alle Messungen mit ausreichendem Abstand voneinander (mindestens 5mm) durchzuführen. Tabelle 3 zeigt die Häufigkeitsverteilung der TNM-Klassifikation des Patientenguts, während Tabelle 4 die Lokalisation der Resektate zeigt. Die Patientenkohorte bestand aus zehn männlichen und zwei weiblichen Patienten, das Durchschnittsalter lag bei 61,8 Jahren. TNM T N M Klassifikation Anzahl 1 4 2 3 3 3 4 2 0 8 1 0 2 4 0 5 1 7 Tabelle 3: TNM-Klassifikation des Patientenguts 21 Lokalisation Anzahl Unterkiefer 4 Mundboden 4 Zunge 2 Wange 1 retromolar 1 Tabelle 4: Lokalisation der Resektate Alle Patienten, die als potentielle Teilnehmer an der Studie galten, wurden vor der Operation über die Teilnahme aufgeklärt. Das Resektat wurde nach dessen konventioneller Resektion durch einen Mund-Kiefer- Gesichtschirurgen des Universitätsklinikums Erlangen zunächst nicht in Formalin, sondern in isotoner Kochsalzlösung (NaCl 0.9%, 100ml, B.Braun Melsungen AG) in einer Plastikbox bei konstant 22 Grad Celsius gelagert. Der Zeitrahmen zwischen der Resektion des Tumors und dessen Abholung für die Versuchsdurchführung betrug maximal 30 Minuten. Die Versuche wurden immer am Operationstag mit einer gesamten ex vivo Zeit von maximal 3 Stunden bei 22 Grad Celsius durchgeführt. Die Studie wurde durch die Ethik-Kommission der Friedrich-AlexanderUniversität Erlangen-Nürnberg genehmigt (Antragsnummer: 245-12 B). 22 Abbildung 1: Resektat nach Abholung in der OP-Abteilung. Fadenmarkierungen wurden vom Chirurgen angebracht 6.2 Versuchsaufbau 6.2.1 Setup Laser Für die Laserablation wurde ein Er:YAG-Laser (2,94 µm, Glissando, WaveLight TM, Germany) mit einer Energie von 500 mJ (3.97 J/cm²/Puls), einer Frequenz von 10 Hz und einer Pulsdauer von 350 µs verwendet. Die Pulszahl betrug 30 Pulse, die Pause zwischen den Pulsen 110 µs. Während der Laserablation wurde das Gewebe durch ein Spraysystem mit Kochsalzlösung (NaCl 0.9%, 100ml, B.Braun Melsungen AG) gekühlt. Die Temperatur der Kühlflüssigkeit betrug 22 Grad Celsius. In einer 10 Resektate umfassenden Vorversuchsreihe wurde die für die Studie verwendete Laserenergie evaluiert. An den 10 Gewebsresektaten wurde jeweils gesundes epitheliales Ge- 23 webe sowie malignes epitheliales Gewebe mit verschiedenen Laserenergien beschossen. Nach der histopathologischen Auswertung der Messpunkte bezüglich der Ablationstiefe und –breite wurde die Laserenergie auf 500 mJ festgelegt. 6.2.2 Setup Lichtfaser Für die Weiterleitung des Lichts wurde ein Lichtfasersystem (QR600-7SR125BX, 200–1100 nm; Ocean Optics W, Dunedin, Florida, USA) benutzt. Dieses System bestand aus insgesamt drei Fasern, die y- förmig angeordnet waren. Eine Faser endete an der Lichtquelle (Abbildung 2, a) und bestand aus sechs einzelnen Fasern. Die an der Lichtquelle endende Faser diente dazu, das durch die Lichtquelle ausgesandte Licht an das Gewebe weiterzuleiten. Die zweite Faser endete am Spektrometer (Abbildung 2, b) und bestand aus einer zentralen Faser, die dazu diente, das durch das Gewebe emittierte Licht aufzunehmen und an das Spektrometer weiterzuleiten. Die dritte Faser (Anregungs- und Aufnahmefaser), die in Abbildung 2 als c markiert ist, endete direkt am Gewebe (Abbildung 2, d) und diente einerseits zur Bestrahlung des Gewebes mit dem Licht aus der Lichtquelle und andererseits zum Detektieren des durch das Gewebe emittierten Lichts. Diese dritte Faser war die Messsonde und hatte insgesamt sieben Fasern - die sechs Fasern der Lichtquelle (Anregungsfasern) und die zentrale Faser (Aufnahmefaser) für das Spektrometer. 24 Abbildung 2: Lichtfasersystem Der optimale Abstand der Messsonde zum Ablationsspot wurde während der 10 Resektate umfassenden Vorversuchsreihe evaluiert. Zunächst wurde der Abstand auf 15 mm festgelegt. Es zeigte sich dabei, dass der Lichtkegel, den die Messsonde auf den Ablationsspot warf, größer war als der abladierte Spot selbst. So musste davon ausgegangen werden, dass nicht nur das abladierte Gewebe durch das ausgesandte Licht zur Autofluoreszenz angeregt wurde, sondern ebenfalls das umliegende Gewebe, das zwar durch den Lichtkegel bestrahlt, jedoch vorher nicht abladiert wurde. Dadurch wurden nicht nur die optischen Eigenschaften des abladierten Gewebes detektiert, sondern auch die des nicht abladierten. 25 Abbildung 3: optische Messung direkt am Ablationsort mit 15 mm Messabstand a) Spektrometer c) Reflection/backscattering probe b) Lichtquelle d) Gewebe Der Abstand der Messsonde zur Gewebeoberfläche wurde auf 5 mm reduziert. Damit konnte sichergestellt werden, dass ausschließlich das durch den Laser abladierte Gewebe zur Autofluoreszenz angeregt wurde und auch nur die optischen Eigenschaften des vorher mit dem Laser abladierten Gewebes detektiert wurden. 26 Abbildung 4: Ausbreitung des Lichtkegels bei einem Messsonde-Gewebe-Abstand von 5 mm 6.2.3 Anregung und Detektion Das Gewebe wurde durch eine Lichtquelle (Mercury, Newport 200 Watt Hg; Oriel Apex Fiber Illuminator; Oriel Instruments, Stratford, Connecticut, USA) mit einem Filter bei 377 nm (Bandpassfilter 377 ± 50 nm, Edmund Optics, Karlsruhe, Deutschland) zur Autofluoreszenz angeregt. Die Weiterleitung des Lichts erfolgte mit dem in Kapitel 6.2.2. erläuterten Lichtfasersystem. Das vom Gewebe zurückgestrahlte Licht wurde mit einem Spektrometer detektiert (QE 65000, 200–950 nm; Ocean OpticsW, Dunedin, Florida, USA). Mit dem Programm Spectra Suite wurden die Daten graphisch am Computer dargestellt, es wurden 30 Messungen pro Messpunkt mit einer Integrationszeit von 50 ms durchgeführt. Um die Messergebnisse nicht durch eine zu hohe Tageslichteinstrahlung zu beeinflussen, wurde der Messraum verdunkelt. Jedoch wurden die Versuche nicht in kompletter Dunkelheit durchgeführt, da dies praxisferne Operationsbedingungen wären. 27 Abbildung 5: Setup für die Versuchsdurchführung 6.3 Versuchsdurchführung 6.3.1 Festlegung der Messpunkte Das Gewebe wurde zunächst vorsichtig gereinigt. Dies geschah durch Abtupfen mit einem in isotoner Kochsalzlösung (NaCl 0.9%, 100ml, B.Braun Melsungen AG) getränkten Wattestäbchen. Insgesamt wurden 8 Messpunkte festgelegt: 4 in der als tumorfrei klassifizierten Schleimhaut (im Bereich der gesunden Schleimhaut, die als Sicherheitsabstand bei der Resektion des Tumors mit entfernt wurde) und 4 Messpunkte in der als Plattenepithelkarzinom klassifizierten Schleimhaut. Die Festlegung der Messpunkte auf dem Resektat erfolgte visuell und mit der Erfahrung eines Facharztes für Mund-, Kiefer- und Gesichtschirurgie. Die anschließende histopathologische Auswertung durch das Pathologische Institut des Universitätsklinikums Erlangen 28 überprüfte, ob die Klassifikation vor den Versuchen (als Tumor beziehungsweise als gesunde Schleimhaut) dem tatsächlichen Sachverhalt entsprach. Der Abstand zwischen den einzelnen Messpunkten betrug immer mindestens 5 mm. Dadurch wurde vermieden, dass ein Teil des Gewebes durch den Laser mehrfach beschossen wurde, außerdem konnte das Pathologische Institut dadurch die Messpunkte eindeutig voneinander unterscheiden, was eine sichere Aussage über die Malignität der untersuchten Schleimhautareale ermöglichte. Abbildung 6: Schematische Darstellung der Verteilung der Messpunkte Die insgesamt 8 Messpunkte wurden mit einer Nadel, an der ein Plastikfähnchen angebracht war, markiert. Es wurden je 2 Messpunkte im Tumor und im tumorfreien Resektionsrand mit an Nadeln befestigten roten Plastikfähnchen markiert, außerdem je 2 Messpunkte im Tumor und im tumorfreien Resektionsrand mit an Nadeln befestigten blauen Plastikfähnchen. 29 6.3.2 Rote Messpunkte Die rot markierten Messpunkte wurden zuerst mit dem Laser abladiert, anschließend wurden die optischen Eigenschaften des abladierten Epithels erhoben. Eine Datenerhebung vor der Laserablation fand an diesen Messpunkten nicht statt. 6.3.3 Blaue Messpunkte Bei den blau markierten Messpunkten wurden die Autofluoreszenzdaten erhoben und es wurde keine Laserablation durchgeführt. Da die Messpunkte nicht abladiert wurden, konnte die Histopathologie diese Messpunkte genau in dem Zustand auswerten, in dem die Punkte auch gemessen wurden. Hätte an diesen Punkten anschließend an die Datenerhebung eine Laserablation stattgefunden, so hätte histologisch nicht mehr der Zustand des Gewebes vor der Laserablation erfasst werden können. Folglich hätte nicht sicher nachgewiesen werden können, ob die Autofluoreszenzdaten vor Laserablation tatsächlich im tumorfreien Gewebe beziehungsweise im Tumor aufgenommen wurden und ob tatsächlich Epithel gemessen wurde. Durch Einkerbungen in den Plastikfähnchen bei den roten und bei den blauen Messpunkten konnte außerdem erkannt werden, ob sich der Messpunkt in der als Tumor beziehungsweise in der als tumorfrei klassifizierten Schleimhaut befand. Die Nadelmarkierungen zeigten also zwei Parameter auf: ob es sich bei dem markierten Punkt um als Tumor oder als gesunde Schleimhaut klassifiertes Gewebe handelte und ob eine Laserablation stattfand oder nicht. Die Nadelmarkierungen wurden jeweils vor der Messung und der Ablation des Messpunktes entfernt und anschließend wieder angebracht. 30 6.3.4 Datenerhebung Zunächst wurden die Daten für Autofluoreszenz vor der Laserablation aufgenommen. Hierzu wurden alle 4 blau markierten Messpunkte gemessen. Nachdem das Instrumentarium für die Versuche, wie bereits in Kapitel 6.2. beschrieben, aufgebaut war, wurde das Gewebe so platziert, dass die Oberfläche des zu messenden Areals senkrecht zur Messsonde stand. Der Abstand der Messsonde zur Oberfläche des Gewebes betrug 5mm. Anschließend wurden 30 Messungen für jeden der 4 blau markierten Messpunkte gemacht. Damit waren die Daten vor der Laserablation erhoben und es wurden keine weiteren Untersuchungen an den blau markierten Messpunkten durchgeführt. Abbildung 7: optische Messung vor Ablation a) Spektrometer c) Reflection/backscattering probe b) Lichtquelle d) Gewebe 31 Abbildung 8: Messung der Autofluoreszenzdaten vor Laserablation Anschließend wurde an allen 4 rot markierten Schleimhautarealen eine Laserablation durchgeführt. Für die Ablation wurde ein Er:YAG-Laser mit den bereits beschriebenen Einstellungen verwendet. Das Resektat wurde so platziert, dass seine Oberfläche senkrecht zum Laserstrahl ausgerichtet war. Der Abstand des Lasers zur Oberfläche des Gewebes betrug 4,5 cm. Die Schleimhaut wurde mit 30 Laserpulsen unter Spraywasserkühlung (NaCl 0.9%, 100ml, B. Braun Melsungen AG) bei 22 Grad Celsius abladiert. Nach der Ablation jedes Messpunktes wurde die Linse des Lasers sorgfältig mit Isopropanol (teslanol IP-Isopropanol, wentronic-Electronic Components Handels GmbH, Braunschweig) gereinigt, um eine Kontamination der Linse mit Gewebe des Präparates und eine damit einhergehende Leistungseinschränkung des Lasers zu verhindern. 32 Abbildung 9: Gewebeablation a) Laser d) Gewebe Danach wurden an den 4 abladierten Messpunkten die Daten zur Autofluoreszenz nach der Laserablation erhoben. Dies geschah in gleicher Weise und mit den gleichen Messinstrumenten wie bei der Datenerhebung der blau markierten Punkte. 33 Abbildung 10: optische Messung direkt am Ablationsort nach Laserablation a) Spektrometer c) Reflection/backscattering probe b) Lichtquelle d) Gewebe Der Tumor wurde danach in Formalin (Formaldehydlösung 4%, Otto Fischbar GmbH & Co. KG, Saarbrücken) gelegt und umgehend an die OP-Abteilung zurückgegeben, das Gewebe wurde dann in üblicher Art und Weise an das Pathologische Institut weitergegeben. Um genau zu wissen, ob die im Versuch als Tumor beziehungsweise tumorfreies Gewebe nadelmarkierten Schleimhautareale tatsächlich richtig klassifiziert wurden, untersuchte das Pathologische Institut die markierten Messpunkte hinsichtlich ihrer Malignität. Außerdem wurde das Ausmaß der Laserablation untersucht. Die Tumorresektate wurden formalinfixiert an das Pathologische Institut weitergegeben. Die Aufarbeitung der Präparate hinsichtlich der studienrelevanten Fragestellung erfolgte im Rahmen des Routine-Zuschnitts der 34 Großpräparate. Die Schnittführung wurde nach Sicherung der für die Tumordiagnostik und den R-Status relevanten Gewebsentnahmen an die Lokalisation der gesetzten Nadelmarkierungen angepasst. Hierbei wurde jeweils ein Schnitt entlang der Nadelmarkierung durchgeführt, so dass der Stichkanal zur Darstellung kam. Nach Entfernung der Nadel wurde der Stichkanal mit einem feinen Pinsel tuschemarkiert. Danach erfolgten Gewebeentnahmen unter Einschluss des jeweiligen Stichkanals und deren Einbettung in getrennte Kapseln. Im Anschluss wurden Paraffinblöcke angefertigt und die für die Studie relevanten, gesondert gekennzeichneten Blöcke unter vorsichtigem Anschneiden in mindestens drei Schnittstufen aufgearbeitet, bis der Stichkanal auf dem histologischen Schnittpräparat zur Darstellung kam. Die Präparate wurden mit einem Färbeautomat (ST5010 Autostainer XL, Leica Biosystems Nussloch GmbH) in HE-Färbung gefärbt. Im Rahmen der histopathologischen Begutachtung der jeweiligen Schnittpräparate konnte der jeweilige Messpunkt hinsichtlich seiner Dignität sowie hinsichtlich des Vorhandenseins und der Tiefenausdehnung der Laserablation untersucht werden. Die histologische Begutachtung als Goldstandard bei der Differenzierung von pathologischem Gewebe konnte somit als Qualitätskontrolle fungieren und verhindern, dass bei der Auswertung der Daten einzelne Messpunkte fälschlicherweise als Tumor beziehungsweise tumorfreies Gewebe klassifiziert wurden. Um eine Vergleichbarkeit der Daten zu schaffen, wurde darauf geachtet, dass vor und nach Laserablation die gleiche Gewebeart auf ihre optischen Eigenschaften untersucht wurde. Durch die histopathologische Aufarbeitung wurde also untersucht, ob alle markierten Messpunkte tatsächlich im Epithel - entweder in malignem oder gesundem - lagen und dadurch die optischen Eigenschaften des Epithels gemessen wurden. Des Weiteren konnte an den rot markierten abladierten Messpunkten durch die Histopathologie festgestellt werden, wie viel des Epithels durch die Ablation entfernt wurde und ob die Basallamina noch intakt war. Mit diesem Verfahren wurde sichergestellt, dass auch nach der Laserablation durch die lichtbasierten Analyseverfahren nur die optischen Eigenschaften des epithelialen Gewebes und nicht die des subepithelialen Gewebes aufgenommen wurden. 35 Abbildung 11: Histologischer Schnitt eines Messpunktes in gesunder epithelialer Schleimhaut. Der Stichkanal der Nadelmarkierung und die Tusche zur Markierung des Stichkanals sind deutlich zu erkennen. HE-Färbung 36 Abbildung 12: Histologischer Schnitt eines Messpunktes in maligner epithelialer Schleimhaut. Der Stichkanal der Nadelmarkierung und die Tusche zur Markierung des Stichkanals sind zu erkennen. HE-Färbung Abbildung 13: Präparat nach allen Messungen mit Nadelmarkierungen 37 Abbildung 14: Schematische Darstellung des Versuchsablaufs Laser Er:YAG-Laser 2,94 µm, Glissando, WaveLight TM, Germany Lichtfasersystem QR600-7-SR125BX, 200–1100 nm; Ocean Optics W, Dunedin, Florida, USA Lichtquelle Mercury, Newport 200 Watt Hg, Bandpassfilter 377 ± 50 nm, Edmund Optics, Karlsruhe, Deutschland Spektrometer QE 65000, 200–950 nm; Ocean OpticsW, Dunedin, Florida, USA Tabelle 5: Übersicht Materialien 38 6.4 Statistik Alle aufgenommenen Daten wurden zur Klassifikation in gesunde epitheliale Schleimhaut und maligne epitheliale Schleimhaut einem mathematischen Algorithmus unterzogen. Um die Güte dieses Klassifikationsverfahrens zu testen, wurden die Vorhersagen des Modells mit den tatsächlichen Klassen (Tumor bzw. tumorfrei) verglichen. Es wurde in dieser Studie eine leave-oneout-cross-validation durchgeführt. Dabei wurden die Autofluoreszenzdaten eines Patienten aus dem gesamten Datenpool aller Patienten herausgenommen. Die Daten aller Patienten (ohne den Herausgenommenen) wurden zum Anlernen des Verfahrens benutzt. Danach wurden die Klassen (Tumor oder tumorfrei) der Daten des einen herausgenommenen Patienten mit dem vorher angelernten Verfahren vorhergesagt und mit der tatsächlichen Klasse (aus der histopathologischen Auswertung ersichtlich) verglichen. Dieser Vorgang wurde bei allen Patienten wiederholt. Es wurden also nacheinander die Patienten einzeln aus dem gesamten Datenpool herausgenommen, ein Verfahren angelernt und dann die Klassenzugehörigkeit der Daten des herausgenommenen Patienten vorhergesagt. Durch den Vergleich der Vorhersage mit der histopathologischen Auswertung konnte der Klassifikationsfehler für die Daten jedes Patienten ermittelt werden. Das Verfahren zur Klassifikation der Daten beinhaltete die principal component analysis (PCA) zur Variablenreduktion, da die linear discriminant analysis (LDA) nur mit weniger Variablen umgehen kann. Die Anzahl der principal components (Hauptkomponenten) der beiden Klassen (Tumor und tumorfrei) betrug zwischen 50 und 250. Die Anzahl der Hauptkomponenten wurde für jedes Modell (alle Modelle innerhalb der leave-one-out-cross-validation) extra bestimmt, so dass der Klassifikationsfehler, der mit dem angelernten Verfahren erreicht wurde, minimal war. Die Bestimmung der Anzahl der Hauptkomponenten erfolgte wiederum mit einer leave-one-out-cross-validation, allerdings nur von den Daten, die zum Lernen des Verfahrens benutzt wurden (also ohne den anfangs heraus genommenen Patienten, von dem die Fehlerquoten ermittelt werden sollten). Daraus wurden die Fehler für 50, 100, 150, 200 und 250 principal components berechnet. Es wurde dann die Anzahl der Hauptkomponenten gewählt, die die niedrigste Fehlerquote hatte. 39 Das Ergebnis der LDA zeigte die Wahrscheinlichkeit für die Zugehörigkeit zur Klasse „Tumor“, die Klassifikation erfolgte dann mit einem Cutpoint von 0.5. Für die Erstellung der receiver-operating-characteristics (ROC)-Kurve wurden die Sensitivitäten und Spezifitäten für alle möglichen Cutpoints berechnet. Der optimale Cutpoint liegt dort, wo auch der Youden-Index (Sensitivität+Spezifität-1) maximal ist. Um die Differenzierbarkeit von malignem und gesundem Gewebe vor und nach der Laserablation darzustellen und zu vergleichen, wurden die Sensitivitäten und Spezifitäten sowie die area under the ROC-curve (AUC) berechnet. 40 7 Ergebnisse 7.1 Histopathologische Auswertung Insgesamt wurden 12 Resektate untersucht, bei jedem Resektat gab es 4 blau (keine Laserablation) und 4 rot (Laserablation) markierte Messpunkte. Bei jedem Messpunkt wurden 30 Messungen durchgeführt. Damit umfasste die Versuchsreihe theoretisch 48 blaue Messpunkte mit insgesamt 1440 Messungen und 48 rote Messpunkte mit insgesamt 1440 Messungen. In der histopathologischen Auswertung wurden die markierten Messpunkte auf ihre tatsächliche Malignität untersucht. Des Weiteren konnte die Tiefe der Ablation sowie das Vorhandensein von Plattenepithel an den Messpunkten überprüft werden. Die Auswertung ergab, dass insgesamt 3 blau markierte Messpunkte (keine Laserablation) nicht aus Epithel, sondern aus Weichgewebe bestanden. Die Daten dieser Messpunkte wurden nicht berücksichtigt. Außerdem wurde 1 blau markierter Messpunkt während der Versuchsreihe fälschlicherweise als tumorfreie Schleimhaut klassifiziert. Dieser Messpunkt wurde dann nachträglich als malignes Epithel gewertet und ging als solches in die statistische Auswertung ein. Für die statistische Auswertung wurden insgesamt 45 blau markierte Messpunkte verwendet, bei denen jeweils 30 Messungen durchgeführt wurden. 15 der 1350 Messungen waren fehlerhaft und wurden deshalb nicht in die statistische Auswertung einbezogen, es wurden also 1335 Messungen ausgewertet. Bei den rot markierten Messpunkten ergab die histopathologische Auswertung, dass insgesamt 8 Messpunkte nicht aus Epithel, sondern aus Weichund Granulationsgewebe bestanden. Auch diese Messpunkte wurden statistisch nicht berücksichtigt. Darüber hinaus wurde ein rot markierter Messpunkt während der Versuchsreihe fälschlicherweise als Tumor klassifiziert. Dieser Messpunkt wurde nachträglich als gesundes Epithel gewertet und ging als solcher in die statistische Auswertung ein. Es wurden insgesamt 40 rot markierte Messpunkte in die statistische Auswertung aufgenommen, bei jedem 41 Punkt wurden 30 Messungen durchgeführt. 3 dieser Messungen waren fehlerhaft, es wurden also 1197 Messungen ausgewertet. keine Laserablation-blau Laserablation-rot Schleimhaut 22 21 epithelialer Tumor 23 19 gesamt 45 40 tumorfreie epitheliale Tabelle 6: Übersicht über die Anzahl der ausgewerteten Messpunkte blau: Messung der Autofluoreszenzdaten ohne Laserablation rot: zuerst Laserablation, dann wurden die Autofluoreszenzdaten des abladierten Gewebes gemessen Die Ablation umfasste nahezu die gesamte Breite des Epithels, ohne jedoch das Epithel komplett zu entfernen, die Basallamina war intakt. Der Ablationskrater hatte einen Durchmesser von ca. 4 mm und eine Tiefe von ca. 0,35 mm. Außerdem war der Ablationsspot makroskopisch gut zu erkennen. Es konnte also sichergestellt werden, dass ausreichend viel Gewebe abladiert wurde, um eine Gewebsveränderung zu erreichen und außerdem die Ablationsraten hoch genug waren, um einen in die Praxis umsetzbaren Ablauf zu simulieren. Gleichzeitig war der Laserabtrag nur so groß, dass ein Rest des Epithels auch nach der Ablation noch vorhanden und die Basallamina intakt war. Damit wurden durch die anschließenden optischen Analyseverfahren die optischen Eigenschaften des Epithels und nicht die des subepithelialen Gewebes gemessen. 42 Abbildung 15: Histologische Darstellung des Ablationsspots bei einer Laserenergie von 500 mJ. HE-Färbung 7.2 Autofluoreszenz vor Laserablation Der Klassifikationsfehler zur Unterscheidung zwischen Tumor und tumorfreier Schleimhaut lag vor der Ablation bei 23%. Die Differenzierung der Gewebearten konnte mit einer Sensitivität von 76% und einer Spezifität von 78% durchgeführt werden. Tabelle 7 zeigt die Konfusionsmatrix für die Autofluoreszenz vor Laserablation mit einem standardmäßigen Cutpoint von 0.5. Die Werte der receiver operating characteristics (ROC)-Kurve sind Abbildung 16 zu entnehmen. Hier wurde ein Cutpoint von 0.4835 gewählt. Die area under the curve (AUC) beträgt 0.82. In Abbildung 17 sind beispielhaft drei Spektren der Autofluoreszenz dargestellt. 43 epitheliale gesun- epithelialer Tumor de Schleimhaut (durch Histologie (durch Histologie verifiziert) verifiziert) als epitheliale ge- 506 168 674 139 522 661 645 690 1335 sunde Schleimhaut vorausgesagt als epithelialer Tumor vorausgesagt gesamt Tabelle 7: Konfusionsmatrix vor Laserablation mit Anzahl der Messungen 44 Abbildung 16: ROC vor Laserablation 45 46 Abbildung 17: Spektren der Autofluoreszenz vor Laserablation. Zu sehen sind beispielhaft die Spektren dreier Resektate rot: epithelialer Tumor grün: gesunde epitheliale Schleimhaut 7.3 Autofluoreszenz nach Laserablation Tumor und tumorfreie Schleimhaut konnten nach der Ablation mit einem Klassifikationsfehler von 13% unterschieden werden. Die Sensitivität lag bei 84%, die Spezifität bei 90%. In Tabelle 8 ist die Konfusionsmatrix für die Autofluoreszenz nach Laserablation mit einem standardmäßigen Cutpoint von 0.5 zu sehen. Die Werte der ROC-Kurve mit einem Cutpoint von 0.4835 können aus Abbildung 18 entnommen werden. Die AUC betrug 0.92. Abbildung 19 zeigt beispielhaft drei Spektren der Versuchsreihe nach Laserablation. 47 tatsächlich epithe- tatsächlich epithe- liale gesunde lialer Tumor Schleimhaut (durch Histologie (durch Histologie verifiziert) verifiziert) als epitheliale ge- 564 92 656 66 475 541 630 567 1197 sunde Schleimhaut vorausgesagt als epithelialer Tumor vorausgesagt gesamt Tabelle 8: Konfusionsmatrix nach Laserablation mit Anzahl der Messungen 48 Abbildung 18: ROC nach Laserablation 49 50 Abbildung 19: Spektren der Autofluoreszenz nach Laserablation. Zu sehen sind beispielhaft die Spektren dreier Resektate rot: epithelialer Tumor grün: gesunde epitheliale Schleimhaut 7.4 Vergleich vor und nach Laserablation Beim Vergleich der Ergebnisse vor und nach Laserablation fällt auf, dass die Unterscheidung von malignem und gesundem Gewebe nach der Laserablation besser gelang als davor. Der Klassifikationsfehler war vor der Laserablation um 10 Prozentpunkte höher als danach, die AUC betrug vor der Laserablation 0.82, danach hatte sie einen Wert von 0.92. Die Gewebedifferenzierung konnte vor der Laserablation mit einer Sensitivität von 76% und einer Spezifität von 78% durchgeführt werden, nach der Ablation gelang dies mit einer Sensitivität von 84% und einer Spezifität von 90%. 51 8 Diskussion 8.1 Diskussion der Ergebnisse In der vorliegenden ex vivo Studie wurde die optische Differenzierbarkeit von oralem malignem und oralem gesundem Gewebe vor und nach einer Er:YAG-Laserablation untersucht. Dafür wurden an 12 Resektaten Autofluoreszenzdaten des Gewebes vor und nach der Ablation an ausgewählten Messpunkten aufgenommen und ausgewertet. Durch die histopathologische Untersuchung der Messpunkte konnten die Malignität des Gewebes sowie das Ausmaß der Laserablation festgestellt werden. Mit dem Vergleich der Messdaten vor und nach der Ablation konnten Unterschiede in der Differenzierbarkeit von gesundem und malignem Gewebe durch die Laserablation untersucht werden. Insbesondere wurde der Einfluss der Laserablation auf das optische Spektrum des abladierten Gewebes im Detail betrachtet. Der Einsatz einer fluoreszenzbasierten Gewebedifferenzierung zur Steuerung der Laserablation setzt voraus, dass die Gewebedifferenzierung mit der Fluoreszenzspektroskopie auch nach der Laserablation möglich ist. In der Literatur wird die fluoreszenzbasierte Spektroskopie vorwiegend im Sinne einer präoperativen Methode zur Gewebedifferenzierung von maligner und gesunder Schleimhaut beschrieben (vgl. Tabelle 1). Hierfür ist es nicht nötig, das Gewebe mit einem Laser zu abladieren, das Verfahren ist berührungslos, schnell durchzuführen, nicht gesundheitsgefährdend und potentiell unendlich oft wiederholbar. Diese Studien können ohne Risiken für den Patienten in vivo durchgeführt werden. In vorgelegter Arbeit sollte die Gewebedifferenzierung nach der Laserablation untersucht werden, dies setzt eine Ablation des Gewebes voraus. Ziel war hier zunächst, im Sinne einer ex vivo Grundlagenstudie zu klären, ob optische Analyseverfahren auch für eine Tumoridentifikation unter Laseranwendung verwendet werden können. Damit sollte die Grundlage für eine sensorbasierte tumorspezifische Laserchirurgie erarbeitet werden. Die ex vivo Zeit von maximal 3 Stunden nach der Tumor- 52 resektion unterscheidet sich nicht signifikant von anderen ex vivo Studien zur autofluoreszenzbasierten Spektroskopie [10, 77]. Die Ergebnisse der vorgelegten Arbeit zeigen, dass gesundes von malignem Gewebe vor der Laserablation mit einer Sensitivität von 76% und einer Spezifität von 78% differenziert werden kann. Diese Ergebnisse sind vor dem Hintergrund der verschiedenen Differenzierungskriterien, die in der Literatur angegeben werden, zu diskutieren. Fluoreszenz bei 630 nm wird von Porphyrin hervorgerufen, Peaks im Autofluoreszenzspektrum bei dieser Wellenlänge werden mit der Anreicherung von Porphyrin in Tumorgewebe erklärt und können somit ein Differenzierungskriterium zur Identifikation von malignem Gewebe sein [53, 64]. In einer Studie von Inaguma et al. konnte festgestellt werden, dass bei 85% der Karzinome, die bei einer Wellenlänge von 410 nm angeregt wurden, porphyrin-typische Autofluoreszenzen zu beobachten sind [45]. Die Autofluoreszenzpeaks bei 630 nm sind in der vorgelegten Arbeit nicht bei allen Spektren zu erkennen. Die Entstehung dieser Peaks wird mit der vermehrten Entstehung von Porphyrin durch den Zerfall von Hämoglobin erklärt. Dieser Prozess findet vor allem bei zunehmender Zellnekrose im Tumorzentrum statt. In der vorgelegten Arbeit wurden jedoch vier Messpunkte im Tumor festgelegt, das heißt, nicht alle diese Punkte konnten genau im Tumorzentrum platziert werden. Somit ist davon auszugehen, dass die Zellnekrose an einigen Messpunkten noch nicht in dem Maße wie in der Studie von Yang et al. fortgeschritten war. Die porphyrin-typische Fluoreszenz zur Gewebedifferenzierung wird in einer anderen Studie durch Mikroorganismen, die sich auf nekrotischem Gewebe ansiedeln, beschrieben [73]. Diese in vivo Studie ist jedoch nicht mit der vorgelegten ex vivo Studie vergleichbar, da sich die Zusammensetzung der Oberflächenbestandteile des Gewebes im Zuge der Resektion und anschließenden Lagerung verändert. Die Fluoreszenzspektroskopie zur Unterscheidung von malignem und gesundem Gewebe basiert des Weiteren auf einer Intensitätsabschwächung der aufgenommenen Spektren [37, 53]. In einer Arbeit von Gillenwater et al. konnte bei Betrachtung des gesamten Autofluoreszenzspektrums festgestellt werden, dass die Intensität des Spektrums bei maligne verändertem Gewebe 53 geringer ist als bei gesundem. Zusammen mit dem porphyrin-typischen Peak bei 630 nm als Diskriminierungsparameter konnte so eine Sensitivität von 82% und eine Spezifität von 100% zur Unterscheidung von gut- und bösartigem Gewebe erzielt werden [31]. Auch in einer Studie von Betz et al. wurde eine geringere Intensität der Spektren bei maligne verändertem Gewebe festgestellt [7]. Hauptverantwortlich für diese Intensitätsabschwächung sind die Dickenzunahme des Epithels, vermehrte Streuung des Lichts durch das Epithel, Keratinverlust im Epithel und verstärkte Lichtabsorption durch Hämoglobin (stärkere Durchblutung im Tumorgewebe) [70, 94]. Außerdem kommt es zum Verlust von NADH und FAD. Beide sind wesentliche Fluorophore des Gewebes und fluoreszieren normalerweise stark [47]. Diese Intensitätsunterschiede sind auch in der vorgelegten Arbeit zu erkennen. Alle Spektren weisen im Bereich von 450 - 650 nm Intensitätsunterschiede auf: Die Intensität der Autofluoreszenz ist bei gesunder Schleimhaut höher als bei bösartig veränderter. Somit kann auch in der vorgelegten Arbeit die Intensität der Spektren als Differenzierungskriterium herangezogen werden. Form und Intensität der Autofluoreszenzspektren sind stark von den gewählten Wellenlängen abhängig, mit denen das Gewebe zur Autofluoreszenz angeregt wird [86, 111]. In einer in vivo Studie von Heintzelman et al. wurden die Anregungswellenlängen evaluiert, mit denen die Detektion oraler Neoplasien am besten gelang. Die Ergebnisse dieser Studie zeigten, dass mit den Anregungswellenlängen von 350, 380 und 400 nm die besten Ergebnisse erzielt werden konnten [38]. In anderen Arbeiten, die die Differenzierung oraler Tumoren von gesundem oralem Gewebe mit der berührungslosen Autofluoreszenzspektroskopie untersuchten, wurden ebenfalls vor allem Anregungswellenlängen im Bereich von 300 - 450 nm gewählt (vgl. Tabelle 1). Beim Vergleich dieser Studien ist jedoch keine bestimmte Wellenlänge oder ein engerer Wellenlängenbereich zu erkennen, mit dem die Gewebedifferenzierung signifikant besser gelang als mit anderen Wellenlängen. Diese fehlende Optimierung der Anregungswellenlänge wird als limitierender Faktor zur besseren Gewebedifferenzierung mit der Autofluoreszenzspektroskopie beschrieben [17]. Allerdings konnte in einer Arbeit von de Veld et al. beobachtet werden, dass sich die Ergebnisse zur Differenzierung von gesundem und malignem Gewebe nicht signifikant für unterschiedliche Anregungswel- 54 lenlängen unterscheiden [20]. Hier liefert die Literatur also zum Teil widersprüchliche Ergebnisse, aufschlussreiche Studien zur Optimierung der Anregungswellenlängen fehlen [38]. Es ist jedoch festzuhalten, dass die in der vorgelegten Arbeit gewählte Anregungswellenlänge von 377 nm im gleichen Bereich wie die in anderen Studien liegt. Somit ist vom gleichen Maß der Autofluoreszenzanregung auszugehen wie in vergleichbaren Arbeiten. Orale maligne Schleimhaut konnte von oraler gesunder nach der Laserablation mit einer Sensitivität von 84% und einer Spezifität von 90% differenziert werden. Die Differenzierung gelang nach der Laserablation besser als davor. Durch die Laserablation wurden also die Messergebnisse beeinflusst. Beim Vergleich der Autofluoreszenzdaten zur Gewebedifferenzierung vor und nach Laserablation ist zu beachten, dass es gewisse Störfaktoren gibt, die die Fluoreszenzspektren und damit die Qualität der Differenzierung beeinflussen. Vor der Laserablation wurde darauf geachtet, dass die Oberfläche frei von Verschmutzungen war. Dies konnte jedoch nur visuell überprüft werden, folglich konnten nicht alle Verschmutzungen auf dem Gewebe vor den Messungen sicher entfernt werden. Es kann deshalb davon ausgegangen werden, dass sich vereinzelt Blutrückstände auf dem zu messenden Areal befanden. Die fluoreszierenden Eigenschaften des Gewebes sind abhängig von reflektierenden und absorbierenden Vorgängen des eingestrahlten Lichts. Der Oxy- und Desoxyhämoglobingehalt des lichtbestrahlten Gewebes sind mitentscheidend für die Absorptionseigenschaften des eingestrahlten Lichts [21]. Durch nicht entfernte Blutbestandteile kann das aufgenommene Fluoreszenzspektrum verändert werden, somit ist das Spektrum nicht mehr nur abhängig vom lichtbestrahlten Epithel. Diese Blutbestandteile können sich sowohl auf gesundem als auch auf malignem Gewebe befinden und können dazu führen, dass sich die optischen Spektren der verschiedenen Gewebearten nicht mehr so stark voneinander unterscheiden. Dies kann zu einer Verschlechterung der Diskriminierung von malignem und gesundem Gewebe führen, da die lichtbasierten Messmethoden auf dem Prinzip eines charakteristischen Spektrums für jede Gewebeart beruhen [88]. Durch die Laserablation wurde oberflächlich Gewebe abgetragen (vgl. Abbildung 15). Dadurch wurden auch Blutrückstände auf der Gewebeoberfläche 55 entfernt. Durch die Autofluoreszenzmessungen nach der Laserablation wurden somit nur die optischen Spektren des Gewebes ohne Verschmutzungen aufgenommen. Dies kann zu einer Verbesserung der Gewebedifferenzierung nach Laserablation im Vergleich zur Differenzierung vor der Ablation führen. Ähnliche Beobachtungen konnten in einer anderen Arbeit gemacht werden: Die Laserablation führte dazu, dass mit der Fluoreszenzspektroskopie Fettvon Nervengewebe nach der Ablation besser differenziert werden konnte als davor. Als Grund dafür wird die Entfernung der lipidreichen Schicht um den Nerv durch die Laserablation angegeben. Dadurch unterscheidet sich die Gewebezusammensetzung und somit das optische Spektrum des Fett- und Nervengewebes nach der Laserablation stärker als zuvor [100]. Die Differenzierung von malignem und gesundem Gewebe mit optischen Messmethoden konnte in anderen Studien mit Sensitivitäten und Spezifitäten von jeweils über 0.90 durchgeführt werden [7, 8, 17, 21, 24, 31, 32]. Durch die bereits beschriebenen Verunreinigungen auf der Gewebeoberfläche, die durch die Laserablation entfernt wurden, konnten diese Sensitivitäten und Spezifitäten bei den Autofluoreszenzmessungen vor der Laserablation nur annähernd erreicht werden. Ziel der Studie war es, die Einflüsse der Laserablation auf die optischen Eigenschaften des Gewebes zu untersuchen. Vaporisation, Karbonisation und Koagulation sind Vorgänge, die während der Laserablation am Gewebe stattfinden [65]. Histologisch sind Nekrosen, Bläschen, Kollagendenaturierung und kleine Entzündungen feststellbar [15, 19, 61, 87, 119]. Die optischen Eigenschaften des Gewebes werden durch die Laserablation ebenfalls beeinflusst. Die Absorptionsquote des eingestrahlten Lichts und damit das optische Spektrum kann durch die Karbonisationszone erhöht und das optische Spektrum damit geschwächt werden, dagegen kann es bei geringer Koagulation des Gewebes zu einer Erhöhung der Reflexionsrate des eingestrahlten Lichts kommen [118]. Die Absorptionsquote des eingestrahlten Lichts ist weiterhin vom Oxy- und Desoxyhämoglobingehalt des Gewebes abhängig [76]. Durch die Koagulation von Proteinen kommt es im abladierten Gewebe zu einem hämostatischen Effekt und einer Veränderung der Gewebedurchblutung, was zu veränderten Oxy- und Desoxyhämoglobingehalten führt [34]. Diese genannten Veränderungen sind auch an pathologischem Gewebe zu erkennen [21, 88]. 56 Nach der Laserablation konnten gesunde und maligne Schleimhaut mit einer Sensitivität von 84% und einer Spezifität von 90% unterschieden werden. Diese Ergebnisse zeigen zum einen, dass die Beseitigung der Gewebeverunreinigungen auf der Oberfläche durch den Laser zu einer Verbesserung der Ergebnisse führte. Zum anderen gelang die Unterscheidung von maligner und gesunder Schleimhaut nach der Laserablation mit vergleichbaren Sensitivitäten und Spezifitäten wie in anderen Arbeiten, bei denen die prätherapeutische Identifikation maligner Schleimhaut im Vordergrund stand, folglich keine Laserablation durchgeführt wurde und somit nicht die histologischen und im optischen Spektrum feststellbaren Veränderungen durch die Ablation berücksichtigt wurden [7, 8, 17, 21, 24, 31, 32]. Die Veränderung der optischen Eigenschaften des Gewebes und ihre Auswirkungen auf die optische Malignitätsdiagnostik sind jedoch ein wichtiger Faktor zur Implementierung eines berührungslosen, optischen Feedback-Mechanismus, welcher auf direktem Wege die Laserablation steuern kann. Hierbei ist die Unterscheidung von malignem und gesundem Gewebe elementar, um nicht pathologisch verändertes Gewebe zu schonen und im Operationssitus verbliebenes, malignes Gewebe zu identifizieren und zu entfernen. Die Autofluoreszenzspektroskopie zur Differenzierung von maligner und gesunder Schleimhaut, die in vorgelegter Arbeit mit einer Sensitivität von 84% und einer Spezifität von 90% gelang, kann hier als Grundlage für einen solchen optischen FeedbackMechanismus dienen. In vorgelegter Studie wurde die autofluoreszenzbasierte Gewebe- differenzierung ohne Korrektur durch die Diffuse Reflexion untersucht. Die Fluorophorkonzentration gilt als die wichtigste Gewebeeigenschaft zur optischen Differenzierung des Gewebes. Deswegen wird in der Literatur eine Korrektur der Originaldaten der Fluoreszenzspektroskopie diskutiert, um die Fluoreszenzen der Fluorophore ohne Einflüsse wie Streuung und Absorption von Licht darzustellen (intrinsische Fluoreszenz) [35, 94]. Die einfachste Methode, um das aufgenommene Spektrum von diesen Einflüssen zu bereinigen, ist die Korrektur des Autofluoreszenzspektrums mit den Spektren der Diffusen Reflexion [3, 20, 69]. Wenn jedoch die Fluoreszenzspektroskopie als Feedback-System zur Lasersteuerung eingesetzt werden soll, sollte dieses System im Sinne eines real-time Analyseverfahrens sehr schnell das 57 Gewebe identifizieren können. Die Korrektur des Fluoreszenzspektrums mit der Diffusen Reflexion ist aber zeitintensiv, da zusätzlich zur Autofluoreszenz auch die Daten der Diffusen Reflexion erfasst werden müssen. Die rein autofluoreszenzbasierte Gewebedifferenzierung ohne Korrektur ermöglicht eine schnelle Datenerfassung und erlaubt trotz der fehlenden Korrektur Rückschlüsse auf die Fluorophorzusammensetzung des Gewebes. Außerdem können durch die Detektion der Streuungs- und Absorptionsvorgänge zusätzliche Informationen über das Gewebe erfasst werden [76, 118]. Es wurden bereits erste Ansätze zur computergestützten Lasersteuerung untersucht. Eine Arbeit von Sotsuka et al. beschreibt die Steuerung einer Laser-Osteotomie durch einen Computer. Die Ablation wurde mittels der CAD/CAM-Technologie gesteuert (computer aided design/computer aided manufactoring) [96]. Die computergestützte Lasersteuerung diente hier allerdings vor allem dazu, den Abstand des Lasers vom Knochen konstant zu halten und nicht dazu, verschiedene Gewebearten voneinander zu unterscheiden. Eine andere Möglichkeit des computergesteuerten Lasereinsatzes stellt die präoperative Planung und Festlegung der Ablation auf der Basis bildgebender Verfahren dar. Eine ex vivo Studie von Burgner et al. setzt hier an. Die Ablation wird präoperativ anhand eines CTs geplant und dann autonom robotergestützt anhand der Planung durchgeführt. So konnten Schnitte durchgeführt werden, die maximal 0,5 mm von der präoperativen Planung abwichen [11]. Dieser Ansatz kann aber nicht als ein real-time Analyseverfahren zur intraoperativen Gewebedifferenzierung herangezogen werden, da intraoperativ keine Informationen über das Gewebe gewonnen werden können. Die intraoperative Steuerung der Laserablation konnte in einer anderen Arbeit durch Detektion der thermischen Veränderungen um das abladierte Gewebe erfolgreich durchgeführt werden. Durch Rückkopplung des Detektionssystems mit der Lasersteuerung konnte die Ablation gestartet beziehungsweise gestoppt werden, wenn bestimmte präoperativ festgelegte Kontrollkriterien eintraten [5]. Hier zeigt sich, dass es technisch umsetzbar ist, die Laserablation im real-time Verfahren zu steuern, um auch auf intraoperativ eintretende Gewebsveränderungen reagieren zu können. 58 Erste Studien zur Lasersteuerung mit Hilfe optischer Analyseverfahren gibt es bereits. Es konnte die Differenzierung gesunder Gewebearten nach der Laserablation mit dem optischen Analyseverfahren der Diffusen Reflexion mit einer AUC von 0.97 durchgeführt werden [100]. Andere ex vivo und in vivo Studien zeigen ebenfalls, dass optische Messmethoden als FeedbackMechanismus zur Lasersteuerung dienen können [7, 98, 99, 101]. Allerdings muss berücksichtigt werden, dass nur gesunde Gewebearten untersucht wurden und die Diffuse Reflexion als Analyseverfahren gewählt wurde. In der Neurochirurgie konnte ein Konzept entworfen werden, durch das Gehirntumoren mit einem robotergestützten Lasersystem therapiert werden können. Der Laser wird hier intraoperativ mittels der autofluoreszenzbasierten Identifikation von Tumorgewebe gesteuert [2, 59]. Die Autofluoreszenzspektroskopie basiert in diesen Studien jedoch auf der präoperativen Gabe von 5-Aminolävulinsäure, die das Gewebe zur Autofluoreszenz anregt. Die Identifikation von Tumorgewebe wurde in vorliegender Studie ohne die systematische oder lokale Gabe von Fluoreszenzverstärkern untersucht. Dies garantiert einen einfachen und in der Praxis umsetzbaren Einsatz ohne gesundheitliche Risiken für den Patienten. Die vorliegenden Ergebnisse zeigen, dass ein autofluoreszenzbasiertes Rückkopplungssystem als Grundlage zur Lasersteuerung dienen kann. Jedoch gibt es auch einige Einschränkungen, deren Folgen noch zu untersuchen sind. Für die Versuchsreihe wurde ein Er:YAG-Laser ausgewählt. Die Energie des Lasers wird sehr gut vom Wasser im Gewebe absorbiert, da die Wellenlänge des Lasers (2,94 µm) sehr nahe am Absorptionsmaximum von Wasser (3 µm) liegt [25]. Gleichzeitig wird die Laserenergie nur spezifisch von einem sehr kleinen Teil des Gewebes aufgenommen (vom direkt abladierten Gewebe) und es kann gezielt abladiert werden, ohne das umliegende Gewebe zu schädigen. Der Er:YAG-Laser ist in der Lage, sowohl Hart- als auch Weichgewebe schnell zu abladieren, gleichzeitig gibt es nur geringe thermische Schäden am umliegenden Gewebe [39, 46]. Bei anderen Lasern (Nd:YAG-, Ho:YAG-, lang gepulste CO2-Laser) kommt es zu größeren Karbonisationszonen, da diese Laser Wellenlängen aussenden, die nicht so spezifisch von 59 bestimmten Gewebearten absorbiert werden [112]. Die Veränderung des optischen Spektrums durch eine Er:YAG-Ablation ist deshalb nicht direkt übertragbar auf die Veränderungen, die durch andere Laser ausgelöst werden. Es gibt zwar aufschlussreiche Studien über die Bearbeitung von Gewebe mit verschiedenen Lasern, jedoch wird dort der Laser mit der Hand gesteuert. Es fehlen Methoden, mit denen die Ablation durch einen objektiven Kontrollmechanismus gesteuert werden kann[56, 103, 104]. Bei Betrachtung der Ergebnisse der ex vivo Studie ist zu beachten, dass eine direkte in vivo Übertragung nicht möglich ist. Ex vivo ist der Wassergehalt des Gewebes geringer. Durch die fehlende Blutzirkulation ist der Blutgehalt ebenfalls geringer, was zu einer zunehmenden Deoxygenierung des Hämoglobins führt [76, 91]. Es sind weitere in vivo Studien nötig, um den Einfluss der Blutzirkulation auf das optische Spektrum nach der Laserablation zu untersuchen. Zudem sollte die Datenmenge zum Einfluss der Laserablation auf die optische Gewebedifferenzierbarkeit vergrößert werden, um die Grundlage für eine in vivo Implementierung des Systems zu schaffen. 8.2 Schlussfolgerung Die Ergebnisse nach Laserablation zeigen das Potential der Autofluoreszenzspektroskopie, gesundes von malignem Gewebe auch unter dem Einfluss der Laserablation schnell und zuverlässig zu differenzieren. Die vorgelegte Arbeit kann hier als Grundlage für ein optisches Feedbacksystem dienen, mit dem im real-time Verfahren eine Gewebeidentifikation möglich ist und somit die Laserablation gesteuert werden kann. Damit kann es in der Zukunft gelingen, die Vorteile der Laserablation mit den Vorteilen der optischen Analyseverfahren zu verbinden. Zeitaufwändige Methoden wie die Schnellschnittdiagnostik und die Abhängigkeit des Therapieerfolgs von den Erfahrungen des Chirurgen könnten dann in den Hintergrund treten. Um zu überprüfen, wie die vorgelegten Ergebnisse in eine in vivo Anwendung umgesetzt werden können, sind weitere Untersuchungen notwendig. 60 9 Literaturverzeichnis [1] [2] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] Alster TS, Khoury RR. (2009) Treatment of laser complications. Facial Plast Surg. 25(5):316-323. Ando T, Kobayashi E, Liao H, Maruyama T, Muragaki Y, Iseki H, Kubo O, Sakuma I. (2011) Precise comparison of protoporphyrin IX fluorescence spectra with pathological results for brain tumor tissue identification. Brain Tumor Pathol. 28(1):43-51. Angheloiu GO, Arendt JT, Muller MG, Haka AS, Georgakoudi I, Motz JT, Scepanovic OR, Kuban BD, Myles J, Miller F, Podrez EA, Fitzmaurice M, Kramer JR, Feld MS. (2006) Intrinsic fluorescence and diffuse reflectance spectroscopy identify superficial foam cells in coronary plaques prone to erosion. Arterioscler Thromb Vasc Biol. 26(7):1594-1600. Bagan J, Sarrion G, Jimenez Y. (2010) Oral cancer: clinical features. Oral Oncol. 46(6):414-417. Bar NK, Schulz T, Puccini S, Schirmer T, Kahn T, Busse H. (2003) [MR-guided laserinduced thermo-ablation of liver tumors: clinical experiences and therapy control concepts]. Z Med Phys. 13(3):209-213. Baxter GD, Walsh DM, Allen JM, Lowe AS, Bell AJ. (1994) Effects of low intensity infrared laser irradiation upon conduction in the human median nerve in vivo. Exp Physiol. 79(2):227-234. Betz CS, Mehlmann M, Rick K, Stepp H, Grevers G, Baumgartner R, Leunig A. (1999) Autofluorescence imaging and spectroscopy of normal and malignant mucosa in patients with head and neck cancer. Lasers Surg Med. 25(4):323-334. Betz CS, Stepp H, Janda P, Arbogast S, Grevers G, Baumgartner R, Leunig A. (2002) A comparative study of normal inspection, autofluorescence and 5-ALA-induced PPIX fluorescence for oral cancer diagnosis. Int J Cancer. 97(2):245-252. Bornstein ES. (2003) Why wavelength and delivery systems are the most important factors in using a dental hard-tissue laser: a literature review. Compend Contin Educ Dent. 24(11):837-838, 841, 843, 848. Breslin TM, Xu F, Palmer GM, Zhu C, Gilchrist KW, Ramanujam N. (2004) Autofluorescence and diffuse reflectance properties of malignant and benign breast tissues. Ann Surg Oncol. 11(1):65-70. Burgner J, Muller M, Raczkowsky J, Worn H. (2010) Ex vivo accuracy evaluation for robot assisted laser bone ablation. Int J Med Robot. 6(4):489-500. Burns AJ, Navarro JA. (2009) Role of laser therapy in pediatric patients. Plast Reconstr Surg. 124(1 Suppl):82e-92e. Capon A, Mordon S. (2003) Can thermal lasers promote skin wound healing? Am J Clin Dermatol. 4(1):1-12. Chance B, Thorell B. (1959) Localization and kinetics of reduced pyridine nucleotide in living cells by microfluorometry. J Biol Chem. 234:3044-3050. Chen B, Thomsen SL, Thomas RJ, Oliver J, Welch AJ. (2008) Histological and modeling study of skin thermal injury to 2.0 microm laser irradiation. Lasers Surg Med. 40(5):358-370. Clark AL, Gillenwater A, Alizadeh-Naderi R, El-Naggar AK, Richards-Kortum R. (2004) Detection and diagnosis of oral neoplasia with an optical coherence microscope. J Biomed Opt. 9(6):1271-1280. Coghlan L, Utzinger U, Drezek R, Heintzelmann D, Zuluaga A, Brookner C, RichardsKortum R, Gimenez-Conti I, Follen M. (2000) Optimal fluorescence excitation 61 [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] wavelengths for detection of squamous intra-epithelial neoplasia: results from an animal model. Opt Express. 7(12):436-446. Collier T, Follen M, Malpica A, Richards-Kortum R. (2005) Sources of scattering in cervical tissue: determination of the scattering coefficient by confocal microscopy. Appl Opt. 44(11):2072-2081. D'Arcangelo C, Di Nardo Di Maio F, Prosperi GD, Conte E, Baldi M, Caputi S. (2007) A preliminary study of healing of diode laser versus scalpel incisions in rat oral tissue: a comparison of clinical, histological, and immunohistochemical results. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 103(6):764-773. de Veld DC, Skurichina M, Witjes MJ, Duin RP, Sterenborg HJ, Roodenburg JL. (2005) Autofluorescence and diffuse reflectance spectroscopy for oral oncology. Lasers Surg Med. 36(5):356-364. De Veld DC, Witjes MJ, Sterenborg HJ, Roodenburg JL. (2005) The status of in vivo autofluorescence spectroscopy and imaging for oral oncology. Oral Oncol. 41(2):117-131. Delme K, Meire M, De Bruyne M, Nammour S, De Moor R. (2009) [Cavity preparation using an Er:YAG laser in the adult dentition]. Rev Belge Med Dent (1984). 64(2):71-80. DGZMK. Vorläuferläsionen des oralen Plattenepithelkarzinoms. 2010 [cited; Available from: http://www.dgzmk.de/uploads/tx_szdgzmkdocuments/Zahnarztversion_Vorlaeufer laesionen_Plattenepithelkarzinom_29.11.2010.pdf Dhingra JK, Perrault DF, Jr., McMillan K, Rebeiz EE, Kabani S, Manoharan R, Itzkan I, Feld MS, Shapshay SM. (1996) Early diagnosis of upper aerodigestive tract cancer by autofluorescence. Arch Otolaryngol Head Neck Surg. 122(11):1181-1186. Dmovsek-Olup B, Vedlin B. (1997) Use of Er:YAG laser for benign skin disorders. Lasers Surg Med. 21(1):13-19. Drezek R, Brookner C, Pavlova I, Boiko I, Malpica A, Lotan R, Follen M, RichardsKortum R. (2001) Autofluorescence microscopy of fresh cervical-tissue sections reveals alterations in tissue biochemistry with dysplasia. Photochem Photobiol. 73(6):636-641. Driemel O, Kunkel M, Hullmann M, von Eggeling F, Muller-Richter U, Kosmehl H, Reichert TE. (2007) Diagnosis of oral squamous cell carcinoma and its precursor lesions. J Dtsch Dermatol Ges. 5(12):1095-1100. Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. (2010) Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 127(12):28932917. Fried NM. (2001) Potential applications of the erbium:YAG laser in endourology. J Endourol. 15(9):889-894. Genovese MD, Olivi G. (2010) Use of laser technology in orthodontics: hard and soft tissue laser treatments. Eur J Paediatr Dent. 11(1):44-48. Gillenwater A, Jacob R, Ganeshappa R, Kemp B, El-Naggar AK, Palmer JL, Clayman G, Mitchell MF, Richards-Kortum R. (1998) Noninvasive diagnosis of oral neoplasia based on fluorescence spectroscopy and native tissue autofluorescence. Arch Otolaryngol Head Neck Surg. 124(11):1251-1258. Gillenwater A, Jacob R, Richards-Kortum R. (1998) Fluorescence spectroscopy: a technique with potential to improve the early detection of aerodigestive tract neoplasia. Head Neck. 20(6):556-562. Gonzalez-Ramirez I, Irigoyen-Camacho M, Ramirez-Amador V, Lizano-Soberon M, Carrillo-Garcia A, Garcia-Carranca A, Sanchez-Perez Y, Mendez-Martinez R, Granados-Garcia M, Ruiz-Godoy L, Garcia-Cuellar C. (2013) Association between age and high-risk human papilloma virus in Mexican oral cancer patients. Oral Dis.796-804. 62 [34] [35] [36] [37] [38] [39] [40] [41] [42] [43] [44] [45] [46] [47] [48] [49] [50] [51] [52] [53] Gorisch W, Boergen KP. (1982) Heat-induced contraction of blood vessels. Lasers Surg Med. 2(1):1-13. Gupta PK, Majumder SK, Uppal A. (1997) Breast cancer diagnosis using N2 laser excited autofluorescence spectroscopy. Lasers Surg Med. 21(5):417-422. Hale GM, Querry MR. (1973) Optical Constants of Water in the 200-nm to 200microm Wavelength Region. Appl Opt. 12(3):555-563. Harries ML, Lam S, MacAulay C, Qu J, Palcic B. (1995) Diagnostic imaging of the larynx: autofluorescence of laryngeal tumours using the helium-cadmium laser. J Laryngol Otol. 109(2):108-110. Heintzelman DL, Utzinger U, Fuchs H, Zuluaga A, Gossage K, Gillenwater AM, Jacob R, Kemp B, Richards-Kortum RR. (2000) Optimal excitation wavelengths for in vivo detection of oral neoplasia using fluorescence spectroscopy. Photochem Photobiol. 72(1):103-113. Hohenleutner U, Hohenleutner S, Baumler W, Landthaler M. (1997) Fast and effective skin ablation with an Er:YAG laser: determination of ablation rates and thermal damage zones. Lasers Surg Med. 20(3):242-247. Horch HH, Gerlach KL, Schaefer HE. (1986) CO2 laser surgery of oral premalignant lesions. Int J Oral Maxillofac Surg. 15(1):19-24. Horowitz A. (2003) Has the time come fpr opportunistic oral cancer screening? Br Dent J.194:497-502. Howaldt HP, Kainz M, Euler B, Vorast H. (1999) Proposal for modification of the TNM staging classification for cancer of the oral cavity. DOSAK. J Craniomaxillofac Surg. 27(5):275-288. Hsu S, Singh B, Schuster G. (2004) Induction of apoptosis in oral cancer cells: agents and mechanisms for potential therapy and prevention. Oral Oncol. 40(5):461-473. Hyde N, Hopper C. (1999) Oral cancer: the importance of early referral. Practitioner. 243(1603):753, 756-758, 760-751 passim. Inaguma M, Hashimoto K. (1999) Porphyrin-like fluorescence in oral cancer: In vivo fluorescence spectral characterization of lesions by use of a near-ultraviolet excited autofluorescence diagnosis system and separation of fluorescent extracts by capillary electrophoresis. Cancer. 86(11):2201-2211. Jahn R, Bleckmann A, Duczynski E, Huber G, Lierse W, Struve B, Jungbluth KH. (1994) [Thermal side effects after use of the pulsed IR laser on meniscus and bone tissue]. Unfallchirurgie. 20(1):1-10. Jayanthi JL, Subhash N, Stephen M, Philip EK, Beena VT. (2011) Comparative evaluation of the diagnostic performance of autofluorescence and diffuse reflectance in oral cancer detection: a clinical study. J Biophotonics. 4(10):696-706. Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. (2011) Global cancer statistics. CA Cancer J Clin. 61(2):69-90. Jerjes W, Hamdoon Z, Hopper C. (2012) CO2 lasers in the management of potentially malignant and malignant oral disorders. Head Neck Oncol. 4:17. Jerjes W, Upile T, Hamdoon Z, Mosse CA, Akram S, Hopper C. (2011) Prospective evaluation of outcome after transoral CO(2) laser resection of T1/T2 oral squamous cell carcinoma. Oral Surg Oral Med Oral Pathol Oral Radiol Endod.180-187. Kanojia D, Sawant SS, Borges AM, Ingle AD, Vaidya MM. (2012) Alterations in keratins and associated proteins during 4- Nitroquinoline-1-oxide induced rat oral carcinogenesis. J Carcinog. 11:14. Keller U, Hibst R, Mohr W. (1991) [Experimental animal studies on laser osteotomy using the erbium: YAG laser system]. Dtsch Z Mund Kiefer Gesichtschir. 15(3):197199. Kluftinger AM, Davis NL, Quenville NF, Lam S, Hung J, Palcic B. (1992) Detection of squamous cell cancer and pre-cancerous lesions by imaging of tissue autofluorescence in the hamster cheek pouch model. Surg Oncol. 1(2):183-188. 63 [54] [55] [56] [57] [58] [59] [60] [61] [62] [63] [64] [65] [66] [67] [68] [69] [70] [71] Ko JY, Wang CP, Ting LL, Yang TL, Tan CT. (2009) Endoscopic nasopharyngectomy with potassium-titanyl-phosphate (KTP) laser for early locally recurrent nasopharyngeal carcinoma. Head Neck. 31(10):1309-1315. Kolli VR, Savage HE, Yao TJ, Schantz SP. (1995) Native cellular fluorescence of neoplastic upper aerodigestive mucosa. Arch Otolaryngol Head Neck Surg. 121(11):1287-1292. Kuttenberger JJ, Stubinger S, Waibel A, Werner M, Klasing M, Ivanenko M, Hering P, Von Rechenberg B, Sader R, Zeilhofer HF. (2008) Computer-guided CO2-laser osteotomy of the sheep tibia: technical prerequisites and first results. Photomed Laser Surg. 26(2):129-136. Le Harzic R, Konig K, Wullner C, Vogler K, Dnitzky C. (2009) Ultraviolet femtosecond laser creation of corneal flap. J Refract Surg. 25(4):383-389. LeitlinienprogramOnkologie. Diagnostik und Therapie des Mundhöhlenkarzinoms. 2012 [cited; Available from: http://www.krebsgesellschaft.de/download/s3_mundhoehlenkarzinom_ol_langver sion_20121115.pdf Liao H, Noguchi M, Maruyama T, Muragaki Y, Kobayashi E, Iseki H, Sakuma I. (2012) An integrated diagnosis and therapeutic system using intra-operative 5aminolevulinic-acid-induced fluorescence guided robotic laser ablation for precision neurosurgery. Med Image Anal. 16(3):754-766. Lomke MA. (2009) Clinical applications of dental lasers. Gen Dent. 57(1):47-59. Luomanen M. (1987) A comparative study of healing of laser and scalpel incision wounds in rat oral mucosa. Scand J Dent Res. 95(1):65-73. Mahn HR, Nowak C, Audring H, Liebetruth J, Lindenau KF. (1982) [Animal experiment comparison of the therapeutic efficacy of tumor excision with a scalpel or with a CO2 laser in subcutaneously implanted Lewis lung cancer]. Z Exp Chir. 15(1):38-47. Majaron B, Srinivas SM, Huang H, Nelson JS. (2000) Deep coagulation of dermal collagen with repetitive Er:YAG laser irradiation. Lasers Surg Med. 26(2):215-222. Marchesini R, Brambilla M, Pignoli E, Bottiroli G, Croce AC, Dal Fante M, Spinelli P, di Palma S. (1992) Light-induced fluorescence spectroscopy of adenomas, adenocarcinomas and non-neoplastic mucosa in human colon. I. In vitro measurements. J Photochem Photobiol B. 14(3):219-230. McKenzie AL. (1990) Physics of thermal processes in laser-tissue interaction. Phys Med Biol. 35(9):1175-1209. Meijer J. (2004) Laser beam machining (LBM), state of the art and new opportunities. J Mater Process Technol.2–17. Menovsky T, van den Bergh Weerman M, Beek JF. (1996) Effect of CO2 milliwatt laser on peripheral nerves: Part I. A dose-response study. Microsurgery. 17(10):562567. Moskalik K, Kozlov A, Demin E, Boiko E. (2009) The efficacy of facial skin cancer treatment with high-energy pulsed neodymium and Nd:YAG lasers. Photomed Laser Surg. 27(2):345-349. Muller MG, Georgakoudi I, Zhang Q, Wu J, Feld MS. (2001) Intrinsic fluorescence spectroscopy in turbid media: disentangling effects of scattering and absorption. Appl Opt. 40(25):4633-4646. Muller MG, Valdez TA, Georgakoudi I, Backman V, Fuentes C, Kabani S, Laver N, Wang Z, Boone CW, Dasari RR, Shapshay SM, Feld MS. (2003) Spectroscopic detection and evaluation of morphologic and biochemical changes in early human oral carcinoma. Cancer. 97(7):1681-1692. Nanni CA, Alster TS. (1998) Complications of cutaneous laser surgery. A review. Dermatol Surg. 24(2):209-219. 64 [72] [73] [74] [75] [76] [77] [78] [79] [80] [81] [82] [83] [84] [85] [86] [87] [88] [89] Nelson JS, Yow L, Liaw LH, Macleay L, Zavar RB, Orenstein A, Wright WH, Andrews JJ, Berns MW. (1988) Ablation of bone and methacrylate by a prototype midinfrared erbium:YAG laser. Lasers Surg Med. 8(5):494-500. Onizawa K, Saginoya H, Furuya Y, Yoshida H. (1996) Fluorescence photography as a diagnostic method for oral cancer. Cancer Lett. 108(1):61-66. Oosterhuis JW, Verschueren RC, Eibergen R, Oldhoff J. (1982) The viability of cells in the waste products of CO2-laser evaporation of Cloudman mouse melanomas. Cancer. 49(1):61-67. Orchardson R, Peacock JM, Whitters CJ. (1997) Effect of pulsed Nd:YAG laser radiation on action potential conduction in isolated mammalian spinal nerves. Lasers Surg Med. 21(2):142-148. Palmer GM, Marshek CL, Vrotsos KM, Ramanujam N. (2002) Optimal methods for fluorescence and diffuse reflectance measurements of tissue biopsy samples. Lasers Surg Med. 30(3):191-200. Palmer GM, Zhu C, Breslin TM, Xu F, Gilchrist KW, Ramanujam N. (2003) Comparison of multiexcitation fluorescence and diffuse reflectance spectroscopy for the diagnosis of breast cancer (March 2003). IEEE Trans Biomed Eng. 50(11):1233-1242. Papadavid E, Katsambas A. (2003) Lasers for facial rejuvenation: a review. Int J Dermatol. 42(6):480-487. Pashkevich A DA, Chumakov O. (2004) Multiobjective optimization of robot motion for laser cutting applications. Int J Comput Integrated Manuf.17(12): 171–183. Pavlova I, Sokolov K, Drezek R, Malpica A, Follen M, Richards-Kortum R. (2003) Microanatomical and biochemical origins of normal and precancerous cervical autofluorescence using laser-scanning fluorescence confocal microscopy. Photochem Photobiol. 77(5):550-555. Pourzarandian A, Watanabe H, Aoki A, Ichinose S, Sasaki KM, Nitta H, Ishikawa I. (2004) Histological and TEM examination of early stages of bone healing after Er:YAG laser irradiation. Photomed Laser Surg. 22(4):342-350. Pustovalov VK, Astafyeva LG. (2011) Nonlinear thermo-optical properties of twolayered spherical system of gold nanoparticle core and water vapor shell during initial stage of shell expansion. Nanoscale Res Lett. 6:448. Rapiti E, Verkooijen HM, Vlastos G, Fioretta G, Neyroud-Caspar I, Sappino AP, Chappuis PO, Bouchardy C. (2006) Complete excision of primary breast tumor improves survival of patients with metastatic breast cancer at diagnosis. J Clin Oncol. 24(18):2743-2749. Reichart P. Primärprevention des Mundhöhlenkarzinoms und oraler Präkanzerosen. In: GesichtsChir MK, ed. 2000:357-364. Reichart P, Hausamen J, Becker J, Neukam F, Schliephake H, Schmelzeisen R. Curriculum Zahnärztliche Chirurgie, Band 1. Berlin: Quintessenz Verlags-GmbH 2002:580. Richards-Kortum R, Sevick-Muraca E. (1996) Quantitative optical spectroscopy for tissue diagnosis. Annu Rev Phys Chem. 47:555-606. Rico PJ, Johnson TE, Mitchell MA, Saladino BH, Roach WP. (2000) Median effective dose determination and histologic characterization of porcine (Sus scrofa domestica) dermal lesions induced by 1540-nm laser radiation pulses. Comp Med. 50(6):633-638. Roblyer D, Kurachi C, Stepanek V, Williams MD, El-Naggar AK, Lee JJ, Gillenwater AM, Richards-Kortum R. (2009) Objective detection and delineation of oral neoplasia using autofluorescence imaging. Cancer Prev Res (Phila). 2(5):423-431. Romanos G, Ko HH, Froum S, Tarnow D. (2009) The use of CO(2) laser in the treatment of peri-implantitis. Photomed Laser Surg. 27(3):381-386. 65 [90] [91] [92] [93] [94] [95] [96] [97] [98] [99] [100] [101] [102] [103] [104] [105] [106] [107] [108] Rooks B. (2000) Lasers become the acceptable face of precision welding and cutting. Ind Robot Int J.27(22): 103–107. Salomatina E, Yaroslavsky AN. (2008) Evaluation of the in vivo and ex vivo optical properties in a mouse ear model. Phys Med Biol. 53(11):2797-2807. Schantz SP, Kolli V, Savage HE, Yu G, Shah JP, Harris DE, Katz A, Alfano RR, Huvos AG. (1998) In vivo native cellular fluorescence and histological characteristics of head and neck cancer. Clin Cancer Res. 4(5):1177-1182. Scheifele C, Reichart PA. (1998) [Oral leukoplakia in manifest squamous epithelial carcinoma. A clinical prospective study of 101 patients]. Mund Kiefer Gesichtschir. 2(6):326-330. Schwarz RA, Gao W, Daye D, Williams MD, Richards-Kortum R, Gillenwater AM. (2008) Autofluorescence and diffuse reflectance spectroscopy of oral epithelial tissue using a depth-sensitive fiber-optic probe. Appl Opt. 47(6):825-834. Shafer WG, Waldron CA. (1975) Erythroplakia of the oral cavity. Cancer. 36(3):10211028. Sotsuka Y, Nishimoto S, Tsumano T, Kawai K, Ishise H, Kakibuchi M, Shimokita R, Yamauchi T, Okihara SI. (2013) The dawn of computer-assisted robotic osteotomy with ytterbium-doped fiber laser. Lasers Med Sci. Epub ahead of print. Spinelli P, Calarco G, Mancini A, Ni XG. (2006) Operative colonoscopy in cancer patients. Minim Invasive Ther Allied Technol. 15(6):339-347. Stelzle F, Adler W, Zam A, Tangermann-Gerk K, Knipfer C, Douplik A, Schmidt M, Nkenke E. (2012) In vivo optical tissue differentiation by diffuse reflectance spectroscopy: preliminary results for tissue-specific laser surgery. Surg Innov. 19(4):385-393. Stelzle F, Tangermann-Gerk K, Adler W, Zam A, Schmidt M, Douplik A, Nkenke E. (2010) Diffuse reflectance spectroscopy for optical soft tissue differentiation as remote feedback control for tissue-specific laser surgery. Lasers Surg Med. 42(4):319-325. Stelzle F, Terwey I, Knipfer C, Adler W, Tangermann-Gerk K, Nkenke E, Schmidt M. (2012) The impact of laser ablation on optical soft tissue differentiation for tissue specific laser surgery-an experimental ex vivo study. J Transl Med. 10:123. Stelzle F, Zam A, Adler W, Tangermann-Gerk K, Douplik A, Nkenke E, Schmidt M. (2011) Optical nerve detection by diffuse reflectance spectroscopy for feedback controlled oral and maxillofacial laser surgery. J Transl Med. 9:20. Stopp S, Svejdar D, von Kienlin E, Deppe H, Lueth TC. (2008) A new approach for creating defined geometries by navigated laser ablation based on volumetric 3-D data. IEEE Trans Biomed Eng. 55(7):1872-1880. Stubinger S, Ghanaati S, Saldamli B, Kirkpatrick CJ, Sader R. (2009) Er:YAG laser osteotomy: preliminary clinical and histological results of a new technique for contact-free bone surgery. Eur Surg Res. 42(3):150-156. Stubinger S, Landes C, Seitz O, Sader R. (2007) Er:YAG laser osteotomy for intraoral bone grafting procedures: a case series with a fiber-optic delivery system. J Periodontol. 78(12):2389-2394. Suarez P, Batsakis JG, el-Naggar AK. (1998) Leukoplakia: still a gallimaufry or is progress being made?--A review. Adv Anat Pathol. 5(3):137-155. Suhr MA, Hopper C, Jones L, George JG, Bown SG, MacRobert AJ. (2000) Optical biopsy systems for the diagnosis and monitoring of superficial cancer and precancer. Int J Oral Maxillofac Surg. 29(6):453-457. Takac S, Stojanovic S, Muhi B. (1998) [Types of medical lasers]. Med Pregl. 51(34):146-150. Thomson PJ, Wylie J. (2002) Interventional laser surgery: an effective surgical and diagnostic tool in oral precancer management. Int J Oral Maxillofac Surg. 31(2):145153. 66 [109] [110] [111] [112] [113] [114] [115] [116] [117] [118] [119] [120] Tuchmann A, Fischer PL, Bauer P, Plenk H, Jr., Braun O, Dinstl K. (1986) [Scalpel and CO2 laser in the animal experiment. A comparative study of inoculation tumors of the mouse]. Langenbecks Arch Chir. 368(2):125-136. van der Hem PS, Nauta JM, van der Wal JE, Roodenburg JL. (2005) The results of CO2 laser surgery in patients with oral leukoplakia: a 25 year follow up. Oral Oncol. 41(1):31-37. Wagnieres GA, Star WM, Wilson BC. (1998) In vivo fluorescence spectroscopy and imaging for oncological applications. Photochem Photobiol. 68(5):603-632. Walsh JT, Jr., Deutsch TF. (1989) Er:YAG laser ablation of tissue: measurement of ablation rates. Lasers Surg Med. 9(4):327-337. Walsh JT, Jr., Deutsch TF. (1989) Pulsed CO2 laser ablation of tissue: effect of mechanical properties. IEEE Trans Biomed Eng. 36(12):1195-1201. White JM, Chaudhry SI, Kudler JJ, Sekandari N, Schoelch ML, Silverman S, Jr. (1998) Nd:YAG and CO2 laser therapy of oral mucosal lesions. J Clin Laser Med Surg. 16(6):299-304. Woolgar JA, Scott J, Vaughan ED, Brown JS, West CR, Rogers S. (1995) Survival, metastasis and recurrence of oral cancer in relation to pathological features. Ann R Coll Surg Engl. 77(5):325-331. Yadav GS, Donoghue M, Tauro DP, Yadav A, Agarwal S. (2013) Intraoperative imprint evaluation of surgical margins in oral squamous cell carcinoma. Acta Cytol. 57(1):75-83. Yang YL, Ye YM, Li FM, Li YF, Ma PZ. (1987) Characteristic autofluorescence for cancer diagnosis and its origin. Lasers Surg Med. 7(6):528-532. Yaroslavsky AN, Schulze PC, Yaroslavsky IV, Schober R, Ulrich F, Schwarzmaier HJ. (2002) Optical properties of selected native and coagulated human brain tissues in vitro in the visible and near infrared spectral range. Phys Med Biol. 47(12):20592073. Zaffe D, Vitale MC, Martignone A, Scarpelli F, Botticelli AR. (2004) Morphological, histochemical, and immunocytochemical study of CO2 and Er:YAG laser effect on oral soft tissues. Photomed Laser Surg. 22(3):185-189. Zhou ZT, Jiang WW. (2008) Cancer stem cell model in oral squamous cell carcinoma. Curr Stem Cell Res Ther. 3(1):17-20. 67 10 Abkürzungsverzeichnis Hg Quecksilber J Joule mJ Millijoule Hz Hertz PCA principal Component Analysis PCs principal components AUC area under the curve ROC receiver operating characteristic LDA linear discriminant analysis NAD Nikotinamid-Adenin-Dinukleotid FAD Flavin- Adenin- Dinukleotid % Prozent vgl vergleich CAD/ CAM computer aided design/ computer aided manufacturing cm Zentimeter cm² Quadratzentimeter mm Millimeter µm Mikrometer nm Nanometer ml Milliliter NaCl Natriumchlorid HE Hämatoxylin-Eosin CT Computertomographie 68 11 Danksagung Mein besonderer Dank gilt Herrn PD Dr. Dr. Florian Stelzle für die Planung der Versuche sowie für Motivation, Gespräche und Hilfe auch über die Dissertation hinaus. Seine Anleitung zur wissenschaftlichen Tätigkeit und seine zuverlässige Betreuung haben wesentlichen Anteil am Gelingen dieser Arbeit. Herrn Prof. Dr. med. Dr. med. dent. Dr. h.c. F.W. Neukam, Direktor der Klinik und Poliklinik für Mund-, Kiefer-, Gesichtschirurgie der Friedrich-AlexanderUniversität Erlangen-Nürnberg, gilt mein Dank für die Schaffung der notwendigen Voraussetzungen zur Durchführung dieser Arbeit in der Klinik. Herrn Dr. med. dent. Christian Knipfer danke ich für die gewissenhafte Betreuung und fachliche Unterstützung. Mein persönlicher Dank gilt meinem Projektpartner und Freund Bastian Bergauer für die freundschaftliche und erfolgreiche Zusammenarbeit. Ich danke Frau Dr. Katrin Brunner und Herrn Dr. Werner Adler für die wertvolle und tatkräftige Unterstützung. Ihre Ratschläge und Anregungen waren mir stets eine große Hilfe. Ich danke meinen Großeltern, meinen Freunden und meiner Freundin für die treue Unterstützung und den großen Rückhalt. Am Ende gilt ein ganz besonderer Dank meinen lieben Eltern und meinem Bruder Thomas. Durch ihre unentwegte Hilfe und großzügige Unterstützung in allen Jahren haben sie die vorliegende Dissertation erst ermöglicht. 69 12 Lebenslauf Andreas Malte Amann Adresse Kobergerstr. 29 90408 Nürnberg Geboren 03.11.1987 in Nürnberg Eltern Elke Amann Georg Amann Geschwister Thomas Amann Familienstand ledig Staatsangehörigkeit deutsch Bildungsgang 1994- 1996 Grund- und Teilhauptschule Bartholomäusstraße, Nürnberg 1996- 1998 Grundschule Thoner Espan, Nürnberg 1998- 2007 Peter-Vischer-Schule, Nürnberg Abteilung Gymnasium 2007 Abitur an der Peter-Vischer-Schule, Nürnberg Note: 1,6 WS 2007/ 2008 WS 2012/ 2013 Studium der Zahnmedizin an der Friedrich-AlexanderUniversität Erlangen-Nürnberg März 2010 Zahnärztliche Vorprüfung Note: 1,5 November 2012 Zahnärztliche Prüfung Note: 1,6 November 2012 Approbation als Zahnarzt Seit 01.10.2013 Assistenzzahnarzt in der Praxis Dr. Felix Sippel, Nürnberg