Zytostatika Pharmakotherapie von Tumoren
Werbung

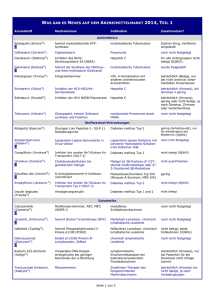
Zytostatika Pharmakotherapie von Tumoren Sommersemester 2008 z.B. Trastuzumab, Cetuximab Ziele der Chemotherapie 1. Kurative Therapie: Heilung ist möglich (z.B. maligne Lymphome, Hoden-Ca) 2. Palliative Therapie: Verbesserung Lebensqualität, ohne Heilung der 3. Neoadjuvante Therapie: Präoperative Chemotherapie (Tumorgröße↓, keine Metastasierung vor dem kurativen Eingriff) 4. Adjuvante Therapie: Verhinderung von Rezidiven und Metastasen Probleme bei der Bekämpfung von Tumoren Unterscheidung von schädlichem Tumorgewebe und gesundem Gewebe Unterschiedlicher Effekt auf schnell und langsam proliferierende Zellen Selektive Wirkung auf Zellen, die sich im Zellzyklus befinden Tumorverdopplungszeiten Schnell wachsende Tumoren sind gegenüber einer Chemotherapie besonders sensitiv Tumor Heilungsrate % (durch Chemotherapie) Verdopplungszeit (Tage) Chorioncarzinom 60-90 1,5 Hodenkarzinom 90 5-6 Colonkarzinom <5 80 Bronchialkarzinom <5 90 Der Zellzyklus Prüfung der Replikation, Fehlerbeseitigung Tumorzellen: • Unabhängigkeit von Wachstumssignalen Proliferation begünstigt (genetisch aktivierte intrazelluläre Signalproteine, Defekte von Regulatorproteinen z.B. p53) • Sensitivität vermindert gegenüber Wachstumsinhibition • Apoptoseneigung vermindert Chemotherapeutika: Beziehung zum Zellzyklus Phasen-unspezifisch (zyklusspezifisch) – Substanz unterbricht Zellteilung in jeder Phase – abhängig von Höhe der Dosierung Phasen-spezifisch – Substanz unterbricht Zellteilung in spezifischer Phase – am effektivsten wenn viele Zellen in Teilung Zellteilungsphasen-spezifischer Angriff einiger Zytostatika: bevorzugt in der S- und M-Phase Alkylantien u.a. DNA-schädigende Substanzen Vinca-Alkaloide Taxane Mitose G2 Bleomycin G1 G0 S-Phase Pyrimidinanaloge Purinanaloge Topoisomerasehemmstoffe Hydroxyharnstoff Polychemotherapie Kombinationsbehandlung (z.B. CMF-Schema) von Tumoren mit verschiedenen Zytostatika mit unterschiedlichem Wirkungsmechanismus: •unterschiedlichen Nebenwirkungen (Dosislimitierung einzelner Substanzen durch spez. NW) •Elimination resistenter Tumorzellen „Fractional kill“ –Hypothese •Einzeldosis tötet konstante Fraktion der Tumor-Zellen •Wiederholung Intervallen nötig in definierten Zytostatika-Nebenwirkungen (unspezifisch) Tumor-Zerfall Hyperurikämie (durch Hypoxanthin-Anhäufung: Harnsäure ↑; (Na-Urat: Gichtanfälle) Hyperkaliämie Hyperphosphatämie alle Zytostatika Knochenmark Epithel ZNS Immunsystem Organschäden Gonaden Neoplasien Anämie Leukopenie Hämostasestörungen Mucositis (GIT) Haarausfall Übelkeit, Erbrechen Infekte Leber, Niere, Herz Sterilität Begleit-Therapie „supportive“ Therapie Hydrierung Allopurinol (Isomer des Hypoxanthins, XanthinoxidaseHemmung): Serumharnsäure↓ Antiemetika Analgetika Infektprophylaxe Psychopharmaka Immuntherapie (Hämatopoetische Wachstumsfaktoren) G-CSF granulocyte colony-stimulating factor (Filgrastim): erhöhte Neutrophilenfreisetzung Pharmakologische Angriffspunkte Pentostatin hemmt Adenosin-DA 6-Mercaptopurin 6-Thioguanin hemmt Purinsynthese Interferenz mit Nukleotidintermediärstoffwechsel PurinSynthese PyrimidinSynthese Hydroxyharnstoff Ribonukleotide 5-Fluorouracil Desoxyribonukleotide hemmt DHF-Reduktion und dadurch TMP- und Purinsynthese hemmt Nukleinsäuresynthese DNA Topoisomerase-Hemmer Etoposid, Teniposid DNA-Schädigung (Reparatur↓) RNA Anthrazykline Actinomycine Proteine Alkylantien Cisplatin Addukt-Bildung mit DNA Asparaginase deaminiert Asparagin und hemmt Proteinsynthese Vinca-Alkaloide Paclitaxel Bleomycin DNA-Fragmentierung hemmt TMP-Synthese Cytarabin Flutarabin Methotrexat DNA-Interkalation (+Schäd.) (RNA-Synthese↓) hemmt RN-Reduktase Enzyme Mikrotubuli interferiert mit Spindelapparat (Mitose) Pharmakologische Angriffspunkte Pentostatin hemmt Adenosin-DA 6-Mercaptopurin 6-Thioguanin hemmt Purinsynthese Interferenz mit Nukleotidintermediärstoffwechsel PurinSynthese PyrimidinSynthese Hydroxyharnstoff Ribonukleotide 5-Fluorouracil Desoxyribonukleotide hemmt DHF-Reduktion und dadurch TMP- und Purinsynthese hemmt Nukleotidsynthese DNA Topoisomerase-Hemmer Etoposid, Teniposid DNA-Schädigung (Reparatur↓) Alkylantien Cisplatin Addukt-Bildung mit DNA RNA Anthrazykline Actinomycine Proteine Asparaginase deaminiert Asparagin und hemmt Proteinsynthese Vinca-Alkaloide Paclitaxel Bleomycin DNA-Fragmentierung hemmt TMP-Synthese Cytarabin Flutarabin Methotrexat DNA-Interkalation (+Schäd.) (RNA-Synthese↓) hemmt RN-Reduktase Enzyme Mikrotubuli interferiert mit Spindelapparat (Mitose) DNA-reaktive Substanzen (Alkylantien) N-Lost-Derivate (Chlorethamin Derivate) Cyclophosphamid, (Endoxan ®) Ifosfamid (Holoxan ®) Trofosfamid (Ixoten ®) Melphalan (Alkeran ®) Chlorambucil (Leukeran ®) Nitrosoharnstoffverbindungen Carmustin (Carmubris ®) Lomustin (Cecemu ®) Estramustin (Estracyt ®) Nimustin (ACNU ®) Vorläufer: Schwefel-Lost Senfgas („Gelbkreuz“) Haut, Augen, auch: blutbildendes und lymphat. System) Aktivierung von N-Lost (I) und DNA-Alkylierung (II) Chlorid-Abspaltung elektrophiler Angriff: N7 Guanin N1, N3 Adenin, Amino-, Hydroxylgruppen von Proteinen Guanin Guanin Interstrang-Quervernetzung Metabolische Aktivierung von Cyclophosphamid Cyclophosphamid Leber Tumor Wirkform Wirkform Blasenschädigung Blasenschädigung hämorrhagische Zystitis seit 1958, auch heute wichtig für die Therapie! Cyclophosphamid (Endoxan®, Cyclostin®) Indikationen: Mamma-, Bronchial-, Ovarial-Ca, maligne Lymphome (CMF-Schema) rheumatoide Arthritis (immunsuppressiv) Kinetik: p.o. Gabe (BV > 70%), hohe Dosen: i.v. hepat. Aktivierung (Hydroxlierung) UAW: Myelosuppression (dosislimitierend) Übelkeit, Erbrechen, Haarausfall Urotoxizität (Acrolein) Prävention mit (Hämorrhagische Cystitis) Mesna Kardiotoxizität hydrophile Thiolverbindung 2-Mercaptoethansulfonat-Na Lungenfibrose Nitrosoharnstoffverbindungen: Lomustin (Cecenu®) Lomustin Spontaner Zerfall: t1/2: min Hohe Lipohilie: Ind: Hirntumore (im ZNS 3040% der Plasmakonz.) O-6 Guanin, ( N-3 Cytosin) NW: verzögerte Knochenmarksdepression (3-4 Wochen) Hepatotoxizität Andere alkylierende Substanzen: Trabectedin (Yondelis®) Oct. 2007 beim Weichteilsarkom Seescheide (Ecteinascidia turbinata) Alkylierung hemmt Transkription zahlreicher Gene Hemmt DNA-Reparaturmechanismen Häufige Nebenwirkungen Trabectedin (Yondelis®) Cytostatische Platinverbindungen 1965 (Rosenberg): Wirkung von elektr. Feldern auf Bakterien untersucht. Effekt von Pt-Elektroden Aktivierung intrazellulär: Ersatz der Chlorid-Liganden durch Wasser: Aquoliganden Schnell: Cisplatin, langsamer:Carboplatin) Therapieprobleme: Erbrechen, Nephrotoxizität (Cis) Neurotoxizität Knochenmarksdep. (Carbo) u.a. Ind: Tumore des Urogenitaltraktes Pharmakologische Angriffspunkte Pentostatin hemmt Adenosin-DA 6-Mercaptopurin 6-Thioguanin hemmt Purinsynthese Interferenz mit Nukleotidintermediärstoffwechsel PurinSynthese PyrimidinSynthese Hydroxyharnstoff Ribonukleotide 5-Fluorouracil Desoxyribonukleotide hemmt DHF-Reduktion und dadurch TMP- und Purinsynthese hemmt Nukleotidsynthese DNA Topoisomerase-Hemmer Etoposid, Teniposid DNA-Schädigung (Reparatur↓) DNA-Interkalation (+Schäd.) (RNA-Synthese↓) Bleomycin DNA-Fragmentierung hemmt TMP-Synthese Cytarabin Fludarabin Methotrexat Anthrazykline Actinomycine hemmt RN-Reduktase RNA Proteine Alkylantien Cisplatin Nitrosoharnstoffverb. Addukt-Bildung mit DNA Asparaginase deaminiert Asparagin und hemmt Proteinsynthese Vinca-Alkaloide Paclitaxel Enzyme Mikrotubuli interferiert mit Spindelapparat (Mitose) Antimetabolite (Beispiele) Phasenspezifisch! (S) Folsäure-Antagonisten Methotrexat Purin-Analoga (A, G) Mercaptopurin Thioguanin Pentostatin Fludarabin Pyrimidin-Analoga (C, T) 5-Fluorouracil Cytarabin Gemcitabin Methotrexat (Metex®, Lantarel®) oral Methotrexat i.v. 50-80% Niere Leber Methotrexat hydrophil! 7-OHMethotrexat (Akkumulation bei Hochdossistherapie) + Polyglutamat dUMP C1-Stoffwechsel dTMP Methotrexat Indikationen: Kurativ ist Monotherapie bei Chorionkarzinom Andere Ind.: Osteo-, Mammacarcinom Human Chorion Gonadotropin Trophoblasten! Nebenwirkungen: Knochenmarkssuppression, Schleimhautschäden, Nephro- und Hepatotoxizität Resistenzmechanismen betreffen Transporter, Affinität zu DHFR, Genamplifikation der DHFR Leukovorin-Rescue (Formyltetrahydrofolsäure) Antimetabolite: Purinanaloga Hypoxanthin-GuaninPhosphoribosyl-Transferase HypoxanthinAnalogon Ind.: 6-Mercaptopurin bei Leukämien NW: Hepatotox. /Knochemarksdep. Allupurinol (XanthinoxidaseHemmer)hemmt 6-MercaptopurinAbbau! Feedback-Inhibitoren Wirkmechanismus von Pentostatin (Nipent®) dATP↑ Feedback-Inhibitor RibonucleotidReduktase Antimetabolite: Pyrimidinanaloga 5-Fluorouracil FdUMP 5-FU dUMP FUTP Einbau in RNA FdUTP Thymidilatsynthase 5,10MethylenTHF DNA-Synthese dTMP DHF THF Nukleotide Hydroxyharnstoff RibonukleotidReduktase dNukleotide Gemcitabin Cytosin-Arabinosid Ind.: Colorectales carcinom, Mammacarcinom Ww: Folinsäure verstärkt Wirkung! Nw.: Knochenmarksdepression, Schleimhautschädigungen, Hand-Fuß-Syndrom Antimetabolite: Pyrimidinanaloga Zuckerrest: Arabinose Sterische Hinderung der Rotation der Pyrimidinbase um glykosidische Bindung, Hemmung der DNA-Polymerase Pharmakologische Angriffspunkte Pentostatin hemmt Adenosin-DA 6-Mercaptopurin 6-Thioguanin hemmt Purinsynthese Interferenz mit Nukleotidintermediärstoffwechsel PurinSynthese PyrimidinSynthese Hydroxyharnstoff Ribonukleotide 5-Fluorouracil Desoxyribonukleotide hemmt Nukleotidsynthese hemmt DHF-Reduktion und dadurch TMP- und Purinsynthese DNA Topoisomerase-Hemmer Etoposid, Teniposid DNA-Schädigung (Reparatur↓) DNA-Interkalation (+Schäd.) (RNA-Synthese↓) Bleomycin DNA-Fragmentierung hemmt TMP-Synthese Cytarabin Flutarabin Methotrexat Anthrazykline Actinomycine hemmt RN-Reduktase RNA Proteine Alkylantien Cisplatin Addukt-Bildung mit DNA Asparaginase deaminiert Asparagin und hemmt Proteinsynthese Vinca-Alkaloide Paclitaxel Enzyme Mikrotubuli interferiert mit Spindelapparat (Mitose) Topoisomerasen Jede Zelle enthält ~ 2 m DNA, verpackt im Zellkern DNA ist um basische Proteine (Histone) gewickelt und eng spiralisiert. DNA muss entspannt (relaxiert) werden, bevor Transkription / Replikation erfolgen kann Topoisomerasen verursachen einzelne (Topoisomerase I) oder doppelte Strangbrüche (Topoisomerase II) der DNA während der DNA-Relaxation Strangbrüche werden wieder zusammengefügt In Gegenwart von Topoisomerase-Inhibitoren bleiben Strangbrüche erhalten ⇒ DNA geschädigt Topoisomerase - Inhibitoren Topoisomerase I-Inhibitoren Irinotecan (Kolon-, Rectum-Ca) Topotecan (Ovarial-, kleinzelliges Bronchial-Ca) Irinotecan: schwere Diarrhöen (Loperamid!), cholinerges Frühsyndrom: Speichel-,Tränenfluss (Atropin!) Topoisomerase II-Inhibitoren Etoposid (VP-16) Teniposid (VM-26) hämatologische Tumoren, Bronchial-, Ovarial-, Keimzelltumoren Pharmakologische Angriffspunkte Pentostatin hemmt Adenosin-DA 6-Mercaptopurin 6-Thioguanin hemmt Purinsynthese Interferenz mit Nukleotidintermediärstoffwechsel PurinSynthese PyrimidinSynthese Hydroxyharnstoff Ribonukleotide 5-Fluorouracil Desoxyribonukleotide hemmt DHF-Reduktion und dadurch TMP- und Purinsynthese hemmt Nukleotidsynthese DNA Topoisomerase-Hemmer Etoposid, Teniposid DNA-Schädigung (Reparatur↓) RNA Anthrazykline Actinomycine Proteine Alkylantien Cisplatin Addukt-Bildung mit DNA Asparaginase deaminiert Asparagin und hemmt Proteinsynthese Vinca-Alkaloide Paclitaxel Bleomycin DNA-Fragmentierung hemmt TMP-Synthese Cytarabin Flutarabin Methotrexat DNA-Interkalation (+Schäd.) (RNA-Synthese↓) hemmt RN-Reduktase Enzyme Mikrotubuli interferiert mit Spindelapparat (Mitose) Anthrazykline Doxorubicin Daunorubicin Epirubicin Idarubicin 1. Interkalation (Störung DNA- und RNA-Synthese) 2. DNA-Strangbrüche infolge Topoisomerase II-Hemmung breite Anwendung: Karzinome, Sarkome, Lymphome * Nebenwirkungen: Kardiotoxizität (dosislimitierend) Gewebsnekrosen (Paravasat) u.a. Hinw.: Pegylierung (Methoxypolyethylenglykol) bei liposomalem Doxorubicin. Ziel: reduzierte Gewebebindung Gewebsnekrose (Paravasat) Pharmakologische Angriffspunkte Pentostatin hemmt Adenosin-DA 6-Mercaptopurin 6-Thioguanin hemmt Purinsynthese Interferenz mit Nukleotidintermediärstoffwechsel PurinSynthese PyrimidinSynthese Hydroxyharnstoff Ribonukleotide 5-Fluorouracil Desoxyribonukleotide hemmt Nukleotidsynthese hemmt DHF-Reduktion und dadurch TMP- und Purinsynthese DNA Topoisomerase-Hemmer Etoposid, Teniposid DNA-Schädigung (Reparatur↓) DNA-Interkalation (+Schäd.) (RNA-Synthese↓) Bleomycin DNA-Fragmentierung hemmt TMP-Synthese Cytarabin Flutarabin Methotrexat Anthrazykline Actinomycine hemmt RN-Reduktase RNA Proteine Alkylantien Cisplatin Addukt-Bildung mit DNA Asparaginase deaminiert Asparagin und hemmt Proteinsynthese Vinca-Alkaloide Paclitaxel Enzyme Mikrotubuli interferiert mit Spindelapparat (Mitose) Vinca-Alkaloide (aus trop. Immergrün/MadagaskarImmergrün/Catharanthus roseus NW: Vincristin: neurotoxisch •Periphere Neuropathien (Finger, Zehen) •autonomes Nervensystem Obstipation, Blasenatonie • Hirnnervschädigung Doppelsehen, Hörverlust halbsynthetisch: andre: knochenmarksschädigend Taxane (Paclitaxel: Alkaloid aus der Pazifischen Eibe) z.B. bei Ovarial-, Mammacarcinom, Knochenmarkssuppression, periphere Neuropathien Mikrotubuli-Inhibitoren 2. Gezielte Therapiekonzepte „targeted therapy“ Antikörper Bsp.: B-Zell non-Hodgekin-Lymphom CD20: hoch exprimiert auf B-Zellen, nicht auf Plasmazellen, Stammzellen kein natürlicher Ligand bekannt Rituximab (CD20-Antigen) B-Zell-Lymphome Alemtuzumab (CD52-Antigen) B-Lymphome (CLL) Fieber, kutane T-Lymphome Infektionen Fieber, Nausea, Diarrhoe, Infektion Antikörper Wirkmechanismen CD20 Antigen) Apoptose Complement cascade Macrophagen Complement - vermittelte Zytolyse Zell- vermittelte Zytolyse Antikörper Eingriff in die Signaltransduktion: SIGMA-ALDRICH EGF-Rezeptor (HER1, 2) Signaling Ligand EGFR EGFR-TK K K PI3-K pY pY pY GRB2 SOS RAS RAF STAT3 PTEN AKT MEK Gene transcription Cell cycle progression MAPK PP Proliferation / maturation DNA Myc JunFos Myc Cyclin D1 Cyclin D1 Survival (anti-apoptosis) Chemotherapy / Metastasis radiotherapy Angiogenesis resistance EGFR ist in einigen Karzinomen überexprimiert : Lungenkrebs, Colorectales Carcinom (HER 1), Brustkrebs (HER 2) Signaltransduktionshemmer: Antikörper Cetuximab Erbitux®, rekombinanter monoclonaler Antikörper gegen EGF-(HER 1) colorektale Karzinome Rezeptor Kombinationstherapie mit Topoisomerase I-Hemmern Signaltransduktionshemmung: Antikörper Trastuzumab Herceptin® •rekombinanter humanisierter monoclonaler Antikörper gegen HER2-Onkoprotein •HER2: EGF-Rezeptor 2, nachweisbar auf 20-30% der Mammakarzinome •NW: anaphylaktische Reaktionen: Bronchospasmen, Atemnot, Fieber, Schüttelfrost •Kombinationstherapie mit Paclitaxel •Achtung: bei Behandlung mit Anthracyclinen erhöhte Gefahr der Cardiotoxizität! (HER2 im Herzen exprimiert) Signaltransduktionshemmer: EGF-Rezeptor (HER1)Antagonisten Gefitinib Bronchial-Ca (nicht klz.) Iressa® Neu seit Ende 2005 Erlotinib (Tarceva®) Eingriff in die Signaltransduktion: Bsp. Chronische myeloische Leukämie (CML) PDGF-BB BCR-Abl-Proteinkinase (Philadelphia-Chromosom (9/22)) Zellproliferation ↑ Imatinib (Glivec®) bei der chronischen myeloischen Leukämie Proteinkinase-Inhibitor Signaltransduktionshemmer: Imatinib (GlivecR) Eigenschaften: • Remissionen >90% (meist partiell) • langfristig Resistenzentwicklung • UAW: Ödeme Nausea/Erbrechen Nierenversagen Muskelkrämpfe Leberschäden Seit dem 1. Januar 2008 ist Nilotinib (Tasigna®) in Deutschland zur Behandlung der CML bei Imatinib resistenten Tumoren im Handel Signaltransduktionshemmung: Angriffspunkt Angiogenese •Angiogenese: Neubildung von Blutgefäßen •wichtig beim Wachstum und bei der Metastasen-Bildung von Tumoren •VEGF – Schlüsselmediator der Tumor-Gefäßneubildung Tumorzellen benötigen ab einer bestimmten Größe eine eigene Blutversorgung Tumor Kapillare VEGF spielt die Schlüsselrolle bei der tumorinduzierten Gefäßneubildung Hypoxie VEGF Angiogenese ZellwachstumFaktoren Die Gefäßneubildung fördert das Wachstum des Tumors und erhöht das Risiko der Metastasierung Gefäßversorgung Tumorzelle Bevacizumab (Avastin®) Monoklonaler rekombinanter VEGF-Antikörper Vaskuläre Endothelzellen von Tumoren sind meistens unreif und benötigen VEGF zum Überleben Die Blockierung von VEGF führt zur Apoptose der unreifen Endothelzellen Schrumpfende Tumorzelle GefäßRückbildung Bevacizumab (Avastin®) Monoklonaler rekombinanter VEGF-Antikörper Thalidomid (Contergan®) /Lenalidomid (Revlimid®) beim multiplen Myelom: Thalidomid Lenalidomid Thalidomid (Contergan®) /Lenalidomid (Revlimid®) beim multiplen Myelom: 1 2 3 4 Immunmodulatorische Wirkstoffe vom Imid-Typ: IMIDs Proteasomen-Inhibitor Bortezomib (Velcade®) Ind: Plasmozytom Neuropathien Diarrhoe Proteasomen-Inhibitor Bortezomib (Velcade®) Das Boratom bindet an die katalytische Funktion des 26S Proteasoms. Ind.: Multiples Myelom NW:periphere Neuropathien, Fatigue, Übelkeit 3. Hormone zur Tumortherapie Hormone und Tumortherapie Bsp.: metastasierendes Prostatakarzinom Gonadoliberin-Analoga /-superagonisten Buserelin Leuprorelin (hypothalamisch hypophysärer Feedback: Testosteron↓) Hormone und Tumortherapie Bsp.: metastasierndes Prostatakarzinom Hypothalamus Nasal, subcutanes Implantat Hypophyse Rezeptordownregulation LH- FSHAusschüttung NW: zu Therapiebeginn Anstieg der Testosteronbildung; Knochenmetastasen ↑, (Tumor flare up); Potenz- und Libidoverlust, Hitzewallungen Antiandrogene, Antiestrogene und Aromataseinhibitoren Antiandrogene: •Kombination mit GnRH-Agonisten •Binden an Testosteronrezeptor, verhindern aber Translokation in den Zellkern •Hemmen Testosteronwirkungen •Ind: Prostatakarzinom Aromatasehemmer: Hemmung der Aromatase (CYP19) in Ovarien, fett Muskelgewebe, Mammakarzinomzellen) Blockade der Umwandlung von Androgenen in Östrogene Ind: Mammakarzinom Immuntherapie: Interleukin-2 Interleukin-2 (IL-2) 15 kD Glykoprotein •wird normalerweise von T-Zellen sekretiert, •bindet an einen spezifischen IL-2 Rezeptor. •stimuliert Wachstum und Reifung von T-Zellen (T-Zell Wachstumsfaktor) •Aktiviert natürliche Killerzellen •erhöht die Fähigkeit des Immunsystems Tumorzellen abzutöten Indikation: Malignes Melanom Nierencarcinom NW: cardiotoxisch, Ödembildung, gippeartige Symptome Papillomvirus und Cervixkarzinom Papillomvirus und Cervixkarzinom Papillomvirus und Cervixkarzinom ENDE