neue tHerapiemODalitÄten
Werbung

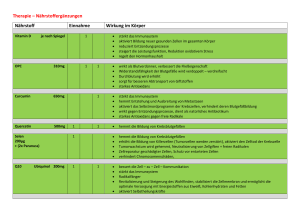
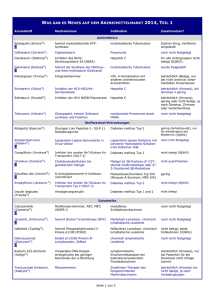
BLACK WHITE RED Multiples Myelom – Broschüre der Wissenschaftsjournalisten NEUE THERAPIEMODALITÄTEN Ein besseres Verständnis der Pathogenese und Progression des MM hat zur Entwicklung neuer Therapien geführt, die sowohl auf die Myelomzelle als auch auf das Mikroenvironment des Knochenmarks abzielen. Ebenfalls viel versprechend sind Kombinationstherapien, bei denen etablierte Medikamente zusammen mit in der Prüfung befindlichen Medikamenten eingesetzt werden. Im Folgenden findet sich ein Überblick über MM Therapien, zu denen gegenwärtig klinische Prüfungen durchgeführt werden.60, 61 • L enalidomid – Der Wirkmechanismus dieses Arzneimittels ist nicht vollkommen geklärt. Es moduliert die Produktion von Zytokinen, die eine Inflammation inhibieren und die Immunantwort fördern; weiterhin leitet es die Proliferation von T Lymphozyten ein, steigert die Aktivität der natürlichen Killerzellen, hemmt die Proliferation hämatopoetischer Zell-Linien (Zellen, die sich unter Laborbedingungen unbegrenzt reproduzieren) und es hemmt das Wachstum neuer Blutgefäße. • B evacizumab – Bevacizumab hemmt ein als VEGF bezeichnetes Protein, dem vermutlich eine Rolle beim Wachstum neuer Blutgefäße und bei der Proliferation von Blutzellen zukommt. • T ipifarnib – Tipifarnib inhibiert die Aktivität der Farnesyltransferase, was seinerseits die Aktivierung des wachstumsfördernden ras-Gens verhindert. • T halidomid – Der Wirkmechanismus von Thalidomid wird nicht vollkommen verstanden, könnte jedoch mit der Suppression einer übermäßigen Produktion von TNF alpha und der „down-Modulation“ ausgewählter, an der Zelloberfläche exprimierter Adhäsionsmoleküle, die an der Migration weißer Blutkörperchen beteiligt sind, in Zusammenhang stehen. • PTK 787/ZK222582 – Dieser Wirkstoff hemmt die VEGF-Rezeptorkinase sowie weitere an der Angiogenese beteiligte Tyrosinkinasen. • D epsipeptid, SAHA, PXD101 – Diese Wirkstoffe inhibieren die Histondeacetylasen, die beim Assemblieren der DNA behilflich sind und die Genexpression regulieren. • D oxil – Durch seine Bindung an DNA und das Inhibieren der Nukleinsäuresynthese beeinträchtigt Doxil das Wachstum von Tumorzellen. • A plidin – Von diesem Präparat wird angenommen, dass es VEGF hemmt und die Apoptose induziert. • A rsentrioxid – Arsentrioxid hemmt direkt das Wachstum von Tumorzellen und führt den Zelltod herbei; es blockiert die Fähigkeit der Myelomzellen, sich an den Stromazellen des Knochenmarks „anzuheften“, indem es die Produktion von Adhäsionsmolekülen auf den Oberflächen beider Zelltypen inhibiert, und es blockiert die Absonderung von IL 6 und die Produktion von VEGF. • 1 7-AAG – 17-AAG [17-(Allylamino)-17-demethoxygeldanamycin] hemmt das Hitzeschockprotein HSP90, welches das Wachstum der Myelomzellen und ihr Überleben fördert. • C HIR-258 – CHIR-258 ist ein Inhibitor des FGF Rezeptors 3 (fibroblast growth factor), der das Zellwachstum und die Angiogenese reguliert. • A tiprimod – Atiprimod inhibiert IL 6, das für das Wachstum maligner Zellen ausschlaggebend ist, und hemmt außerdem die Knochenerosion. • SCI O-469 – SCIO-469 hemmt das Protein p38 MAP Kinase, das wiederum an der Produktion von IL 6 und VEGF beteiligt ist. • CCI -779 – Die Substanz inhibiert den mTOR Signalweg (mammalian target of rapamycin), der das Zellwachstum erleichtert. 19