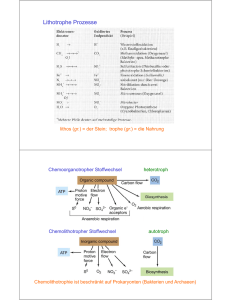
Allgemeine Mikrobiologie - Fuchs / Schlegel - Beck-Shop
Werbung

Allgemeine Mikrobiologie Begründet von Hans-Günter Schlegel von Georg Fuchs, Hans-Günter Schlegel überarbeitet Allgemeine Mikrobiologie – Fuchs / Schlegel schnell und portofrei erhältlich bei beck-shop.de DIE FACHBUCHHANDLUNG Thematische Gliederung: Medizinische Mikrobiologie, Virologie, Parasitologie Thieme 2006 Verlag C.H. Beck im Internet: www.beck.de ISBN 978 3 13 444608 1 Inhaltsverzeichnis: Allgemeine Mikrobiologie – Fuchs / Schlegel 14 Phototrophe Lebensweise Unter Phototrophie versteht man die Nutzung von Licht als Energiequelle. Die Energie des eingefangenen Sonnenlichts wird zum Aufbau eines Protonengradienten ber der Membran eingesetzt, der anschließend der ATP-Synthase zur ATPBildung dient (Elektronentransportphosphorylierung). Man nennt diesen Prozess auch Photophosphorylierung. Die phototrophen Bakterien gliedern sich in eine Gruppe von oxygenen Phototrophen, die Cyanobakterien, und mehrere Gruppen anoxygener Phototropher. Cyanobakterien verwenden als einzige Bakterien Wasser als Elektronendonator fr ihre Biosynthesen und entwickeln Sauerstoff als Produkt der Wasserspaltung. Die Phototrophie ist eine ursprngliche Entwicklung von Bakterien. Die Plastiden der verschiedenen Algengruppen und der Pflanzen stellen die endosymbiontisch lebenden Abkmmlinge cyanobakterieller Vorlufer mit stark reduzierten Genomen dar. Die photosynthetischen Systeme all dieser Organismen enthalten Chlorophylle bzw. Bakteriochlorophylle als wesentliche Pigmente, die fr die Energiekonservierung notwendig sind. Diese Pigmente finden sich dabei sowohl in lichteinfangenden Antennenkomplexen als auch in den energiekonservierenden Reaktionszentren der Photosynthese. Photosynthetische Reaktionszentren gibt es in zwei unterschiedlichen Typen, die als Photosystem I bzw. II bezeichnet werden. Der wesentliche Unterschied zwischen anoxygenen und oxygenen Phototrophen besteht darin, dass erstere jeweils nur einen Typ von Photosystem haben, whrend Cyanobakterien und Plastiden beide Photosysteme bentigen. Viele Phototrophe sind darber hinaus auch autotroph und nutzen CO2 als einzige C-Quelle; dabei werden unterschiedliche Stoffwechselwege zur CO2-Fixierung genutzt. Parallel zur (bakterio-)chlorophyll-basierten Phototrophie gibt es bei einigen prokaryontischen Gruppen auch unabhngig evolvierte Systeme mit Retinal als Pigment; Bakteriorhodopsin und Proteorhodopsin nutzen die Lichtenergie als lichtgetriebene Protonenpumpen. G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG berblick 14.1 Bedeutung und Prinzipien der Photosynthese . . . 407 14.1.1 Licht als Energiequelle und phototrophes Wachstum . . . 407 Prinzipien der Photosynthese . . . 407 14.1.2 14.2 Oxygene phototrophe Bakterien (Cyanobakterien) . . . 409 14.2.1 14.2.2 14.2.3 14.2.4 Vorkommen und Rolle von Cyanobakterien . . . 409 Stoffwechsel und Zellstruktur . . . 410 Morphologische Gruppen . . . 411 Zelldifferenzierungen . . . 413 14.3 Anoxygene phototrophe Bakterien . . . 413 14.3.1 Vorkommen und Rolle von anoxygenen phototrophen Bakterien . . . 415 Purpurbakterien und Grne Nicht-Schwefelbakterien (Photosysteme vom Typ II) . . . 417 Grne Schwefelbakterien und Heliobakterien (Photosysteme vom Typ I) . . . 419 14.3.2 14.3.3 14.4 Photosynthetische Pigmente und Thylakoide . . . 420 14.4.1 14.4.2 14.4.3 Chlorophylle und Bakteriochlorophylle . . . 420 Akzessorische Pigmente . . . 422 Thylakoide . . . 424 14.5 Antennenkomplexe . . . 424 14.5.1 14.5.2 14.5.3 LH I und II . . . 425 Chlorosomen . . . 425 Phycobilisomen . . . 426 14.6 Oxygene Photosynthese . . . 426 14.6.1 14.6.2 14.6.3 14.6.4 14.6.5 14.6.6 Die photosynthetische Redoxkette im berblick . . . 427 Photosystem II (Chinon-Typ) und Wasserspaltung . . . 428 Elektronentransportkette . . . 429 Photosystem I (FeS-Typ) und NADPH-Bildung . . . 430 Zyklische Photophosphorylierung . . . 430 Bilanz, Quantenbedarf und Wirkungsgrad der Lichtreaktion . . . 431 14.7 Anoxygene Photosynthese . . . 432 14.7.1 Gemeinsamkeiten und Unterschiede bei den anoxygenen Photosystemen . . . 432 Photosysteme vom Typ II (Chinon-Typ) und vom Typ I (FeS-Typ) . . . 434 14.7.2 14.8 Bakteriorhodopsin- und Proteorhodopsin-abhngige Photosynthese . . . 435 G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG 14.1 Bedeutung und Prinzipien der Photosynthese 14.1 Bedeutung und Prinzipien der Photosynthese Das Licht der Sonne stellt die wichtigste Energiequelle fr das Leben auf der Erde dar. Mehrere Gruppen von Organismen haben sich an die Nutzung von Licht als einziger Energiequelle angepasst, die Phototrophen. Sie stehen an der Basis der Nahrungsketten auf der Erde. Selbst die Mitglieder der wenigen sonnenlichtunabhngigen Lebensgemeinschaften, z. B. der erdwrmeabhngigen „Schwarze Raucher“-Systeme der Tiefsee (Kap. 17.9.2), bentigen photosynthetisch erzeugten Sauerstoff fr ihre Atmung. Diese Bezge wurden bereits in Kapitel 1.6 dargestellt. 14.1.1 Licht als Energiequelle und phototrophes Wachstum Die Umwandlung der Lichtenergie in chemische Energie ist einer der bedeutsamsten biologischen Prozesse, der frh in der Evolution entstanden ist. Bei allen photosynthetisch aktiven Organismen sind dabei die gleichen Grundprinzipien zu finden. Auch die beteiligten Pigmente und Membranproteinkomplexe, die fr die Energiekonversion notwendig sind, sind in ihrem Grundaufbau hnlich. Eine Unterscheidung der phototrophen Organismen wird danach getroffen, ob sie bei der Photosynthese Sauerstoff aus Wasser freisetzen (oxygene Photosynthese) oder nicht (anoxygene Photosynthese). Alle phototrophen Eukaryonten (Pflanzen und Algen) sowie die Cyanobakterien betreiben oxygene Photosynthese. Die restlichen bakteriellen Gruppen von Phototrophen sind anoxygen und stellen Relikte aus der sauerstofffreien Urzeit dar. Das sptere Zusammenfhren der beiden Photosysteme und die Erfindung der Wasserspaltung gekoppelt an ein Photosystem ist eines der folgenreichsten Ereignisse der Evolution. Ihr verdanken wir den Sauerstoff der Atmosphre (Plus 14.1). Die oxygene Photosynthese der Cyanobakterien war Grundlage der erfolgreichen Endosymbiose mit dem Vorlufer der Pflanzen. Die Symbiose von Grnalgen oder Cyanobakterien mit Pilzen hat zur Lebensform der photosynthetisierenden Flechten gefhrt. 14.1.2 407 Plus 14.1 Wasserspaltung: Segen und Fluch der Evolution Die Erfindung der Wasserspaltung zur Gewinnung von Reduktionsquivalenten fr die CO2-Fixierung hatte zwei gewaltige Auswirkungen auf die Evolution. 1. Die oxygene Photosynthese ermglichte die Verwendung eines universellen und in unbegrenzten Mengen vorkommenden Elektronendonators (H2O) und entwickelte sich zum haupschlichen primren Produktionsprozess. 2. Gleichzeitig schuf sie Sauerstoff, Gift fr die bis dahin anoxisch lebenden Bakterien. An diese „Umweltkatastrophe“ mussten sie sich anpassen, oder sie starben aus; eine Herausforderung! Die oxygene Photosynthese hat sich vor etwa 2,7 Milliarden Jahren entwickelt. Der dabei entstehende Sauerstoff reicherte sich allmhlich in der Atmosphre und dann auch in den Gewssern an, sodass vor etwa 550 Millionen Jahren die heutige Konzentration von 20 % erreicht war, die eine explosionsartige Zunahme eukaryontischer Lebewesen und die Landbesiedlung der Pflanzen ermglichte. Prinzipien der Photosynthese Die Chloroplasten, die Organellen der Photosynthese in Algen und Pflanzen, haben ihren Ursprung in den Cyanobakterien. Deshalb ist der Photosyntheseprozess in diesen Organellen und in Cyanobakterien sehr hnlich und vergleichbar (Plus 14.2). Photosynthese war ursprnglich definiert als lichtabhngige CO2-Fixierung (Assimilation in Strke), die gekoppelt ist mit der Entwicklung von Sauerstoff. Man hat spter erkannt, dass hierfr zwei getrennte Prozesse verantwortlich sind (Abb. 14.1): In einer Lichtreaktion wird Wasser gespalten, der Sauerstoff wird freigesetzt und der Wasserstoff auf NADP+ bertragen. Gleichzeitig wird ATP aus ADP und Pi gebildet. Diese Lichtreaktion wird heute als Photosynthese bezeichnet. In einer Dunkelreaktion wird CO2 gebunden und mit NADPH unter ATPVerbrauch zu Kohlenhydrat reduziert. Sie ist mit der Lichtreaktion durch den Bedarf an ATP und NADPH verbunden. Wir besprechen hier die Lichtreaktion. Der Photosyntheseapparat ist membrangebunden und besteht aus Lichtsammel- oder Antennenkomplexen, dem oder den Reaktionszentren, einer Protonen transduzierenden Elektronentransportkette und einer H+-ATP-Synthase. In den Antennenkomplexen wird Lichtenergie absorbiert. Die entstehenden kurzlebigen angeregten Moleklzustnde wan- G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG Lichtreaktion hν 2 H 2O O2 2 NADP Dunkelreaktion + 2 NADPH + H + 3 ADP + 3 Pi 3 ATP 9 ADP + 8 Pi 9 ATP 6 NADP+ 6 NADPH + H+ Triosephosphat + 3 H 2O Abb. 14.1 Licht- und Dunkelreaktion der Photosynthese (aus Doenecke et al., 2005). 3 CO2 408 14 Phototrophe Lebensweise Plus 14.2 Chloroplasten Chloroplasten sind die Organellen der Photosynthese grner Pflanzen. Sie sind von einer doppelten ußeren Membran umhllt, die sie gegen das Cytoplasma der Pflanzen- bzw. Algenzelle abgrenzt (Abb.). Die innere Membran entspricht der Membran des endosymbiontischen Cyanobakteriums. Der Innenraum wird Stroma genannt; hier finden wir typisch bakterielle Bestandteile und Stoffwechselleistungen: plastidre DNA, den plastidren Proteinsyntheseapparat, die Enzyme der CO2-Fixierung, der Strkesynthese und der Fettsuresynthese sowie der Sulfat- und Nitrat-Assimilation (ausgenommen die Nitrat-Reduktase). Das Stroma ist durchzogen von in sich geschlossenen sackartigen Thylakoidmembranen. In diesen sind die Multi-Enzym-Komplexe der Lichtreaktionen und der ATP-Synthase-Komplex lokalisiert, zu denen ADP, Phosphat sowie NAD(P)+ freien Zugang haben. Die Membranen lagern sich oft zu Stapeln zusammen, die sich nach Aufschluss der Chloroplasten als Grana isolieren lassen. Die Thylakoidmembranen umschließen einen Innenraum, der Lumen genannt wird. Dieser proteinfreie Raum entspricht dem Außenraum und in ihm finden keine Synthesen statt. Zwischen Lumen und Stroma bildet sich im Fließgleichgewicht der Photosynthese ein pH-Gradient aus (sauer im Lumen, also „außen“), der die ATP-Synthese treibt. Chloroplast äußere Membran innere Membran Aufbau eines Chloroplasten grner Pflanzen und Algen. Whrend der Evolution entwickelte sich die ußere Membran aus einer Membran der Eukaryonten, die innere aus einer Membran des endosymbiontischen Cyanobakteriums, sie entspricht dessen Cytoplasmamembran. Aus ihr leiten sich die Thylakoide von Chloroplasten und Cyanobakterien ab, wie im Schema angegeben. PS, Photosystem. Cytoplasma H+ Stroma H+ H+ H+ H+ H+ hν PS 2H2O H+ O2 ADP H+ ATP Thylakoidlumen Thylakoidmembran dern zum Reaktionszentrum. Dort bewirkt die Anregungsenergie einen photochemischen Prozess. Bei dieser Photoreaktion wird ein Pigment oxidiert, was sich an der kurzfristigen nderung seiner Farbe bemerkbar macht; d. h. sein Absorptionsmaximum ndert sich, was experimentell gemessen werden kann (es wird „gebleicht“). Gleichzeitig kommt es zu einer Ladungstrennung ber die Membran: Pigment P + hn + Akzeptor A p Pigment+ + Akzeptor– Das Donatorsystem (P/P+) hat ein positives, das Akzeptorsystem (A/A–) ein negatives Potenzial. Das dem Pigment P im Reaktionszentrum („primrer Donator“) entzogene Elektron wird durch die Lichtenergie sehr rasch (in ps) auf einen „primren Akzeptor A“ mit sehr negativem Redoxpotenzial bertragen. Diese Ladungstrennung wird stabilisiert, indem das Elektron von dort rasch auf weitere Elektronenakzeptoren mit positiverem Redoxpotenzial gelangt. Die Rckreaktion, d. h. die Ladungsrekombination, verluft um Grßenordnungen langsamer. Die Chloroplasten der grnen Pflanzen und Algen verwenden wie deren Vorlufer, die Cyanobakterien, zwei Photosysteme, die durch eine Elektronentransportkette miteinander verbunden sind. Hier dient die Wasserspaltung der Reduktion des durch Licht oxidierten Photosystems II, wobei Sauerstoff entsteht (oxygene Photosynthese). Die Elektronen fließen vom reduzierten Elektronenbertrger des Photosystems II auf ein weiteres Photosystem I. Von dort werden sie durch eine zweite Lichtreaktion schließlich auf NADP+ bertragen. Das Hintereinanderschalten der beiden Photosysteme sorgt also dafr, dass am System II ein sehr starkes Oxidationsmittel zur Oxidation des Wassers und am System I ein sehr starkes Reduktionsmittel zur Reduktion von NADP+ erzeugt wird. G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG 14.2 Oxygene phototrophe Bakterien (Cyanobakterien) 409 Bei der anoxygenen Photosynthese wird nur ein Photosystem vom Typ II oder I verwendet. Vom reduzierten Elektronenbertrger fließen hier die Elektronen in einem zyklischen Elektronentransport wieder zurck zum oxidierten Pigment im Reaktionszentrum, das in den Ausgangszustand rckversetzt wird. Der lichtgetriebene Elektronentransport dient hier nur der Energiegewinnung. Reduktionsquivalente fr die CO2-Fixierung werden durch Oxidation anorganischer oder organischer Verbindungen bereitgestellt. Der Elektronentransport ist mit einem Protonentransport durch die Membran gekoppelt. Der so erzeugte Protonengradient dient der ATPSynthese. Redoxkette, Protonentransport und ATP-Synthese haben große hnlichkeiten mit den Vorgngen in der Atmungskette. 14.2 Oxygene phototrophe Bakterien (Cyanobakterien) Cyanobakterien reprsentieren die grßte, formenreichste und am weitesten verbreitete Gruppe von phototrophen Bakterien. Sie wurden flschlicherweise auch Blaualgen genannt, denn es sind typische Prokaryonten und keine Algen. Wie ihr Name sagt, sind sie meist blaugrn (Phycocyanine, Kap. 14.4.2), einige sind rotbraun (Phycoerythrine, Kap. 14.4.2) oder schwarzgrn. Cyanobakterien betreiben als einzige Bakteriengruppe eine oxygene Photosynthese und sind damit nicht an begrenzt verfgbare Elektronendonatoren fr die Kohlenstoffassimilation aus CO2 angewiesen. Diese Tatsache, aber auch ihre lange Evolution, erklren ihre weite Verbreitung. 14.2.1 Vorkommen und Rolle von Cyanobakterien Ihre Befhigung, an extremen Standorten zu wachsen und oft auch N2 fixieren zu knnen, gibt Cyanobakterien eine große Bedeutung im Naturhaushalt. Sie bernehmen an nhrstoffarmen oder extremen Standorten oft die Rolle von Pionieren. Man kann sie im Fluoreszenzmikroskop leicht als rot fluoreszierende Bakterien (Chlorophyll-a-Fluoreszenz) von anderen Bakterien unterscheiden, neben den ebenfalls rot fluoreszierenden, aber meist grßeren Algen. Unter gnstigen Entwicklungsbedingungen knnen sie ganze Matten bilden (z.B. Stromatolithen, Kap. 1.4, s. auch Abb. 17.19, S. 563). In aeroben Bereichen des Sßwassers und in den Ozeanen sind sie, neben den Algen, die wesentlichen Primrproduzenten. Da viele Vertreter von ihnen Stickstoff fixieren knnen, gewinnen sie unter Stickstofflimitierung, wenn Nitrat oder Ammaniak nur in kleinsten Konzentrationen vorhanden sind und deshalb das Wachstum begrenzen, im Licht sogar die berhand. Unter diesen Bedingungen knnen Cyanobakterien sich in Massen vermehren und blaugrne Teppiche an der Wasseroberflche bilden, wenn das sonst wachstumsbegrenzende Element Phosphor in Gewsser eingetragen wird oder zu bestimmten Jahreszeiten mit dem nhrstoffreichen Tiefenwasser nach oben gelangt (Abb. 14.2, Abb. 14.4a) (s. auch Kap. 17.9.1). In tropischen Gebieten lsst sich Spirulina maxima in Massen zur Gewinnung von Tierfutter und Eiweiß zchten. Auch fr die Teichwirtschaft ist eine solche Massenentwicklung („Wasserblte“) erwnscht. Bei der Trinkwassergewinnung ist dagegen Wasserblte gefrchtet, da einige Arten wie Microcystis sp. („Netzblaualge“) Toxine, andere erdig schmeckende Stoffe (Geosmin) bilden. G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG Abb. 14.2 Wasserblte in einem eutrophierten See. Es handelt sich um fdige Cyanobakterien, deren Zellaggregate mit der Hand „gefischt“ werden knnen. 410 14 Phototrophe Lebensweise Man findet Cyanobakterien auch auf und in feuchtem Boden, sie bilden Krusten auf Gestein (z. B. sog. „Tintenstriche“ an feuchten Felswnden), und sie leben selbst wenige Millimeter unter der Oberflche von feuchten porsen Gesteinen (endolithisch, der Tau in Wstengegenden gengt zum Leben!). Einige einzellige Cyanobakterien wie Synechococcus lividus sind so sure- und hitzetolerant, dass sie in sauren heißen Quellen (pH 4, 70 hC) wachsen (Abb. 14.9, S. 416, Abb. 17.18, S. 560 und Box 14.1, S. 417). Manche Cyanobakterien gehen Symbiosen ein (Abb. 14.3). Sie versorgen den Wirt mit organischen Verbindungen (einige tropische Blattflechten) oder mit gebundenem Stickstoff, wie im Fall der Hornmoose, der Palmenfarne (Cycadaceae) und der Bltenpflanze Gunnera, sowie des tropischen Wasserfarns Azolla. Letzterer dient der Grndngung von Reisfeldern. 14.2.2 Stoffwechsel und Zellstruktur Cyanobakterien sind photolithoautotroph und ihr Stoffwechsel folgt einem Tag-Nacht-Rhythmus (circadiane Rhythmik). Sie besitzen Photosystem I und II und verwenden Wasser als Elektronendonator fr die autotrophe CO2-Fixierung ber den Calvin-Zyklus (Tab. 14.1). Einige Arten knnen aber auch mit H2S als Elektronendonator eine anoxygene Photosynthese (nur Photosystem I) betreiben, und nur wenige sind fakultativ chemotroph. Die mehrschichtige Zellwand enthlt Murein, Lipopolysaccharide, Proteine und Polysaccharide und ist oft von Schleim oder einer Kapsel berlagert. Ihre Membranlipide enthalten mehrfach ungesttigte Fettsuren (vgl. Chloroplasten!), eine Besonderheit unter den Bakterien. Auffallend sind die umfangreichen Thylakoidmembranen mit Phycobilisomen als Lichtantennen (Kap. 14.5.3). Die lamellaren Thylakoidmembranen bilden ein Netzwerk, das auf den peripheren Teil der Zelle begrenzt ist. Es ist wahrscheinlich nicht mit der Cytoplasmamembran verbunden, obwohl es aus ihr ursprnglich entstanden ist. Beide Membransysteme enthalten den Photosyntheseapparat und die Atmungskette. b a Cyanobakterien c Abb. 14.3 Beispiele fr Symbiosen von Cyanobakterien. a Im Thallus von Hornmoosen. b In den Korallenwurzeln des Palmfarns Cycas. c In den Blttern des Wasserfarns Azolla. d In der Blattbasis am Rhizom der Bltenpflanze Gunnera (Aufnahmen b–c G. Fuchs). G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG d 14.2 Oxygene phototrophe Bakterien (Cyanobakterien) 411 Tab. 14.1 Eigenschaften phototropher Bakterien. Cyanobakterien Purpurbakterien Grne Schwefelbakterien Grne NichtSchwefelBakterien Heliobakterien PS-Typ PS I + II PS II PS I PS II PS I Pigmente Chl a (b) BChl a,b BChl a,c (d,e) BChl a,c BChl g Antennen Phycobilisomen Thylakoide LH I + LH II Intracytoplasmatische Membranen Chlorosomen Chlorosomen ?? Autotroph + (+) + +/- - (?) Ernhrungsweise photoautotroph lithoautotroph photoautotroph lithoautotroph organoheterotroph photoautotroph lithoautotroph photoautotroph lithoautotroph organoheterotroph photoautotroph organoheterotroph CO2-Fixierung Calvin-Zyklus Calvin-Zyklus Reduktiver TCA-Zyklus HydroxypropionatZyklus Keine ? Elektronendonator H2O H2S/organische Verbindungen H2S H2/organische Verbindungen Organische Verbindungen Fakultativ chemotroph (+) +/- - + - Man findet bei Cyanobakterien hufig Carboxysomen, phagenkopfhnliche Einschlusskrperchen, in denen die Enzyme der CO2-Fixierung kristallin vorliegen (Kap. 5.11). Canobakterien besitzen keine Flagellen, aber viele fadenbildende Arten knnen sich auf festen Oberflchen oder in Bakterienmatten gleitend fortbewegen und zeigen phototaktisches Verhalten. Gasvakuolen erlauben ihnen, sich an der Oberflche oder in geeigneten Wassertiefen zu halten. Sie bilden neben Strke und Polyphosphat hufig in großen Mengen Cyanophycin (Poly-(Asp-Arg)) als Speicherstoffe (Kap. 8.7.6). Der Proteinspeicher dient als Stickstoffspeicher, aber auch als bescheidener Energiespeicher: Arginin kann in Ornithin und Carbamoylphosphat gespalten werden, und letzteres ermglicht selbst unter anoxischen Bedingungen ATP-Bildung durch Substratstufenphosphorylierung (Carbamoylphosphat + ADP p CO2 + NH3 + ATP). 14.2.3 Morphologische Gruppen Cyanobakterien sind zwar hinsichtlich ihres Stoffwechsels recht einheitlich und bilden eine natrliche Gruppe; dafr ist ihre Biologie und Morphologie umso vielseitiger (Abb. 14.4). Ihre Einteilung in fnf morphologische Gruppen deckt sich nur bedingt mit ihrem Stammbaum. 1. Einzellige Formen (Stbchen oder Kokken) mit gewhnlicher Zellteilung sind phylogenetisch sehr divers. Man findet sie in den Gattungen Synechococcus (= “Anacystis“), Gloeocapsa („Hllenblaualge“; gloios, gr.: klebrige Masse) oder Synechocystis. Die Zellen bilden meist Kolonien oder tafelfrmige Platten, die teilweise mit bloßem Auge sichtbar sind, sie werden durch Kapseln oder Schleimsubstanzen („Gallerte“) zusammengehalten (Abb. 14.5). G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG 412 14 Phototrophe Lebensweise a b Abb. 14.4 Cyanobakterien. a Wasserblte in einem eutrophierten See, die im wesentlichen aus Cyanobakterien (Microcystis sp.) besteht (Aufnahme J. Weekesser). b Mikroskopisches Bild einer Probe aus einer Wasserblte. Man erkennt mindestens drei koloniebildende Arten. c Cyanobakterien in Laborkulturen. Die Farben knnen je nach Chromophoren von grn bis blau ber rot bis gelb variieren (Quelle: www.labor-spiez.ch). c 2. Cyanobakterien mit multipler Teilung innerhalb einer Zelle findet man in den Gattungen Pleurocapsa („Krustenalge“) und Dermocapsa. Es entstehen viele kleine Zellen innerhalb einer Hlle. Die folgenden Gruppen bilden Zellfden, Trichome. Die Einzelzellen sind durch Plasmodesmen miteinander verbunden. Die Zellteilung erfolgt innerhalb des Fadens und die Trichome knnen sich gleitend auf Oberflchen bewegen oder schwingende Bewegungen ausfhren. Die Vermehrung erfolgt durch Zerbrechen der Fden in sog. Hormogonien. 3. Recht stattliche Cyanobakterein mit teilweise auffallendem Aussehen, die Scheiden ausbilden und keine Heterocysten haben, finden sich in den Gattungen Oscillatoria („Schwingalge“), Trichodesmium, Phormidium („Hutchenblaualge“) und Spirulina („Schraubenzieheralge“). Oscillatoria princeps misst bis zu 60 mm im Durchmesser. Gloeobacter Synechococcus Gloeothece Gloeocapsa Anabaena Dermocarpa Nostoc Cylindrospermum Abb. 14.5 Einige Cyanobakterien aus verschiedenen Verwandtschaftsgruppen und mit verschiedener Morphologie. Symbole: dick gezeichnete Zellwnde und polare Granula kennzeichnen Heterocysten; ausgefllte Zellen markieren Akineten (Dauerzellen); dnne Linien außerhalb der Trichome kennzeichnen Scheiden. Spirulina Calothrix Oscillatoria Lyngbya G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG Fischerella 14.3 Anoxygene phototrophe Bakterien 4. Eine große Gruppe bilden fdige Cyanobakterien ohne Scheiden, die Heterocysten ausbilden und N2 fixieren, darunter die Gattungen Nostoc („Zitter- oder Gallertalge“, Nostoc commune, Engelsschnutze (!) oft am Wegrand zu sehen), Anabaena („Ringelalge“), Lyngbia („Scheidenblaualge“) und Scytonema („Tintenstrichalge“). 5. Verzweigte, filamentbildende Vertreter, teilweise mit Heterocysten, sind Stigonema („Lagerblaualge“) und Fischerella sp. Eine Besonderheit sind die „Prochlorophyten“, mit den fdigen Prochlorothrix und den kugelfrmigen Prochlorococcus als typischen Vertretern. Prochlorococcus sp. stellen in den Ozeanen einen wichtigen Anteil am Phytoplankton (104 – 105 Zellen/ml). Es handelt sich um phototrophe Bakterien, die wie die Chloroplasten der Pflanzen Thylakoidstapel ausbilden und (ein modifiziertes) Chlorophyll a und Chlorophyll b besitzen, whrend verwandte Cyanobakterien nur Chlorophyll a besitzen. Sie besitzen auch keine Phycobilisomen. Wegen des Vorkommens von Chlorophyll b hat man anfangs in ihnen das „missing link“ zwischen den Cyanobakterien und den Chloroplasten gesehen; es handelt sich aber nicht um die direkten Vorlufer der Chloroplasten (Plus 14.3). Vielmehr haben Cyanobakterien einschließlich Prochlorophyten und Chloroplasten einen gemeinsamen Vorlufer. Ein lebender naher Cyanobakterienverwandter der Chloroplasten wurde bisher nicht gefunden. 14.2.4 Zelldifferenzierungen In dieser großen Bakteriengruppe beobachtet man auch besondere Zelldifferenzierungen und Strukturen (Abb. 14.6). Akineten sind dickwandige, große und stark gefrbte Dauerzellen in einem Zellfaden, die der berdauerung dienen. Heterocysten sind ebenfalls dickwandige, aber farblose oder gelbliche Zellen in einem ansonsten blaugrnen Zellfaden. Sie fixieren N2 und versorgen die Nachbarzellen mit gebundenem Stickstoff (Glutamin) im Gegentausch mit Disacchariden. Sie besitzen kein Photosytem II und entwickeln deshalb auch keinen Sauerstoff (Kap. 8.4.1). Hormogonien sind Bruckstcke von Zellfden, die der Verbreitung dienen. Baeocyten nennt man Zellpakete, die nach vielfacher Zellteilung in einer Ursprungszelle entstehen (Pleurocapsales). 14.3 Anoxygene phototrophe Bakterien Es gibt mehrere nicht nher verwandte Bakteriengruppen, welche die Fhigkeit zur anoxygenen Photosynthese entwickelt haben (Abb. 14.7). Die Vertreter der verschiedenen Gruppen unterscheiden sich dabei in einigen grundlegenden Eigenschaften. Zum Beispiel kommen unter anderem zwei verschiedene Typen von photosynthetischen Reaktionszentren vor (Photosystem-I-bzw. II-Typ, Tab. 14.1). Deshalb geht man davon aus, dass die Photosynthese sich frh in getrennten Linien weiterentwickelt hat und darber hinaus durch lateralen Gentransfer in weitere Bakteriengruppen gelangt ist. Die anoxygenen phototrophen Bakterien sind auf einen externen Wasserstoffdonator angewiesen. Sie vermgen anorganische Verbindungen wie H2, H2S, S, H2S2O3 (Thiosulfat) oder Fe2+ sowie organische Verbindungen wie beispielweise Grprodukte und sogar Aromaten zu verwerten. Diese Verbindungen stehen nur in begrenzter Menge und bevorzugt unter anoxischen Bedingungen zur Verfgung (deshalb auch das begrenze G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG 413 Plus 14.3 Prochloron und Cyanophora paradoxa Prochloron sp. wurde als erster Vertreter der Prochlorophyten als Symbiont von marinen Seescheiden entdeckt. Es ist ein recht großes phototrophes, derzeit noch nicht kultivierbares Bakterium mit ausgeprgten intracytoplasmatischen Membranen. Cyanophora paradoxa ist eine Sßwasseralge (Glaucocystophyt), die sog. Cyanellen enthlt und von deren Photosyntheseprodukten lebt. Die Cyanellen haben noch viele Eigenschaften von Cyanobakterien erhalten, wie cyanobakterienhnliche Thylakoide und Photosyntheseapparat, Reste der Peptidoglycanschicht und ein kleines Genom (etwa 10 % des Genoms verwandter Cyanobakterien). Es sind obligate Endosymbionten, die aber eine gemeinsame Wurzel mit den Chloroplasten haben. 414 14 Phototrophe Lebensweise Abb. 14.6 Akineten, Heterocysten und Hormogonien von Cyanobakterien. Deferribacter Flavobakterien Spirochäten Deinococci grüne Nicht-Schwefelbakterien Thermotoga Thermodesulfobacterium Aquifex grüne Schwefelbakterien Cytophaga Planctocymes/Pirella Verrucomicrobien Chlamydien Cyanobakterien Actinobakterien Heliobakterien Nitrospira Purpurbakterien α Nicht-Schwefelβ purpurbakterien γ Schwefelpurpurbakterien Abb. 14.7 Stammbaum der Eubakterien mit Gruppen, die phototrophe Bakterien beherbergen. Vorkommen dieser Organismen). Nur unter anoxischen Bedingungen betreiben sie Photosynthese mit Hilfe von Bakteriochlorophyllen (Ausnahmen von der anaeroben Lebensweise, siehe aerobe Photosynthese, unten). G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG 14.3 Anoxygene phototrophe Bakterien 14.3.1 Vorkommen und Rolle von anoxygenen phototrophen Bakterien Anoxygene phototrophe Bakterien kommen in der anoxischen Zone vieler Gewsser vor, sie bilden oft lachsfarbene bis dunkelweinrote Belge ber dem Schlamm oder faulendem Pflanzenmaterial (Abb. 14.8). In solchen manchmal dezimeterdicken Schichten ber dem Schlammhorizont findet man Schwefelpurpurbakterien (Chromatiaceae), darunter riesengroße Arten wie Chromatium okenii oder Thiospirillum jenense (s. Abb. 14.9). Diese auffallend purpurfarbenen Chromatien oxidieren im Licht rasch H2S zu Schwefel, den sie intrazellulr in großen Mengen als stark lichtbrechende Kgelchen ablagern. Der Schwefel dient als gespeichertes Reduktionsmittel (Weiteroxidation: S + 4 H2O p H2SO4 + 6 H) und ermglicht die Assimilation von CO2 im Licht auch ohne ußeren Elektronendonator. Die Oxidation der reduzierten Schwefelverbindungen H2S, H2S2O3 (Thiosulfat) und Schwefel wird in Kapitel 11 besprochen. Licht und hohe Sulfidkonzentration findet man auch in flachen Meerwassertmpeln, in denen starke Sulfatreduktion stattfindet, sowie in Schwefelquellen. Die Grnen Schwefelbakterien, aber auch verschiedene Schwefelpurpurbakterien, kommen in der Natur meist streng geschichtet vor, dort wo H2S vorhanden und noch ausreichend Licht zur Verfgung steht. Dagegen sind die fakultativ photoorganotrophen Purpurbakterien ubiquitr in oxischen und anoxischen Bereichen von Gewssern und Bden mit organischen Stoffen. Man findet anoxygene phototrophe Bakterien auch unter Wasserlinsendecken, die sozusagen als optische Filter denjenigen Lichtanteil bereits herausgefiltert haben, der fr das Algenwachstum ntzlich ist (s. Abb. 17.11, S. 547). Jahreszeitlich bedingt kommt es zur Massenentwicklung von Schwefelpurpurbakterien in der anoxischen Zone von Seen unterhalb der Temperatur-Sprungschicht (oder Chemokline, s. Kap. 17.9.1, Plus 17.9, S. 545). Dort stehen H2S, CO2 und organische Verbindungen aus dem anaeroben Stoffwechsel anderer Bakterien zur Verfgung. In Tiefen von 10–30 m dringt kaum Infrarotlicht durch, sondern nur noch etwas Blau- und Blaugrnlicht (450–500 nm) (s. Abb. 14.13, S. 420). Gerade in diesem Wellenlngenbereich absorbieren die tiefrotgefrbten Carotinoide der Purpurbakterien, die ihnen ihre charakteristische Farbe verleihen. Einige Arten knnen an solchen ihnen zusagenden Standorten nahezu in Reinkulturen vorliegen. Unter den Grnen Schwefelbakterien findet man dort entsprechend die carotinoidreichen, braungefrbten Arten. Eine Besonderheit stellen die anoxygenen aeroben phototrophen Bakterien dar. Es sind meist marine, organotrophe alpha-Proteobakterien wie Roseobacter sp. oder Erythrobacter sp., die zwischen Algen leben. Sie besitzen – anders als die typischen Purpurbakterien – nur geringe Menge an Photosyntheseapparat mit Typ-II-Reaktionszentrum. Sie betreiben eine obligat aerobe Photosynthese (Photophosphorylierung) mit Bakteriochlorophyll a und sind deshalb streng aerob. Licht, Sauerstoff und organische Ausscheidungsprodukte der Algen geben ihnen einen Selektionsvorteil. Weitere kologische Zusammenhnge werden in Kapitel 17.9.1 besprochen. Fr eine Anreicherung der Purpurbakterien werden deren verschiedene Absorptionsspektren ausgenutzt (Box 14.1). Viele anoxygene phototrophe Bakterien zeigen auch im Dunkel der Nacht bescheidenes Wachstum und berleben, wenn ihnen organische Substrate zur Verfgung stehen. Sie greifen dazu auch auf die im Licht angelegten Speicherpolymere zurck. G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG 415 416 14 Phototrophe Lebensweise Purpurbakterien Faulschlamm Zucker Purpurbakterien, Algen, Cyanobakterien H2S Sulfatreduktion, Eiweißzersetzung H2S organische Säuren (Acetat, Propionat, Butyrat, CH4, H2) Abb. 14.8 Rand eines flachen Gewssers, in dem Schwefelpurpurbakterien zur Massenentwicklung kommen. Erklrung im Text. Chromatium vinosum Thiocystis violacea Thiospirillum jenense Chromatium okenii Chromatium warmingii Thiocystis gelatinosa Lamprocystis Thiodictyon Thiopedia Amoebobacter Rhodospirillum rubrum Rhodobacter sphaeroides G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG Abb. 14.9 Einige Schwefel-Purpurbakterien (Chromatiaceae) und Nicht-Schwefelpurpurbakterien (Rhodospirillaceae). 14.3 Anoxygene phototrophe Bakterien 14.3.2 417 Purpurbakterien und Grne Nicht-Schwefelbakterien (Photosysteme vom Typ II) Man kennt zwei natrliche Gruppen anoxygener phototropher Bakterien, deren Vertreter ein Photosystem II – allerdings ohne Wasserspaltungskomplex – besitzen, die Proteobakterien (Purpurbakterien) und die Grnen Nicht-Schwefelbakterien. Purpurbakterien Die photosynthetisierenden Proteobakterien nennt man auch Purpurbakterien. Ihre Bezeichnung geht auf die purpurrote (aber auch brunliche bis gelbliche) Frbung dichter Kulturen (Abb. 14.10) zurck, die durch den hohen Gehalt an Carotinoiden bedingt ist. Nach ihrem Stoffwechsel teilt man sie in zwei Gruppen ein, die Schwefelpurpurbakterien und die Box 14.1 Anreicherungskultur Die unterschiedlichen Absorptionseigenschaften der verschiedenen anaeroben phototrophen Bakterien ist die Voraussetzung dafr, dass sie verschiedene spektrale Anteile des Lichtes zur Photosynthese zu nutzen vermgen. Bei der Anreicherung nutzt man die Anpassung dieser Organismen an bestimmte Lichtverhltnisse (Intensitt, Wellenlnge) aus. Hinzu kommen andere Faktoren wie der H2S-Gehalt, andere Wasserstoffdonatoren, pH-Wert, Temperatur, organische C-Quellen oder CO2, sowie das Vorhandensein einiger Vitamine, insbesondere Vitamin B12, aber auch Biotin, Thiamin oder 4-Aminobenzoat. Als Inokulum verwendet man Teichschlamm oder Teichwasser (Abb.). Wird ein mit Eiweiß, Erde und Sand beschichteter Zylinder mit Wasser gefllt und mit Standortmaterial beimpft, so kommen im nahen Infrarotlicht Nicht-Schwefelpurpurbakterien zum Wachstum (Kap. 17.9.1). Das Eiweiß wird von anderen Bakterien vergoren und von den Grprodukten und Licht leben die Purpurbakterien. Ein Zusatz von Calciumsulfat (Gips) sorgt dafr, dass Sulfatreduzierer H2S in hohen Konzentrationen bilden. Dadurch wird das Wachstum der Nicht-Schwefelpurpurbakterien unterdrckt (sie tolerieren nur geringe H2S-Konzentrationen I 0.01 %) und photolithoautotrophe Schwefelpurpurbakterien dominieren (sie bentigen H2S und tolerieren hohe H2S-Konzentrationen). In synthetischen, Vitamin B12 und andere Vitamine enthaltenden Nhrlsungen mit verschiedenen Wasserstoffdonatoren lassen sich durch feine Abstufungen der H2S- und Nhrsalzkonzentration, des pH-Wertes, der Temperatur und der Lichtintensitt viele verschiedene Arten der Purpurbakterien sowie Arten der strikt anaeroben grnen Bakterien anreichern. Phototrophe, die am Grund tiefer Gewsser leben, haben hufig Gasvakuolen und verlangen niedrige H2S-Konzentrationen, Klte und Schwachlicht. Im Extremfall gengt so wenig Licht, wie durch ein Schlsselloch in einen dunklen Raum fllt. 800 – 900 nm 900 –1100 nm 800 –900 nm 720 –770 nm Bakterienplatte Anreicherungskulturen („WINOGRADSKYSulen“) von phototrophen Bakterien. Oben ist der spektrale Durchlssigkeitsbereich von Lichtfiltern angegeben, hinter denen sich die benannten Bakterienarten und -gruppen bevorzugt entwickeln. Einige Tage nach dem Ansetzen der Kultur und Beimpfung mit Teichschlamm und -wasser bilden sich rote bzw. grne „Bakterienplatten“ in der Wassersule. organische Verbindungen H2S Sand Faulschlamm, Gips, Erde Erde Eiweiß Nicht-Schwefelpurpurbakterien Rhodospirillum rubrum Rhodopseudomonas viridis G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG Schwefelpurpurbakterien Grüne Schwefelbakterien 418 14 Phototrophe Lebensweise a b Abb. 14.10 Purpurbakterien. a Rand einer warmen Quelle, in der verschiedene phototrophe Bakterien zur Massenentwicklung kommen und dnne Schichten ausbilden. b Laborkulturen von Purpurbakterien (Aufnahmen G. Fuchs). Nicht-Schwefelpurpurbakterien (Tab. 14.1). Der Photosyntheseapparat ist auf intracytoplasmatischen Membranen lokalisiert (Kap. 14.3.3), nur bei wenigen Arten ist er auf die Cytoplasmamembran beschrnkt. Bei allen Vertretern ist das Reaktionszentrum vom Typ II und wird von einem zylindrisch geformten Antennenkomplex (LH I, Kernkomplex oder core complex) umgeben. Ein zweiter variabler Antennenkomplex (LH II) kann in Abhngigkeit von der Lichtintensitt in variablen Mengen vorhanden sein (Kap. 14.5.1). Alle Vertreter besitzen Bakteriochlorophyll a oder b und knnen N2 fixieren. Autotrophe Vertreter fixieren CO2 ber den Calvinzyklus. Die Purpurbakterien stehen im natrlichen Stammbaum neben nichtphototrophen Vertretern der Proteobakterien. Ob die Photosynthese eine ursprngliche Eigenschaft des gemeinsamen Vorfahren aller Proteobakterien war, ist unentschieden. Die Schwefelpurpurbakterien sind obligat phototroph und bentigen reduzierte Schwefelverbindungen als Elektronendonatoren eines photolithotrophen Stoffwechsels. Schwefelwasserstoff wird intermedir zu Schwefel oxidiert und dieser wird gespeichert. Sie gehren zur gammaSubklasse der Proteobakterien. Typische Gattungen sind Chromatium mit intrazellulrer Schwefelspeicherung und Ectothiorhodospira mit extrazellulrer Schwefelablagerung. Die Nicht-Schwefelpurpurbakterien gehren zu den alpha- und betaSubklassen der Proteobakterien. Sie bentigen organische Verbindungen anstelle von reduzierten Schwefelverbindungen als Elektronendonatoren fr die Photosynthese, sie sind also photoorganotroph. Dennoch besitzen die meisten Arten ebenfalls die Enzyme des Calvinzyklus, nutzen die CO2-Fixierung aber nur in Ausnahmefllen. Oft wachsen sie mixotroph, d. h. sie beziehen ihren Zellkohlenstoff sowohl aus der CO2-Fixierung als auch aus organischen Verbindungen, wenn solche vorhandenen sind. Bevorzugt werden Grprodukte anderer Bakterien (Plus 14.4). Wichtige Gattungen sind Rhodospirillum, Rhodobacter, Rhodopseudomonas (alphaUnterklasse) und Rhodocyclus (beta-Unterklasse). Die meisten Arten der Nicht-Schwefelpurpurbakterien sind metabolisch sehr vielseitig. Man findet bei ihnen Photosynthese, aerobe Atmung und Grung. Die Grnen Nicht-Schwefelbakterien Diese Bakterien reprsentieren einen weiteren eigenen Stamm im Bakterienstammbaum. Eine typische Gattung ist Chloroflexus (Kap. 2.6.1). Chloroflexus-Arten sind fakultativ phototroph und wachsen auch chemotroph im Dunkeln. Sie sind meist photoorganotroph und verwenden organischen Verbindungen als Elektronendonatoren, knnen aber auch auf Plus 14.4 Warum CO2-Fixierung, wenn organische Substrate vorhanden sind? Wenn phototrophe Bakterien beispielsweise eine Fettsure als Energiequelle oxidieren oder als Kohlenstoffquelle verwenden, so ist dieser Prozess mit der Freisetzung von Reduktionsquivalenten verbunden. Im Fall der Verwertung des Grproduktes Buttersure C4H8O2, die Zellkohlenstoff auf der Oxidationsstufe von Kohlenhydraten [CH2O] liefern soll, gilt die Gleichung: C4H8O2 + 2 H2O p 4 [CH2O] + 4 H. Die Reduktionsquivalente mssen verbraucht werden, was unter anoxischen Bedingungen ohne eine anaerobe Atmung nicht gelingt. Dagegen kann man damit CO2 fixieren, nach der Gleichung: 4 H + 1 CO2 p 1 [CH2O] + 1 H2O. Die CO2-Fixierung dient hier als „Elektronenabfluss“ bei der Verwertung von organischen Verbindungen, deren Reduktionszustand hher ist als derjenige des Zellkohlenstoffs. G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG 14.3 Anoxygene phototrophe Bakterien 419 photolithotrophe Bedingungen mit Wasserstoff als Elektronendonator umschalten. Sie fixieren dann CO2 ber den 3-Hydroxypropionatzyklus, verwandte Gattungen dagegen anscheinend ber den Calvinzyklus. Die Photosynthese der Chloroflexaceae luft wie bei den Purpurbakterien ber ein photosynthetisches Reaktionszentrum vom Photosystem-II-Typ. Die Lichtsammlung erfolgt wie bei den Chlorobiaceae ber Chlorosomen, die auch hier Bakteriochlorophyll c als charakteristisches Pigment enthalten (dagegen enthlt die verwandte Gattung Heliothrix Bakteriochlorophyll a) (Abb. 14.11). 14.3.3 Grne Schwefelbakterien und Heliobakterien (Photosysteme vom Typ I) Man kennt zwei natrliche Bakteriengruppen, von denen Vertreter ein Photosystem I besitzen, die Grnen Schwefelbakterien (Abb. 14.12) und die grampositiven Heliobakterien. Grne Schwefelbakterien Die Grnen Schwefelbakterien bilden eine eigene Entwicklungslinie im Bakterienstammbaum, die Chlorobiaceae (s. Abb. 14.7). Diese Bakterien sind obligat photolithoautotroph; sie bentigen Schwefelwasserstoff als Elektronendonator und fixieren CO2 ber den reduktiven Citratzyklus. Darber hinaus zeichnen sich die Chlorobiaceae durch ein photosynthetisches Reaktionszentrum vom Typ I und Chlorosomen als Lichtsammelkomplexe aus (Kap. 14.5.2). Typische Pigmente fr diese Gruppe der anoxygenen Phototrophen sind Bakteriochlorophyll c und d, die in großen Mengen in den Chlorosomen angereichert sind. Chlorobium-Arten sind auch die phototrophen Partner in der symbiontischen Assoziation Chloro- Chlorobium limicola Chlorobium vibrioforme Chlorobium phaeobacteroides Chlorochromatium (consortium) Pelodictyon clathratiforme Pelochromatium (consortium) G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG Abb. 14.11 Entwicklung von verschiedenen phototrophen Bakterien am Rande einer heißen vulkanischen Quelle. Das Photo zeigt eine Luftaufnahme der Grand Prismatic Spring aus dem Yellowstone Nationalpark; am Bildrand der befestigte Steg. Im blauen heißen Bereich wachsen keine Phototrophen. Im etwas klteren grnen Randbereich gedeihen thermophile Cyanobakterien. Der gelbe Rand ist Schwefel. Die klteren (55 hC) orangefarbenen Abflsse aus der Quelle sind dominiert von Matten von Chloroflexus aurantiacus (Copyright Bernhard Edmaier). Abb. 14.12 Einige Grne Schwefelbakterien (Chlorobiaceae). 420 14 Phototrophe Lebensweise Chl-a chromatium aggregatum und Pelochromatium roseum; die phototrophen Bakterien umgeben ein nichtphototrophes zentrales anaerobes Bakterium, das Sulfat oder Schwefel zu H2S reduziert, und H2S dient wiederum der anoxygenen Photosynthese (Kap. 17.8). Chl-b Heliobakterien a Absorption bzw. Intensität (Pigmente) (Sonnenlicht) Spektrum des Sonnenlichts Die Heliobakterien wurden als bisher letzte Gruppe anoxygener phototropher Bakterien erst 1983 identifiziert. Sie gehren phylogenetisch zu den grampositiven Bakterien, obwohl sie eine echte gramnegative Zellwandstruktur aufweisen. Diese Bakterien sind obligat anaerob und wechseln je nach Umweltbedingungen zwischen photoorganotropher Lebensweise und chemoorganotrophem Grungsstoffwechsel. Sie zeichnen sich wie die Chlorobiaceae durch ein Reaktionszentrum vom Typ I aus. Typische Gattungen sind Heliobacterium und Heliorestis. Lutein 400 500 600 Wellenlänge [nm] 700 Farbskala des sichtbaren Lichtes Wassertiefe [m] b 0 r o 20 40 60 y 0 5 v 10 Photosynthetische Pigmente und Thylakoide 14.4 g 50 b 100 Phototrophe Bakterien fallen sofort durch ihre Frbung auf, die fast alle Farben umfasst, von purpurn ber rot, lachsfarben, orange, ocker und braun zu grn und blaugrn (Abb. 14.10). Fr die Absorption im blauen (I 450 nm) und im roten sowie infraroten Spektralbereich (650–1100 nm) sind die Chlorophylle verantwortlich. Die Absorption im Bereich von 400–550 nm geschieht hauptschlich durch Carotinoide und bei Cyanobakterien im Bereich 550–650 nm durch Phycobiline (Abb. 14.13). Alle Pigmente sind durch ausgeprgte konjugierte Doppelbindungssysteme ausgezeichnet. einfallendes Licht [%] Abb. 14.13 Absorptionsspektrum von Chlorophyll a und b und dem Carotinoid Lutein (gelst in Aceton). a Die obere Kurve zeigt das Spektrum des Sonnenlichtes. Man beachte die sogenannte Grnlcke der Chlorophylle im Bereich des grnen Lichtes (480–550 nm). b Die Abhngigkeit der Verteilung von Licht verschiedener Wellenlngen von der Wassertiefe; r = 720 nm (rot), o = 620 nm (orange), y = 560 nm (gelb), g = 510 nm (grn), b = 460 nm (blau), v = 390 nm (violett). Chlorophylle und Bakteriochlorophylle 14.4.1 Die wichtigsten photosynthetischen Pigmente sind die Chlorophylle der oxygenen Phototrophen bzw. die Bakteriochlorophylle (BChl) der anoxygenen Phototrophen. Sie sind Lichtabsorber mit hohem Absorptionsquerschnitt. (Bakterio)Chlorophylle sind sowohl in den Proteinkomplexen der photosynthetischen Reaktionszentren als auch in den Proteinen der Antennenkomplexe enthalten. Diese Farbstoffe stammen von Protoporphyrin IX ab und enthalten in einem Tetrapyrrolring Mg2+ gebunden (Abb. 14.14). Protoporphyrin IX ist der Vorlufer von Hmen und (Bakterio)Chlorophyllen. Die Mg-Chelatase, welche den ersten Syntheschritt in Richtung (Bakterio)Chlorophylle katalysiert, wird durch Sauerstoff im CH3 HC CH2 H3C A N H3C CH3 CH3 C O CH2 CH3 Mg Phytyl-Rest CH3 N B H CH3 O O Chlorophyll a H N D A N N 7 D N Mg N B N N Mg N 8 C H3C CH2 CH2 H O O C O CH3 N C CH3 Chlorophyll b N Chl-a Abb. 14.14 Chlorophyll a und b. Der elektronenanziehende Formylrest von Chl-b verndert die p-Elektronenwolke und somit das Spektrum. Darunter sind 2 Resonanzstrukturen der delokalisierten p-Elektronen der konjugierten Doppelbindungen (rot) dargestellt. G. Fuchs, Allgemeine Mikrobiologie (ISBN 3134446081) c2006 Georg Thieme Verlag KG