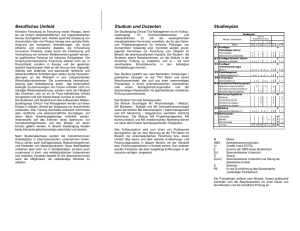
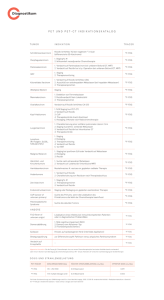
Morphologie und klinische Befunde bei Nachresektaten operierter
Werbung

$XVGHP,QVWLWXWIU3DWKRORJLHGHU%HUJEDX%HUXIVJHQRVVHQVFKDIWDQ den Berufsgenossenschaftlichen Kliniken Bergmannsheil-UniversitŠtsklinik 'LUHNWRU3URI'UPHG.00OOHU Morphologie und klinische Befunde bei Nachresektaten operierter Sarkome Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen FakultŠt der Ruhr-UniversitŠt zu Bochum vorgelegt von Jutta Harten aus Bremen 2004 Dekan: Prof. Dr. med. G. Muhr Referent: PD Dr. med. M. Krismann Korreferent: Prof. Dr. med. G. R. Hohlbach 7DJGHUPQGOLFKHQ3UIXQJ Inhaltsverzeichnis 9HU]HLFKQLVKlXILJJHEUDXFKWHU$ENU]XQJHQ ________________________________ 3 Tabellenverzeichnis ______________________________________________________ 4 Abbildungsverzeichnis____________________________________________________ 5 1 Einleitung_____________________________________________________ 6 1.1 (LQIKUXQJ ____________________________________________________ 6 1.2 Klassifizierungssysteme __________________________________________ 6 1.3 Histologische EntitŠten ___________________________________________ 7 1.3.1 1.3.2 1.3.3 1.3.4 1.3.5 1.3.6 1.3.7 1.3.8 1.3.9 1.3.10 1.3.11 1.3.12 Malignes Fibršses Histiozytom (MFH) ______________________________ 7 Liposarkom ____________________________________________________ 8 Synovialsarkom________________________________________________ 10 Sarkome der Muskulatur_________________________________________ 12 Fibršse Sarkome _______________________________________________ 14 Neurale Sarkome_______________________________________________ 16 6DUNRPHGHU%OXWXQG/\PSKJHIlH_______________________________ 19 PerivaskulŠre Sarkome __________________________________________ 22 ExtraskelettŠre kartilaginŠre und ossŠre Sarkome _____________________ 22 Mesotheliale Tumoren __________________________________________ 24 Gemischte Sarkome ____________________________________________ 24 Malignes Mesenchymom ________________________________________ 25 1.4 Histologischer Aufbau und Ausbreitungsmuster, Histogenese von Rezidiven 25 1.5 Chirurgische Therapie___________________________________________ 26 1.5.1 1.5.2 1.5.3 PrimŠrresektion ________________________________________________ 26 (PSIHKOXQJIUGLH'HILQLWLRQYRQ5HVHNWLRQVUlQGHUQ _________________ 27 Probleme der Nachresektion ______________________________________ 28 1.6 3URJQRVWLVFKH)DNWRUHQIUGLH(QWVWHKXQJYRQ/RNDOUH]LGLYHQ __________ 29 1.6.1 1.6.2 TherapieabhŠngige Faktoren______________________________________ 29 TumorabhŠngige Faktoren _______________________________________ 30 1.7 Klinische Unterscheidung zwischen Lokalrezidiv und postoperativen VerŠnderungen ________________________________________________ 31 1.7.1 1.7.2 MRT ________________________________________________________ 31 Andere Diagnostik _____________________________________________ 32 1.8 †berlebensrate von Patienten mit einem Lokalrezidiv __________________ 32 2 Fragestellung _________________________________________________ 33 3 Material und Methode _________________________________________ 34 3.1 Idee und Ursprung der Arbeit _____________________________________ 34 1 3.2 Material ______________________________________________________ 34 3.2.1 3.2.2 Materialumfang________________________________________________ 34 Gliederung des Materials ________________________________________ 35 3.3 Methode _____________________________________________________ 36 3.3.1 3.3.2 Histologische Aufarbeitung der Resektate ___________________________ 36 Eingabe der verschiedenen Parameter in eine Datenmaske ______________ 38 4 Ergebnisse ___________________________________________________ 44 4.1 Parameter, die mit dem Auftreten von Lokalrezidiven bzw. nicht malignen, postoperativen VerŠnderungen korrelieren __________________________ 46 4.1.1 4.1.2 4.1.3 PatientenabhŠngige Faktoren _____________________________________ 47 TumorabhŠngige Faktoren _______________________________________ 49 TherapieabhŠngige Faktoren______________________________________ 56 4.2 hEHUSUIXQJGHUGXUFKJHIKUWHQ'LDJQRVWLNDXILKUH5LFKWLJNHLW _________ 61 4.2.1 4.2.2 4.2.3 4.2.4 4.2.5 Magnetresonanztomografie_______________________________________ Computertomografie ____________________________________________ Sonografie ____________________________________________________ Kšrperliche Untersuchung _______________________________________ Sonstige Untersuchungen ________________________________________ 4.3 Zusammenfassung______________________________________________ 67 4.3.1 4.3.2 4.3.3 4.3.4 PatientenabhŠngige Faktoren _____________________________________ TumorabhŠngige Faktoren _______________________________________ TherapieabhŠngige Faktoren______________________________________ ValiditŠt der bildgebenden und anderen Diagnostik____________________ 5 61 63 64 65 66 67 67 70 72 Diskussion ___________________________________________________ 73 5.1 Prognostische Faktoren __________________________________________ 73 5.1.1 5.1.2 5.1.3 5.1.4 PatientenabhŠngige Faktoren _____________________________________ TumorabhŠngige Faktoren _______________________________________ TherapieabhŠngige Faktoren______________________________________ 6FKOXIROJHUXQJHQ _____________________________________________ 5.2 Bildgebende und andere Diagnostik ________________________________ 83 5.2.1 5.2.2 5.2.3 MRT ________________________________________________________ 83 Andere Diagnostik _____________________________________________ 84 6FKOXIROJHUXQJ _______________________________________________ 85 6 7 73 74 76 81 Zusammenfassung_____________________________________________ 87 Literatur_____________________________________________________ 89 2 9HU]HLFKQLVKlXILJJHEUDXFKWHU$ENU]XQJHQ AE Absetzungsebene (chirurgisch) BHL Berufsgenossenschaftliche Kliniken Bergmannsheil, UniversitŠtsklinik CT Computertomografie DD Differentialdiagnose EMA Epitheliales Membranantigen G Grading M Metastase (hŠmatogene Metastasierung) MFH Malignes Fibršses Histiozytom MPNST Maligner Peripherer Nervenscheidentumor MRT Magnetische Resonanztomografie N Nodus (regionŠre Lymphknotenmetastasierung) NNM Nebennierenmark NOS Not otherwise specified OP Operation p (TNM) postsurgical (nur in Zusammenhang mit TNM-Klassifikation) PAS PerjodsŠure-Schiff-Reaktion PE Probeexzision prox. proximal R Residualtumor S. Seite T /RNDOH$XVEUHLWXQJGHV7XPRUV7XPRUJU|H WHO World Health Organization 3 Tabellenverzeichnis Tabelle 1: Korrelation zwischen Resektionsrand und Lokalrezidiv .................................... 29 Tabelle 2: Aktuelle Diagnose und bisheriger Krankheitsverlauf aller 83 Tumorpatienten . 44 Tabelle 3: Geschlechterverteilung und Durchschnittsalter bei Stellung der PrimŠrdiagnose.................................................................................................... 47 Tabelle 4: Mittlere Dauer zwischen Erstsymptomen (ES) und primŠrer Sarkomdiagnose (PD) ..................................................................................................................... 48 Tabelle 5: HŠufigkeit der verschiedenen histologischen Typen .......................................... 49 Tabelle 6: Verteilung der verschiedenen Differenzierungsgrade des PrimŠrtumors ........... 51 Tabelle 7: Verteilung der verschiedenen Differenzierungsgrade des jeweils vorherigen Tumors ................................................................................................................ 51 Tabelle 8: Differenzierungswechsel im Krankheitsverlauf bei allen Patienten mit mindestens einem Rezidiv- oder Residualtumor................................................. 52 Tabelle 9: HŠufigkeit der verschiedenen Tumorlokalisationen ........................................... 53 Tabelle 10: Infiltrationstiefe des PrimŠrtumors ................................................................... 53 Tabelle 11: Infiltrationstiefe des jeweils vorherigen Tumors .............................................. 53 7DEHOOH7XPRUJU|H7GHV3ULPlUWXPRUV ................................................................... 54 7DEHOOH7XPRUJU|H7GHVMHZHLOVYRUKHULJHQ7XPRUV.............................................. 54 Tabelle 14: Anzahl der Tumorknoten im jeweils vorherigen Tumor .................................. 55 Tabelle 15: Anzahl der Tumorknoten im PrimŠrtumor ....................................................... 55 Tabelle 16: Verteilung der vorherigen Kategorie ................................................................ 55 Tabelle 17: HŠufigkeit der prŠoperativ angewandten Probeexzisionen / Biopsien ............. 56 Tabelle 18: HŠufigkeit des vorherigen Operationsortes ...................................................... 57 Tabelle 19: Anzahl der bisherigen Operationen unter den aktuellen Nachresektaten ......... 57 Tabelle 20: Durchschnittlicher Abstand in Monaten zur vorherigen OP ............................ 57 Tabelle 21: HŠufigkeit des jeweils vorherigen Operationsmodus unter allen Nachresektaten .................................................................................................. 58 Tabelle 22: Vorheriger Resektionsstatus (chirurgisch beurteilt) unter allen Nachresektaten .................................................................................................. 59 Tabelle 23: †bereinstimmung zwischen chirurgischer und histopathologischer Beurteilung des Resektionsstatus...................................................................... 59 Tabelle 24: Vorherige ResektionsqualitŠt (histopathologisch beurteilt) unter allen Nachresektaten .................................................................................................. 59 Tabelle 25: Sicherheitsabstand der jeweils vorherigen Operation (nur R0) unter den Rezidiven .......................................................................................................... 60 Tabelle 26: Ergebnisse der kernspintomografischen Untersuchungen................................ 61 Tabelle 27: Unterschiede im mittleren zeitlichen Abstand zwischen vorheriger OP und MRT.................................................................................................................. 62 Tabelle 28: Ergebnisse der computertomografischen Untersuchungen............................... 63 Tabelle 29: Unterschiede im mittleren zeitlichen Abstand zwischen vorheriger OP und CT ..................................................................................................................... 63 Tabelle 30: Ergebnisse der sonografischen Untersuchungen .............................................. 64 Tabelle 31: Unterschiede im mittleren zeitlichen Abstand zwischen vorheriger OP und Sonografie ......................................................................................................... 64 Tabelle 32: Ergebnisse der kšrperlichen Untersuchung ...................................................... 65 Tabelle 33: Unterschiede im mittleren zeitlichen Abstand zwischen vorheriger OP und kšrperlicher Untersuchung................................................................................ 66 Tabelle 34: ValiditŠt der verschiedenen Untersuchungen ................................................... 72 4 Abbildungsverzeichnis Abbildung 1: Makrofotogramm eines auf Kork aufgespannten tumorfreien Liposarkomnachresektats............................................................................... 36 Abbildung 2: Makrofotogramm eines 18,5x8,5x18,5 cm messenden Sarkoms NOS ......... 37 Abbildung 3: prŠoperativ angefertigtes CT des in Abb. 2 gezeigten Resektats .................. 37 Abbildung 4: Anzahl der Operationen seit Sarkomdiagnose bei allen Patienten mit aktuell tumorfreiem Nachresektat .................................................................. 45 Abbildung 5: Anzahl der Operationen seit Sarkomdiagnose bei allen Patienten mit Residual- oder Rezidivtumor im aktuellen Nachresektat............................... 45 Abbildung 6: Zeitraum zwischen Erstsymptomen und Sarkomdiagnose in Monaten......... 48 Abbildung 7: HŠufigkeit der verschiedenen histologischen Diagnosen .............................. 50 5 Einleitung 1 Einleitung 1.1 (LQIKUXQJ Weichteilsarkome sind seltene maligne Tumoren mesenchymalen oder neuroektodermalen Ursprungs. Die jŠhrliche Inzidenz liegt bei 10-40/Mio.; insgesamt machen sie nahezu 1 % aller Erwachsenenmalignome aus, wobei MŠnner etwas hŠufiger als Frauen betroffen sind [8]. Der Sarkomanteil an den kindlichen (< 15 Jahren) Malignomen liegt bei ca. 7 % [2]. Als hŠufigster Manifestationsort der Sarkome sind die ExtremitŠten mit ca. 60 % (in 2/3 der FŠlle untere ExtremitŠt - meistens Oberschenkel -, in 1/3 obere ExtremitŠt) betroffen, gefolgt von Rumpf inklusive Retroperitoneum mit 30 %; die Kopf- und Halsregion sind mit etwa 10 % am seltensten betroffen [2]. Klinisch findet sich meist eine (fast) schmerzlose, die Funktion kaum beeinflussende Schwellung; der allgemeine Gesundheitszustand des Patienten ist unbeeintrŠchtigt [41]. Die 5-Jahres-†berlebensrate betrŠgt insgesamt nahezu 50-60 % [36]. HŠufigste Todesursache ist die Ausbildung von Metastasen. Nur in seltenen FŠllen ist ein unkontrolliertes lokales Tumorwachstum im Sinne von immer wiederkehrenden /RNDOUH]LGLYHQ IU GHQ 7RG YHUDQWZRUWOLFK GLHV JLOW YRU DOOHP IU 6DUNRPH DQ +DOV XQG Kopf, im retroperitonealen und viszeralen Raum [42]. 1.2 Klassifizierungssysteme *HPl GHP American Joint Committee (AJC) System werden Weichteilsarkome durch das TNM-System (Staging) und den MalignitŠtsgrad (Grading) klassifiziert. Das Grading beschreibt den Differenzierungsgrad der Tumorzellen (G1 = hochdifferenziert; G2 = mittelgradig differenziert; G3 = niedrig differenziert; G4 = anaplastisch; GX = fehlende $QJDEH GDV 6WDJLQJ GLH 7XPRUDXVEUHLWXQJ +LHUIU ZLUG GLH 7XPRUJU|H LQ ]ZHL Gruppen (T1 < 5 cm, 1a = oberflŠchlich, 1b = tief; T2 > 5 cm, 2a = oberflŠchlich, 2b = tief; TX = fehlende Angabe) unterteilt und der Status der Lymphknoten (N0 = keine Lymphknotenmetastasen; N1 = regionŠre Lymphknotenmetastasen; NX = fehlende Angabe) und anderer Organe (M0 = keine Fernmetastasen; M1 = Fernmetastasen vorhanden; MX = IHKOHQGH$QJDEHEHUSUIW>@'DDEHU)HUQPHWDVWDVHQEHLGHU3ULPlUGLDJQRVHNOLQLVFK meistens noch nicht manifest sind und Lymphknotenmetastasen generell eher selten YRUNRPPHQEOHLEWRIWQXUGLH7XPRUJU|HXPGDV6WDJLQJ]XEHVWLPPHQ>@ Die VollstŠndigkeit der Tumorentfernung wird durch die QualitŠt der ResektionsrŠnder charakterisiert (R0 = kein Residualtumor; R1 = mikroskopischer Residualtumor; R2 = makroskopischer Residualtumor; RX = fehlende Angabe). 6 Einleitung 1.3 Histologische EntitŠten :HLFKJHZHEVVDUNRPH ]HLJHQ JHQHUHOO HLQH VHKU JURH 9DULDELOLWlW ZDV LKU PRUSKRORJLVFKHV (UVFKHLQXQJVELOG EHWULIIW (V JLEW ]ZHL WKHRUHWLVFKH $QVlW]H IU GHQ Entstehungsmodus von Weichteilsarkomen, wobei die bislang gebrŠuchlichste Klassifikation vom Prinzip der Histogenese ausgeht. Hiernach leitet sich der Tumor von Zellen eines definierten Weichgewebes ab. Nach heutiger Auffassung kann eine SOXULSRWHQWHPHVHQFK\PDOH6WDPP]HOOHDOV8UVSUXQJV]HOOHXQWHU(LQIOXXQWHUVFKLHGOLFKHU Faktoren sich verschiedenartig differenzieren und Ausgangspunkt malignen sarkomatšsen Wachstums werden. Die Klassifizierung des Sarkoms richtet sich zunŠchst einmal nach dem im Tumor histologisch vorherrschenden Gewebe. So unterscheidet man Tumoren mit fibršser oder fibrohistiozytŠrer Differenzierung, Tumoren myogenen oder lipogenen Ursprungs, DQJLRPDW|VH1HXELOGXQJHQXQG1HXELOGXQJHQGHV1HUYHQKOOJHZHEHVVRZLH7XPRUHQPLW synovialer Differenzierung. Tumoren, deren histologische Zuordnung zu einem bestimmten Gewebe nicht mšglich ist, werden anhand ihres morphologischen Bildes charakterisiert und benannt. Durch die Entwicklung immunhistochemischer und molekularbiologischer Techniken in den letzten Jahren konnte die Anzahl der unklassifizierten Sarkome auf ca. 5 % gesenkt werden [47]. 'LH $QJDEHQ EHU GLH $Q]DKO GHU KLVWRORJLVFKHQ 6DUNRPW\SHQ XQWHUOLHJHQ HUKHEOLFKHQ Schwankungen, da immer wieder neue EntitŠten beschrieben werden. Eine Standardklassifikation, die WHO classification of tumours [13], erwŠhnt zur Zeit 55 verschiedene Typen. Auch die Einteilung nach Enzinger / Weiss, Weiss, S.W. [58] ist eine der JHEUlXFKOLFKVWHQ.ODVVLILNDWLRQHQ]XUGLDJQRVWLVFKHQ(LQRUGQXQJ(LQHUGHU*UQGHIUGLH JURH 9DULDELOLWlW OLHJW ZDKUVFKHLQOLFK LQ GHU ELVODQJ QRFK XPVWULWWHQHQ 'LJQLWlW HLQLJHU sogenannter "Borderline-Tumoren", ein anderer in der unterschiedlichen Subtypisierung bereits bekannter Sarkomtypen. 1.3.1 Malignes Fibršses Histiozytom (MFH) Das Maligne Fibršse Histiozytom - bis vor kurzem noch als eigene histologische EntitŠt betrachtet - war mit einem Anteil von 20-25 % [37] das wohl am hŠufigsten diagnostizierte WeichJHZHEVVDUNRP 'LHVH KlXILJHQ 'LDJQRVHQ ZDUHQ DEHU XD DXFK GHU $QOD IU GLH $QQDKPHGDLPPHUPHKUVFKHLQEDUXQNODVVLIL]LHUEDUHSOHRPRUSKH6DUNRPHEHTXHPHU weise als MFH eingestuft wurden [25, 32, 57]. In letzter Zeit stellte sich dann aufgrund zunehmend detaillierter pathologischer Untersuchungstechniken (cytogenetische Analyse, ,PPXQKLVWRFKHPLH HWF KHUDXV GD GLH PHLVWHQ 0)+ GRFK ZHLWHU W\SLVLHUEDU VLQG 'LHV LVW YRU DOOHP IU GLH MHZHLOLJH NOLQLVFKH 3URJQRVH XQG GLH XQWHUVFKLHGOLFKHQ 7KHUDSLH PDQDKPHQlXHUVWZLFKWLJ>@ 7 Einleitung Bereits 1992 wurde das MFH in seiner Existenz in Frage gestellt, da diese Tumoren bis auf das Fehlen spezifischer Zelliniendifferenzierung nichts gemeinsam hatten und auch ein histiozytŠrer Ursprung nicht bewiesen werden konnte [12]. Vorhandene Histiozyten sollen eher Ausdruck eines reaktiven Geschehens sein, aber keine neoplastische Komponente darstellen [48]. ,Q YHUVFKLHGHQHQ 6WXGLHQ ZXUGHQ XUVSUQJOLFK DOV 0)+ GLDJQRVWL]LHUWH 6DUNRPH QHX aufgearbeitet und konnten nach eingehenden pathologischen Untersuchungen in den meisten FŠllen als entweder lipogen, myogen etc. oder selten sogar als Karzinom bei epithelialer Herkunft reklassifiziert werden [32, 33]. Diejenigen Malignen fibršsen Histiozytome, die auch mit Hilfe neuer histologischer Techniken unklassifizierbar bleiben, VROOHQ ]XNQIWLJ DOV SOHRPRUSKH 6DUNRPH 126 QRW RWKHUZLVH VSHFLILHG EH]HLFKQHW werden [33]. Da diese Erkenntnisse aber relativ neu sind, tritt der Begriff "Sarcoma NOS" im Ergebnisund Diskussionsteil nicht auf. Die "veraltete" Bezeichnung MFH stellt in der vorliegenden Studie auch weiterhin die am hŠufigsten vorkommende Diagnose dar. Gleichfalls finden VLFKLP7H[W]7DXFKGLHELVKHUJlQJLJHQIQI6XEW\SLVLHUXQJHQVWRULIRUPSOHRPRUSK "myxoid", "riesenzellig", "inflammatorisch" und "angiomatšs". 1.3.2 Liposarkom Mit einer Inzidenz von 9,8-16 % unter den Sarkomen zŠhlt das Liposarkom zu den hŠufigsten malignen Weichteiltumoren. Bevorzugter Manifestationsort ist der Oberschenkel, gefolgt von Retroperitoneum und inguinaler Region. Etwas seltener betroffen sind die obere ExtremitŠt und die Kopf- und Halsregion. Der Tumor wŠchst vor allem in tiefer gelegenen intermuskulŠren oder faszialen Strukturen und weniger hŠufig oberflŠchlich wie z. B. in der Subkutis. Die hšchste Erkrankungsrate liegt zwischen dem 40. und 60. Lebensjahr, wobei die Grenze nach oben offen ist. Bei Kindern ist das /LSRVDUNRPlXHUVWVHOWHQ.OLQLVFKFKDUDNWHULVWLVFKLVWHLQHEHUPHKUHUH0RQDWHODQJVDP wachsende tiefe Schwellung, die bei Diagnosestellung nicht selten eine betrŠchtliche *U|H DXIZHLVW XQG JU|HQDEKlQJLJ DXFK 6FKPHU]HQ XQG 6SDQQXQJVJHIKO YHUXUVDFKHQ kann. Das makroskopische Bild zeigt meist einen gut umschriebenen, durchschnittlich 5-10 cm JURHQ EHL UHWURSHULWRQHDOHU /DJH DXFK JU|HUHQ 7XPRU YRQ JHOERUDQJHU ELV ZHLJUDXHU Farbe und fester Konsistenz. Meist findet sich ein lobuliertes Wachstumsmuster und manchmal auch separate Tumorlappen jenseits des Haupttumors. Histologisch besteht der Tumor allgemein aus einer variablen Anzahl mono- oder multivakuolŠrer Lipoblasten, von SULPLWLYHQ PHVHQFK\PDOHQ =HOOHQ PLW QXU ZLQ]LJHQ )HWWWURSIHQ ELV ]X JURHQ XQL vakuolŠren Siegelringzellen mit hohem Fettgehalt. Im Prinzip spiegeln Liposarkome die 8 Einleitung verschiedenen Reifestadien von Adipozyten wider. In der Immunhistochemie zeigt vor allem der Einsatz von Antikšrpern gegen Vimentin und S-100-Protein eine positive Reaktion. Wiederum gibt es mehrere morphologische Varianten: myxoid, gut differenziert, dedifferenziert, rundzellig und pleomorph in absteigender HŠufigkeit, wobei auch gemischte Diagnosen vorkommen, und zwar in 5-10 % der FŠlle. Die Prognose hŠngt sowohl von der histologischen Diagnose als auch von der 5HVHNWLRQVTXDOLWlW DE 'LH -DKUHVhEHUOHEHQVUDWH IU DOOH KLVWRORJLVFKHQ 7\SHQ EHWUlJW 59-70 %, die 10-Jahres-†berlebensrate liegt zwischen 45 und 53 %, wobei retroperitoneal lokalisierte Tumoren eine wesentlich schlechtere Prognose als die in den ExtremitŠten aufweisen. Die Rezidivraten belaufen sich auf 46-57 %. Meistens besitzen die Rezidivtumoren das gleiche morphologische Bild wie die PrimŠrtumoren. Die Metastasierungsrate hŠngt wie auch bei anderen Sarkomen meist vom histologischen Typ und von der Differenzierung ab. HŠufigste Lokalisationen sind Lunge, Viszerum, Knochen und seršse OberflŠchen; Lymphknotenmetastasen kommen dagegen selten vor. Gelegentlich treten Liposarkommetastasen im Sinne eines multizentrischen Tumorwachstums an Stellen auf, an denen normalerweise keine Fernmetastasen vorkommen, wie z. B. Brustwand, Retroperitoneum und ExtremitŠten. Myxoides Liposarkom: Die myxoide Variante macht etwa die HŠlfte aller Liposarkome aus und besteht mikroskopisch aus verstreuten proliferierenden Lipoblasten unterschiedlicher Differen]LHUXQJ ± UHFKW KlXILJ VLQG VRJHQDQQWH XQLYDNXROlUH 6LHJHOringzellen mit erhšhtem Lipidgehalt, einem feinen verzweigten Kapillarmuster und reichlich myxoidem Stroma. 'LH0HWDVWDVLHUXQJVUDWHLVWJHULQJXQGGLH3URJQRVHGDPLWVHKUJQVWLJ Gut differenziertes Liposarkom: Die gut differenzierten Liposarkome bilden wegen ihrer guten Prognose eine eigene Gruppe; sie rezidivieren eher selten und setzen niemals Fernmetastasen. Bei subkutaner Lokalisation sind Rezidive am seltensten und eine lokale Exzision daher ausreichend, bei tiefer Lage sollte aber wegen der hšheren Rezidivrate eine weite Exzision erfolgen. Je nach histologisch vorherrschendem Bild unterscheidet man wiederum drei verschiedene Kategorien. Die hŠufigste Form besteht hauptsŠchlich aus lipomŠhnlichen Arealen, die reife Fettzellen enthalten. Sie unterscheidet sich aber von einem echten Lipom durch zerstreute multivakuolŠre Lipoblasten mit Kernatypien und fibroblastische Spindelzellen. Eine weitere Art, meist intraperitoneal lokalisiert, besteht aus verstreuten Lipoblasten oder multiQXNOHlUHQ =HOOHQ UHLIHQ )HWW]HOOHQ XQG HLQHP HQW]QGOLFKHQ ,QILOWUDW DXV Lymphozyten und Plasmazellen und wird daher auch als inflammatorisch bezeichnet. Die sklerosierende Variante manifestiert sich vor allem in der Leistengegend und im Retroperitoneum. Histologisch dominieren verstreute atypische Zellen und gelegentlich Lipoblasten zwischen Arealen verschieden dichter Kollagenfasern. Der Begriff atypisches 9 Einleitung /LSRP ZLUG DOOJHPHLQ QXU GDQQ DQJHZHQGHW ZHQQ HV VLFK XP DXVVFKOLHOLFK VXENXWDQH kleine Tumoren mit minimalen Zellatypien handelt. Dedifferenziertes Liposarkom: So bezeichnet man Formen, die gleichzeitig gut und schlecht differenzierte nichtlipogene Areale beinhalten; letztere kšnnen beliebigen anderen Sarkomtypen, z.B. Fibro-, Leiooder Rhabdomyosarkom, Šhneln. HŠufigster Manifestationsort sind die Leistengegend und das Retroperitoneum. Rundzelliges Liposarkom: Dies ist im Grunde eine schlecht differenzierte Variante der myxoiden Form, besteht aber wegen des klinisch aggressiven Verlaufs und der schlechten Prognose als eigene EntitŠt. Mikroskopisch findet sich eine starke Proliferation von kleinen uniformen runden Zellen mit selten intrazellulŠrem Lipidgehalt in einer wenig mukoiden Matrix. Pleomorphes Liposarkom: Hier handelt es sich um Liposarkome mit extremem zellulŠrem Pleomorphismus und ungeordnetem Wachstumsmuster. Es kommen typischerweise Riesenzellen mit unterschiedlichem Fettgehalt und Kernatypien vor, aber auch uni- oder multivakuolŠre Lipoblasten. Die Metastasierungstendenz ist hoch und die Prognose damit relativ XQJQVWLJ 1.3.3 Synovialsarkom Mit einer Inzidenz von 5,6-10 % unter den Sarkomen zŠhlt das Synovialsarkom ebenfalls zu den hŠufigsten Weichteilsarkomen. Es erscheint vorwiegend zwischen dem 15. und 40. Lebensjahr, und zwar bei MŠnnern etwas hŠufiger als bei Frauen. Synovialsarkome entstehen oft in paraartikulŠrem Gewebe, meist eng assoziiert mit Sehnen oder Sehnenscheiden, Bursae oder Gelenkkapseln, aber selten in der Synovia selbst. HŠufige Manifestationsorte sind die ExtremitŠten und hier vor allem die Unterschenkel- und Knieregion, gefolgt von Hals, Kopf und Rumpf in selteneren FŠllen. Klinisch zeigt sich PHLVWHLQHEHU-DKUHODQJVDPZDFKVHQGHWLHIH6FKZHOOXQJLQFD % der FŠlle mit Schmerzen oder SpannungsgefKO DVVR]LLHUW XQG HYHQWXHOO JHULQJIJLJHQ %HZHJXQJV einschrŠnkungen. Synovialsarkome sind von fester bis weicher Konsistenz, gelber bis grauZHLHU )DUEH GXUFKVFKQLWWOLFK FP JUR XQG PHLVW IHVW KDIWHQG DQ GHU EHQDFKEDUWHQ 6HKQH E]Z 6HKQHQVFKHLGH RGHU lXHUHU *HOHQNNDSVHO %HL ODQJVDPHP :DFKVWXP LVW GHU 7XPRU makroskopisch gut umschrieben, rund oder multilobulŠr und eventuell zystisch. Bei rapidem Wachstum dominiert eine schlecht umschriebene, zottige, oft hŠmorrhagische und nekrotische Tumormasse. Die €tiologie dieser Tumoren ist noch ungeklŠrt, aber es wird 10 Einleitung eine primitive Mesenchymzelle als Ursprung angenommen und nicht das normale Synovialgewebe. Histologisch handelt es sich um zwei morphologisch verschiedene, aber histogenetisch verwandte Zellkomponenten, zum einen die epitheliale karzinomŠhnliche und zum anderen die spindelzellige, dem Fibrosarkom Šhnliche. Je nach vorherrschendem Anteil unterscheidet man vier verschiedene Varianten: biphasisch, monophasisch fibršs, monophasisch epithelial und schlecht differenziert. Die biphasische Form ist durch die Koexistenz von epithelialen und fibroblastenŠhnlichen Spindelzellen gekennzeichnet und hat von allen Formen anscheinend die beste Prognose. Die kuboiden oder langen epithelialen Zellen sind in soliden StrŠngen oder Nestern angeordnet oder sie umsŠumen GUVHQlKQOLFKH VHNUHWKDOWLJH 5lXPH 'LH JXW RULHQWLHUWHQ SOXPSHQ 6SLQGHO]HOOHQ ELOGHQ kompakte Lagen, die die epithelialen Zellen umgeben. Zellreiche Areale wechseln sich mit zellarmen ab, das Stroma enthŠlt Kollagen, myxoides Material und nicht selten Kalzifikationen. Mastzellen sind ebenfalls hŠufig. Der Vaskularisierungsgrad reicht von YHUHLQ]HOWHQ ELV ]DKOUHLFK GLODWLHUWHQ *HIlHQ 'LH PRQRSKDVLVFK ILEU|VH )RUP NRPPW relativ hŠufig vor und ist eigentlich eine Extremvariante der biphasischen Form. Dabei EHUZLHJHQ GLH 6SLQGHO]HOOHQ XQG HV ILQGHQ VLFK QXU ZLQ]LJH $UHDOH HSLWKHOLDOHU 'LIIHUHQ]LHUXQJ 'LH DQGHUH lXHUVW VHOWHQH ([WUHPvariante der biphasischen Form stellt das monophasisch epitheliale Synovialsarkom dar. Wegen der ausgedehnten epithelialen Differenzierung kann es leicht mit einem Karzinom verwechselt werden. Das schlecht differenzierte Synovialsarkom bildet wegen des klinisch aggressiven Verlaufs eine eigene EntitŠt. Die kleinen ovalen oder spindeligen Zellen sind dicht gepackt, schlecht differenziert und stehen morphologisch zwischen epithelialer und spindelzelliger Form. In immunhistochemischen Untersuchungen des Synovialsarkoms exprimieren sowohl die epithelialen als auch die spindelzelligen Anteile vor allem verschiedene Zytokeratine und weniger intensiv EMA (epitheliales Membranantigen). Eine positive Reaktion von Vimentin zeigt sich dagegen nur in den Spindelzellen. 'LH 3URJQRVH LVW PLW HLQHU EHU %igen MetastasierungsrDWH UHODWLY XQJQVWLJ Bevorzugte Metastasenlokalisation ist die Lunge, gefolgt von Lymphknoten und Knochenmark. Rezidive sind ebenfalls hŠufig. Die 5-Jahres-†berlebensraten schwanken zwischen 36 und 82 %, die 10-Jahres-†berlebensraten liegen wegen der meist spŠten Metastasenmanifestation bei 20 bis 38 =X GHQ JQVWLJHQ SURJQRVWLVFKHQ )DNWRUHQ ]lKOHQ MXQJHV Alter (< 15-DKUH 7XPRUJU|H < 5 cm, Lokalisation im distalen ExtremitŠtenteil und anscheinend ausgedehnte Ossifikation und Kalzifikation. 11 Einleitung 1.3.4 Sarkome der Muskulatur 1.3.4.1 Leiomyosarkom Nicht organgebundene Leiomyosarkome machen etwa 5-10 % aller Weichteiltumoren aus, treten vorwiegend im hšheren Erwachsenenalter auf und kommen etwas hŠufiger bei Frauen als MŠnnern vor. Unterschieden werden drei Gruppen, die sich zwar histologisch gleichen, aber klinisch und biologisch differieren: Leiomyosarkome der tiefen und (sub)kutanen Weichgewebe und Leiomyosarkome vaskulŠren Ursprungs. Die tiefen Leiomyosarkome kommen am hŠufigsten vor und manifestieren sich in etwa 50 % der FŠlle im Retroperitoneum (hier sind vor allem Frauen betroffen), gefolgt von Abdominalhšhle und seltener den ExtremitŠten. Das durchschnittliche Erkrankungsalter betrŠgt 60 Jahre. Die klinischen Symptome sind (abdominale) Schwellung, Schmerzen, Gewichtsverlust, †belkeit und Erbrechen. 'LHUHWURSHULWRQHDOHQ7XPRUHQKDEHQHLQH'XUFKVFKQLWWVJU|HYRQFPXQGLQYROYLHUHQ RIW DXFK DQGHUH 2UJDQH 'DV PDNURVNRSLVFKH 7XPRUELOG LVW YRQ ZHLJUDXHU )DUEH fleischiger Konsistenz und fokal von Nekrosen und HŠmorrhagien durchsetzt. Mikroskopisch charakteristisch sind in Faszikeln angeordnete, spindelige Tumorzellen mit reichlich Zytoplasma, die bei guter Differenzierung parallel angeordnete Myofibrillen erkennen lassen. HŠufig finden sich auch mehrkernige Riesenzellen. In der ImmunKLVWRFKHPLH ]HLJHQ VLFK SRVLWLYH 5HDNWLRQHQ IDVW LPPHU IU 0XVNHOVSH]LILVFKHV $NWLQ (HHF XQG HWZDV YDULDEOHU IU 'HVPLQ 6HOWHQHU NDQQ .HUDWLQ QDFKJHZLHVHQ ZHUGHQ Die meisten Tumoren sind mittelgradig differenziert und scharf begrenzt. Histologische Varianten umfassen das epitheloide Leiomyosarkom, dessen Zellen runder sind und ein fast vakuolŠres, klarzellŠhnliches Zytoplasma haben; das myxoide Leiomyosarkom, ein VHKUK\SR]HOOXOlUHU7XPRUPLWlXHUVWXQJQVWLJHU3URJQRVHXQGGDVVHOWHQH*UDQXODUzellleiomyosarkom, dessen Zellen ein granulŠres Zytoplasma besitzen. Leiomyosarkome sind insgesamt eine sehr aggressive Tumorgruppe mit einer vor allem bei UHWURSHULWRQHDOHU /DJH XQJQVWLJHQ 3URJQRVH ZHJHQ GHU ORNDOHQ $XVEUHLWXQJ )HUQ PHWDVWDVHQ ELOGHQ VLFK YRUZLHJHQG LQ /XQJH XQG /HEHU 'LH /DQJ]HLWEHUOHEHQVUDWHQ betragen verschiedener Studien zufolge 6-29 %, bei Manifestation in den ExtremitŠten liegt die 5-Jahres-†berlebensrate bei 64 %. Das seltener vorkommende (sub)kutane Leiomyosarkom hat wegen seiner oberflŠchlichen Lage eine bessere Prognose. Hier sind MŠnner hŠufiger als Frauen betroffen; das durchschnittliche Erkrankungsalter liegt zwischen dem 50. und 70. Lebensjahr. HŠufigste Manifestationsorte sind behaarte ExtremitŠtenseiten. 0DNURVNRSLVFKVLQGGLH7XPRUHQYRQJUDXZHLHU)DUEH'LHLQWUDGHUPDOHNXWDQH)RUPLVW bei Diagnosestellung meist kleiner als 2 cm, schlecht umschrieben, schmerzhaft und die GDUEHUOLHJHQGH+DXWRIWYHUIlUEWRGHUXO]HULHUW'LHVXENXWDQH)RUPZlFKVWVFKQHOOHULVW 12 Einleitung PHLVWVFKRQJU|HUEHL(QWGHFNXQJEHVVHUXPVFKULHEHQXQGGLH(SLGHUPLVLVWDEJHVHKHQ von der Schwellung nicht verŠndert. Das histologische Bild Šhnelt dem der tiefen Leiomyosarkome. Die RezidivhŠufigkeit betrŠgt ca. 50 % und die Metastasierungsraten bei der kutanen bzw. subkutanen Variante 0-10 % bzw. 30-40 %. 'LH /HLRP\RVDUNRPH YDVNXOlUHQ 8UVSUXQJV NRPPHQ lXHUVW VHOWHQ YRU 6LH VLQG JHZ|KQOLFKPLWPLWWOHUHQELVJURHQ9HQHQPHLVWHQVGHU9HQDFDYDDVVR]LLHUW 1.3.4.2 Rhabdomyosarkom Das Rhabdomyosarkom ist das hŠufigste Weichteilsarkom des Kindes- und Jugendalters, ZlKUHQGHVEHL(UZDFKVHQHQDXHURUGHQWOLFKVHOWHQYRUNRPPW+lXILJH0DQLIHVWDWLRQVRUWH sind die Kopf- und Halsregion (vor allem Orbita, Nasopharynx, Nasenhšhle), Retroperitoneum und Genitaltrakt (vor allem Paratestikularregion, Harnblase, Prostata, Vagina), seltener die ExtremitŠten. Da an diesen Orten physiologischerweise oft keine quergestreifte Muskulatur vorkommt (z. B. Harnblase, Nasenhšhle, Mittelohr), wird ursŠchlich nicht von einer muskulŠren Tumorgenese, im Sinne einer Muskelzelle, die plštzlich dedifferenziert, ausgegangen. Vielmehr wird der Ursprung in einer primitiven Mesenchymzelle mit der KapazitŠt zur Rhabdomyoblastendifferenzierung gesehen oder in IUK]HLWLJDQDQGHUH2UWHYHUVSUHQJWHPHPEU\RQDOHQ0XVNHOJHZHEH Das grobe, histologische Bild ist durch ausdifferenzierte Skelettmuskelfasern oder deren Vorstufen, den Rhabdomyoblasten, charakterisiert. Von den verschiedenen immunhistochemischen Markern sind Antikšrper gegen Desmin, muskelspezifisches Aktin (HHF 35) und Myoglobin am gebrŠuchlichsten. Das makroskopische Bild ist von der Lokalisation abhŠngig. Die in HohlrŠumen (-organen) wachsenden Arten sind meist gut umschrieben, PXOWLQRGXOlURGHUSRO\SRLGPLWJOlQ]HQGHUJHODWLQ|VHUJUDXZHLHU6FKQLWWIOlFKHXQG]XP Teil Einblutungen oder Zysten. Die tiefen, intramuskulŠren Tumoren sind von festerer Konsistenz, schlechter umschrieben, infiltrieren ins Nachbargewebe, zeigen oft fokale Nekrosen und zystische Degeneration. Die Rhabdomyosarkome lassen sich histologisch, biologisch und klinisch in vier verschiedene Varianten einteilen: embryonal, alveolŠr, ERWU\RLGXQGSOHRPRUSKLQDEVWHLJHQGHU+lXILJNHLWZREHLhEHUODSSXQJHQEOLFKVLQG Die Prognose ist von vielen Faktoren abhŠngig; bei der alveolŠren und pleomorphen Form ist die MortalitŠt am hšchsten. Metastasen manifestieren sich am hŠufigsten in Lunge, regionalen Lymphknoten und im Knochenmark und sind in 20 % der FŠlle bereits bei der PrimŠrdiagnose prŠsent. InadŠquate Operationen resultieren hŠufig in destruktiv und infiltrativ (oft intraossŠr) wachsenden Rezidiven. Bei folgenden Tumoreigenschaften liegt die 5-Jahres-†berlebensrate bei ca. 85 %: regionale Lymphknotenmetastasen, aber keine Fernmetastasen; komplette oder R1-, aber keine R2-Resektion, kein alveolŠres Rhabdomyosarkom. Therapeutisch wird neben der Operation und Radiatio vor allem die Chemotherapie eingesetzt. 13 Einleitung Embryonales Rhabdomyosarkom: Diese hŠufigste Form (50-60 %) der Rhabdomyosarkome betrifft besonders SŠuglinge und MQJHUH .LQGHU XQG HUVFKHLQW YRUZLHJHQG DQ .RSIEHUHLFK *HQLWDOWUDNW XQG 5HWUR peritoneum. Das makroskopische Bild Šhnelt den verschiedenen Reifestadien von Muskelgewebe. Es gibt undifferenzierte Areale mit runden oder spindeligen, hyperchromatischen ungeordneten Zellen ohne Rhabdomyoblasten und besser differenzierte Areale mit lŠnglichen, spindeligen Rhabdomyoblasten, die manchmal eine Querstreifung erkennen lassen. Das Stroma enthŠlt meist wenig Kollagen und unterschiedliche Mengen myxoiden Materials. Eine untergeordnete Variante mit guter klinischer Prognose ist der spindelzellige Typ, bestehend aus uniformen Spindelzellen in faszikulŠrer Anordnung und reichlich Kollagen. AlveolŠres Rhabdomyosarkom: Dies ist die zweithŠufigste Variante; sie tritt vorwiegend zwischen dem 10. und 25. Lebensjahr auf, ist etwas šfter in den ExtremitŠten lokalisiert und Šhnelt morphologisch weitgehend der embryonalen Form. Die Tumorzellen sind schlecht differenziert, haben ein rundes bis ovales Aussehen und sind hŠufig lose ohne Verbund angeordnet, was ein alveolŠres Erscheinungsbild abgibt. Die Prognose ist schlecht. Botryoides Rhabdomyosarkom: 'LHVH SURJQRVWLVFK JQVWLJH 9DULDQWH ]HLJW HLQ SRO\SRLGHV WUDXEHQlKQOLFKHV :DFKVWXPV muster mit wenigen Rhabdomyoblasten in einem myxomŠhnlichen Stroma. Bevorzugte Lokalisationen sind schleimhŠutige Hohlorgane / HohlrŠume wie Harnblase oder Nasenhšhle. Es kommt vor allem bei SŠuglingen und kleinen Kindern vor. Pleomorphes Rhabdomyosarkom: 'LHSOHRPRUSKHSURJQRVWLVFKXQJQVWLJH)RUPPDFKW HWZD % der Rhabdomyosarkome aus und erscheint vorwiegend bei Šlteren Erwachsenen nach dem 40. Lebensjahr. %HYRU]XJWHU 0DQLIHVWDWLRQVRUW VLQG GLH JURHQ ([WUHPLWlWHQmuskeln, vor allem der Oberschenkel. Die mikroskopische Diagnose ist schwierig, da oft typische Rhabdomyoblasten fehlen und die €hnlichkeit mit anderen pleomorphen Sarkomen hoch ist. Bei den 7XPRU]HOOHQ KDQGHOW HV VLFK XP ORVH DUUDQJLHUWH ]XIlOOLJ RULHQWLHUWH JURH UXQGH RGHU pleomorphe Zellen mit hyperchromatischen Kernen und evtl. Rhabdomyoblasten; eine Querstreifung ist aber nicht zu erkennen. 1.3.5 Fibršse Sarkome 1.3.5.1 Fibrosarkom 'DVDGXOWH)LEURVDUNRPNDQQLQMHGHP$OWHUDXHUEHL.LQGHUQEHYRU]XJW]ZLVFKHQGHP 30. und 55. Lebensjahr, auftreten und macht etwa 5 % aller Sarkome aus. MŠnner sind 14 Einleitung etwas hŠufiger betroffen als Frauen. HŠufigste Lokalisation ist die Oberschenkel- und Knieregion, gefolgt von Rumpf und den distalen ExtremitŠtenanteilen wie Unterschenkel XQG8QWHUDUP .OLQLVFK ]HLJW VLFK PHLVW HLQH EHU 0RQDWH ELV -DKUH ODQJVDP ZDFKVHQGH GXUFKVFKQLWWOLFK FP JURH 6FKZHOOXQJ GLH QXU LQ GHU )lOOH LQLWLDO 6FKPHU]HQ verursacht. Fibrosarkome entwickeln sich hauptsŠchlich in tiefen Strukturen wie dem intraoder intermuskulŠren Bindegewebe, Faszien, Aponeurosen und Sehnen, aber ganz selten subkutan. Makroskopisch handelt es sich um eine solitŠre fleischige runde oder lobulierte Masse von JUDXZHLHU ELV EUDXQJHOEHU )DUEH 'LH NOHLQHUHQ 7XPRUHQ VLQG RIW JXW XPVFKULHEHQ XQG EHNDSVHOW GLH JU|HUHQ KLQJHJHQ VFKOHFKW EHJUHQ]W PLW PXOWLSOHQ $XVZFKVHQ XQG Infiltration ins umliegende Gewebe. Das histologische Bild ist relativ uniform: Spindelfšrmige fibroblastenŠhnliche Zellen in faszikulŠrem Muster, die durch eine variable $Q]DKO YRQ .ROODJHQIDVHUQ JHWUHQQW ZHUGHQ %HL VFKOHFKWHU 'LIIHUHQ]LHUXQJ EHUZLHJHQ dichte wenig orientierte kleine rundliche Tumorzellen, spŠrlicher Kollagengehalt, mehr Nekrosen, Blutungen und Mitosen. Fibrosarkome exprimieren immunhistochemisch Vimentin und zeigen in der RetikulinprŠparation ein dichtes kollagenes Netzwerk. 'LH 3URJQRVH LVW XQJQVWLJ GLH -DKUHVhEHUOHEHQVUDWH OLHJW YHUVFKLHGHQHQ 6WXGLHQ zufolge zwischen 29 und 78 % abhŠngig vom Grading und der ResektionsqualitŠt, die Rezidivrate bei ungefŠhr 50 %. Fernmetastasen manifestieren sich meistens in der Lunge, JHIROJW YRP 6NHOHWW XQG lXHUVW VHOWHQ LQ GHQ /\PSKNQRWHQ (LQH HLJHQH 9DULDQWH ELOGHW das kongenitale oder infantile Fibrosarkom, das vor allem im ersten Lebensjahr vorkommt und einen klinisch besseren Verlauf aufweist als die adulte Form. Morphologisch Šhneln sich die beiden Formen. Charakteristisch ist ein sehr schnelles Wachstum und eine EHWUlFKWOLFKH7XPRUJU|H'LHPHLVWHQGLHVHU7XPRUHQN|QQHQWURW]GHVUDSLGHQ9HUODXIV durch eine weite Exzision geheilt werden. Die 5-Jahres-†berlebensrate liegt hier bei 84 %. 1.3.5.2 Fibromatosen Fibromatosen werden hinsichtlich der DignitŠt zwischen benigner fibršser Neubildung und malignem Fibrosarkom eingeordnet. Aggressives infiltrierendes Wachstum und Rezidivbildung sind hŠufig, aber nie kommt es zu fernmetastatischen Absiedlungen. Fibromatosen lassen sich in oberflŠchliche (superfiziale) und tiefe Fibromatosen unterteilen. Histologisch handelt es sich um hoch differenziertes fibršses Gewebe, das makroskopisch derb, schlecht umschrieben, solitŠr oder multipel imponiert. Die superfizialen Formen weisen ein weniger DJJUHVVLYHV 9HUKDOWHQ DOV GLH WLHIHQ DXI 'LH 7XPRUHQ VLQG YRQ NOHLQHUHU *U|H langsamerem Wachstum und entspringen von oberflŠchlichen Faszien oder Aponeurosen. Die tiefe Fibromatose, wegen der band- oder sehnenŠhnlichen Konsistenz auch Desmoidtumor genannt, wŠchst schneller, rezidiviert šfter, ist insgesamt aggressiver und betrifft immer tiefe muskelaponeurotische Strukturen. Die tiefen Fibromatosen teilt man je nach 15 Einleitung 0DQLIHVWDWLRQVRUW LQ IQI .DWHJRULHQ DEGRPLQDO H[WUDDEGRPLQDO LQWUDDEGRPLQDO mesenterial und infantil. Aufgrund des klinisch besonders aggressiven Verlaufs und der relativ hohen Inzidenz soll die extraDEGRPLQDOHDJJUHVVLYH)LEURPDWRVHKLHUHWZDVDXVIKUOicher dargestellt werden. 1.3.5.2.1 Extraabdominale (aggressive) Fibromatose Dieser Tumor zŠhlt mit einer Inzidenz von ca. 3-4 Mio./Jahr zu den hŠufigen WeichteillŠsionen und erscheint vorwiegend im jugendlichen oder jungen Erwachsenenalter, mit einer leichten prozentualen HŠufung bei Frauen. Ausgangspunkt ist meist das intermuskulŠre Bindegewebe, bedeckende Faszien oder Aponeurosen von Schulter, Brustwand, 5FNHQ XQG 2EHUVFKHQNHO 7\SLVFKH IUKH 6\PSWRPH VLQG HLQH VFKPHU]ORVH ODQJVDP wachsende, schlecht umschriebene Schwellung von derber Konsistenz, spŠter eventuell auch Schmerzen oder neurologische Symptome. In seltenen FŠllen kommt es zu einem multizentrischen Wachstum in derselben anatomischen Region, meist proximal des PrimŠrtumors. 0DNURVNRSLVFK KDQGHOW HV VLFK XP GXUFKVFKQLWWOLFK FP JURH GHUEH 7XPRUHQ PLW glŠnzender, narbenŠhnlicher SchnittflŠche, die entweder begrenzt auf oder entlang der Muskelfaszie wachsen oder in das umliegende Gewebe infiltrieren. Mikroskopisch finden sich gut orientierte schlanke fibroblastische Spindelzellen, die durch reichlich Kollagen getrennt werden. Eine Infiltration der Tumorzellen in die benachbarte Muskulatur ist sehr hŠufig. Es finden sich aber keine Kernatypien und kaum Mitosen. In der Immunhistochemie kommen vor allem Antikšrper gegen Vimentin, a-Aktin der glatten Muskulatur und Muskelaktin, aber seltener Desmin zum Einsatz. Die Prognose ist sehr gut, Metastasen wurden bisher nicht beschrieben, die Rezidivraten liegen laut verschiedener Studien zwischen 29 und 65 %, nicht selten kommt es zu zwei oder mehreren Rezidiven. Wegen des infiltrativen Wachstums ist unbedingt eine weite oder radikale Resektion anzustreben. 1.3.6 Neurale Sarkome 1.3.6.1 Maligner peripherer Nervenscheidentumor (MPNST) Der MPNST (syn.: malignes Schwannom, Neurofibrosarkom) ist mit einem Anteil von 10 % eines der hŠufigsten Weichteilsarkome und hat seinen Ursprung in nervalen Strukturen inkl. Neurofibromen oder in Tumoren mit Aspekten der neuralen 'LIIHUHQ]LHUXQJ 'LH 7XPRU]HOOHQ lKQHOQ HQWVSUHFKHQG GHP 1HUYHQKOOJHZHEH HQWZHGHU Schwannzellen oder (perineuralen) Fibroblasten. †ber die HŠlfte dieser Sarkome sind mit den Neurofibromen der Neurofibromatose I assoziiert; ca. 10 % sind SpŠtfolgen einer therapeutischen Radiatio. Das Erkrankungsalter liegt insgesamt zwischen dem 20. und 50. 16 Einleitung Lebensjahr (durchschnittlich 32 Jahre). Manifestationsorte sind in den meisten FŠllen die JURHQ 1HUYHQVWlPPH GHV 5XPSIHV XQG GHU SUR[LPDOHQ ([WUHPLWlWHQUHJLRQHQ ZLH ] % der Plexus brachialis. Klinisch zeigen sich zuerst eine gelegentlich schmerzhafte Schwellung und spŠter eventuell neurologische Symptome. 0DNURVNRSLVFK KDQGHOW HV VLFK XP HLQH PHLVW IXVLIRUPH FP JURH ZHLEUDXQH 0DVVH mit Einblutungen und Nekrosen, die entweder innerhalb eines Hauptnerven oder eines Neurofibroms lokalisiert ist. Nervenverdickungen proximal und distal des Tumors VSUHFKHQ IUHLQH$XVEUHLWXQJHQWODQJGHV3HULRGHU(SLQHXULXPV 0LNURVNRSLVFK LVW GLH Unterscheidung von anderen spindelzelligen Tumoren schwierig. Die Tumorzellen gleichen klassischerweise den Schwannzellen und sind in Faszikeln angeordnet, die sich mit hypozellulŠren myxoiden Arealen abwechseln. In 10-15 % der FŠlle sind heterotope Elemente wie Knochen- oder Knorpelgewebe vorhanden. Die meisten dieser Tumoren sind schlecht differenziert. In der Immunhistochemie kommen am hŠufigsten Antikšrper gegen S-100-Protein, Leu-7- und Myelin-basic-Protein zur Anwendung. Je nach vorherrschendem histologischen Bild unterscheidet man folgende Typen: MPNST mit Rhabdomyosarkom (maligner Tritontumor): Hier bestehen gleichzeitig sowohl neural als auch muskulŠr differenzierte Zellen nebeneinander, die wahrscheinlich beide von einer neuralen Stammzelle abstammen. Histologisch findet sich zusŠtzlich zu dem gewohnten Bild eine variable Anzahl relativ reifer Rhabdomyoblasten. GlandulŠres MPNST (malignes glandulŠres Schwannom): Das mikroskopische Bild zeigt einen spindelzelligen Hintergrund und darin heterotope (OHPHQWH 2VWHRLG .QRUSHO HWF XQG ZHQLJH 'UVHQ EHVWHKHQG DXV HSLWKHOlKQOLFKHQ kuboidalen oder sŠulenfšrmigen Zellen. Diese Variante kommt kaum sporadisch, sondern IDVWDXVVFKOLHOLFKEHLGHU1HXURILEURPDWRVH,YRU Epitheloides MPNST (malignes epitheloides Schwannom): 'DVPRUSKRORJLVFKH%LOGLVWGXUFKNXU]H6lXOHQJURHUHSLWKHORLGHU=HOOHQGLH]ZDUNHLQ Melanin enthalten, aber melanomŠhnliche Kerne besitzen, gekennzeichnet. Das gesamte Aussehen erinnert daher stark an ein Karzinom oder Melanom. Hier gibt es auch oberflŠchliche, dermale und subkutane Formen mit einer besseren Prognose. 'LH LQVJHVDPW HKHU XQJQVWLJH 3URJQRVH GHU 1HUYHQVFKHLGHQWXPRUHQ LVW GXUFK KRKH Metastasierungs- und Rezidivraten gekennzeichnet. Die 5-Jahres-†berlebensrate liegt Studien zufolge bei etwa 44 %. HŠufige Metastasierungsorte sind die Lunge, gefolgt von Knochen und ganz selten regionale Lymphknoten. Die mit der Neurofibromatose I assoziierten Formen haben eine besonders schlechte Prognose. 17 Einleitung 1.3.6.2 Primitiver Neuroektodermaler Tumor (PNET) (LQWHLOXQJ 1HXUREODVWRP ± *DQJOLRQHXUREODVWRP ± 1HXURHSLWKHOLRP 3HULSKHUHU QHXUR ektodermaler Tumor) - Extraskeletales Ewing-Sarkom Neuroblastom und Ganglioneuroblastom: Die (Ganglio-)Neuroblastome, die ihren Ursprung im adrenalen und autonomen Nervensystem haben, sind die dritthŠufigsten kindlichen malignen Tumoren nach der LeukŠmie und den Gehirntumoren. Betroffen sind vor allem SŠuglinge und Kleinkinder, ganz selten Jugendliche oder Erwachsene. Ausgangspunkt sind primordiale neurale Stammzellen, die sich an den sympathischen fetalen Ganglien oder dem Nebennierenmark DQVLHGHOQ 'LH EHYRU]XJWHQ 0DQLIHVWDWLRQVRUWH EHILQGHQ VLFK GDKHU LP 110 XQG EHUDOO zwischen SchŠdelbasis und Becken nahe der Mittellinie (hier besonders Mediastinum und Retroperitoneum). Klinisch zeigen sich oft ein palpabler Tumor, Katecholaminerhšhungen im Serum und viele unspezifische Symptome wie Fieber, Gewichtsverlust etc. 0DNURVNRSLVFK]HLJWVLFKHLQOREXOLHUWHUGXUFKVFKQLWWOLFK FP JURHU ZHLFKHU JUDXHU und zum Teil hŠmorrhagischer Tumor. Das Neuroblastom besteht meist aus Neuroblasten, die verschiedene Grade der ganglionŠren Differenzierung, aber keine Schwannzelldifferenzierung annehmen kšnnen. Das Ganglioneuroblastom (= differenziertes Neuroblastom) unterscheidet sich davon durch zusŠtzliche Mengen an Schwannzellproliferationen. An immunhistochemischen Markern werden Antikšrper gegen Neuronspezifische Enolase, Neurofilament-Protein und S-100-Protein eingesetzt. Die Prognose ist stark von verschiedenen Faktoren wie Alter und Staging abhŠngig; unter dem 2. Lebensjahr betrŠgt die 2-Jahres-†berlebensrate Studien zufolge 77 EHU GHP /HEHQVMDKU QXU %. In 2/3 der FŠlle sind bei Diagnosestellung bereits Fernmetastasen vorhanden. Neuroepitheliom (Peripherer Neuroektodermaler Tumor): Dieser hoch aggressive Tumor nimmt seinen Ursprung vom peripheren Nervensystem und macht ca. 1 % aller Weichteilsarkome aus. Er kann in jedem Alter aber bevorzugt unterhalb des 35. Lebensjahres auftreten. 1/3 der FŠlle sind mit Hauptnerven assoziiert; KlXILJVWHU /RNDOLVDWLRQVRUW VLQG GLH ([WUHPLWlWHQ XQG KLHU YRU DOOHP *HVl XQG Oberschenkel. Oft zeigen sich primŠr neurologische Symptome. Das neuroblastomŠhnliche mikroskopische Bild ist von kleinen Rundzellen in wahlloser, trabekulŠrer oder rosettenfšrmiger Anordnung geprŠgt. Manchmal finden sich auch Spindelzellen, aber niemals Neuropili oder Ganglienzellen. In der Immunhistochemie kommen bevorzugt 0DUNHU IU 1HXURQVSH]LILVFKH (QRODVH XQG =HOOoberflŠchenantigen p30/32 zur Anwendung. Die 3-Jahres-†berlebensraten reichen laut verschiedener Studien von weit unter bis 50 %. 18 Einleitung Extraskeletales Ewing Sarkom: Hier handelt es sich wahrscheinlich um eine undifferenzierte VorlŠuferstufe des Neuroepithelioms, allerdings mit einer besseren Prognose. Durchschnittliches Erkrankungsalter ist das 20. Lebensjahr; hŠufigste Manifestationsorte sind die Paravertebralregion, Brustwand, untere ExtremitŠten und das Retroperitoneum. Klinisch imponieren ein rapides Wachstum, Schmerzen und neurologische Symptome. Makroskopisch handelt es sich meist um eine multilobulŠre, weiche bis bršckelige Masse, die von Nekrosen, Zysten oder Blutungen gezeichnet ist. Histologisch finden sich solide gepackte Rundzellen, eine relativ hohe Vaskularisierung und Retikulinfasern. Die Zellen exprimieren fast immer das Glykoprotein mic-2-Gen und etwas weniger hŠufig Vimentin. Die Prognose hat sich dank Chemotherapie in der letzten Zeit sehr verbessert; die 5-Jahres-†berlebensrate liegt Studien zufolge bei 66 %. 1.3.6.3 Klarzellsarkom (Malignes Weichteilmelanom) Dieser Tumor ist neuroektodermaler Abstammung und wahrscheinlich enger mit malignen Melanomzellen als mit Schwannzellen verwandt. Am hŠufigsten erkranken junge Erwachsene im Alter zwischen 20 und 40 Jahren. Bevorzugter Manifestationsort ist die XQWHUH([WUHPLWlW )X XQG .QLH JHIROJW YRQ GHU REHUHQ ([WUHPLWlW 'HU 7XPRU ZlFKVW fast immer tief und ist eng mit Sehnen oder Aponeurosen assoziiert; die Epidermis ist nicht involviert. An der betreffenden Stelle zeigt sich eine langsam wachsende, meist VFKPHU]KDIWH 6FKZHOOXQJ 'DV PDNURVNRSLVFKH %LOG XPIDW HLQH OREXOLHUWH ELV PXOWL QRGXOlUH JUDXZHLH GXUFKVFKQLWWOLFK FP JURH 0DVVH PLW IRNDOHQ 1HNURVHQ Blutungen oder Zysten und selten schwarzer Pigmentierung. Das mikroskopische Bild ist eher einheitlich: geordnete fusiforme oder runde Tumorzellen mit klarem Zytoplasma und oft intrazellulŠrem Melanin in einem fibrokollagenen Gewebe; gelegentlich Riesenzellen. Immunhistochemisch exprimieren fast alle Zellen S-100-Protein, viele HMB-45 (Melanomassoziiertes Antigen) u. a. Die Prognose ist selbst bei adŠquater Therapie schlecht. Die Rezidiv- bzw. Metastasierungsraten liegen Studien zufolge bei 39 % bzw. 50 %. SpŠtrezidive bzw. -metastasen sind relativ hŠufig. 1.3.7 6DUNRPHGHU%OXWXQG/\PSKJHIlH 1.3.7.1 Angiosarkom Dieser Tumor des hšheren Erwachsenenalters macht etwa 1 % aller Weichteilsarkome aus. Bevorzugte Manifestationsorte sind in absteigender Reihenfolge die Haut, oberflŠchliche :HLFKWHLOH XQG VHOWHQHU %UXVW /HEHU .QRFKHQ 0LO] +HU] RGHU JU|HUH *HIlH 'D GLH Angiosarkome keine einheitliche EntitŠt darstellen, unterscheidet man mehrere Subtypen. 19 Einleitung Kutanes Angiosarkom, nicht mit Lymphšdem assoziiert: Diese hŠufigste Variante betrifft vor allem Šltere Menschen und manifestiert sich vorwiegend an Kopf und Hals, gefolgt von Rumpf und ExtremitŠten. Erstes Symptom ist meist ein schlecht umschriebenes HŠmatom (Druckstelle) mit induriertem Randsaum. *URH /lVLRQHQ N|QQHQ DXFK NQRWLJ XQG XO]HULHUW LPSRQLHUHQ :HJHQ PXOWLIRNDOHP :DFKVWXP LQ EHU % der FŠlle ist die Tumorausdehnung oft schwer bestimmbar. Makroskopisch finden sich viele eingeblutete Areale, Infiltration der Dermis und manchmal auch von Subkutis und Faszie. Das zystisch und hŠmorrhagisch erscheinende, mikroskopische Bild ist von gut bis mittelgradig differenzierten Tumorzellen, die deutliche *HIlOXPLQD DXVELOGHQ JHSUlJW ,Q GHU 3HULSKHULH EHILQGHQ VLFK GLODWLHUWH /\PSKJHIlH GLHYRQFKURQLVFKHQ(QW]QGXQJV]HOOHQXQGNOHLQHQ HQGRWKHOreichen Kapillaren umgeben ZHUGHQ 'LH *HIlH ELOGHQ XQWHUHLQDQGHU $QDVWRPRVHQ DXV ,Q GHU ,PPXQhistochemie kommen verschiedene Marker zur Anwendung, vor allem Antikšrper gegen Faktor VIII assoziiertes Antigen (von-Willebrand-Faktor) und CD31 (ein Membranprotein). Die Prognose dieser Variante ist vor allem wegen der hŠufigen FehleinschŠtzung (BenignitŠt) des Initialtumors ziemlich schlecht; die 5-Jahres-†berlebensrate liegt bei ca. 12 %. Die meisten Metastasen bilden sich in den zervikalen Lymphknoten, gefolgt von Lunge, Leber und Milz. Kutanes Angiosarkom, mit Lymphšdem assoziiert (= Lymphangiosarkom): Hier wird ein Lymphšdem (nach Mastektomie, traumatisch etc.) als Ursache angenommen. Frauen sind von dieser Form hŠufiger als MŠnner betroffen. Die oberflŠchlich lokalisierten LŠsionen sind meist als mehrere Knoten, die spŠter miteinander verschmelzen und eventuell auch ulzerieren, palpabel. Die tiefe subkutane Form erscheint manchmal nur als gefleckte, pinkrote VerfŠrbung auf der Haut. Mikroskopisch sieht man kapillarŠhnliche *HIlH DXV 7XPRU]HOOHQ EHVWHKHQG ZHOFKH GLH +DXW XQG GDV :HLFKJHZHEH LQILOWULHUHQ 'LH*HIlOXPLQDN|QQHQOHHUVHLQ(U\WKUR]\WHQRGHUNODUH)OVVLJNHLWHQWKDOWHQ(LQ]LJHU Hinweis auf einen lymphatischen Ursprung sind Areale sogenannter Lymphangiomatosis PLW GLODWLHUWHQ ZDKUVFKHLQOLFK O\PSKDWLVFKHQ *HIlHQ GLH YRQ SOXPSHQ (QGRWKHO]HOOHQ ausgekleidet sind. Die Prognose ist wegen sehr hoher Rezidiv- und Metastasierungsraten HEHQIDOOVVHKUXQJQVWLJ Angiosarkom der Brust: Dieser seltene, aber bšsartigste Mamma-Tumor kommt nur bei Frauen vor und ist im tiefen BrustGUVHQgewebe lokalisiert. Das histologische Bild Šhnelt dem anderer Angiosarkome. Angiosarkom der tiefen Weichteile: Dieser hochmaligne, immer auf das tiefe Weichgewebe beschrŠnkter Tumor ist bisher erst selten beschrieben worden. Er tritt in jedem Alter auf, und zwar hŠufiger bei MŠnnern. Manifestationsort ist meist die (untere) ExtremitŠt oder die Abdominalhšhle. Klinisch 20 Einleitung LPSRQLHUWHLQHJURHKlPRUUKDJLVFKH6FKZHOOXQJGLHRIWPLWHLQHPFKURQLVFKHQ+lPDWRP verwechselt wird. Strahleninduziertes Angiosarkom: Dieses ist fast immer schlecht differenziert und hoch aggressiv und erscheint vorwiegend (intra-)abdominal, aber auch dermal nach therapeutischer Radiatio. 1.3.7.2 Kaposi-Sarkom 'DV .DSRVL6DUNRP LVW GXUFK GLH LQWUDGHUPDOH 3UROLIHUDWLRQ YRQ NOHLQHQ XQG JU|HUHQ GLODWLHUWHQ *HIlHQ FKDUDNWHULVLHUW (V HUVFKHLQW LPPHU PXOWLIRNDO RIW DXFK DQ verschiedenen Kšrperstellen, weshalb mittlerweile vorwiegend die Strahlen- und Chemotherapie anstatt der chirurgischen Therapie angewendet wird. Die Prognose ist stark von der Immunabwehr des Patienten abhŠngig, es wird u. a. eine viral assoziierte oder sogar bedingte Genese diskutiert. HŠufigster Manifestationsort ist der Unterschenkel, seltener die Arme oder innere Organe. Makroskopisch handelt es sich um eine langsam wachsende, zunŠchst flache, spŠter knotige LŠsion von roter bis violetter Farbe, die von einem …dem RGHU8O]HUDWLRQHQEHJOHLWHWVHLQNDQQ0LNURVNRSLVFKVLHKWPDQHLQYHUVWULFNWHV*HIlQHW] das sich in der Dermis oder auch Subkutis ausbreitet. Die Tumorzellen erscheinen wie normales kapillares oder lymphatisches Endothel, also relativ blande. In der Immunhistochemie werden verschiedene monoklonale Antikšrper zur Identifizierung bestimmter Endothelstrukturen verwandt. Klinisch unterscheidet man vier unterschiedliche Gruppen: die chronische Form (90 % aller Kaposi-Sarkome), die lymphadenopathische Form, die nach Transplantationen auftretende und die mit AIDS assoziierte Form. Obwohl keine Fernmetastasen auftreten, liegt die MortalitŠt wegen des multifokalen Wachstums und oft anderer Begleiterkrankungen um 10-20 %, bei der AIDS assoziierten Form sogar noch hšher. 1.3.7.3 HŠmangioendotheliom Dieser Tumor steht hinsichtlich der DignitŠt zwischen HŠmangiom und konventionellem Angiosarkom. Histologisch haben sich hauptsŠchlich vier Formen herausgebildet. Epitheloides HŠmangioendotheliom: Es tritt in jedem Alter, aber selten bei Kindern auf und manifestiert sich meist in den tiefen oder oberflŠchlichen Weichteilen, seltener in parenchymatšsen Organen. Mindestens 50 % GHU )lOOH VLQG HQJ PLW *HIlHQ DVVR]LLHUW RGHU HQWVSULQJHQ GLUHNW DXV LKQHQ .OLQLVFK zeigen sich eine leicht schmerzhafte Schwellung und manchPDO DXFK *HIlverVFKOX V\PSWRPH'LHGLUHNWDXV*HIlHQVWDPPHQGHQRIWWKURPEHQŠhnlichen Tumoren sind von ZHLURWHU )DUEH GLH UXQGHQ ELV VSLQGHOLJHQ 7XPRU]HOOHQ ]HLJHQ HQGRtheliale 'LIIHUHQ]LHUXQJ DEHU NHLQH *HIlOXPHQformation wie die HŠmangiome. Sie entspringen GLUHNW DXV HLQHP *HIl XQG ZDFKVHQ GDQQ LQV :HLFKJHZHEH KLQHLQ 'HU LPPXQKLVWR chemische Nachweis von Faktor VIII assoziiertem Antigen fŠllt meist positiv aus. Die 21 Einleitung Prognose ist bei WeichteilORNDOLVDWLRQ PHLVWHQV JQVWLJ 5H]LGLYH XQG 0HWDVWDVHQ VLQG selten; die MortalitŠt betrŠgt 13 %. Spindelzelliges HŠmangioendotheliom: Diese Variante betrifft oft junge Erwachsene und manifestiert sich in der Subkutis oder 'HUPLVGHUGLVWDOHQ([WUHPLWlWHQUHJLRQHQRIW+DQG(VJLEWNHLQH0HWDVWDVHQGDIUDEHU hŠufig Rezidive und ausgedehntes multifokales Wachstum. Morphologisch findet man NOHLQH U|WOLFKH .QRWHQ PLW RIW JURHQ NDYHUQ|VHQ 9HQHQ XQG SUROLIHULHUHQGHQ 6SLQGHO zellen. 1.3.8 PerivaskulŠre Sarkome 1.3.8.1 Malignes HŠmangioperizytom Die HŠufigkeit dieses Tumors wird auf etwa 2,5 % aller Weichteilsarkome geschŠtzt. Das Durchschnittsalter liegt bei 45 Jahren, die wichtigsten Manifestationsorte sind in absteigender HŠufigkeit: untere ExtremitŠt, Becken und Retroperitoneum, Kopf und Hals. Die meist intramuskulŠr und seltener dermal oder subkutan lokalisierten Tumoren sind oft OREXOLHUW JXW XPVFKULHEHQ GXUFKVFKQLWWOLFK FP JUR XQG PDQFKPDO KlPRUUKDJLVFK zystisch oder nekrotisch. Histologisch finden sich viele verzweigte, verschieden weite *HIlH GLH YRQ JURHQ IODFKHQ JHOHJHQWOLFK SDOLVDGHQI|UPLJ JHRUGQHWHQ 7XPRU]HOOHQ umgeben werden. Diese sind wahrscheinlich perizytŠren Ursprungs und exprimieren variabel u. a. Vimentin, CD34, Faktor XIIIa und HLA-DR. Klinisch zeigen sich eine langsam wachsende, selten schmerzhafte Schwellung, Teleangiektasien bis Varizen und HLQH (UZlUPXQJ GHU GDUEHU OLHJHQGHQ +DXW %HL pelviner oder retroperitonealer Lokalisation kann es zu wachsendem Bauchumfang, Erbrechen, Harnretention etc. kommen. Die Prognose ist schwer vorherzusagen; es gibt sowohl gut differenzierte, schnell heilende Formen als auch schlecht differenzierte Formen mit aggressivem Verlauf. Die Metastasierungsrate (vor allem Lunge und Knochen betroffen) betrŠgt Studien zufolge 17 %. 1.3.9 ExtraskelettŠre kartilaginŠre und ossŠre Sarkome 1.3.9.1 Extraskelettales Chondrosarkom Die extraskelettale Form ist wesentlich seltener als die primŠr knšcherne; es werden drei verschiedene histologische Varianten unterschieden. Myxoides extraskelettales Chondrosarkom: Es ist wahrscheinlich chondroblastischer Herkunft und macht etwa 2,3 % aller Sarkome aus. Das durchschnittliche Erkrankungsalter liegt zwischen dem 46. und 57. Lebensjahr, 22 Einleitung Frauen sind etwas hŠufiger betroffen. †ber 2/3 der FŠlle sind in den ExtremitŠten (vor allem Oberschenkel und Kniekehle) lokalisiert, meist intramuskulŠr, seltener subkutan. Die NOLQLVFKHQ6\PSWRPHVLQGODQJVDPHV:DFKVWXPPDQFKPDO6FKPHU]HQXQGMHQDFK*U|H 8O]HUDWLRQHQXQG%OXWXQJHQ'LHJXWXPVFKULHEHQHQPHLVWFP JURHQ7XPRUHQVLQG lobuliert bis knotig mit gelatinšser, graubrauner SchnittflŠche. Das histologische Bild ist von chondroblastenŠhnlichen Tumorzellen geprŠgt, die durch unterschiedliche Mengen mukoiden Materials getrennt werden. Gelegentlich finden sich Foci typischer reifer Knorpelzellen mit deutlichen Lakunen. Die Zellen exprimieren hauptsŠchlich Vimentin und weniger deutlich Leu-7- und S-100-Protein. Die Rezidiv- bzw. Metastasierungsraten OLHJHQ EHL EHU % bzw. 40 %; wobei zellarme und an myxoidem Stroma reiche Tumoren eine bessere Prognose aufweisen. SpŠtrezidive und -metastasen sind relativ hŠufig. Die 10-Jahres-†berlebensrate liegt Studien zufolge bei 73 %. Mesenchymales extraskelettales Chondrosarkom: Diese Form stammt wahrscheinlich von primitiven prŠkartilaginen Mesenchymzellen ab und manifestiert sich bevorzugt an Kopf und Hals (vor allem Orbita), kranialer und spinaler harter Hirnhaut und seltener am Oberschenkel. Betroffen sind vorwiegend 15- bis MlKULJH.OLQLVFK]HLJHQVLFKDXHUEHL/RNDOLVDWLRQLQGHQ([WUHPLWlWHQPHLVWUDSLGHV Wachstum, Schmerzen und verschiedene neurologische oder systemische Symptome. Die JXW XPVFKULHEHQHQ 7XPRUHQ VLQG RIW PXOWLOREXOLHUW YRQ ZHLFKHU .RQVLVWHQ] ZHLJUDXHU Farbe und enthalten verstreute Knorpel- und Knochenfoci. Mikroskopisch zeigt sich ein charakteristisches biphasisches Muster: primitive, runde bis spindelige mesenchymale Zellen (eventuell Neuronspezifische Enolase+, Leu-7+) und dazwischen gut differenziertes Knorpelgewebe (S-100-Protein+) mit hŠufig zentraler Kalzi- oder Ossifikation. Die Prognose ist durch eine hohe Metastasierungsrate gekennzeichnet; die 5-Jahres- bzw. 10Jahres-†berlebensrate betrŠgt Studien zufolge 55 % bzw. 27 %. Gut differenziertes extraskelettales Chondrosarkom: Bei dieser extrem seltenen Variante handelt es sich wahrscheinlich eher um die lokale Ausdehnung oder Metastase der primŠr knšchernen Form. EigenstŠndiges Auftreten ist die Ausnahme und wird nur bei synovialem und periostalem Ursprung oder infolge therapeutischer Bestrahlung angenommen. 1.3.9.2 Extraskelettales Osteosarkom Dieser Tumor (ca. 1 DOOHU 6DUNRPH KDW VHLQHQ 8UVSUXQJ EHUZLHJHQG LQ HKHPDOV bestrahlten Arealen. Das durchschnittliche Erkrankungsalter liegt zwischen 47 und 55 Jahren; bevorzugte Lokalisationen sind die Oberschenkelmuskulatur, das Retroperitoneum XQG GLH JURHQ %HFNHQ XQG 6FKXOWHUmuskeln. Klinische Symptome sind: schnelles Wachstum, Schmerzen und eventuell Hautulzeration. DasPRUSKRORJLVFKH%LOGZHLJUDX gut umschrieben bis infiltrierend wachsend, feste bis steinige Konsistenz und multiple 23 Einleitung Nekrosen und Einblutungen, neoplastisches Osteoid oder Knochen und runde bis spindelige Osteoblasten in variablen Anteilen. Der immunhistochemische Nachweis von Vimentin ist positiv. Die Prognose ist sehr schlecht. 1.3.10 Mesotheliale Tumoren Das Mesotheliom hat seinen Ursprung entweder in den Mesothelzellen oder in den darunter liegenden mesenchymalen Zellen der Serosa. Morphologisch werden primŠr zwei Typen unterschieden: das diffuse Mesotheliom und der maligne solitŠre (= lokalisierte) fibršse Tumor von Pleura und Peritoneum. 1.3.11 Gemischte Sarkome 1.3.11.1 AlveolŠres Weichteilsarkom Zu diesem seltenen Tumor (0,5-1 % aller Sarkome) gibt es kein benigQHV*HJHQVWFNXQG der genaue Ursprung ist unklar. Er erscheint vor allem bei Jugendlichen und jungen Erwachsenen. Die Lokalisation ist vom Alter abhŠngig; bei Erwachsenen ist vorwiegend der Oberschenkel betroffen, bei Kindern die Kopf- und Halsregion. Klinisch zeigt sich eine langsam wachsende, schmerzlose und manchmal pulsierende Schwellung. Die Tumoren sind meist schlecht umschrieben, von weicher bis bršckeliger Konsistenz und oft von ]DKOUHLFKHQ *HIlHQ XPJHEHQ 0LNURVNRSLVFK VLHKW PDQ =HOOQHVWHU GLH GXUFK ILEU|VH 7UDEHNHO XQG *HIlH YRQHLQDQGHU JHWUHQQW VLQG 'LH JURHQ UXQGHQ ELV SRO\JRQDOHQ Tumorzellen besitzen ein granulŠres, manchmal vakuolisiertes Zytoplasma. Die Zellen exprimieren gelegentlich S-100-Protein und Neuronspezifische Enolase und variabel auch muskulŠre Marker wie Vimentin, HHF 35 (Muskelspezifisches Aktin) und Desmin. Die 3URJQRVHLVWZHJHQGHVKlXILJIUKHQ0HWDVWDVHQZDFKVWXPV/XQJH*HKLUQXQG.QRFKHQ ]LHPOLFKXQJQVWLJDEHUEHL.LQGHUQDOOJHPHLQHWZDVEHVVHU 1.3.11.2 Epitheloides Sarkom Das epitheloide Sarkom ist das hŠufigste Weichteilsarkom von Hand und Handgelenk. Meist sind Jugendliche und junge Erwachsene betroffen. Nach Finger, Hand und Unterarm sind Knie und Unterschenkel die zweithŠufigsten Lokalisationen. Das morphologische Bild Šhnelt dem Synovialsarkom: runde, epitheloide bis plumpe spindelige Zellen, die sich miteinander in nodulŠrer Anordnung vermischen, muzine Grundsubstanz und gelegentlich Kalzifikationen. Die nodulŠren Zellhaufen zeigen oft zentrale Degeneration und Nekrosen. Die Tumorzellen exprimieren hauptsŠchlich Zytokeratin, Vimentin und EMA (Epitheliales 0HPEUDQDQWLJHQ'LH7XPRUHQVLQGGXUFKVFKQLWWOLFKFPJURHYHQWXHOOPXOWLQRGXOlU XQG ZHLVHQ HLQH JOlQ]HQGH JUDXZHLH ELV EUDXQH 6FKQLWWIOlFKH DXI %HL REHUIOlFKOLFKHU Lokalisation handelt es sich oft um feste solitŠre oder multiple Knoten, die langsam 24 Einleitung wachsen und eventuell ulzerieren. Bei tiefer Lokalisation ist der Tumor meist fest mit 6HKQHQVFKHLGHQ RGHU )DV]LHQ YHUEXQGHQ JU|HU VFKOHFKWHU XPVFKULHEHQ XQG RIW QXU DOV VerhŠrtung palpabel. Mit einer 77 %igen Rezidiv- und 45 %igen Metastasierungsrate ist die Prognose relativ ernst. Typisch sind multiple Rezidive, die sich disseminiert in der (Epi-)Dermis oder entlang Sehnen und Faszien ausbreiten. 1.3.11.3 Maligner Extrarenaler Rhabdoidtumor Dieser sehr seltene, oberflŠchlich dem Rhabdomyosarkom Šhnelnde Tumor wurde zuerst in der Niere beschrieben; sein Ursprung ist weitestgehend noch unklar. Betroffen sind vorwiegend Kleinkinder und seltener Jugendliche oder Erwachsene. HŠufigste Manifestationsorte sind die tiefen Weichgewebe von Nacken, Schulter, Rumpf und ExtremitŠten. Das histologische Bild wird vor allem von drei Aspekten geprŠgt: schlecht differenzierte runde bis polygonale Zellen mit azidophilem PAS+ Zytoplasma, immunhistochemische Expression von Keratin, EMA und Vimentin; keine immunhistochemische Expression von Desmin, Myoglobin und S-100-Protein u. a. Die Prognose ist generell schlecht mit einem klinisch rapiden Verlauf. 1.3.12 Malignes Mesenchymom Dieser seltenH7XPRUSDWLQNHLQH.DWHJRULHHULVWGHILQLHUWGXUFKGLH3UlVHQ]YRQ]ZHL oder mehreren nicht epithelialen Gewebskomponenten. HŠufigster Manifestationsort ist das Retroperitoneum und die untere ExtremitŠt; das durchschnittliche Erkrankungsalter OLHJW EHU -DKUHQ 0LNURVNRSLVFK XQWHUVFKHLGHW PDQ ]ZHL .DWHJRULHQ JOHLFK]HLWLJ myosarkomatšse und liposarkomatšse Areale zusammen mit spindelzelliger Komponente oder irgendeinen vorherrschenden Sarkomtyp kombiniert mit malignen knorpeligen oder RVVlUHQ )RFL 'LH LPPXQKLVWRFKHPLVFKH 5HDNWLRQ IlOOW MH QDFK KLVWRORJLVFK EHU wiegendem Typ sehr variabel aus. Eine Prognose ist wegen der zu geringen bisherigen Dokumentation nicht mšglich; die Therapie richtet sich daher nach der vorherrschenden am schlechtesten differenzierten Komponente. 1.4 Histologischer Aufbau und Ausbreitungsmuster, Histogenese von Rezidiven :HLFKWHLOVDUNRPH UHVSHNWLHUHQ SUlIRUPLHUWH QDWUOLFKH *UHQ]HQ ZLH 0XVNHOIDV]LHQ Aponeurosen, tiefe Faszien und intermuskulŠre Septen bis zu einem sehr spŠten Stadium. (LQH YRQ 7XPRUJHZHEH EHUKUWH DEHU QLFKW LQILOWULHUWH )DV]LH VWHOOW VRPLW HLQH DGlTXDWH Absetzungsebene dar. Fett-, Muskel- oder lockeres Bindegewebe werden dagegen leicht YRQ 7XPRU]HOOHQ LQILOWULHUW XQG VROOWHQ PLW JUR]JLJHP 6LFKHUKHLWVDEVWDQG UHVH]LHUW werden [44]. Somit richtet sich der erforderliche Sicherheitsabstand nach der QualitŠt des Resektionsrandes [53]. 25 Einleitung 6FKLFKWDXIEDX HLQHV 6DUNRPV YRQ LQQHQ QDFK DXHQ (QQHNLQJ.ODVVLILNDWLRQ ]XVDPPHQJHIDWYRQ5\GKROP>@ · · Tumorgewebe Kapsel: das durch den Tumor komprimierte umliegende Gewebe · reaktive Zone: besteht aus proliferierenden mesenchymalen Zellen, Neovaskularisation · gesundes Gewebe XQG(QW]QGXQJV]HOOHQDXHUKDOEGHU.DSVHO.DSVHOUHVWHXQGUHDNWLYH=RQHELOGHQ die Pseudokapsel) Sarkomzellen kšnnen unabhŠngig von ihrem Differenzierungsgrad die makroskopisch oft intakt erscheinende Kapsel durchdringen, in die reaktive Zone infiltrieren und dort Satellitenknoten bilden. Gut differenzierte Tumoren infiltrieren meist nicht in das Gewebe DXHUKDOEGHUUHDNWLYHQ=RQH$XVQDKPH]%DJJUHVVLYH)LEURPDWRVH%HL*7XPRUHQ dagegen kann die Kapsel komplett zerstšrt sein, die reaktive Zone ist prominenter und Satellitenknoten finden sich in weitem Abstand auch im normalen Gewebe (Enneking.ODVVLILNDWLRQ]XVDPPHQJHIDWYRQ5\GKROP>@ ,Q HLQHU6WXGLHPLWEHUZLHJHQGQLHGULJGLIIHUHQ]LHUWHQLQWUDPXVNXOlUHQ6DUNRPHQ wurde in der histologischen Aufarbeitung nur selten eine reaktive Zone gefunden [1]. Dies und GLH 7DWVDFKH GD QLFKW DOOH PDUJLQDO UHVH]LHUWHQ *6DUNRPH ORNDO UH]LGLYLHUHQ ]HLJHQ GD GLH ,QWHUDNWLRQ ]ZLVFKHQ 6DUNRP XQG QRUPDOHP *HZHEH ZHLWHU XQWHUVXFKW ZHUGHQ PX>@ )U GDV (QWVWHKHQ YRQ /RNDOUH]LGLYHQ ZHUGHQ DOVR KDXSWVlFKOLFK LP 2SHUDWLRQVEHWW verbliebene Tumorreste(-zellen) angeschuldigt sowie auch lokal abgesprengte Satellitenmetastasen jenseits des Haupttumors [44]. Eine weitere ErklŠrung geht von bereits V\VWHPLVFK ]LUNXOLHUHQGHQ 6DUNRP]HOOHQ DXV GLH HUQHXW GDV XUVSUQJOLFKH 7XPRUEHWW besiedeln [44]. 1.5 Chirurgische Therapie 1.5.1 PrimŠrresektion Weichteilsarkome neigen zur Ausbildung von Lokalrezidiven. Nach lokaler Resektion im Sinne einer AusschŠlungsresektion treten in mindestens 60 % der FŠlle Rezidive auf, nach ausgedehnter weiter Exzision dagegen nur in ca. 20 % [2]. Aus diesem Grund steht die adŠquate chirurgische Tumorresektion an erster Stelle der Behandlungsmethoden [2, 15, 44, 46, 50, 52]. -HQDFK$XVPDGHU5HVHNWLRQXQWHUVFKHLGHWPDQIROJHQGH5HVHNWLRQVDUWHQ · Palliative Resektion zwecks Tumorverkleinerung 26 Einleitung · · · · Lokale Resektion im Sinne einer AusschŠlungsresektion Weite Resektion mit einem definierten Sicherheitsabstand Radikale Resektion im Sinne einer Kompartmentresektion Amputation Die optimale Ausdehnung der Operation wird zum einen durch das Ausbreitungsmuster des Tumors [17] und zum anderen durch seine anatomische Lokalisation bestimmt [10]. So LVW EHL JURHQ WLHIORNDOLVLHUWHQ 7XPRUHQ RGHU 7XPRUHQ GHV 5HWURSHULWRQHXPV XQG 0HGLDVWLQXPV HLQH ZHLWH 5HVHNWLRQ PHLVW VFKZHU ]X HUUHLFKHQ 'DV JOHLFKH JLOW IU 7XPRUHQ GHU +DQG .RSI XQG +DOVUHJLRQ 6DUNRPH GLH LQ .QRFKHQ %OXWJHIlH RGHU Nerven infiltrieren, sind oft amputationspflichtig; zur Zeit wird die Amputation in weniger als 10 % der FŠlle angewendet [2]. 8QHUOlOLFK IU HLQH RSWLPDOH FKLUXUJLVFKH 7KHUDSLH LVW GDV SUlRSHUDWLYH 6WDJLQJ XQG GLH 'LJQLWlWVEHVWLPPXQJGHV7XPRUVGXUFKHLQH %LRSVLH(LQHUGHUKlXILJVWHQ*UQGHGDIU GD GLH PDUJLQDOH 5HVHNWLRQ LP 6LQQH HLQHU $XVVFKlOXQJVUHVHNWLRQ LPPHU QRFK GXUFK JHIKUW ZLUG OLHJW LQ GHU XQ]XUHLFKHQGHQ SUlRSHUDWLYHQ 'LDJQRVWLN VR GD HLQ sarkomatšses Wachstum zunŠchst nicht erkannt wird [15, 41]. $XHUGHP NDQQ GLH QLFKW VHOWHQ JXW XPVFKULHEHQH YRQ GQQHU .DSVHO EHJUHQ]WH 7XPRUPDVVH %HQLJQLWlW YRUWlXVFKHQ >@ XQG GDV RIW PKHORVH $XVVFKlOHQ DXI GLH 9ROOVWlQGLJNHLW GHU ([]LVLRQ hindeuten [10]. Dabei resultieren aus dieser sogenannten AusschŠlungstechnik fast immer unvollstŠndige Resektionen mit mikroskopisch oder makroskopisch infiltrierten AbsetzungsrŠndern [52]. 1.5.2 (PSIHKOXQJIUGLH'HILQLWLRQYRQ5HVHNWLRQVUlQGHUQ 'HILQLWLRQHLQHV.RPSDUWLPHQWVQDFK(QQHNLQJ]XVDPPHQJHIDWYRQ5\GKROP>@ Ein Kompartiment ist ein anatomischer Raum (z. B. Muskelgruppe), der in allen 5LFKWXQJHQYRQQDWUOLFKHQ6WUXNWXUHQ]%)DV]LHEHJUHQ]WZLUG$P2EHUVFKHQNHOJLEW es nach Ennekings Klassifikation 3 Kompartimente: · · · anterolateral (M. quadriceps) medial (Adduktorengruppe) posterior (Streckergruppe inkl. N. ischiadicus) Auch das subkutane Fettgewebe bildet ein Kompartiment, obwohl es keine longitudinalen Grenzen (Faszien) besitzt. Hier wird eine En-bloc-Resektion von Tumor, Haut, tiefer )DV]LHXQGHLQHP6LFKHUKHLWVDEVWDQGYRQPLQGHVWHQVFPEH]JOLFKGHU/RNDOUH]LGLYUDWH einer muskulŠren Kompartimentresektion gleichgestellt [44]. Nach einer modifizierten Definition kann auch ein einzelner Muskel ein Kompartiment bilden (z. B. M. rectus IHPRULVYRUDXVJHVHW]WHVZXUGHYRUKHUNHLQHRIIHQH%LRSVLHGXUFKJHIKUW>@ 27 Einleitung Definition der chirurgischen ResektionsrŠnder nach Enneking [9], modifiziert von Rydholm und Rššser [44]: · · · intralŠsional: Im Wundbett findet sich residuelles Tumorgewebe. marginal: Die Absetzungsebene liegt zwischen Kapsel und reaktiver Zone oder in der reaktiven Zone. Im Wundbett finden sich die reaktive Zone mit Satellitenknoten und eventuell Satellitenmetastasen im umliegenden normalen Gewebe. weit-S (bei subkutanen Tumoren): Die Absetzungsebene besteht aus einem minimal 2 cm makroskopisch gesunden Randsaum und der basalen Faszie (hier Abstand egal). Im Wundbett befinden sich normales Gewebe und eventuell Satellitenmetastasen. · · · weit-AM (engl.: areolar or muscular; bei tieflokalisierten Tumoren): Die Absetzungsebene weist in allen Richtungen einen makroskopischen Sicherheitsabstand von mindestens 2 cm auf. Im Wundbett befinden sich normales Gewebe und eventuell Satellitenmetastasen. weit-F (Faszie; bei intramuskulŠren Tumoren) (V PX HLQH SULPlUH 0\HNWRPLH LQNOXVLYH LQWDNWHU )DV]LHQ GXUFKJHIKUW ZHUGHQ 9RUDXVVHW]XQJ NHLQH RIIHQH %LRSVLH in der prŠoperativen Diagnostik. Im Wundbett befindet sich normales Gewebe. radikal: bei kompletter Kompartimentresektion en-bloc. 1.5.3 Probleme der Nachresektion 1DFKUHVHNWLRQHQVLQGEHLXQYROOVWlQGLJHU3ULPlUUHVHNWLRQLQGL]LHUWZHQQXQJHZLLVWRE die PrimŠrresektion im Gesunden erfolgte oder um einen weiteren Sicherheitsabstand zu erreichen bei zuvor knapper Tumorexzision. Das Ziel der Nachresektion ist die Entfernung jeglichen residuellen Tumorgewebes, die Entfernung von Gewebe, das wŠhrend der ersten Operation eventuell mit Tumorzellen kontaminiert wurde und ein weiter Resektionsrand aus gesundem Gewebe in allen Ebenen. Narben- und Granulationsgewebe sollten wegen der potentiellen Tumorkontaminierung immer mit reseziert werden [15]. (LQJURHV3UREOHPOLHJWLQGHURIWVFKZHU]XEHVWLPPHQGHQ$XVGHKQXQJGHVUHVLGXHOOHQ 7XPRUJHZHEHV GD LQ GHQ ELOGJHEHQGHQ 9HUIDKUHQ GDV XUVSUQJOLFKH 7XPRUEHWW YRQ SRVWRSHUDWLYHQ9HUlQGHUXQJHQEHUODJHUWVHLQNDQQ'HP&KLUXUJHQ LVW LQ VROFKHQ )lOOHQ QLFKWEHNDQQWZLHJURGLHUHVLGXHOOH7XPRUPDVVHLVW>@'LHVUHVXOWLHUWGDQQKlXILJLQ weit ausgedehnten Nachresektionen und damit in hšherer MorbiditŠt (Gefahr der verlŠngerten Wundheilung und Rehabilitation, eventuell Funktionsverlust der betreffenden Region). Dies gilt vor allem, wenn knšcherne oder neurovaskulŠre Strukturen in der NŠhe des Tumorbetts liegen [15]. 28 Einleitung 1.6 3URJQRVWLVFKH)DNWRUHQIUGLH(QWVWHKXQJYRQ/RNDOUH]LGLYHQ 1.6.1 TherapieabhŠngige Faktoren 1.6.1.1 Resektionsrand und Operationsmodus Wie in vielen Studien gezeigt wurde, sind die meisten Lokalrezidive Folge inadŠquater PrimŠrresektion [2, 10, 15, 17]. Eine Assoziation besteht zwischen der QualitŠt des ResektionsUDQGHV GHU 7XPRUORNDOLVDWLRQ XQG DXVGHKQXQJ XQG GHP *UDGLQJ GD JURH tieflokalisierte G3-Sarkome hŠufiger in R1-Resektionen resultieren, was wiederum das Rezidivrisiko erhšht [17]. Tabelle 1: Korrelation zwischen Resektionsrand und Lokalrezidiv Intra- o. extrakompartimentŠres Wachstum Resektionsrand Differenzierung Lokalrezidivrisiko marginal niedrig 90% marginal hoch 70% weit niedrig intra- / extrakompartimentŠr 50% / 70% weit hoch intrakompartimentŠr 10% radikal niedrig intra- / extra- 10% / 20% radikal hoch 0% Quelle: Enneking [9] ,Q YHUVFKLHGHQHQ 6WXGLHQ NRQQWH JH]HLJW ZHUGHQ GD 5UHVH]LHUWH 3DWLHQWHQ DOVR PLNURVNRSLVFK YHUEOLHEHQHU 5HVLGXDOWXPRU HLQ HUK|KWHV /RNDOUH]LGLY JHJHQEHU 5 UHVH]LHUWHQ3DWLHQWHQKDEHQ>@,QHLQHUZHLWHUHQ6WXGLHZDUGDV5LVLNRIUHLQ Lokalrezidiv nach inadŠquater Resektion 3mal hšher als nach adŠquater Resektion (adŠquat = marginale Resektion mit Nachbestrahlung, weite oder radikale Resektion; inadŠquat = intralŠsionale Resektion oder marginale Resektion ohne Nachbestrahlung) [17]. Bei folgender Situation, unabhŠngig von adjuvanter Radiatio, wurden gar keine Rezidive beobachtet: G1, R0 (Abstand > 1 cm); 6 Rezidive entwickelten sich bei G1Tumoren nach R0-Resektion (Abstand < 0,5 cm) ohne Nachbestrahlung [50]. 1.6.1.2 Offene Biopsie Die prŠoperative offene Biopsie erhšht wegen der Gefahr der Tumorzellverschleppung die Rezidivrate [3] und sollte deshalb nur in AusnahmefŠllen und auch nur von dem Chirurgen, GHUIUGDVZHLWHUH3UR]HGHUHYHUDQWZRUWOLFKLVWGXUFKJHIKUWZHUGHQ>@ 1.6.1.3 Adjuvante Strahlentherapie In einigen Studien wurde eine Reduktion der Lokalrezidivrate durch adjuvante Radiatio gezeigt [6, 40]. ErklŠrt wird dies durch die erfolgreiche Vernichtung mikroskopischer Tumorfoci [2, 30, 34]. Die adjuvante Radiatio kann prŠoperativ, intraoperativ oder postoperativ erfolgen. In der Anwendung unterscheidet man die externe bzw. perkutane 29 Einleitung von der interstitiellen Radiatio, letztere mittels radioaktiver Implantate, die in die NŠhe des Tumors plaziert werden. Die postoperative perkutane Bestrahlung kommt am hŠufigsten zur Anwendung und resultiert in einer Rezidivrate von etwa 9-28 %, wie in vielen Studien gezeigt wurde [13, 29, 37, 45, 54]. 'LH *OLHGPDHQ HUKDOWHQGH 2SHUDWLRQ LQ .RPELQDWLRQ PLW 1DFKEH strahlung ist mittlerweile Standardtherapie. Da die Rezidivrate nach weiter Resektion ohne Nachbestrahlung bei ca. 10 % liegt, wird der Nutzen der postoperativen Radiatio bei dieser 5HVHNWLRQVDUW LQ )UDJH JHVWHOOW 'LHV JLOW YRU DOOHP IU VXENXWDQH E]Z LQWUDPXVNXOlUH Sarkome [43, 45]. In einer Studie mit 140 Patienten entwickelten die nachbestrahlten Patienten, die entweder R1-reseziert waren oder niedrig differenzierte Sarkome hatten, 5mal seltener Lokalrezidive als die nicht bestrahlten Patienten. Bei R0-resezierten Patienten oder hoch bis mittelgradig differenzierten Tumoren war die Rezidivsenkung durch Nachbestrahlung statistisch nicht signifikant [34]. Der prŠoperative Einsatz der Strahlentherapie erreicht einer Studie zufolge Šhnliche lokale Tumorkontrollraten wie der postoperative Einsatz [51], in einer anderen Studie hingegen ZDU GLH SUlRSHUDWLYH GHU SRVWRSHUDWLYHQ 5DGLDWLR EHUOHJHQ >@ 'D DEHU KlXILJ :XQG heilungsstšrungen vorkommen, sollte die prŠoperative Radiatio nur in EinzelfŠllen zur Verbesserung der lokalen OperabilitŠt angewendet werden [34]. 1.6.2 TumorabhŠngige Faktoren 1.6.2.1 Lokalrezidiv Patienten mit einem Lokalrezidiv haben gegenEHU3DWLHQWHQPLWHLQem PrimŠrtumor ein 2bis 7,4fach erhšhtes Risiko, erneut an einem Rezidiv zu erkranken [5, 35, 50]. 1.6.2.2 Grading Schlecht differenzierte Sarkome haben eine hšhere Rezidivrate als gut differenzierte [19]. In einer weiteren Studie war das Rezidivrisiko bei Anwesenheit von Tumornekrosen (gehen in die Beurteilung des Gradings mit ein) dreifach erhšht [17]. 1.6.2.3 7XPRUJU|H T2-Tumoren haben ein 40 % hšheres Rezidivrisiko als T1-Tumoren [5]. In zwei weiteren 6WXGLHQHUJDEHLQH7XPRUJU|HEHU cm ein erhšhtes Rezidivrisiko [11, 17]. 1.6.2.4 Lokalisation 1XU ZHQLJH $UEHLWHQ IDQGHQ HLQH SURJQRVWLVFKH 5HOHYDQ] IU GLH /RNDOLVDWLRQ ,Q HLQHU Studie war das Rezidivrisiko bei Tumorlokalisation im distalen Bereich der oberen ([WUHPLWlW PDO K|KHU >@ HLQH SODXVLEOH (UNOlUXQJ DOOHUGLQJV JDE HV GDIU QLFKW ,Q 30 Einleitung einer anderen Studie rezidivierten in Rumpf und Retroperitoneum lokalisierte Sarkome hŠufiger als jene, die in den ExtremitŠten lokalisiert waren [37]. 1.6.2.5 Regionaler Lymphknotenstatus Eine lymphogene Tumorausbreitung kommt bei den Sarkomen insgesamt sehr selten vor. Sind aber positive Lymphknoten vorhanden, so ist dies ein Zeichen der lokal fortgeVFKULWWHQHQ 7XPRUHUNUDQNXQJ GLH GDQQ KlXILJ GDV XUVSUQJOLFKH .RPSDUWLPHQW EHU schritten hat. Wenn mšglich, sollte in solchen FŠllen die Operation des PrimŠrtumors und die Lymphadenektomie im Rahmen einer KontinuitŠtsresektion erfolgen [34]. In einer Studie mit 140 Patienten entwickelten diejenigen Patienten mit positiven lokalen Lymphknoten hŠufiger Lokalrezidive als solche mit negativen Lymphknoten [34]. 1.6.2.6 Histologie Bei der Untersuchung des histologischen Typs als prognostischen Parameter fanden einige 6WXGLHQHUK|KWH/RNDOUH]LGLYUDWHQIUGDV/HLRP\RVDUNRP>@)LEURVDUNRP>@GHQ 03167>@XQGHLQHYHUPLQGHUWH5H]LGLYUDWHIUGDV/LSRVDUNRP>@ 1.7 Klinische Unterscheidung zwischen Lokalrezidiv und postoperativen VerŠnderungen 'LH 8QWHUVFKHLGXQJ ]ZLVFKHQ 6DUNRPUH]LGLY XQG QXU RSHUDWLY EHGLQJWHQ HQW]QGOLFKHQ 9HUlQGHUXQJHQ LP 6LQQH HLQHV ³3VHXGRUH]LGLYV³ VLHKH 6 33) durch bildgebende Verfahren ist deshalb so problematisch, weil fast jede Operation reaktive GewebsverŠnderungen auslšst, die das Vorhandensein von rezidivierendem oder residuellem Tumorgewebe verschleiern kšnnen. Dies gilt besonders dann, wenn eine diagnostische BildJHEXQJ IUK SRVWRSHUDWLY HUIROJW GD GDV :XQGEHWW LQ GLHVHU 3KDVH KlXILJ QRFK YRQ 6HURPHQRGHU+lPDWRPHQEHUODJHUWLVW=XHLQHP VSlWHUHQ =HLWSXQNW ZLHGHUXP N|QQHQ ausgeprŠgte Fibrosierungen vorliegen, die das Wundbett ebenfalls maskieren. In der Literatur gibt es insgesamt nur sehr wenige Arbeiten, die sich mit diesem Thema beschŠftigen. 1.7.1 MRT In der PrimŠrdiagnostik von Weichteilsarkomen ist die MRT immer mehr verbreitet [31, @XQGGHU&7LQVJHVDPWEHUOHJHQ>@ In der postoperativen Verlaufskontrolle bzw. der Unterscheidung zwischen Rezidiv oder Pseudorezidiv wird ebenfalls die MRT als wichtiges diagnostisches Mittel favorisiert [20, 56]. In einigen weiteren Studien wurde hinsichtlich der Unterscheidung zwischen Rezidiv XQGHQW]QGOLFKHQSRVWRSHUDWLYHQ9HUlQGHUXQJHQGLH057DXIGLHMHZHLOVYHUVFKLHGHQHQ 31 Einleitung Signalgebungen untersucht und auch die SpezifitŠt und SensitivitŠt berechnet [4, 7, 16, 38, 55]. 1.7.2 Andere Diagnostik In einer Studie von Kostakoglu et al. wurde die Thallium-201-Szintigrafie mit der MRT und anderen bildgebenden Verfahren hinsichtlich der Differenzierung zwischen Tumorrezidiv oder -UHVLGXXP XQG 3VHXGRUH]LGLY YHUJOLFKHQ 'HUHQ (UJHEQLVVH ]HLJHQ GD GLH 6]LQWLJUDILHGHU057LQ6HQVLWLYLWlWXQG6SH]LILWlWEHUOHJHQLVW>@ 1.8 †berlebensrate von Patienten mit einem Lokalrezidiv Statistisch gesehen haben Patienten mit Fernmetastasen hŠufiger Lokalrezidive als Patienten ohne Fernmetastasen, und die †berlebensrate von Patienten mit Rezidiv ist geringer, verglichen mit der von Patienten mit einem PrimŠrtumor, d.h. jedes Rezidiv ist HLQ ,QGLNDWRU IU HLQH VFKOHFKWH 3URJQRVH LQ %H]XJ DXI 0HWDVWDVHQ XQG GLH LangzeitEHUOHEHQVUDWH > @ 'DKHU VWHOOW VLFK GLH )UDJH RE /RNDOUH]LGLYH DOV 8UVDFKH IU PHWDVWDWLVFKHV:DFKVWXPDQ]XVHKHQVLQG)ROJHQGH:HUWHEH]JOLFKGHU-DKUHV0)h5 (= metastasenfreie †berlebensrate) ergab eine Studie mit Patienten, die an einem Sarkomrezidiv litten [18]: · -DKUHV0)h5PHWDVWDVHQIUHLHhEHUOHEHQVUDWHIU3DWLHQWHQPLW/RNDOUH]LGLY % · -DKUHV0)h5IU3DWLHQWHQPLW/RNDOUH]LGLYDEHURKQH)HUQPHWDVWDVHQ % · -DKUHV0)h5IU3DWLHQWHQRKQH/RNDOUH]LGLY % *HJHQGLH9HUPXWXQJ/RNDOUH]LGLYHN|QQWHQIUPHWDVWDWLVFKHV:DFKVWXPYHUDQWZRUWOLFK VHLQ VSULFKW GLH 7DWVDFKH GD 0HWDVWDVHQ RIW ]HLWJOHLFK PLW GHP 5H]LGLY DXIWUHWHQ PDQFKPDO VRJDU IUKHU $XHUGHP IKUHQ KRFKPDOLJQH 7XPRUHQ * * KlXILJHU ]X Lokalrezidiven [19] und Fernmetastasen als niedrigmaligne Tumoren [42]. Demnach N|QQWH GLH 0HWDVWDVHQELOGXQJ DXI GDV DJJUHVVLYH 7XPRUZDFKVWXP ]XUFN]XIKUHQ VHLQ und nicht auf das Lokalrezidiv. Bei Dedifferenzierung des Tumorrezidivs allerdings kann es durch die nun hšhere MalignitŠt zu metastatischen Absiedlungen kommen. Wiederum ist aber nicht das Lokalrezidiv verantwortlich, sondern die hohe TumormalignitŠt [17, 42]. In einer weiteren Studie mit R1-resezierten Sarkomen hatten die tieflokalisierten, niedrig differenzierten Tumoren ein erhšhtes Rezidivrisiko und eine erhšhte MortalitŠt, bei gleichem Resektionsmodus von G1-Tumoren stieg hingegen nur das Rezidivrisiko, aber nicht die MortalitŠt. Bei nur 6 % aller hoch differenzierten Sarkome entwickelten sich Fernmetastasen [5]. 'D KRFKPDOLJQH E]Z VFKOHFKW GLIIHUHQ]LHUWH 7XPRUHQ HLQH 3UlGLVSRVLWLRQ VRZRKO IU /RNDOUH]LGLYHDOVDXFKIUV\VWHPLVFKH5H]LGLYHGDUVWHOOHQNRUUHOLHUHQ/RNDOUH]LGLYH]ZDU PLWGHP$XIWUHWHQYRQ0HWDVWDVHQVLQGDEHUQLFKWXUVlFKOLFKIUVLHDQ]XVHKHQ>@ 32 Fragestellung 2 Fragestellung :HLFKWHLOWXPRUHQ QHLJHQ ]XU $XVELOGXQJ YRQ /RNDOUH]LGLYHQ VR GD VLFK GHU 3DWLHQW LQ vielen FŠllen einer zweiten (QWHQ 5H]LGLYRSHUDWLRQ XQWHU]LHKHQ PX ,P 5DKPHQ GHU DQVFKOLHHQGHQKLVWRORJLVFKHQ$XIDUEHLWXQJGHV5HVHNWLRQVJXWHVNDQQGLH'LDJQRVHHLQHV Tumorrezidivs aber nicht immer bestŠtigt werden. Bei der feingeweblichen Aufarbeitung VRJHQDQQWHU 1DFKUHVHNWDWH LP ,QVWLWXW IU 3DWKRORJLH GHU .OLQLNHQ %HUJPDQQVKHLO ILHO DXI GD HLQLJH 3UlSDUDWH HQWJHJHQ GHU NOLQLVFK YHUPXWHWHQ 'LDJQRVH NHLQ 7XPRUgewebe mehr enthielten. Statt dessen fanden sich verschiedene nicht maligne, postoperative 9HUlQGHUXQJHQLQIODPPDWRULVFKILEU|V|GHPDW|VKLHUQDFKIROJHQGDOV³3VHXGRUH]LGLY³ bezeichnet, im ehemaligen Tumorbett. 'D 2SHUDWLRQHQ YRQ 6DUNRPUH]LGLYHQ LQ LKUHP 8PIDQJ DXV 6LFKHUKHLWVJUQGHQ RIW radikaler und ausgedehnter als die primŠre Tumorresektion sind und somit den Patienten teilweise erheblich belasten, ist die bereits in der prŠoperativen Diagnostik mšglichst sichere Entscheidung, ob es sich um ein Rezidiv oder um postoperative VerŠnderungen KDQGHOWEHVRQGHUVZQVFKHQVZHUW Hieraus ergibt sich die Fragestellung, ob es mšglich ist, durch den Vergleich prŠoperativer klinischer und bildgebender Befunde mit dem postoperativ tatsŠchlich am Resektat erhobenen histologischen Befund bereits prŠoperativ eine mšglichst zuverlŠssige EntVFKHLGXQJ]XWUHIIHQREHVVLFKXP7XPRUJHZHEHRGHUOHGLJOLFKHQW]QGOLFKYHUlQGHUWHV Gewebe im Sinne eines Pseudorezidivs handelt. Zur Bearbeitung dieser Frage sollten folgende Parameter herangezogen werden: 1. Prognostische Parameter (patientenabhŠngige, tumorabhŠngige und therapieabhŠngige) sollen herausgearbeitet werden, die hŠufig mit dem Auftreten von Sarkomrezidiven assoziiert sind. Von diesen Parametern soll besonders der Sicherheitsabstand zwischen Tumorgewebe und Absetzungsebene der vorhergehenden Operation untersucht und mit dem histopathologischen Befund am Nachresektat verglichen werden, um auch hier die )UDJH ]X SUIHQ QDFK ZLHYLHO FP 6LFKHUheitsDEVWDQG HLQ ]XNQIWLJHV 7XPRUUH]LGLY immer seltener auftritt. 2. Vier verschiedene klinische Untersuchungsmethoden (kšrperliche Untersuchung, Sonografie, CT, MRT), die in der prŠoperativen Diagnostik vor den Rezidivoperationen angewendet wurden, sollen auf ihre korrekte Vorhersage (Rezidiv / kein 5H]LGLYEHUSUIWZHUGHQ 33 Material und Methode 3 Material und Methode 3.1 Idee und Ursprung der Arbeit Ausgangspunkt der Arbeit waren Weichteilsarkomresektate, die in der UniversitŠtsklinik %HUXIVJHQRVVHQVFKDIWOLFKH .OLQLNHQ %HUJPDQQVKHLO .OLQLN IU 3ODVWLVFKH &KLUXUJLH 'LUHNWRU 3URI 'U 6WHLQDX FKLUXUJLVFK HQWIHUQW XQG DQVFKOLHHQG LP ,QVWLWXW IU Pathologie an der Klinik untersucht wurden. Bei den Operationen handelte es sich aus- VFKOLHOLFK XP 1DFKUHVHNWLRQHQ YRQ 6DUNRPHQ GHUHQ SULPlUH FKLUXUJLVFKH %HKDQGOXQJ meistens in auswŠrtigen Kliniken stattgefunden hatte. Als bei der Aufarbeitung der Proben DXIILHO GD HLQLJH NHLQ 7XPRUJHZHEH PHKU HQWKLHOWHQ ZXUGHQ GDUDXIKLQ ]XQlFKVW DOOH pathologisch-anatomischen Begutachtungen von ehemaligen und neu eingesandten Weichteiltumorresektaten gesammelt. Als sich die FŠlle mit der Diagnose "postoperative HQW]QGOLFKH 9HUlQGHUXQJHQ KlXIWHQ ZXUGH LP 'H]HPEHU GDUDXV GDV 7KHPD IU eine Doktorarbeit entwickelt. 3.2 Material 3.2.1 Materialumfang Insgesamt wurden 132 Weichteilsarkomresektate makroskopisch und feingeweblich aufgearbeitet. Davon wurden 128 Resektate im Bergmannsheil untersucht, 4 Resektate VWDPPWHQ DXV DXVZlUWLJHQ ,QVWLWXWHQ IU 3DWKRORJLH 'UHL )lOOH VWDPPWHQ DXV GHQ -DKUHQ 1991/92, 21 FŠlle aus den Jahren 1993/94, 65 aus den Jahren 1995/96 und 43 aus den Jahren 1997/98. Die in diesem Zeitraum gesammelten pathologisch-anatomischen Begutachtungen und die jeweils zugehšrigen Krankenakten wurden retrospektiv auf bestimmte Parameter untersucht. Insgesamt wurden die Befunde und Akten von 83 3DWLHQWHQEHDUEHLWHW'LHXUVSUQJOLFKH=DKOGHU5HVHNWDWHE]Z3DWLHQWHQZDUQRFKJU|HU MHGRFKVWHOOWHVLFKZlKUHQGGHU%HDUEHLWXQJKHUDXVGDYLHOH$NWHQZHJHQXQ]XUHLFKHQGHU Angaben nicht verwendet werden konnten. Ansonsten wurden sŠmtliche Informationen EHU ]XYRU HUIROJWH 7KHUDSLH XQG 'LDJQRVWLN DXV 2SHUDWLRQVbericht, Bestrahlungs- oder Chemotherapieprotokoll, pathologisch-anatomischer Begutachtung, kšrperlichem bzw. bildgebendem Untersuchungsbefund und der Anamnese entnommen. Wichtige Informationen konnten auch Arztbriefen oder allgemeinen Nachsorgeprotokollen entnommen werden, falls die entsprechenden Untersuchungsbefunde fehlten. 34 Material und Methode 3.2.2 Gliederung des Materials 1DFK $XVVFKOX GHV QLFKW YHUZHUWEDUHQ 0DWHULDOV EOLHEHQ DOVR PDNURVNRSLVFK XQG PLNURVNRSLVFKXQWHUVXFKWH5HVHNWDWHYRQLQVJHVDPW3DWLHQWHQEULJ'LH(UJHEQLVVHGHU pathologisch-anatomischen Begutachtungen wurden in vier Gruppen eingeteilt. · · · · Rezidiv (richtig positive Diagnose): alle prŠoperativ nicht eindeutig gesicherten LŠsionen, die rezidivverdŠchtig waren und sich spŠter tatsŠchlich als Rezidiv erwiesen. Pseudorezidiv (nicht maligne postoperative VerŠnderung = falsch positive prŠoperative Diagnose): alle prŠoperativ nicht eindeutig gesicherten LŠsionen, die sich spŠter als QLFKWPDOLJQHVOHGLJOLFKSRVWRSHUDWLYHQW]QGOLFKYHUlQGHUWHV*HZHEHHUZLHVHQ Pseudorezidiv (Wundkorrektur = richtig negative prŠoperative Diagnose): alle prŠoperativ nicht tumorverdŠchtigen LŠsionen, die wegen Wundheilungsstšrungen oder aus rein kosmeWLVFKHQ *UQGHQ HUQHXW operiert worden waren. Auch diese 5HVHNWDWHZXUGHQVRUJIlOWLJDXIHYHQWXHOOYRUKDQGHQHV7XPRUJHZHEHEHUSUIW Residualtumor (richtig positive Diagnose): alle bereits prŠoperativ eindeutig als Tumorresiduen gesicherten LŠsionen. Die Mehrheit der Patienten waren das erste Mal an einem Rezidiv oder Residualtumor erkrankt. Einige hatten sich jedoch schon mehrmals einer Rezidiv- bzw. Residualoperation unterzogen. In solchen FŠllen wurde, wenn mšglich, jedes einzelne Rezidiv gesondert bearbeitet und dementsprechend als einzelner Fall betrachtet. So ergaben sich aus 83 verschiedenen Patienten letztendlich 116 FŠlle, wie nachfolgend beschrieben: Bei 65 Patienten wurde jeweils nur ein Resektat untersucht, bei 12 Patienten je zwei Resektate, bei zwei Patienten jeweils drei, bei weiteren zwei Patienten jeweils vier, bei einem 3DWLHQWHQIQIXQGEHLHLQHPZHLWHUHQ3DWLHQWHQDFKW5HVHNWDWH Die insgesamt 116 FŠlle setzen sich wie folgt zusammen: · · · · 55 Rezidivtumoren 30 postoperative, nicht maligne VerŠnderungen 2 Wundkorrekturen 29 Residualtumoren 35 Material und Methode 3.3 Methode 3.3.1 Histologische Aufarbeitung der Resektate Die 1997 und 1998 eingesandten auf ein Sarkomrezidiv verdŠchtigen PrŠparate wurden im Rahmen der Studie in AbstŠnden von etwa 0,5 cm Breite lamelliert, um daraus die Paraffinblšcke und letztendlich die SchnittprŠparate anfertigen zu kšnnen. Die Aufarbeitung und mikroskopische Begutachtung erfolgte durch die mit der WeichteilSDWKRORJLHEHIDWHQ0LWDUEHLWHUGHV,QVWLWXWV Folgende Parameter wurden untersucht: 1. QualitŠt und QuantitŠt des Gewebes zwischen Tumor und Absetzungsrand Dazu wurde jede vom Chirurgen markierte Absetzungsebene des PrŠparats gesondert auf Tumorfreiheit bzw. den minimalen Sicherheitsabstand untersucht. Bei sehr geringen SicherheitsabstŠnden wurde zusŠtzlich die QualitŠt des Resektionsrandes dokumentiert. Letztendlich wurde die ResektionsqualitŠt (R0, R1 oder R2), der minimale Sicherheitsabstand in cm und die Anwesenheit von Satellitenmetastasen dokumentiert. 2. QualitŠt und QuantitŠt des Tumor(-verdŠchtigen) Gewebes Hierbei wurden vor allem die PrŠparate genauer untersucht, die bei der primŠren mikroskopischen Begutachtung zunŠchst als Pseudotumor klassifiziert worden waren. Bei unklarer histologischer EntitŠt wurden immunhistochemische Untersuchungen angeschlossen. Die ZHLWHUH%HJXWDFKWXQJHUIROJWHKLQVLFKWOLFKEOLFKHU)DNWRUHQZLH*UDGLQJ6WDJLQJXD Abbildung 1: Makrofotogramm eines auf Kork aufgespannten tumorfreien Liposarkomnachresektats. Das PrŠparat stammt aus der linken Leiste eines 48-jŠhrigen Patienten. 4XHOOH,QVWLWXWIU3DWKRORJLHDQGHQ.OLQLNHQ%HUJPDQQVKHLO 36 Material und Methode Abbildung 2: Makrofotogramm eines 18,5x8,5x18,5 cm messenden Sarkoms. Das PrŠparat (Sarkom NOS, ehemals MFH, G2) stammt aus der Thoraxwand eines 61-jŠhrigen Patienten, nicht in sano. Deutlich zu erkennen sind das knotige Wachstum unter der teilweise noch intakten Haut, das atypische Vaskularisationsmuster und die oberflŠchliche Exulceration. 'LHVHV5HVHNWDWZXUGHQLFKWDXIJHVSDQQWEHUVDQGWGDKLHUHLQH55HVHNWLRQEHUHLWVDXV NOLQLVFKHU6LFKWQLFKWP|JOLFKZDU4XHOOH,QVWLWXWIU3DWKRORJLHDQGHQ.OLQLNHQ Bergmannsheil Abbildung 3: prŠoperativ angefertigtes CT des in Abb. 2 gezeigten Resektats. Da hier ein JURHVBrustwandsarkom mit tiefer mediastinaler Infiltration vorliegt, war eine In-sano5HVHNWLRQQLFKW]XHUUHLFKHQ4XHOOH,QVWLWXWIU3DWKRORJLHDQGHQ.OLQLNHQ%HUJPDQQVKHLO 37 Material und Methode 3.3.2 Eingabe der verschiedenen Parameter in eine Datenmaske Mit Hilfe des Datenbankprogramms Microsoft Access wurde eine Datenmaske erstellt. In GLHVH ZXUGHQ GDQQ DXV GHP DNWXHOOHQ SDWKRORJLVFKDQDWRPLVFKHQ %HIXQG $QJDEHQ EHU den zu beschreibenden, aktuellen Tumor und aus der zugehšrigen Krankenakte Angaben EHU3DWLHQWHQ9RUJHVFKLFKWHYRUKHULJHQ7XPRU7KHUDSLHXQG'LDJQRVWLNHLQJHJHEHQ 3.3.2.1 Angaben zum aktuell untersuchten Tumor Tumorkategorie Bei der Eingabe in dieses Feld wurde zwischen den vier Kategorien Rezidiv, NarbengewebeVWHOOYHUWUHWHQGIUSRVWRSHUDWLYHQLFKWPDOLJQH9HUlQGHUXQJHQResidualtumor und Wundkorrektur (bei Wundheilungsstšrungen oder kosmetischer Indikation) unterschieden. Als Rezidive galten Tumoren, die zuvor im Gesunden oder unsicher im *HVXQGHQ RSHULHUW ZRUGHQ ZDUHQ DXHUGHP QLFKW LP *HVXQGHQ RSHULHUWH 7XPRUHQ GLH DEHU SRVWRSHUDWLY ]XVlW]OLFK HLQHU 1DFKEHVWUDKOXQJ XQG RGHU &KHPRWKHUDSLH ]XJHIKUW worden waren. Als Residualtumoren galten zuvor nicht im Gesunden operierte Tumoren ohne Nachbestrahlung und / oder Chemotherapie. Diagnose Hier wurde der jeweilige histologische Typ (z. B. Liposarkom), wenn mšglich mit Subklassifizierung (z. B. rundzellig) eingegeben. Handelte es sich um die Kategorie Narbengewebe, wurde die vorherrschende histologische VerŠnderung (z. B. granulierende (QW]QGXQJDQJHJHEHQ$XHUGHPZXUGH YHUPHUNW RE HLQ :HFKVHO LQ GHU +DXSWWXPRU diagnose oder Subklassifizierung zwischen aktuellem und vorherigem Sarkom vorlag. Grading Hier wurden der jeweilige Differenzierungsgrad (siehe Kapitel 1.2, S. 6) und eine eventuelle €nderung desselben zwischen aktuellem und vorherigem Sarkom vermerkt. Enthielt der Tumor zwei Differenzierungsstufen, wurde dies mit G1-2; G2-3 oder G3-4 angegeben. Staging Hier wurde die Tumorausdehnung mittels der TNM-Klassifizierung (siehe Kapitel 1.2, S. 6) und eine eventuelle €nderung derselben zwischen aktuellem und vorherigem Sarkom angegeben. 7XPRUJU|H Diese setzte sich wiederum aus mehreren Parametern zusammen: Die Anzahl der Tumorknoten wurde entweder durch die entsprechende Ziffer oder bei multiplen Tumorknoten als disseminiert beschrieben. Der 'XUFKPHVVHU GHV JU|WHQ 7XPRUNQRWHQV ZXUGHZHQQP|JOLFKIUDOOHGUHL(EHQHQLQFPDQJHJHEHQ0LWGHU*HVDPWJU|H war die FlŠche gemeint, auf der sich die einzelnen Tumorknoten ausbreiteten. Sie wurde als JU|WHU 'XUFKPHVVHU ZHQQ P|JOLFK IU DOOH GUHL (EHQHQ LQ FP DQJHJHEHQ :DU GLH 38 Material und Methode *HVDPWJU|HLQGHUSDWKRORJLVFKDQDWRPLVFKHQ%HJXWDFKWXQJQLFKWDQJHJHEHQZXUGHKLHU QRFKPDOV GLH *U|H GHU E]Z GHV HLQ]HOQHQ 7XPRUNQRWHQV EHVFKULHEHQ :DU GLH GesamtJU|H DOV QXU PLNURVNRSLVFK IDEDU RGHU QXU HLQ]HOQH 7XPRUzellen" beschrieben, erfolgte hier ebenfalls die Angabe "mikroskopisch". Satellitenknoten Hier wurde angegeben, ob jenseits des Haupttumors abgesprengte sogenannte Satellitenmetastasen vorhanden waren oder nicht. Tumorlokalisation Hier wurden 14 verschiedene anatomische Regionen unterschieden: Kopf und Hals; Schulter; Oberarm; Unterarm; Hand; Thorax (anterior et posterior); Abdomen (anterior et SRVWHULRU 5HWURSHULWRQHXP 9LV]HUXP *HVl 2EHUVFKHQNHO 8QWHUVFKHQNHO )X 8QWHU dem Parameter Genauere Tumorlokalisation wurde die betreffende Region nŠher beschrieben, durch Attribute wie z. B. proximal, distal, medial oder lateral. Infiltrierte Strukturen Hier erfolgte zunŠchst die Unterscheidung nach oberflŠchlicher, faszialer oder tiefer Lokalisation - unabhŠngig davon, ob es sich um Tumor- oder Narbengewebe handelte -, ZREHL PLW REHUIOlFKOLFK GLH ,QILOWUDWLRQ YRQ DXVVFKOLHOLFK (SLGHUPLV &RULXP RGHU Subkutis, mit "faszial" die Infiltration der darunter liegenden Faszie oder breitbasige Auflagerung auf derselben und mit "tief" die Infiltration von Muskulatur und / oder tiefer gelegenen Strukturen gemeint war. ZusŠtzlich wurden die jeweils infiltrierten Strukturen so genau wie mšglich benannt (z. B. Subkutis, Knochen, Periost etc.). ResektionsrŠnder Hier wurde die QualitŠt der ResektionsrŠnder der jetzigen Operation vermerkt (siehe Kapitel 1.2, S. 6). Konnte eine eindeutige Entscheidung zwischen den drei Mšglichkeiten R0; R1 oder R2 nicht getroffen werden, erfolgte die Angabe R0/1 oder R1/2. Unter dem Parameter Minimaler Abstand in cm erfolgte die Eingabe des geringsten Sicherheitsabstands im Resektat durch die entsprechende Ziffer. Bei fehlender Angabe wurde die Ziffer Null eingegeben. War die Tumorresektion nicht im Gesunden erfolgt, NRQQWHGLHVHV)HOGGHILQLWLRQVJHPlQLFKWDXVJHIOOWZHUGHQ Unter dem Parameter †brige Absetzungsebenen wurden die SicherheitsabstŠnde der UHVWOLFKHQ 5HVHNWDWUlQGHU DQJHJHEHQ $XHUGHP HUIROJWH LQ GLHVHP )HOG HLQH JHQDXHUH Beschreibung der QualitŠt des Resektionsrandes bei sehr geringen SicherheitsabstŠnden. Immunhistochemie +LHU ZXUGH QXU DQJHJHEHQ RE LPPXQKLVWRFKHPLVFKH 8QWHUVXFKXQJHQ GXUFKJHIKUW worden waren oder nicht. 39 Material und Methode 3.3.2.2 Angaben zum vorherigen Tumor Sie erfolgten nach denselben Parametern wie die Angaben zum jetzigen Tumor; lediglich die Parameter Diagnosewechsel, Gradingwechsel und Stagingwechsel waren hier irrelevant und wurden deshalb nicht verwendet. 3.3.2.3 Angaben zur vorherigen Operation Datum und Ort ZunŠchst wurden Datum und Ort der Operation angegeben. Beim Ort erfolgte nur die 8QWHUVFKHLGXQJ ]ZLVFKHQ %HUJPDQQVKHLO XQG $XVZlUWVµ VWHOOYHUWUHWHQG IU DOOH DXV wŠrtigen Kliniken). Art der Operation Unter diesem Parameter wurde der jeweilige Resektionsmodus eingegeben. Es gab sieben verschiedene Eingabemšglichkeiten: "lokale Resektion", "weite Resektion", "Muskelgruppenresektion", "Kompartimentresektion", "Amputation", "palliative Resektion" und "Wundkorrektur". 'HU%HJULIIORNDOH5HVHNWLRQJDOWIUHLQH7XPRUHQWIHUQXQJPLWVHKUJHULQJHPRGHUJDU NHLQHP6LFKHUKHLWVDEVWDQGXQGZHLWH5HVHNWLRQIUHLQHQGHILQLHUWHQJU|HUHQ6LFKHU heitsabstand in allen Ebenen. "Muskelgruppen- bzw. Kompartimentresektion" bedeutete die Entfernung eines oder mehrerer Muskeln bzw. Kompartiments, "palliative Resektion" die partielle Tumorentfernung, wenn eine komplette Heilung nicht mehr mšglich war. Dabei spiegeln die Angaben die Ansicht des Chirurgen, also das makroskopische Operationsergebnis wider und kšnnen vom tatsŠchlichen histologischen Ergebnis abweichen. So konnte ein laut Operationsbericht mit weitem Abstand (also weite Resektion) resezierter Tumor histologisch jedoch einen sehr geringen Sicherheitsabstand zeigen. AbsetzungsrŠnder laut OP-Bericht Hier wurde angegeben, ob die Tumorentfernung nach Ansicht des Chirurgen, also nach makroskopischen Gesichtspunkten, im Gesunden erfolgte oder nicht. Es gab die Eingabemšglichkeiten "in sano", "nicht sicher in sano" oder "nicht in sano". Dieses Feld sollte mšgliche Differenzen zum tatsŠchlichen pathologischen Resektionsergebnis aufzeigen. Welche Strukturen wurden entfernt ? 8QWHU GLHVHP 3DUDPHWHU ZXUGH P|JOLFKVW JHQDX IHVWJHKDOWHQ ZLH JUR GDV HQWIHUQWH PrŠparat war, welche Weichteile entfernt wurden (Dermis, Subkutis, Muskulatur, Knochen etc.), ob das Resektat in toto oder fraktioniert entnommen wurde. 40 Material und Methode 3.3.2.4 Angaben zur Therapie Anzahl der Operationen insgesamt In diesem Feld wurde angegeben, wie oft der Patient bisher (jetzige Resektion und auch PHKUHUH -DKUH ]XUFNOLHJHQGH 5HVHNWLRQHQ HLQJHVFKORVVHQ ZHJHQ GHV 6DUNRPV RSHULHUW wurde. Probeexzisionen und Biopsien wurden hier ausgeschlossen. Nachbehandlung Es wurde jeweils angegeben, ob zwischen aktuellem und vorherigem Tumor eine Strahlentherapie, systemische Chemotherapie oder Chemotherapie unter lokaler Hyperthermie HUIROJW ZDU RGHU QLFKW $XHUGHP ZXUGH GHU Zeitraum der jeweiligen Behandlung vermerkt. 3.3.2.5 Angaben zum Patienten Hier wurden nur das Geschlecht und Alter des Patienten (sowohl Geburtsjahr als auch Alter bei Erstdiagnose) angegeben. 3.3.2.6 Angaben zur Vorgeschichte Datum und Ort ZunŠchst wurden Datum und Ort der primŠren Sarkomdiagnose angegeben. Beim Ort erfolgte nur die Unterscheidung zwischen "Bergmannsheil" und "AuswŠrts" (stellverWUHWHQGIUDOOHDXVZlUWLJHQ.OLQLNHQXQG3UD[HQ Tumoranamnese +LHU ZXUGHQ $QJDEHQ EHU (UVWV\PSWRPH ]XHUVW EHKDQGHOQGHQ $U]W ZHOFKH )DFK richtung, Krankenhaus oder Praxis), zunŠchst vermutete Diagnose, erste Diagnostik und 7KHUDSLH JHPDFKW 'D GLH $QJDEHQ KLHUEHU WHLOZHLVH VHKU OFNHQKDIW ZDUHQ ZXUGHQ VLH DOOH LQ HLQHP HLQ]LJHQ )HOG ]XVDPPHQJHIDW XQG QXU HLQLJH ZLH IROJW ZHLWHU DXIJHVFKOVVHOW Zeitraum zwischen Erstsymptomen und der primŠren Sarkomdiagnose Damit war der zeitliche Abstand zwischen dem Auftreten erster Symptome und dem Zeitpunkt der Sarkomerstdiagnose gemeint. Die Angabe des entsprechenden Zeitraums erfolgte in Wochen, Monaten oder Jahren. Sarkomdiagnose, wodurch ? Unter diesem Parameter sollte das diagnostische Verfahren angegeben werden, durch das die Sarkomdiagnose gestellt werden konnte. Hier gab es die vier verschiedenen Eingabemšglichkeiten "Tumorresektion" (im Sinne einer prompten kompletten Tumorentfernung), "PE" (ProbeH[]LVLRQ %LRSVLH XQG %LOGJHEXQJ VWHOOYHUWUHWHQG IU HLQH UDGLRORJLVFKH Diagnostik). 41 Material und Methode Zeitraum zwischen Sarkomdiagnose und der ersten Operation Die Angabe des entsprechenden Zeitraums erfolgte in Wochen, Monaten oder Jahren. In vielen FŠllen war die Sarkomdiagnose gleichzeitig die erste Operation, dann erfolgte die Eingabe der Ziffer Null. Anzahl der Rezidive insgesamt In diesem Feld wurde angegeben, um das wievielte Rezidiv bzw. Residualtumor es sich bei dem aktuellen Tumor handelte; bzw. bei den Kategorien Narbengewebe und Wundkorrektur, wieviele Rezidiv- oder Residualtumoren bereits vorausgegangen waren. 3.3.2.7 Angaben zur prŠoperativen Diagnostik Durch welches Verfahren wurde das erneute Tumorwachstum festgestellt bzw. vermutet ? Bei diesem Parameter gab es neun verschiedene Eingabemšglichkeiten: "MRT", "CT", "Sonografie", "kšrperliche Untersuchung", "Selbst", "PE oder Biopsie", "R1- oder R2Resektion des vorherigen Tumors", "unsichere R0-Resektion des vorherigen Tumors" und "kein Rezidivverdacht". Hatten verschiedene Untersuchungen das gleiche Ergebnis gezeigt, wurde jene genannt, die zeitlich zuerst erfolgt war. Gab es keine zeitlichen Differenzen, waren mehrere Nennungen mšglich. Bei der Kategorie Wundkorrektur erfolgte grundsŠtzlich die Eingabe "kein Rezidivverdacht". Bei der Kategorie Residualtumor erfolgte in diesem Feld immer die Angabe "R1- oder R2Resektion des vorherigen Tumors", da ein Tumorwachstum in diesen FŠllen eindeutig EHNDQQW ZDU XQG GDKHU QLFKW PHKU IHVWJHVWHOOW RGHU YHUPXWHW ZHUGHQ PXWH 'LH 2SWLRQ "unsichere R0-Resektion des vorherigen Tumors" wurde dann eingegeben, wenn nicht klar war, ob die vorherige Resektion im Gesunden erfolgte oder der Sicherheitsabstand ausreichend war. Oft war dieser Unsicherheitsfaktor die einzige Operationsindikation ohne zusŠtzliche Untersuchungen. Angewandte Diagnostik mit jeweiligem Ergebnis +LHU ZXUGH IU DOOH DXVJHVXFKWHQ GLDJQRVWLVFKHQ 3DUDPHWHU N|USHUOLFKH 8QWHUVXFKXQJ Sonografie, CT, MRT, Selbst und Sonstiges) jeweils angegeben, ob sie prŠoperativ angewendet wurden oder nicht und falls ja, auf die verschiedenen mšglichen Diagnosen IROJHQGHUPDHQ EHUSUIW HUJDE +LQZHLV DXI /RNDOUH]LGLY HUJDE NHLQHQ +LQZHLV DXI Lokalrezidiv", "keine eindeutige Aussage mšglich". Der Parameter "Selbst" galt hier stellYHUWUHWHQG IU 6\PSWRPH 6FKPHU]HQ 6FKZHOOXQJ HWF GLH GHU 3DWLHQW VHOEVW EHPHUNW hatte. Unter dem Parameter "Sonstiges" konnten Ergebnisse von anderen Untersuchungen (z. B. Biopsie, Szintigrafie etc.) eingetragen werden. 42 Material und Methode Abstand Hier wurde angegeben, in welchem zeitlichen Abstand (Angabe in Wochen, Monaten oder Jahren) nach der vorherigen bzw. vor der jetzigen Operation die angewandte Diagnostik N|USHUOLFKH 8QWHUVXFKXQJ 6RQRJUDILH &7 057 6HOEVW XQG 6RQVWLJHV GXUFKJHIKUW wurde. Befund Hier erfolgte eine kurze Zusammenfassung des schriftlichen Untersuchungsbefundes der obengenannten Diagnostik. 43 Ergebnisse 4 Ergebnisse Insgesamt wurden die Daten von 83 Patienten ausgewertet. Hinsichtlich der aktuellen Erkrankung lagen bei 29 Patienten Rezidive (richtig positive Diagnose) vor und bei 24 Patienten Residualtumoren (richtig positive Diagnose); bei 28 Patienten fanden sich nicht maligne, postoperative VerŠnderungen (falsch positive Diagnose) im Nachresektat und bei 2 Patienten wurde eine Wundkorrektur (richtig negative Diagnose) nach zuvor erfolgter Sarkomoperation vorgenommen, hier fand sich ebenfalls kein Tumorgewebe mehr im Resektat. Aus diesem Patientengut ergaben sich dann insgesamt 55 Rezidive, 30 nicht maligne, postoperative VerŠnderungen, 29 Residualtumoren und 2 Wundkorrekturen, also insgesamt 116 verschiedene FŠlle. Die gesamten 116 FŠlle wurden nur zur Analyse sogenannter variabler Parameter, d.h. von jeweiliger Operation und Diagnostik abhŠngige Parameter (z. B. Operationsmodus), verwendet. Bei der Untersuchung fixer Parameter (z. B. Patientenalter, Tumorlokalisation) ZXUGHQQDWUOLFKVWHWVQXUGLHYHUVFKLHGHQHQ3DWLHQWHQKHUDQJH]RJHQ Tabelle 2: Aktuelle Diagnose und bisheriger Krankheitsverlauf aller 83 Tumorpatienten Aktuelle Tumorerkrankung, bzw. -diagnose Anzahl der Patienten relativ / absolut davon Anzahl der Patienten mit vorheriger Entfernung von PrimŠrtumorgewebe Narbengewebe Residualtumor (richtig positive Diagnose) 29% / 24 19 - Rezidiv- oder Residualtumorgewebe 5 Rezidivtumor (richtig positive Diagnose) 35% / 29 5 1 23 tumorfreies Resektat (falsch positive Diagnose) 34% / 28 20 3 5 tumorfreies Resektat (richtig negative Diagnose) insgesamt 2% / 2 1 - 1 100% / 83 Quelle: eigene Darstellung Die nachfolgenden Abbildungen 4 und 5 zeigen den bisherigen Krankheitsverlauf aller 83 Patienten, anhand der Anzahl der operativen Eingriffe seit Sarkomdiagnose (einVFKOLHOLFK PrimŠrresektion). Die oberste Markierung (Kreis) bei jedem Patienten entspricht der DNWXHOOHQ (UNUDQNXQJ (LQH 9HUELQGXQJVOLQLH YRQ HLQHP .UHLV QDFK XQWHQ EHGHXWHW GD dieses Resektat im Rahmen der Studie pathologisch-anatomisch begutachtet wurde bzw. ,QIRUPDWLRQHQ EHU GLH ]ZLVFKHQ]HLWOLFK GXUFKJHIKUWH 'LDJQRVWLN E]Z 7KHUDSLH XQG RGHU $QJDEHQ EHU GDV JHQDXH 5HVHNWLRQVergebnis vorlagen. Die 116 Verbindungslinien entsprechen also der Anzahl aller begutachteten Resektate. Fehlt die Linie zwischen unterstem Kreis und horizontaler Achse, so stand der entsprechende pathologischDQDWRPLVFKH%HIXQGQLFKW]XU9HUIJXQJ7URW]GHPNRQQWHQLQVROFKHQ)lOOHQPDQFKPDO allgemeinere Daten wie z. B. PrimŠrdiagnose oder Patientenalter verwendet werden. 44 Ergebnisse Abbildung 4: Anzahl der Operationen seit Sarkomdiagnose bei allen Patienten mit aktuell tumorfreiem Nachresektat (= 30 Patienten). Quelle: eigene Darstellung Abbildung 5: Anzahl der Operationen seit Sarkomdiagnose bei allen Patienten mit ResidualRGHU5H]LGLYWXPRULPDNWXHOOHQ1DFKUHVHNWDW 3DWLHQWHQ$XVIKUOLFKH(UNOlUXQJYJO Seite 41. Quelle: eigene Darstellung 45 Ergebnisse 4.1 Parameter, die mit dem Auftreten von Lokalrezidiven bzw. nicht malignen, postoperativen VerŠnderungen korrelieren Um Unterschiede hinsichtlich der oben beschriebenen Parameter (siehe Kapitel 3.3.2, S. 38) zwischen den Nachresektaten mit Rezidivtumor und solchen ohne Tumorgewebe festzustellen, wurden eben diese beiden diagnostischen Gruppen jeweils mit den gleichen 3DUDPHWHUQNRUUHOLHUWXQGDXIHYHQWXHOOH'LIIHUHQ]HQEHUSUIW=XGHQWXPRUIUHLHQ1DFK resektaten wurden sowohl die FŠlle mit falsch positiver Diagnose (d.h. Tumor vermutet, aber nicht bestŠtigt) als auch die FŠlle mit richtig negativer Diagnose (Wundkorrektur, kein Tumor vermutet) gezŠhlt, da auch diese FŠlle nochmals sorgfŠltig auf rezidivierendes Tumorgewebe hin untersucht worden waren. Die gesicherten Residualtumoren wurden nur in wenige Untersuchungen mit einbezogen, GDVLHGHILQLWLRQVJHPlGXUFKGLHYRUKHULJH1LFKWLQVDQR5HVHNWLRQYHUXUVDFKWZRUGHQ waren und ursŠchlich wahrscheinlich nicht mit anderen Faktoren in Zusammenhang gebracht werden konnten. Zusammenfassend wurden also meistens die tumorfreien Resektate mit den Rezidivtumoren verglichen. Nachresektate mit Rezidivtumor: Hier wurden parameterabhŠngig folgende Patientengruppen gesondert untersucht: · Aktuelles Nachresektat (29 Patienten): Alle Patienten mit Rezidivtumor im aktuellen Nachresektat. · Alle Patienten 3DWLHQWHQ $OOH 3DWLHQWHQ GLH MHPDOV HLQ 5H]LGLY IUKHU RGHU aktuell) hatten, selbst wenn nachfolgende Resektate tumorfrei waren (letzteres zutreffend auf 5 Patienten). · Erstrezidive 3DWLHQWHQ 'DV HUVWH 1DFKUHVHNWDW PXWH HLQ HFKWHV 5H]LGLY VHLQ d.K GD OHGLJOLFK GLH 3ULPlUWXPRURSHUDWLRQ PLW QDFKZHLVOLFKHP 56WDWXV YRUDXV JHJDQJHQ VHLQ GXUIWH XP GHQ P|JOLFKHQ (LQIOX IUKHUHU 2SHUDWLRQHQ DXI nachfolgende RezidivHQWVWHKXQJHQ DXV]XVFKOLHHQ DOVR NHLQH DQGHUHQ 2SHUDWLRQHQ zwischenzeitlich. Patienten mit bereits mehreren Rezidiven, bei denen aber der Resektionsstatus des PrimŠrtumors unbekannt war, wurden von dieser Gruppe ausgeschlossen. · Alle Resektate (55 Resektate): Anzahl aller Resektate mit Rezidivtumor, nur bei der Untersuchung variabler Parameter verwendet. Tumorfreie Nachresektate: Hier wurden parameterabhŠngig folgende Patientengruppen gesondert untersucht: · Aktuelles Nachresektat (30 Patienten): Alle Patienten, deren aktuelles Nachresektat kein Tumorgewebe mehr enthielt, unabhŠngig davon, ob nur die PrimŠrtumorerkrankung oder bereits Rezidiv- oder Residualtumoren vorausgegangen waren. 46 Ergebnisse · · Tumorfreie Resektate ohne Rezidiv in Vergangenheit (25 Patienten): Die vorherige Tumorkategorie durfte nur PrimŠrtumor (zutreffend auf 21 Patienten), Narbengewebe (3 Patienten) oder erster Residualtumor (1 Patient) lauten. Es sollten wirklich nur die Patienten betrachtet werden, die noch kein Rezidiv entwickelt hatten. Alle Resektate (32 Resektate): Anzahl aller tumorfreien Resektate, nur bei der Untersuchung variabler Parameter verwendet. Nachresektate mit Residualtumor: Hier wurden parameterabhŠngig folgende Patientengruppen untersucht: · · · Aktuelles Nachresektat (24 Patienten): Alle Patienten mit Residualtumor im aktuellen Nachresektat. Erste Residualtumoren (25 Patienten): Anzahl aller Patienten mit Residualtumor direkt nach PrimŠroperation. Alle Resektate (29 Resektate): Anzahl aller Resektate mit Residualtumor, nur bei der Untersuchung variabler Parameter verwendet. 4.1.1 PatientenabhŠngige Faktoren 4.1.1.1 Alter und Geschlecht Das VerhŠltnis von mŠnnlichen zu weiblichen Patienten betrug insgesamt 50:33 (1,52:1). Das durchschnittliche Erkrankungsalter (Alter bei PrimŠrdiagnose) lag bei 48,3 Jahren, bei einer Spanne von 13 bis 83 Jahren. Tabelle 3: Geschlechterverteilung und Durchschnittsalter bei Stellung der PrimŠrdiagnose Patientenanzahl insgesamt mŠnnlich weiblich m : w Durchschnittsalter bei Diagnose Alle Patienten 83 (100%) 50 (60,2%) 33 (39,8%) 1,5:1 48,3 Jahre Alle jemals an einem Rezidiv erkrankten Patienten Nur Patienten mit Erstrezidiv 38 (100%) 25 (65,8%) 13 (34,2%) 1,9:1 52,7 Jahre 20 (100%) 12 (60%) 8 (40%) 1,5:1 49,4 Jahre Patienten ohne Tumornachweis im aktuellen Resektat 30 (100%) 15 (50%) 15 (50%) 1:1 42,9 Jahre Patienten ohne Tumornachweis im aktuellen Resektat + ohne Rezidiv in Vergangenheit Quelle: eigene Darstellung 25 (100%) 12 (48%) 13 (52%) 0,9:1 41,0 Jahre 47 Ergebnisse 4.1.1.2 Zeitraum zwischen Erstsymptomen und PrimŠrdiagnose %HL 3DWLHQWHQ IHKOWH GLH $QJDEH EHU GHQ =HLWUDXP ]ZLVFKHQ GHP $XIWUHWHQ HUVWHU Symptome (= ES) und der PrimŠrdiagnose des Sarkoms (= PD). Bei den restlichen 55 Patienten betrug der durchschnittliche Abstand 13,1 Monate (Spannweite: 1 Woche - 20 Jahre). Tabelle 4: Mittlere Dauer zwischen Erstsymptomen (ES) und primŠrer Sarkomdiagnose (PD) Patientenanzahl Mittlere Dauer Spannweite in zwischen ES - Monaten PD in Monaten gesamt davon mit Angabe zur Dauer zwischen ES - PD Alle Patienten 83 55 13,1 (8,7 ohne $XVUHLHU 0,25-42 (AusUHLHU Alle jemals an einem Rezidiv erkrankten Patienten Nur Patienten mit Erstrezidiv 38 21 12,1 1-36 20 15 14,4 2-36 30 24 25 20 7,5 (6,0 ohne $XVUHLHU 7,4 (5,6 ohne $XVUHLHU 1-13 $XVUHLHU 1-12 $XVUHLHU Patienten ohne Tumornachweis im aktuellen Resektat Patienten ohne Tumornachweis im aktuellen Resektat + ohne Rezidiv in Vergangenheit Quelle: eigene Darstellung 'LH HLQ]HOQHQ 0RQDWVDQJDEHQ ZXUGHQ IU GDV IROJHQGH 'LDJUDPP ]ZHFNV SUR]HQWXDOHU 'DUVWHOOXQJLQ0RQDWV,QWHUYDOOH]XVDPPHQJHIDW Zeitraum zwischen Erstsymptomen (ES) und Sarkomdiagnose (SD): 5,0% 16,3% 28,6% 35,0% 20,00% 28,6% 25,5% 20% 40,00% insgesamt Rezidive insgesamt nur Erstrezidive tumorfreie Nachresektate 40,00% 40% 42,9% Anzahl der Patienten in % 56,4% 60,0% 60% 0% 0-6 7-12 > 12 Zeitraum in Monaten Abbildung 6: Zeitraum zwischen ES und SD in Monaten (zusammenJHIDWLQ0RQDWV Intervalle) bei: allen Patienten insgesamt, allen jemals an einem Rezidiv erkrankten Patienten, nur Patienten mit Erstrezidiv, allen tumorfreien Nachresektaten ohne Rezidiv in Vergangenheit. Darstellung der Zeilen 1 - 3, 5 der Tabelle 4. Quelle: eigene Darstellung 48 Ergebnisse 4.1.2 TumorabhŠngige Faktoren 4.1.2.1 Histologischer Typ Die histologischen Typen verteilten sich insgesamt wie folgt: Liposarkom (26 Patienten), MFH (20), Synovialsarkom (11), Leiomyosarkom (6), Aggressive Fibromatose (4), Epitheloides Sarkom (3), MPNST (2), Fibrosarkom (1), Rhabdomyosarkom (1), Malignes HŠmangioperizytom (1), Epitheloides HŠmangioendotheliom (1), Extraskelettales Osteosarkom (1), Klarzellsarkom (1) und unklassifizierte Sarkome (5). %HLGHQIQIXQNODVVLIL]LHUWHQ6DUNRPHQKDQGHOWHHVVLFKXP · DD: MFH / pleomorphes Sarkom · Pleomorphes Sarkom · · · DD: MFH-Šhnliches Sarkom/ amelanotisches Melanom DD: MPNST / Spindelzellsarkom / myxoides Liposarkom DD: Embryonales Rhabdomyosarkom / Extraskelettales Ewing Sarkom Tabelle 5: HŠufigkeit der verschiedenen histologischen Typen Anzahl aller Patienten Alle jemals an einem Rezidiv erkrankten Patienten Nur Patienten mit Erstrezidiv insgesamt 83 (100%) 38 (100%) 20 (100%) Patienten ohne Patienten ohne TumorTumornachweis im nachweis im aktuellen aktuellen Resektat Resektat + ohne Rezidiv in Vergangenheit 30 (100%) 25 (100%) Liposarkom 26 (31,3%) 8 (21,1%) 5 (25%) 14 (46,7%) 13 (52%) MFH 20 (24,1%) 11 (28,9%) 3 (15%) 7 (23,3%) 5 (20%) Synovialsarkom 11 (13,3%) 5 (13,2%) 5 (25%) 4 (13,3%) 3 (12%) Leiomyosarkom 6 (7,2%) 3 (7,9%) 3 (15%) 2 (6,7%) 1 (4%) Aggressive Fibromatose Epitheloides Sarkom 4 (4,8%) 2 (5,2%) 2 (10%) - - 3 (3,6%) - - - - MPNST 2 (2,4%) 2 (5,2%) - - - Fibrosarkom 1 (1,2%) 1 (2,6%) - - - Rhabdomyosarkom andere 1 (1,2%) 1 (2,6%) - - - 4 (4,8%) 3 (7,9%) 2 (10%) - - 2 (5,2%) - 3 (10%) 3 (12%) Unklassifizierte 5 (6%) Sarkome Quelle: eigene Darstellung 49 Ergebnisse HŠufigkeit der verschiedenen histologischen Sarkomtypen 25,0% Liposarkom 31,3% 52,0% 46,7% 24,1% 15,0% MFH 20,0% 23,3% 13,3% Synovialsarkom 12,0% 7,2% Leiomyosarkom 4,0% 25,0% 13,3% 15,0% 6,7% 4,8% 10,0% Aggr. Fibromatose 3,6% Epitheloides Sarkom 2,4% MPNST GesamthŠufigkeit 1,2% HŠufigkeit nur unter den Erstrezidiven Fibrosarkom HŠufigkeit unter den tumorfreien Nachresektaten ohne 1,2% Rezidiv in Vergangenheit HŠufigkeit unter allen tumorfreien Nachresektaten Rhabdomyosarkom 4,8% * HŠmangioendotheliom, extraossŠres Osteosarkom, Malignes HŠmangioperizytom, Klarzellsarkom 10,0% andere * 6,0% unklassifizierte Sarkome 8,3% 0% 10,0% 10% 20% 30% 40% 50% Anzahl der Patienten in % Abbildung 7: HŠufigkeit der verschiedenen histologischen Diagnosen. Quelle: eigene Darstellung 50 Ergebnisse 4.1.2.2 Grading Hier wurde der Differenzierungsgrad nur des PrimŠrtumors betrachtet. Bei 26 der 83 3DWLHQWHQIHKOWHKLHUEHUGLH$QJDEHEHLGUHL 3DWLHQWHQ ODJ HLQ 7XPRU YRQ LQWHUPHGLlUHU DignitŠt (aggressive Fibromatose) vor. Bei 10 Tumoren lag ein gemischtes Grading vor, d. h. die Tumorzellen warHQ XQWHUVFKLHGOLFK GLIIHUHQ]LHUW * IQIPDO * GUHLPDO G3-4 zweimal). Tabelle 6: Verteilung der verschiedenen Differenzierungsgrade des PrimŠrtumors insgesamt mit Angabe zum primŠren Grading mit Grading des PrimŠrtumors G1 und G1-2 G2 und G2-3 G3 und G3-4 Alle Patienten 83 54 (100%) 20 (37%) 18 (33,3%) 16 (29,6%) Alle jemals an einem Rezidiv erkrankten Patienten Nur Patienten mit Erstrezidiv 38 17 (100%) 10 (58,8%) 4 (23,5%) 3 (17,6%) 20 11 (100%) 6 (54,5%) 4 (36,4%) 1 (9,1%) Patienten ohne Tumornachweis im 25 aktuellen Resektat + ohne Rezidiv in Vergangenheit Quelle: eigene Darstellung 24 (100%) 6 (26,1%) 11 (47,8%) 7 (30,4%) Hier wurde der Differenzierungsgrad des jeweils vorherigen Tumors betrachtet. Bei 16 der 3DWLHQWHQIHKOWHKLHUEHUGLH$QJDEHEHL3DWLHQWHQODJHLQ7XPRUYRQLQWHUPHGLlUHU DignitŠt (aggressive Fibromatose) vor. Bei 9 Tumoren lag ein gemischtes Grading vor, d. h. die Tumorzellen waren unterschiedlich differenziert (G1-2 viermal, G2-3 dreimal, G3-4 zweimal). Tabelle 7: Verteilung der verschiedenen Differenzierungsgrade d. jeweils vorherigen Tumors insgesamt mit Angabe zum mit Grading des vorherigen Tumors vorherigen Grading G1 und G1-2 G2 und G2-3 G3 und G3-4 83 63 (100%) 18 (28,6%) 25 (39,7%) 20 (31,7%) Patienten mit Rezidiv im 29 aktuellen Resektat Patienten ohne Tumornach30 weis im aktuellen Resektat Quelle: eigene Darstellung 22 (100%) 5 (22,7%) 11 (50%) 6 (27,3%) 27 (100%) 8 (29,6%) 11 (40,7%) 8 (29,6%) Alle Patienten Wechsel im Grading Bei 59 der 83 Patienten lag mindestens ein Residual- oder Rezidivtumor vor. Unter diesen Patienten wurde ermittelt, ob im Krankheitsverlauf ein Differenzierungswechsel des Tumors aufgetreten war oder nicht. Bei 4 Patienten lag eine aggressive Fibromatose vor, bei 13 Patienten hatte sich das Grading im Verlauf nicht geŠndert, bei 23 Patienten hatte es sich einmal oder mehrmals geŠndert (13mal Dedifferenzierung, 7mal Zunahme und 3mal sowohl Zu- als auch Abnahme des Differenzierungsgrades), bei 19 Patienten fehlte hierzu 51 Ergebnisse die Angabe. Die drei KrankheitsverlŠufe mit sowohl Dedifferenzierung als auch Zunahme GHV*UDGLQJVHUVFKHLQHQQLFKWLQQDFKIROJHQGHU7DEHOOHVRQGHUQVLQGVHSDUDWDXIJHIKUW PrimŠrtumor G1 ® 1.Rezidiv G2 ® 2.Rezidiv G1 PrimŠrtumor G3 ® 1.Rezidiv G2 ® 2.Rezidiv G3 1.Rezidiv GX ® 2.Rezidiv G2 ® 3.Rezidiv G2 ® 4.Rezidiv G3 ® Residualtumor G2 Tabelle 8: Differenzierungswechsel im Krankheitsverlauf bei allen Patienten mit mindestens einem Rezidiv- oder Residualtumor G1 8 Gradingwechsel im IUKHUHU'LIIHUHQ]LHUXQJVJUDG Krankheitsverlauf ? Nein Ja Keine GX G1 G1-2 G2 G2-3 Angabe 4 3 1 3 - G1-2 1 - - 1 - - - - - - - G2 21 4 7 10 - 3 2 - 2 - - G2-3 4 - 4 - - 1 1 1 - 1 - G3 12 4 6 2 - 2 - 2 1 - 1 G3-4 1 1 - - - - - - - - - GX 5 - - 5 2 - - 1 - 2 - Aggressive Fibromatose 4 4 - - - - - - - - - Patienten mit mindestens einem Rezidiv oder Residualtumor (59) Aktuelles Grading Anzahl der Patienten insgesamt G3 G3-4 - - Hellgrau unterlegt sind die Entdifferenzierungen Quelle: eigene Darstellung 4.1.2.3 Tumorlokalisation Folgende Tumorlokalisationen kamen vor: Die untere ExtremitŠt war in 52 FŠllen, die obere ExtremitŠt in 19 FŠllen, der Rumpf in 12 FŠllen und die Kopf- und Halsregion in keinem Fall betroffen. Zur oberen ExtremitŠt zŠhlten Schulter (Axillaregion), Oberarm, 8QWHUDUP XQG +DQG ]XU XQWHUHQ ([WUHPLWlW ]lKOWHQ *HVl 2EHUVFKHQNHO 8QWHUVFKHQNHO XQG)X]XP5XPSI6FKXOWHU&ODYLFXODXQG6FDSXODUHJLRQ7KRUD[XQG$EGRPHQ 52 Ergebnisse Tabelle 9: HŠufigkeit der verschiedenen Tumorlokalisationen Anzahl Obere ExtremitŠt Untere ExtremitŠt Rumpf Gesamt Prox. Distal Gesamt Prox. Distal 19 (22,9%) 10 9 52 (62,7%) 39 13 12 (14,5%) Alle jemals an einem 38 (100%) Rezidiv erkrankten Patienten 8 (21,1%) 5 3 26 (68,4%) 20 6 4 (10,5%) Patienten ohne Tumornach30 (100%) weis im aktuellen Resektat Patienten ohne Tumornach25 (100%) weis im aktuellen Resektat + ohne Rezidiv in Vergangenheit Quelle: eigene Darstellung 4 (13,3%) 3 1 20 (66,7%) 14 6 6 (20%) 4 (16%) 3 1 16 (64%) 12 4 5 (20%) Anzahl aller Patienten 83 (100%) 4.1.2.4 Infiltrationstiefe Hier wurde die Infiltrationstiefe des jeweils vorherigen Tumors / PrimŠrtumors untersucht. War das vorletzte Resektat frei von Tumorgewebe, so wurde die Infiltrationstiefe des nŠchstIUKHUHQ 6DUNRPV HUPLWWHOW 'LHVH 6LWXDWLRQ WUDI DEHU QXU DXI 3DWLHQWHQ PDO Rezidivtumor; 3mal Narbengewebe) zu. Tabelle 10: Infiltrationstiefe des PrimŠrtumors insgesamt Anzahl aller Patienten 83 mit Angabe zur primŠren Infiltrationstiefe 43 (100%) mit tiefer Infiltration mit faszialer Infiltration mit oberflŠchlicher Infiltration 37 (75,5%) 1 (2%) 11 (22,4%) Nur Patienten mit Erstrezidiv 20 12 (100%) 12 (100%) - - Patienten ohne Tumornachweis im aktuellen Resektat + ohne Rezidiv in Vergangenheit Quelle: eigene Darstellung 25 16 (100%) 8 (50%) 1 (6,3%) 7 (43,8%) Tabelle 11: Infiltrationstiefe des jeweils vorherigen Tumors insgesamt Alle Patienten 83 davon mit Angabe zur Infiltrationstiefe 73 (100%) Patienten mit Rezidiv im aktuellen Resektat 29 25 (100%) 21 (84,0%) 2 (8,0%) 2 (8,0%) Patienten ohne Tumornach30 weis im aktuellen Resektat Quelle: eigene Darstellung 22 (100%) 13 (59,1%) 1 (4,5%) 8 (36,4%) 53 mit tiefer Infiltration 51 (69,9%) mit faszialer Infiltration 3 (4,1%) mit oberflŠchlicher Infiltration 19 (26,0%) Ergebnisse 4.1.2.5 7XPRUJU|H Das primŠre Staging (des PrimŠrtumors) konnte nicht mehr bei allen 83 Patienten nachvollzogen werden. Vor allem bei solchen Patienten mit hoher Rezidivfrequenz und schon OlQJHU]XUFNOLHJHQGHP3ULPlUWXPRUIHKOWHQLQGHQ$NWHQGLHHQWVSUHFKHQGHQ$QJDEHQ Ob bei Rezidivtumoren respektive Narbengewebe Unterschiede in der HŠufigkeit von regionŠren Lymphknotenmetastasen bestehen, konnte nicht untersucht werden, da von DOOHQ 3DWLHQWHQ LQVJHVDPW QXU ]ZHL 3DWLHQWHQ DNWXHOO EHUKDXSW SRVLWLYH /\PSKNQRWHQ aufwiesen. Hinsichtlich des Lymphknotenstatus des vorherigen Tumors fehlte bei 47 Patienten die Angabe, bei 33 Patienten lagen negative Lymphknoten vor und bei drei Patienten lag eine aggressive Fibromatose (kein Staging wegen intermediŠrer DignitŠt) vor. Bei zwei Patienten lagen aktuell Fernmetastasen vor, 15 Patienten waren frei von Fernmetastasen und bei den restlichen 66 Patienten fehlte hierzu die Angabe. Tabelle 127XPRUJU|H7GHV3ULPlUWXPRUV insgesamt Alle Patienten 83 davon mit Angabe zur 3ULPlUWXPRUJU|H 60 (100%) Alle Patienten mit Residualtumor nur nach PrimŠrtumoroperation 25 22 (100%) 6 (27,3%) 16 (72,7%) Nur Patienten mit Erstrezidiv 20 10 (100%) 2 (20%) 8 (80%) 25 25 (100%) 9 (36%) 16 (64%) Patienten ohne Tumornachweis im aktuellen Resektat + ohne Rezidiv in Vergangenheit Quelle: eigene Darstellung mit T1 (< 5cm) mit T2 (> 5cm) 20 (33,3%) 40 (66,7%) %HLGHU3DWLHQWHQNRQQWHGLHMHZHLOVYRUKHULJH7XPRUJU|HHUPLWWHOWZHUGHQ,Q )lOOHQ ZDU GLH 7XPRUJU|H XQEHNDQQW JHZHVHQ 7; XQG EHL 3DWLHQWHQ KDWWH ]XYRU Narbengewebe vorgelegen. Tabelle 137XPRUJU|H7GHVMHZHLOVYRUKHULJHQ7XPRUV insgesamt davon mit Angabe zur YRUKHULJHQ7XPRUJU|H mit T1 (< 5cm) mit T2 (> 5cm) 83 68 (100%) 30 (44,1%) 38 (55,9%) Patienten mit Rezidiv im 29 aktuellen Resektat Patienten ohne Tumornach30 weis im aktuellen Resektat Quelle: eigene Darstellung 21 (100%) 12 (57,1%) 9 (42,9%) 27 (100%) 10 (37%) 17 (63%) Alle Patienten 54 Ergebnisse 4.1.2.6 Anzahl der Tumorknoten Tabelle 14: Anzahl der Tumorknoten im jeweils vorherigen Tumor insgesamt mit Angabe zur Anzahl der Tumorknoten mit Anzahl der Tumorknoten im vorherigen Resektat: 1 2 oder mehr Alle Patienten 83 66 (100%) 51 (77,3%) 15 (22,7%) Patienten mit Rezidiv im aktuellen Resektat 29 24 (100%) 16 (66,7%) 8 (33,3%) Patienten ohne Tumornach30 weis im aktuellen Resektat Quelle: eigene Darstellung 25 (100%) 21 (84%) 4 (16%) Tabelle 15: Anzahl der Tumorknoten im PrimŠrtumor insgesamt mit Angabe zur Anzahl der Tumorknoten mit Anzahl der Tumorknoten im PrimŠrtumor: 1 2 oder mehr Alle Patienten 83 43 (100%) 37 (86%) 6 (14%) Nur Patienten mit Erstrezidiv 20 6 5 1 21 (100%) 18 (85,7%) 3 (14,3%) Patienten ohne Tumornachweis im 25 aktuellen Resektat + ohne Rezidiv in Vergangenheit Quelle: eigene Darstellung Satellitenknoten Unterschiede hinsichtlich der HŠufigkeit von Satellitenmetastasen zwischen Resektaten mit und ohne Rezidivtumor konnten nicht untersucht werden, da insgesamt nur bei 6 Patienten MHZHLOV5H]LGLYHEHUKDXSWVROFKH7XPRUDEVSUHQJXQJHQEHVFKULHEHQZXUGHQ$OOHGLHVH Patienten hatten spŠter wieder ein Rezidiv entwickelt. 4.1.2.7 Vorherige Tumorkategorie Tabelle 16: Verteilung der vorherigen Kategorie insgesamt mit vorheriger Kategorie PrimŠrtumor Rezidiv- oder Residualtumor Narbengewebe Alle Patienten 83 (100%) 45 (54,2%) 34 (41%) 4 (4,8%) Patienten mit Rezidiv im aktuellen Resektat 29 (100%) 5 (17,2%) 23 (79,3%) 1 (3,4%) Patienten ohne Tumornachweis im aktuellen Resektat 30 (100%) 21 (70%) 6 (20%) 3 (10%) 24 (100%) 19 (79,2%) 5 (20,8%) - Patienten mit Residualtumor im aktuellen Resektat Quelle: eigene Darstellung 55 Ergebnisse 4.1.3 TherapieabhŠngige Faktoren 4.1.3.1 PE / Biopsie Um festzustellen, ob vorherige Probeexzisionen oder Biopsien im Gegensatz zu sofortigen, vollstŠndigen Tumorresektionen durch eine eventuelle Tumorzellverschleppung mit spŠteren hšheren Rezidivraten einhergehen, wurden eben diese beiden diagnostischen Gruppen miteinander verglichen. Es wurden dazu nur die Ergebnisse der ersten NachUHVHNWLRQEHWUDFKWHWXPGHQ(LQIOXQDFKIROJHQGHU2SHUDWLRQHQDXIHLQHP|JOLFKH7XPRU zellVWUHXXQJ DXV]XVFKOLHHQ ,QVJHVDPW ZXUGH EHL 3DWLHQWHQ ]XQlFKVW HLQH 3( EHL einem Patienten eine Biopsie und bei 69 Patienten eine unmittelbare Tumorresektion durchJHIKUWEHLHLQHP3DWLHQWHQIHKOWHGLH$QJDEHKLHUEHU Tabelle 17: HŠufigkeit der prŠoperativ angewandten Probeexzisionen / Biopsien insgesamt Alle Patienten 83 davon mit Angabe zur Sarkomdiagnose 82 (100%) Nur Patienten mit Erstrezidiv 20 20 (100%) 6 (30%) 14 (70%) 25 25 (100%) 4 (16%) 21 (84%) Patienten ohne Tumornachweis im aktuellen Resektat + ohne Rezidiv in Vergangenheit Quelle: eigene Darstellung mit PE / Biopsie vor der PrimŠr-OP 13 (15,9%) ohne PE vor der PrimŠr-OP 69 (84,1%) 4.1.3.2 Operationsort Von den insgesamt 83 Patienten wurden 58 zuvor auswŠrts und 25 an den Berufsgenossenschaftlichen Kliniken Bergmannsheil (BHL) operiert. Anhand dieses Parameters sollte EHUSUIW ZHUGHQ RE 3DWLHQWHQ PLW HLQHU IDOVFK SRVLWLYHQ 'LDJQRVH EHL GHQHQ DOVR GDV vermutete Rezidiv postoperativ doch nicht nachgewiesen werden konnte) hŠufiger aus auswŠrtigen Kliniken stammten als solche mit richtig positiver Diagnose, also tatsŠchlichem Rezidivnachweis. Die Patienten aus auswŠrtigen KrankenhŠusern brachten ]ZDUVlPWOLFKH%HULFKWHEHUGLHGXUFKJHIKUWH'LDJQRVWLNXQG7KHUDSLHPLWGLHVHZDUHQ DEHU±YRUDOOHPZHQQVLHDXVNOHLQHUHQ.OLQLNHQVWDPPWHQ±RIWQLFKWVRYROOVWlQGLJXQG prŠzise als aus dem auf die WeichteilWXPRUWKHUDSLHVSH]LDOLVLHUWHQ%+/6RLVWHVIUGHQ behandelnden Chirurgen bei einem primŠr auswŠrts operierten Patienten vermutlich viel problematischer, die exakte OP-Indikation zu stellen als bei einem primŠr im BHL behandelten Patienten. 56 Ergebnisse Tabelle 18: HŠufigkeit des vorherigen Operationsortes insgesamt zuvor im BHL operiert zuvor auswŠrts operiert Alle Patienten 83 (100%) 25 (30,1%) 58 (69,9%) Patienten mit Rezidiv im aktuellen Resektat 29 (100%) 14 (48,3%) 15 (51,7%) Patienten ohne Tumornachweis im aktuellen Resektat (falsch positive Diagnose) 28 (100%) 4 (13,3%) 24 (86,6%) Patienten ohne Tumornachweis im aktuellen Resektat (richtig negative Diagnose) Patienten mit Residualtumor im aktuellen Resektat Quelle: eigene Darstellung 2 (100%) 2 (100%) - 24 (100%) 5 (20,8%) 19 (79,2%) 4.1.3.3 Anzahl der Operationen 44 Patienten waren bisher nur einmal operiert worden, 21 Patienten zweimal, 8 Patienten GUHLPDO ]ZHL 3DWLHQWHQ YLHUPDO 3DWLHQWHQ IQIPDO HLQ 3DWLHQW VHFKVPDO HLQ ZHLWHUHU achtmal und zwei Patienten jeweils 21- bzw. 28mal. Tabelle 19: Anzahl der bisherigen Operationen unter den aktuellen Nachresektaten insgesamt Operationsanzahl Anzahl der bisherigen Operationen (Mittelwert) 1 2 3 >3 83 (100%) 2,4 44 (53%) 21 (25,3%) 8 (9,6%) 10 (12%) Patienten mit Rezidiv im 29 (100%) aktuellen Resektat Patienten ohne Tumornach30 (100%) weis im aktuellen Resektat Patienten mit Residualtumor 24 (100%) im aktuellen Resektat Quelle: eigene Darstellung 3,5 5 (17,2%) 10 (34,5%) 6 (20,7%) 8 (27,6%) 1,4 21 (70%) 7 (23,3%) 2 (6,7%) - 2,5 18 (75%) 4 (16,7%) - 2 (8,3%) Alle Patienten 4.1.3.4 OP-Abstand Durchschnittlicher zeitlicher Abstand zur jeweils vorherigen Operation bei den verschiedenen Tumorkategorien. Tabelle 20: Durchschnittlicher Abstand in Monaten zur vorherigen OP insgesamt mit durchschnittlichem Abstand in Monaten Alle Resektate 116 7,2 ± Resektate mit Rezidiv 55 10,9 ± tumorfreie Resektate (falsch positive Diagnose) 30 3,2 ± tumorfreie Resektate (richtig negative Diagnose) 2 20,5 ± Resektate mit Residualtumor 29 3,6 ± Quelle: eigene Darstellung 57 Spannweite der Einzelwerte in Monaten Ergebnisse 4.1.3.5 Operationsmodus )ROJHQGH 2SHUDWLRQVDUWHQ $Q]DKO GHU )lOOH ZXUGHQ GXUFKJHIKUW ORNDOH 5HVHNWLRQ FŠlle), weite Resektion (23), Muskelgruppen- (2), Kompartiment- (3), palliative Resektion (5), Amputation (1); in 11 FŠllen fehlte die Angabe zur Operationsart. Als problematisch stellte sich bei dieser Analyse die je nach Klinik unterschiedlich gehandhabte Definition von "lokaler" und "weiter" Resektion heraus. Es fehlten meist Angaben dazu, nach welchen Kriterien der Resektionsmodus beurteilt worden war; selten wurde er im Operationsbericht durch QualitŠt und / oder QuantitŠt des makroskopischen SicherheitsDEVWDQGHVEHJUQGHW$XIGHU*UXQGODJHGHU(QQHNLQJ.ODVVLILNDWLRQJDEHVLQGHU*UXSSH der weiten Resektionen beispielsweise nur drei †bereinstimmungen mit dem tatsŠchlichen histopathologischen Ergebnis. In 7 FŠllen gab es keine †bereinstimmung und in 13 FŠllen konnte kein Vergleich angestellt werden, da der histopathologische Befund nicht vorlag. In der Gruppe der Lokalresektionen gab es die meisten bewiesenen †bereinstimmungen, aber bei den Kompartiment- bzw. Muskelgruppenresektionen keine einzige: In 4 FŠllen war die †bereinstimmung fraglich und in einem Fall sicher ausgeschlossen. Deshalb sind die folgenden Ergebnisse nur unter Vorbehalt zu bewerten. Tabelle 21: HŠufigkeit des jeweils vorherigen Operationsmodus unter allen Nachresektaten insgesamt Alle Resektate 116 mit Angabe mit vorheriger Operationsart zur lokal weit MuskelOperationsart gruppen 105 (100%) 71 (67,6%) 23 (21,9%) 2 (2%) Resektate mit Rezidiv 55 49 (100%) 29 (59,2%) 15 (30,6%) 2 (4,1%) 2 (4,1%) 1 (2%) - tumorfreie Resektate 32 29 (100%) 21 (72,4%) 7 (24,1%) - 1 (3,4%) - - Resektate mit 29 27 (100%) Residualtumor Quelle: eigene Darstellung 21 (77,8%) 1 (3,7%) - - - 5 (18,5%) Kompartiment 3 (2,9%) Amputation 1 (1%) palliativ 5 (4,8%) 4.1.3.6 5HVHNWLRQVTXDOLWlWGHUYRUKHULJHQ2SHUDWLRQ±FKLUXUJLVFKEHXUWHLOW Hier ging es um die Beurteilung der Absetzungsebenen (AE) von chirurgischer Seite aus (im Gesunden oder nicht im Gesunden operiert). In 69 FŠllen fehlte die Angabe, also NRQQWHQQXU)lOOHIUGLH$EIUDJHYHUZHUWHWZHUGHQ ,QVJHVDPWZDUHQ2SHUDWLRQHQ als im Gesunden reseziert, 7 Operationen als nicht im Gesunden und 5 Operationen als fraglich im Gesunden reseziert beschrieben worden. 58 Ergebnisse Tabelle 22: Vorheriger Resektionsstatus (chirurgisch beurteilt) unter allen Nachresektaten insgesamt davon mit chirurgischer Beurteilung mit vorherigem Resektionsstatus laut OP-Bericht in sano nicht sicher in sano nicht in sano Alle Resektate 116 47 (100%) 35 (74,5%) 5 (10,6%) 7 (14,9%) Resektate mit Rezidiv 55 21 (100%) 19 (90,5%) 2 (9,5%) - tumorfreie Resektate 32 11 (100%) 9 (81,8%) - 2 (18,2%) Resektate mit Residualtumor 29 15 (100%) 7 (46,7%) 3 (20%) 5 (33,3%) Quelle: eigene Darstellung †bereinstimmung zwischen chirurgischem und histopathologischem Resektionsergebnis: Tabelle 23: †bereinstimmung zwischen chirurgischer und histopathologischer Beurteilung des Resektionsstatus Chirurgische Anzahl der Resektate Beurteilung von 47 insgesamt mit folgender histopathologischer Beurteilung Resektaten R0 R0/1 R1 R2 RX In sano 35 16 5 8 4 2 Fraglich in sano 5 - - 2 2 1 Nicht in sano 7 - - 1 6 - Hellgrau unterlegt sind die †bereinstimmungen Quelle: eigene Darstellung 4.1.3.7 5HVHNWLRQVTXDOLWlWGHUYRUKHULJHQ2SHUDWLRQ±KLVWRSDWKRORJLVFKEHXUWHLOW 8PIHVW]XVWHOOHQZHOFKHQ(LQIOXGLH5HVHNWLRQVTXDOLWlW555RGHU5DXIGLH QDFKIROJHQGH 5H]LGLYKlXILJNHLW KDW ZXUGHQ DOOH 1DFKUHVHNWDWH DXHU 5HVLGXDOWXPRUHQ GD KLHU GLH YRUKHULJH 5HVHNWLRQVTXDOLWlW GHILQLWLRQVJHPl 5 RGHU 5 EHWUXJ DXI GLH YRUKHULJH5HVHNWLRQVTXDOLWlWKLQEHUSUIW Tabelle 24: Vorherige ResektionsqualitŠt (histopathologisch beurteilt) unter allen Nachresektaten insgesamt davon mit Angabe zur ResektionsqualitŠt ResektionsqualitŠt der vorherigen Operation R0 R0/1 R1 R2 Alle Resektate DXHU5HVLGXDOWXPRUHQ 87 76 (100%) 46 (60,5%) 17 (22,4%) 9 (11,8%) 4 (5,3%) Resektate mit Rezidiv 55 46 (100%) 33 (71,7%) 7 (15,2%) 5 (10,9%) 1 (2,2%) tumorfreie Resektate 32 30 (100%) 13 (43,3%) 10 (33,3%) 4 (13,3%) 3 (10%) Quelle: eigene Darstellung 59 Ergebnisse 4.1.3.8 Sicherheitsabstand Bei 33 der 55 RezidivfŠlle hatte zuletzt eine histopathologisch beschriebene R0-Resektion stattgefunden. Davon lagen in 15 FŠllen konkrete Angaben zum Sicherheitsabstand in cm zwischen Tumorgewebe und Absetzungsebene (AE) vor. In 10 FŠllen enthielten die entsprechenden pathologisch-anatomischen Begutachtungen keine Zahlenangaben, sondern nur vage Beschreibungen der ResektionsrŠnder (z. B. knapp, einige Bindegwebslamellen, schmaler Muskelsaum etc.); in 7 FŠllen fehlte jegliche Information, und in einem weiteren Fall handelte es sich bei dem vorherigen Resektat um narbiges nicht malignes Gewebe, dessen AbstŠnde zur Absetzungsebene aber nicht dokumentiert waren. Insgesamt konnten DOVR)lOOHIUGLHVH$EIUDJHYHUZHUWHWZHUGHQ Tabelle 25: Sicherheitsabstand der jeweils vorherigen Operation (nur R0) unter den Rezidiven mit Beschreibung oder cm-Angabe zum vorherigen Sicherheitsabstand insgesamt Nur Rezidive nach 25 R0-Resektion Quelle: eigene Darstellung knappe AE ausreichend freie AE 0,1 - 0,5 0,5 - 0,9 1 - 1,9 2 - 2,9 3 - 3,9 4 - 4,9 9 1 6 - 1 2 4 2 4.1.3.9 Adjuvante Strahlen- und Chemotherapie Bei der Untersuchung dieses Parameters ergab sich wŠhrend der Aktenrecherche folgendes Problem: Nur bei 16 Patienten war eine Radiatio (meistens postoperativ) und bei 9 3DWLHQWHQ HLQH &KHPRWKHUDSLH GXUFKJHIKUW ZRUGHQ ,Q GHQ UHVWOLFKHQ 3DWLHQWHQDNWHQ GDJHJHQ JDE HV NHLQHUOHL $QJDEHQ EHU GXUFKJHIKUWH DGMXYDQWH 7KHUDSLHQ 7URW]GHP NRQQWH DEHU QLFKW DXVJHVFKORVVHQ ZHUGHQ GD HLQ 7HLO GLHVHU UHVWOLFKHQ 3DWLHQWHQ QLFKW doch chemo- oder strahlentherapiert worden waren und lediglich die entsprechenden Protokolle der Akte nicht beigelegt waren. Dies wŠre sogar wahrscheinlich, da es sich in YLHOHQ )lOOHQ XP PLWWHO ELV QLHGULJ GLIIHUHQ]LHUWH 7XPRUHQ XQG DXHUGHP EHUHLWV RIW XP Rezidive handelte. Die Anzahl derjenigen Patienten, die definitiv nicht nachbestrahlt worden waren, konnte somit nicht ermittelt werden, also auch nicht als Vergleichsgruppe dienen. Von den 16 postoperativ radiotherapierten Patienten entwickelten insgesamt 11 wieder ein Rezidiv: 3/6 nach R0-Status, 5/7 nach R1/2-Status und 3/3 nach RX-Status. Von den 9 postoperativ chemotherapierten Patienten entwickelten insgesamt 6 wieder ein Rezidiv. Nur bei zwei Patienten wurde die Anwendung einer hyperthermen ExtremitŠtenperfusion beschrieben; beide hatten spŠter wieder ein Rezidiv entwickelt. 60 Ergebnisse 4.2 hEHUSUIXQJGHUGXUFKJHIKUWHQ'LDJQRVWLNDXILKUH5LFKWLJNHLW Hier wurde die zwischen zwei Tumoroperationen angewandte Diagnostik bei jeweils allen 116 FŠllen betrachtet. In 22 der 116 FŠlle gab es keinerlei Angaben hierzu. Insgesamt lagen die Befunde von 80 MRT zu 65 Nachresektaten, 23 CT und 22 Sonogrammen zu jeweils 21 Resektaten sowie 54 kšrperliche Untersuchungen zu 45 Nachresektaten vor. Bei den Befunden wurde immer zwischen positivem, negativem und unsicherem Testergebnis unterschieden. 4.2.1 Magnetresonanztomografie Zu 65 Nachresektaten (von 56 Patienten) lagen insgesamt 80 Befunde von prŠoperativ GXUFKJHIKUWHQNHUQVSLQtomografischen Untersuchungen vor. Zu den 65 Resektaten gab es in 13 FŠllen jeweils zwei oder drei, ansonsten pro Resektat nur jeweils einen MRT-Befund. Die nachfolgende Tabelle zeigt die prŠoperativen MRT-Befunde von allen 65 Resektaten. Pro Resektat wurde nur jeweils ein Befund ausgewertet, und zwar derjenige, der dem spŠteren histologischen Ergebnis am meisten entsprach. Insgesamt gab es 42 positive, 10 negative und 13 unsichere Testergebnisse. Tabelle 26: Ergebnisse der kernspintomografischen Untersuchungen Alle tumorhaltigen Resektate (84) Anzahl der Radiologischer Untersuchungsbefund GXUFKJHIKUWHQ sicherer Hinweis keine eindeutige MRT auf Tumorgewebe Aussage mšglich 51 38 (74,5%) 8 (15,7%) kein Hinweis auf Tumorgewebe 5 (9,8%) Resektate mit Rezidivtumor (55) 34 27 (79,4%) 3 (8,8%) 4 (11,8%) Resektate mit Residualtumor (29) 17 11 (64,7%) 5 (29,4%) 1 (5,9%) Alle tumorfreien Nachresektate (32) 14 4 (28,6%) 5 (35,7%) 5 (35,7%) Total (Zeile 1+4) 65 42 13 10 Quelle: eigene Darstellung SensitivitŠt: richtig positive Befunde / Resektate mit nachgewiesenem Tumor = 38/51 = 74,5 % SpezifitŠt: richtig negative Befunde / Resektate ohne vitales Tumorgewebe = 5/14 = 35,7 % Positive PrŠdiktion: richtig positive Befunde / alle positiven Befunde = 38/42 = 90,5 % Negative PrŠdiktion: richtig negative Befunde / alle negativen Befunde = 5/10 = 50 % 61 Ergebnisse $XHUGHP ZXUGH HUPLWWHOW ZHOFKHQ (LQIOX GHU ]HLWOLFKH $EVWDQG ]ZLVFKHQ YRUKHULJHU Tumorresektion und postoperativer MRT-Diagnostik auf die ValiditŠt der Befunde hat. Die Tomogramme waren insgesamt in einer Zeitspanne von 0,25 bis 48 Monaten postoperativ angefertigt worden. Bei einem Befund fehlte die Angabe zum Untersuchungszeitpunkt. Gab es pro Resektat mehrere MRT-Befunde, so wurde bei den tumorhaltigen Resektaten folgenderPDHQ YRUJHJDQJHQ: Bei mehreren positiven Befunden wurde nur der zeitlich ]XHUVW HUIROJWH EHUFNVLFKWLJW EHL PHKUHUHQ QHJDWLYHQ %HIXQGHQ QXU GHU ]HLWOLFK ]XOHW]W HUIROJWH )U GLH WXPRUIUHLHQ 5HVHNWDWH JDOW GDV 8PJHNHKUWH %HL PHKUHUHQ XQWHU schiedlichen Befundergebnissen pro Resektat wurden alle mit in die Berechnung aufgenommen, um zu ermitteln, ab wann die Befunde richtig wurden. Solche Untersuchungen mit unsicherem Ergebnis waren 3,6 Wochen (Spannweite 1-7 :RFKHQRKQH$XVUHLHUZHUWHYRQXQG0RQDWHQSRVWoperatiYGXUFKJHIKUWZRUGHQ Tabelle 27: Unterschiede im mittleren zeitlichen Abstand zwischen vorheriger OP und MRT Resektate mit Rezidivtumor Mittlerer postoperativer Untersuchungsabstand in Monaten In () Anzahl der jeweiligen Befunde insgesamt - zur jeweils bei positivem Befund bei unsicherem ersten Untersuchung Befund bei negativem Befund 8,0 (33) 11,0 (26) 4,3 (4*) 5,7 (9**) 2,4 (11) 0,8 (5) 1,5 (1) Alle tumorfreien 3,9 (14) 0,7 (3) bzw. 3,5 (4) 1,0 (5) Nachresektate mit AusUHLHU * Einer der 4 unsicheren Befunde wurde in einer spŠteren Untersuchung positiv. ** )QIGHUQHXQQHJDWLYHQ%HIXQGHZXUGHQLQVSlWHUHQ8QWHUVXFKXQJHQSRVLWLY Quelle: eigene Darstellung 7,0 (5) Resektate mit Residualtumor 1,9 (17) 62 Ergebnisse 4.2.2 Computertomografie =X 5HVHNWDWHQ YRQ 3DWLHQWHQ ODJHQ %HIXQGH YRQ SUlRSHUDWLY GXUFKJHIKUWHQ computertomografischen Untersuchungen vor. Wiederum wurde pro Resektat nur derjenige Befund ausgewertet, der dem spŠteren histologischen Ergebnis am meisten entsprach. Es gab insgesamt 14 positive, 5 negative und zwei unsichere Testergebnisse. Tabelle 28: Ergebnisse der computertomografischen Untersuchungen Anzahl der jeweils durchJHIKUWHQ&7 Radiologischer Untersuchungsbefund Alle tumorhaltigen Resektate (84) 15 sicherer Hinweis keine eindeutige auf Tumorgewebe Aussage mšglich 13 (86,7%) 1 Resektate mit Rezidivtumor (55) 12 10 (83,3%) Resektate mit Residualtumor (29) 3 3 - - 6 1 1 4 21 14 2 5 Alle tumorfreien Nachresektate (32) Total (Zeile 1+4) kein Hinweis auf Tumorgewebe 1 1 1 Quelle: eigene Darstellung SensitivitŠt: richtig positive Befunde / Resektate mit nachgewiesenem Tumor = 13/15 = 86,7 % SpezifitŠt: richtig negative Befunde / Resektate ohne vitales Tumorgewebe = 4/6 = 66,7 % Positive PrŠdiktion: richtig positive Befunde / alle positiven Befunde = 13/14 = 92,6 % Negative PrŠdiktion: richtig negative Befunde / alle negativen Befunde = 4/5 = 80 % Auch hier wurde der zeitliche Abstand zwischen Tumorresektion und postoperativer CTDiagnostik ermittelt. Die Untersuchungen waren zwischen 0,25 und 38 Monaten nach der 2SHUDWLRQGXUFKJHIKUWZRUGHQ Tabelle 29: Unterschiede im mittleren zeitlichen Abstand zwischen vorheriger OP und CT Resektate mit Rezidivtumor Mittlerer postoperativer Untersuchungsabstand in Monaten In () Anzahl der jeweiligen Befunde insgesamt - zur jeweils Bei positivem Bei unsicherem ersten Untersuchung Befund Befund 10,9 (12) 12,9 (10) 0,5 (1) Bei negativem Befund 2 (1) Resektate mit Residualtumor 1,3 (3) 1,3 (3) - - Alle tumorfreien Nachresektate 6 (6) 7 (2*) 6 (1) 5,4 (4) * Eins von zwei positiven Ergebnissen wurde in einer spŠteren Untersuchung unsicher. Quelle: eigene Darstellung 63 Ergebnisse 4.2.3 Sonografie Hier gab es 22 Befunde zu 21 Resektaten von prŠoperativ angefertigten Sonogrammen. Es lagen 14 positive, 5 negative und zwei unsichere Testergebnisse vor. Tabelle 30: Ergebnisse der sonografischen Untersuchungen Anzahl der jeweils durchJHIKUWHQ6RQRV Sonografischer Untersuchungsbefund sicherer Hinweis auf Tumorgewebe keine eindeutige kein Hinweis auf Aussage mšglich Tumorgewebe 18 13 (72,2%) 2 3 Resektate mit Rezidivtumor (55) 14 11 (78,6%) 1 2 Resektate mit Residualtumor (29) 4 2 1 1 Alle tumorfreien Nachresektate (32) 3 1 - 2 Total (Zeile 1+4) 21 14 2 5 Alle tumorhaltigen Resektate (84) Quelle: eigene Darstellung SensitivitŠt: richtig positive Befunde / Resektate mit nachgewiesenem Tumor = 13/18 = 72,2 % SpezifitŠt: richtig negative Befunde / Resektate ohne vitales Tumorgewebe = 2/3 = 66,7 % Positive PrŠdiktion: richtig positive Befunde / alle positiven Befunde = 13/14 = 92,9 % Negative PrŠdiktion: richtig negative Befunde / alle negativen Befunde = 2/5 = 40 % Wiederum wurde der zeitliche Abstand zwischen Tumorresektion und postoperativer Ultraschall-Diagnostik ermittelt. Der mittlere postoperative Untersuchungsabstand variierte zwischen 0,5 und 48 Monaten. Tabelle 31: Unterschiede im mittleren zeitlichen Abstand zwischen vorheriger OP und Sonografie Resektate mit Rezidivtumor Mittlerer postoperativer Untersuchungsabstand in Monaten In () Anzahl der jeweiligen Befunde insgesamt - zur jeweils Bei positivem Bei unsicherem ersten Untersuchung Befund Befund 14,5 (14) 16,1 (11) 9 (1) Bei negativem Befund 8,3 (3*) Resektate mit Residualtumor 2,1 (4) 3,5 (2) 0,5 (1) 0,75 (1) Alle tumorfreien Nachresektate 3,8 (3) 8 (1) - 1,75 (2) * Eins von drei negativen Ergebnissen wurde in einer spŠteren Untersuchung unsicher. Quelle: eigene Darstellung 64 Ergebnisse 4.2.4 Kšrperliche Untersuchung =X 5HVHNWDWHQ YRQ 3DWLHQWHQ ODJHQ %HIXQGH YRQ SUlRSHUDWLY GXUFKJHIKUWHQ kšrperlichen Untersuchungen vor. In 7 FŠllen gab es Angaben zu mehreren Untersuchungen; hier wurde jeweils die zuletzt erfolgte betrachtet, da die Testergebnisse dann richtiger waren. Insgesamt gab es 34 positive, 9 negative und 2 unsichere Ergebnisse. Tabelle 32: Ergebnisse der kšrperlichen Untersuchung Anzahl der durchJHIKUWHQ kšrperlichen Untersuchungen Kšrperlicher Untersuchungsbefund sicherer Hinweis auf Tumorgewebe keine eindeutige kein Hinweis auf Aussage mšglich Tumorgewebe 40 32 (80%) 2 6 Resektate mit Rezidivtumor (55) 28 24 (86%) 2 2 Resektate mit Residualtumor (29) 12 8 (67%) - 4 Alle tumorfreien Nachresektate (32) 5 2 - 3 (60%) Total (Zeile 1+4) 45 34 2 9 Alle tumorhaltigen Resektate (84) Quelle: eigene Darstellung SensitivitŠt: richtig positive Befunde / Resektate mit nachgewiesenem Tumor = 32/40 = 80 % SpezifitŠt: richtig negative Befunde / Resektate ohne vitales Tumorgewebe = 3/5 = 60 % Positive PrŠdiktion: richtig positive Befunde / alle positiven Befunde = 32/34 = 94,1 % Negative PrŠdiktion: richtig negative Befunde / alle negativen Befunde = 3/9 = 33,3 % Die kšrperlichen Untersuchungen wurden zwischen 0,5 und 48 Monaten postoperativ durchJHIKUW,QHLQHP)DOOIHKOWHGLH$QJDEH]XP8QWHUVXFKXQJV]HLWSXQNW 65 Ergebnisse Tabelle 33: Unterschiede im mittleren zeitlichen Abstand zwischen vorheriger OP und kšrperlicher Untersuchung Bei negativem Befund 4 (6*) Resektate mit Residualtumor Mittlerer postoperativer Untersuchungsabstand in Monaten In () Anzahl der jeweiligen Befunde insgesamt - zur jeweils Bei positivem Bei unsicherem Befund ersten Untersuchung Befund 10,6 (27) 10,9 (23) 3,8 (1) bzw. 25,9 (2) PLW$XVUHLHU 3,8 (12) 4,6 (8) - Alle tumorfreien Nachresektate 5,8 (5) 5,3 (4**) Resektate mit Rezidivtumor 11 (2) - 2,1 (4) * 4 der 6 negativen Befunde wurden in spŠteren Untersuchungen positiv. ** Einer der vier negativen Befunde wurde spŠter positiv. Quelle: eigene Darstellung 4.2.5 Sonstige Untersuchungen 4.2.5.1 Probeexzision In insgesamt 12 FŠllen bei 10 Patienten (9 Rezidive, 1 Residualtumor, 2 tumorfreie NachUHVHNWDWH ODJHQ $QJDEHQ EHU HLQH SUlRSHUDWLY DQJHZDQGWH 3( RGHU %LRSVLH YRU $XI diese Weise wurden 8 Rezidive als solche erkannt (3mal durch Biopsie, 5mal durch PE); EHL HLQHP 5H]LGLY HUJDE GLH 3( QXU K\SHUSODVWLVFKHV 1DUEHQJHZHEH ± DOOHUGLQJV QRFK Monate vor dem erneuten Rezidiv, das dann 6 Monate spŠter durch Bildgebung erkannt wurde. Ein Residualtumor wurde durch eine PE bestŠtigt. Bei den zwei tumorfreien Resektaten (falsch positive Diagnose) hatte zuvor in einem Fall eine Biopsie und im anderen Fall eine PE, jeweils mit negativer Diagnose, stattgefunden. 4.2.5.2 Selbstbeobachtung /HLGHUNDQQNHLQH]XYHUOlVVLJH$XVVDJHEHUGLH$Q]DKOGHU)lOOHLQGHQHQGLH3DWLHQWHQ ihr Rezidiv selbst bemerkten, getroffen werden, da auch hier die Angaben nicht ausreichend waren. Bei nur neun Patienten fanden sich entsprechende Angaben. In diesen FŠllen hatten die Patienten durch Schwellung oder VerhŠrtung an der ehemaligen Tumorlokalisation ein Rezidiv vermutet, was sich auch in acht FŠllen bestŠtigte, sich aber in einem Fall als nicht malignes Narbengewebe erwies. 66 Ergebnisse 4.3 Zusammenfassung 4.3.1 PatientenabhŠngige Faktoren 4.3.1.1 Alter Das durchschnittliche Alter aller Patienten bei Sarkomdiagnose betrug 48,3 Jahre; bei den Patienten mit Erstrezidiv (sŠmtlichen Patienten mit Rezidiv) betrug es 49,4 (52,7) Jahre. Das Diagnosedurchschnittsalter bei den Patienten mit tumorfreiem Nachresektat ohne Rezidiv (mit Rezidiv) in Vergangenheit war mit 41 (43) Jahren etwas niedriger. 4.3.1.2 Geschlecht Die Geschlechterverteilung des Gesamtpatientenguts betrug m:w = 1,5:1. Bei den Patienten mit Erstrezidiv (sŠmtlichen Patienten mit Rezidiv) betrug sie 1,5:1 (1,9:1), und bei den Patienten mit tumorfreiem Resektat ohne Rezidiv (mit Rezidiv) in Vergangenheit war die Verteilung 0,9:1 (1:1). 4.3.1.3 Zeitraum zwischen Erstsymptomen und primŠrer Sarkomdiagnose Die Symptomdauer bis zur PrimŠrdiagnose betrug bei allen Patienten im Mittel 13,1 bzw. 0RQDWH RKQH $XVUHLHUZHUW 'LHVHU =HLWUDXP XPIDWH EHL GHQ 3DWLHQWHQ PLW Erstrezidiv (sŠmtlichen Patienten mit Rezidiv) 14,4 (12,1) Monate. Eine wesentlich NU]HUH 6\PSWRPGDXHU YRQ 0RQDWHQ E]Z RKQH $XVUHLHU E]Z RKQH $XVUHLHUODJEHLGHQ3DWLHQWHQPLWWXPRUIUHLHP1DFKUHVHNWDWRKQH5H]LGLYPLW5H]LGLY in Vergangenheit vor. 4.3.2 TumorabhŠngige Faktoren 4.3.2.1 Histologischer Typ Die hŠufigste Tumorart bei allen Patienten insgesamt war das Liposarkom (31 %), gefolgt von MFH und Synovialsarkom. Diese drei Diagnosen entfielen auf fast 70 % aller Patienten. Bei sŠmtlichen Patienten mit Rezidivtumor war das MFH am hŠufigsten vertreten, gefolgt von Liposarkom und Synovialsarkom. Bei den Patienten mit Erstrezidiv dagegen kamen das Lipo- und Synovialsarkom mit jeweils 25 % am hŠufigsten vor. Unter den tumorfreien Nachresektaten ohne Rezidiv (mit Rezidiv) in Vergangenheit dominierte jeweils das Liposarkom mit 54 % (47 %), gefolgt von MFH und Synovialsarkom. $OOHDQGHUHQ'LDJQRVHQNDPHQVRVHOWHQYRUGDVLHSUR.DWHJRULHMHZHLOVDXIK|FKVWHQV drei Patienten zutrafen und somit statistisch nicht relevant waren. 67 Ergebnisse 4.3.2.2 Grading Grading des PrimŠrtumors Der PrimŠrtumor war bei sŠmtlichen Patienten mit Rezidiv und Patienten mit erstem Rezidiv am hŠufigsten hoch differenziert (G1) gewesen (entgegen durchschnittlich G2 bei allen PrimŠrtumoren insgesamt). Bei den tumorfreien Nachresektaten mit oder ohne Rezidiv in Vergangenheit hatte hingegen primŠr hŠufiger eine mittelgradige Differenzierung (G2) vorgelegen. Grading des jeweils vorherigen Tumors Die Analyse des jeweils vorhergehenden Tumors zeigte eine HŠufung der mittelgradigen Differenzierung (G2) sowohl bei den Rezidiven als auch den tumorfreien Resektaten. 4.3.2.3 Tumorlokalisation Sowohl bei den Patienten mit Rezidiv als auch allen Patienten insgesamt war die untere ExtremitŠt am hŠufigsten (etwa 2/3 aller FŠlle) betroffen, gefolgt von oberer ExtremitŠt und Rumpf. Bei den Patienten mit tumorfreiem Resektat (mit oder ohne Rezidiv in Vergangenheit) dominierte ebenfalls die untere ExtremitŠt, allerdings war die Rumpfregion etwas šfter und die obere ExtremitŠt etwas seltener betroffen als durchschnittlich. 4.3.2.4 Infiltrationstiefe Infiltrationstiefe des PrimŠrtumors Bei 76 % aller PrimŠrtumoren insgesamt hatte der Tumor tiefe Strukturen infiltriert, bei den Patienten mit Rezidivtumor im ersten Nachresektat war der PrimŠrtumor in allen FŠllen tief lokalisiert gewesen, und bei den tumorfreien Nachresektaten (kein Rezidiv in Vergangenheit) lag dieser Anteil bei nur 50 %. Infiltrationstiefe des jeweils vorherigen Tumors 70 % aller vorhergehenden Tumoren hatten tiefe Strukturen, 4 % fasziale und 26 % oberflŠchliche Strukturen infiltriert. Bei den aktuellen Rezidiven bzw. tumorfreien Nachresektaten waren tiefe Strukturen in 84 % bzw. 59 % von der Infiltration betroffen. 4.3.2.5 7XPRUJU|H 7XPRUJU|HGHV3ULPlUWXPRUV 'LH 3ULPlUWXPRUJU|H ZDU EHL GHQ 3DWLHQWHQ PLW (UVWUH]LGLY HWZDV K|KHU JHZHVHQ LQ 80 % der FŠlle T2, 20 % T1) als durchschnittlich (67 % der FŠlle T2). Bei den Patienten PLWWXPRUIUHLHP1DFKUHVHNWDWNHLQ5H]LGLYLQ9HUJDQJHQKHLWODJ GLH 3ULPlUWXPRUJU|H noch etwas seltener (64 DOVGXUFKVFKQLWWOLFKEHU cm (T2). 68 Ergebnisse 7XPRUJU|HGHVMHZHLOVYRUKHULJHQ7XPRUV 'LH 8QWHUVXFKXQJ GHU 7XPRUJU|H GHV MHZHLOV YRUKHUJHKHQGHQ 7XPRUV ]HLJWH GLHVPDO eine HŠufung der T1-Tumoren (57 %) unter den Patienten mit aktuellem Rezidiv. Dies hŠngt wahrscheinlich mit den engmaschigen Nachsorgeuntersuchungen dieser Patienten XQGGHQGDGXUFKEHGLQJWHQIUK]HLWLJHQ5HVHNWLRQHQGHU7XPRUHQ]XVDPPHQ 4.3.2.6 Anzahl der Tumorknoten Anzahl der Tumorknoten des PrimŠrtumors Hier fehlten wiederum bei den Patienten mit Rezidiv die erforderlichen Angaben, um eine sichere Aussage zu treffen. Bei allen Patienten insgesamt hatte in 86 % der FŠlle der PrimŠrtumor aus nur einem Knoten bestanden, in 14 % lagen mindestens zwei Knoten oder HLQHGLVVHPLQLHUWH$XVEUHLWXQJYRU)DVWLGHQWLVFKH:HUWHHUJDEHQVLFKIUGLHWXPRUIUHLHQ Nachresektate. Anzahl der Tumorknoten des jeweils vorherigen Tumors %HLHWZDHLQHP)QIWHODOOHU3DWLHQWHQEHVWDQGGHUMHZHLOVYRUKHULJH7XPRUDXV]ZHLRGHU mehreren Knoten. Bei den Patienten mit aktuellem Rezidiv lag der entsprechende Anteil mit 33 % etwas hšher und bei den Patienten mit Pseudorezidiv mit 16 % etwas niedriger. Satellitenknoten Unterschiede hinsichtlich der HŠufigkeit von Satellitenmetastasen zwischen Resektaten mit und ohne Rezidivtumor konnten nicht untersucht werden, da insgesamt nur bei 6 Patienten MHZHLOV5H]LGLYHEHUKDXSWVROFKH7XPRUDEVSUHQJXQJHQEHVFKULHEHQZXUGHQ$OOHGLHVH Patienten hatten spŠter wieder ein Rezidiv entwickelt. 4.3.2.7 Vorherige Tumorkategorie Bei fast 80 % aller Patienten mit aktuellem Rezidivtumor war der vorherige Tumor ebenfalls ein Rezidiv- oder Residualtumor gewesen. Nur bei 17 % handelte es sich um einen Zustand direkt nach PrimŠrtumor. Bei den Patienten ohne Tumornachweis im aktuellen Resektat verhielt es sich fast genau umgekehrt, denn in 70 % der FŠlle war nur die PrimŠrtumoroperation vorausgegangen. Ebenso hatte bei den Patienten mit Residualtumor im aktuellen Resektat in fast 80 % der FŠlle zuvor nur die PrimŠrtumoroperation stattgefunden. 69 Ergebnisse 4.3.3 TherapieabhŠngige Faktoren 4.3.3.1 PE / Biopsie In fast 17 % der FŠlle mit tumorfreiem Nachresektat war vor der PrimŠr-OP eine PE GXUFKJHIKUWZRUGHQGLHVHU$QWHLOODJEHLGHQ3DWLHQWHQPLW5H]LGLYWXPRUPLW % etwas hšher. Insgesamt wurde bei 16 % aller Patienten prŠoperativ eine PE vorgenommen. 4.3.3.2 Anzahl der Operationen Die Anzahl der bisherigen Operationen lag bei den Patienten mit tumorfreiem Nachresektat im Mittel bei 1,4 Operationen, dagegen betrug sie insgesamt 2,4 und bei den Patienten mit Rezidivtumor sogar 3,5 Operationen. Von allen Patienten insgesamt waren bisher 47 % zweimal oder mehrmals operiert worden. Dieser Anteil betrug bei den Patienten mit tumorfreiem Nachresektat nur 30 %, bei den Patienten mit Rezidiv hingegen sogar 83 %. 4.3.3.3 OP-Abstand Der zeitliche Abstand zur vorherigen OP betrug durchschnittlich 3,2 Monate bei den 3DWLHQWHQ PLW WXPRUIUHLHP 1DFKUHVHNWDW XQG ZDU GDPLW HUKHEOLFK NU]HU DOV EHL GHQ Patienten mit Rezidiv (im Mittel 10,9 Monate). Residualtumoren wurden durchschnittlich innerhalb von 3,6 Monaten nachreseziert. 4.3.3.4 Operationsort Ein sehr hoher Anteil der Patienten mit falsch positiver Diagnose (87 %) war zuvor in einer auswŠrtigen Klinik operiert worden. Dagegen wurden nur 70 % der Patienten insgesamt und sogar nur die HŠlfte der Patienten mit Rezidivtumor zuvor auswŠrts operiert. 4.3.3.5 Operationsmodus der vorherigen OP Dieser Parameter war insgesamt kaum aussagekrŠftig, da die Angaben zur ResektionsTXDOLWlW PHLVW VHKU GUIWLJ ZDUHQ XQG MHGHU 6WDQGDUGLVLHUXQJ HQWEHKUWHQ +lXILJ VWLPPWH auch der chirurgisch beschriebene Operationsmodus nicht mit dem tatsŠchlichen histoSDWKRORJLVFKHQ (UJHEQLV EHUHLQ 9RU DOOHP EHL GHQ YHUPHLQWOLFK ZHLWHQ 5HVHNWLRQHQ ]HLJWHQ VLFK LQ GHQ DQVFKOLHHQGHQ KLVWRpathologischen Begutachtungen oft entweder knappe SicherheitsabstŠnde (nur wenige mm) oder sogar infiltrierte Resektatgrenzen. Die meisten Sarkome waren chirurgischen Angaben zufolge zuvor lokal (68 %) oder weit (22 %) reseziert worden. Bei den tumorfreien Nachresektaten bzw. Rezidiven lag der Anteil der lokalen Resektion bei 72 % bzw. 59 % und der Anteil der weiten Resektion bei 24 % bzw. 31 %. Muskelgruppen- bzw. Kompartimentresektionen waren insgesamt nur IQIPDOGXUFKJHIKUWZRUGHQGDYRQYLHULQGHU9RUJHVFKLFKWHYRQ3DWLHQWHQPLW5H]LGLY 70 Ergebnisse 4.3.3.6 5HVHNWLRQVVWDWXVGHUYRUKHULJHQ2SHUDWLRQ±FKLUXUJLVFKEHXUWHLOW Die Analyse dieses Parameters war nicht sehr aussagekrŠftig, zumal in vielen 2SHUDWLRQVEHULFKWHQKLHU]XGLHHUIRUGHUOLFKHQ$QJDEHQIHKOWHQ,QôDOOHU)lOOHLQVJHVDPW waren die ResektionsrŠnder der vorherigen Operation vom Operateur als in sano beschrieben worden. Dieser Anteil lag unter den tumorfreien Nachresektaten bei fast 82 % und unter den Rezidiven bei sogar 91 %. Bei den Residualtumoren (also histopathologisch JHVLFKHUWH5RGHU55HVHNWLRQEHWUXJGHU$QWHLOGHUPXWPDOLFK]XYRULP *HVXQGHQ resezierten Sarkome immerhin noch 47 %. Die Beurteilung der ResektionsrŠnder von chirurgischer Seite wich auch in einigen FŠllen YRPDQVFKOLHHQGHQKLVWRSDWKRORJLVFKHQ%HIXQGDE$OOHPXWPDOLFKQLFKWLP*HVXQGHQ RSHULHUWHQ 7XPRUHQ VWLPPWHQ PLW GHU DQVFKOLHHQGHQ KLVWRSDWKRORJLVFKHQ %HJXWDFKWXQJ DOOH 5 RGHU 5 EHUHLQ GDJHJHQ HUZLHVHQ VLFK ]Z|OI 5HVHNWDWH GLH FKLUXUJLVFK DOV LQ sano betrachtet worden waren, bei histopathologioscher Inspektion als R1 (8 Resektate) RGHU 5 5HVHNWDWH UHVH]LHUW +LHUEHL PX EHUFNVLFKWLJW ZHUGHQ GD HLQH 'LIIHUHQ]LHUXQJ ]ZLVFKHQ 5 XQG 5 DXV FKLUXUJLVFKHU 6LFKW QDWUOLFK QLFKW P|JOLFK LVW Deshalb betrŠgt die †bereinstimmung mit dem histopathologischen Ergebnis auch nur 73 %. 4.3.3.7 5HVHNWLRQVTXDOLWlWGHUYRUKHULJHQ2SHUDWLRQ±KLVWRSDWKRORJLVFKEHXUWHLOW Von allen Nachresektaten insgesamt (Residualtumoren ausgeschlossen) waren 61 % zuvor als sicher R0 reseziert beurteilt worden. Bei den Rezidivresektaten lag dieser Anteil bei fast 72 % und bei den tumorfreien Resektaten bei nur 43 %. Bei den tumorfreien Resektaten waren weiterhin in 1/3 der FŠlle zuvor unsichere ResektionsrŠnder (R0/1) und in 23 % sogar R1- oder R2-ResektionsrŠnder beschrieben worden. Bei den Rezidiven lagen die Anteile der vorher als R0/1 bzw. R1/2 beurteilten Resektionen bei nur 15 % bzw. 13 %. Nachresektate mit Rezidiv Bei 33 der 55 Nachresektate mit Rezidivtumor hatte zuvor eine eindeutige R0-Resektion stattgefunden. Bei 7 Resektaten konnte keine sichere Entscheidung (R0/1) getroffen werden, ob der Tumor im Gesunden entfernt wurde; es lag aber in jedem Fall in mindestens einer Ebene ein knapper Exzisionsabstand vor, und in 6 FŠllen lag eine eindeutige R1- oder R2-Situation mit postoperativer Radiatio vor. In 9 FŠllen war die vorherige ResektionsqualitŠt všllig unklar (RX). Bei den 33 R0-Resektaten handelte es sich in 19 FŠllen um sehr knappe SicherheitsabstŠnde (< 0,1-0,9 cm) in mindestens einer Ebene (tiefe AE am hŠufigsten betroffen); in 8 FŠllen fehlte hierzu jede Angabe; in einem Fall waren sie als ausreichend (nicht nŠher erlŠutert) beschrieben, in zwei FŠllen lagen sie bei jeweils 1 cm und 1,5 cm und in drei FŠllen bei jeweils ³ 3 cm. 71 Ergebnisse Tumorfreie Nachresektate Bei 30 der 32 tumorfreien Resektate handelte es sich um falsch positive Diagnosen, d.h. es war Tumorgewebe vermutet worden. Davon lag zufolge der letzten pathologischanatomischen Begutachtungen in 11 FŠllen ein Zustand nach R0-Resektion, in 10 FŠllen ein Zustand nach R0/1-Resektion, in 4 FŠllen eine R1-Situation und in drei FŠllen eine R2Situation vor. In zwei FŠllen fehlte die Angabe zur ResektionsqualitŠt. %HLGHQ)lOOHQPLWYRUKHULJHU55HVHNWLRQILHODXIGDLQNHLQHP)DOOFP$QJDEHQ]X den SicherheitsabstŠnden vorlagen. In drei FŠllen war das vorherige Resektat bereits tumorfrei gewesen; in 5 FŠllen wurde jeweils ein nur schmaler Sicherheitsabstand bestehend aus Muskel-, Binde- oder Fettgewebe beschrieben, in 2 FŠllen wurde eine randlich intakte Tumorkapsel beschrieben und in einem Fall fehlte hierzu die Angabe. Bei den 10 FŠllen mit vorausgehender R0/1-Resektion wurde oft ein "Heranreichen" der Tumorzellen an mindestens eine Absetzungsebene ohne oder mit fraglicher Infiltration derselben beschrieben. In einigen FŠllen lag eine stellenweise nicht mehr intakte Pseudokapsel vor. 4.3.3.8 Adjuvante Strahlen- und Chemotherapie Nur bei 20 Patienten war eine postoperative Strahlen- oder Chemotherapie beschrieben worden, und in 65 % dieser FŠlle war spŠter ein Rezidiv entstanden. Von den Patienten mit R0- oder R0/1-Resektion und nachfolgender Radiatio oder Chemotherapie (8 Patienten) hatten 4 spŠter wieder ein Rezidiv entwickelt. In der Patientengruppe mit R1- oder R2Resektion und nachfolgender Radiatio oder Chemotherapie (7 Patienten) hatten 5 spŠter ein Rezidiv entwickelt. 4.3.4 ValiditŠt der bildgebenden und anderen Diagnostik Tabelle 34: ValiditŠt der verschiedenen Untersuchungen Mittlerer postoperativer Untersuchungsabstand in Monaten SensitivitŠt insgesamt in % (richtig positive Diagnose) 6HQVLWLYLWlWQXUIU5H]LGLYHLQ SpezifitŠt insgesamt in % (richtig negative Diagnose) Positive PrŠdiktion in % Negative PrŠdiktion in % MRT CT Sonografie 5,5 8,1 10,6 Kšrperliche Untersuchung 8,2 75 (38/51) 87 (13/15) 72 (13/18) 80 (32/40) 79 (27/34) 83 (10/12) 79 (11/14) 86 (24/28) 36 (5/14) 67 (4/6) 67 (2/3) 60 (3/5) 91 (38/42) 93 (13/14) 93 (13/14) 94 (32/34) 50 (5/10) 80 (4/5) 40 (2/5) 33 (3/9) Quelle: eigene Darstellung 72 Diskussion 5 Diskussion 5.1 Prognostische Faktoren Die Ergebnisse dieser Arbeit mit denen aus der bis dato dazu erschienenen Literatur in Beziehung zu setzen, war nicht ganz unproblematisch, da sich das untersuchte Ausgangspatientengut anderer Studien in den meisten FŠllen von dem dieser Arbeit unterschied. Es handelte sich nŠmlich fast immer um Langzeit-Prospektivstudien, die den Krankheitsverlauf der Patienten seit der PrimŠroperation verfolgten, also auch die Patienten, die nach GHU3ULPlUUHVHNWLRQIULPPHUJHQHVHQZDUHQ(EHQGLHVH3DWLHQWHQZDUHQMDHLQZLFKWLJHU Bestandteil der Berechnung der spŠteren RezidivhŠufigkeit in AbhŠngigkeit verschiedener Parameter. Im Gegensatz dazu stellen in dieser retrospektiven Fall-Kontroll-Studie ausVFKOLHOLFK VROFKH 3DWLHQWHQ GLH VLFK HLQHU ]ZHLWHQ n-ten) Nachresektion unterziehen PXWHQGDV.ROOHNWLYIUGLH%HUHFKQXQJYHUVFKLHGHQHU+lXILJNHLWHQGDUZHLOYRQGLHVHQ Patienten ausgehend Parameter ermittelt werden sollten, welche auf tumorfreie, HQW]QGOLFKQDUELJH 9HUlQGHUXQJHQ KLQGHXWHQ RGHU HKHU DXI HLQ HUQHXWHV 5H]LGLY hinweisen. 5.1.1 PatientenabhŠngige Faktoren +LHU ILHO DXI GD GDV Ersterkrankungsalter der Patienten mit tumorfreiem Nachresektat ohne Rezidiv in der Vergangenheit im Durchschnitt 7,3 Jahre unter dem Ersterkrankungsalter der Gesamtpatienten lag. Bei den Patienten mit erstem Rezidiv bzw. sŠmtlichen Patienten mit Rezidiv lag das Erkrankungsalter allerdings nur unwesentlich bzw. 4 Jahre EHUGHPGesamterkrankungsalter. In einigen Studien wurde ein hšheres Lebensalter aber DOVSURJQRVWLVFKHU )DNWRUIUHLQH]XNQIWLJH5H]LGLYHQWVWHKXQJEHVFKULHEHQ> @ MšglicherZHLVHLVWGLH+HLOXQJVWHQGHQ]EHLMQJHUHQ3DWLHQWHQK|KHUVRGDVLH JHQHUHOO VHOWHQHU5H]LGLYHDXVELOGHQ(LQHJHQHUHOOK|KHUH5DGLNDOLWlWGHU2SHUDWLRQHQEHLMQJHUHQ Patienten kann hier als Ursache ausgeschlossen werden, da bei den Operationsarten bzw. ResektionsqualitŠten keine altersabhŠngigen Unterschiede bestanden. Es kšnnte jedoch VHLQGDEHLMQJHUHQ3DWLHQWHQEHZXWRGHUXQEHZXWYRUVLFKWLJHUYRUJHJDQJHQZLUG d. h. bei jeglichem Rezidivverdacht mšglichst immer nachreseziert wird, um jedes Risiko DXV]XVFKOLHHQ EHL lOWHUHQ 3DWLHQWHQ KLQJHJHQ HKHU HLQH DEZDUWHQGH +DOWXQJ WROHULHUW wird. Die Geschlechterverteilung betrug bei den Patienten mit Pseudorezidiv sowohl mit oder ohne Rezidiv in Vergangenheit etwa 1:1, wŠhrend bei den Patienten mit Erstrezidiv und auch insgesamt die MŠnner mit 1,5:1, bei sŠmtlichen Patienten mit Rezidiv sogar 1,9:1 hŠufiger betroffen waren. Anhand dieser Gesamtverteilung von m:w = 1,5:1 wŠren bei den Patienten mit Pseudorezidiv Šhnliche Werte zu erwarten gewesen, da ja insgesamt MŠnner etwas šfter an Weichgewebssarkomen erkranken und folglich auch mehr MŠnner als 73 Diskussion )UDXHQ QDFKUHVH]LHUW ZHUGHQ PWHQ $QVFKHLQHQG VLQG DEHU KlXILJHU )UDXHQ IlOVFKOLFKHUZHLVH QDFKUHVH]LHUW ZRUGHQ DOV 0lQQHU (LQH SODXVLEOH (UNOlUXQJ KLHUIU JLEW es allerdings nicht. :HLWHUKLQ ZDU DXIIlOOLJ GD GHU =HLWUDXP ]ZLVFKHQ HUVWHQ .UDQNKHLWVV\PSWRPHQ XQG SULPlUHU6DUNRPGLDJQRVHEHLGHQ3DWLHQWHQPLW3VHXGRUH]LGLYHWZDVNU]HUJHZHVHQZDU als insgesamt und sogar nur halb so lang wie bei den Patienten mit Rezidiv. Allerdings NRUUHOLHUWH HLQH NU]HUH =HLWVSDQQH ZLHGHUXP QLFKW PLW HLQHU JHULQJHUHQ 3ULPlU WXPRUJU|H'DVN|QQWHGDIUVSUHFKHQGDEHLODQJHU6\PSWRPGDXHUXQDEKlQJLJYRQGHU 7XPRUJU|HGLH6DUNRP]HOOHQPHKU=HLW]XP6WUHXHQMHQVHLWVHLQHUYRUKDQGHQHQ.DSVHO haben, ehe sie reseziert werden und dann diese Zellen im Wundbett verbleiben und Rezidive ausbilden. Bei den Patienten mit langer Symptomdauer wŠre wichtig zu wissen, REHLQHVSlWH$U]WNRQVXOWDWLRQRGHUDEHUHLQHIUKH$U]WNRQVXOWDWLRQPLWDOOHUGLQJVIDOVFK QHJDWLYHP%HIXQG]XGHUVSlWHQ6DUNRPGLDJQRVHJHIKUWKDWWH(LQLJHZHQLJH$QDPQHVHQ HQWKLHOWHQ +LQZHLVH DXI SULPlU IDOVFK QHJDWLYH 'LDJQRVHQ ZLH +lPDWRP 0XVNHOIDVHUUL oder Lipom. Bei den meisten Anamnesen fehlte allerdings die entsprechende Information. 5.1.2 TumorabhŠngige Faktoren %HL EHU GHU +lOIWH GHU 3DWLHQWHQ PLW WXPRUIUHLHP 1DFKUHVHNWDW RKQH 5H]LGLY LQ GHU Vergangenheit hatte primŠr ein Liposarkom vorgelegen, obwohl der Gesamtanteil der Liposarkome hier bei durchschnittlich etwa 30 %, und bei den Rezidiven noch etwas darunter lag. Laut verschiedener Publikationen betrŠgt der Liposarkomanteil unter den Weichteilsarkomen aber nur 10-16 %, und nur eine Studie [21] fand eine verminderte Rezidivrate bei Vorliegen dieses histologischen Typs. Der hohe Liposarkomanteil unter GHQ 3DWLHQWHQ PLW 3VHXGRUH]LGLY KlQJW DOVR ZDKUVFKHLQOLFK PLW GHP KLHU EHUGXUFK schnittlichen Gesamtanteil an Liposarkomen zusammen. Ansonsten gab es unter den Patienten mit Rezidiv keine auffŠllige HŠufung eines bestimmten Sarkomtyps. Ergebnisse verschiedener Studien, in denen Leiomyosarkome [17], Fibrosarkome [35, 35] und der MPNST [35] mit einer hšheren Lokalrezidivrate assoziiert waren, kšnnen nicht bestŠtigt werden. Beim Grading ergaben sich keine Besonderheiten; bei den meisten tumorfreien 1DFKUHVHNWDWHQ KDWWH SULPlU HLQ PLWWHOJUDGLJ GLIIHUHQ]LHUWHU 7XPRU YRUJHOHJHQ ± EHL GHQ Patienten mit Rezidiv hingegen šfter ein hoch differenzierter, was eigentlich unlogisch ist und wahrscheinlich zufŠllig bedingt. In der Literatur fand nur eine Arbeit eine SURJQRVWLVFKH 5HOHYDQ] IU GDV *UDGLQJ DOV XQJQVWLJHQ )DNWRU IU HLQH VSlWHUH Rezidiventstehung [19]. Ebenfalls unauffŠllig war die Verteilung der Tumorlokalisation. Sowohl bei den Patienten mit Rezidiv als auch denen ohne vitale Tumoranteile im Nachresektat war die untere 74 Diskussion ExtremitŠt (und hier wiederum der proximale Anteil) am hŠufigsten betroffen. Die zweithŠufigste Tumorlokalisation war bei den Patienten mit Rezidiv die obere ExtremitŠt und bei den Patienten mit Pseudorezidiv die Rumpfregion. Nur zwei Arbeiten fanden eine SURJQRVWLVFKH5HOHYDQ]IUGLHREHUH([WUHPLWlW [17] XQGIU5XPSIXQG5HWURSHULWRQHXP >@/HW]WHUHVOlWVLFKZDKUVFKHLQOLFKGXUFKGLHLQGLHVHU5HJLRQFKLUXUJLVFKQXUVFKZHU erreichbare RadikalitŠt erklŠren. %HL GHU 8QWHUVXFKXQJ GHU ,QILOWUDWLRQVWLHIH GHV 3ULPlUWXPRUV ILHO DXI GD GLHVH EHL GHQ Patienten mit Pseudorezidiv ohne Rezidiv in der Vergangenheit hŠufiger oberflŠchlich gewesen war (44 %) als bei allen Patienten insgesamt (22 %) und den Patienten mit Erstrezidiv (0$XHUGHPODJGHU$QWHLOGHUSULPlUHQ77XPRUHQXQWHUGHQ3DWLHQWHQ mit Erstrezidiv bei nur 20 % (T2 80 %); bei den Patienten mit Pseudorezidiv hingegen war dieser Anteil mit 36 % zwar nur unwesentlich erhšht, entsprach damit aber zumindest der GesamthŠufigkeit von primŠren T1-Tumoren (33 %). In der Gruppe der Patienten mit DNWXHOOHP 5H]LGLY EHWUXJ GLH MHZHLOV YRUKHULJH 7XPRUJU|H ± JDQ] LP *HJHQVDW] ]XU 3ULPlUWXPRUJU|H ± LQ % der FŠlle weniger als 5 cm (also T1). Dies ist hšchstwahrscheinlich durch die engmaschigen Nachsorgeuntersuchungen bedingt, die eine IUK]HLWLJH(QWGHFNXQJGHU5H]LGLYHHUP|JOLFKHQ$OOHLQGLH,QILOWUDWLRQVWLHIHZXUGHLQGHU /LWHUDWXU ]ZDU QLFKW DOV SURJQRVWLVFKHU )DNWRU IU HLQH VSlWHUH Lokalrezidiventstehung, ZRKO DEHU HLQH 7XPRUJU|H ! 5 cm [5] bzw. > 10 cm [11, 17] als prognostisch relevant EHVFKULHEHQ'DGLHPHLVWHQ77XPRUHQDXIJUXQGLKUHU*U|HIDVWLPPHUWLHIORNDOLVLHUW sind (in dieser Arbeit > 80 %), korrelieren diese Ergebnisse mit den Literaturangaben. Mit dem Parameter "Anzahl der Tumorknoten" sollte eine eventuelle HŠufung primŠr disseminierter oder in multiplen Konglomeraten vorliegender Sarkome unter den Patienten mit Rezidiv im Gegensatz zu nur einem Tumorkonglomerat bei den Patienten mit Pseudorezidiv festgestellt werden. Diese Tendenz konnte leider bei isolierter Betrachtung der PrimŠrtumoren nicht festgestellt werden, v. a. auch mangels hierzu vorhandener Angaben bei den Patienten mit Rezidiv. Bei Betrachtung des jeweils vorherigen Resektats bei allen Patienten mit Tumorrezidiv im aktuellen Resektat kam eine disseminierte Tumorausbreitung (³ 2 Tumorknoten) etwas hŠufiger vor (33 %) als insgesamt (23 %) und unter den Patienten ohne vitale Tumoranteile im Nachresektat (16 %). Satellitenmetastasen wurden insgesamt zu selten beschrieben oder nicht untersucht (die ZHQLJHQDOOHUGLQJVDOOHLQGHU9RUJHVFKLFKWHYRQ3DWLHQWHQPLW5H]LGLYXPGDUEHUHLQH Aussage treffen zu kšnnen, obwohl vermutlich gerade diese mikroskopischen TumorDEVSUHQJXQJHQRIWYHUDQWZRUWOLFKIUHLQVSlWHUHV/RNDOUH]LGLYVLQG Der wichtigste Parameter war die Beurteilung der vorherigen Tumorkategorie, also die Frage, ob der vorausgehende Tumor bereits ein Rezidiv war oder nicht. Bei 80 % der Patienten mit aktuellem Pseudorezidiv war unmittelbar der PrimŠrtumor oder aber ein ebenfalls tumorfreies PrŠparat entfernt worden, dagegen entsprach dieser Anteil bei den 75 Diskussion Patienten mit aktuellem Rezidiv nur 20 %; in 79 % der FŠlle waren ein oder mehrere Rezidive bereits vorausgegangen. Zu Šhnlichen Ergebnissen kamen auch andere Studien, LQGHQHQQDFKJHZLHVHQZXUGHGD3DWLHQWHQPLWHLQHP/RNDOUH]LGLYJHJHQEHU3DWLHQWHQ mit primŠrer Sarkomerkrankung ein hšheres Risiko haben, erneut an einem Lokalrezidiv zu erkranken [5, 35, 50]. +LHU PX GLVNXWLHUW ZHUGHQ RE PLW MHGHU 2SHUDWLRQ GDV 5LVLNR einer tatsŠchlichen Tumorzellverschleppung steigt und inwieweit das Operationsbett durch diverse postoperative VerŠnderungen mit jeder Resektion mehr "maskiert" wird, wodurch eine Entscheidung zwischen gesundem und tumoršsem Gewebe chirurgischerseits immer VFKZLHULJHU ZLUG $XHUGHP YHUJU|HUQ VLFK PLW MHGHU ]XVlW]OLFKHQ 1DFKUHVHNWLRQ GLH lokalen GewebsGHIHNWH XQG GLHVH OLPLWLHUHQ GDQQ VFKOLHOLFK GLH 0|JOLFKNHLW HLQH chirurgische RadikalitŠt zu erreichen. 5.1.3 TherapieabhŠngige Faktoren Interessant war hier die Analyse der Frequenz von prŠoperativen Probeexzisionen. Bei der %HWUDFKWXQJ GHU 3DWLHQWHQ PLW (UVWUH]LGLY ILHO DXI GD KlXILJHU 3( E]Z %LRSVLHQ vorgenommen worden waren als bei den Patienten mit tumorfreiem Nachresektat und allen Patienten insgesamt. Auch zu diesem Aspekt fanden sich bestŠtigende Angaben in der Literatur: Bei offener prŠoperativer PE besteht die Gefahr der Tumorzellverschleppung und damit das Risiko einer erhšhten Lokalrezidivrate [3, 41]. Allerdings waren bei den 3DWLHQWHQ PLW 3VHXGRUH]LGLY QLFKW ZHQLJHU %LRSVLHQ DOV GXUFKVFKQLWWOLFK GXUFKJHIKUW ZRUGHQVRGDVLFKKLHUDXVNHLQHJQVWLJH3URJQRVHQLFKWDQHLQHP5H]LGLY]XHUNUDQNHQ ergibt. Von allen Patienten insgesamt waren 70 % zuvor in einer auswŠrtigen Klinik und nur 30 % im BHL operiert worden. Bei den Patienten mit Pseudorezidiv war der Anteil der Patienten mit Zustand nach auswŠrtiger Resektion wesentlich hšher (87 %) als bei den Patienten mit Rezidiv (52 'LHV KlQJW ZDKUVFKHLQOLFK GDPLW ]XVDPPHQ GD LP 5DKPHQ GHU IU Weichteiltumorchirurgie XQG GLDJQRVWLN HUIDKUHQHQ XQG VSH]LDOLVLHUWHQ $EWHLOXQJ IU 3ODVWLVFKH &KLUXUJLH LQ .RRSHUDWLRQ PLW GHP ,QVWLWXW IU 3DWKRORJLH DQ GHQ .OLQLNHQ Bergmannsheil eine genauere und mehr standardisierte Therapie und Nachsorge mšglich ist. Deshalb ist bei den primŠr hier behandelten Patienten die Anzahl der spŠter durchJHIKUWHQ 1DFKUHVHNWLRQHQ RKQH 1DFKZHLV GHV YHUPXWHWHQ 7XPRUV JHULQJHU DOV EHL GHQ auswŠrtigen Patienten. Die Analyse des vorherigen Operationsmodus bei den zwei verschiedenen PatientenJUXSSHQ HUJDE OHLGHU NHLQH VFKOVVLJHQ (UJHEQLVVH %HL GHQ 3DWLHQWHQ PLW 5H]LGLY ODJ LQ 59 % der FŠlle ein Zustand nach Lokalresektion vor, bei den Patienten mit Pseudorezidiv EHWUXJGLHVHU $QWHLO QLFKW HUZDUWXQJVJHPl ZHQLJHU VRQGHUQ ZDU PLW % sogar hšher. Diese unklaren Werte kommen vermutlich durch die je nach Klinik sehr unterschiedlich 76 Diskussion JHKDQGKDEWH 'HILQLWLRQ YRQ ZHLWHU XQG ORNDOHU 5HVHNWLRQ ]XVWDQGH VR GD GLH Untersuchung dieses Parameters nicht aussagekrŠftig war. Die chirurgisch beurteilten Resektionsergebnisse (in sano / nicht in sano) stimmten in etwa óDOOHU)lOOHPLWGHUDQVFKOLHHQGHQKLVWRORJLVFKHQ%HXUWHLOXQJQLFKWEHUHLQ%HLGLHVHQ 1LFKWEHUHLQVWLPPXQJHQKDQGHOWHHVVLFK]XPJU|WHQ7HLOXPYHUPHLQWOLFKHIn-sanoResektionen", die sich dann mikroskopisch als R1-Resektionen erwiesen. Ansonsten eignete sich dieser Parameter nicht als prognostischer Faktor, da sowohl bei den FŠllen mit als auch ohne Nachweis vitalen Tumorgewebes im PrŠparat die vorherige Operation in EHU % der FŠlle als in sano angesehen wurde. Bei der Betrachtung der durchschnittlichen bisherigen Operationsanzahl, die bei allen 3DWLHQWHQLQVJHVDPWEHWUXJ]HLJWHVLFKGDGLH3DWLHQWHQPLW5H]LGLYLP0LWWHOVFKRQ šfter operiert worden waren (3,5) als die Patienten mit Pseudorezidiv (1,4). Diese (UJHEQLVVHNRUUHOLHUHQPLWGHU$XVVDJHGD % der Patienten mit Lokalrezidiv bereits an einem oder mehreren Rezidiv- oder Residualtumoren erkrankt und operiert worden waren. Ein erheblicher Unterschied zwischen den beiden Patientengruppen bestand im zeitlichen Abstand der aktuellen zur jeweils vorherigen Operation, der bei den Patienten mit Pseudorezidiv im Mittel nur 3,2 Monate, bei den Patienten mit Rezidiv dagegen 10,9 Monate betrug. Wahrscheinlich ist dieser relativ kurze Abstand bei den Patienten mit Pseudorezidiv GDGXUFK ]X HUNOlUHQ GD GLH SRVWRSHUDWLYHQ 9HUlQGHUXQJHQ ZLH Granulations- und Narbengewebe, Serome oder HŠmatome, die zur Verwechslung mit HLQHP 5H]LGLY IKUHQ N|QQHQ VLFK PHLVWHQV LQQHUKDOE GHU HUVWHQ :RFKHQ SRVWRSHUDWLY ausbilden. Echte Rezidive brauchen in den meisten FŠllen anscheinend lŠnger, um eine NOLQLVFKH 5HOHYDQ] ]X HUODQJHQ 'DV ZUGH EHGHXWHQ GD HLQH SRVWRSHUDWLY UHODWLY IUK aufgetretene Schwellung, hier nach durchschnittlich 3,2 Monaten, wahrscheinlich eher šdematšsen bzw. narbigen VerŠnderungen, eine relativ spŠt - im Mittel nach 10,9 Monaten - entstandene dagegen eher tumoršsen VerŠnderungen entspricht. 5.1.3.1 ResektionsqualitŠt und Resektionsabstand in cm ,Q GLYHUVHQ 6WXGLHQ NRQQWH JH]HLJW ZHUGHQ GD PDUJLQDO RSHULHUWH E]Z 5 UHVH]LHUWH Sarkome eine wesentlich hšhere Rezidivrate aufweisen als im Gesunden operierte Sarkome [21, 34, 35, 50]. Dagegen gibt es in der Literatur bislang nur wenige und XQWHUVFKLHGOLFKH $QJDEHQ EHU JHQDX GHILQLHUWH 6LFKHUKHLWVDEVWlQGH GLH EHL HLQHU Resektion eingehalten werden sollten. Oft wird ein Abstand von "mehreren" cm in allen Ebenen empfohlen [2], bei subkutanen Sarkomen wird z.B. eine primŠre En-blocResektion inklusive 3-5 cm umliegenden Gewebes und tiefer Faszie empfohlen [43] und in einer weiteren Studie wurden laterale AbstŠnde von 5 cm und tiefe AbstŠnde von 2 cm favorisiert [39]. 77 Diskussion Nachresektate mit Nachweis eines Tumorrezidivs In dieser Studie waren von allen PrŠparaten mit Rezidivnachweis zwar 72 % zuvor sicher R0 reseziert worden (28 % R1, R2 mit Nachbestrahlung oder unsicher R0 reseziert), allerdings in den meisten FŠllen (76 %) mit nur sehr geringem, weniger als 1 cm betragendem Sicherheitsabstand zum Resektionsrand. Bei zwei Patienten hatte ein minimaler Abstand zwischen 1 und 1,9 cm und bei drei Patienten ein Sicherheitsabstand > 3 cm vorgelegen, welcher in der Literatur als ausreichend im Sinne einer weiten Resektion angesehen wird. Aus diesem Grund sollen diese drei Patienten hier genauer betrachtet werden: Minimaler Abstand 4,5 cm: Bei der 66-jŠhrigen Patientin lag ein MPNST G2 pT2 N0 M0 der Axilla (= Residualtumor nach 3ULPlUWXPRU23 EHU x 4 cm vor, mit hauptsŠchlicher Lokalisation zentral im N. medianus und Infiltration in das umliegende Weichgewebe. Anamnestisch erwŠhnenswert ist ein Zustand nach ipsilateraler Brustamputation 16 Jahre zuvor. Der N.PHGLDQXVZXUGHEHLGHU2SHUDWLRQEHUHLQH/lQJHYRQ 12,5FP DEJHVHW]W VDPW DQKlQJHQGHP )HWWJHZHEH EHU x 6 cm und 8 x 2 cm Hautspindel, mit Epineurektomie von N. ulnaris und -musculocutaneus, partieller Biceps- und 7ULFHSVUHVHNWLRQ XQG (QWIHUQXQJ GHV 6HSWXP LQWHUPXVFXODUH EHU cm. Laut OP-Bericht lag eine weite Exzision vor. Es ergab sich ein minimaler Resektionsabstand von 4,5 cm. Der Tumor bestand nur aus einem Knoten; Satellitenmetastasen lagen nicht vor. Viereinhalb Monate spŠter ergab die Nachsorgeuntersuchung den Verdacht auf ein /RNDOUH]LGLYZHOFKHVGDQQò0RQDWHVSlWHURSHUDWLYHQWIHUQWZXUGH'LDJQRVH03167 G2 pT2 NX MX R1), in zwei Knoten vorlag (3 cm im N. medianus und 4 cm im N.XOQDULVXQGXQWHU(UKDOWGHU*HIlXQG1HUYHQVWUXNWXUHQQLFKWNXUDWLYHQWIHUQWZHUGHQ konnte. Als problematisch wird in der Literatur die bei diesen Sarkomen bevorzugte Ausbreitung entlang des Epi- oder Perineuriums angesehen, die intraoperativ nur schwer zu erkennen ist XQG YLHOOHLFKW DXFK LQ GLHVHP )DOO DOV XUVlFKOLFK IU GDV HUQHXWH 5H]LGLY WURW] FP Sicherheitsabstand gelten kann. Minimaler Abstand 4 cm: Beim PrimŠrtumor des 27-jŠhrigen Patienten handelte es sich um einen MPNST G1-2 pT1 N0 M0 R0/1 der Unterbauchregion, der zusammenhŠngend in grobknotigem Wachstum vorlag und < 50 % Nekrosen aufwies. Der Patient hatte einen Monat zuvor erstmals einen tastbaren Tumor bemerkt. Bei der lokalen Exzision wurde ein ca. 4 x 2,5 cm tumoršs durchVHW]WHV *HZHEVVWFN HQWIHUQW EHL GHU KLVWRORJLVFKHQ Aufarbeitung ergab sich eine subfasziale Tumorlokalisation im M. rectus abdominis mit tiefer Faszieninfiltration. Randlich wurde eine begrenzende Pseudokapsel beschrieben, die DQ]ZHL6WHOOHQPDNURVNRSLVFKIUDJOLFKGXUFKEURFKHQZDUDQVRQVWHQEHUDOOHLQVSlUOLFKHU Muskulatur- und Fettgewebssaum. Im 2 Wochen spŠter angefertigten CT ergab sich kein Rezidivhinweis. Wiederum 3 Wochen spŠter erfolgte eine weite Nachresektion aufgrund 78 Diskussion der unsicheren R0-Situation. Es wurden der rechte M. rectus abdominis komplett und Anteile des linken, eine 11 x 6 cm Hautspindel mit anhŠngend 16 x 11 x 5 cm Fettgewebe und Anteile des Peritoneums entfernt. Feingeweblich fand sich eine vom Rektusmuskel eingescheidete 4,5 x 2 cm Narbenzone, die bis auf das Peritoneum reichte. Zentral in dieser 1DUEHQ]RQH IDQGHQ VLFK EHU cm fraglich atypische Zellproliferate. Die minimalen AbstŠnde zur Narbenzone lagen in jeder Ebene zwischen 4 und 5 cm. 3 Monate spŠter ergab die Nachsorgeuntersuchung eine ausgedehnte Peritoneal- und Mesenterialmetastasierung. Die 2 Monate spŠtere palliative explorative Laparatomie ergab eine Peritonealsarkomatose mit Infiltration in Darm und Mesenterium im Beckenbereich und einen Konglomerattumor im Douglasraum; Diagnose: epitheloider MPNST G2-3 pT2 NX MX R2. %HLGLHVHP3DWLHQWHQNDQQZDKUVFKHLQOLFKHLQHVFKRQIUK]HLWLJHTumorzellabsiedlung ins 3HULWRQHXP GLH GLH *UXQGODJH IU GLH $XVEUHLWXQJ LQ GHU %DXFKK|KOH GDUVWHOOW DQJHQRPPHQ ZHUGHQ 'LH %HVFKUHLEXQJ GHU IUKHQ WLHIHQ )DV]LHQLQILOWUDWLRQ XQG GHU VSlWHUHQ 1DUEHQ]RQH GLH ELV DXI GDV 3HULWRQHXP UHLFKWH ODVVHQ GDUDXI VFKOLHHQ 6HOEVW ZHQQ ORNDOLVLHUW QXU HLQ]HOQH IUDJOLFKH =HOODW\SLHQ JHIXQGHQ ZXUGHQ PX PDQ YRQ weiteren zu diesem Zeitpunkt bereits bestehenden Tumorabsiedlungen in anderen, bei der 23 QLFKW HQWIHUQWHQ 6WUXNWXUHQ DXVJHKHQ =X EHUOHJHQ EOHLEW RE EHL 6DUNRPLQILOWUDWLRQ tiefer Faszien im Bauchraum eine (ausgedehnte) Peritonealresektion vorgenommen werden sollte, um derartige KrankheitsverlŠufe zu verhindern. Minimaler Abstand 3 cm: Bei dem PrimŠrtumor einer 39-jŠhrigen Patientin handelte es sich um eine 9 x 6FPJURH$JJUHVVLYH)LEURPDWRVH''*)LEURVDUNRPS71;0; im proximalen medialen Oberschenkel. Es wurde eine Muskelgruppenresektion mit Entfernung des proximalen M. gracilis, der Mm. semitendinosus und semimembranosus, Teilen des Adduktor brevis, 16 x 5 cm Hautspindel und 19 x 16 cm Weichgewebe YRUJHQRPPHQ 'LH KLVWRORJLVFKH $XIDUEHLWXQJ HUJDE HLQH EHUZLHJHQG VXENXWDQH Lokalisation mit beginnender tiefer Muskelinfiltration; der minimale Sicherheitsabstand betrug 3 cm in der distalen AE und 6 cm zur Tiefe. Der Tumor lag zusammenhŠngend in grobknotigem Wachstum vor; Satellitenmetastasen fehlten. 15 Monate spŠter bemerkte die Patientin nach einem Sturz an selber Stelle eine VerhŠrtung, die wiederum 4 Monate spŠter biopsiert wurde und die gleiche Diagnose (DD: Aggressive Fibromatose / G1 Fibrosarkom) erbrachte. Die durch Kompartimentresektion erfolgte Rezidiv-OP (Diagnose: $JJUHVVLYH)LEURPDWRVHS7]HLJWHHLQHGLVVHPLQLHUWH7XPRUDXVEUHLWXQJJU|WHU.QRWHQ 4,5 cm) auf die Subkutis beschrŠnkt. Anamnestisch wird ein relativ langer Zeitraum (29 Monate) zwischen Erstsymptomen und Sarkomdiagnose mit langsamem Tumorwachstum angegeben. Die Sarkomdiagnose erfolgte einen Monat vor der PrimŠr-OP durch eine PE. 79 Diskussion In diesem Fall kšnnen nur die relativ spŠte Sarkomdiagnose, die prŠoperative PE und der histologische Typ an sich (die Aggressive Fibromatose ist in der Literatur durch hohe Rezidivraten gekennzeichnet) als mšgliche Rezidivursachen diskutiert werden. Nachresektate ohne Nachweis eines Tumorrezidivs Bei den Patienten mit tumorfreiem Nachresektat lag in 43 % ein Zustand nach sicherer R0Resektion, in 33 % ein Z. n. R0/1 Resektion vor, bei 23 % war sogar eine R1- oder R2Resektion vorausgegangen. Bei drei der 13 R0-Resektionen hatte im vorherigen Resektat bereits Narbengewebe vorgelegen; hier war entweder durch MRT oder palpable Knotenbildung wieder ein Rezidiv vermutet worden. Bei weiteren 10 Resektaten mit Z. n. R0-Resektion wŠren eigentlich weite SicherheitsabstŠnde zu erwarten gewesen, statt dessen fanden sich fast DXVVFKOLHOLFK DOV NQDSS LQ VDQR EHVFKULHEHQH $EVWlQGH LQ GHQ SDWKRORJLVFKDQDWR mischen Begutachtungen. In nur zwei FŠllen war eine eindeutige Tumorkapsel beschrieben worden, die aber laut Literaturangaben [9] durchaus auch von Tumorzellen durchsetzt sein kann. Bei den restlichen Resektaten handelte es sich meist sogar nur um lockeres Fett- oder Bindegewebe, das den Tumor umgab. Insgesamt war in der Gruppe der 13 R0-Resektion nur bei einem Patienten eine postoperative Radiatio beschrieben worden. Bei den 10 FŠllen mit Z. n. R0/1-Resektion ist noch unverstŠndlicher, warum sich kein Rezidiv ausbildete, zumal hier hŠufig randbildendes Tumorgewebe beschrieben und deshalb eine Resektion in sano immer angezweifelt worden war. Allerdings war hier immer unklar, was der Ausdruck "randbildend" nun eigentlich bedeutet: eine von Tumorzellen durchbrochene Absetzungsebene oder ein im mikroskopischen Bereich liegender 6LFKHUKHLWVDEVWDQG" ,Q GLHVHU *UXSSH ODJHQ LQ QXU ]ZHL )lOOHQ $QJDEHQ EHU HLQH 1DFK bestrahlung vor, welche die Rezidivfreiheit erklŠren kšnnte. In 7 FŠllen hatte eine R1- oder R2-Resektion vorgelegen, davon zwei mit postoperativer 5DGLDWLR 9RU DOOHP EHL GHQ IQI 5 E]Z 55HVHNWLRQHQ RKQH QDFKIROJHQGHU 5DGLDWLR wŠren Tumorresiduen zu erwarten gewesen. In vier pathologischen Begutachtungen trat wieder der Begriff "randbildendes" Tumorgewebe auf. Hier blieb eigentlich unklar, ob die Definition der R1-Resektion wirklich zutreffend war oder ob es sich nicht doch um eine marginale R0-Resektion handelte. Insgesamt bleibt fraglich, warum sich nach derart beschriebenen ResektionsrŠndern kein Rezidivtumor mehr entwickelte. 80 Diskussion 5.1.4 6FKOXIROJHUXQJHQ Insgesamt konnten sechs der siebzehn untersuchten prognostischen Parameter zur KlŠrung der Fragestellung beitragen. 1. (LQMXQJHV$OWHUEHLSULPlUHU6DUNRPGLDJQRVHVFKHLQWHLQHQJQVWLJHQ(LQIOXDXIGLH lokale Tumorkontrolle zu haben, denn die Patienten mit Pseudorezidiv waren mit einem durchVFKQLWWOLFKHQ $OWHU YRQ -DKUHQ -DKUH IUKHU HUNUDQNW DOV GLH Patienten mit Tumorrezidiv. 2. (LQH IUK]HLWLJH 'LDJQRVH GHV 3ULPlUWXPRUV KDW ZDKUVFKHLQOLFK HEHQIDOOV HLQHQ JQVWLJHQ (LQIOX EH]JOLFK GHU 5H]LGLYKlXILJNHLW GD EHL GHQ 3DWLHQWHQ RKQH Tumornachweis im Nachresektat die PrimŠrdiagnose im Mittel schon 5,6 Monate nach Symptombeginn gestellt worden war, bei den Patienten mit Rezidiv hingegen erst nach 14,4 Monaten. Hier konnte nicht geklŠrt werden, wie es zu diesen spŠten Diagnosen gekommen war; d.h. ob die Ursache vorwiegend beim Patienten (spŠte Arztkonsultation) oder aber beim Arzt (falsch negative Diagnose) lag. 3. 'LH 7XPRUJU|H ZXUGH EHUHLWV LQ DQGHUHQ 6WXGLHQ DOV SURJQRVWLVFKHU )DNWRU IU HLQH spŠtere Rezidiventstehung beschrieben [5, 11, 17]. Auch diese Studie zeigte eine HŠufung der primŠren T2-Tumoren unter den Patienten mit Tumorrezidiv. Noch auffŠlliger war in diesem Zusammenhang aber die Infiltrationstiefe des PrimŠrtumors. %HL DOOHQ 3DWLHQWHQ PLW DXVVFKOLHOLFK HUVWHP 5H]LGLY KDWWH GHU 3ULPlUWXPRU WLHIH Strukturen infiltriert (100 %), bei den Patienten mit Pseudorezidiv hingegen nur in 50 % der FŠlle. 4. Ein weiteres wichtiges Kriterium war die vorherige Tumorkategorie. Unter den Patienten mit Pseudorezidiv waren in 80 % der FŠlle zuvor entweder der PrimŠrtumor oder ein ebenfalls tumorfreies PrŠparat entfernt worden. Bei den Patienten mit Rezidiv betrug dieser Anteil nur 20 %; bei den restlichen 80 % waren bereits ein oder mehrere Rezidive vorausgegangen! Andere Studien bestŠtigen diese Ergebnisse [5, 35, 50]. Entsprechend verhielt es sich mit der mittleren Anzahl der bisherigen Resektionen: 1,4 Operationen waren bei den Patienten mit Pseudorezidiv und 3,5 bei den Patienten mit Tumorrezidiv vorausgegangen. 5. Genauso wie die bisherige OperationshŠufigkeit kšnnte der zeitliche Abstand zur vorherigen Operation einen Hinweis darauf geben, ob ein echtes Tumor- oder Pseudorezidiv vorliegt. Ist der Abstand nur kurz (hier 3,2 Monate), so handelt es sich ZDKUVFKHLQOLFKXPHLQHHQW]QGOLFKRGHU|GHPDW|VEHGLQJWH6FKZHOOXQJ%HLOlQJHUHP Abstand ist eher ein Rezidiv als Schwellungsursache anzunehmen (hier 10,9 Monate). Fazit: Schon in anderen Studien wurde darauf hingewiesen, wie wichtig es ist, standardisierte Diagnose- und Therapieschemata bei der Behandlung von Weichteilsarkomen einzuhalten bzw. betroffene Patienten umgehend in sogenannte "Weichteil81 Diskussion tumorzentren" einzuweisen, um u. a. die RezidivhŠufigkeit zu senken. In dieser Studie waren nur 13 % der Patienten mit tumorfreiem Nachresektat (falsch positive Diagnose) ]XYRU LP %HUJPDQQVKHLO IU GLH Weichteiltumorchirurgie bzw. -pathologie spezialisierte $EWHLOXQJLP5DKPHQGHU3ODVWLVFKHQ&KLUXUJLHXQGGHV ,QVWLWXWVIU3DWKRORJLHRSHULHUW worden. D. h. in 87 % der FŠlle war die primŠre Tumordiagnostik, -chirurgie und -histopathologie LQ YHUVFKLHGHQHQ DXVZlUWLJHQ .OLQLNHQ LQ JDQ] 'HXWVFKODQG GXUFKJHIKUW ZRUGHQ %HL GLHVHQ )lOOHQ ZDUHQ GLH 8QWHUVXFKXQJVHUJHEQLVVH RIW OFNHQKDIW GLH pathologisch-anatomischen Begutachtungen nicht eindeutig usw. Dementsprechend fiel dann die prŠoperative Entscheidung, ob es sich nun um Tumor- oder nur Narbengewebe KDQGHOWVHKUVFKZHUXQGIKUWHRIW]XUIDOVFKSRVLWLYHQOP-Indikation. ,Q GLHVHP =XVDPPHQKDQJ PX DXFK DQJHPHUNW ZHUGHQ GD GLH %HJULIIH ZHLWH XQG "lokale Resektion" bisher nicht standardisiert verwendet werden. Viele auswŠrtige .OLQLNHQ EHQXW]WHQ GLH JOHLFKH FKLUXUJLVFKH 'HILQLWLRQ IU XQWHUVFKLHGOLFKH 5HVHNWLRQV ergebnisse. Bei angeblich "weiten Resektionen" fehlte oft die Angabe des Sicherheitsabstandes. Da die meisten Patienten zuvor auswŠrts operiert worden waren, konnte der ResektionsPRGXV KLHU DOVR QLFKW DOV SURJQRVWLVFKHU )DNWRU IU HLQH VSlWHUH Rezidiventstehung dienen. Anhand solcher Ergebnisse wird deutlich, wie wichtig einheitlich verwendete Definitionen von ResektionsrŠndern und Resektionsarten sind. Da aber Weichteilsarkome unter allen Tumorarten insgesamt sehr selten vorkommen, ist es sicher nicht einfach, diese Forderung in die Praxis umzusetzen und hier einheitliche Bedingungen zu schaffen. Der Resektionsabstand ist der am genauesten untersuchte Parameter dieser Studie. 7URW]GHP VLQG GLH (UJHEQLVVH KLHU QLFKW ]XIULHGHQVWHOOHQG GD NHLQH $XVVDJH GDUEHU getroffen werden kann, welcher Sicherheitsabstand in cm mit hoher Wahrscheinlichkeit ein Rezidiv verhindert. In der Literatur wird ein Sicherheitsabstand von entweder 2-3 cm umliegenden Fett- oder Bindegewebes oder nur Fasziengewebe in allen Ebenen als adŠquater Resektionsrand angesehen. Bei den meisten Patienten mit Rezidiv dieser Studie allerdings betrug der Sicherheitsabstand der vorherigen Resektion £ FP RKQH GD KLHU jedesmal eine fasziale Begrenzung vorlag. Diese Tatsache erklŠrt in den meisten FŠllen die Rezidiventstehung. Bei den Patienten mit Pseudorezidiv dagegen waren die ResektionsrŠnder als noch knapper, oft als von Tumorgewebe infiltriert beschrieben worden. Bei nicht einmal der HŠlfte dieser Patienten lagen eindeutige R0-Resektionen vor. Bei 1/3 der Patienten lagen nur fragliche R0-Resektionen vor. Bei den restlichen Patienten waren sogar R1- und R25HVHNWLRQHQEHVFKULHEHQZRUGHQ±LQGHQPHLVWHQ)lOOHQRKQHSRVWRSHUDWLYH6WUDKOHQRGHU Chemotherapie. Hier bleibt wirklich unklar, warum die Nachresektate kein Tumorgewebe mehr enthielten. Mšglicherweise fand bei einigen Resektaten eine postoperative Gewebsfragmentierung statt, nach der die tatsŠchlichen PrŠparategrenzen nicht mehr nachvoll82 Diskussion zogen werden konnten und somit infiltrierte ResektionsrŠnder vorgetŠuscht wurden? Vielleicht ist bei diesen Patienten aber in Zukunft mit einer Rezidivbildung zu rechnen, die ]XGHPMHW]LJHQ=HLWSXQNWPLNURVNRSLVFKQLFKWIDEDULVW =XVDPPHQIDVVHQGNDQQJHVDJWZHUGHQGDIROJHQGHSURJQRVWLVFKH3DUDPHWHUHKHUDXIHLQ Pseudorezidiv als auf ein Rezidiv hinweisen: Ersterkrankungsalter £-DKUHQHLQHIUKH PrimŠrdiagnose nach Symptombeginn (5,6 Monate), keine PE vor PrimŠrresektion, noch kein Rezidiv in Vergangenheit, kurzer Abstand zur vorherigen Operation, PrimŠrtumorLQILOWUDWLRQQXUREHUIOlFKOLFKHU6WUXNWXUHQXQG±QXUYRQ%HGHXWXQJIUGDV%HUJPDQQVKHLO ±YRUKHULJH2SHUDWLRQLQDXVZlUWLJHU.OLQLN 5.2 Bildgebende und andere Diagnostik 5.2.1 MRT In der postoperativen Verlaufskontrolle bzw. der Unterscheidung zwischen Rezidiv oder Pseudorezidiv wurde die MRT in mehreren Studien favorisiert [16, 20, 56]. Auch in dieser Studie wurde die MRT wesentlich hŠufiger als die anderen bildgebenden Verfahren angewendet. Die SensitivitŠt betrug 74,5 % und die SpezifitŠt nur 35,7 %. Diese zunŠchst recht unbefriedigend erscheinenden Ergebnisse lassen sich hauptsŠchlich darauf ]XUFNIKUHQ GD VROFKH %HIXQGH PLW XQVLFKHUHP (UJHEQLV ]ZDU ULFKWXQJZHLVHQGHU Befund, aber eben keine eindeutige Entscheidung) nicht in die Berechnung der ValiditŠt PLW HLQIOLHHQ NRQQWHQ 9RQ GLHVHQ XQVLFKHUHQ 8QWHUVXFKXQJVEHIXQGHQ ZLHGHUXP waren bis auf zwei Ausnahmen alle innerhalb weniger Wochen (durchschnittlich 3,6 Wochen ohne $XVUHLHUZHUWH SRVWRSHUDWLY DQJHIHUWLJW ZRUGHQ $OOH MRT-Aufnahmen, die spŠter (mehrere Monate) postoperativ erfolgt waren, hatten eindeutigere Befunde ergeben. Bei nur 5 von 14 Patienten mit Pseudorezidiv kam es durch die MRT zu richtig negativen Ergebnissen (weitere 5 unsichere, 4 falsch positive). Unter den 5 unsicheren Ergebnissen deuteten aber vier Befunde eher auf ein Pseudorezidiv als ein Tumorrezidiv hin, das aber wegen diverser postoperativer VerŠnderungen letztlich nicht ausgeschlossen werden NRQQWH :UGHQ GLHVH YLHU )lOOH ]X GHQ ULFKWLJ QHJDWLYHQ 'LDJQRVHQ JH]lKOW OlJH GLH SpezifitŠt bei 64 %. Hinsichtlich der Erkennung von Tumorrezidiven als auch Residualtumoren betrug die gemeinsame SensitivitŠt fast 75 %; bei den Residualtumoren alleine allerdings nur 65 %. 'LHVH'LVNUHSDQ]LVWZDKUVFKHLQOLFKGXUFKGHQEHL3DWLHQWHQPLW 5HVLGXDOWXPRU NU]HUHQ postoperativen Untersuchungsabstand (im Mittel 1,9 Monate) zu erklŠren. Obwohl die 'LDJQRVH5HVWWXPRUDXFKIUGHQ5DGLRORJHQGHILQLWLRQVJHPlHLJHQWOLFKVFKRQYRUKHU feststand, konnte dieser sie nur anhand der Bilder aber nicht immer bestŠtigen. Hier 83 Diskussion standen oft postoperative GewebsverŠnderungen im Vordergrund und maskierten das Wundbett. Da die Residualtumoren in dieser Gruppe ein Drittel aller Resektate mit 7XPRUQDFKZHLVDXVPDFKWHQZXUGHGLH*HVDPWVHQVLWLYLWlWGDGXUFKQHJDWLYEHHLQIOXW %HWUDFKWHW PDQ VFKOLHOLFK QXU VROFKH 3DWLHQWHQ PLW 5H]LGLYWXPRU ULFKWLJ SRVLWLYH Diagnose hier im Mittel nach 11 Monaten), so steigt die SensitivitŠt auf 79 %, da die MRT-Bilder meist erst spŠter (durchschnittlich 8 Monate) postoperativ angefertigt wurden XQG IROJOLFK VHOWHQHU YRQ IUKHQ SRVWRSHUDWLYHQ 9HUlQGHUXQJHQ EHUlagert waren. Betrachtet man die Vorhersehbarkeit der MRT, so schneidet hier die positive PrŠdiktion mit 90,5 DOVR GLH :DKUVFKHLQOLFKNHLW PLW GHU HLQ PXWPDOLFK GLDJQRVWL]LHUWHV 5H]LGLY WDWVlFKOLFKHLQVLVWJXWDEXQGNDQQIUGHQ.OLQLNHUDOVDXVUHLFKHQGH2SHUDWLRQVLQGLNDWLRQ gesehen werden. Das Umgekehrte gilt leider nicht bei negativen Diagnosen, die sich entsprechend der negativen PrŠdiktion nur in 50 % der FŠlle bewahrheiten. Andere Studien, die den Nutzen der MRT in der Entscheidung zwischen postoperativen VerŠnderungen und Lokalrezidiv untersuchten [4, 7, 16, 20, 38, 55, 56], fanden z. B. eine 83 %ige SensitivitŠt bzw. 93 %ige SpezifitŠt [7] oder eine 83 %ige SensitivitŠt bzw. 85 %ige SpezifitŠt [38]. 'D GLH 057 LQ GLHVHU 6WXGLH VFKOHFKWHU DEVFKQLWW DOV GLH &7 ODJ KDXSWVlFKOLFK DQ GHQ hŠufigen unsicheren Testergebnissen bei der MRT, die in die Berechnungen nicht mit HLQJLQJHQ =X GLHVHP JU|HUHQ 8QVLFKHUKHLWVIDNWRU IKUWH X a. sicherlich der im Mittel NU]HUHSRVWRSHUDWLYH8QWHUVXFKXQJVDEVWDQG0RQDWHEHLGHU057LP*HJHQVDW]]XU CT (8,1 Monate). 5.2.2 Andere Diagnostik Die CT schnitt mit einer fast 87 %igen SensitivitŠt im Vergleich am besten von allen 8QWHUVXFKXQJVPHWKRGHQDE%HUFNVLFKWLJWZHUGHQPXKLHUDEHUGDVPLWQXU%HIXQGHQ VHKU NOHLQH 3DWLHQWHQNROOHNWLY $XHUGHP JDE HV LQ GLHVHU *UXSSH QXU ]ZHL XQVLFKHUH Testergebnisse. Dies ist hšchstwahrscheinlich durch den insgesamt lŠngeren postoperativen Untersuchungsabstand, u. a. bedingt durch die geringe Anzahl an ResidualWXPRUHQ LQ GLHVHU *UXSSH QXU GHU 5HVHNWDWH PLW 7XPRU ]X HUNOlUHQ VR GD GLH ValiditŠt im Gegensatz zur MRT nicht sehr beeintrŠchtigt wurde. Da insgesamt nur 6 Patienten mit Pseudorezidiv mittels CT untersucht wurden, ist die SpezifitŠt nicht zu verwerten. 'LH6RQRJUDILHZXUGHYRQ DOOHQ8QWHUVXFKXQJHQDPVSlWHVWHQSRVWRSHUDWLYGXUFKJHIKUW Das kann durch die geringe Anzahl an Befunden oder rein zufŠllig bedingt sein. Es liegt DEHU YHUPXWOLFK DP HKHVWHQ GDUDQ GD GHU 8OWUDVFKDOO LQ GHU 'LDJQRVWLN GHU 6DUNRP UH]LGLYH YRU DOOHP LQ GHU IUKHQ SRVWRSHUDWLYHQ 3KDVH ]XJXQVWHQ YRQ &7 XQG 057 seltener angewendet wird, aufgrund seiner ungenaueren Auflšsung. Die Berechnungen in dieser Studie ergaben eine 72 %LJH6HQVLWLYLWlWIUGLH6RQRJUDILHEHUGLH6SH]LILWlWNDQQ 84 Diskussion kaum eine Aussage getroffen werden, da insgesamt nur drei Ultraschallbefunde von tumorfreien Resektaten vorlagen. Eine andere Studie fand dagegen eine 100 %ige SensitivitŠt bzw. 79 %LJH6SH]LILWlWIUGLH6RQRJUDILH>@ Die Bedeutung der kšrperlichen Untersuchung darf nicht zu hoch bemessen werden, da sie ja nur dann richtig positive Ergebnisse liefern kann, wenn der Tumor entweder recht REHUIOlFKOLFK OLHJW RGHU DEHU EHUHLWV HLQH JHZLVVH *U|H HUUHLFKW KDW $QGHUHUVHLWV PX VHOEVW QLFKW PDOLJQHV HQW]QGOLFK YHUlQGHUWHV *HZHEH LQ LUJHQGHLQHU $UW IU GHQ Untersucher durch eine Schwellung (…dem, Narbe) palpabel sein. Ist gar nichts zu sehen oder zu tasten, kann immer nur eine negative Diagnose gestellt werden. So erklŠrt sich ZDKUVFKHLQOLFK DXFK GLH QLHGULJH QHJDWLYH 3UlGLNWLRQ (LQ ZHLWHUHV 3UREOHP ZDU GD GLH MRT- oder &7'LDJQRVWLN RIW EHUHLWV YRUODJ XQG VRPLW VLFKHU (LQIOX QDKP DXI GDV Ergebnis der kšrperlichen Untersuchung. Eine unabhŠngige Beurteilung war also oft nicht gesichert. So ist dann auch die recht hohe SensitivitŠt eher kritisch zu bewerten. Aus GLHVHP *UXQGH OLHJHQ ZDKUVFKHLQOLFK DXFK LQ GHU /LWHUDWXU NHLQH 6WXGLHQ EHU GLH kšrperliche Untersuchung zur Differenzierung zwischen Rezidiv und Narbengewebe vor. In einer anderen Prospektivstudie von Kostakoglu et al. wurde die Thallium-201Szintigrafie mit der MRT und anderen bildgebenden Verfahren hinsichtlich der Differenzierung zwischen Tumorrezidiv oder -UHVLGXXPXQGSRVWRSHUDWLYHQHQW]QGOLFKHQ VerŠnderungen verglichen [27]. Insgesamt waren 21 Patienten untersucht worden. Die Ergebnisse zeigten eine 100 %ige SensitivitŠt und 87,5 %LJH 6SH]LILWlW IU GLH Thallium Szintigrafie verglichen mit einer nur 95 %igen SensitivitŠt bzw. 50 %igen SpeziILWlWIUGLH MRT. 5.2.3 6FKOXIROJHUXQJ *UXQGVlW]OLFK PX DQJHPHUNW ZHUGHQ GD 6HQVLWLYLWlW XQG 6SH]LILWlW VlPWOLFKHU Untersuchungsergebnisse kritisch zu bewerten sind. Zum einen kann nicht davon DXVJHJDQJHQ ZHUGHQ GD GLH %HIXQGH HLQHU $NWH LPPHU YROOVWlQGLJ ZDUHQ ZDKUVFKHLQ lich ist mehr Diagnostik betrieben, aber nicht dokumentiert worden. Zum anderen liegt den Befunden kein Standardisierungsschema zugrunde, da sie aus unterschiedlichen Kliniken stammen. Auch die Untersuchungszeitpunkte waren stets unterschiedlich und hatten doch JURHQ(LQIOXDXIGLH5LFKWLJNHLWGHU7HVWHUJHEQLVVH%HLHLQLJHQ$XVZHUWXQJHQZDUGDV zugrunde liegende Kollektiv auch einfach nicht ausreichend (z. B. nur drei Sonografiebefunde bei den Resektaten ohne Tumornachweis); dann konnten die Ergebnisse kaum bewertet werden. ,QVJHVDPW NDQQ DEHU JHIROJHUW ZHUGHQ GD GHU SRVWRSHUDWLYH 8QWHUVXFKXQJV]HLWSXQNW DXHURUGHQWOLFKZLFKWLJLVWIUGLH'LIIHUHQ]LHUXQJ]ZLVFKHQ5H]LGLYXQGQLFKWPDOLJQHP HQW]QGOLFK YHUlQGHUWHP *HZHEH 6R EHWUXJ EHL GHQ 3DWLHQWHQ PLW 5H]LGLY GHU 85 Diskussion postoperative Zeitraum, in dem die MRT negative oder unsichere Befunde lieferte, im Mittel bis zu 5,7 Monate. Erst nach durchschnittlich 11 Monaten wurden die Rezidive durch die MRT erkannt; mit der CT entsprechend erst nach etwa 13 Monaten und mit der 6RQRJUDILHVRJDUHUVWQDFK0RQDWHQXQWHU%HUFNVLFKWLJXQJGHUIU&7XQG6RQRJUDILH kleineren Patientenkollektive). Bei den Patienten mit Pseudorezidiv hingegen lieferte die MRT (unter Beachtung des hier nur kleinen Patientenkollektivs) bis durchschnittlich 3,6 Wochen postoperativ falsch positive oder unsichere Befunde, wahrscheinlich durch postoperative VerŠnderungen bedingt. Allerdings waren im Durchschnitt auch erst nach 7 Monaten die Befunde richtig negativ. Mit den anderen Diagnostiken wurden zu wenig Patienten mit Pseudorezidiv untersucht, um einen Vergleich anstellen zu kšnnen. %HLGHU%HXUWHLOXQJGHU9DOLGLWlWILHODXIGDGLH6HQVLWLYLWlWJUXQGVlW]OLFKK|KHU DOV GLH SpezifitŠt war; es wurden also šfter falsch positive als falsch negative Diagnosen gestellt. Bei der Betrachtung der SensitivitŠt nur IUGLH5H]LGLYHNHLQH)lOOHPLW5HVLGXDOWXPRU HUJDEHQVLFKEHLGHQGUHLELOGJHEHQGHQ'LDJQRVWLNHQJDUNHLQHVRJURHQ8QWHUVFKLHGHIU MRT und Sonografie je 79 %, CT 83 %). Da es unter den MRT-Befunden, bedingt durch viele kurze postoperative UntersuchungsabstŠnde, hŠufiger unsichere Testergebnisse gab, LVW NODU GD GLHVH GLH 6HQVLWLYLWlW XQJQVWLJ EHHLQIOXWHQ 'HVKDOE PX GLH 057 WURW] dieser Ergebnisse als bevorzugtes Verfahren zur Differenzierung zwischen Tumorgewebe XQG QDUELJ HQW]QGOLFK YHUlQGHUWHP *HZHEH LP 9HUJOHLFK ]XU &7 XQG 6RQRJUDILH angesehen werden. Weiterhin empfiehlt es sich nach den hier vorliegenden Ergebnissen innerhalb eines postoperativen Zeitraums von mindestens 3,6 Wochen, keine MRTUntersuchung vorzunehmen, um Verwechslungen mit postoperativ verŠndertem Gewebe zu vermeiden. 86 Zusammenfassung 6 Zusammenfassung %HL =ZHLWHLQJULIIHQ RSHULHUWHU 6DUNRPH ILQGHW VLFK QHEHQ ÄHFKWHQ³ 7XPRUUH]LGLYHQ vielfach auch nicht malignes, postoperativ verŠndertes Gewebe im Sinne eines Pseudorezidivs. Ziel dieser Studie war die Ermittlung verschiedener Parameter, welche bereits prŠoperativ auf die richtige Differentialdiagnose (Rezidiv oder Pseudorezidiv) hindeuten. Dazu wurden die PrŠparate von insgesamt 83 wegen Verdacht auf ein Sarkomrezidiv in der UniversitŠtsklinik Bergmannsheil operierter Patienten histopathologisch aufgearbeitet und entweder als Residualtumor (24 Befunde), Rezidiv (29 Befunde) oder Pseudorezidiv (30 Befunde) klassifiziert. Innerhalb der letzten beiden Gruppen wurden jeweils zwei weitere Gruppen unterschieden: Patienten mit (1+n)-ter Nachresektion und Patienten, bei denen es sich um die erste Nachresektion handelte. So konnten einerseits YHUIlOVFKHQGH (LQIOVVH GXUFK IUKHUH 2SHUDWLRQHQ DXVJHVFKORVVHQ ZHUGHQ DQGHUHUVHLWV aber verringerte sich dadurch die Anzahl der zugrunde liegenden Befunde. Im ersten Teil der Studie wurden 17 verschiedene Kriterien (sowohl patientenabhŠngige, tumorabhŠngige als auch therapieabhŠngige) ermittelt und jeweils mit den Patientengruppen mit und ohne Tumorrezidiv korreliert. Da es sich parameterabhŠngig z.T. um sehr kleine Patientenkollektive handelte, wurde auf eine Berechnung von Signifikanzen insgesamt verzichtet, und es wurden lediglich die verschiedenen HŠufigkeiten bzw. Mittelwerte in den jeweiligen Patientengruppen dargestellt. Im zweiten Teil wurden verschiedene Untersuchungsmethoden auf ihre Korrektheit hin EHUSUIW(VZXUGHQVRZRKO6HQVLWLYLWlW6SH]LILWlWSRVLWLYHXQGQHJDWLYH3UlGLNWLRQYRQ SUlRSHUDWLY GXUFKJHIKUWHQ 8QWHUVXFKXQJHQ CT-Befunde, 22 Sonografie-, 80 MRTund 54 kšrperliche Untersuchungen) ermittelt als auch die AbhŠngigkeit der Diagnose vom ]HLWOLFKHQ$EVWDQG]XUMHZHLOV YRUKHULJHQ 2SHUDWLRQ EHUSUIW $XFK hier ging es um die Frage, ob anhand der retrospektiv erhobenen Testergebnisse bereits prŠoperativ eine Differenzierung zwischen Rezidiv und Pseudorezidiv mšglich ist. Folgende Ergebnisse konnten erzielt werden: 1. Die in der Fragestellung besonders hervorgehobene Ermittlung des Resektionsabstandes im Rahmen der vorherigen Operation lieferte vor allem hinsichtlich der Patienten mit Pseudorezidiv keine befriedigenden Ergebnisse, da die SicherheitsabstŠnde stets weniger als 2 cm betragen hatten, einer "weiten Resektion" also nicht HQWVSUDFKHQ 9RQ GHQ EULJHQ SURJQRVWLVFKHQ 3DUDPHWHUQ NRQQWHQ VHFKV ]XU .OlUXQJ der Fragestellung beitragen, da sie deutliche Unterschiede in den beiden Patientengruppen aufwiesen: (1) Junges Alter bei PrimŠrdiagnose: Patienten mit Pseudorezidiv 41 Jahre, - mit Rezidiv 49,4, Patienten insgesamt 48,3. (2) kurzer Zeitraum zwischen Beginn erster Symptome und PrimŠrdiagnose: Patienten mit Pseudorezidiv 5,6 Monate, - mit Rezidiv 14,4, - insgesamt 8,7. (3) Noch kein Rezidiv in Vergangenheit: zutreffend 87 Zusammenfassung auf 80 % der Patienten mit Pseudorezidiv, nur auf 20,6 % mit Rezidiv, auf 59 % insgesamt. (4) kurzer Abstand zur vorherigen Operation: Patienten mit Pseudorezidiv 0RQDWH PLW 5H]LGLY LQVJHVDPW $XVVFKOLHOLFK REHUflŠchliche Tumorinfiltration: Patienten mit Pseudorezidiv 43,8 %, - mit Rezidiv 0 %, - insgesamt 22,4 %. (6) vorherige Operation in auswŠrtiger Klinik: Patienten mit Pseudorezidiv 86,6 %, - mit Rezidiv 51,7 %, - insgesamt 69,6 %. Diese retrospektiv erhobenen Kriterien kšnnten eine Hilfestellung geben, bereits prŠoperativ Patienten ohne vitale Tumoranteile zu erkennen und deshalb nicht zu operieren bzw. hier eine abwartende +DOWXQJ PLW HQJPDVFKLJHQ .RQWUROOHQ ]X WROHULHUHQ 'LHV ZUGH NODVVLVFKHUZHLVH DXI Patienten mit folgender Konstellation zutreffen: Alter bei PrimŠrdiagnose £ 41 Jahre, PrimŠrdiagnose spŠtestens 5,6 Monate nach dem Auftreten erster Symptome, Zeitraum VHLWYRUKHULJHU2SHUDWLRQK|FKVWHQV0RQDWHDXVVFKOLHOLFKREHUIOlFKOLFKH7XPRU LQILOWUDWLRQQRFKNHLQ5H]LGLYLQ9HUJDQJHQKHLWXQGQXUYRQ%HGHXWXQJIUGDV%+/ - primŠre Resektion in auswŠrtiger Klinik. 2. /HW]WHQGOLFK N|QQHQ QXU GLH (UJHEQLVVH GHU 057 YHUOlOLFK EHZHUWHW ZHUGHQ hauptsŠchlich aufgrund der zu geringen Patientenanzahl, die mit den anderen 0HWKRGHQXQWHUVXFKWZXUGH'DYLHOH057VHKUIUKSRVWRSHUDWLYDQJHIHUWLJWZRUGHQ waren, gab es hier hŠufig unsichere Befunde, die weder einem positiven noch QHJDWLYHQ 7HVWHUJHEQLV ]XJHRUGQHW ZHUGHQ NRQQWHQ XQG GLH 9DOLGLWlW XQJQVWLJ EHHLQIOXWHQ6RVFKQLWWGLH9DOLGLWlWLP9HUJOHLFKPLWDQGHUHQ6WXGLHQHKHUPlLJDE (SensitivitŠt 74,5 %, SpezifitŠt 35,7 %, positive PrŠdiktion 90,5 %, negative PrŠdiktion 50 GDIUDEHUZDUGHU(LQIOXGHVSRVWRSHUDWLYHQ8QWHUsuchungsabstandes auf die korrekte Diagnose deutlich zu erkennen: Richtig positive Testergebnisse wurden im Mittel erst nach 11 Monaten erhoben, falsch negative nach 5,7 Monaten, richtig negative erst nach 7 Monaten, unsichere oder falsch positive Testergebnisse im Mittel :RFKHQ 6SDQQZHLWH :RFKHQ SRVWRSHUDWLY 'LHVH :HUWH ]HLJHQ GD SRVWRSHUDWLY HLQ 0LQGHVW]HLWUDXP YRQ HWZD 0RQDW ELV ]XU YHUOlOLFKHQ 05 Diagnostik verstreichen sollte, wenn es um die Differentialdiagnose des Tumorrezidivs geht. Operativ bedingte GewebsverŠnderungen wie HŠmatome, Granulationen oder )LEURVLHUXQJHQ EHUODJHUQ RIIHQEDU ELV GDKLQ GDV :XQGJHELHW XQG N|QQHQ DOV unsichere oder falsch positive Befunde interpretiert werden. Andererseits scheinen Tumorrezidive bis zur MR-Nachweisgrenze durchschnittlich 11 Monate zu benštigen. Beide Kernfragen der Studie konnten erfolgreich beantwortet werden. Zum einen wurden VHFKV SURJQRVWLVFKH 3DUDPHWHU HUDUEHLWHW GLH IU 7XPRUIUHLKHLW XQG JHJHQ HLQ HUQHXWHV 5H]LGLY VSUHFKHQ =XP DQGHUHQ NDQQ IU GLH 057 HLQH (PSIHKOXQJ ]XP SRVWRSHUDWLYHQ 8QWHUVXFKXQJV]HLWSXQNW EH]JOLFK GHU 'LIIHUHQ]LHUXQJ ]ZLVFKHQ 5H]LGLY RGHU 3VHXGR rezidiv getroffen werden. 88 Literatur 7 [1] Literatur Akpinar Basdemir, G., Sabah, D., Arkun, R., et al. Reactive zone, does it exist? In: Brennan, M. F., Hilaris, B., Shiu, M. H., Lane, J., Magill, G., Friedrich, C., Hajdu, S. I. (1987). Local recurrence in adult soft-tissue sarcoma. A randomized trial of brachytherapy. Arch. Surg. 122(11), 1289-93 [2] Alvegard, T. (1996). Soft tissue sarcomas. Acta Oncol. (Suppl. 35) 7, 117-22 [3] Berlin, O., Stener, B., Angervall, L., Kindblom, L. G., Markhede, G., Oden, A. (1990). Surgery for soft tissue sarcoma in the extremities. A multivariate analysis of the 6-26-year prognosis in 137 patients. Acta Orthop. Scand. 61(6), 475-86 [4] Biondetti, P. R., Ehman, R. L. (1992). Soft-tissue sarcomas: use of textural patterns in skeletal muscle as a diagnostic feature in postoperative MR imaging. Radiology 183(3), 845-8 [5] Brennan, M. F. (1997). The Enigma of Local Recurrence. Ann. Surg. Oncol. 4(1), 1-12 [6] Brennan, M. F., Hilaris, B., Shiu, M. H., Lane, J., Magill, G., Friedrich, C., Hajdu, S. I. (1987). Local recurrence in adult soft-tissue sarcoma. A randomized trial of brachytherapy. Arch. Surg. 122(11), 1289-93 [7] Choi, H., Varma, D. G. K., Fornage, B. D., Kim, E. E., Johnston, D. A. (1991). Soft-tissue sarcoma: MR imaging vs sonography for detection of local recurrence after surgery. Am. J. Roentgenol. 157(2), 353-8 [8] Dirix, L. Y., Somville, J., Van Oosterom, A. T. (1996). Diagnosis and treatment of soft tissue sarcomas in adults. Curr. Opinion Oncol. 8, 289-98 [9] Enneking, W. F. (1983). Musculoskeletal Tumor Surgery. In: Rydholm, A. (1997). Surgical margins for soft tissue sarcoma. Acta Orthop. Scand. (Suppl. 273) 68, 81-5 [10] Enneking, W. F., Spanier, S. S., Malawer, M. M. (1981). The effect of the anatomic setting on the results of surgical procedures for soft parts sarcoma of the thigh. Cancer 47(5), 1005-22 [11] Fischer, A., Ludemann, M., Schulte-Monting, J., Finke, J., Imdahl, A., Farthmann, E. H. (1997). Therapieergebnisse von Patienten mit Weichteilsarkom: Retrospektive Analyse zur Identifizierung unabhŠngiger Prognosefaktoren. Zentralbl. Chir. 122(10), 901-8 89 Literatur [12] Fletcher, C. D. (1992). Pleomorphic malignant fibrous histiocytoma: fact or fiction? A critical reappraisal based on 159 tumors diagnosed as pleomorphic sarcoma. Am. J. Surg. Pathol. 16(3), 213-28 [13] Fletcher, C. D. M., Unni, K. K., Mertens, F. (ed.) (2002). World Health Organisation classification of tumours. Pathology and genetics of tumours of soft tissue and bone. IARC Press: Lyon [14] Goodlad, J. R., Fletcher, C. D. M. (1995). Recent developments in soft tissue tumours. Histopathology 27, 103-20 [15] Goodlad, J. R., Fletcher, C. D. M., Smith, M. A. (1996). Surgical resection of primary soft-tissue sarcoma. Incidence of residual tumour in 95 patients needing reexcision after local resection. J. Bone Joint Surg. [Br.] 78-B, 658-61 [16] Griffiths, H. J., Thompson, R. C., Nitke, S. J., Olson, P. N., Thielen, K. R., Amundson, P. (1997). Use of MRI in Evaluating Postoperative Changes in Patients With Bone and Soft Tissue Tumors. Orthopedics 20(3), 215-20 [17] Gustafson, P. (1994). Soft tissue sarcoma. Epidemiology and prognosis in 508 patients. Acta Orthop. Scand. (Suppl. 259) 65, 2-31 [18] Gustafson, P., Dreinhšfer, K. E., Rydholm, A. (1993). Metastasis-free survival after local-recurrence in soft tissue sarcoma. J. Bone Joint Surg. [Br.] 75, 658-60 [19] Gustafson, P., Rššser, B., Rydholm, A. (1991). Is local recurrence of minor importance for metastases in soft tissue sarcoma? Cancer 67, 2083-6 [20] Hanna, S. L., Fletcher, B. D. (1995). MR Imaging of Malignant Soft-Tissue Tumors. MRI Clinics of North America 3(4), 629-50 [21] Herbert, S. H., Corn, B. W., Solin, L. J., Lanciano, R. M., Schultz, D. J., Mc Kenna W. G., Coia, L. R. (1993). Limb-preserving treatment for soft tissue sarcomas of the extremities. The significance of surgical margins. Cancer 15: 72(4), 1230-8 [22] Hermanek, P., Hutter, R. V. P., Sobin, L. H., Wagner, G., Wittekind, C. (1997). TNM-Atlas. Springer Verlag. Berlin, Heidelberg, New York [23] Hohenberger, P., Mendrik, H., Schmidt-Peter, P., Schlag, P. M. (1996). Rechtfertigen sich erweiterte Tumorresektion und Rekonstruktion beim Weichgewebesarkom aus Rezidivrate und †berlebenszeit? Langenbecks Arch. Chir. (Suppl. Kongressbd.) 113, 229-31 [24] Katenkamp, D. (2000). Maligne Weichgewebstumoren: Betrachtungen zum diagnostischen Beitrag der Pathologie. Deutsches €rzteblatt 8, A-452 90 Literatur [25] Katenkamp, D. (1998). Morphologie und Molekularbiologie maligner Weichgewebstumoren. Schweiz. Rundsch. Med. Prax. 87(34), 1043-9 [26] Kempson, R. L. (1996). Soft Tissue. Pathology 3(2), 545-53 [27] Kostakoglu, L., Panicek, D. M., Divgi, C. R., Botet, J., Healey, J., Larson, S. M., Abdel-Dayem, H. M. (1995). Correlation of the findings of thallium-201 chloride scans with those of other imaging modalities and histology following therapy in patients with bone and soft tissue sarcomas. Eur. J. Nucl. Med. 22(11), 1232-37 [28] Kransdorf, M. J. (1995). Malignant Soft-Tissue Tumors in a Large Referral Population: Distribution of Diagnoses by Age, Sex, and Location. AJR. 164, 12934 [29] Leibel, S. A., Tranbaugh, R. F., Wara, W. M., Beckstead, J. H., Bovill, E. G., Phillips, T. L. (1982). Soft tissue sarcomas of the extremities: survival and patterns of failure with conservative surgery and postoperative irradiation compared to surgery alone. Cancer 50(6), 1076-83 [30] Lindberg, R. D., Martin, R. G., Romsdahl, M. M., Barkley, H. T. Jr. (1981). Conservative surgery and postoperative radiotherapy in 300 adults with soft-tissue sarcomas. Cancer 47(10), 2391-7 [31] Maas, R. (1992). Radiologische Diagnostik der Rezidive von Weichteilsarkomen. Radiologe 32(12), 597-605 [32] Meister, P. (1996). Malignant fibrous histiocytoma: histomorphological pattern or tumor type. Pathol. Res. Pract. 192(8), 877-81 [33] Mertens, F., Fletcher, C. D., Dal Cin, P., De Wever, I., Mandahl, N., Mitelman, F., Rosai, J., Rydholm, A., Sciot, R., Tallini, G., Van den Berghe, H., Vanni, R., Willen, H. (1998). Cytogenetic analysis of 46 pleomorphic soft tissue sarcomas and correlation with morphologic and clinical features: a report of the CHAMP Study Group. Chromosomes and Morphology. Genes Chromosomes Cancer 22(1), 16-25 [34] Peiper, M., Zurakowski, D., Zornig, C. (1995). Lokalrezidive von Weichteilsarkomen an ExtremitŠten und Rumpf. Langenbecks Arch. Chir. 380, 333-39 [35] Pisters, P. W., Leung, D. H., Woodruff, J., Shi, W., Brennan, M. F. (1996). Analysis of prognostic factors in 1,041 patients with localized soft tissue sarcomas of the extremities. J. Clin. Oncol. 14(5), 1679-89 [36] Pollock, R. E., Karnell, L. H., Menck, H. R., Winchester, D. P. (1996). The National Cancer Data Base report on soft tissue sarcoma. Cancer 78 (10), 2247-57 91 Literatur [37] Potter, D. A., Glenn, J., Kinsella, T., Glatstein, E., Lack, E. E., Restrepo, C., White, D. E., Seipp, C. A., Wesley, R., Rosenberg, S. A. (1985). Patterns of recurrence in patients with high-grade soft-tissue sarcomas. J. Clin. Oncol. 3(3), 353-66 [38] Reuther, G., Mutschler, W. (1990). Detection of local recurrent disease in musculoskeletal tumors: magnetic resonance imaging versus computed tomography. Skeletal Radiol. 19(2), 85-90 [39] Rohrborn, A., Roher, H. D. (1998). Chirurgisch-onkologische Aspekte der Sarkomtherapie. Schweiz. Rundsch. Med. Prax. 87(34), 1050-60 [40] Rosenberg, S. A., Tepper, J., Glatstein, E., Costa, J., Baker, A., Brennan, M., Demoss, E. V., Seipp, C., Sindelar, W. F., Sugarbaker, P., Wesley, R. (1982). The treatment of soft-tissue sarcomas of the extremities: prospective randomized evaluations of (1) limb-sparing surgery plus radiation therapy compared with amputation and (2) the role of adjuvant chemotherapy. Ann. Surg. 196(3), 305-15 [41] Rydholm, A. (1997). Centralization of soft tissue sarcoma. The southern Sweden experience. Acta Orthop. Scand. (Suppl. 273) 68, 4-8 [42] Rydholm, A. (1997). Prognostic factors in soft tissue sarcoma. Acta Orthop. Scand. (Suppl. 273) 68, 148-55 [43] Rydholm, A. (1997). Surgery without radiotherapy in soft tissue sarcoma. Acta Orthop. Scand. (Suppl. 273) 68, 117-19 [44] Rydholm, A. (1997). Surgical margins for soft tissue sarcoma. Acta Orthop. Scand. (Suppl. 273) 68, 81-5 [45] Rydholm, A., Gustafson, P., Rooser, B., Willen, H., Akerman, M., Herrlin, K., Alvegard, T. (1991). Limb-sparing surgery without radiotherapy based on anatomic location of soft tissue sarcoma. J. Clin. Oncol. 9(10), 1757-65 [46] Schlag, P. M., Hohenberger, P. (1998). Determinants for operative and multimodal treatment of malignant soft tissue tumors. Verh. Dtsch. Ges. Pathol. 82, 64-6 [47] Schmidt, D. (1992). Pathologie der Weichteilsarkome. Radiologe 32(12), 579-83 [48] Schneider, P., Busch, U., Meister, H., Qasem, Q., Wunsch, P. H. (1999). Malignant fibrous histiocytoma (MFH). A comparison of MFH in man and animals. A critical review. Histol. Histopathol. 14(3), 845-60 [49] Simon, M. A., Finn, H. A. (1993). Diagnostic Strategy for Bone and Soft-Tissue Tumors. J. Bone Joint Surg. [Am.] 75-A(4), 622-32 92 Literatur [50] Singer, S., Corson, J. M., Gonin, R., Labow, B., Eberlein, T. J. (1994). Prognostic Factors Predictive of Survival and Local Recurrence for Extremity Soft Tissue Sarcoma. Ann. Surg. 219(2), 165-73 [51] Spiro, I. J., Rosenberg, A. E., Springfield, D., Suit H. (1995). Combined surgery and radiation therapy for limb preservation in soft tissue sarcoma of the extremity: the Massachusetts General Hospital experience. Cancer Invest. 13(1), 86-95 [52] Steinau, H. U., Hebebrand, D., Torres, A., Vogt, P. (1998). Weichgewebssarkome: Resektionsprinzipien und Wiederherstellungschirurgie. Schweiz. Rundsch. Med. Prax. 87(34), 1061-5 [53] Stener, B., Surgical treatment of soft tissue tumors. (1979). In: Rydholm, A. (1997). Surgical margins for soft tissue sarcoma. Acta Orthop. Scand. (Suppl. 273) 68, 81-5 [54] Suit, H. D., Mankin, H. J., Wood, W. C., Proppe, K. H. (1985). Preoperative, intraoperative, and postoperative radiation in the treatment of primary soft tissue sarcoma. Cancer 55(11), 2659-67 [55] Vanel, D., Lacombe, M. J., Couanet, D., Kalifa, C., Spielmann, M., Genin, J. (1987). Musculoskeletal tumors: follow up with MR imaging after treatment with surgery and radiation therapy. Radiology 164(1), 243-5 [56] Varma, D. G. K., Jackson, E. F., Pollock, R. E., Benjamin, R. S. (1995). SoftTissue Sarcoma of the Extremities: MR Appearance of Post-Treatment Change and Local Recurrences. MRI Clinics of North America 3(4), 695-712 [57] Walter, T. A., Weh, H. J., Schlag, P. M., Zornig, C., Hossfeld, D. K. (1997). Cytogenetic studies in malignant fibrous histiocytoma. Cancer Genet. Cytogenet. 94(2), 131-4 [58] Weiss, S. W., Goldblum, J. R. (1995). Enzinger and :HLVV¶Vsoft tissue tumors. 4th ed. Mosby: St. Louis, USA [59] Wiklund, T. A., Alvegard, T. A., Mouridsen, H. T., Rydholm, A., Blomqvist, C. P. (1993). Marginal surgery and postoperative radiotherapy in soft tissue sarcomas. The Scandinavian Sarcoma Group experience. Eur. J. Cancer 29A(3), 306-9 93 Danksagung Danksagung Bedanken mšchte ich mich bei all denjenigen, die diese Dissertation ermšglicht und zu ihrem Gelingen beigetragen haben. 'HP 'LUHNWRU GHV ,QVWLWXWV IU 3DWKRORJLH +HUUQ 3URIHVVRU 'U .0 0OOHU IU GLH †berlassung des interessanten Themas und die kooperative Zusammenarbeit gilt mein besonderer Dank. Herrn Priv.-Doz. Dr. M. .ULVPDQQ GDQNH LFK IU GLH H[]HOOHQWH XQG YHUWUDXHQVYROOH Betreuung, sein stetiges Interesse an dieser Arbeit und die vielen Diskussionen und Anregungen. 5HFKWKHU]OLFKP|FKWHLFKPLFKEHLDOOHQPLWGHU:HLFKWHLOSDWKRORJLHEHIDWHQ0LWDUEHLWHU GHV ,QVWLWXWV IU GLH JXWH =XVDPPHQDUEHLW XQG GLH $QIHUWLJXQJ GHU GHWDLOOLHUWHQ %HIXQG berichte bedanken. +HUUQ 3URIHVVRU 'U + 8 6WHLQDX 'LUHNWRU GHU .OLQLN IU SODVWLVFKH &KLUXUJLH %HUJPDQQVKHLOLQ%RFKXPGDQNHLFKIUGLHIUHXQGOLFKH(LQVLFKWQDKPHLQGLH]DKOUHLFKHQ und ergiebigen Krankenakten. Frau Sabine 0HW]OHUGDQNHLFKIUGLHDXVIKUOLFKHQ.RUUHNWXUYRUVFKOlJH 0HLQHQ(OWHUQGDQNHLFKEHVRQGHUVIULKUHPRUDOLVFKH8QWHUVWW]XQJ $EVFKOLHHQG P|FKWH LFK PLFK JDQ] KHU]OLFK EHL PHLQHP )UHXQG 0LFKDHO IU GLH Vermittlung seiner Computerkenntnisse und seine stetige Motivation und Geduld bedanken. Lebenslauf Lebenslauf Persšnliche Daten Name Jutta Harten Geburt 02.05.1974 in Bremen Familienstand ledig Schulbildung 05.1993 Studium 10.1993 - 04.2000 09.1995 08.1996 Abitur in Bremen Humanmedizin an der Ruhr-UniversitŠt Bochum bU]WOLFKH9RUSUIXQJ (UVWHU$EVFKQLWWGHUlU]WOLFKHQ3UIXQJ 03.1999 =ZHLWHU$EVFKQLWWGHUlU]WOLFKHQ3UIXQJ 04.1999 - 03.2000 Praktisches Jahr am Ev. Krankenhaus Hattingen, Wahlfach: AnŠsthesie 04.2000 'ULWWHU$EVFKQLWWGHUlU]WOLFKHQ3UIXQJ Berufserfahrung Praktika 03.1993 - 05.1993 Schwesternhelferinnen-Lehrgang beim Roten Kreuz mit DQVFKOLHHQGHP3UDNWLNXPLP=HQWUDOkrankenhaus Bremen-Ost NebentŠtigkeiten 05.1996 - 12.1996 5HJHOPlLJH6WDWLRQVDXVKLOIHLP6WJosef-Hospital Bochum Famulaturen 03.1996 - 04.1996 Innere Medizin / Uniklinik St. Josef-Hospital Bochum 02.1997 - 03.1997 Pathologie / Uniklinik Bergmannsheil Bochum Lebenslauf 09.1997 - 10.1997 PŠdiatrie / Prof. Hess-Kinder-Klinik Bremen 03.1998 - 04.1998 Radiologie / Gemeinschaftspraxis Dres. med. Wahl Bremen Beruf ± AIP- und Assistentenstelle in der Neurologie / Klinikum seit 10.2003 0DVWHUVWXGLHQJDQJÄ%LRORJLHGHU=HOOHQ³VRZLH7lWLJNHLW ,EEHQEUHQ als wissenschaftliche Hilfskraft an der UniversitŠt 2VQDEUFN