INFEKTABWEHR UND IMPFUNG Vorlesung 6
Werbung
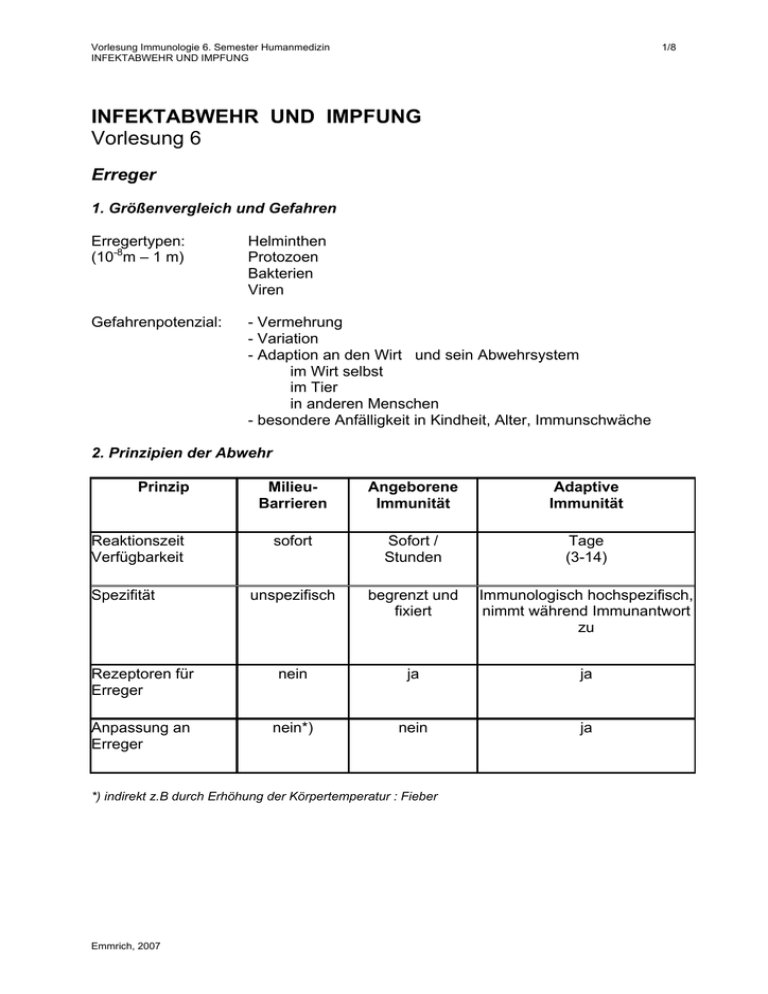
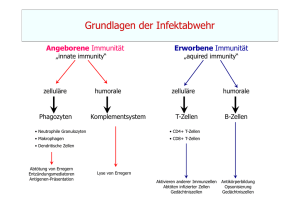
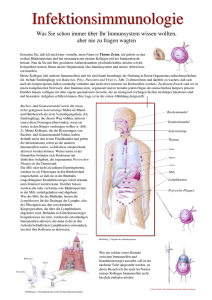
Vorlesung Immunologie 6. Semester Humanmedizin INFEKTABWEHR UND IMPFUNG 1/8 INFEKTABWEHR UND IMPFUNG Vorlesung 6 Erreger 1. Größenvergleich und Gefahren Erregertypen: (10-8m – 1 m) Helminthen Protozoen Bakterien Viren Gefahrenpotenzial: - Vermehrung - Variation - Adaption an den Wirt und sein Abwehrsystem im Wirt selbst im Tier in anderen Menschen - besondere Anfälligkeit in Kindheit, Alter, Immunschwäche 2. Prinzipien der Abwehr Prinzip MilieuBarrieren Angeborene Immunität Adaptive Immunität sofort Sofort / Stunden Tage (3-14) unspezifisch begrenzt und fixiert Immunologisch hochspezifisch, nimmt während Immunantwort zu Rezeptoren für Erreger nein ja ja Anpassung an Erreger nein*) nein ja Reaktionszeit Verfügbarkeit Spezifität *) indirekt z.B durch Erhöhung der Körpertemperatur : Fieber Emmrich, 2007 Vorlesung Immunologie 6. Semester Humanmedizin INFEKTABWEHR UND IMPFUNG 2/8 Milieu-Barrieren Übersicht Uns schützen zunächst physikalische und Milieu-Barrieren vor dem Erregereintritt. Sie betreffen ganz wesentlich die Haut und die Schleimhaut und es gehören dazu pH-Wert-Schwellen (pH Magen: 1 – 2, Hautsäuremantel pH 3 – 5, Schweiss pH 5, Vagina 4 – 4,5, Harnwege 5 – 7), aber auch Strömungsvektoren (Harnwege, Zilienschlag der Bronchialepithelien), Reflexe (Hustenreflex), besondere Milieubedingungen (Zusammensetzung der Tränenflüssigkeit, Keimbesetzung und – konkurrenz). Angeborene Immunität 1. Übersicht Barrieren A. Epitheliale Barrieren (mit γ, δ-T-Zellen in der Shleimhaut) B. Molekulare Barrieren in Körperflüssigkeiten (induzierbar wie z.B. Zytokine und nicht-induzierbar) C. Phagozyten : Neutrophile/Monozyten/Makrophagen NK-Zellen „pattern recognition“ Rezeptoren ¾ ¾ Die angeborene Immunität umfasst unmittelbar verfügbare oder kurzfristig innerhalb von max. 4h nach dem Erregereintritt rekrutierte Abwehrmechanismen. Bevor nach etwa 4 Tagen die ersten Effektorfunktionen der adaptiven Immunität verfügbar werden, übernimmt die Entzündung vor Ort die Erregerabwehr. 2. Epithelbarrieren (A) Epitheliale Barrieren mit Schnittstellen zur adaptiven Immunität ¾ Intraepitheliale Lymphozyten (IEL) und Immunzellen innerhalb von M-Zellen (= Mucosa-Epithelzellen ohne Villi aber mit Höhlen, die B-, T-Zellen und Makrophagen enthalten ) stellen die erste Abwehrfront gegen enterale Antigene. ¾ IEL tragen γ, δ T-Zellrezeptoren, die z.B. Glykolipide erkennen und sehr eingeschränkt in ihrer Spezifität sind. Sie erkennen ihr Antigen ohne MHCRestriktion. ¾ Schutzfilm-Moleküle: Kationische antibakterielle α-Defensine (Darmschleimhaut) und β-Defensine (Lungenepithel) Emmrich, 2007 Vorlesung Immunologie 6. Semester Humanmedizin INFEKTABWEHR UND IMPFUNG 3/8 3. Molekulare Barrieren (B) Nicht-induzierbare Effektoren ¾ Substanzen mit mikrobizider Wirkung Säuren: Magen-, Milch-, Fettsäuren Enzyme: Lysozym, Pepsin ¾ Surfactant-Proteine besetzen Bakterienoberflächen (Opsonierung) ¾ Komplementsystem wichtige biologische Effekte (siehe Vorlesung 4) ¾ Weitere molekulare Barrieren bilden Plasmaproteine wie C-reaktives Protein Induzierbare Effektoren: Zytokine ¾ Makrophagen-Zytokine = Monokine - IL-1 aktiviert Endothelzellen, Kostimulator für T-Zellen, Fieber, Akut-Phase-Proteine in der Leber. - IL-6 regt Antikörpersynthese in B-Zellen an, Kostimulation T-Zellen - TNFα wird über TLR4 induziert und steigert Gefäßpermeabilität, reguliert Adhäsionsmoleküle auf, stimuliert Thrombozyten und mobilisiert DC. CAVE : Bei systemischer bakterieller Infektion droht Sepsis - IL-8 lockt Neutrophile an - IL-12 stimuliert Th1- und NK-Zellen ¾ Interferone - IFNα und IFNβ wirken virostatisch und regulieren MHC-Moleküle auf - IFNγ reguliert MHCI- und –II-Moleküle auf und aktiviert Makrophagen 4. Phagozyten (C) Für die Funktion aller Zellen der angeborenen Immunität und insbesondere der Phagozyten von ausschlaggebender Bedeutung sind ihre Rezeptoren (siehe Vorlesung 4). Hierzu gehören Komplementrezeptoren, C-Typ Lektinrezeptoren, TLR, Fc-Rezeptoren und STS. ¾ Neutrophile Granulozyten und Monozyten/Makrophagen erreichen als erste Zellen den Ort des Erregereintritts und beginnen mit der Phagozytose. ¾ Neutrophile Granulozyten und Monozyten/Makrophagen bilden die erste zelluläre Front für die Erregerabwehr. ¾ Intrazellulär : Phagolysosomen, Lysozym ¾ Extrazellulär : Antibakterielle Wirkstoffe und Entzündungsmediatoren 5. NK-Zellen (C) NK-Zellen überwachen andere Zellen in Bezug auf die Expression von MHCIMolekülen mit Hilfe des killing inhibitors factors (KIR) und des kiling activatory factors (KAR). KIR hemmt KAR wenn hinreichend MHCI vorhanden ist. Andernfalls wird die Hemmung aufgehoben und Zytolyse eingeleitet. Emmrich, 2007 Vorlesung Immunologie 6. Semester Humanmedizin INFEKTABWEHR UND IMPFUNG 4/8 6. Entzündung ¾ Ursprüngliche Entzündungsdefinition: DOLOR - Schmerz RUBOR - Rötung CALOR - Hitze TUMOR - Schwellung ¾ Charakteristika: - verstärkte Blutzufuhr zum Infektionsort - verstärkte Kapillarpermeabilität Ödembildung und Aufregulation von Adhäsionsmolekülen - Chemoattraktion durch IL-8 - Extravasation von Neutrohilen und Makrophagen in das umgebende Gewebe - Eiterbildung nach Absterben der Zellen ¾ Generalisierte Entzündung (Sepsis): Eine massive Freisetzung von Zytokinen, welche oft durch bakterielles Endotoxin (LPS) von ausgelöst wird, kann zu intravaskulärer Koagulation und dadurch defekter Gerinnung, Änderungen der Gefäßpermeabilität, Flüssigkeitsverlust in den Geweben, Blutdruckabfall, Kreislaufzusammenbruch und hämorrhagischer Nekrose, besonders im Darm, führen. Escape-Strategien 1. Antigene Variation Antigene Vielfalt lässt das Immunsystem ins Leere laufen! ¾ Vielfalt der Stämme Einige Erreger bilden viele nicht-antigen verwandte Stämme (z.B. 84 verschiedene Stämme bei Streptococcus pneumoniae mit typenspezifischen Polysacchariden, aber keine Kreuzimmunität). ¾ Antigendrift Punktmutationen bei Oberflächenproteinen, so dass protektive Antikörper nicht mehr binden können (meist noch partieller Schutz vorhanden). ¾ Antigenshift Rekombination mit verwandten Viren in einem Wirtsorganismus, so dass protektive Antikörper und T-Zellen nicht mehr schützen (meist schwere Infektionen). Bei Trypanosomen findet die Antigenvariation des variantenspezifischen Glykoproteins (VSG) im gleichen Wirt statt (ca. 1000 VSG-Gene, immer nur eines exprimiert). 2. Verbergen vor dem Immunsystem Verbergen im Gewebe Erreger verbirgt sich in unzugänglichem Gewebe. ¾ Varicella (Herpes) zoster (Windpocken) überdauert in den Spinalanglien und kann bei Stress oder Immunschwäche eine Gürtelrose auslösen. Emmrich, 2007 Vorlesung Immunologie 6. Semester Humanmedizin INFEKTABWEHR UND IMPFUNG 5/8 Verbergen vor Phagozyten Erreger macht sich unsichtbar. Erreger vermeidet das Andocken an Phagozytenrezeptoren. ¾ Einige Erreger können Repellents freisetzen, die Chemokine blockieren. Der Erreger verliert seinen „Duft“. Verbergen im Phagozyten Erreger entwickelt resistente Hülle oder Kapsel und überlegt in der Zelle unzerstört. ¾ Mycobakterien überleben in nicht-aktivierten Makrophagen (Phagosom verschmilzt nicht mit Lysosom) ¾ Toxoplasma gondii entkommt aus Phagosom, bildet eigene Vesikel ¾ Borrelien lassen sich von Makrophagen „einwickeln“ und überdauern in der Zelle. ¾ Leishmanien Geißeltragende Protozoen, die in Makrophagen eindringen, im Phagolysosom überleben, dieses verlassen und den Makrophagen funktionell lähmen. 3. Schwächung des Immunsystems Eingriff in Erkennung durch das adaptive Immunsystem Erreger stört APC-Funktionen Erreger stört Induktion der adaptiven Immunität Auslöschung einer speziellen Vβ TCR – Genfamilie (z.B. durch Superantigene wie MMTV) Infizierte Zellen stoppen Antigenpräsentation Eingriff in Steuerung des Immunsystems Erreger stört aktiv aber indirekt durch Eingriff in die Regulationsebene des Systems Eingriff in Effektormechanismen des Immunsystems Erreger stört aktiv seine Aufnahme oder den Abbau durch Phagozyten Erreger stört aktiv zelluläre oder Mediator-vermittelte EffektorMechanismen z.B. der Phagozyten Dysregulation Emmrich, 2007 Erreger stört komplexe regulatorische Balancen HIV-Infektion über das CD4Molekül schädigt selektiv die Th-Zellen und ihre Funktionen Mykobakterien setzen ein Lipoarabinomannan frei, welches die Wirkung von IFNg auf Makrophagen blockiert Nach Phagozytose sezerniert Mycobakterium tuberculosis Inhibitoren für die Fusion von Phagosom mit Lysosom Mykobakterien sezernieren Katalase und bremsen damit die Mikrobizidie von Hydrogenperoxid M.leprae bewirkt Polarisierung der Th-Zellen Tuberkuloide Lepra : Th1Übergewicht Lepromatöse Lepra : Th2 Übergewicht Vorlesung Immunologie 6. Semester Humanmedizin INFEKTABWEHR UND IMPFUNG 6/8 Impfungen 1. Aktive und passive Immunisierung Aktive Immunisierung ¾ Stimulation der körpereigenen Immunabwehr durch abgetötete (Totimpfstoff) oder abgeschwächte (attenuierte) Erreger (Lebendimpfstoff). CAVE: Vollständiger Schutz braucht Zeit! Etwa 10 – 14 Tage dauert es in den meisten Fällen bis zum vollständigen Schutz. Passive Immunisierung ¾ Kurzfristiger Ersatz der körpereigenen Immunabwehr durch Übertragung von spezifischen Antikörpern („Antiserum“) ggf. in Zukunft von extrakorporal präparierten spezifischen T-Zellen. 2. Regeln und Impfpass ¾ Impfungen bieten hohe, risikoarme und preiswerte Sicherheit vor Ansteckung mit Infektionskrankheiten! Sie sollten in einem persönlichen Impfpass aufgezeichnet werden. Leider nehmen Impfmüdigkeit und ablehnende Haltungen (Fundamentalismus, Ängste) zu. Geduldige Aufklärung tut Not! ¾ Grundsätzlich sind Standardimpfungen immer zu empfehlen, dringend angeraten sind sie bei Kindern. Zusatzimpfungen empfehlen sich bei Geschäftsreisende, Berufstätigen mit erhöhter Infektionsgefahr und Senioren (Influenza, Pneumokokken). ¾ In Deutschland gibt es keine Impfpflicht mehr, jedoch Impfempfehlungen der STIKO (Ständige Impfkommission) am Robert-Koch-Institut (RKI) in Berlin. 3. Empfehlungen Impfkalender für Babys und Kleinkinder Impfkalender für Kinder, Jugendliche und Erwachsene Tetanus Diphterie Pertussis Poliomyelitis Hepatitis B Pneumokokken Windpocken Tetanus Diphterie Pertussis Poliomyelitis Hepatitis B Pneumokokken Windpocken Haemophilus influenzae Meningokokken Masern, Mumps, Röteln Influenza Papillomaviren Wichtige Reiseimpfungen Cholera Gelbfieber Hepatitis A und B Poliomyelitis Malaria-Prophylaxe Tollwut Typhus Infos zu Reise-Imfpungen: www.dtg.org und Bulletins des Robert-Koch-Instituts und der WHO Emmrich, 2007 Vorlesung Immunologie 6. Semester Humanmedizin INFEKTABWEHR UND IMPFUNG 7/8 Impfstoffentwicklung 1. Anforderungen an einen Impfstoff Kriterien für einen effektiven Impfstoff Sicherheit Der Impfstoff darf selbst nicht zu Krankheit oder Tod führen. Schutz Der Impfstoff muss vor einer Krankheit schützen, die durch einen lebenden Erreger hervorgerufen wird. Langanhaltende Wirkung Der Schutz vor einer Infektion muss mehrere Jahre anhalten. Induktion neutralisierender Antikörper Einige Krankheitserreger (wie das Poliovirus) infizieren Zellen, die nicht ersetzt werden können (z.B. Neuronen); neutralisierende Antikörper können einer Infektion vorbeugen. Praktische Anforderungen Geringe Kosten pro Dosis, biologische stabil, leicht zu verabreichen, keine / akzeptable Nebenwirkungen 2. Lebendimpfstoffe ¾ Die klassische Herstellungsweise eines attenuierten Lebendimpfstoffes besteht in der Anpassung (über Zellkulturpassagen) eines Virus an Affenzellkulturen und dem Verlust der Pathogenität bei künftigem Kontakt mit menschlichen Zellen. Hohe Immunogenität und Protektion werden eher durch Lebendimpfstoffe erreicht. 3. Totimpfstoffe ¾ Totimpfstoffe können aus abgetötetem Erregermaterial bestehen. ¾ Zwei neuere Entwicklungen betreffen Peptide ggf. in Kombination mit Makromolekülen als Trägerstrukturen. ¾ Nach exakter Analyse der relevanten Epitope werden die betreffenden Peptide chemisch synthetisiert, um einen Impfstoff ohne jegliches Sicherheitsrisiko zu erzeugen. Es gibt jedoch Limitationen: Kleine Peptide sind kaum immunogen. ABER: Peptide > 20 aa sind schwierig zu synthetisieren. ¾ Peptide, die gleichermaßen durch Antikörper erkannt werden aber auch von T-Zellen (d.h. an MHC-Moleküle binden). ¾ Verwendung von ISCOMs, d.h. von Lipid-Micellen mit deren Hilfe Peptide in die Zelle geschleust werden, wo sie sich mit MHC Klasse I - Molekülen verbinden. ¾ Die jüngste Entwicklung sind MHC-Tetramere mit vorgefertigten Peptiden als T-Zell“impfstoffe“. Emmrich, 2007 Vorlesung Immunologie 6. Semester Humanmedizin INFEKTABWEHR UND IMPFUNG 8/8 4. Gentechnisch erzeugte Impfstoffe ¾ Im Vergleich zu klassischen Methoden erreicht man eine schnellere und verlässlichere Attenuierung durch gezielte Mutation oder Deletion von Virulenzgenen. Die Rückmutation zum Wildtyp lässt sich auf diese Weise praktisch ausschließen und auf anlaufende Epidemiewellen kann rascher durch Bereitstellung eines geeigneten Impfstoffes reagiert werden. ¾ Noch zielgenauer ist die Definition der relevanten T- und B-Zellepitope und die Einschleusung der betreffenden Genabschnitte in einen Wirtsorganismus (z.B. Vaccinia-Virus). So wurde beim ersten gentechnisch hergestellten Humanimpfstoff (Hepatitis B) verfahren. 5. DNA-Impfstoffe ¾ Plasmid-DNA eines Immunogens führt bei intramuskulärer Injektion am Eintrittsort zu Proteinexpression und Immunreaktion mit Impfeffekt. ¾ Sicher (keine Erregerreplikation), stabil und preiswert, bisher nur im Tierexperiment erprobt. Emmrich, 2007