Hepatitis C-Infektionen: Diagnose
Werbung

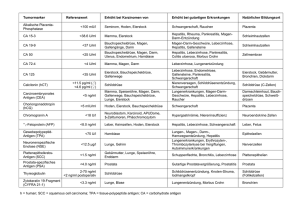
Medizin Hepatitis C-Infektionen: Diagnose-Defizit und hohe Dunkelziffer Prof. Dr. Claus Niederau, Katholische Kliniken Oberhausen, St. Josef-Hospital, Oberhausen Gründe für eine HCV-Übertragung waren vor 1992 überwiegend kontaminierte Injektionen, medizinische Eingriffe und Blutprodukte. Seit der Identifikation des HCV 1989 und der Verfügbarkeit eines Antikörpertests ab 1992 reduzierte sich die iatrogene Ausbreitung in den Industrieländern drastisch. Heute geschehen die meisten Neuinfektionen im Rahmen des i.v. Drogenkonsums. Die Neuerkrankungsrate geht zurück, die Folgeerkrankungen der schon infizierten Personen werden dagegen in den nächsten Jahren zunehmen. Bei etwa 20 % der chronisch HCV-Infizierten bildet sich eine Leberzirrhose, die ihrerseits ein HCC-Risikofaktor ist. Schon heute geht ein großer Teil der Zirrhosen, HCC und Lebertransplantationen auf das Konto der Hepatitis C. Allein in den USA werden in den nächsten 40 – 50 Jahren fast 2 Millionen HCV-Patienten eine Zirrhose entwickeln 4), etwa 400 000 ein HCC 4 – 7). Und etwa 1 Million Personen werden an HCVassoziierten Komplikationen sterben 7 – 8). Unterschätzte Prävalenz Die Daten aus dem US-amerikanischen National Health and Nutrition Examination Survey (NHANES), die einen reprä14 Diagnostik im Dialog • Ausgabe 40 • 5/2013 corbis Jährlich infizieren sich weltweit 3 – 4 Millionen Menschen mit dem Hepatitis C-Virus (HCV). Die Infektion zeigt eine hohe Chronifizierungsrate, sie zählt daher zu den wichtigsten Leberkrankheiten. Etwa 150 Millionen Menschen tragen HCV-bedingt ein erhöhtes Risiko für eine Leberzirrhose und ein hepato-celluläres Carcinom (HCC) 1 – 3). In vielen Ländern gibt es hochwertige diagnostische Tests sowie Leitlinien zur HCV-Testung der Allgemeinbevölkerung und zum Screening von Risikogruppen. Doch in der Praxis mangelt es häufig an der konsequenten Umsetzung oder ausreichenden Kenntnissen der Ärzte. Daher liegt die Dunkelziffer chronischer HCV-Infektionen extrem hoch – vermutlich sind es um die 80 % ! Diese Zahl alarmiert auch deshalb, weil hochwirksame Medikamente zur Heilung oder Verringerung der Spätfolgen zur Verfügung stehen. sentativen Querschnitt der Allgemeinbevölkerung zeigen, beziffern die Prävalenz der HCV-Infektion (anti-HCV positiv) auf 1,5 –1,7 %. Vermutlich jedoch ist dieser Wert um 1 Million chronisch Infizierter unterschätzt, da Risikogruppen wie Inhaftierte und Obdachlose nicht eingeschlossen waren 9). In Europa leiden etwa 9 Millionen Menschen an einer chronischen Hepatitis C 10). Die HCV-Prävalenz (anti-HCV positiv) schwankt von 0,4 % (Schweden, Deutschland, Niederlande) über 2 – 3 % (Mittelmeerländer) bis > 20 % in einigen Regionen Süd-Europas 11, 12). Nach Angaben des RKI gehört Deutschland mit 0,4 % zu den Niedrig-Prävalenzregionen, allerdings werden die eigenen Zahlen kritisch kommentiert 13), da z.B. Risikogruppen wie Drogenabhängige, Inhaftierte und Migranten in bisherigen Studien unterrepräsentiert waren. Neuere Untersuchungen lieferten folgende Daten: OIn einem Hamburger Labor wiesen 12,9 % der unselektierten Blutproben eine erhöhte GPT auf, 6,3 % davon waren anti-HCV positiv. In der Kontrollgruppe mit normaler GPT dagegen lag dieser Anteil bei nur 1,7 % 14). OIn den Jahren 2008 – 2009 wurden an der Berliner Charité 13 328 Patienten der Notaufnahme auf eine HCVInfektion untersucht. 66 % der Patien­ ten hatten erhöhte Transaminasen und 2,5 % waren anti-HCV-positiv 15). ONoch häufiger ließ sich eine HCVInfektion beim Screening von Migranten in 16 Hamburger Praxen und 5 Klinikambulanzen diagnostizieren: die Prävalenz von anti-HCV betrug 5,8 % (Praxen) bzw. 6,3 % (Ambulanzen) 16). OBei i.v. Drogenabhängigen ist die Prävalenz um ein Vielfaches höher – in einer Untersuchung betrug die HCV-Rate in Berlin 53 % und in Essen 80 % 17)! Klare Screeningempfehlungen Die Suche nach einer HCV-Infektion ist mit der Antikörpermessung einfach und verlässlich, so dass dieser Test bei immunkompetenten Personen in der Praxis ausreicht. Mit dem Antikörpertest erkennt man etwa 99 % der HCV-Infektionen. Nur bei Immungeschwächten oder in frühen Phasen der akuten Infektion findet man eine positive HCV-RNA ohne Antikörpernachweis. Der Immunoblot hat für die klinische Praxis keine Bedeutung. Bei allen Patienten mit nachgewiesenem anti- HCV sollte ein entsprechender RNA-Test durchgeführt werden. Dadurch lässt sich eine replikative Infektion von einer ausgeheilten Infektion bzw. einem unspezifisch positiven Antikörperbefund abgrenzen. Verschiedene Leitlinien 18, 19) und auch das Robert-Koch Institut (RKI) 20) geben bezüglich der Testung auf HCV-Infektion folgende Empfehlungen ab: OIn der Allgemeinbevölkerung sollten (auch nur geringfügig) erhöhte Transaminasen (GPT) Anlass zur spezifischen Antikörper-Diagnostik sein. OFür Risikogruppen ist ein HCV-Screening auch bei normalen Leberwerten obligat. Zu den typischen HCV-Risikogruppen gehören OPatienten, die vor 1992 Blutprodukte erhalten haben ODialyse-, Hämophilie- und transplantierten Patienten Oi.v. Drogenkonsumenten OPersonen aus Ländern mit endemischer Häufung der Hepatitis Mangelnde Umsetzung Die Screening-Empfehlungen der aktuellen deutschen S3-Leitlinie (Tab.) werden derzeit nur unzureichend umgesetzt. Besonders Migranten aus Ländern mit hoher Hepatitis-Prävalenz sind in Deutschland eine wichtige Zielgruppe für systematisches Screening – auch ohne Symptome und mit normalen Leberwerten 13, 19). In zwei epidemio­ logischen Studien z.B. stammten nur etwa 2/3 der in Deutschland lebenden Hepatitis C-Patien­ t en gebürtig aus Deutschland 21, 22). Das Screening dieses Risikokollektivs hat sich als kosteneffektiv erwiesen 23). Bei i.v. Drogenabhängigen ist die Evidenz für ein HCV-Screening aufgrund der sehr hohen Prävalenz noch klarer. Die konsequente Umsetzung von Empfehlungen scheitert auch an mangelnden Kenntnissen z.B. auf Seiten von Ärzten. In der Praxis des Hausarztes sind erhöhte Leberwerte „an der Tagesordnung“. In einer bundesweiten Studie lagen dort 13,5 % aller GPT-Werte über dem Normwert 24). Lange Zeit galten leicht erhöhte Transaminasen aber als „Kavaliersdelikt“, ohne Konsequenzen. Eine Ana- lyse im hausärztlichen Bereich zeigte, dass etwa 60 % der Hausärzte maximal fünf Anti-HCV-Tests pro Jahr, mehr als 30 % überhaupt keinen Test durchgeführt haben 25). Erhöhte Leberwerte gehören jedoch abgeklärt, da sie nicht „automatisch“ durch Alkoholkonsum oder Leberverfettung entstehen 20). Eine HCV-Diagnostik mit Bestimmung von antiHCV sollte erfolgen bei: - Personen mit erhöhten Transaminasen und / oder klinischen Zeichen einer Hepatitis bzw. chronischen Lebererkrankung unklarer Genese - Empfängern von Blut und Blutprodukten (vor 1992) - Transplantatempfängern - Hämodialyse-Patienten - aktiven und ehemaligen i. v. Drogenkonsumierenden - Insassen von Justizvollzugsanstalten - HIV- und / oder HBV-Infizierten -H aushaltsangehörigen bzw. Sexualpartnern HCVInfizierter und Kindern HCV-positiver Mütter -P ersonen mit Migrationshintergrund aus Regionen mit erhöhter HCV-Infektionsrate, -m edizinischem Personal -B lut-, Organ- und Gewebespendern - jedem, der eine entsprechende Untersuchung explizit wünscht (incl. adäquater Beratung) Tab.: Screening-Empfehlung der aktuellen deutschen S3-Leitlinie (modifiziert aus 19) Die Bereitschaft von Hausärzten zur Anforderung eines Antikörpertests korreliert mit der Höhe der GPT: Sie ist am größten bei GPT-Konzentrationen über dem Dreifachen des oberen Normwertes. Dieses Vorgehen entspricht jedoch nicht der medizinischen Realität. In einer prospektiven Untersuchung von 192 Hausarztpraxen lag die tatsächliche Zahl der positiven HCV-Tests in der Gruppe mit sehr hohen Leberwerten relativ niedrig 24). Demgegenüber können chronische Lebererkrankungen mit normalen Transaminasen einhergehen und trotzdem in eine Zirrhose münden. Auch die Symptomatik bei HCV-Infektion ist nicht eindeutig; das ergab eine Fragebogenanalyse bei in Deutschland lebenden Patienten 26): Etwa 30 % aller Personen mit chronischer Hepatitis C waren asymptomatisch, ca. 60 % gaben nur unspezifische Beschwerden wie Müdigkeit, Konzentrationsschwäche und Oberbauchbeschwerden an. Bei Risikopersonen sollte daher auch der Hausarzt unabhängig vom GPT- und Beschwerdestatus eine HCV-Antikörpertestung veranlassen. Mangelhafte Umsetzung und Kenntnisse im Kontext der HCV-Diagnostik resultie- ren in einem unzureichenden Screening. Dies erklärt, warum so wenige HCVInfizierte von ihrer Infektion wissen. Im Jahr 2011 hat das RKI 127 infektiöse Erreger hinsichtlich der Bedeutung für die nationale Surveillance publiziert: HCV erhielt den Rang 5 und gehört damit in die Gruppe mit der höchsten Priorität 27). Dieser enormen medizinischen und ökonomischen Bedeutung der Hepatitis C muss in der täglichen Praxis mehr Rechnung getragen werden. Innerhalb Europas haben bisher nur Frankreich und Schottland ein nationales Programm, um das Hepatitis-Screening in Risikogruppen zu verbessern 10). Screening „Birth-Cohort“ Das „Center for Disease Control and Prevention“ (CDC) in den USA hat im Jahre 2012 die Screening-Empfehlung auf die sogenannte „Birth-Cohort“ ausgeweitet 28). Es handelt sich um die Geburtsjahrgänge 1945 bis 1965, bei denen – aufgrund der vielfältigen iatrogenen Infektionsquellen vor 1990 – die Prävalenz der chronischen Hepatitis C bei > 3 % und damit im Vergleich zu anderen Jahrgangsstufen 5-fach höher liegt. Wie bei den anderen Risikogruppen soll innerhalb der „Birth-Cohort“ jede Person einmal auf HCV getestet werden. Das Screening ist auch ökonomisch sinnvoll: die Kosten liegen bei 15.000 – 39.000 US-$ pro gewonnenem Lebensjahr und damit in der Größenordnung anderer Vorsorgemaßnahmen wie der präventiven Koloskopie und der Mammographie 29, 30). In Deutschland fehlen zwar verlässliche Zahlen zur HCV-Prävalenz in einer „Birth-Cohort“, vermutlich aber sehen die Daten zur Häufigkeitsverteilung in unterschiedlichen Altersgruppen ähnlich aus, zumal in anderen europäischen Ländern eine entsprechende „Birth-Cohort“ nachgewiesen wurde 31, 32). Da in Deutschland die HCV-Prävalenz insgesamt wahrscheinlich niedriger liegt als in den USA, sind weitere Studien erforderlich und die amerikanischen Richtlinien nicht einfach übertragbar. Zumindest aber sollten in Deutschland die jetzigen Empfehlungen zum Screening von Risikogruppen umgesetzt werden (Tab.), um die hohe Dunkelziffer unerkannter Infektionen zu senken. Das ist sehr oft nicht der Fall: Diagnostik im Dialog • Ausgabe 40 • 5/2013 15 verschiedene Untersuchungen beziffern die tatsächliche HCV-Testung in Risikokollektiven auf 17 – 87 % 33, 34). Hohe Dunkelziffer bekämpfen Die bisherigen Screening-Strategien hatten weltweit keine erkennbare Wirkung auf die hohe Dunkelziffer bei HCV-Infektionen OIn den USA wissen 45 – 85 % der Infizierten nichts von ihrer Infektion 35 – 38). OIn Europa kennen bis zu 90 % der HCV-Infizierten ihren Infektionsstatus nicht 39). ODie Rate unerkannter HCV-Infektionen liegt in der Gruppe der i.v. Drogenabhängigen schätzungsweise bei 72 % 40). Nationale Screening-Programme sind essenziell, einerseits um die Virusaus- breitung zu stoppen, andererseits, um infizierte Personen über ihren Status aufklären und ihnen eine adäquate Therapie anbieten zu können. Die antivirale Therapie bei HCV-Infektionen verringert das Risiko von Leberzirrhose, -karzinom, -transplantation und Tod deutlich. In einer Studie mit 16 864 HCV-Patienten war die Ausheilung der Infektion (Sustained Virologic Response / SVR) mit einer Halbierung der Mortalität und einer deutlichen Reduktion des HCC-Risikos assoziiert 41). Die diagnostischen und therapeutischen Voraussetzungen zur Bekämpfung der HCV-Infektion und ihrer Folgen stehen zur Verfügung – die offiziellen Empfehlungen müssen allerdings auch konsequent und kompetent in der täglichen Praxis umgesetzt werden! Literatur Die umfangreiche Literaturliste ist über die Redaktion erhältlich. Korrespondenzadresse: Prof. Dr. Claus Niederau Katholische Kliniken Oberhausen gem. GmbH St. Josef-Hospital Klinik für Innere Medizin Akademisches Lehrkrankenhaus der Universität Duisburg-Essen Mülheimer Straße 83 46045 Oberhausen [email protected] Medizin – Für Sie gelesen Patienten mit chronischer Hepatitis B (CHB) tragen ein erhöhtes Risiko für Leberzirrhose und Leberzellkarzinom (HCC). Serumkonzentrationen der Hepatitis B Virus-DNA (HBV-DNA) und des Hepatitis-B-Antigens (HBsAg) sind für die Diagnose und Therapiesteuerung von CHB etablierte Marker. Sind sie auch prognostisch relevant? Diese Frage beantwortete die große Kohortenstudie REVEAL*-HBV. 2006 beschrieben die Autoren bereits einen deutlichen Zusammenhang zwischen erhöhter HBV-DNA und der HCC-Inzidenz 1). Neuere Daten identifizierten zusätzlich HBsAg als unabhängigen Risikofaktor für die Entwicklung eines HCC 2). Danach können HBsAg-Tests bis dato „unsichtbare“ Gefahren identifizieren, denn auch bei niedrigen HBV-DNA-Werten besteht ein gewisses HCC-Risiko. Vor allem für Patienten mit niedriger viraler DNA im Serum ist HBsAg als komplementärer Prognosemarker von klinischer Bedeutung. Weltweit sind mehr als 350 Millionen Menschen mit dem Hepatits B Virus infiziert. Langzeitfolgen wie Leberzirrhose oder HCC betreffen schätzungsweise 25 – 40 % der chronisch Infizier16 Diagnostik im Dialog • Ausgabe 40 • 5/2013 corbis „Unsichtbare“ Gefahr für die Leber? ten. Kommerziell verfügbare Methoden zur Quantifizierung von HBV-DNA und HBsAg unterstützen die Diagnose und die Therapiesteuerung. Besitzen diese Marker auch einen klinischen Wert für die Risikostratifizierung hinsichtlich HCC? Mit dieser Fragestellung beschäftigte sich die seit 1991 laufende REVEALHBV-Studie aus Taiwan. Ihre Daten spiegeln den „natürlichen“ Krankheitsverlauf wider, da keine therapeutischen Interventionen erfolgten. Risikofaktor HBV-DNA In einem Kollektiv aus 3 653 CHB-Patien­ ten – bis 2003 ohne Zugang zu therapeutischen Maßnahmen – wurde über 13 Jahre die HCC-Inzidenz beobachtet und in verschiedenen Studiengruppen miteinander verglichen 1). Maßgeblich für die Gruppenzuteilung war die Ausprägung folgender HCC-Risikofaktoren: Geschlecht, Alter, Nikotin- und Alkoholkonsum, Konzentration der Transaminasen, HBe-Antigen-Status, bestehende Leberzirrhose sowie Konzentration der HBV-DNA (gemessen mit dem COBAST AMPLICOR HBV Test Kit von Roche aus tiefgefrorenen Proben vom Beginn und vom Ende der Studie). Das Ergebnis war ein statistisch signifikanter Zusammenhang zwischen HBVDNA und HCC: OVerglichen mit Patienten ohne detektierbare HBV-DNA (d. h. unter 300 Kopien/ ml), lag das HCC-Risiko bei HVBDNA-Konzentrationen > 104 Kopien/ml etwa 3-fach und bei > 105 Kopien/ml etwa 10-fach höher. Bei HBV-DNAWerten < 104 Kopien/ml ließ sich dagegen kein größeres Risiko erkennen. OHohe HBV-DNA-Titer korrelieren häufig mit anderen oben genannten Risikofaktoren. Daher wurde die Unabhängigkeit des molekularen Markers hinsichtlich HCC-Risiko geprüft und auch bestätigt: Verglichen mit Patienten ohne detektierbare HBVDNA lag das angepasste HCC-Risiko bei HVB-DNA-Konzentrationen > 104