Vorlesung 8
Werbung
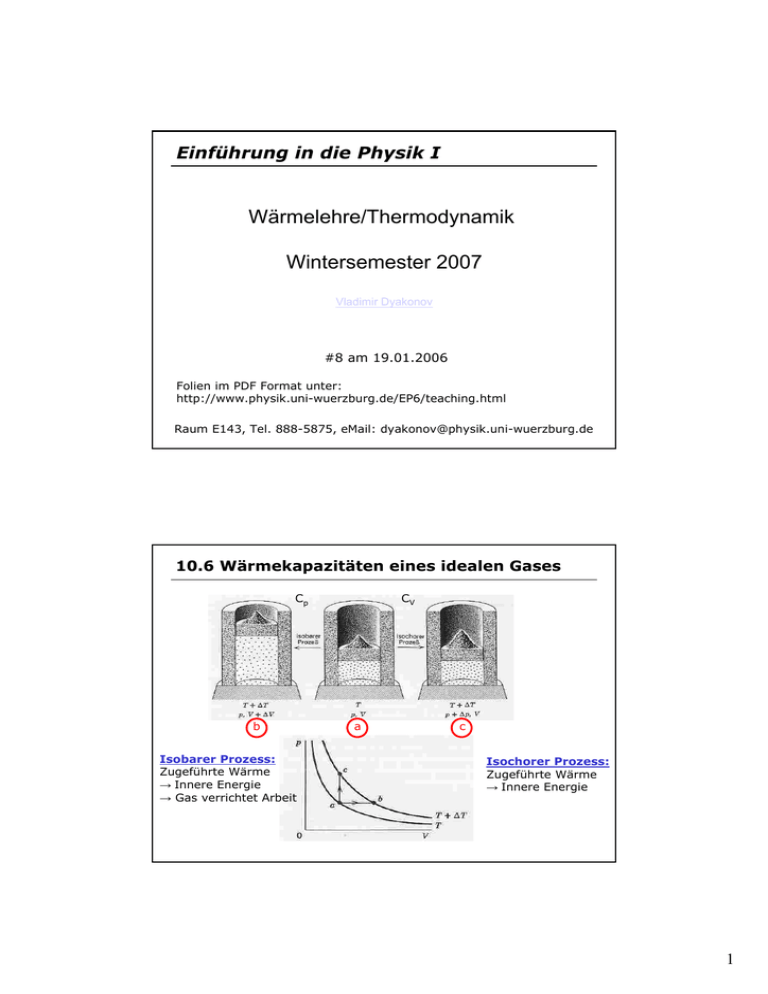
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #8 am 19.01.2006 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/EP6/teaching.html Raum E143, Tel. 888-5875, eMail: [email protected] 10.6 Wärmekapazitäten eines idealen Gases CV Cp b Isobarer Prozess: Zugeführte Wärme → Innere Energie → Gas verrichtet Arbeit a c Isochorer Prozess: Zugeführte Wärme → Innere Energie 1 10.6 Wärmekapazitäten eines idealen Gases Bei dem Vergleich der molaren Wärmekapazitäten von Gasen fallen eine Reihe von Besonderheiten ins Auge: 1) Cp & CV besitzen jeweils für einatomige, zweiatomige und mehratomige Gase charakteristische Werte 2) Erstaunlich: Differenz Cp-CV ist bei nahezu allen Gasen eine Zahl nahe bei R, der allg. Gaskonstante f=3 f=5 f=7 10.6 Energieerhaltungssaz 2 10.6 Wärme & Arbeit Beispiel: Gas in einem Behälter Arbeit F = p· A -Gas dehnt sich gegen den Stempeldruck aus r r dW = F ⋅ ds = pAds = pdV Reibungsfreier Kolben Isolierende Wand p -Verrichtete ges. Volumensänderungsarbeit: W = ∫ dW = Ve ∫ pdV Wärme Va Wärmereservoir T 10.6 Einschub: äußere/innere Arbeit an Gasen pi = pa = pa> pi Pa< pi pa Reibungsfreier Kolben innere Gasdruck beliebiger Aussendruck Kompression Expansion Verrichtete Arbeit in jedem Fall immer: V dW = − pa dV („Unendlich langsamer“) Spezialfall pa≈pi: pi dW = − pa dV = pi dV Vorteil: Man kann für pa ≈pi die Zustandsgleichung verwenden Fazit: Begrifflich ist zwischen pa und pi streng zu unterscheiden; es besteht nur numerische Gleichheit zwischen beiden Drücken! 3 10.6 Einschub: äußere/innere Arbeit an Gasen V2 W = − ∫ pa dV p a = const . V2 = − pa ∫ dV = − pa (V2 − V1 ) V1 V1 Konvention: dV < 0; dW > 0 dV > 0; dW < 0 Fläche u. d. Kurve Geleistete mechanische Arbeit ist wegabhängig und nicht allein durch die Zustandsgrößen des Anfangs- und Endzustands bestimmt. W ist keine Zustandsgröße ! 10.6 Wärme & Arbeit Beispiel: Gas in einem Behälter Isotherme Zustandsänderung p pa p 1 a Anfangszustand pa 1 Isotherme 2 pe Endzustand Isotherme Va Ve V pe b Va 2 Isotherme Ve V Die von einem System geleistete Arbeit (gelieferte, empfangene Wärme) hängt nicht nur vom Ausgangs- und Endzustand ab, sondern auch von den Zwischenzuständen, also vom Weg, auf dem das System geführt wird 4 10.6 Wärme & Arbeit Beispiel: Gas in einem Behälter p Arbeit ist das Integral unter dem Weg im pV-Diagramm p p a a pa 1 pe pa b Va 2 pe Isotherme Ve V a 1 Va pa b 2 1 pe Isotherme Ve V b Va 2 Ve Isother e V 10.6 Molare Wärmekapazitäten bei konst. Volumen - Erwärmung bei konstantem Volumen kann nur erreicht werden, wenn man gleichzeitig den äußeren Druck erhöht • Wärmeenergie wird nur in innere Energie umgesetzt ∆Q = ∆U • Für ein Mol des Gases gilt: ∆Q = cνV · ∆T = ∆U 5 10.6 Molare Wärmekapazitäten bei konst. Druck - Um eine Erwärmung bei konstantem Druck zu erreichen, muss man das Gas sich ausdehnen lassen - Bei Zufuhr an Wärmeenergie erhöht sich das Volumen (Festkörper, Gas, Flüssigkeit) • Wärmeenergie wird (1) in innere Energie umgesetzt und es wird (2) mechanische Arbeit verrichtet ∆Q = ∆U + ∆Wmech • ∆Wmech= F ∆x = p A ∆x = p ∆V • Für ein Mol des Gases gilt: ∆Q = cνV · ∆T + p ∆V 10.6 Molare Wärmekapazitäten bei konst. Druck • Allg. Gasgleichung für ein Mol des Gases: vor Expansion: pV=RT nach Expansion: p (V+∆V) = R (T+∆T) Subtraktion: p ∆V = R ∆T • daraus folgt: ∆Q = cνV · ∆T + p ∆V = cνV · ∆T + R ∆T cνp =(cνV + R) ∆T = cνp ∆T = molare Wärmekapazität bei konstantem Druck (= cmol, oder cm in d. Literatur) CνP=CνV+R 6 10.7 Hauptsätze der Thermodynamik Vorbemerkungen: • Thermodynamisches System: System von Atomen/Molekülen, das mit der Umgebung im Energieaustausch in Form von Wärme und/oder mechanischer Arbeit steht. • Hauptsätze der Thermodynamik behandeln die Frage: Wie ändert sich der Zustand eines Systems beim Energieaustausch mit der Umgebung ? • Die Hauptsätze der Thermodynamik sind mathematisch nicht beweisbar, sondern Erfahrungstatsachen, die aus Beobachtungen abgeleitet sind. • Zustand eines Systems: Gesamtheit seiner Eigenschaften, die durch äußere Randbedingungen festgelegt sind. • Gleichgewichtszustand eines Systems: Eigenschaften ändern sich nicht mit der Zeit (stationärer Zustand) • Gleichgewichtszustand des Systems eindeutig bestimmt durch die Zustandsgrößen: P, V, T 10.7 1. Hauptsatz der Thermodynamik Nebenbemerkungen: Zustandsfunktion • • Man ändere den Zustand eines Systems vom Zustand A nach Zustand B so langsam, dass immer thermodynamisches Gleichgewicht herrscht. Dann hängt die dabei zugeführte Wärmemenge ∆Q von der Vorgehensweise bei der Zustandsänderung ab (Wegabhängigkeit von ∆Q ) Auch die aufgewendete Arbeit ∆W hängt vom Weg ab • d.h. Q, W sind Wegfunktionen • Die Änderung der Inneren Energie ∆U hängt aber nur vom Startpunkt (Zustand A) und vom Endpunkt (Zustand B) ab (wegunabhängig). • U nennt man deshalb eine Zustandsfunktion 7 10.7 1. Hauptsatz der Thermodynamik Veranschaulich: pa 1 - System geht von 1 nach 2 (irgendwie) Anfangszustand - System leistet W/ empfängt Q Isotherme 2 pe Endzustand Isotherme Va Ve V - Q & W sind wegabhängig, d.h. prozessabhängig ! - Innere Energie U = Q+W ist wegunabhängig - U hängt nur vom Anfangs& Endzustand ab, wobei beide Gleichgewichtszustände sind 10.7 1. Hauptsatz der Thermodynamik Die einem System von außen zugeführte Wärmemenge ∆Q führt zu • • Erhöhung ∆U der inneren Energie U und damit Erhöhung ∆T der Temperatur T Expansion des Volumens V gegen den äußeren Druck, wobei vom System die Arbeit ∆W verrichtet wird Gleichung des 1. Hauptsatzes: ∆Q = ∆U - ∆W • 1. Haupsatz ist der Energieerhaltungssatz der Thermodynamik: ∆U = ∆Q + ∆W Summe der einem System von außen zugeführten Wärme und der zugeführten Arbeit ist gleich der Zunahme der inneren Energie 8 10.7 1. Hauptsatz der Thermodynamik dU = δ Q + δ W Differentielle Form des 1. Hauptsatzes Vorzeichenkonvention: Dem System zugeführte Energie δQ und am System geleistete Arbeit δW werden positiv gezählt, entzogene Energien und abgegebene Arbeit erscheinen negativ (NB: Vorzeichenkonvention ist leider nicht einheitlich in der Literatur) • Der 1. Hauptsatz kann auf jeden Vorgang in der Natur angewendet werden, sofern er nur zwischen 2 Gleichgewichtszuständen stattfindet • Eine periodisch arbeitende Wärmekraftmaschine (Dampfmaschine, Ottomotor) hat nach einem Arbeitszyklus im Idealfall ihre innere Energie ∆U nicht geändert, ∆U = 0, ⇒ ∆Q = -∆W : • „Es ist unmöglich, eine periodisch arbeitende Maschine zu bauen, die ohne Energiezufuhr ∆Q ständig Arbeit ∆W verrichtet“. • Unmöglichkeit eines „Perpetuum mobile 1. Art“ 10.7 1. Hauptsatz der Thermodynamik Robert Mayer 1814-1878 (Mediziner) Als er eines Tages nach Indonesien reiste bemerkte er, dass in dem tropischen Klima das Venenblut eine dem arteriellen Blut ähnliche Färbung annahm. Durch diese Beobachtung angeregt, begann er mit einer Untersuchung des menschlichen Wärmehaushalts. Seine Ergebnisse fasste er zum Ersten Hauptsatz der Thermodynamik zusammen: Energie kann nicht vernichtet werden. Sie kann lediglich in eine andere Form von Energie umgewandelt werden. Man kann keine Maschine konstruieren (Perpetuum Mobile erster Art), die nichts weiter tut als Energie zu erzeugen. Mayers Theorie wurde jedoch nicht anerkannt, da Beweise fehlten. Erst Joule konnte diese Theorie wenig später und unabhängig von Mayer genauer nachweisen. Erst Jahre später wurde Mayer nach schweren Depressionen und einem Selbstmordversuch auch als Entdecker anerkannt und erhielt viele Auszeichnungen und wurde sogar in den Adel aufgenommen (von Mayer). 9 10.7 Formulierungen des 1. Hauptsatzes • Energiesatz der Mechanik beantwortet die Frage, wie sich die Energie eines mechanischen Systems ändern läßt: durch Arbeit ∆W= ∆E = ∆(Etr + Erot + Ep + Eschw) Energie eines mechanischen Systems kann durch Zufuhr bzw. Abfuhr von Arbeit geändert werden. • In der Thermodynamik wird die Energieübertragungsform „Wärme“ ins Geschehen mitaufgenommen: ∆U = ∆Q + ∆W Die innere Energie U eines thermodynamischen Systems kann durch Zufuhr von Arbeit ∆W oder durch Zufuhr von Wärme ∆Q vergrößert werden (1. Hauptsatz) Energiezufuhr: mechanischen, elektrischen, magnetischen Weg; Strahlung 10.7 Formulierungen des 1. Hauptsatzes • • • Wärme und Arbeit sind Übertragungsformen der Energie. Im System selbst steckt dann weder Arbeit noch Wärme; nur die Energie (innere Energie) des Systems hat sich bei der Übertragung geändert. Deswegen ist es falsch zu sagen: Wärme wird im System gespeichert (Wärmekapazität) Formen der Energieübertragung: 1) Mechanische Volumenarbeit: dW =- pdV; (Kolben) 2) Wärme: dQ= CV dT; (Flamme, Wärmebad, Heizspirale) Konvention: Positive ∆W, ∆Q Negative ∆W, ∆Q ⇔ ⇔ Vergrößerung der inneren Energie Verkleinerung der inneren Energie 10 10.7 Anwendungen des 1. Hauptsatz der Thermodynamik Beispiele zum ersten Hauptsatz Genauere Betrachtung der möglichen Zustandsänderungen, die jeweils nach der primären Zustandsvariablen, die sich bei dem Prozess nicht ändert, klassifiziert werden 1) Isochore Prozesse ∆V = 0 Î V = konstant 2) Isobare Prozesse ∆p = 0 Î p = konstant 3) Isotherme Prozesse ∆T = 0 Î T = konstant 4) Adiabatische Prozesse ∆Q = 0 Î S = konstant 10.7 Anwendungen des 1. Hauptsatz der Thermodynamik a) Isochorer Prozesse (V = constant) Isochore Zustandsänderung bedeutet, der Stempel bleibt in Ruhe ∆V = 0 Î dx = 0 Î ∆W = 0 d.h. es wird keine äußere Arbeit verrichtet 11 10.7 Anwendungen des 1. Hauptsatz der Thermodynamik a) Isochorer Prozesse (V = constant) Die von außen dem System zugeführte Wärmemenge dQ wird vollständig in innere Energie dU umgesetzt (Temperaturerhöhung) ∆Q = ∆U = CV ∆Τ Definitionsgleichung: Spezifische Wärmekapazität bei konstantem Volumen ⎛ ∂U ⎞ CV = ⎜ ⎟ ⎝ ∂T ⎠V Verbindet stoffcharakteristische Größe mit Zustandsgrößen 10.7 Anwendungen des 1. Hauptsatz der Thermodynamik b) Isobarer Prozess (p = constant) Die von außen dem System zugeführte Wärmemenge dQ wird in Arbeit dW und innere Energie dU umgewandelt ∆Q = ∆U + ∆W 12 10.7 Anwendungen des 1. Hauptsatz der Thermodynamik b) Isobarer Prozess (p = constant) Bei Wärmezufuhr unter konstantem Druck dehnt sich das Gas aus und verrichtet mechanische Arbeit ∆W = F ∆x = p A ∆x = p ∆V ∆Q = ∆U + p ∆V = cp m ∆T cp: Wärmekapazität eines Gase bei konstantem Druck. • Neue Zustandsgröße: Enthalpie H H = U + p V (Zustandsgröße) dH = dU + p dV + dp V = dU + p dV = dQ ⎛ ∂H ⎞ CP = ⎜ ⎟ ⎝ ∂T ⎠ P Bei isobarer Zustandsänderung ist die Enthalpiezunahme gleich der zugeführten Wärmemenge Zustandsgröße H wird oft verwendet bei Phasenumwandlungen, chemischen Reaktionen oder anderen Prozessen, die mit p = const. ablaufen 10.7 Anwendungen des 1. Hauptsatz der Thermodynamik c) Isothermer Prozess (T = constant) • Weil U ~ T: dU ≡ 0 ! ∆Q = ∆W • dQ = p dV Die von außen dem System zugeführte Wärmemenge dQ wird vollständig in Arbeit dW umgewandelt, die das System wieder nach außen abgibt. • Arbeitsleistung bei isothermer Zustandsänderung (Ausdehnung: d.h. V1 < V2): p ⋅ V = R ⋅ T = const. W =Q= V2 V2 V1 V1 1 V2 ∫ p(V )dV = RT ∫ V dV = RT ln V 1 13 10.7 Anwendungen des 1. Hauptsatz der Thermodynamik c) Isothermer Prozess (T = constant) •Da U ~ T: dU ≡ 0 ! (Innere Energie ändert sich nicht, wohl aber die Energiedichte !!!) p p1 ∆Q = ∆W 1 • dQ = p dV Die von außen dem System zugeführte Wärmemenge dQ wird vollständig in Arbeit dW umgewandelt, die das System wieder nach außen abgibt. 2 p2 V1 V2 W =Q= V V2 • Arbeitsleistung bei isothermer Zustandsänderung (Ausdehnung: d.h. V1 < V2): V2 V 1 dV = RT ln 2 V V1 V1 ∫ p(V )dV = RT ∫ V1 10.7 Anwendungen des 1. Hauptsatz der Thermodynamik d) Adiabatischer Prozess (Q = constant) ∆U = ∆W • dQ ≡ 0 ! • Hierbei findet kein Austausch von Wärmeenergie mit der Umgebung statt ! bei schnellen Änderungen von V, p (Wärmeaustausch hängt nach) bei thermischer Isolation - T Thermische Isolation Luftpumpe 14











