Inhaltsverzeichnis
Werbung

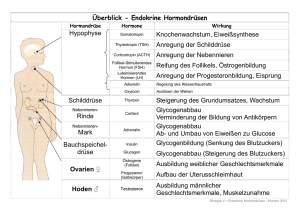
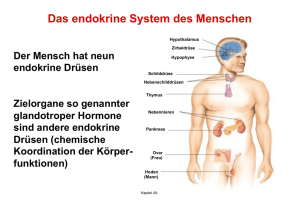
Stoffwechselhormone Universität Ulm WS 2004/2005 Inhaltsverzeichnis 1. Theoretischer Hintergrund.......................................4 1.1. Definition des Begriffs „Hormon“............................4 1.2. Einteilungsmöglichkeiten von Hormonen...............4 a) Einteilung nach der Wirkungsweise b) Einteilung nach Bildungs – und Wirkungsort c)Einteilung nach chemischer Struktur 1.3. Molekulare Wirkungsmechanismen........................5 a) Genaktivierungsprinzip b) Second – messenger – Prinzip 1.4. Hormondrüsen des Menschen.................................9 a) Drüsen und ihre Hormone b) Hierarchie der Hormondrüsen 1.5. Hormone der Insekten.............................................10 1.6. Regulation des Energiestoffwechsels................... a) beim Menschen b) bei Inesekten -1- Stoffwechselhormone 1.7. Definition der „Lucusta-Einheit“............................ 1.8. Aufgabenstellung des Versuchs............................ 2. Material und Methoden............................................ 2.1. Versuch 1: Dosis-Wirkungs-Kurve....................... 2.2. Versuch 2: Zeit-Wirkungs-Kurve............................ 2.3. Präparation der Corpora cardiaca.......................... 3. Ergebnisse................................................................ 3.1. Versuch 1.................................................................. 3.2. Versuch 2.................................................................... 4. Diskussion................................................................. 4.1. Versuch 1................................................................... 4.2. Versuch 2................................................................... 4.3. Vergleich der Nullwerte........................................... 5. Quellenangaben........................................................ -2- Stoffwechselhormone 1. Theoretischer Hintergrund 1.1. Definition des Begriffs "Hormon" Hormone sind chemische Botenstoffe, die die metabolische Aktivität von Zellen Geweben oder Organen beeinflussen. Sie werden von speziellen Drüsen oder Zellen in kleinen Mengen produziert und auf verschiedenen Wegen zu ihren Zielorganen transportiert (Blutbahn, Hämolymphe, Luft). Dort lösen Hormone nach Bindung an einen spezifischen Rezeptor eine bestimmte Reaktion aus. 1.2. Einteilungsmöglichkeiten von Hormonen a) Einteilung nach der Wirkungsweise Kinetisch: Wirkung auf Pigmentwanderung (Melatonin), Muskelkontraktion (Adrenalin) und Drüsensekretion (Releasing-Hormone) Metabolisch: Wirkung auf den Kohlenhydrat – und Proteinhaushalt (Thyroxin, Insulin) und den Elektrolyt – und Wasserhaushalt (ADH, Aldosteron) Morphogenetisch: Wirkung auf Wachstum und Differenzierung, zum Beispiel Allgemeinwachstum (Wachstumshormone), Differenzierung primären der und Metarmophose sekundären (Thyroxin), Geschlechtsmerkmale (Androgene, Östrogene) Verhalten: Wirkung durch Einfluss auf die Nervensystems (Östrogene, Androgene, Progesteron) -3- Funktionsweise des Stoffwechselhormone b) Einteilung nach Bildungs – und Wirkungsort Unterscheidung nach ihrem Bildungsort: Neurohormone: werden von neurosekretorischen Zellen produziert und freigesetzt (hypothalamische Hormone, Neurohypophysenhormone) Glanduläre Hormone: Bildung in speziellen Hormondrüsen, z.B. Schilddrüse, Bauchspeicheldrüse, Nebennieren Aglanduläre Hormone: Produktion durch bestimmte Gewebe mit endokriner Funktion, Wirkung auf direkt benachbartes oder nahe gelegenes Zielgewebe (Prostaglandine, Histamin) Mediatoren: hormonähnliche Stoffe, die von verschiedenen Zellen produziert werden, aber nur eine lokale Wirkung zeigen Unterscheidung nach ihrem Wirkungsort: Autokrin: Hormone, die die sezernierende Zelle selbst beeinflussen Parakrin: Wirkung auf direkt benachbarte Zellen Endokrin: Botenmoleküle werden über die Blutbahn zu weiter entfernt liegendem Gewebe transportiert Spezielfall: wenn die Hormone von Nervenzellen gebildet und in die Blutbahn abgegeben werden, spricht man vom neuroendokrinen System Exokrin: werden aus dem Organismus heraustransportiert (Bsp.: Pheromone) c) Einteilung nach chemischer Struktur Amine (Aminosäureabkömmlinge): lassen sich von Aminosäuren ableiten, Bsp.: Adrenalin, Thyroxin Fettsäureabkömmlinge: cyclisch ungesättigte Fettsäuren, die meistens aus Lipiden der Plasmamembran gebildet werden, Bsp.: Prostaglandin -4- Stoffwechselhormone Steroide: cyclische Kohlenwasserstoffderivate, die aus Cholesterin synthetisiert werden, Bsp.: Östrogen, Testosteron, Cortison Proteo – und Peptidhormone: bestehen aus kurzen oder längeren Aminosäureketten, Bsp.: Insulin, Glukagon, Releasing-Hormone 1.3. Molekulare Wirkungsmechanismen a) Genaktivierungsprinzip Die Genaktivierung kann nur mit Hilfe von lipophilen Hormonen stattfinden, die die Zellmembran der Zielzelle passieren können. Im Cytoplasma bindet das Hormon an seinen spezifischen Rezeptor nach dem Schlüssel-Schloss-Prinzip und bildet einen Hormon–Rezeptor–Komplex. Dieser kann nach einer Konformationsänderung die Kernmembran passieren und so über ein Akzeptormolekül an bestimmte Bereiche der DNA binden. Dort wirkt der Komplex als Transriptionsfaktor und schaltet spezifische Gene an oder aus. Abb. 1: Genaktivierungsprinzip Campbell, Biologie, S.1002, 2.Auflage b) Second – messenger – Prinzip -5- Stoffwechselhormone Im Gegensatz zu den lipophilen Hormonen können hydrophile Hormone die Cytoplasmamembran nicht passieren. Sie wirken über einen intrazellulären Botenstoff, der die jeweiligen Reaktionen in der Zelle in Gang setzt. cAMP Das zyklische Adnosinmonophosphat (cAMP) ist ein Beispiel für ein chemisches Botenmolekül. Die Aktivierung wird nun am Beispiel von Adrenalin erklärt: Das Hormon (first messenger) bindet spezifisch an seinen membranständigen Rezeptor in der jeweiligen Zielzelle. Dadurch entsteht ein Hormon-RezeptorKomplex, der wiederum an ein bestimmtes Membranprotein bindet, ein sogenanntes G–Protein. G–Proteine sind molekulare Überträgerstoffe, die eine aktivierende oder eine hemmende Wirkung ausüben können. Durch die Bindung des G–Proteins mit GTP (Guanintriphosphat) wird ein weiteres Protein, nämlich das Enzym Adenylatcyclase, aktiviert. Die Adenylatcyclase setzt nun ATP zu cAMP um, welches den second messenger darstellt. Im nächsten Schritt beeinflusst cAMP ein weiteres Enzym, die cAMP-abhängige Proteinkinase oder kurz A-Kinase. A-Kinasen bestehen aus einer regulatorischen und einer katabolischen Untereinheit. Sie werden aktiviert, indem cAMP die regulatorische Untereinheit entfernt, woraufhin die katalytische Untereinheit frei wird und anschließend eine Enzymkaskade in Depolymerisation von Glycogen zu Glucose statt. -6- Gang setzt. Nun findet die Stoffwechselhormone Abb. 2: Sekond Messenger Prinzip Campbell, Biologie, S.1003, 2.Auflage Ca2+ Neben den chemischen Botenmolekülen können auch verschiedene andere Substanzen, wie zum Beispiel Calciumionen, für eine Signaltransduktion verantwortlich sein. Wieder bindet das Hormon (first messenger) an seinen spezifischen Membranrezeptor und der Hormon-Rezeptor-Komplex aktiviert ein G-Protein. Das GProtein aktiviert daraufhin das Enzym Phospholipase C, welches Phospholipide in Diacylglycerin (DAG) und Inositoltriphosphat (IP3) spaltet. Beide Stoffe wirken als second messenger. DAG aktiviert das Enzym Proteinkinase C, das durch Phosphorylierung bestimmter Proteine in der Zellmembran seine Wirkung entfaltet. IP3 hingegen bewirkt eine intrazelluläre Erhöhung der Ca2+ - Konzentration, entweder durch Aufnahme aus dem extrazellulären Medium oder durch Freisetzung von Calciumionen aus dem ER. Ca2+ wirkt dabei als third messenger. Die Calciumionen üben ihre Wirkung auf die Zielzelle nun direkt aus oder durch Bindung an das Protein Calmodulin. Ein Beispiel für diesen Mechanismus ist das Hormon Insulin. -7- Stoffwechselhormone 2+ Abb. 3: Wirkung von Ca als Third-messenger Campbell, Biologie, S.2006, 2.Auflage 1.4. Hormondrüsen des Menschen a) Drüsen und ihre Hormone In der folgenden Tabelle sind einige menschliche Hormondrüsen, ihre Hormone und deren Wirkungen aufgelistet. Tabelle 1: menschliche Hormondrüsen Drüse Hormone Wirkungen Adenohypophyse Thyreotropes Hormon (TSH) fördern Bildung und Ausschüttung Corticotropes Hormon (ACTH) der Hormone von Schilddrüse, Luteinisierendes Hormon (LH) Nebennierenrinde, Ovar und Hoden Follikelstimulierendes Hormon (FSH) Neurohypophyse Wachstumshormon (GH) stimuliert das Körperwachstum Vasopressin fördert Wasserrentention der Niere Oxytocin Wirkung auf Uterusmuskulatur -8- Stoffwechselhormone Schilddrüse Pankreas Thyroxin Regulation des Trijodthyronin Grundumsatzes Insulin Regulation des Glukose- Glukagon spiegels im Blut Nebennierenmark Adrenalin und Erhöhung der Leistungsbereitschaft Noradrenalin Nebennierenrinde Clucocorticoide beeinflussen den Kohlenhydratstoffwechsel und die Immunreaktion Mineralocorticoide Regulation des Mineral- und Wasserhaushaltes Eierstock Östrogene Ausbildung der weibl. Geschlechtsmerkmale Gestagene regeln Ovarialzyklus und Schwangerschaft Ausbildung Hoden Androgene der männl. Geschlechtsmerkmale b) Hierarchie der Hormondrüsen Der Hypothalamus bildet die oberste Kontrollinstanz des Drüsensystems des Körpers. Er empfängt Informationen aus allen Teilen des Körpers, vor allem aber von anderen Gehirnregionen. Die hypothalamischen Hormone werden von zwei verschiedenen Sorten von neurosekretorischen Zelle gebildet und dann zur Hypophyse weitergeleitet. Die Hypophyse (Hirnanhangsdrüse) ist die übergeordnete Hormondrüse, da sie andere Hormondrüsen zur Hormonproduktion anregen kann, dabei aber selbst unter hormoneller Kontrolle des Hypothalamus steht. Sie besteht aus zwei getrennten Teilen, der Neurohypophyse und der Adenohypophyse. Die Neurohypophyse ist ein Neurohämalorgan, d.h. die Axone der neurosekretorischen Zellen des Hypothalamus sind so lang, dass sie bis in die Neurohypophyse hineinreichen, wodurch die Hormone direkt übertragen werden -9- Stoffwechselhormone können. Sie dient zur Speicherung und Sekretion der Hormone Adiuretin (ADH) und Oxytocin. Die Adenohypophyse wird durch Releasing-(RH) oder Inhibiting-Hormone (IH) beeinflusst. Diese werden von neurosekretorischen Zellen mit kurzen Axonen produziert und über ein Pfortadersystem zur Adenohypophyse transportiert. Sie regen zur Bildung eigener Hormone an, zum Beispiel die vier tropischen Hormone Thyreotropin (TSH), Adrenocorticotropin (ACTH), Follikel stimulierendes Hormon (FSH) und Luteinisierendes Hormon (LH), die andere Hormondrüsen zur Hormonproduktion anregen, oder das Wachstumshormon. 1.5. Hormone der Insekten Hier sind Hormone für Metamorphose und Häutungszyklen, Fortpflanzung und Diapause zu ständig. Daneben aber auch sowohl zur Regulation des Gehalts an Metaboliten in der Hämolymphe als auch zur Osmoregulation. Die „Hormondrüsen“ (s.Abb.4) lassen sich im Grunde in zwei Gruppen aufteilen, die neurosekretorischen Zellen im Gehirn und die Neurohämalorgane im weiteren Kopfbereich. Abb.4 : Lage der endokrinen Organe bei einem Insekt De Deuterocerebrum; Pr Protocerebrum; Tr Tritocerebrum (aus: Vergleichende Tierphysiologie, Heldmaier/Neuweiler, S. 407, Abb. 9.4) Die neurosekretorischen Zellen sind Nervenzellen, die Hormon produzieren. Diese liegen im Zentralen Nervensystem und sind wie normale Nervenzellen aufgebaut. Zusätzlich besitzen sie aber noch sogenannte neurosekretorische Granula. - 10 - Stoffwechselhormone Das namengebende Neurosekret wird im Zellkörper gebildet und innerhalb der Axone transportiert. Deren verdickten Enden bilden keine Synapsen wie normale Nervenzellen, sondern enden in unmittelbarer Nähe zu den Neurohämalorganen. Die Aufgabe dieser Organe besteht in der Speicherung und Kontrolle der Abgabe des Neurosekrets. Zum Teil kann das Neurosekret aber auch direkt ins Kreislaufsystem (und damit in die Hämolymphe) abgegeben werden. Zu den Neurohämalorganen gehören zum einen die paarig angeordneten Corpora cardiaca. Diese erhalten Neurosekret aus verschiedenen Regionen des Protocerebrums und Tritocerebrums. Zusätzlich enthalten sie Zellen, die selbst endokrine Funktion besitzen und Neurone, die über Axone mit den Corpora allata verbunden sind. Die Corpora allata ist ein herkömmliches endokrines Organ, d.h. die Zellen sind darauf spezialisiert Botenstoffe zu synthetisieren und direkt ins Blut zu sekretieren. Bei diversen Insekten ist die C. allata nicht mehr paarig angeordnet, sondern zu einem einzigen Organ verschmolzen (C. allatum). Das andere wichtige Organ ist die ebenfalls paarige Prothorakaldrüse. Bei stammesgeschichtlich frühen Insekten ist sie eine kompakte endokrine Drüse, die im Bereich des Kopfes liegt. Bei späteren Insekten dagegen liegt sie mehr im Thorax und ist verbreitert. In der nachstehenden Tabelle sind die wichtigsten Hormone und ihre Wirkungen aufgelistet. Tab.2 : Hormone der Insekten Bildungsort Hormon Chem. Wirkung Struktur Neurosekretorische Prothorakotrophes Protein Stimuliert Ecdyson Zellen im Gehirn, Synthese, startet Hormon (PTTH) Ausschüttung über dadurch die Corpora cardiaca Vorbereitung der Häutung Prothorax-Drüse Ecdyson Steroid Häutungshormon, verändert Stoffwechsel der Epidermiszellen - 11 - Stoffwechselhormone Corpora allata Terpenderivat Juvenilhormon Hoher JH-Gehalt erhält Larvalstadien bei der (JH) Häutung, niedriger Titer verursacht Imaginalhäutung Neurosekretorische Adipokinetisches Zellen im Gehirn, Protein Etwa 30 AKH´s bekannt, mobilisieren Hormon (AKH) Ausschüttung aus Speicherlipide, den Corpora Energieversorgung beim cardiaca Flug, gleichzeitig Neurotransmitter, stimuliert lokomotorische Aktivität Motoneurone Protein Proctolin Neuromodulator, steigert Herzfrequenz, Darmmotorik und andere neuronal ausgelöste Muskelkontraktionen Neurosekretische Protein Bursicon Zellen im Gehirn fördert Cuticulaentwicklung, Härten und Gerben der Cuticula nach der Häutung (vor allem nach Imaginal-Häutung 2 Paar Eclosionshormon neurosekretorische (EH) Protein Löst den eigentlichen Schlüpfvorgang aus Zellen im Gehirn 1.6. Regulation des Energiestoffwechsels - 12 - Stoffwechselhormone Der Energiestoffwechsel wird neben anderen Faktoren auch hormonell geregelt. Dabei ist es wichtig, dass die Höhe des Hormonspiegels überwacht und reguliert werden kann. Im einfachsten Falle hemmt oder fördert die Substratkonzentration selbst die Hormonbildung. Weitere Möglichkeiten wurden schon im Abschnitt 1.4. erläutert. a) beim Menschen Chemische Energie kann auf verschiedene Weisen gewonnen werden, aerob oder anaerob, und zwar wird dabei immer aus Nährstoffen ATP produziert. Gärung als Abbau von Zuckermolekülen ohne Sauerstoff wird nur in Ausnahmezuständen genutzt. Dazu zählt die Milchsäuregärung im Muskel, die zu Muskelkater und Muskelerschöpfung führen kann. Dabei wird Pyruvat vom NADH direkt zu Lactat reduziert. Dieses wird später vom Blut zur Leber befördert und in den Zellen wieder zu Pyruvat umgesetzt. Die Milchsäuregärung ist aber auch dahingehend negativ zu bewerten, dass hier nur zwei ATP Moleküle (der universelle Energieüberträger der Zelle) entstehen. Die normale Energiegewinnung ist die unter Sauerstoffverbrauch. Die dabei ablaufenden Prozesse werden Glykolyse, Citratcyclus und Atmungskette genannt und laufen im Mitochondrium ab. Die Glykolyse entspricht der Milchsäuregärung, d. h. auch hier wird Glucose zu Pyruvat oxidiert. Dieses wird dann allerdings im Citratcyclus weiter oxidiert, wodurch die Energie die noch im Pyruvat steckt auch noch für den Körper nutzbar wird. Bei der anschließenden Atmungskette (wozu auch die oxidative Phosphorilierung gehört) wird nun der größte Teil der Energie gewonnen. Denn dabei oxidiert NADH durch Luftsauerstoff und freiwerdende Energie wird zur ATP Synthese eingesetzt. Dabei werden insgesamt pro Molekül Glucose immerhin 36 ATP Moleküle frei (s.Abb.5). - 13 - Stoffwechselhormone Abb.5: Eine Zusammenfassung der Zellatmung (aus: N.A.Campbell; Biologie, S.190, Abb. 9.15) Als Beispiel für antagonistischen Langerhansschen die Regulation Hormone Zellen Insulin des Energiestoffwechsels und ausgeschüttet Glucagon werden. erwähnt, Um den seien die hier von Stoffwechsel die den im Gleichgewicht zu halten, sollte der Blutglucosespiegel bei ungefähr 0,9 mg/ml liegen. Insulin wird ausgeschüttet, sobald der Blutzuckergehalt über diesen Wert steigt. Neben anderen Auswirkungen werden dadurch fast alle Körperzellen, ausgenommen die Gehirnzellen, angeregt Glucose aus dem Blut aufzunehmen. Falls aber der Wert unter diesen Punkt sinkt, wird Glucagon ausgeschüttet und z.B. die Leber angeregt eingelagertes Glycogen abzubauen und als Glucose wieder ins Blut abzugeben. Zur Energiespeicherung wird Glucose nicht nur in der Leber sondern auch in den Muskeln in Form von Glycogen eingelagert, während das Fettgewebe es zu Fett umbaut. b) bei Insekten Die Flugmuskeln der Insekten gewinnen ihre Energie stets aerob. Da die Flugmuskeln selber keine großen Energiereserven speichern können, müssen energiereiche Moleküle von der Hämolymphe geliefert werden. - 14 - Stoffwechselhormone Hierbei kann man zwischen Aminosäuren-, Kohlenhydrat- und Fettfliegern unterscheiden. Das Gewebe mit Speicherkapazität und der entsprechenden Stoffwechselaktivität ist der Fettkörper der Insekten. Nur wenige Arten wie die Tsetse-Fliege Glossina morsitans oder der Kartoffelkäfer Leptinotarsa decemlineata nutzen Aminosäuren (genauer Prolin) als Energielieferant im Flugstoffwechsel. Das Prolin entsteht im Fettkörper durch den Abbau von Fettsäuren bzw. aus Acetyl-CoA, im Citratcyclus unter Beteiligung von Alanin. Danach wird das Prolin über die Hämolymphe in den Flugmuskel transportiert und hier oxidativ abgebaut. Dabei entsteht wieder Alanin, das über die Hämolymphe zurück in den Fettkörper gelangt und damit zur erneuten Synthese von Prolin zur Verfügung gestellt wird. Als Kohlenhydrat-Flieger gelten zum Beispiel die Schmetterlinge. Denn sie haben meist nur kurze Flüge von Blüte zu Blüte zu bewältigen und nehmen dabei zuckerhaltigen Nektar auf. Dieser wird zum Disaccharid Trehalose umgebaut, da dies der Transportzucker in der Hämolymphe ist. In den Flugmuskeln angekommen wird die Trehalose vom Enzym Trehalase zu Glucose abgebaut, so dass in den Muskeln die Glykolyse ablaufen kann. Der von uns betrachtete Fettflieger ist die Wanderheuschrecke Locusta migratoria, die zu den Langstreckenfliegern zählt. Um die Energie dafür aufbringen zu können, wird in den ersten Flugminuten auf schneller verfügbare Energie aus Kohlenhydraten (Trehalose) zurückgegriffen. Der anfängliche Kohlenhydratstoffwechsel wird durch das Aminhormon Octopamin gesteuert und entspricht damit dem blutzuckersteigernden Hormon Adrenalin der Wirbeltiere. Nach 10-20 Minuten übernehmen, zum Ende der ersten Flugphase, Peptidhormone die Regulation des Stoffwechsels und der Energiebereitstellung. Diese werden in der Corpora cardiaca synthetisiert und im hinteren Hirnbereich gespeichert. Über die Verbindung mit dem Nervi Corporis zum Gehirn wird die Exozytose des AKH induziert. Durch die Hämolymphe gelangt es zum Fettkörper und bindet dort an seine Rezeptoren. Wie in Abb. ersichtlich, löst dieser Vorgang in der - 15 - Stoffwechselhormone Zelle, über die second- Messenger cAMP und Ca2+, die Aktivierung der Lipase aus, welche die gespeicherten Triacylglyceride in Diacylglyceride spaltet. Diese Diglyceride werden an der Membranoberfläche des Fettkörpers mit dem (in der Hämolymphe vorhandenen) Transportprotein HDLp und dem Apoprotein ApoLp-III zu einem Transportkomplex zusammengelagert. Dieser ganze Komplex wird als LDLp bezeichnet und übernimmt die Beförderung der Diglyceride zu den Muskelzellen. Dort bindet der Transportkomplex an das membranständige Enzym LipophorinLipase, welche den Abbau katalysiert und dabei die Fettsäuren von Glycerin spaltet. Die Fettsäuren wiederum werden in die Muskelzelle aufgenommen und oxidiert, während die restlichen Bestandteile des Komplexes in der Hämolymphe zurückbleiben und somit wieder der Komplexbildung zur Verfügung stehen. Der Verlauf des Fettstoffwechsels ist in Abb. 6 dargestellt. Abb.6: Die physiologische Steuerung des Fettstoffwechsels AKH Adipokinetisches Hormon; ApoLp-III ApollpophorinIII; CC Corpora cardiaca; DG Diacylglyceride; FFa freie Fettsäuren; HDLp High-Density-Lipophorin; LDLp Low-DensityLipophorin; TG Triacylglyceride (aus: Skript zum Tierphysiologischen Anfängerpraktikum) Die Regulation dieses Stoffwechselprozesses gelingt nur über die Zusammenarbeit aller beteiligten Proteine. So inhibiert freies ApoLp-III in der Hämolymphe zusätzlich die Lipophorin- Lipase, was einen Mindestgehalt an Fett in der Hämolymphe sichert. Der Umstand, dass Fette osmotisch inaktiv speicherbar sind, und beim oxidativen Abbau der Fettsäuren metabolisches Wasser entsteht, führt zu einem geringen Wasserbedarf der Tiere. Außerdem besitzen Fette ein hohes ATP-Äquivalent von - 16 - Stoffwechselhormone 0,65 mol ATP pro g Fett. Diese Fakten sind für Langstreckenflieger von besonderer Bedeutung und Nutzen. 1.7. Definition der „Lucusta-Einheit“ Unter der Lucusta-Einheit versteht man die Menge an AKH, die benötigt wird, um die halbe Fettkonzentration in der Hämolymphe zu erreichen. Diese AKH Menge mobilisiert eine bestimmte Menge Fett in Form von Diglyceriden. 1.8. Aufgabenstellung des Versuchs In diesem Versuch wird untersucht, in wieweit sich das Hormon AKH auf den Fettmetabolismus der Wanderheuschrecke Locusta migratoria auswirkt. Dies wird anhand der Abhängigkeit von der Zeit und der Dosis auf die Fettkonzentration der Hämolymphe analysiert. Außerdem werden am Ende aus sieben Wanderheuschrecken die Corpora cardiaca´s herauspräpariert, damit ein Corpora cardiaca Aliquot für die nächste Gruppe bereit steht. 2. Material und Methoden 2.1. Versuch 1: Dosis-Wirkungs-Kurve Vor Versuchsbeginn wurde vier Wanderheuschrecken (Locusta migratoria) je 5µl einer unterschiedlich hoch konzentrierten Lösung eines Corpora cardiaca Extraktes, welches das adipokinetische Hormon (AKH) enthält, von der Betreuerin injiziert. Dafür wurden sieben Corpora cardiaca aus dem Versuch der vorherigen Woche verwendet und mit Wasser verdünnt, damit man die Mengen von 0,009, 0,0175, 0,035 und 0,07 als Anteile der extrahierten Hormondüsen bekommt. Außerdem wird einem Tier als Blindwert 5µl bidestilliertes H20 injiziert. - 17 - Stoffwechselhormone 60 Minuten nach der Injektion wird dem Tier Hämolymphe entnommen, um den darin vorhandenen Fettgehalt zu bestimmen. Hierfür wird das Tier auf den Rücken gelegt, festgehalten und der Kopf mit einer Pipettenspitze nach hinten gehalten. An der Übergansregion von Caput und Thorax, an der der Chitinpanzer sehr dünn ist, wird die Wanderheuschrecke mit einem Skalpell perforiert. Durch Ausübung von Druck auf den Thorax bildet sich an der angeschnittenen Stelle eine Tropfen Hämolymphe, der dann abpipettiert Doppelbestimmung werden zweimal kann. 10µl Hierbei Hämolymphe werden jedem entnommen, Tier wobei zur darauf aufgepasst werden muss, dass keine Fettzellen aus dem nahe liegende Fettkörper mit aufgenommen werden. Die entnommene Hämolymphe wird zu je 1ml Isopropanol gegeben und sofort mit Hilfe eines Rüttlers gemischt. Ebenfalls werden ein Triglycerid-Standard (Triolein, 3mg/ml), ein Diglycerid- Standard (Dipalmitin, 3mg/ml) und reines Wasser als Leerwert mit je 1ml Isopropanol vermischt (Pipettierschema siehe Tabelle 3). Tabelle 3: Pipettierschema zur Dosis-Wirkungs-Kurve Isopropanol Hämolymphe Probe 1ml 10µl Standard 1ml Leerwert 1ml Standard H20 10µl 10µl Zu jeder Probe werden nun 200µl Kalilauge (KOH) gegeben, mit dem Rüttler vermischt und in einem Wasserbad 5 Minuten bei 60°C inkubiert. Hierbei reagieren die Di- und Triglyceride mit dem KOH zu Glycerin und Fettsäuren. Um die Reaktion zu stoppen, werden die Reagenzien in Eis abgekühlt. Anschließend wird zu jeder Probe 200µl Natriumperjodad hinzugefügt, geschüttelt und 10 min bei Raumtemperatur stehen gelassen. Dabei wird das Glycerin durch Natriumperjodad in Formaldehyd gespalten. Zuletzt pipettiert man die Farbreagenz (NH4+ und Acetylaceton) in jedes Reagenzglas, vermischt den Inhalt im Rüttler, setzt Glaskugel auf die Reagenzgläser und inkubiert sie eine halbe Stunde bei 60°C. Dadurch reagiert das Formaldehyd zu Diacetyldihydrolutidin, wodurch eine Farbveränderung (gelb) auftritt. - 18 - Stoffwechselhormone Die entstandenen Lösungen werden nun in Küvetten umgeschüttet und bei 410nm photometriert, wobei die Extinktion gemessen wird. 2.2. Versuch 2: Zeit-Wirkungs-Kurve Fünf Wanderheuschrecken wurden vor dem Versuch eine Menge von 0,07 Rohextrakt der Corpora cardiaca von der Betreuerin injiziert. Nach unterschiedlichen Zeiten (10min, 30min, 60min, 90min und 120min) wird dann Hämolymphe entnommen und der jeweilige Fettgehalt, wie in Versuch 1 beschrieben, bestimmt. Außerdem wird der Fettgehalt der Hämolymphe eines Ruhetiers, welchem nichts injiziert wurde, untersucht. 2.3. Präparation der Corpora cardiaca Die Corpora cardiaca wird aus den Köpfen von 7 Wanderheuschrecken unter dem Stereobinocular präpariert, welche davor vom restlichen Körper abgetrennt wurden. Die Hormondrüse ist halbmonförmig und liegt dorsal hinter dem Gehirn, hinter den Mundwerkzeugen und Oberschlundganglion. Die sieben Drüsen werden in reinem Wasser homogenisiert, so dass das Gewebe aufgeschlossen wird und in Eppendorfgefäße gegeben. Dann wird nochmals homogenisiert, wobei als Lösungsmittel Methanol verwendet wird und wieder in Eppendorfgefäße umgefüllt. Diese werden dann in einer Biofuge 5min bei 13000U zentrifugiert. Der Überstand wird abgenommen und über Nacht eingeengt, so dass das für Insekten schädliche Methanol verdampfen kann. Das gewonnene Rohextrakt der Corpora cardiaca kann dann von dem nächsten Kurs verwendet werden. 3. Ergebnisse 3.1. Versuch 1 Um die Konzentration der Lösungen berechnen zu können, wird zuerst der Absorptionskoeffizient ε mit Hilfe des Lambert-Beerschen-Gesetztes berechnet, das wie folgt lautet: ∆E=c*d*ε ε= ∆E d*c - 19 - Stoffwechselhormone Dieses Gesetz besagt, dass die Extinktion ∆E der Konzentration c des absorbierenden Stoffes und der Schichtdicke d der Lösung proportional ist. Der Absorptionskoeffizient ist ε, er ist abhängig von der Art der Substanz und der Wellenlänge. Da die Konzentration der Standardlösungen bekannt ist, kann man somit ε, wie in Tabelle 4 gezeigt ist, berechnen. Tabelle 4: Berechnung von ε aus den Standards Standard 1 Extinktion 1 Extinktion 2 Mittelwert Konzen- ε in [ml* ∆E1 ∆E2 ∆E tration c cm-1*mg-1] 0,198 0,175 0,1865 3mg/ml 0,0622 0,117 0,202 *1 0,117 3mg/ml 0,039 Dipalmitin Standard 2 Triolein 1 * Da dieser Wert zu hoch ist, wurde er in unseren Berechnungen nicht berücksichtigt. Nun kann man ebenfalls mit dem Lambert-Beerschen-Gesetz die Konzentrationen der einzelnen Lösungen berechnen: c= ∆E d*ε Hierfür wird für die Fettkonzentration cA der Absorptionskoeffizient ε1 des DipalmitinStandards verwendet und für die Fettkonzentration cB der des Tripalmitin-Standards (ε2). Die berechneten Werte werden in Tabelle 5 gezeigt. Tabelle 5: Ergebnisse des Dosis-Wirkungs-Versuches Injizierte Extinktion 1 Extinktion 2 Mittelwert Fettkonzen- Fettkonzen- Dosis ∆E1 ∆E2 ∆E tration cA tration cB Bidest. H20 0,439 0,465 0,452 7,271 11,589 0,009 0,787 0,492 *1 0,787 12,659 20,180 0,0175 0,975 0,845 0,91 14,638 23,333 0,035 0,927 1,073 1 16,086 25,641 0,07 0,675 0,706 0,6905 11,107 17,705 Die Fettkonzentration cA in mg/ml gegen die Dosis, die dem Tier injiziert wurde, aufgetragen ergibt die Kurve in Graphik 1. Es wurde hierfür nur die Fettkonzentration cA verwendet, also nur die Werte, die mit Hilfe des Dipalmitin-Standards berechnet - 20 - Stoffwechselhormone wurden. Da die Fettkonzentration cB denselben Kurvenverlauf, nur etwas verzerrt ergeben würde. (Weitere Begründung siehe Diskussion.) Graphik 1: Dosis-Wirkungs-Kurve 3.2. Versuch 2 Es wird, analog zu Versuch 1 die Konzentrationen der einzelnen Lösungen nach Lambert-Beer berechnet. Dies ergibt die Tabelle 6: Tabelle 6: Ergebnisse des Zeit-Wirkungs-Versuches Zeit Extinktion 1 Extinktion 2 Mittelwert Fettkonzen- Fettkonzen- ∆E1 ∆E2 ∆E tration cA tration cB Ruhetier 0,370 0,466 0,418 6,724 10,718 10 min 0,697 0,665 0,681 10,954 17,462 30 min 0,880 0,991 0,9355 15,048 23, 987 60 min *1 *1 *1 *1 *1 90 min 1,120 0,787 0,9535 15,338 24,449 120 min 1,181 1,336 1,2585 20,244 32,269 1 * Da aus diesem Versuchstier keine Hämolymphe gewonnen werden konnte, konnten diese Werte nicht berechnet werden. - 21 - Stoffwechselhormone Die Fettkonzentration cA gegen die Zeit aufgetragen, ergibt die Graphik 2: Graphik 2: Zeit-Wirkungs-Kurve 4. Diskussion Bei beiden Versuchen wurden die Ergebnisse mit dem Absorptionskoeffizienten des Dipalmitin-Standards berechnet, da in den Wanderheuschrecken Diglyceride und nicht Triglyceride zur eigentlichen Energiegewinnung gespalten werden. Da Triolein der gängigere Standard ist und deshalb Verwechslungsgefahr besteht, wurde er in unseren Versuch miteinbezogen. Die höheren Fettkonzentrationen bei Triolein als Standard lassen sich dadurch erklären, dass bei selber Menge verhältnismäßig weniger Glycerinmoleküle enthalten sind, was bewirkt, dass weniger Farbstoff gebildet wird, also die Extinktion geringer ist. Dies hat zur Folge, dass der Extinktionskoeffizient ε2 niedriger ist als ε1, und somit bei der Berechnung der Fettkonzentrationen höhere Werte für cB als für cA zustande kommen. - 22 - Stoffwechselhormone 4.1. Versuch 1 Bei dem Dosis-Wirkungsversuch wäre eine Sättigungskurve, die sich asymptotisch einem Grenzwert nähert zu erwarten. Wenn weniger ADH - Hormone als Rezeptoren am Fettkörper vorhanden sind, steigt die Fettkonzentration durch Erhöhung der Hormonkonzentration an. Sind alle Rezeptoren mit Hormonen besetzt, kann trotz Erhöhung der ADH Konzentration nicht mehr Hormon gebunden werden. Es können also nicht mehr Triglyceride in Diglyceride gespalten werden und dadurch hat auch die Menge an Glycerin in der Hämolymphe auf einem konstant hohen Niveau erreicht. Die Messwerte für Bidest. Wasser und für die Corpora cardiaca Äquivalente von 0,009, 0,0175 sowie 0,035 entsprechen diesen Erwartungen. Der Messwert für das Corpora cardiaca Äquivalent von 0,07 ist deutlich zu niedrig, dadurch sinkt die Kurve stark ab, anstatt ein Plateau bei konstantem Wert zu bilden. Gründe für die zu niedrige Fettkonzentration könnten sein: Beim Pipettieren der Hämolymphe sind versehentlich Luftblasen entstanden, so dass nur eine verringerte Menge an Hämolymphe untersucht werden konnte. Es können Variationen bei der Hormonkonzentration auftreten, da kein reines AKH verwendet wurde, sondern nur das Äquivalent aus der Corpora cardiaca. Meint ihr hiermit Schwankungen innerhalb der Probe, weil die Lösung nicht homogen war? Schwankungen zwischen den einzelnen Konzentrationen (0,07, 0,035 usw.) können nicht auftreten, da es sich immer um eine 1:2 Verdünnung handelte. Es könnten also nur Fehler auftreten, wenn ich die Probe vor der Weiterverdünnung nicht richtig vermischt habe. Die Verwendung von reinem AKH würde an dieser Fehlerquelle aber auch nichts ändern. Das Versuchstier könnte aufgrund der Haltung in einer kleinen Box nervös geworden sein und versucht haben zu fliehen, was einen deutlich höheren Fettumsatz zur Folge hat. Somit wäre nur noch eine geringe Menge an Glycerin im Körper vorhanden und damit nachweisbar. - 23 - Stoffwechselhormone 4.2. Versuch 2 Bei dem Dosis-Zeit-Versuch wäre für die Fettkonzentration in Abhängigkeit von der Zeit eine Glockenkurve zu erwarten, was bedeutet, dass die Kurve relativ steil ansteigt, dann einen Höhepunkt erreicht und anschließend wieder abfällt. Der Hochpunkt wäre ungefähr bei der Zeit 60min zu erwarten. Die injizierte Menge an Corpora cardiaca bzw. ADH war bei allen Versuchstieren gleich hoch bei 0,07. Somit kann also eine maximale Sättigung wie im Versuch vorher gezeigt, erreicht werden. Die am Anfang sehr niedrige Fettkonzentration, die dann ansteigt, bedeutet, dass es eine gewisse Zeit dauert, bis das Hormon seinem Wirkungsort erreicht und bis die Fette gespalten sind, so dass Glycerin nachgewiesen werden kann. Nach ca. 60 min ist das Optimum der Fettkonzentration erreicht, das bedeutet, dass eine maximale Anzahl von ADH-Molekülen den Fettkörper erreicht haben. Dies bewirkt, dass sich ein Gleichgewicht zwischen den Molekülen, die den Fettkörper erreichen und dann wieder in diesem abgebaut werden, einstellt. Da das ADH nach einer gewissen Zeit enzymatische abgebaut wird, sinkt die Fettkonzentration folglich. Die Messwerte der Fettkonzentration beim Ruhetier und bei den Tieren, bei denen die Hämolymphe-Abnahme nach 10min, 30min und 90min erfolgte entsprechen unseren gerade genannten Vermutungen. Da dem 60 min Tier keine Hämolymphe entnommen werden konnte, ist in unserer Kurve kein Optimum vorhanden. Wir vermuten, dass nach 60min die Fettkonzentration bei ca. 19-20mg/ml liegt. Die nach 120min gemessene Fettkonzentration ist viel zu hoch, da die Kurve zu diesem Zeitpunkt nicht wie bei uns steigen, sondern schon abfallen sollte. Die Gründe für den zu hohen Messwert können folgende sein: Bei der Entnahme von Hämolymphe könnte der Fettkörper mit angestochen worden sein, so dass daraus zusätzlich Fett in unsere Probe gelangen konnte. Wahrscheinlicher hingegen ist, dass das Versuchstier kurz vor der Hämolymphe-Entnahme unter Stress gelitten hat und so selbst eine hohe Konzentration an AKH ausgeschüttet hat, wodurch zusätzlich Diglyceride entstanden und gespalten wurden. - 24 - Stoffwechselhormone Es wäre auch möglich, dass unser Versuchstier lethargisch war und sich überhaupt nicht bewegt hat, so dass kein Fett bis zur Entnahme verbraucht wurde. Allgemein sind die gemessenen Werte nicht unbedingt zuverlässig und repräsentativ, da wir jeweils nur einem Tier Hämolymphe entnommen haben und da jede Messung nur zweifach durchgeführt wurde. Um eine repräsentative Statistik zu bekommen, müsste man die Versuche viel häufiger durchführen, wodurch exaktere Mittelwerte entstehen würden und somit abweichende Werte sicherer als Ausreißer erkannt werden können. 4.3. Vergleich der Nullwerte Zum Abgleichen wurde einmal ein Ruhetier verwendet, das andere Mal ein Tier, dem bidest. Wasser injiziert wurde. Dieses Tier steht unter demselben Stress durch die Injektion, wie die anderen Versuchstiere. Das Ruhetier war diesem Stress nicht ausgesetzt, ist also in dieser Hinsicht nicht ganz so repräsentativ. Da aber durch die Wasserinjektion die Hämolymphe verdünnt wurde, wodurch der Fettgehalt in der entnommenen Hämolymphe erniedrigt wird. Allgemein ist es schwer die beiden Tiere zu vergleichen, da sie unter unterschiedlichen Bedingungen leben mussten und jedes Tier sich anders auf Stress reagiert. 5.Quellenangaben 1. Versuchsskript „Kurs Stoffwechselhormone“, Anfängerpraktikum Tierphysiologie, WS 2004/5 2. Zoologie Wehner Gering, Thieme Verlag, 23.Auflage, 1995 3. Biologie, Campbell, Spektrum Akademischer Verlag, 2.Auflage, 2000 4. Tierphysiologie, Eckert, Thieme Verlag, 4.Auflage, 2002 5. Penzlin H.; Lehrbuch der Tierphysiologie, 4. Auflage, 1989 6. Heldmaier/Neuweiler; Vergleichende Tierphysiologie, 2004 - 25 -