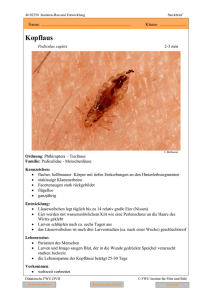
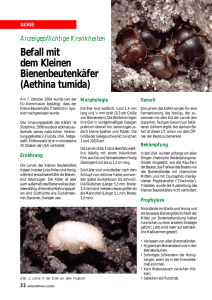
in Anopheles gambiae
Werbung

Aus dem Institut für Zoologie, Professur für Spezielle Zoologie/Parasitologie Der Technischen Universität Dresden Diplomarbeit Etablierung von Biotests und biochemischen Methoden zur Charakterisierung metabolischer Insektizidresistenz in Anopheles gambiae (Diptera: Culicidae). eingereicht von: Sacha Hanig (Matrikel Nr. 2956200) Dresden, 14.03.2008 Die wissenschaftliche Betreuung dieser Arbeit hatte Herr Prof. Dr. Rolf Entzeroth und Frau Dr. Natascha Rauch. „Fortuna lächelt, doch mag sie N ur ungern voll beglücken; Schenkt sie uns einen Som mertag, So schenkt sie uns auch M ücken.“ Wilhelm Busch II Inhaltsverzeichnis Abkürzungen V Danksagung VII I. Einleitung 1 I.1 Mücken als Krankheitsüberträger 1 I.1.1 Malaria 1 I.2 Systematik, Taxonomie und Biologie von Anopheles gambiae 3 I.3 Insektizide und Vektorbekämpfung 5 I.4 Insektizid-Resistenz 7 I.4.1 Target-Site-Resistance 7 I.4.2 Metabolische Resistenz 8 I.4.2.1 Carboxylesterasen (EC 3.1.1.1) 8 I.4.2.2 Glutathion-S-Transferasen (EC 2.5.1.18) 8 I.4.2.3 Monooxygenasen (EC1.14.-.-) 9 I.5 Zielstellung 10 II. Material & Methoden 11 II.1 verwendete Chemikalien 11 II.1.1 verwendete Insektizide 12 II.1.2 verwendete Puffer für Enzymtests 13 II.2 Mückenzucht 14 II.3 Biotests 16 II.3.1 Larvenbiotest 16 II.3.2 Biotest adulter Mücken 16 II.4 Enzymtests 18 II.4.1 Carboxylesterase-Test 18 II.4.2 Native Polyacrylamidgelelektrophorese mit Aktivitätsfärbung der 19 Esterasen II.4.3 Glutathion-S-Transferase (CDNB-Test) 21 II.4.4 Glutathion-S-Transferase (MCB-Test) 22 II.4.5 Monooxygenase-Test 23 II.4.6 Peroxidasen (ABTS-Test) 24 III. Ergebnisse 25 III.1 Mückenzucht 25 III III.2 Biotests 26 III.2.1 Larvenbiotests 26 III.2.2 Biotests adulter Tiere 29 III.3 Enzymtests 31 III.3.1 Proteinbestimmung 31 III.3.2 Carboxylesterasen 31 III.3.2.1 Einfluss des Homogenisationspuffers auf die Esteraseaktivität 33 III.3.2.2 Esteraseaktivität der beiden Stämme im Vergleich 34 III.3.3 Glutathion-S-Transferasen (CDNB-Test) 35 III.3.4 Glutathion-S-Transferasen (MCB-Test) 42 III.3.5 Monooxygenasen 44 III.3.6 Peroxidasen 48 IV. Diskussion 49 IV.1 Mückenzucht 49 IV.2 Biotests 52 IV.3 Enzymtests 55 IV.3.1 Carboxylesterasen 56 IV.3.2 Glutathion-S-Transferasen 58 IV.3.3 Oxidasen 60 V. Zusammenfassung 65 VI. Literatur 67 Selbständigkeitserklärung 77 IV Abkürzungen Abb. Abbildung ABTS 2,2'-Azinobis-(3-ethylbenzthiazolin-6-sulfonsäure) AChE Acetylcholinesterase APS Ammoniumpersulfat BSA Bovine Serum Albumin bspw. beispielsweise CHAPS CDC CDNB 3-[(3-Cholamidopropyl) dimethylammonio]-1propansulfonat Center for Disease Control and Prevention 1-Chloro-2,4-dinitrobenzene; 1-Chlor-2,4-dinitro-benzol cm Zentimeter d Tag(e) DDT Dichlordiphenyltrichlorethan DTT 1,4-Dithio-DL-threit(ol) dest. H2O destilliertes Wasser DMSO Dimethylsulfoxid EDTA Ethylenamintetraessigsäure f.v. final volume g Gramm GSH red. L-Glutathion reduzierte Form GSH ox. L-Glutathion oxidierte Form GST Glutathion S-Transferase h Stunde(n) HEPES 2-(4-(2-Hydroxyethyl)-1-piperazinyl)-ethansulfonsäure IRAC Insecticide Resistance Action Committee kDa kiloDalton kdr Knock Down Resistance KISUMU LC50 M insektizidsensibler Laborstamm von Anopheles gambiae (stammt ursprünglich aus Kisumu, Kenia) Letale Konzentration, bei der 50 % der untersuchten Individuen in einer definierten Zeit sterben mol/Liter V MCB Monochlorobiman mg Milligramm ml Milliliter min Minute(n) MO Monooxygenase mU Milli-Unit (spezifische Aktivität) n Anzahl NADPH Nicotinsäure-Amid-Adenin-Dinukleotid-Phosphat Na/K-PP Natrium/Kalium-Phosphatpuffer nm Nanometer ng Nanogramm n.u.Z. nach unserer Zeitrechnung OP Organophosphat PAGE Polyacrylamidgelelektrophorese PBS phophate buffered saline RF Resistenzfaktor RSP reduced susceptibility to permethrin, Anopheles gambiae Laborstamm sec Sekunde(n) Tab. Tabelle TÄ Tieräquivalent(e) TEMED Tetramethylethylendiamin TRIS Tris(hydroxymethyl)-aminomethan v.u.Z. vor unserer Zeitrechnung WHO World Health Organisation xg Vielfaches des Fallgeschwindigkeit z.B. zum Beispiel µl Mikroliter VI Danksagung An dieser Stelle möchte ich Prof. Dr. Rolf Entzeroth, für die Möglichkeit meine Diplomarbeit am Institut für spezielle Zoologie und Parasitologie machen zu können, danken. Außerdem danke ich ihm für seine stetig interessierte Diskussionsbereitschaft und sehr gute Betreuung. Mein besonderer Dank gilt Frau Dr. Natascha Rauch für ihre immer freundliche und sehr gute Betreuung, ihre ausdauernde Hilfe, wenn Probleme auftraten oder am Wochenende die Mückenzucht betreut werden musste. Außerdem natürlich Dank für unzählige Besprechungen, Telefonate (meist außerhalb der Arbeitszeit) und Ratschläge, die mich immer einen Schritt weiter gebracht haben und mich stets vor all zu großer Verzweiflung retteten. Vor allem meiner Frau möchte ich für ihre aufopfernde Rückendeckung und ihr Verständnis danken, ohne dies wäre die Arbeit nicht möglich gewesen. Meinen Kindern danke ich für ihre meist ansteckend gute Laune und meiner ganzen Familie dafür, dass sie oft mehr an mich geglaubt hat als ich selbst. Ich möchte ausdrücklich Herrn Dr. Tobias Wage danken, der mich mit seinem Sinn für Genauigkeit vor allzu gewagten Thesen und Formulierungen bewahrt hat und der mir trotz seiner knapp bemessenen Zeit immer mit Rat und Tat zur Seite stand. Weiterhin danke ich den Mitarbeitern von Bayer CropScience für eine Kooperation, die keine Wünsche offen ließ und immer netten Telefonaten. Ich danke Herrn Prof. Dr. Walter A. Maier, der während seines leider viel zu kurzen Besuches für Motivation und viele gute Ratschläge sorgte. Nicht zuletzt bedanke ich mich bei allen Mitarbeitern der Fachrichtung für Hilfsbereitschaft beim Korrekturlesen, bei allen für die Laborarbeit wichtigen Belangen und so manches Kaffeetrinken mit angeregten Diskussionen, aus denen nicht selten neue Perspektiven erwuchsen VII I. Einleitung I.1 Mücken als Krankheitsüberträger Schon vor fast 300 Jahren schrieb Carl von Linné über Stechmücken: „Ich möchte glauben, daß diese Art nirgends auf der Erde in so unermeßlicher Menge auftritt wie in den Wäldern Lapplands, wo sie ihrer Zahl nach mit dem Staub der Erde wetteifert.“ (BERNERTH & TOBIAS, 1997). Jeder, der schon einmal im Sommer nördlich des Polarkreises unterwegs war, wird dies sicher bestätigen können. Meist kann man bei Aufenthalten in diesen Gebieten die Zahl der juckenden Stiche kaum noch zählen. Doch auch wenn heute Stechmücken für Mittel- und Nordeuropäer als Plagegeister bekannt sind, so kommt ihnen weltweit eine noch viel größere Bedeutung als Krankheitsüberträger zu. Warum gerade Stechmücken (Culicidae) unter allen Insekten, die Krankheiten übertragen, so wichtig für die Wissenschaft sind, wird klar, wenn man sich einen Überblick über diese Krankheiten verschafft. Dabei sind Mücken sowohl für den Menschen als auch für Tiere ausgesprochen gefährliche Vektoren. Die humanmedizinisch wichtigsten Krankheiten, denen Culiciden als Überträger dienen, sind: Malaria (CATTERUCCIA, 2007; CUAMBA et al., 2006; SHARP et al., 2007; TUTEJA, 2007), lymphatische Filariose (DAS & SUBRAMANIAN, 2002; MAK, 1987; PAILY et al., 2006), Rift-Valley-Fieber, West-Nil-Virus (DIALLO et al., 2005), Dengue-Fieber und Gelb-Fieber (BROGDON, 1998a). Einen sehr guten Überblick zu diesen und weiteren potentiell übertragbaren Krankheitserregern, sowie zu endemischen Stechmücken, findet man speziell für Deutschland im Forschungsbericht 200 61 218/11 des Umweltbundesamtes (MAIER et al., 2003) oder auch bei HEMMER et al. (2007). I.1.1 Malaria Unter den übertragbaren Erregern sind neben potenten Viren vor allem die einzelligen Parasiten aus der Gattung Plasmodium hervorzuheben, da sie die Erreger der Malaria sind. Das aus dem Italienischen stammende Wort Malaria („mala aria“) bedeutet „schlechte Luft“. Schon der griechische Arzt Hippokrates (460-377 v.u.Z.) brachte das Auftreten der Fieberkrankheit mit Sumpfgebieten in Zusammenhang, erkannte aber seiner Zeit nicht die Verbindung der Krankheit zu deren Überträgern, den Mücken. So hielt sich lange die Vorstellung, dass abgestandenes Wasser oder faulig riechende Luft für die Erkrankung verantwortlich wäre. Auch in Europa war Malaria, vor allem durch den Erreger Plasmodium vivax, weit verbreitet (DOBSON, 1989; DOBSON, 1994; SERANDOUR et al., 2007). Der berühmte Dichter und Schriftsteller Friedrich Schiller erwarb auf einer Reise nach Mannheim im Jahre 1783 eine Malaria und kämpfte anschließend mit vielen Rückfällen (KLIMM, 2002). 1 Historiker glauben gar, dass ganze Schlachten von dieser Krankheit geschlagen wurden. So wurde (410 n.u.Z.) das Heer der Goten, unter Führung von König Alarich, vor Rom fast durch Malaria aufgerieben. Um die belagerte Stadt von der Wasserzufuhr abzuschneiden, hatten sie die Aquädukte zerstört und das Wasser versumpfte die Felder. Die resultierende Mückenplage brachte schließlich Fieber und Schwäche über die Belagerer (MARTINI, 1933). Selbst Alexander der Große (356-326 v.u.Z.) und ein Großteil seines Heeres sollen an Malaria gestorben sein. Hier allerdings wird sehr kontrovers diskutiert, denn auch das West-Nil-Virus könnte dafür in Frage kommen (MARR & CALISHER, 2003). Für die Bedeutung der Culiciden allerdings spielt dies keine Rolle, denn beide Krankheiten werden von diesen Vektoren übertragen. Im Zuge des derzeitig vermuteten Klimawandels könnten Stechmücken als Krankheitsüberträger auch in Europa wieder zunehmend eine Rolle spielen (EPSTEIN, 2000; HEMMER et al., 2007; KHASNIS & NETTLEMAN, 2005; MAIER et al., 2003). Bis 1955 kam Malaria auch in den Küstengebieten Deutschlands vor. Trockenlegung von Sümpfen und Feuchtgebieten, bessere Wohnverhältnisse, weniger Mückenkontakt, gute Diagnostik und vor allem Behandlungsmöglichkeiten haben in den Industrieländern zur Verdrängung der Malaria geführt (HEMMER et al., 2007; MAIER, 2004). Derzeit ist die Krankheit fast ausschließlich ein Problem der armen Regionen Lateinamerikas, Asiens und vor allem Afrikas. Malaria ist weltweit die bedeutendste von Insekten übertragene Krankheit (TUTEJA, 2007). Jährlich sterben über eine Million Menschen an den Folgen einer Malariainfektion. Bis zu 500 Millionen Erkrankungen, verursacht durch Plasmodium spec., werden jedes Jahr erfasst. Bei neun von zehn Kindern unter fünf Jahren, die im subsaharischen Afrika sterben, ist Malaria die Todesursache (WHO, 2005). Der in Afrika wichtigste Überträger von Malaria ist Anopheles gambiae. Der Fokus der Wissenschaft liegt vor allem deshalb auf dem afrikanischen Kontinent, da mehr als 80 % der weltweit durch Malaria verursachten Todesfälle dort zu finden sind. Afrika zählt über 70 % aller Fälle der weltweit durch Plasmodium falciparum verursachten Malariaerkrankungen. Plasmodium falciparum ist der Erreger der so genannten „Malaria Tropica“, der gefährlichsten und tödlichsten Form dieser Krankheit. (CATTERUCCIA, 2007; TUTEJA, 2007; WHO, 2005). Man geht davon aus, dass die jährlichen Kosten der Malariabekämpfung allein für den betroffenen afrikanischen Raum 1,7 bis 2,2 Milliarden US-Dollar betragen werden. Im Zeitraum von 2006 bis 2015 rechnet man weltweit mit Kosten von 38 bis 45 Milliarden USDollar (KISZEWSKI et al., 2007). Die nach wie vor hohe Mortalität und der erhebliche 2 finanzielle Aufwand zeigen die Relevanz und Aktualität des Problems „Malaria“ sehr deutlich. Neben der Entwicklung von Behandlungsmethoden gegen die Malariaerreger Plasmodium spec. selbst, gewinnt auch die Vektorbekämpfung zunehmend an größerer Bedeutung. I.2 Systematik, Taxonomie und Biologie von Anopheles gambiae Die Mücken der Gattung Anopheles sind Zweiflügler (Diptera) und haben einen holometabolen Lebenszyklus. Sie gehören zu den Nematocera (SCHINER, 1862), den Mücken im engeren Sinn. Typisch für die Männchen dieser systematischen Gruppe sind die mindestens sechsgliedrigen buschig behaarten Antennen. Die im Wasser lebenden Larven besitzen eine feste Kopfkapsel und haben stark ausgeprägte Mandibeln. Anopheles wird weiter in die Familie der Culicidae eingeordnet. Andere Gattungen der Culiciden sind Aedes, Culex, Mansonia und Cukisetta. Allen Weibchen der Culiciden gemein ist das Blutsaugen mittels ihres Stechrüssels. Die Antennen der Weibchen besitzen stets 15 Glieder (MEHLHORN & PIEKARSKI, 1998). Männchen und Weibchen der Gattung Anopheles sind leicht durch die Struktur ihrer Antennen zu unterscheiden (Abb.1 und Abb.2). Die adulten männlichen Tiere können an den stark gefiederten Fühlern erkannt werden, außerdem fällt das deutlich verdickte zweite Antennen-Grundglied, der Pedicellus auf (Abb.I.2.1). Der Pedicellus trägt bis zu 30000 Sinneszellen und dient als Hör- und Schweresinnesorgan. Abb.I.2.1: Anopheles gambiae Männchen (Rasterelektronenmikroskopisches Bild, Markus Gensch & Sacha Hanig TU-Dresden) Abb.I.2.2: Anopheles gambiae Weibchen (Rasterelektronenmikroskopisches Bild, Markus Gensch & Sacha Hanig TU-Dresden) Dieser Wahrnehmungsapparat ermöglicht es den Anopheles-Männchen die artspezifische Frequenz des Flügelschlages ihrer Weibchen zu hören. Vor allem für im gleichen Lebensraum 3 (sympatrisch) vorkommende, nahe verwandte Arten ist dies wichtig, damit z.B. keine potentiell unfruchtbaren Hybriden entstehen (BROGDON, 1998b). Die Männchen der Gattung Anopheles finden sich zur Paarung über kontrastierten Geländemarken (meist Wasserflächen) zu großen Schwärmen zusammen. Die Weibchen werden vom optisch weithin wahrnehmbaren Schwarm angelockt. Fliegt ein artzugehöriges Weibchen in den Schwarm, so wird es von einem Männchen ergriffen, und das Paar verlässt zur Kopula den Schwarm (BERNERTH & TOBIAS, 1997). Die Paarung dauert meist nur Sekunden und findet im Flug statt. Ist ein Weibchen besamt, so speichert es den aufgenommenen Samen im Receptaculum seminis und paart sich, nach bisherigem Wissen, kein zweites Mal. Spätestens drei bis sechs Tage nach der Befruchtung wird eine Blutmahlzeit aufgenommen, die zur Entwicklung und Reifung der Eier obligatorisch ist. Nicht selten werden dazu mehr als drei Kilometer Flugstrecke zurückgelegt (PAGES et al., 2007). Anopheles-Eier besitzen Wasseroberfläche in laterale stillen Schwimmkörper Seichtwasserzonen und oder werden einzeln strömungsgeschützt auf der zwischen Wasserpflanzen abgelegt. Der Schlupf der Larven erfolgt nach wenigen Tagen. Selbst wenn die Larven in ausgetrockneten Randbereichen von Gewässern schlüpfen, können sie über kurze Strecken ins Wasser gelangen (KOENRAADT et al., 2003). Die Larvenentwicklung ist stark von der Wassertemperatur abhängig. Bei einer Temperatur von 22 °C dauert die Entwicklung vom Ei zur Puppe 16 Tage, bei 27,5 °C nur 9,5 Tage (ARMSTRONG & BRANSBYWILLIAMS, 1961). Anders als bei anderen Culiciden-Larven fehlt den Larven der Gattung Anopheles am VIII Abdominalsegment ein Atemrohr (Atemsyphon), stattdessen besitzen Anopheles-Larven eine Atemplatte. Dies führt zur gattungstypischen Haltung parallel zur Wasseroberfläche. Die Futteraufnahme erfolgt durch das Einstrudeln von Partikeln, die auf dem Wasser treiben. Grundsätzlich wird Nahrung bei Larven dieser Gattung nur von der Wasseroberfläche aufgenommen, dazu drehen sie ihren Kopf um 180 °. Neben pflanzlichem Detritus, Pollen und Algen werden selbst Artgenossen und Aas nicht verschmäht (MEHLHORN & PIEKARSKI, 1998; PAGES et al., 2007; WENK & RENZ, 2003). Der Artenkomplex Anopheles gambiae umfasst sechs Mückenarten (BESANSKY et al., 1994; MATTINGLY, 1977): Anopheles gambiae (sensu stricto) Anopheles bwambae Anopheles arabiensis Anopheles merus Anopheles quadriannulatus Anopheles melas 4 Mit Anopheles gambiae und Anopheles arabiensis sind die zwei wichtigsten und effektivsten Malariaüberträger für Afrika in diesem Artenkomplex enthalten. Diese Culiciden-Gruppe ist daher für Vektor-Kontroll-Programme und die Wissenschaft von größtem Interesse. Bis vor 60 Jahren wurde Anopheles gambiae (GILES, 1902) synonym als Anopheles costalis geführt. Die taxonomische Diskussion um die Prioritäten währte lange. Mit „Genera Insectorum“ (EDWARD, 1932) setzte sich der inzwischen anerkannte Name der Art Anopheles gambiae (sensu stricto) durch (MATTINGLY, 1977). Auch in der deutschen Entomologie tauchte Anopheles costalis schließlich nur noch als veraltetes Synonym auf (WEYER, 1954). Diese Verwirrungen in der Namensgebung der Art sind vor allem deshalb erwähnenswert, da in dieser Zeit einige wertvolle Beobachtungen gemacht und viele Erkenntnisse zu Leben und Verhalten der Culiciden gewonnen wurden. I.3 Insektizide und Vektorbekämpfung Insektizide finden schon seit sehr langer Zeit Verwendung. Zu Beginn unserer Zeitrechnung wurden in China Chrysanthemensamen bereits als Insektizid genutzt und Extrakte bestimmter Chrysanthemenarten wurden auch in Europa schon vor hunderten Jahren gegen Kopfläuse eingesetzt. Pyrethrine als zugrunde liegende Wirkstoffe waren damals noch nicht bekannt. Die Suche nach neuen, günstigen, synthetisch herstellbaren Insektiziden begann mit fortschreitenden industriellen Möglichkeiten und zunehmendem Wissen zur Chemie solcher Stoffe immer erfolgreicher zu werden. Mit dem 1874 erstmalig synthetisierten und 1938 von Paul Müller als insektizid wirksam erkannten Dichlordiphenyltrichlorethan (DDT), glaubte man schließlich den Durchbruch errungen zu haben. Die zu jener Zeit bekannten Pyrethrine und Rotenon konnten mit den, von den Entwicklern als günstig beschriebenen Eigenschaften des DDTs nicht mithalten. DDT war stabil und höchst wirksam. 1948 bekam Paul Müller den Nobelpreis für seine Entdeckung. Die Nachteile der Stabilität des Wirkstoffes wurden erst mit extensiver Nutzung deutlich. Im Jahre 1962 kam durch Rachel Carsons Buch „Silent Spring“ erstmals eine große öffentliche Diskussion zum Thema Insektizide in Gang. Schließlich wurde DDT durch seine verheerenden Folgen für die Umwelt in den meisten Ländern verboten (ROGAN & CHEN, 2005; TURUSOV et al., 2002). Trotzdem hat DDT zeigen können, welchen Nutzen Insektizide bei der Bekämpfung von Insekten als Vektoren und auch als Nutzpflanzenschädlinge haben können. Heute werden Chemikalien wie Insektizide deutlich genauer auf Umweltverträglichkeit und humantoxisches Potential geprüft. In der EU gibt es dazu die REACH-Verordnung (EG-Verordnung Nr.1907/2006), welche seit 01.01.2007 in jedem Mitgliedsstaat als unmittelbares Recht verankert ist (LAHL & HAWXWELL, 2006). 5 Gerade für die Vektorbekämpfung insektizidimprägnierte Moskitonetze im und Zuge das der Malariaproblematik Behandeln von Wohnräumen sind mit Insektenbekämpfungsmitteln in den betroffenen Gebieten unerlässlich (CURTIS & KANKI, 1998; HILL et al., 2007). Selbst der erneute Einsatz von DDT wird durch die vielen Malariatoten diskutiert (GUIMARAES et al., 2007). Die derzeitige Schwierigkeit besteht darin, dass der rückläufigen Zahl der zugelassenen Insektizide eine wieder steigende Zahl an vektorvermittelten Krankheiten gegenübersteht. Da die zugelassenen Mittel sehr begrenzt sind, gewinnt zudem die Problematik der Insektizidresistenz stetig an Bedeutung. Die Suche nach Alternativen, wie z.B. Pheromonfallen, neuen Insektiziden, Synergisten, besseren Formulierungen und Forschung zu den Ursachen für Resistenz sowie deren molekulare Mechanismen, ist daher für Vektorkontrollprogramme eine der wichtigsten Aufgaben (HEMINGWAY et al., 2006). Das Insecticide Resistance Action Committee (IRAC) führt derzeit die in Tab.I.3.1 gezeigten Substanzgruppen zur Verktorbekämpfung auf. Tabelle I.3.1: Vom IRAC aufgeführte Substanzen zur Vektorbekämpfung primärer Wirkort Gruppe Untergruppe chemische Gruppe Beispiele A Carbamate Bendiocarb, Propoxur B Organophosphate (OPs) Malathion, Temephos B Fiprole Fipronil Acetylcholinesterase Inhibitoren 1 GABA-gesteuerte Chlorid Kanal Antagonisten 2 Natrium Kanal Modulatoren 3 DDT, Pyrethroide und Pyrethrine Deltamethrin, Cyfluthrin, Permethrin nicotinerge AcetylcholinRezeptor Agonisten 5 Spinosine Spinosad Juvenil-Hormon Mimikry 7 A Juvenil-Hormon Analoga Methopren, Hydropren C Pyriproxifen Pyriproxifen A1 Bacillus thuringiensis var. israelensis A2 Bacillus sphaericus mikrobielle Disruptoren der Mitteldarm-Membranen von Insekten 11 Disruptoren der ChitinBiosynthese 15 Benzoylharnstoffe Diflubenzuron, Triflumuron, Novaluron Quelle: IRAC (http://www.irac-online.org/documents/vector_moa.pdf) 03.01.2008 6 I.4 Insektizid-Resistenz Das Erwerben von Insektizidresistenz ist ein auf Selektion beruhender Prozess. Individuen, deren Physiologie und somit auch deren genetische Prädisposition es erlauben größere Mengen an Insektizid zu vertragen als andere Tiere der gleichen Population, werden höhere Überlebenschancen haben. Daraus resultieren bessere Reproduktionsmöglichkeiten für diese resistenten Individuen. Eine Population kann schließlich nach kurzer Zeit überwiegend aus Tieren bestehen, die höhere Dosen des eingesetzten Insektizids vertragen. Der Einsatz von Insektiziden verursacht jedoch nicht zwangsläufig eine Resistenz (IRAC, 2007). Das IRAC definiert Resistenz als: „Selektion genetischer Charakteristika einer Insektenpopulation, welche auch bei wiederholter, vorschriftsmäßiger Anwendung eines Insektizides dazu führen, dass das vorgesehene Maß an Dezimierung der Tiere, nicht erreicht wird.“ (IRAC, 2007). Resistenz findet man im Reich der Insekten inzwischen gegen alle gängigen chemischen Klassen von Insektiziden (BROGDON, 1998a). Unterschieden werden mehrere Arten von Resistenz: Metabolische Resistenz, „Target-site-resistance“, „Reduced penetration“ (mutationsbedingte Veränderungen des Chitinpanzers und somit schlechteres Eindringen von Wirkstoffen) und Verhaltensbedingte Resistenz (ROBERTS & ANDRE, 1994). Von maßgeblichem Interesse sind vor allem die „Target-site-resistance“ und die metabolisch bedingte Resistenz (IRAC, 2007). I.4.1 Target-site-resistance Das molekulare Ziel (Target) von Organophosphaten und Carbamaten ist die Acetylcholinesterase (AChE), ein Enzym mit großer Bedeutung für die synaptische Reizleitung des Nervensystems. Es hydrolysiert den Neurotransmitter Acetylcholin und beendet somit den Nervenimpuls. Wird AChE inhibiert kommt es somit zu massiven neuronalen Störungen, welche schließlich zum Tod führen. Eine Mutation im Gen, das für die AChE codiert, kann die Angriffspunkte der genannten Insektizide so verändern, dass sie wirkungslos werden. Man spricht dann von einer Target-site-resistance (HEMINGWAY et al., 2004). Ein weiteres Beispiel für diese Form der Resistenz ist die sogenannte kdr (knockdown resistance). Insektizide, wie DDT oder Pyrethroide, welche die Natriumkanäle und deren Ionenpermeabilität beeinflussen, können bei bestimmten Mutationen nicht mehr angreifen, was zur Resistenz in Form der kdr führt (ZLOTKIN, 1999). 7 I.4.2 Metabolische Resistenz Werden infolge evolutionärer Anpassung ein oder mehrere Enzyme mit entgiftender Wirkung in überdurchschnittlichem Maße produziert oder wird deren Aktivität oder Substrataffinität mutationsbedingt erhöht und selbiges führt zu Resistenz, dann spricht man von metabolisch bedingter Resistenz (HEMINGWAY et al., 2004; LI et al., 2007). Die wichtigsten zurzeit bekannten Gruppen von Enzymen, welche für Insektizidresistenz verantwortlich gemacht werden, sind: Carboxylesterasen (EC 3.1.1.1), Glutathion S-Transferasen (EC 2.5.1.18) und Cytochrom P450 abhängige Monooxygenasen (EC 1.14.-.-) (HEMINGWAY & RANSON, 2000). Vor allem durch die große Vielfalt der metabolischen Resistenzmechanismen, ist dieser Bereich für die Forschung sehr interessant (LI et al., 2007). I.4.2.1 Carboxylesterasen (EC 3.1.1.1) Vor allem in der Stechmückengattung Culex konnte Carbamat- und OrganophosphatResistenz mit Carboxylesterasen in Zusammenhang gebracht werden (HEMINGWAY & KARUNARATNE, 1998). Offenbar gibt es eine starke Affinität einiger Carboxylesterasen zu diesen Insektizidklassen, was bei Überexpression zu Resistenz, durch Immobilisierung der eingesetzten Insektenbekämpfungsmittel im aktiven Zentrum des Enzyms, führt (KARUNARATNE et al., 1995). Auch für den permethrinresistenten Anopheles gambiae Laborstamm RSP wurden erhöhte Mengen Carboxylesterase mit der Insektizidresistenz in Verbindung gebracht (VULULE et al., 1999). Ein genereller Zusammenhang mit Pyrethroidresistenzen wird allerdings immer noch diskutiert (HEMINGWAY et al., 2004). Neben dieser auf der Quantität der Enzyme beruhenden Resistenz gegen Insektizide können auch qualitative Faktoren eine Rolle spielen. Eine erhöhte Aktivität der Esterasen kann zu einem schnellen Abbau der eingesetzten Chemikalie durch Hydrolyse führen, was ebenfalls Resistenz zur Folge haben kann, welche z.B. oft das Organophosphat Malathion betrifft (HEMINGWAY, 1982; HEMINGWAY, 1983a; HEMINGWAY, 1983b). I.4.2.2 Glutathion-S-Transferasen (EC 2.5.1.18) Die große Familie der Glutathion-S-Transferasen (GSTs) ist für diese Arbeit vor allem wegen ihrer maßgeblichen Rolle in der Phase II der Entgiftung (LUMJUAN et al., 2007) von großem Interesse. GSTs metabolisieren sowohl endogene Stoffe als auch Xenobiotika, sind aber auch an Hormonsynthese, intrazellulären Transportprozessen und vor allem am Schutz vor oxidativem Stress beteiligt (HAYES & PULFORD, 1995). Neben Carboxylesterasen und Cytochrom P450 abhängigen Monooxygenasen sind GSTs von Bedeutung für 8 Fremdstoffmetabolismus und somit auch für Insektizidresistenz (FOURNIER et al., 1992; RANSON & HEMINGWAY, 2005; RAUCH & NAUEN, 2004; SAWICKI et al., 2003; VONTAS et al., 2001). Diese Enzyme katalysieren die Konjugation des Tripeptids Glutathion (GSH) an elektrophile Substrate wie z.B. einige Insektizide oder auch deren giftige metabolische Produkte. Sie können im Zytosol, aber auch membrangebunden gefunden werden. Für Anopheles gambiae sind drei Gene mikrosomaler GSTs bekannt (RANSON et al., 2002). Die trimeren Komplexe membrangebundener GSTs der Mikrosomen werden in eine eigene Klasse insektenspezifischer GSTs gestellt, konnten jedoch bisher nicht mit dem Metabolismus von Insektiziden in Verbindung gebracht werden (RANSON & HEMINGWAY, 2005). Cytosolische GSTs sind meist dimere Enzyme mit einer Masse von etwa 23 bis 28 kDa je Monomer (SONODA, 2006). Üblicherweise erfolgte die Nomenklatur für GSTs bei Insekten mittels römischer Zahlen. Die Vergabe der Zahl richtete sich dabei nach Elutionsreihenfolge bei Proteinreinigung oder nach dem isoelektrischen Punkt. Später wurden zwei Klassen (I und II) als insektenspezifisch eingeführt (ENAYATI et al., 2005). Aufgrund der inzwischen großen Vielzahl der bekannten GSTs bei Insekten wurde schließlich die bei Säugern übliche Nomenklatur übernommen, nach der die Enzymgruppen mit griechischen Buchstaben voneinander getrennt werden (CHELVANAYAGAM, 2001). Die vorher übliche Nomenklatur (GST Klassen I, II und III) ist somit nicht mehr aktuell. I.4.2.3 Monooxygenasen (1.14.-.-) Cytochrom P450 abhängige Monooxygenasen zeichnen sich in ihrer Funktion als Entgiftungsenzyme durch eine große Bandbreite umsetzbarer endogener und lipophiler, exogener Substanzen aus. Es sind Cytochrom-assoziierte Enzyme der P450-Reihe und in vielen Fällen für Resistenzen verantwortlich oder daran beteiligt (BERGE et al., 1998; DABORN et al., 2002). Der Großteil dieser Enzymgruppe benötigt für die Aktivität NADPH (FEYEREISEN, 1999). Zusammen mit erhöhten Esterasemengen sind Monooxygenasen beim permethrinresistenten Laborstamm RSP (Anopheles gambiae) diskutiert worden (VULULE et al., 1999). In den meisten Fällen, bei denen Insektizidresistenz mit Oxidasen in Verbindung gebracht werden konnte, gehörten die Gene zur Cyp6-Familie (HEMINGWAY et al., 2004). Das erste bei Insekten (aus Musca domestica) beschriebene und charakterisierte Cytochrom P450Gen ist Cyp6A1 (FEYEREISEN et al., 1989). Die hohe funktionelle Diversität dieser Enzymgruppe beruht auf der Vielfalt der vorhandenen P450-Gene, die oft in Clustern zusammen liegen. Jedes Gen codiert dabei für jeweils ein P4509 Enzym. Sie kommen bei Insekten sowohl mitochondrial als auch mikrosomal vor und sind in ihrer Funktion durch heterologe Expression ihrer cDNA gut erforscht (FEYEREISEN, 1999). Für 36 Insektizide aus allen Klassen sind P450-assoziierte Resistenzen untersucht worden. Mehr als 660 P450-Gene aus 45 Cyp-Familien sind aus Insekten bekannt (LI et al., 2007). Der Großteil dessen, was man zur Funktion dieser Enzyme weiß, stammt aus der Forschung an homologen Proteinen in Säugern. Funktion und Wirkungsmechanismus der P450-Systeme sind hoch konserviert. Das Resultat der Reaktion von diesen Oxidasen ist vom jeweiligen Enzym und vom Substrat abhängig und reicht von Hydroxylierung über Epoxidbildung, O-, N- und S-Dealkylierung, bis zu N-, P- und S-Oxidationen (HODGSON et al., 1993). Ein genauer Reaktionsablauf findet sich bei FEYEREISEN (1999). I.5 Zielstellung Eine kontinuierliche Überwachung von Vektorpopulationen im Verbreitungsgebiet der Malaria ist ein wichtiges Instrument, um die Effektivität in der Bekämpfung der Überträger zu verbessern (CUAMBA et al., 2006; SHARP et al., 2007). Die vorliegende Arbeit hat das Ziel, die metabolische Resistenz näher zu untersuchen. Drei für die Insektizidentgiftung sehr wichtige Enzymsysteme sollen dazu untersucht und die Methoden zur Bestimmung der Enzymaktivität etabliert werden. Es soll damit ein schnelles Monitoring der biochemischen Eigenschaften von verschiedenen Mückenstämmen ermöglicht werden, so dass potentielle Abweichungen bzw. hohe Enzymaktivitäten später mit Insektizidresistenz korreliert werden können. Für die Messung der Carboxylesterase-Aktivität soll die Methode nach GRANT et al. (1989) etabliert und optimiert werden. Zur Analyse der GST-Aktivität soll mit dem auf dem Substrat Chlorodinitrobenzen (CDNB) beruhenden Test nach HABIG et al. (1974) mit den Modulationen von NAUEN & STUMPF (2002) gearbeitet werden. Außerdem soll der Versuch unternommen werden, die Aktivität NADPH-abhängiger, mikrosomaler Monooxygenasen zu messen. Ein solcher Test wurde für Anopheles bisher nicht publiziert. Zur Etablierung der Methoden sollen zwei Stämme von Anopheles gambiae, der insektizidsensible Laborstamm KISUMU und der pyrethroidresistente Laborstamm RSP (reduced susceptibility to permethrin), dienen. Tiermaterial in gefrorener Form und Eier zur Etablierung einer eigenen Anopheles-Zucht werden dazu im Rahmen einer Kooperation von der Bayer CropScience AG zur Verfügung gestellt. Damit potenzielle Resistenzen erfasst werden können, soll eine eigene Zucht der zwei Stämme etabliert werden, um Biotests mit Larven und adulten Tieren zu entwickeln, die ein schnelles Resistenz-Monitoring mit verschiedenen Insektiziden ermöglichen. Als Alternative zum WHO-Test wird versucht, die Tests für die Imagines in 20 ml Gläschen durchzuführen. 10 II. Material und Methoden II.1 verwendete Chemikalien Chemikalie 1-Naphthol 1-Naphthylacetat 7-Ethoxycumarin 7-Hydroxycumarin ABTS [2,2'-Azinobis- Hersteller Sigma-Aldrich Chemie GmbH AppliChem GmbH Sigma-Aldrich Chemie GmbH Sigma-Aldrich Chemie GmbH (3-ethylbenzthiazolin-6-sulfonsäure)] Acetonitril BSA (Albuminfraktion Sigma-Aldrich Chemie GmbH Carl Roth GmbH V (pH 7,0) Charge 6T009744) CDNB (1-Chlor-2,4-dinitro-benzol CHAPS (3-[(3-Cholamidopropyl) dimethylammonio]-1-propansulfonat) Coomassie® Brillant Blue G 250 Di-Natriumhydrogenphosphat Dihydrat Di-Natriumhydrogenphosphat Dodecahydrat DTT (1,4-Dithio-DL-threit(ol)) EDTA-Dinatriumsalz-Dihydrat Ethanol, absolut zur Analyse Glutathion Reduktase (aus Bäckerhefe) Glycin HEPES Kaliumdihydrogenphosphat L-Glutathion oxidiert L-Glutathion reduziert Methanol Monochlorobimane NADPH-Teranatriumsalz Natriumacetat PBS (pH 7,2) 10x Sucrose TRIS, ultra pure Triton® X-100 Trizma® Base Wasserstoffperoxid AppliChem GmbH Fluka Fluka Fluka E.Merck AppliChem GmbH AppliChem GmbH AppliChem GmbH E.Merck Sigma-Aldrich Chemie GmbH AppliChem GmbH Sigma-Aldrich Chemie GmbH E.Merck AppliChem GmbH Fluka Carl Roth GmbH Fluka Carl Roth GmbH Carl Roth GmbH invitrogen™ SERVA Feinbiochemica GmbH&Co MP Biochemicals Inc. Fluka Sigma-Aldrich Chemie GmbH E.Merck Verwendete Chemikalien, die nicht extra in dieser Tabelle aufgeführt wurden, sind über die Firma Sigma-Aldrich Chemie GmbH oder AppliChem GmbH bezogen worden. Insektizide wurden vom Kooperationspartner Bayer CropScience AG zur Verfügung gestellt. 11 II.1.1 verwendete Insektizide Insektizid chem. Name Formel Klasse Wirkung Bendiocarb 2,2-Dimethyl-1,3-benzodioxol-4-olmethylcarbamat C12H13NO4 Carbamat Inhibieren der Acetylcholin-Esterase Malathion (1,2-Bis(ethoxy-carbonyl)ethyl)-O,Odimethyldithiophosphat C10H19O6PS2 Organophosphat Inhibieren der Acetylcholin-Esterase Permethrin 3-(2,2-Dichloroethenyl)- 2,2dimethylcyclopropancarboxylsäure(3-phenoxyphenyl)methylester C21H20Cl2O3 Pyrethroid Blockierung der Na+-Kanäle (bleiben offen) Deltamethrin 3-(2,2-Dibromethenyl)-2,2-dimethylcyclopropancarbonsäure-cyan-(3phenoxyphenyl)methylester C22H19Br2NO3 Pyrethroid Bolckierung der Na+-Kanäle (bleiben offen) Cyfluthrin Cyano-(4-fluoro-3-phenoxyphenyl)methyl-3-(2,2-dichloroethenyl)-2,2dimethylcyclopropanecarboxylate C22H18Cl2FNO3 Pyrethroid Bolckierung der Na+-Kanäle (bleiben offen) N H O Cl Cl O O CH3 O N CH3 O CH3 F Cyfluthrin Bendiocarb H3C CH3 O O Cl O O Br H3C CH3 O Br N Cl O Permethrin Deltamethrin S CH3 P H3C O O O S H3C O O O CH3 Malathion Abb.II.1.1: Strukturformeln der Insektizide, die in der Arbeit hauptsächlich getestet wurden 12 II.1.2 Verwendete Puffer für Enzymtests: 0,1 M Na/K-Phosphatpuffer (Na/K-PP), pH 7,5 14,95 g Na2HPO4 x 2H2O 2,176 g KH2PO4 auf einen Liter H2O dest. aufgefüllt 0,1 M Na/K-PP, pH 7,5, 0,1 % Triton X-100 0,1 M Na/K-Phosphatpuffer, pH 7,5 mit zusätzlich 1 ml Triton X-100 auf einen Liter Puffer 0,2 M Na/K-PP, pH 6 8,81 g Na2HPO4 x 12H2O 23,85 g KH2PO4 auf einen Liter H2O dest. aufgefüllt TRIS-HCl-Puffer, 0,05 M, pH 7,5 6,06 g TRIS in 1 Liter H2O dest. auf einen Liter H2O dest. aufgefüllt pH-Wert mit HCl eingestellt Oxidase-Homogenisationspuffer 0,1 M Na/K-PP, pH 7,5 mit zusätzlich: 1 mM EDTA 1 mM DTT 200 mM Sucrose HEPES-Puffer, 0,05 M, pH 6,8 2,98 g HEPES auf 250 ml dest.Wasser aufgefüllt pH mit KOH eingestellt Na-Acetatpuffer, 0,1 M , pH 5,0 5,33 g Natriumacetat 2 ml Eisessig auf einen Liter H2O dest. aufgefüllt 13 II.2 Mückenzucht (Anopheles gambiae) Material: Beide Anopheles gambiae Stämme wurden von der Bayer CropScience AG zur Verfügung gestellt. Der insektizidsensible Laborstamm KISUMU stammt ursprünglich aus Kenia und wurde von Bayer 2005 aus London (London School of Hygiene and Tropical Medicine, UK) bezogen. Das Londoner Institut erhielt den Stamm 1998 aus dem WHO Collaborating Center in Montpellier (Frankreich). Den ebenfalls ursprünglich aus Kenia stammenden permethrinselektierten Laborstamm RSP (VULULE et al., 1996), erhielt Bayer 2006 aus der London School of Hygiene and Tropical Medicine. Transparente Zuchtboxen (TOY BOXX von Rotho Kunststoff AG) mit den Maßen 37 cm x 37 cm x 36 cm (Länge x Breite x Höhe) dienten zur Haltung der adulten Mücken. Für die nötige Luftzirkulation wurden in den Deckel und in zwei Seiten der Boxen große Aussparungen gefräst, die Öffnungen anschließend mit Alu-Fliegengaze abgedichtet. Die Gaze wurde etwas größer als die Aussparungen zurechtgeschnitten und mit einem Lötkolben in den Kunststoff eingeschmolzen. Für eine seitliche Öffnung (Durchmesser 16 cm) wurde ein Acrylglasring mit einem Innendurchmesser von 16 cm und einem Außendurchmesser von 19 cm zurechtgeschnitten und mittels Edelstahl-Maschinenschrauben an dem Behälter befestigt. Unter diesen Ring kann so ein abgeschnittener Damenstrumpf geklemmt werden, der als „Tuchtunnel“ zum Hantieren im Behälter dient und das Entweichen von Mücken verhindert. Die seitlichen Öffnungen müssen in mindestens 5 cm Höhe eingebracht werden, um den Behälterboden mit Wasser füllen zu können. Das Wasser ist für die nötige Luftfeuchtigkeit unverzichtbar. Zucht: Die auf feuchtem Zellstoff erhaltenen Eier wurden in transparente Aufzuchtsschalen (Aufbewahrungsbox, Styrol-Acrylnitril (SAN) mit Deckel, Inhalt 4000 ml, Abmessungen (B/T/H) 340/230/100 mm) der Firma VWR bzw. Fotoschalen mit ähnlichen Maßen) gegeben. Zuvor wurden diese Behälter mit destilliertem (dest.) Wasser bis zu einer Höhe von 2 cm befüllt. In jede Schale wurde eine Spatelspitze fein zerriebenes Futter (Vipan Hauptfutter für Zierfische der Firma SERA™ oder TetraMin der Firma TETRA™) gegeben und in Inkubationsschränke der Firma SANYO (TYP MIR-253) gestellt. Die Larven begannen bei 30 °C Wassertemperatur bereits zwei bis drei Tage nach der Eiablage zu schlüpfen. Von diesem Zeitpunkt an wurde täglich mit fein zerriebenem Zierfischfutter gefüttert. Am vierten Tag nach dem Schlupf wurde das Wasser gewechselt, indem die Larven durch einen Käscher geschüttet wurden, so dass sie anschließend in gereinigte Schalen mit frischem dest. Wasser 14 überführt werden konnten. Nach der Säuberung wurden ca. 300 Larven pro Aufzuchtsschale eingesetzt. Die Beleuchtung der Inkubationsschränke konnte nicht automatisch gesteuert werden. Das Licht wurde morgens eingeschaltet und nachmittags ausgeschaltet. So entstand ein Tag-Nacht Rhythmus von 8 Stunden Licht und 16 Stunden Dunkelheit, wobei Tageslicht für eine gewisse Dämmerung sorgte, da etwas davon die Inkubatoren indirekt erreichte. Nach sieben Tagen waren die ersten Puppen zu finden. Diese wurden abgefischt und in die Zuchtboxen überführt. Dazu sind die transparenten Zuchtboxen am Boden mit dest. Wasser (ohne weitere Zusätze) befüllt worden. Nach dem Schlupf der ersten adulten Tiere wurde mit der Fütterung der Mücken begonnen. Dazu wurden autoklavierte 250 ml Erlenmeyerkolben mit zehnprozentiger Dextroselösung gefüllt. Dicht gerollter Zellstoff wurde von oben in den gefüllten Erlenmeyerkolben gegeben. Die so hergestellte Dochttränke wurde direkt in die Zuchtboxen gestellt und aller zwei Tage erneuert. Um die für die adulten Tiere nötige Luftfeuchtigkeit und Temperatur zu erreichen, wurden die Haltungsboxen auf Heizkabel gestellt. Auf diese Weise konnte die Zucht auch in einem klimatisierten Raum durchgeführt werden. Die Temperatur lag bei Nutzung eines 50 Watt Heizkabels für drei Boxen bei 26 °C und die relative Luftfeuchtigkeit bei 65-70 %. Zur Fütterung mit Blut wurden Anopheles-Weibchen verwendet, die mindestens vier Tage alt waren. Die ersten Blutfütterungen wurden an Ratten (Bezugsquelle: Medizinisch Theoretisches Zentrum Dresden) durchgeführt. Die Tiere wurden von Dr. O. Zierau (Institut für Endokrinologie, TU-Dresden) mit einem Ketamin-Xylazin Gemisch kurzzeitig (ca. 60 min) anästhesiert (Dosierung: 1 bis 2 mg/kg Körpergewicht). Damit die AnophelesWeibchen besser stechen können, wurden die Rückenhaare der Ratten entfernt. Für weitere Blutmahlzeiten der Weibchen wurden sterile Petrischalen mit einem 5:1 Gemisch Rindercitratblut/Fötales Serum Albumin randvoll gefüllt und mit feiner Gaze abgedeckt. Das Blut wurde von einem Veterinär bezogen (Dr. Thomas Kiesling, Possendorf). Nach einer halben Stunde wurde die Petrischale wieder entfernt. Nach einer Blutfütterung wurde stets das dest. Wasser auf dem Behälterboden erneuert. Nach drei Tagen legten die Weibchen die Eier direkt auf die Wasseroberfläche. Nach Umsetzten der adulten Mücken konnte das Wasser durch ein Zellstoffpapier, Filterpapier oder Sieb abgegossen und die Eier in die Larvenaufzucht überführt werden. Aufgrund des großen Aufwands der Zucht wurde allerdings meist die Möglichkeit, Eier vom Kooperationspartner (Bayer CropScience AG) zu bekommen, genutzt, so dass keine Eiablage und Blutfütterung nötig war. 15 II.3 Biotests II.3.1 Larvenbiotest: Für die Larvenbiotests fanden transparente 24-well Zellkulturtestplatten der Firma TPP oder Greiner Verwendung. Pro Kavität wurde zu je zwei Larven in insgesamt 1990 µl H2O dest. der zu testende Wirkstoff in 10 µl DMSO gegeben. Als Kontrolle diente stets die letzte Spalte der Zellkulturplatte, so dass pro Platte acht Kontrolltiere mitgeführt wurden. Die Kontrolle enthielt 0,5 % DMSO. Ein bis zwei Stunden vor einem Larvenbiotest sind die Larven stets gefüttert worden. Anschließend wurden die Tiere durch einen Käscher gegossen und in frisches dest. Wasser gesetzt. Die Larven wurden mit einer abgeschnittenen 1 ml Pipettenspitze in 500 µl Wasser aufgenommen und in 1490 µl vorgelegtes dest. Wasser pipettiert. Die Exposition mit verschiedenen Insektizidkonzentrationen erfolgte über 24 Stunden bei Raumtemperatur (ca. 22 °C). Zur Auswertung wurden die Larven mit einer Nadel oder mit einer Pipettenspitze berührt. Erfolgte nach kurzem Rühren und Anschupsen der Larven keine Bewegung, wurde das Tier als tot betrachtet. Wenn eine Larve gefressen wurde, ist die gesamte Kavität aus der Wertung genommen worden, da nicht sicher gesagt werden konnte, ob das gefressene Tier durch Einwirken des Insektizids gestorben ist. Es wurde darauf geachtet, dass möglichst immer gleichgroße Tiere für eine Testreihe verwendet wurden, da entwicklungsbedingt Larven verschiedener Größe, aber gleichen Alters auftreten. Die Auswertung erfolgte mit der Software BioStat (LC50-Werte) und Excel (Konzentrations-Wirkungskurven). II.3.2 Biotest adulter Mücken: Es wurden zwei verschieden große Gläschen (Glasvials) verwendet und in den Tests verglichen, 20 ml Vials mit Kunststoffdeckel (Ao ≈ 40 cm2) (X500 Szintillationsflasche 20 ml der Firma novodirect GmbH) und 50 ml Rollrandgläser (Ao ≈ 87 cm2) mit PE-Kunststoffdeckel (Firma Carl Roth GmbH & Co. KG). Für die 20 ml Glasvials wurde die gewünschte Menge Insektizid in 500 µl Aceton, für die 50 ml Glasvials in 1 ml Aceton gelöst. Die entsprechende Menge Aceton wurde unter dem Abzug in das offene Glasgefäß gegeben. Die Gläschen wurden auf ein Rotationsgerät wie es für Hotdogs verwendet wird (Hotdog-Maker, Firma Bomann®) gelegt, welcher die Glasvials beständig rotieren ließ. Dies führte zur gleichmäßigen Verteilung des Wirkstoffes und zum Verdunsten des Acetons. 16 Der von der WHO genutzte Test wurde einmalig mit Testsystemen den verglichen. WHO-Testkammern Expositionsraum beschichtete beiden Dazu genutzt. wurden Rundfilter anderen mit wurden In den Insektizid (Ao ≈ 95 cm2) gegeben. Es wurde 1 ml Wirkstoff in Aceton gleichmäßig auf dem Filterpapier verteilt und ebenfalls unter dem Abzug trocknen gelassen. Zehn adulte Mücken wurden in den Abb.II.3.2: WHO-Testkammer (WHO, 2002) Sammelraum (Holding Tube) gegeben und für die jeweilige Testdauer in den Expositionsraum (Exposure Tube) gepustet. Dazu wurde die Falltür zwischen den beiden Kammern kurzzeitig geöffnet (WHO, 2002). Das Absaugen der Tiere erfolgte mit einer regulierbaren pneumatischen Pumpe. Dazu wurde ein Schlauch (0,7 cm Durchmesser) am Ansaugstutzen befestigt. Am Ende des Schlauches wurde ein 15 ml Falcon befestigt. Dazu wurde das Falcon am Boden aufgeschnitten, auf den Schlauch gesteckt und mit Parafilm abgedichtet, so dass die mit dem Deckel verschließbare Seite als Schlauchende diente. In die Bodenöffnung des Falcons wurde Glaswolle gestopft, damit sich die angesaugten Tiere nicht verletzten konnten. Zum Bestimmen der LC50-Werte wurden jeweils zehn unverletzte (!) Tiere pro Gläschen verwendet. Dazu wurden die aus der Zuchtbox abgesaugten adulten Tiere kräftig in das Vial geschüttet. Es ist darauf zu achten, dass alle Tiere keine Verletzungen aufweisen, da dies die Konstitution stark beeinflusst. Es wurden stets 2-4 Tage alte Tiere verwendet, die noch keine Blutmahlzeit erhalten haben. Zur Bestimmung der zu prüfenden Konzentrationsbereiche für dieses Testsystem wurden sogenannte „Range-Finder-Tests“ durchgeführt. Ausgehend von der Konzentration, die die WHO für den Feldeinsatz vorsieht, wurde der Konzentrationsbereich abgeschätzt. Dabei ist aber stets mit einer deutlich unter der Feldkonzentration liegenden Menge begonnen worden. Außerdem dienten diese Tests dazu, die unmittelbar nach Exposition einsetzende Wirkung (Knock Down Effekt) beschreiben zu können, dazu wurde alle zehn Minuten die Anzahl der noch lebendigen Tiere gezählt. Für die Bestimmung der LC50-Werte der getesteten Insektizide wurde nach 4 Stunden die Auswertung vorgenommen. Sie erfolgte mit der Software BioStat© (LC50-Werte) und Excel (Konzentrations-Wirkungskurven). 17 II.4 Enzymtests Für die Auswertungen der spezifischen Aktivität wird 1 Unit (U) definiert als 1 µmol/(min*mg Protein). II.4.1 Carboxylesterase-Test Der Enzymtest zur Bestimmung der Aktivität von Carboxylesterasen wurde in 96-LochMikrotiterplatten der Firma Greiner (transparent, flat bottom) nach der Methode von GRANT et al. (1989) durchgeführt. Verwendet wurden lebende oder bei -80 °C aufbewahrte Tiere. Mit einem Plastik-Micropestill von Eppendorf wurden je nach Fragestellung ein oder mehrere Tiere in einem 1,5 ml Eppendorfgefäß in eiskaltem 0,1 M Na/K-Phosphatpuffer (pH 7,5, 0,1 % Triton X-100) homogenisiert (auf Eis!). Das Homogenat wurde bei 10000 x g und 4 °C für 5 min zentrifugiert und danach der Überstand abgenommen. Als Substrat diente 100 mM 1-Naphthylacetat (Abb.II.4.1) (18,6 mg in 1 ml Aceton). Die 1-NaphthylacetatStammlösung wurde bei -20 °C aufbewahrt. Für die Färbelösung wurden 15 mg Fast Blue RR-Salz in 25 ml 0,2 M Na/K-PP (pH 6) gemischt (vortexen) und anschließend durch einen Faltenfilter (Rotilabo®-Faltenfilter, qualitativ, 150 mm, Firma Carl Roth GmbH) filtriert. Danach wurden 100 µl Substratlösung in 10 ml filtrierte Lösung gegeben. Der Ansatz pro Kavität bestand aus 25 µl Homogenatüberstand, 25 µl 0,2 M Na/K-PP (pH 6,0) und 200 µl Färbelösung. Das Fast Blue RR-Salz ergibt mit dem durch enzymatische Esterspaltung entstehenden 1-Naphtol einen Azofarbstoff. Die kontinuierliche Messung erfolgte photometrisch bei 450 nm, 23 °C alle 30 Sekunden über einen Zeitraum von 10 min an dem Spektrometer Infinite M200 der Firma TECAN. Für die Kontrolle wurden 25 µl 0,1 M Na/K-PP (pH 7,5, 0,1 % Triton X-100) anstatt Homogenat eingesetzt. O O 1-Naphthylacetat O O 1-Naphthylbutyrat Abb.II.4.1: Strukturformeln der zur Bestimmung der Carboxylesterase-Aktivität verwendeten 1-Naphtholester 18 II.4.2 Native Polyacrylamidgelelektrophorese (PAGE) mit Aktivitätsfärbung der Esterasen Für die Methode der nativen PAGE nach ORNSTEIN (1964) wurden die Komponenten für Sammelgel-, Trenngel- und Probenpufferlösung wie folgt hergestellt. Sammelgel-Puffer 0,5 M TRIS-HCl-Puffer pH 6,8 6,05 g TRIS pH-Einstellung mit 4 M HCl auf 100 ml mit dest. Wasser auffüllen Trenngel-Puffer 1,5 M TRIS-HCl-Puffer pH 8,8 18,15 g TRIS pH-Einstellung mit 4 M HCl auf 100 ml mit dest. Wasser auffüllen APS (10 %) 10 mg APS mit dest. Wasser auf 100 ml auffüllen alliquotieren (200 µl) und bei -20 °C einfrieren Elektroden-Puffer TRIS-Glycin-Puffer pH 8,3 15,14 g TRIS 72,0 g Glycin 500 ml dest. Wasser (zehnfach konzentriert!) Probenpuffer 4 g Saccharoselösung (20 %) 1-2 mg Bromphenolblau in 16 ml 1,6 %iger Triton X-100 Ansatz zur Gelherstellung (für zwei Gele): Trenngel (8 %) Sammelgel (3 %) 4,4 ml 2,475 ml 2,5 ml 1,25 ml 3. Acrylamid/Bis 40 % T/3 % C 2,0 ml 375 µl 4. Triton X-100 1,6 % 1,0 ml 600 µl 8 µl 4 µl 100µl 50 µl 1. dest. Wasser 2. Trenngel- bzw. Sammelgel-Puffer 5. TEMED 100 % 6. APS 10 % Lösungen 1.-3. wurden gemischt und im Ultraschallbad entgast. Anschließend wurde Lösung 4. dazugeben und alles für 10 min in den Kühlschrank gestellt. Direkt vor dem Gießen wurde Lösung 5. und 6. dazugegeben. 19 Vorgehensweise beim Gießen: 1. Trenngellösung (ca. 5 ml) bis zur Sammelgelmarkierung füllen. 2. Überschichten mit Isopropanol und Gel für 1 Stunde polymerisieren lassen. 3. Isopropanol abgießen, Sammelgelraum mit dest. Wasser spülen und mit Filterpapier austrocknen. 4. Sammelgellösung auffüllen (randvoll!) und Kämme einhängen. Gel für mind. 1,5 Stunden polymerisieren lassen (eventuelle Blasen durch Schütteln lösen) 5. Kämme herausziehen und mit Elektrodenpuffer überschichten. Probenaufbereitung: 10 Larven oder 10 adulte Tiere von Anopheles gambiae wurden in 50 µl Probenpuffer + 50 µl 0,1 M Na/K-PP (pH 7,5) homogenisiert und bei 10000 x g und 4 °C für 5 Minuten zentrifugiert. 10 µl des Überstandes (1 Tieräquivalent) wurden pro Geltasche eingesetzt. Netzgeräteinstellungen und Durchführung: Für zwei Gele wurden 160 V fürs Sammelgel und 220 V fürs Trenngel eingestellt. Laufzeit: bis Bromphenolblau 1 cm vor Gelende stand. Aktivitäsfärbung der Carboxylesterasen im Gel: Für die Färbelösung wurden 200 mg Fast-Blue-RR-Salz (0,2 %) in 100 ml 0,2 M Na/K-PP (pH 6,0) gelöst und mittels Magnetrührer gemischt. Anschließend wurde die Lösung durch einen Faltenfilter (Rotilabo®-Faltenfilter, qualitativ, 150 mm, Firma Carl Roth GmbH) filtriert und 2 ml 1-Naphtylacetat (11,16 mg 1-NA in 2 ml Aceton) oder 1-Naphtylbutyrat in Aceton dazugegeben. Das Färben der Esterasen im Gel erfolgte für ca. 30 min unter Lichtausschluss. Danach wurden die Gele für 10 min zur Fixierung und Entfärbung in eine 7 %ige Essigsäurelösung überführt. Nach mehrfachem Waschen in dest. Wasser wurden die Gele zur Dokumentation gescannt. 20 II.4.3 Glutathion S-Transferase (CDNB-Test) Als Substrat für die GSTs wurde bei dieser photometrischen Methode nach HABIG et al. (1974) mit Modifikationen von NAUEN & STUMPF (2002) 0,4 mM CDNB verwendet. Es wurden 12,2 mg in 500 µl DMSO gelöst. Für die Substratlösung wurden 100 µl des in DMSO gelösten CDNBs zu 10 ml TRIS-HCl-Puffer gegeben. Das für die Enzymreaktion nötige GSH wurde als 4 mM Lösung (36,9 mg in 10 ml TRIS-HCl-Puffer, pH 7,5) verwendet. Die Tiere wurden, wie in II.4.1 beschrieben, homogenisiert, diesmal jedoch in TRIS-HCl-Puffer. In je eine Kavität einer 96-Loch-Mikrotiterplatte (Firma Greiner, transparent, flat bottom) wurden schließlich direkt vor der Messung 100 µl Homogenat, 100 µl Substratlösung und 100 µl 4 mM GSH gegeben. Für die Kontrolle wurde TRIS-HClPuffer statt Homogenat verwendet. Die Absorption wurde mit dem Spektrometer Infinite M200 der Firma TECAN bei 340 nm alle 30 sec für 5 min gemessen. Bei der Reaktion wird der Chlorsubstituent des CDNBs als Cl- frei und Glutathion wird an dieser Stelle an den Aromaten substituiert, wodurch das Absorptionsspektrum in den sichtbaren Bereich verschoben wird. O2N O2N Cl NO2 + GSH red GST GS NO2 + HCl Abb.II.4.3: Reaktionsgleichung der GST-vermittelten Substitution von GSH an CDNB 21 II.4.4 Glutathion S-Transferase (MCB-Test) Für den fluorimetrischen GST-Test wurde die Methode von NAUEN & STUMPF (2002) mit Monochlorbiman (MCB) als Substrat zugrunde gelegt und modifiziert. 6,8 mg MCB wurden in 500 µl DMSO gelöst (f.v.0,2 mM). Davon wurden 100 µl in 10 ml HEPES-Puffer gegeben und gemischt. GSH wurde als 2 mM Lösung (9,2 mg in 5 ml HEPES-Puffer) eingesetzt. 100 µl Enzymquelle (wie in II.4.1 beschieben hergestellt, nur in HEPES-Puffer), 100 µl Substratlösung und 100 µl GSH-Lösung wurden pro Kavität einer schwarzen 96-LochMikrotiterplatten von Greiner (black, flat bottom) eingesetzt. Bei der GST-katalysierten Reaktion mit MCB entsteht ein fluoreszierendes Endprodukt. Es wurde mit dem Spektrometer Infinite M200 der Firma TECAN bei 400 nm Anregung und 475 nm Emission gemessen. Die Messungen erfolgten im 30 sec Takt für 5 Minuten. O O O N N GST + GSH CH2Cl O N + HCl N CH2 GS Abb.II.4.4: Reaktionsgleichung der Substitution von GSH an Monochlorobiman 22 II.4.5 Monooxygenase-Test Als Substrat dient bei dieser Methode 7-Ethoxycumarin, welches durch Cytochrom P450 abhängige Monooxygenasen (MOs) zu 7-Hydroxycumarin (Umbelliferon) umgesetzt wird (DE SOUSA et al., 1995). Das Reaktionsprodukt Umbelliferon kann schließlich mittels Fluoreszensmessung quantifiziert werden. Aufgrund der benötigten Proteinmenge konnten nur Massenhomogenate verwendet werden. Pro Ansatz wurden 30 Tiere benötigt. Je 15 Tiere wurden in einem Eppendorfgefäß in 1 ml eiskaltem 0,1 M Oxidase-Homogenisationspuffer (siehe II.1.2) mit einem Plastik-Micropestill homogenisiert. Das Homogenat wurde anschließend für 5 min bei 5000 x g und 4 °C zentrifugiert. Der Überstand wurde bei 15000 x g (4 °C) für 15 min zentrifugiert. Es folgt eine weitere Zentrifugation bei 100000 x g in der Ultrazentrifuge Optima ™ Max der Firma Beckman Coulter GmbH (bei 4 °C, 1 h), um die Mikrosomen zu sedimentieren. Dazu wurden die Proben eines Testansatzes vereinigt und in ein Zentrifugenröhrchen (Firma Beckman, conical bottom tube 13 x 51 mm) gegeben. Der Überstand wurde nach der Ultrazentrifugation verworfen. Das Mikrosomen-Pellet wurde in 200 µl eiskaltem 0,1 M Na/K-PP (pH 7,5) gründlich (!) resuspendiert. Von der Suspension wurde eine quantitative Proteinbestimmung nach BRADFORD (1976) durchgeführt. Der Test erfolgte in 96-Loch-Mikrotiterplatten (Firma Greiner, black, flat bottom). Pro Kavität wurden 20-30 µg Protein (in insgesamt 50 µl 0,1 M Na-K-Phosphatpuffer) eingesetzt, gegebenenfalls wurde die Proteinmenge eingestellt. Für die Substratstammlösung wurden 7,6 mg 7-Ethoxycumarin in 1 ml Aceton gelöst (Lösung muss bei -20 °C aufbewahrt werden), davon wurden für die Substratlösung 10 µl in 390 µl 0,1 M Na/K-PP (pH 7,5) gelöst. Pro Kavität wurden 50 µl Homogenat, 40 µl Substratlösung und 10 µl NADPH (8,33 mg/ml dest.Wasser) eingesetzt und bei 29 °C für 45 min inkubiert (Schüttler). Anschließend wurden in jede Kavität 10 µl GSHox (18,3 mg/ml dest. Wasser) und 10 µl Glutathion-Reduktase (0,5 units) gegeben. Dieses Reduktionssystem verbraucht überschüssiges NADPH, welches die Messung stören würde. Nach 15 min wurde die Reaktion mit einem 1:1 Gemisch aus Acetonitril/Trizma-Base (0,05 M, pH 10,0) gestoppt. Gemessen wurde bei 390 nm Anregung und 465 nm Emission (Gain 80) mit dem Spektrometer Infinite M200 (TECAN). NADPH + H H5C2O O O + , O2 + - H2O HO O H3C CHO O Abb.II.4.5: Monooxygenase-vermittelte O-Deethylierung von 7-Ethoxycumarin 23 II.4.6 Peroxidase (ABTS-Test) Zur Bestimmung der Peroxidase-Aktivität wurde ABTS (2,2'-Azinobis-(3-ethylbenzthiazolin6-sulfonsäure)) für den Test verwendet. Als Substratlösung diente 5,49 mg ABTS in 10 ml Na-Acetatpuffer (0,1 mM, pH 5,0). Außerdem wurde die für die Reaktion benötigte H2O2Lösung (3 %) aus einer 30%igen Stammlösung hergestellt. Einzeltiere wurden in 200 µl Na-Acetatpuffer (0,1 mM, pH 5,0) mittels Plastik-Micropestill homogenisiert. Massenhomogenate wurden aus 10 Tieren in 1 ml Na-Acetatpuffer (0,1 mM, pH 5,0) hergestellt (Vorgehen wie bei II.4.1). Für die Messung wurden 96-Loch-Mikrotiterplatten der Firma Greiner (transparent, flat bottom) verwendet. Pro Kavität wurde ¼ Tieräquivalent in 70 µl Na-Acetatpuffer (0,1 mM, pH 5,0) eingesetzt (ggf. mit Na-Acetatpuffer auffüllen). Direkt vor der Messung wurden je Kavität 200 µl Substratlösung (ABTS) und 30 µl H2O2-Lösung (3 %) zugegeben. Infolge der Peroxidase-Reaktion entsteht ein ABTS+-Radikal, welches eine photometrische Messung bei 420 nm (25 °C) ermöglicht. Gemessen wurde über einen Zeitraum von 3 min mit dem Spektrometer Infinite M200 der Firma TECAN. O OO S N N S N O S N S O O Abb.II.4.6: ABTS 24 III. Ergebnisse III.1 Mückenzucht Am 09.05.2007 wurden die ersten Anopheles gambiae Eier erhalten. Es sind ca. 2000 Eier des Stammes KISUMU und ca. 1000 des Laborstammes RSP gewesen. Der Ansatz der Eier erfolgte bei 29,2 °C in dest. Wasser. Der Schlupf der ersten Larven folgte am 11.05.2007. Die ersten Puppenstadien konnten am 19.05.2007 gefunden werden. Die ersten adulten Tiere wurden am 23.05.2007 gefunden. Es schlüpften deutlich weniger adulte Tiere, als Larven vorhanden waren. Die adulten Tiere wurden bei diesem Versuch bei Raumtemperatur (ca.22 °C) und ohne erhöhte Luftfeuchtigkeit gehalten. Die Tiere sind bei diesen Bedingungen, trotz angebotener Zuckerlösung, rasch nach dem Schlupf verstorben. Für weitere Ansätze wurden die Inkubatoren zur Larvenaufzucht beider Stämme auf 30 °C eingestellt. Bei Eintreffen der Lieferung der Eier waren diese stets zwei Tage alt. Am darauffolgenden Tag schlüpften die ersten Larven. Während der Larvenaufzucht konnte beobachtet werden, dass die Tiere Futter vom Boden der Wasserschalen aufnahmen und den Grund teilweise aktiv nach Nahrung absuchten. Nach genau 7 Tagen wurden die ersten Puppen gefunden. Ab dem zweiten Tag nach Fund der ersten Puppenstadien schlüpften die adulten Tiere, welche nun bei 26 °C und erhöhter relativer Luftfeuchtigkeit (60-70 %) gehalten wurden. Die ersten Adulten waren überwiegend Männchen. Unter diesen veränderten Bedingungen wurden die Tiere bei Fütterung von Dextroselösung (10 %) mindestens zwei Wochen alt. Die ersten Blutfütterungsversuche an lebenden anästhesierten Ratten hatten den Tod der Weibchen, die Blut aufgenommen haben, zur Folge. Für weitere Blutfütterungen der Weibchen wurde Rinderblut verwendet. Das Blut wurde bereitwillig aufgenommen. Alle Mücken, die das Blut aufgenommen hatten, sind verendet. Bei der Verwendung von einem Gemisch Rinderzitratblut/Fötales Serum Albumin (4:1) wurde die Blutmahlzeit ebenfalls gut akzeptiert. Nach dieser Fütterung kam es erstmalig zur Ablage von Eiern. 25 III.2 Biotests Es sollte jeweils ein Biotest für lebende Larven und Adulte entwickelt werden. Ziel der Biotests ist es, auch schon geringe Unterschiede in der Mortalität zweier Stämme zu finden, so dass entstehende Resistenzen bereits frühzeitig erkannt werden können. Dabei dient stets ein Laborstamm als Referenz. In dieser Arbeit ist das der Stamm KISUMU, dessen Mortalität bei allen Insektiziden als „normal“ angesehen wurde. Da Tiere, die mehr Insektizid vertragen, eine geringere Mortalität zeigen, kann man aus dem Quotient der LC50-Werte des entsprechenden Insektizids den Resistenzfaktor (RF) des Stammes RSP im Vergleich zum Referenzstamm KISUMU berechnen (LC50 RSP/LC50 KISUMU = RF). Da die von den Larven und Adulten aufgenommene Dosis Insektizid nicht ermittelt werden kann, erfolgte die Ergebnisdarstellung in Konzentrations-Wirkungskurven. III.2.1 Larvenbiotests Bei ersten Versuchen mit nur 2 bis 4 h Expositionsdauer wurde festgestellt, dass Larven durch die getesteten Insektizide teilweise nur immobilisiert wurden und sich nach 24 h wieder erholt hatten. Die Testdauer wurde daher auf 24 h festgelegt. Die Diagramme III.2.1.1 und III.2.1.2 zeigen die Konzentrations-Wirkungskurven der Insektizide Bendiocarb und Malathion. Getestet wurden 5 Tage alte (Bendiocarb) und 6 Tage alte Larven (Malathion) in 24-well Zellkulturtestplatten. Bei allen erfolgten Tests gab es nach der Auswertungszeit von 24 h keine Mortalität bei den Tieren in den Kontrollansätzen. Bendiocarb 5d alte Larven KISUMU RSP 100 100 90 90 80 80 70 70 Mortalität [%] Mortalität [%] KISUMU Malathion 6d alte Larven 60 50 40 RSP 60 50 40 30 30 20 20 10 10 0 0 0,1 1 10 100 Konzentration [ng/m l] 1000 10000 0,1 1 10 100 1000 Konzentration [ng/m l] 26 Diagramm III.2.1.1: Konzentrations-Wirkungsbeziehung für beide Stämme, Wirkstoff: Bendiocarb, n=4 Diagramm III.2.1.2: Konzentrations-Wirkungsbeziehung für beide Stämme, Wirkstoff: Malathion, n=4 Im Falle des Carbamates Bendiocarb lagen die LC50-Werte für den Referenzstamm KISUMU bei 210 ng/ml, für den Stamm RSP bei 678 ng/ml. Der RF für RSP zeigt mit 3,2 eine in Bezug auf den Referenzstamm eine höhere Bendiocarb-Toleranz an. Für das Organophosphat Malathion ergab sich ein RF von 1,9. Die LC50-Werte lagen für KISUMU bei 46 ng/ml und für RSP bei 90 ng/ml. Die Diagramme III.2.1.3 und III.2.1.4 zeigen die Ergebnisse der Pyrethroide Deltamethrin und Permethrin. Für die Tests mit Deltamethrin fällt die Streuung der Werte auf. Im Vergleich zu Bendiocarb und Malathion ist bei den Pyrethroiden ein deutlicher Unterschied zwischen den beiden Stämmen zu erkennen. Deltam ethrin 4d alte Larven KISUMU RSP 100 100 90 90 80 80 70 70 Mortalität [%] Mortalität [%] KISUMU Perm ethrin 5d alte Larven 60 50 40 30 60 50 40 30 20 20 10 10 0 0,001 RSP 0 0,01 0,1 1 10 100 1000 Konzentration [ng/m l] Diagramm III.2.1.3: Konzentrations-Wirkungskurve für Deltamethrin, 4 Tage alte Larven Anopheles gambiae (KISUMU & RSP), n=3 0,001 0,01 0,1 1 10 100 1000 10000 100000 Konzentration [ng/m l] Diagramm III.2.1.4: Konzentrations-Wirkungskurve für Permethrin, 5 Tage alte Larven Anopheles gambiae (KISUMU & RSP), n=5 Der LC50-Wert für Deltamethrin liegt beim Referenzstamm KISUMU bei nur 4,6 ng/ml, für RSP liegt der Wert mit 98 ng/ml sehr viel höher. Der RF zeigte mit einem Wert von 21 eine sehr große Deltamethrin-Toleranz der vier Tage alten RSP-Larven an. Die große Standardabweichung der einzelnen Messwerte erlaubte allerdings nur die Feststellung einer deutlichen Tendenz zu Resistenz. 27 Permethrin wurde von beiden Stämmen in vergleichsweise großen Mengen vertragen. Der LC50-Wert beim Referenzstamm KISUMU liegt bei 1000 ng/ml und für RSP liegt der Wert bei 6750 ng/ml. Der resultierende RF betrug 6,7. Cyfluthrin Larvenalter 4 bis 6 Tage (KISUMU) 5d 4d 6d 100 100 90 90 80 80 70 70 Mortalität [%] Mortailtät [%] 4d Cyfluthrin Larvenalter von 4 bis 6 Tage (RSP) 60 50 40 30 5d 6d 60 50 40 30 20 20 10 10 0 0,001 0,01 0,1 1 10 100 0 1000 0,01 Konzentration [ng/m l] 0,1 1 10 100 1000 10000 Ko nze nt ra t io n [ ng/ m l] Diagramm III.2.1.5: Konzentrations-Wirkungskurve für Cyfluthrin für 4-6 Tage alte Larven Anopheles gambiae (KISUMU), n=3 Diagramm III.2.1.6: Konzentrations-Wirkungskurve für Cyfluthrin für 4-6 Tage alte Larven Anopheles gambiae (RSP), n=3 Das Pyrethroid Cyfluthrin wurde in seiner Wirkung auf verschieden alte Larven getestet. Das Ergebnis für den Stamm KISUMU ist im Diagramm III.2.1.5, das für RSP im Diagramm III.2.1.6 dargestellt. Für beide Stämme zeigte sich eine Zunahme der Wirkstofftoleranz mit steigendem Alter. LC50 und RFs sind in Tabelle III.2.1.1 zusammengefasst. Stamm RSP Alter 4d LC50 [ng/ml] 93 KISUMU 4d 11 RSP 5d 144 KISUMU 5d 69 RSP 6d 1024 KISUMU 6d 167 RF 8,09 2,11 6,12 Tabelle III.2.1.1: LC50 und RFs für Wirkstoff Cyfluthrin, 4 bis 6 Tage alte Larven 28 III.2.2 Biotests adulter Tiere Die Auswertung der Mortalität von adulten Anopheles gambiae in den mit Insektizid beschichteten 20 ml Glasvials erfolgte zunächst nach 24 h. Die Kontrollmortalität in den nur mit Aceton beschichteten Vials lag dabei im Mittel bei 34 %. Die Testdauer wurde auf 4 h reduziert. Bei der neuen Testdauer lag die Mortalität unter den Tieren der Kontrolle im Mittel bei 1,6 %. Zum Ermitteln der für den Test sinnvollen Konzentrationen des entsprechenden Insektizids, wurden sogenannte „Range-finder-Tests“ durchgeführt. Die Testdauer betrug dabei eine Stunde, die Auswertung erfolgte alle 10 Minuten. Exemplarisch für diese Tests ist im Diagramm III.2.2.1 die Auswertung für das Pyrethroid Deltamethrin gezeigt. Mottalität [%] KISUMU "Range-finder"-Test für Deltamethrin 100 90 80 70 60 50 40 30 20 10 0 20 ng/cm2 2 ng/cm2 0,2 ng/cm2 0,02 ng/cm2 Kontrolle 0 10 20 30 40 50 60 Zeit [min] Diagramm III.2.2.1: Biotest mit adulten Anopheles gambiae (KISUMU) über 1 h. Wirkstoff: Deltamethrin bei einem Konzentrationsbereich von 0,02-20 ng/cm2, Test in 20 ml Glasvials. Dieses Beispiel zeigt auch die schnelle Wirkung von Deltamethrin („Knock Down Effekt“), daher ist eine Auswertung nach 4 h völlig ausreichend. Basierend auf diesem Test wurde die höchste Konzentration von Deltamethrin für eine 4 h-Exposition mit 2 ng/cm2 gewählt. Für eine Beurteilung von drei verschiedenen Testsystemen wurde ein einmaliger Versuch mit Deltamethrin durchgeführt. Verglichen wurde die 4 h-Exposition mit Deltamethrin bei Verwendung von WHO-Testkammern, 20 ml und 50 ml Glasvials. Es wurden für jedes Testsystem 10 adulte Tiere eingesetzt. Das Ergebnis des Vergleichs ist im Diagramm III.2.2.2 dargestellt. 29 Testsysteme im Vergleich kl. Vials (Tote) gr. Vials (Tote) WHO (Tote) Mortalität nach 4 h [%] 10 8 6 4 2 0 Kontrollen 0,5 1 Deltamethrin [ng/cm 2 2 ] Diagramm III.2.2.2: Deltamethrin-Biotest mit adulten Anopheles gambiae (KISUMU), 4 h Expositionsdauer, Vergleich dreier Testsysteme. Die Verteilung der Geschlechter in jedem Testansatz war zufällig. Beim WHO-Test zeigte sich bei 4 h Exposition und den gewählten Konzentrationen keine Mortalität. Es gab bei allen Tests keine Mortalität bei den Kontrolltieren. Die Biotests für adulte Tiere wurden basierend auf den Ergebnissen des Methodenvergleichs in 20 ml Glasvials durchgeführt. Die Diagramme III.2.2.3 und III.2.2.4 zeigen die Konzentrations-Wirkungskurven für zwei getestete Pyrethroide. Deltam ethrin adulte Tiere KISUMU RSP 100 100 80 80 Mortalität [%] Mortaltiät [%] KISUMU Perm ethrin adulte Tiere 60 40 60 40 20 20 0 0 0,01 RSP 0,1 1 10 Ko nze nt ra t io n [ ng/ c m 2 ] Diagramm II.2.2.3: Konzentrations-Wirkungskurve für Deltamethrin, adulte 2-4 Tage alte Tiere Anopheles gambiae (KISUMU & RSP), basierend auf 20 ml Glasvialtest, n = 4 0,01 0,1 1 10 100 Ko nze nt ra t io n [ ng/ c m 2 ] Diagramm II.2.2.4: Konzentrations-Wirkungskurve für Permethrin, adulte 2-4 Tage alte Tiere Anopheles gambiae (KISUMU & RSP), basierend auf 20 ml Glasvialtest, n = 3 30 Beide Stämme reagierten schon auf sehr geringe Konzentrationen Deltamethrin. Die LC50 lag bei diesem Wirkstoff für den Referenzstamm KISUMU bei nur 0,21 ng/cm2. Für RSP wurde die LC50 mit 0,79 errechnet. Der resultierende Resistenzfaktor betrug 3,7. Der Anopheles gambiae Stamm RSP vertrug folglich mehr Deltamethrin, zeigte aber nur eine geringe Tendenz zu erhöhter Wirkstofftoleranz. Die LC50-Werte für den Wirkstoff Permethrin lagen für KISUMU bei LC50 = 1,6 ng/cm2 und für RSP bei LC50 = 19,6 ng/cm2. Der RF zeigte mit 12,4 eine erhöhte Permethrintoleranz. Der Versuch die Wirkung des Carbamats Bendiocarb mit dem Glasvialtest zu testen, brachte keine in einer Konzentrations-Wirkungsbeziehung auswertbaren Ergebnisse. III.3 Enzymtests Sämtliche Auswertungen zur Enzymaktivität basieren auf dem linearen Bereich der Aktivitätsänderung mit der Zeit. III.3.1 Proteinbestimmung Die quantitative Proteinbestimmung erfolgte nach (BRADFORD, 1976). Als Referenzprotein für alle Kalibrierungskurven diente Albumin aus Rinderserum (RSA). Die Kalibrierungskurven wurden mit jedem verwendeten Puffer erstellt. Alle erstellten Kalibrierungskurven haben einen Regressionskoeffizienten von 0,99 erreicht. Der Versuch, die quantitative Proteinbestimmung mit „Roti®-Quant“ der Firma ROTH durchzuführen, führte zu keinen reproduzierbaren Ergebnissen. III.3.2 Carboxylesterasen Eine Entwicklungsstadienspezifität und mögliche Unterschiede der vorhandenen Isoenzyme bei den Stämmen RSP und KISUMU (Massenhomogenate mit 10 Tieren) wurden mit einer nativen PAGE ermittelt. Die Aktivitätsfärbung im Gel erfolgte mit den Substraten 1-Naphthylacetat (Abb.II.3.2.1) und 1-Naphthylbutyrat (Abb.III.3.2.2). 31 KIS RSP KISL4d KISL6d RSPL4d RSPL6d Abb. III.3.2.1: Elektropherogramm eines nativen Gels mit dem Substrat 1-Naphthylacetat, KIS = KISUMU; L4d = 4 d alte Larven; L6d = 6 d alte Larven KIS RSP KISL4d KISL6d RSPL4d RSPL6d Abb. III.3.2.2: Elektropherogramm eines nativen Gels mit dem Substrat Naphthybutyrat, KIS = KISUMU; L4d = 4 d alte Larven; L6d = 6 d alte Larven Für beide Substrate waren zwischen den verschiedenen Larvenstadien und Stämmen deutliche Unterschiede in Stärke und Anzahl der Banden zu beobachten. 1-Naphthylacetat zeigte unter gleichen Vorraussetzungen jedoch bei der Aktivitätsfärbung mit Fast Blue RR-Salz (Methode II.4.2) mehr bzw. deutlichere Banden (schwarze Pfeile) als 1-Naphthylbutyrat. 1-Naphthylacetat wurde für alle weiteren Messungen verwendet. Zur Berechnung der Enzymaktivität wurde eine Kalibrierungsgerade für das Reaktionsendprodukt 1-Naphtol mit der Fast Blue RR-Salz-Färbung erstellt. Kalibrierungsgerade 1-Naphthol y = 0,0212x + 0,0556 R2 = 0,99 Extinktion bei 450 nm 1,2 1,0 0,8 0,6 0,4 0,2 0,0 0 10 20 30 40 50 60 Stoffm enge von 1-Naphtol in nm ol Diagramm III.3.2.1: Kalibrierungsgerade für 1-Naphtol, n = 5 32 III.3.2.1 Einfluss des Homogenisationspuffers auf die Esteraseaktivität Um den Aufschluss der Proteinextrakte zu optimieren und herauszufinden, ob neben zytosolischen auch membrangebundene Carboxylesterasen vorhanden sind, wurde die Homogenisierung der Tiere mit zwei verschiedenen Puffern durchgeführt (0,1 M Na/K-PP, pH 7,5 und 0,1 M Na/K-PP, pH 7,5, 0,1 % Triton X-100). Die gemessenen spezifischen Aktivitäten der unterschiedlichen Homogenate wurden verglichen (Diagramm III.3.2.1.1). Puffervergleich Esterase Larven 6d alt RSP L6d RSP L6d TX100 KISUMU L6d KISUMU L6d TX100 0 50 100 150 200 250 300 spezifische Aktivität in mU Diagramm III.3.2.1.1: Anopheles gambiae Larven 6 d alt, 0,1 M Na-K-Phosphatpuffer, pH 7,5 mit und ohne Triton X-100 (0,1 %) als Homogenisationspuffer im Vergleich. Der Zusatz TX100 kennzeichnet die Proben, bei denen das Homogenat mittels Homogensisationspuffer mit Triton X-100 (0,1%) hergestellt wurde. n = 3 Puffervergleich Esterase adulte Anopheles gambiae RSP♂ RSP♂ TX100 RSP♀ RSP♀ TX100 KISUMU♂ KISUMU♂ TX100 KISUMU♀ KISUMU♀ TX100 0 50 100 150 200 250 spezifische Aktivität in mU Diagramm III.3.2.1.2: Anopheles gambiae adulte Tiere, 0,1 M Na-K-Phosphatpuffer, pH 7,5 mit und ohne Triton X-100 (0,1 %) als Homogenisationspuffer im Vergleich. Der Zusatz TX100 kennzeichnet die Proben, bei denen das Homogenat mittels Homogensisationspuffer mit Triton X-100 (0,1 %) hergestellt wurde. n = 3 33 Es zeigte sich sowohl für Larven als auch für adulte Tiere, dass bei Verwenden des Detergenz Triton X-100 im Homogenistationspuffer, eine höhere spezifische Aktivität gemessen werden konnte. III.3.2.2 Esterase-Aktivität der beiden Stämme im Vergleich Esterase-Aktivität im Vergleich RSP L6d RSP♂ RSP♀ KISUMU L6d KISUMU♂ KISUMU♀ 0 50 100 150 200 250 300 spezifische Aktivität in mU Diagramm III.3.2.2.1: Anopheles gambiae adulte Tiere und Larven (6 d alt) 0,1 M Na-K-Phosphatpuffer, pH 7,5 mit Triton X-100 (0,1 %) als Homogenisationspuffer. n = 3 im Vergleich, Im Vergleich mit den adulten Tieren fiel bei beiden Stämmen die deutlich höhere spezifische Carboxylesteraseaktivität der Larven auf. Die Männchen zeigten eine tendenziell geringere spezifische Aktivität als die Weibchen. Signifikante Unterschiede zwischen den Stämmen konnten mit einem zweiseitigen t-Test (p = 0,05) nicht festgestellt werden. 34 III.3.3 Glutathion-S-Transferasen (CDNB-Test) Die GST-Aktivität wurde in einer Messung mit ¼ Tieräquivalenten aus Einzeltierhomogenaten (wie in II.4.3 beschrieben) gemessen (Diagramm III.3.3.1). Einzeltiermessungen GST CDNB-TEST RSP 10 RSP 9 RSP 8 RSP 7 RSP 6 RSP 5 RSP 4 RSP 3 RSP 2 RSP 1 KISUMU 10 KISUMU 9 KISUMU 8 KISUMU 7 KISUMU 6 KISUMU 5 KISUMU 4 KISUMU 3 KISUMU 2 KISUMU 1 0 50 100 150 200 250 300 350 spezifische Aktivität in m U Diagramm III.3.3.1: Vergleich von 10 Einzeltiermessungen (1/4 TÄ wurde gemessen) Vergleich der mittleren spezifischen GST-Aktivität von KISUMU und RSP im CDNB-Test RSP KISUMU 0 50 100 150 200 250 300 spezifische Aktivität in m U Diagramm III.3.3.2: GST-Aktivitätsvergleich von KISUMU und RSP mittels CDNB-Test, Zusammenfassung aus 10 Einzeltiermessungen je Stamm, je Messung wurde ¼ TÄ von einem adulten Tier eingesetzt. 35 Eine Zusammenfassung der Einzeltiermessungen (Diagramm III.3.3.2) zeigte, dass kein signifikanter Unterschied der GST-Aktivitäten beider Stämme besteht (zweiseitiger t-Test, p = 0,05). In Diagramm III.3.3.3 ist die Zusammenfassung der Messungen von jeweils drei Massenhomogenaten (10 Tiere) 5 Tage alter Larven beider Stämme zu sehen. Für jedes der Homogenate wurde eine Doppelbestimmung für ein halbes und ein ganzes Tieräquivalent durchgeführt. spezifische GST-Aktivität der Larven mit 1 TÄ und 1/2 TÄ im Vergleich (CDNB-Test) RSP L5d 1/2 TÄ RSP L5d KISUMU L5d 1/2 TÄ KISUMU L5d 0 50 100 150 200 250 300 spezifische Aktivität in m U Diagramm III.3.3.3: GST-Aktivitätsvergleich 5 Tage alter Larven, n = 2 Bei dieser Messung fiel sehr deutlich ein Unterschied in der spezifischen Aktivität desselben Homogenates bei verschiedenen eingesetzten Proteinmengen auf. Die spezifische Aktivität sollte jedoch, unabhängig von der eingesetzten Proteinmenge sein. Da sich dies in den Ergebnissen nicht gezeigt hat, wurde versucht das Testsystem zu verbessern. Ein Grund für diese Abweichungen könnte das Lösungsmittel des Substrats CDNB sein, daher wurde die Eignung verschiedener Lösungsmittel für CDNB untersucht. In den Diagrammen III.3.3.4 A bis C sind die Resultate bei Verwendung der Lösungsmittel Ethanol, Aceton und DMSO aufgeführt. 36 Aceton als Lösum gsm ittel für CDNB Ethanol als Lösum gsm ittel für CDNB RSP 1/4 RSP 1/4 RSP 1/2 RSP 1/2 RSP 1 RSP 1 KISUMU 1/4 KISUMU 1/4 KISUMU 1/2 KISUMU 1/2 KISUMU 1 KISUMU 1 0 50 100 150 200 0 50 spezifische Aktivität in mU 100 150 200 spezifische Aktivität in mU Diagramm III.3.3.4 A Diagramm III.3.3.4 B DMSO als Lösumgsmittel für CDNB RSP 1/4 RSP 1/2 RSP 1 KISUMU 1/4 KISUMU 1/2 KISUMU 1 0 50 100 150 200 spezifische Aktivität in mU Diagramm III.3.3.4 C GST-Aktivitätsvergleich von KISUMU und RSP-Massenhomogenaten (10 Tiere) bei Verwendung von ¼ , ½ und 1 Tieräquivalenten. CDNB 0,4 mM, GSH 4 mM; A = CDNB in Ethanol gelöst; B = CDNB in Aceton gelöst; C = CDNB in DMSO gelöst, n = 1 Bei allen verwendeten Lösungsmitteln ist eine ähnlich starke Hemmung der spezifischen Aktivität bei steigender Proteinmenge zu beobachten. Um diesen Effekt näher zu untersuchen bzw. andere Faktoren, die für dafür verantwortlich sein können, zu finden, wurde die Konzentration des GSH variiert. Die CDNB-Konzentration blieb dabei, wie ursprünglich (HABIG et al., 1974; NAUEN & STUMPF, 2002) beschrieben bei 4 mM. 37 spezifische GST-Aktivität im Vergleich zur GSH Substratmenge KISUMU 1 TÄ KISUMU 1/2 TÄ KISUMU L 1 KISUMU L 1/2 spezifische Aktivität in mU 180 160 140 120 100 80 60 40 4 mM 6 mM 8 mM 10 mM Konzentration GSH Diagramm III.3.3.7: Entwicklung der GST-Aktivität bei steigender GSH-Konzentration im Test für KISUMU Massenhomogenate (10 Tiere) für ½ und 1 Tieräquivalent, CDNB 0,4 mM, L = Larvenhomogenat, n = 2 spezifische GST-Aktivität im Vergleich zur GSH Substratmenge RSP 1TÄ RSP 1/2TÄ RSP L 1 RSP L 1/2 110 spezifische Aktivität in mU 100 90 80 70 60 50 40 4 mM 6 mM 8 mM 10 mM Konzerntration GSH Diagramm III.3.3.8: Entwicklung der GST-Aktivität bei steigender GSH-Konzentration im Test für RSP Massenhomogenate (10 Tiere) für ½ und 1 Tieräquivalent, CDNB 0,4 mM, L = Larvenhomogenat, n = 2 Bei steigender GSH-Konzentration war für beide Stämme eine deutliche Hemmung der spezifischen Aktivität zu beobachten. Das Phänomen der höheren spezifischen Aktivität bei geringerer eingesetzter Proteinmenge ist weiterhin zu beobachten gewesen. 38 spezifische GST-Aktivität in Abhängigkeit der CDNBKonzentration spezifische Aktivität in mU 180 170 160 150 140 KISUMU 1/2 130 KISUMU 1/4 120 110 100 90 80 0,2 mM 0,4 mM 0,6 mM 0,8 mM Konzentration CDNB Diagramm III.3.3.9: Entwicklung der GST-Aktivität bei steigender CDNB-Konzentration im Test für KISUMU- Massenhomogenate (10 adulte Tiere) für ½ und ¼ Tieräquivalent, GSH 4 mM spezifische GST-Aktivität in Abhängigkeit der CDNBKonzentration spezifische Aktivität in mU 200 180 160 RSP 1/2 140 RSP 1/4 120 100 80 0,2 mM 0,4 mM 0,6 mM Konzentration CDNB 0,8 mM Diagramm III.3.3.10: Entwicklung der GST-Aktivität bei steigender CDNB-Konzentration im Test für RSP- Massenhomogenate (10 adulte Tiere) für ½ und ¼ Tieräquivalent, GSH 4 mM Wurde eine höhere Menge CDNB im Test eingesetzt, stieg bei beiden Stämmen die gemessene spezifische Aktivität deutlich an (Diagramm III.3.3.9 & III.3.3.10). Die Abweichungen blieben jedoch auch bei steigender Aktivität und 0,8 mM CDNB erhalten. 39 Um weiter zu optimieren, wurden Kombinationen unterschiedlicher Konzentrationen von CDNB und GSH im Test untersucht. Dazu wurden 1/8, ¼ und ½ Tieräquivalent pro Ansatz getestet. Das Ergebnis des Versuchs ist im Diagramm III.3.3.11 dargestellt. Test verschiedener GSH & CDNB-Konzentrationen für KISUMU-Massenhomogenate 1/8 TÄ 1/4 TÄ 1/2 TÄ 3mM CDNB & 1mM GSH 2mM CDNB & 1mM GSH 3mM CDNB & 3mM GSH 2mM CDNB & 2mM GSH 1mM CDNB & 1mM GSH 0 20 40 60 80 100 120 140 160 180 200 spezifische Aktivität in m U Diagramm III.3.3.11: Test verschiedener Kombinationen von GSH und CDNB-Konzentrationen, für alle Ansätze wurde das selbe KISUMU-Massenhomogenat verwendet In Diagramm III.3.3.12 sind die Standardabweichungen der Mittelwerte für die Messung jeweils einer Konzentrationskombination aus Diagramm III.3.3.11 dargestellt. Vergleicht man die einzelnen Standardabweichungen, so zeigt sich bei äquimolarer Konzentration von 2 mM für beide Substrate und für die Kombination 2 mM CDNB & 1 mM GSH, die geringste Streuung der Werte. Standartabw eichungen bei Mittelw ertsbildung aus den Messungen der drei Tieräquivalente 3mM CDNB & 1mM GSH 2mM CDNB & 1mM GSH 3mM CDNB & 3mM GSH 2mM CDNB & 2mM GSH 1mM CDNB & 1mM GSH 0,00 5,00 10,00 15,00 20,00 25,00 Standartabw eichung [m U] Diagramm III.3.3.12: Vergleich der Standartabweichungen, die sich bei der Mittelwertsbildung der drei gemessenen Werte aus Diagramm III.3.3.11 ergeben. 40 Um einen möglichen Einfluss des pH-Wertes auf die gemessenen spezifischen Aktivitäten zu untersuchen, wurde die Messung mit verschiedenen Puffern wiederholt. Als Substratkonzentrationen wurden für CDNB und GSH 2 mM gewählt. Für den Versuch wurde jeweils ½ und ¼ Tieräquivalent aus variable pH-Werte GST-Test mit CDNB 1/4 TÄ KISUMU- 1/2 TÄ Massenhomogenaten (10 Tiere) und drei Na/K-PPs mit den pH-Werten pH 7,25 6,0; 6,75 und 7,25 verwendet. Die Resultate des Tests sind in pH 6,75 Diagramm III.3.3.13 dargestellt. Bei der Messung mit verschiedenen pHWerten zeigt sich Unterschied Aktivitäten der bei erneut ein spezifischen verschiedenen Proteinmengen. Bei pH 6,75 ist die Abweichung pH 6,0 0,00 0,05 0,10 0,15 0,20 ∆Extinktion bei 340 nm /m in der errechneten Diagramm III.3.3.13: GST-Aktivität bei Verwendung von Puffern mit verschiedenen pH-Werten. Messung mit KISUMUAktivität geringer als bei den beiden Massenhomogenaten adulter Tiere anderen Puffern. 41 III.3.4 Glutathion S-Transferasen (MCB-Test) Neben dem CDNB-Test wurde die von NAUEN & STUMPF (2002) für 96-LochMikrotiterplatten etablierte Methode zur Bestimmung der GST-Aktivität mit dem Substrat Monochlorbiman modifiziert und als kontinuierliche Messung durchgeführt. Zur Gewährleistung bestmöglicher Sensitivität wurden Anregungs- und Extinktionswellenlängen in einem Spektrum aufgenommen. Das Maximum der Anregung war bei einer Wellenlänge von 400 nm. Diese Anregungswellenlänge wurde für das Spektrum in Diagramm III.3.4.1 verwendet. Um Effekte des Homogenates auszuschließen, wurde das Spektrum von Homogenat, Homogenat mit zugesetztem MCB und von reinem MCB aufgenommen. Spektrum für MCB, Homogenat und Biman-Glutathion bei Anregung mit 400 nm Em Biman-Glutathion Em Homogenat pur Em MCB 2500 2250 2000 1750 Emission 1500 1250 1000 750 500 250 0 420 430 440 450 460 470 480 490 500 510 520 530 Wellenlänge [nm ] 540 550 560 570 580 590 600 Diagramm III.3.4.1: Vergleich der Emissionswerte bei verschiedenen Emissionswellenlängen (420-600 nm) für Homogenat, Homogenat mit zugesetztem Substrat (MCB) und reinem MCB. Messung der Ansätze nach 5 min Inkubationszeit. Das Spektrogramm zeigte für das Reaktionsprodukt Biman-Glutathion (Homogenat + MCB) einen deutlichen Peak zwischen 470 nm und 484 nm. Das Maximum lag auch bei nachfolgenden Tests stets bei genau 476 nm. Monochlorbiman selbst fluoresziert nur wenig im Messbereich, das Homogenat gar nicht. 42 Im Diagramm III.3.4.2 ist die GST-Aktivität für adulte Männchen und Weibchen beider Stämme dargestellt. Die GST-Aktivität konnte nicht in Units angegeben werden, da kein Extinktionskoeffizient bekannt war. GST-Aktivität der ♀ & ♂ (GST-M CB-Test) 1/4 TÄ 1/2 TÄ 1 TÄ RSP ♂ RSP ♀ KISUMU ♂ KISUMU ♀ 0 200 400 600 800 1000 1200 1400 1600 ∆Emission bei 476 nm/min*mg Protein Diagramm III.3.4.2: GST-Aktivität der Männchen und Weibchen beider Stämme im Vergleich, gemessen wurden 1; ½ und ¼ Tieräquivalent aus Massenhomogenaten von 10 Tieren bei 400 nm Anregung und 476 nm Emission. Auch für den MCB-Test zeigten sich die aus dem CDNB-Test bekannten Unterschiede der spezifischen Aktivitäten bei verschiedenen Proteinkonzentrationen. Die Abweichungen der Werte für ein Homogenat lagen zwischen 9 % und 16 %. Um die Reproduzierbarkeit der GST-Aktivität (MCB-Test) Messungen trotzdem gewährleisten zu können, Versuchen wurde in die nachfolgenden Proteinmenge der RSP Homogenate auf 45 µg eingestellt. Die im Diagramm dargestellte III.3.4.3 Messung bei eingestellter Proteinmenge KISUMU zeigt eine Verbesserung der Genauigkeit. Die Standartabweichung Einzelmessungen reproduzierbaren Aktivitätshemmung lag 5,7 %. bei Die der bei 0 500 1000 1500 ∆Em ission bei 476 nm /m in*m g Protein GST- Diagramm III.3.4.3: GST-Aktivität von 45 µg Protein aus RSP und KISUMU im Vergleich, gemessen wurden je erhöhter Anopheles gambiae-Stamm drei Massenhomogenate mit 10 Homogenatmenge blieb jedoch erhalten. Tieren (5 ♀ und 5 ♂), n = 3 43 III.3.5 Monooxygenasen Das für den Monooxygenaseaktivitätstest eingesetzte Substrat 7-Ethoxycumarin wird Monooxygenasevermittelt O-Deethylierung zu durch Kalibrierungsgerade für 7-Hydroxycumarin 7-Hydroxy- 30000 cumarin (Umbelliferon) umgesetzt. Die Kalibrierungsgerade 25000 mit Fluoreszenz Umbelliferon ist im Diagramm III.3.5.1 dargestellt und hat einen Regressionskoeffizienten von 0,99. Die ersten Messungen 15000 10000 bei 5000 Durchführung der Methode nach DE y = 46,6x - 525,6 R2 = 0,99 20000 SOUSA et al. (1995) brachten 0 0 100 keine auswertbaren Ergebnisse. 200 300 400 500 7-Hydroxycum arin in pm ol Nach Verlängerung der Reaktionszeit von 30 min auf 45 min und dem Anpassen der Temperatur von Diagramm III.3.5.1: Kalibrierungsgerade für 7-Hydroxycumarin 30 °C auf 29 °C, konnten erste Ergebnisse erhalten werden. Schon nach wenigen Wiederholungen zeigte sich, dass sich selbst Massenhomogenate mit 60-80 Tieren in ihren Monooxygenaseaktivitäten stark unterschieden. Die Diagramme III.3.5.2 und III.3.5.3 zeigen exemplarisch unterschiedliche Messwerte der ersten Versuche. Monooxygenaseaktivität Massenhom ogenate RSP & KISUMU Monooxygenaseaktivität Massenhom ogenate RSP & KISUMU RSP RSP KISUMU KISUMU 0 500 1000 pm o l/ 4 5 m in*m g P ro t e in 1500 0 500 1000 1500 pm o l/ 4 5 m in*m g P ro t e in Diagramm III.3.5.2 & III.3.5.3: Zwei unterschiedliche Messungen von Massenhomogenaten (60) adulter Tiere beider Anopheles gambiae-Stämme. Für jedes Homogenat wurde eine Dreifachbestimmung durchgeführt. 44 Die Differenz zwischen den beiden Messungen für KISUMU aus den Diagrammen III.3.5.2 & III.3.5.3 war mit ca 550 pmol/45 min*mg Protein extrem hoch. Die für den Test interessanten mikrosomalen Monooxygenasen (MOs) sind membranassoziiert. Um den Aufschluss der Mikrosomen zu verbessern, wurde der Resuspensionspuffer mit Detergenzien versetzt. Mit Triton X-100 konnte selbst bei einer Konzentration von 0,1 % (v/v) keine Aktivität mehr gemessen werden. Dem Resuspensionspuffer wurde in einem weiteren Versuch 0,1 % CHAPS (w/v) zugesetzt. CHAPS ist ein sehr starkes Detergenz mit nicht proteindenaturierenden Eigenschaften, welches bei der Proteinbestimmung nach BRADFORD (1976) und im gemessenen Wellenlängenbereich des MO-Tests (465 nm) keinerlei Störung verursachte. Der in Diagramm dargestellte III.3.5.4 Massenhomogenate je Stamm. Aktivitätsvergleich Eines der zeigt Messungen Massenhomogenate wurde zweier nach der Ultrazentrifugation mit 0,1 % CHAPS im Na/K-PP resuspendiert, das andere Homogenat wurde in Na/K-PP ohne zugesetzte Detergenzien resuspendiert. Monooxygenaseaktivität Vergleich 0,1 % CHAPS und ohne Zusätze RSP chaps RSP KISUMU chaps KISUMU 0 500 1000 1500 2000 2500 pm ol/45 m in*m g Protein Diagramm III.3.5.4: Vergleich der Monooxygenaseaktiviät beider Anopheles gambiaeStämme, bei Verwendung von verschiedenen Resuspensionspufferen, chaps = 0,1 % CHAPS im Resuspensionspuffer Mit 1% CHAPS (w/v) im Resuspensionspuffer war ein Rückgang der Monooxygenaseaktivität zu beobachten. Mit der zehnmal geringeren Menge von 0,1 % (w/v) zeigten sich höhere MO-Aktivitäten. Die Streuung der Messwerte war jedoch um 4 % größer (Diagramm III.3.5.4). 45 Schließlich wurden Massenhomogenate hergestellt, bei denen nach Geschlechtern getrennt wurde. Jeweils 30 Männchen wurden mit 30 Weibchen verglichen. Es wurde dabei darauf geachtet, dass die Weibchen noch keine Blutmahlzeit erhalten haben. Das Ergebnis von vier Messreihen mit Geschlechtertrennung ist im Diagramm III.3.5.5 dargestellt. Monooxygenase-Aktivität ♀ & ♂ im Vergleich RSP ♂ RSP ♀ KISUMU ♂ KISUMU ♀ 0 200 400 600 800 1000 1200 1400 pmol/45 min*mg Prote in Diagramm III.3.5.5: Vergleich der Monooxygenaseaktivität von Weibchen und Männchen der Stämme RSP & KISUMU (Anopheles gambiae), gemessen wurden Massenhomogenate 30 adulter Tiere, n = 4 Weibchen und Männchen zeigten große Unterschiede der MO-Aktivität. Die Männchen beider Stämme weisen eine deutlich höhere MO-Aktivität als die Weibchen auf. Miteinander verglichen sind die Männchen beider Stämme in ihrer Monooxygenaseaktivität aber nicht signifikant verschieden (zweiseitiger t-Test, p = 0,05). Der Unterschied zwischen Männchen und populationseigenen Weibchen war vor allem bei KISUMU sehr ausgeprägt (Differenz: 615 pmol/45 min*mg Protein). Das wichtigste Ergebnis des Tests war die MO-Aktivitätsdifferenz der Weibchen beider Stämme. Die MO-Aktivität der Weibchen unterscheidet sich in einem zweiseitigen t-Test (p = 0,01) signifikant. Die MO-Aktivität der weiblichen Tiere des RSP-Stammes ist dabei signifikant höher als die der KISUMUWeibchen (zweiseitiger t-Test, p = 0,01). Die MO-Aktivität der KISUMU-Weibchen betrug im Mittel 525 pmol/45 min*mg Protein, die der RSP-Weibchen 922 pmol/45 min*mg Protein. Die Differenz war 396 pmol/45 min*mg Protein. Insgesamt wurden 120 Tiere in der Messung erfasst, da aber durch das Verwenden von Massenhomogenaten (jeweils 30 Tiere) nur vier Mittelwerte pro Stamm verglichen werden konnten, ist die Statistik bis weitere Messergebnisse vorliegen noch mit einem Unsicherheitsfaktor versehen. 46 Das Ergebnis der Tests mit 6 Tage alten Larven ist im Diagramm III.3.5.6 dargestellt. Monooxygenaseaktivität 6 Tage alte RSP & KISUMU Larven im Vergleich RSP KISUMU 0 200 400 600 800 1000 1200 pm ol/45 m in*m g Protein Diagramm III.3.5.6: Monooxygenaseaktivität der Larven der An. gambiae-Stämme RSP & KISUMU, n = 3 Die Messung der Monooxygenaseaktivität der Larven beider Stämme zeigte eine starke Streuung der Werte. Die Standardabweichung lag für die Messungen von RSP-Larven bei 83 pmol/45 min*mg Protein, für KISUMU-Larven bei 257 pmol/45 min*mg Protein. Ein deutlicher Unterschied der MO-Aktivität beider Stämme war nicht zu erkennen. 47 III.3.6 Peroxidasen Alternativ zur Methode mit dem Substrat 3,3’,5,5’-Tetramethylbenzidin (TMBZ) nach BROGDON et al. (1997) wurde ein Test mit ABTS entwickelt. Um die optimale Absorptionswellenlänge für das Endprodukt der peroxidasekatalysierten Reaktion mit ABTS zu ermitteln, wurde das Spektrum für ABTS, Homogenat und Endprodukt (ABTS+-Radikal) durchgeführt. Die optimale Wellenlänge für den Test lag bei 420 nm. Die Ergebnisse der Aktivitätsmessung für adulte Tiere mittels dieses ABTS-Tests sind im Diagramm III.3.6.2 dargestellt. Peroxidaseaktivität ♀ & ♂ im Vergleich RSP ♂ RSP ♀ KISUMU ♂ KISUMU ♀ 0 10 20 30 40 50 60 70 ∆Extinktion bei 420 nm/min*mg Protein Diagramm III.3.6.2: Peroxidaseaktivität im Vergleich zwischen Männchen und Weibchen beider Stämme, gemessen wurde ¼ Tieräquivalent aus Massenhomogenaten (10 Tiere), n = 3 Die Peroxidaseaktivität der Männchen und Weibchen der zwei getesteten Stämme zeigen Ähnlichkeiten mit den Ergebnissen der Monooxygenasemessungen mittels 7-Ethoxycumarin. Die Peroxidaseaktivität der Weibchen beider Stämme unterscheidet sich allerdings nicht signifikant (zweiseitiger t-Test, p = 0,05). Pro Stamm und Geschlecht wurden 30 Tiere gemessen. Für eine bessere vergleichende Statistik müssen weitere Messungen durchgeführt werden. 48 IV. Diskussion IV.1 Mückenzucht Die Etablierung der Zucht von Anopheles gambiae hat sich als große Herausforderung erwiesen. Bei der Larvenaufzucht ist eine zu hohe Individuendichte in den Wasserschalen entwicklungshemmend. Offenbar kommt es zu einer Art Überbevölkerungseffekt durch Konkurrenz um Nahrung und Lebensraum (GIMNIG et al., 2002). Außerdem stellt der Kannibalismus unter den Larven in diesem Zusammenhang ein Problem dar. Eine zu hohe Larvendichte wirkt sich nach NG'HABI et al. (2005) auch auf die Fitness der adulten Tiere aus. Die zur Verfügung stehende Wasseroberfläche pro Larve hat große Bedeutung, denn Larven von Anopheles gambiae nehmen aufgrund ihrer Physiologie in natura nur von der Oberfläche des Wassers Nahrung auf (WENK & RENZ, 2003). Es wurde nach mehreren Versuchen schließlich darauf geachtet, ca. 300 Larven in einer Aufzuchtsschale zu halten. Bei einer Wasseroberfläche von 782 cm2 entspricht dies einer Fläche von ca. 2,6 cm2 je Larve. Pro Larve sollten mindestens 2 cm2 zur Verfügung stehen (Prof. Dr. W. MAIER pers. Mitteilung). Unter diesen Bedingungen haben sich die Larven quantitativ und vor allem qualitativ am besten entwickelt. Die Wassertiefe in den Zuchtschalen ist außerdem wichtig. Zu tiefes Wasser führt zu einer geringeren Zahl an Verpuppungen. Ab 2 cm Wassertiefe beginnt die Verpuppungsrate enorm zu sinken (BRIEGEL, 2003). Es wurden genau 2 cm als Wasserstand gewählt. Auf diese Weise bleibt die Zucht effektiv, da das Wasser bei diesem Volumen nicht so häufig gewechselt werden muss und genügend Imagines schlüpfen. Die Fütterung mit Zierfischfutter war eine optimale Lösung, da sowohl pflanzliche als auch tierische Bestandteile enthalten sind und beides für eine gute Entwicklung bei Culicidenlarven nötig ist (TIMMERMANN & BRIEGEL, 1996). Bei der Haltung der Imagines musste eine Lösung für die zu niedrige Temperatur und trockene Luft gefunden werden. Dazu ist der Boden der Zuchtboxen mit dest. Wasser bedeckt worden. Außerdem wurden die Boxen auf Heizkabel gestellt. Durch die nach oben steigende Wärme konnte die nötige Temperatur und relative Luftfeuchte erreicht werden. Besser wäre sicher, einen beheizten Raum zu nutzen und entsprechend zu befeuchten, aber diese Möglichkeit stand nicht zur Verfügung. Im Rahmen dieser Arbeit war die gewählte Variante völlig ausreichend. Die Fortpflanzung war das Komplizierteste bei der Zucht von Anopheles gambiae. Dass die ersten Fütterungsversuche mit Rattenblut an lebenden, anästhesierten Tieren zum späteren Tod der Mückenweibchen führte, musste zur Kenntnis genommen werden. Der Versuch wurde durchgeführt, da die Ratte durch größere Körperoberfläche und größeres Blutvolumen 49 quantitativ besser als Mäuse geeignet wäre. Die Blutfütterung an anästhesierten Mäusen ist in der Laborpraxis bereits bekannt (STRAIF & BEIER, 1996). Meist spielt mangelnde Zuckerversorgung eine Rolle beim vorzeitigen Tod der Weibchen (GARY & FOSTER, 2006; STRAIF & BEIER, 1996). Dies kann aber aufgrund der täglichen Fütterung mit vitaminhaltiger Dextroselösung ausgeschlossen werden. Da Anopheles gambiae Rinder als Blutwirte bevorzugt (KILLEEN et al., 2001), wurde die Blutfütterung anschließend mit Rinderblut durchgeführt. Weil reines Rindercitratblut auch zu hoher Mortalität unter den Weibchen führte, wurde es mit fötalem Serum Albumin verdünnt. Dies basiert auf der spekulativen Annahme, dass beim natürlichen Stechvorgang nur kleine Gefäße getroffen werden und so wohlmöglich nicht so viele rote Blutkörperchen aufgenommen werden. Letztlich führte nur die Fütterung des verdünnten Blutes zur Eiablage. Im Zusammenhang mit der Mückenzucht muss nachdrücklich der Modellcharakter der verwendeten Laborstämme von Anopheles gambiae betont werden. Die Tiere haben sich über viele Jahre an die Zuchtbedingungen im Labor angepasst (z.B. Nahrungssuche der Larven in Form von Gründeln). Nach OKECH et al. (2007) spielt selbst der Bodengrund der Larvenhabitate eine große Rolle für die Entwicklung und Fitness der Tiere. OKECH diskutiert in diesem Zusammenhang sogar Unterschiede in der Vektorkompetenz für Plasmodium. Die Vektorkompetenz bezeichnet das Infektionsvermögen und die mögliche Parasitenlast, die ein adultes Weibchen potentiell tragen wird. Der Tribut an die Laborbedingungen ist in der Regel eine substratfreie Haltung der Larven, denn Bodensubstrat würde schon in punkto Wasserqualität einen erheblichen Mehraufwand bedeuten. Die Fütterung der Larven kann im Labor die natürlichen Gegebenheiten ebenfalls nur annährend wiedergeben. Abhängig vom Habitat ist sehr viel mehr Variabilität in den Nahrungskomponenten zu erwarten. Je nach Vielfalt oder Beschränkung des Nahrungsangebotes gibt es erhebliche Auswirkungen auf die Entwicklung der Culiciden (KAUFMAN et al., 2006). Körpergröße (Thorax) und Flügellänge der adulten Tiere hängen maßgeblich mit der Möglichkeit Reserven anzulegen zusammen, welche dann im Puppenstadium verbraucht werden können (TIMMERMANN & BRIEGEL, 1996; TIMMERMANN & BRIEGEL, 1999). DAHL et al. (1993) konnte nachweisen, dass es bei verschiedenen Stechmückengattungen, Arten und Entwicklungsstadien auch unterschiedliche Präferenzen bei der Wahl der Futterpartikelgröße gibt. Unter Laborbedingungen könnte so selbst durch die Fütterung eine ungewollte Selektion stattfinden, z.B. wenn bei der Etablierung eines neuen Laborstammes aufgrund der Partikelgröße des Futters nur einige Larven zu guter Entwicklung kommen. 50 Das Gründeln der Larven zur Futtersuche am Boden ist z.B. ein deutliches Zeichen für unnatürliches Verhalten. Auch bei den adulten Tieren ist eine gewisse künstliche Selektion nahezu Voraussetzung für die Haltung der Mücken in Gefangenschaft. Ein natürliches Paarungs- und Brutverhalten ist nämlich in den an die Laborbedingungen angepassten Haltungsboxen, nahezu unmöglich (z.B. Schwarmbildung der Männchen, Kopula im Flug etc). Bereits nach der Entnahme der ursprünglich wildlebenden Tiere aus ihrem Habitat kommt es so zur Selektion derer, die sich überhaupt unter diesen Bedingungen vermehren. Dies führt zu einer starken genetischen Verarmung (Prof. Dr. W. MAIER, pers. Mitteilung). Bei der zukünftigen Etablierung und kontinuierlichen Haltung von neuen Stämmen sollte dies beachtet werden. Die Laborstämme können so zwar als Modell problemlos der Etablierung und Erprobung von verschiedenen Tests zu Resistenz und deren molekularen Mechanismus dienen, ersetzen aber keinesfalls die Forschung an Feldstämmen in den betroffenen Gebieten. Als Larven beider Stämme vom Schlupf an mit nur grob zerkleinertem Futter versorgt wurden, konnte eine langsamere Entwicklung beobachtet werden. Die deutlich später als sonst geschlüpften Imagines beider Stämme haben in einem Biotest mit Permethrin höhere Konzentrationen als in sämtlichen vorhergehenden Versuchen vertragen. Ob dies im Zusammenhang mit der langsameren Entwicklung stand, kann noch nicht gesagt werden. Daher wird im Nachlauf der Arbeit in Fütterungsversuchen überprüft, ob es einen Zusammenhang zwischen Entwicklungszeit und Insektizidtoleranz der adulten Tiere gibt. Eine Zucht in speziell für Insektenhaltung vorgesehenen Räumen und mit eigens für die Haltung beschäftigtem Personal bietet natürlich klare Vorteile in punkto Kontrolle und Standardisierung. Trotz der eingeschränkten Bedingungen im Rahmen der vorliegenden Arbeit, konnten aber gut vergleichbare Ergebnisse erzielt werden. 51 IV.2 Biotests Für ein gutes Resistenzmonitoring sind einfache zuverlässige Biotests die Grundlage. Bestmögliche Handhabbarkeit, Reproduzierbarkeit und geringe Kosten stehen dabei im Vordergrund. Vor allem der in dieser Arbeit etablierte Larvenbiotest erfüllt diese Ansprüche in sehr hohem Maße. Ein großer Vorteil des Larventests in 24-Well-Zellkulturtestplatten ist das Einsetzen von nur zwei Larven pro Kavität im Test. Das Problem des Kannibalismus der Larven konnte so gut umgangen werden. Sobald eine Larve gefressen wurde, musste nur ein Teil des Testansatzes aus der Wertung genommen werden. Bei der vom CDC (Center for Disease Control and Prevention) vorgeschlagenen Methode der Biotests für Larven in 150 ml Bechergläsern (CDC, 2002) werden 15 bis 25 Mückenlarven eingesetzt. Sollten bei diesem Verfahren Larven gefressen werden, kann man nicht sicher sagen, ob die Tiere zuvor durch Einfluss des Insektizids verstorben sind. Bei dem System des CDC müsste daher, um eine Auswertung nach 24 h zu ermöglichen, während des Tests gefüttert werden. Das Interagieren der eingesetzten meist stark hydrophoben Insektizide mit den Futterpartikeln kann dabei nicht ausgeschlossen werden. Bei den ersten Biotests in 24-Well-Zellkulturtestplatten konnte festgestellt werden, dass einige Larven nach kurzer Zeit (2 bis 4 h) durch die getesteten Insektizide immobilisiert wurden. Bei Auswertung nach 24 h war die bestimmte Mortalität dann wieder deutlich geringer, da sich einige Tiere wieder erholt hatten und nicht länger bewegungslos waren. Im CDC-Test kann man nicht sicher verhindern, dass diese Immobilisierung in die ermittelte Mortalität mit einfließt, denn die Testdauer beträgt nur 2 Stunden. Die in dieser Arbeit entwickelte Methode ist übersichtlich, leicht durchzuführen und sehr gut auswertbar. Der Aufwand ist mit dem des CDC-Larventests vergleichbar. Als Alternative zum Biotest der WHO für adulte Mücken (WHO, 2002), sollte in der vorliegenden Arbeit die Möglichkeit einer Testmethode in 20 ml Gläschen überprüft werden. Die Vorteile der Gläschen bestehen vor allem darin, dass sie klein, stabil und somit besser zu transportieren sind. Dies ist in Hinblick auf die Anwendung im Feld sehr nützlich. Die Insektizidbeschichtung in verschiedenen Konzentrationen kann bereits vorbereitet, und die Gläschen können mehrfach verwendet werden. Der Test liefert mit einer Versuchsdauer von 4 h schnell Ergebnisse. Das Verfahren ist kostengünstig und die Ergebnisse waren für die gestesteten Pyrethroide reproduzierbar. 52 Problematisch ist die Handhabbarkeit für ungeübte Nutzer. Zehn Tiere unverletzt in eines der Gläschen zu geben, ist sehr schwierig und gelingt nicht immer. Die Auswertung ist aufgrund der mangelnden Übersichtlichkeit in den kleinen Gefäßen schwierig. Außerdem hat sich gezeigt, dass das Testsystem für das Carbamat Bendiocarb möglicherweise ungeeignet ist. Dazu müssen jedoch weitere Versuche folgen, da bisher keine eindeutigen Ergebnisse erzielt werden konnten. Die 20 ml Gläschen werden für den Biotest verschlossen. Die WHOMethode findet in belüfteten Röhrchen statt. Das geschlossene System des Biotests in Gläschen führt zu einer schnelleren Wirkstoffantwort (Diagramm III.2.2.2). Je nach Fragestellung kann dies von Vor- und Nachteil sein, denn der Test liefert zügig Ergebnisse, ist aber nicht mit einer Testdauer von 24 h durchführbar, da dann die Kontrollmortalität auf 34 % anstieg. Das von der WHO vorgeschlagene Verfahren zum Test von adulten Mücken findet weltweit Anwendung (BALKEW et al., 2006; KAMAU & VULULE, 2006; KOMALAMISRA et al., 2006; NAZNI et al., 2005), ist übersichtlich und leicht durchführbar. Für den WHO-Test müssen Testkammern und insektizidbeschichtetes Filterpapier von den WHO bezogen werden. Der in dieser Arbeit entwickelte Biotest liefert gute Ergebnisse, kann durch geringen Materialaufwand in jedem Labor durchgeführt werden und es wird weniger Insektizid benötigt. Die Ergebnisse der Larvenbiotests und die der Biotests für adulte Tiere zeigten für alle getesteten Insektizide eine erhöhte Wirkstofftoleranz des Anopheles gambiae Stammes RSP an. Der ursprünglich im Labor etablierte RSP-Stamm zeichnete sich durch hohe Permethrintoleranz im Vergleich mit dem unselektierten Anopheles-Stamm (UNS) aus (VULULE et al., 1999). Verglichen mit dem Referenzstamm KISUMU konnte diese Wirkstofftoleranz mit den in dieser Arbeit vorliegenden Ergebnissen bestätigt werden. Für Culex pipiens ist bekannt, dass die Selektion der Larven mit Permethrin zwar schnell zu Resistenz bei den Larven führt, jedoch keinen Einfluss auf die adulten Tiere hat (MCABEE et al., 2004). Da die RSP-Tiere jedoch regelmäßig als Imagines selektiert werden (NENTWIG, BAYER CropScience AG, persönliche Mitteilung) ist der Resistenzfaktor (RF) mit 12,7 erwartungsgemäß hoch und zeigt, dass die Testmethode funktioniert. Mit dem etwa um die Hälfte geringeren RF der RSP-Larven, verhält es sich möglicherweise ähnlich dem 53 von MCABEE beschriebenen Mechanismus, nur dass in diesem Fall durch Selektion der Imagines die Larven nicht nachhaltig betroffen sind. Ein potentieller Einflussfaktor bei Biotests mit Insektiziden ist die Temperatur. HODJATI & CURTIS beschreiben für Permethrin eine verminderte Wirkung bei sinkenden Temperaturen (HODJATI & CURTIS, 1999). Weitere Tests bei höheren Temperaturen könnten hier zur Verbesserung der Standardisierbarkeit folgen, da die Versuche bei Raumtemperatur durchgeführt wurden. Der von Bayer CropScience ermittelte RF für Permethrin liegt nahe 10 und wurde ebenfalls bei Raumtemperatur bestimmt. Beim Kooperationspartner wurde der WHO-Test verwendet. Die vergleichbaren Ergebnisse sprechen für eine gute Eignung des Biotest in 20 ml Gläschen. Die immer noch gute Wirksamkeit von Permethrin trotz Selektion des Stammes spricht für eine fortführende Einsetzbarkeit des Insektizids. In diesem Zusammenhang muss allerdings unbedingt auf mögliche Kreuzresistenzen verwiesen werden. Die tendenziell beginnende Deltamethrintoleranz der Larven (III.2.1) und der leicht erhöhte RF (III.2.2) der adulten RSP-Tiere könnten Indikator für eine Kreuzresistenz sein. Bei Aedes aegypti ist selbst für wirkstoffklassenfremde Insektizide wie Malathion die Kreuzresistenz mit Deltamethrin bekannt (RODRIGUEZ et al., 2002; RODRIGUEZ et al., 2003). Permethrin besitzt keine alpha-Cyanogruppe (siehe Abb.II.1.1) und gehört daher zu den Typ-I-Pyrethroiden. Deltamethrin und auch Cyfluthrin (siehe Abb.II.1.1) gehören zu den Typ-II-Pyrethroiden (mit alpha-Cyanogruppe). Um mit Deltamethrin die gleiche Mortalität wie mit Permithrin zu erreichen müssen vergleichsweise geringe Konzentrationen eingesetzt werden. Die ermöglicht jedoch nicht das Ausschließen einer Kreuzresistenz, da Typ-II-Pyrethroide aufgrund ihrer alpha-Cyanogruppe wirksamer sind. Der RSP-Stamm wird schon seit fast 10 Jahren im Labor gehalten und permethrinselektiert. In dieser Zeit hätte sich eine Kreuzresistenz deutlicher zeigen müssen. Auch der gute Knock Down Effekte (Diagramm III.2.2.1) spricht gegen eine bedeutende Kreuzresistenz. Die starke Streuung der Werte des Biotests mit Deltamethrin für vier Tage alte Larven (Diagramm III.2.1.3) sowie der Vergleich der Wirkstoffantworten auf Cyfluthrin mit steigendem Larvenalter (Diagramme III.2.1.5 & III.2.1.6) sprechen für die Notwendigkeit einer besseren Standardisierung der Biotests in Bezug auf die Wahl des Alters der getesteten Larven. Je nach Fragestellung sollte zur optimalen Vergleichbarkeit der Ergebnisse nur ein Larvenalter oder die gesamte Zeitspanne von Tag 4 bis Tag 6 untersucht werden. Soll der 54 Einfluss eines Enzymsystems auf mehrere Insektizide überprüft werden, ist eine Korrelation nur dann sicher möglich, wenn Tiere gleichen Alters gegenübergestellt werden. Larven von Aedes aegypti zeigen z.B. mit steigendem Larvenalter zunehmende GST-Aktivität (ENAYATI et al., 2005; HAZELTON & LANG, 1983). Auch die Tests mit Cyfluthrin zeigen ähnliche Effekte sehr deutlich, da sich der RF für jedes getestete Larvenalter erheblich unterschied (Tab. III.2.1.1). Grundsätzlich können, durch die nicht völlig standardisierbaren Zuchtbedingungen und die neu eingeführten Testmethoden, die Biotestergebnisse nur unter Vorbehalt mit Ergebnissen anderer Arbeitsgruppen verglichen werden. Werte für Wirkstofftoleranz und Mortalität wurden daher immer nur relativ auf den unter gleichen Bedingungen gehaltenen Referenzstamm bezogen. IV.3 Enzymtests Die Vektorbekämpfung und die möglicherweise mit dem Einsatz von Insektiziden verbundene Resistenzbildung ist von großer Bedeutung für die Wissenschaft (BROGDON & MCALLISTER, 1998; CURTIS & KANKI, 1998; ENAYATI et al., 2005; FEYEREISEN, 1995; RANSON & HEMINGWAY, 2005; ROBERTS & ANDRE, 1994), denn Insektizide sind für betroffene Gebiete unerlässlicher Bestandteil der Malariaprävention (CURTIS et al., 1998; CURTIS & KANKI, 1998; HILL et al., 2007). Resistenzen, die durch Veränderungen des molekularen Ziels der Insektizide entstehen, sind zwar weit verbreitet, aber in ihrem Entstehungsmechanismus auf nur wenige Mutationen der entsprechenden Gene beschränkt (LI et al., 2007). Target-Site-Resistance betrifft bei Culiciden, soweit bisher bekannt, nur Na+-Kanäle und Acetylcholin-Esterasen. Die möglichen Mechanismen für metabolisch bedingte Insektizidresistenzen sind aufgrund der Menge der infrage kommenden Enzyme weitaus vielfältiger (LI et al., 2007). Beide Resistenzformen können jedoch gemeinsam auftreten und sich gegenseitig verstärken (ZLOTKIN, 1999). Für den zur Etablierung der Tests zur Verfügung gestellten Anopheles gambiae Stamm RSP ist eine Target-Site-Resistance gegen Pyrethroide, in Form der kdr-Mutation, ermittelt worden (NAUEN,Bayer CropScience AG, pers. Mitteilung). Für Anopheles gambiae wurden zwei Formen der kdr-Mutation im Gen, dass für die Domäne II des Natriumkanals codiert, beschrieben (RANSON et al., 2000, MARTINEZ-TORRES et al., 1998). 55 Basis der näheren Untersuchung von metabolisch bedingten Resistenzmechanismen ist das Bestimmen der Enzymaktivitäten und, wenn möglich, die Quantifizierung der infrage kommenden Enzymsysteme. Um den Einfluss metabolischer Enzyme auf eine potentielle Insektizidentgiftung untersuchen zu können, wurden mehrere Enzymtests, die in der Literatur allgemein für Insekten beschrieben sind, für Anopheles gambiae modifiziert. Dazu sind stets Larven und adulte Tiere beider Stämme verglichen worden. Anfangs wurden alle Versuche mit Massenhomogenaten und Einzeltieren durchgeführt, ohne dabei auf die Trennung von Weibchen und Männchen zu achten. Als sich im späteren Verlauf der Arbeit bei den Untersuchungen zur Monooxygenaseaktivität deutliche Aktivitätsunterschiede zwischen beiden Geschlechtern zeigten, wurden in der verbliebenen Zeit so viele Versuche wie möglich mit einer Trennung von Weibchen und Männchen wiederholt. IV.3.1 Carboxylesterasen Der nach GRANT et al. (1989) durchgeführte Test zur Bestimmung der Enzymaktivität verschiedener Esterasen konnte schnell und problemlos etabliert werden. Ein großer Vorteil der Methode ist die Möglichkeit Reaktionsprodukte verschiedener 1-Naphtolester färben und somit messen zu können. Wie die Elektropherogramme der nativen PAGE (Abb. III.3.2.1 & III.3.2.2) zeigen, werden von verschiedenen Substraten auch unterschiedliche Mengen an Isoenzymen erfasst. Für die Aktivitätsmessung in einem Resistenzmonitoring ist das Erfassen einer großen Fülle an Enzymen von Vorteil. Dies war für 1-Naphthylacetat gegeben, so dass es für weitere Tests verwendet wurde. Wird eine erhöhte spezifische Esteraseaktivität festgestellt, können, durch die Verwendung verschiedener Substrate für die Aktivitätsfärbung, mögliche Unterschiede in den Elektopherogrammen festgestellt werden. Ist bei Verwendung eines Substrates die Aktivität im Enzymtest geringer, können, über die Auswertung der nativen PAGE, Isoenzyme ausgeschlossen oder gar als für die hohe Aktivität verantwortliche Enzyme ermittelt werden. Weitere Analysen, durch Ausschneiden der entsprechend in Frage kommenden Banden, können anschließend folgen (z.B. Massenspektrometrie, MALDI-TOF). Der Zellaufschluss mit Triton X-100 im Homogenisationspuffer brachte eine deutliche Verbesserung. Die spezifische Aktivität bei Verwenden des Detergenz ist nahezu doppelt so groß, als ohne zugesetztes Triton X-100. Eine Erklärung für den Aktivitätsanstieg wäre ein durch das Detergenz verbesserter Aufschluss des Proteinextraktes. So werden auch 56 membranassoziierte Enzyme frei, die sonst nicht im Überstand zu finden wären. Membrangebundene Esterasen aus Mücken sind bekannt und werden bereits auf ihre Eignung für Organophosphat-Abbau auf Oberflächen getestet (ZHANG et al., 2004). Esterasen wurden bisher vor allem im Zusammenhang mit Resistenz gegen Organophosphate diskutiert, sind aber auch mit Pyrethroidresistenzen in Verbindung gebracht worden (BROGDON & MCALLISTER, 1998; CUI et al., 2007; VONTAS et al., 2005). Für den Anopheles gambiae Stamm RSP ist eine erhöhte spezifische Aktivität der Carboxylesterasen publiziert worden (VULULE et al., 1999). In dieser Arbeit konnte dies im Vergleich zum Referenzstamm KISUMU jedoch nicht beobachtet werden. Die genetischen Ursachen der ursprünglich hohen Esteraseaktivität könnte über die lange Zeit, die der Mückenstamm im Labor gehalten wurde (siehe II.2), verloren gegangen sein. Da eine TargetSite-Resistance in Form der kdr-Mutation für RSP vorhanden ist (NAUEN, Bayer CropScience AG, pers. Mitteilung) und Pyrethroidresistenz damit ebenfalls gewährleistet wäre, wäre dies als Erklärung möglich. Eine molekularbiologische Charakterisierung der spezifischen Restriktionslängenpolymorphismen des gestesteten RSP-Stammes ist aufgrund dieser Vermutung für weitere Tests zu empfehlen, war im Rahmen dieser Arbeit aber nicht vorgesehen. Die Larven beider Stämme zeigten eine deutlich höhere Esteraseaktivität als die Imagines. Ursache ist hier wahrscheinlich die hohe Stoffwechselrate durch das sehr schnelle Wachstum. Die Larven nehmen große Mengen Futter auf und entwickeln sich in nur 8-9 Tagen zu Imagines (ARMSTRONG & BRANSBY-WILLIAMS, 1961). Im Zuge der Evolution würde eine höhere Entgiftungsleistung sehr sinnvoll sein, da mit hoher Nahrungsaufnahme auch ein erhöhter Fremdstoffmetabolismus einhergeht. Die Induzierbarkeit einer erhöhten Esteraseaktivität durch kurze Insektizidexposition (10-30 min) soll in weiteren Versuchen für Carboxylesterasen ermittelt werden. Außerdem wird der Einfluss der Entwicklungsdauer der Larven auf die Esterasen geprüft werden. Die Methode zum Ermitteln der Carboxylesterase-Aktivität (GRANT et al., 1989) war problemlos durchführbar und kann zum Testen und Charakterisieren weiterer Anopheles gambiae Stämme eingesetzt werden. 57 IV.3.2 Glutathion-S-Transferasen Für Anopheles gambiae sind 28 für zytosolische GSTs codierende Gene bekannt (DING et al., 2003). Drei dieser Gene können aufgrund ihrer geringen Homologien in keine der bisher bekannten Klassen eingeordnet werden (DING et al., 2003). GSTs werden bei Anopheles gambiae vor allem in Zusammenhang mit DDT-Resistenzen diskutiert (PRAPANTHADARA & KETTERMAN, 1993), sind aber bei Insekten allgemein für Resistenzen gegen alle wichtigen Insektizidklassen bekannt (ENAYATI et al., 2005). Pyrethroide fördern die Peroxidation von Lipiden. Den GSTs wird in diesem Zusammenhang eine wichtige Funktion bei der Entgiftung von Lipidperoxidations-Produkten zugeschrieben (VONTAS et al., 2001). Außerdem wird angenommen, dass GSTs durch das Binden und somit Immobilisieren von Pyrethroiden gegen diese Insektizide schützen (KOSTAROPOULOS et al., 2001). GST haben daher in der Forschung zur metabolischen Resistenz große Bedeutung. Die Bestimmung der spezifischen Aktivität von GSTs mittels des Substrates CDNB ist gängige Laborpraxis, wird jedoch je nach Fragestellung sehr variiert. Bei ETANG et al. (2007) wird z.B. Methanol als Lösungsmittel für CDNB gewählt und der verwendete Na-Phosphatpuffer hat einen pH-Wert von 6,5. Bei der ursprünglichen Methode (HABIG et al., 1974) wird der Test bei pH 7,5 durchgeführt. Dieser Messparameter findet sich auch bei Studien zur Weißen Fliege Bemisia tabaci mit TRIS-HCl-Puffer (RAUCH & NAUEN, 2004). Für kinetische Studien an Delta-GSTs aus Anopheles dirus finden sich CDNB-Tests mit Natrium-Acetatpuffern und Kalium-Phosphatpuffern bei verschiedenen pH-Werten (pH-Bereich 5,0 bis 8,5). Alle Messungen folgten dabei der Michaelis-Menten-Kinetik (WINAYANUWATTIKUN & KETTERMAN, 2004). Die ersten Versuche mit dem CDNB-Test brachten schlüssige Ergebnisse, da aufgrund der Literaturangaben für RSP keine erhöhte GST-Aktivität erwartet wurde (Diagramme III.3.3.1 & III.3.3.2). Erst bei Messungen von Larven beider Stämme (Diagramm III.3.3.3) fielen die starken Abweichungen der spezifischen Aktivität bei Einsetzen verschiedener Proteinmengen auf. Die spezifische Aktivität sollte jedoch nicht abhängig von der Proteinmenge sein. Die darauffolgenden Versuche sollten der Optimierung der Methode für Anopheles gambiae dienen. CDNB ist nicht wasserlöslich und muss daher im Test in einem organischen Lösungsmittel eingesetzt werden. Um den Einfluss des Lösungsmittels für CDNB auf die GST-Aktivität zu untersuchen, wurden Aceton, Ethanol und DMSO im GST-Test verglichen. 58 Als Lösungsmittel für CDNB eignete sich DMSO am besten, was neben der höchsten gemessenen spezifischen Aktivität auch am schnellen restlosen Lösen des Substrates lag. Sehr interessant ist die Substratüberschusshemmung, die bei Erhöhen der GSH-Konzentration auftrat (Diagramm III.3.3.7 & III.3.3.8). Dem gegenüber stand die positive Korrelation der spezifischen Aktivität der GST mit der CDNB-Konzentration (Diagramme III.3.3.9 & III.3.3.10). Diese beiden Versuche, und nicht zuletzt die Konjugationsreaktion, die beide Substrate eins zu eins verknüpft, waren Anlass zur Vermutung, dass die Verwendung von äquimolaren Mengen eine Verbesserung erzielen könnte. Dies konnte bestätigt werden (Diagramm III.3.3.12), wobei tendenziell ein CDNB-Überschuss sogar noch besser ist. Versuche zum Einsatz von CDNB-Überschuss sollten daher folgen. Da die Enzymaktivität stark vom pH-Wert abhängig sein kann, wurde der Einfluss verschiedener pH-Werte gestestet (Diagramm III.3.3.13). Die Variation des pH-Wertes brachte jedoch keine deutlichen Verbesserungen. Der MCB-Test (NAUEN & STUMPF, 2002) wurde so modifiziert, dass kontinuierliche Messungen möglich wurden. Dies erfolgte mit dem Ziel, dem CDNB-Test eine genauere Methode gegenüber zu stellen. Auch mit dieser fluorimetrischen Methode ist jedoch die gleiche Hemmung der GST-Aktivität bei Erhöhen der eingesetzten Homogenatmenge zu beobachten gewesen. Das Einstellen der Proteinkonzentration war eine Möglichkeit Anopheles gambiae Homogenate reproduzierbar zu messen. Auch für den CDNB-Test ist das Einstellen der Proteinkonzentration möglich und würde vermutlich auch reproduzierbare Ergebnisse liefern. Daher wird vorgeschlagen, mit definierten Mengen des Proteinextraktes zu messen, um besser Vergleiche zu anderen Ergebnissen anstellen zu können. Genaue Angaben zur eingesetzten Proteinmenge im Testansatz, wurden in keiner für diese Arbeit verwendeten Publikationen gefunden (ENAYATI et al., 2005; HEMINGWAY et al., 1998; HEMINGWAY et al., 2004; RANSON et al., 2001; UDOMSINPRASERT et al., 2005; WINAYANUWATTIKUN & KETTERMAN, 2004; WONGSANTICHON & KETTERMAN, 2006). Ein Unterschied zu den meisten veröffentlichten Methoden war, dass in dieser Arbeit mit Proteinextrakt der Mücken gemessen wurde. Genauere Untersuchungen zur GST-Aktivität sind meist mit gereinigten oder wenigstens angereicherten GSTs beschrieben. Eine Reinigung der GSTs durch bspw. Affinitätschromatographie könnte eine durch andere Bestandteile des Homogenates verursachte Hemmung (z.B. andere Enzyme, die auch GSH nutzen) verringern und so zu besseren Messergebnissen führen. 59 Da beim MCB- und beim CDNB-Test eine geringere spezifische GST-Aktivität bei Erhöhen der Homogenatmenge zu beobachten war, wird das Auftreten von Konkurrenzreaktionen angenommen. Möglicherweise nutzen andere Enzyme GSH und verbrauchen so das Substrat der GSTs. Vor allem die Möglichkeit, den sensitiveren MCB-Test mit den heute zur Verfügung stehenden Spektrometern (z.B. TECAN Infinite M200) als kontinuierliche Messung durchführen zu können, birgt großes Potential. Die ursprüngliche Variante der Endpunktmessung (NAUEN & STUMPF, 2002) kann dadurch in ihrer Genauigkeit weiter verbessert werden. So kann die Ermittlung der Anfangsgeschwindigkeit, der Maximalgeschwindigkeit und Km-Wertbestimmungen folgen. IV.3.3 Oxidasen Das für den Monooxygenaseaktivitätstest verwendete Substrat 7-Ethoxycumarin (7-EC) findet bereits breite Anwendung in der Forschung zu Insektizidresistenzen. Es wird z.B. für Oxidase-Aktivitätsbestimmungen bei der Baumwolleule (Helicoverpa armigera, Lepidoptera: Noctuidae), bei Drosophila melanogaster (Diptera) und bei Kopfläusen (Pediculus humanus capitis, Anoplura: Pediculidae) eingesetzt (AMICHOT et al., 1998; GONZALEZ AUDINO et al., 2005; YANG et al., 2004). Durch die Modifikationen des von DE Ethoxycumarin-O-Deethylaseaktivität SOUSA et al. (1995) entwickelten Tests, kann die von Anopheles gambiae Massenhomogenaten (30 adulte Tiere) bestimmt werden. Der für die Etablierung der Methode entscheidende Schritt war die Trennung der Geschlechter im Test. In dieser Arbeit wurde erstmalig die Monooxygenaseaktivität von männlichen und weiblichen Tieren unter gleichen Bedingungen getrennt untersucht und gegenübergestellt. Um den Mikrosomenaufschluss weiter zu verbessern und so die Anzahl, der für die Messung nötigen Tiere, weiter zu verringern, werden zusätzliche Versuche zum Einsatz von CHAPS im Resuspensionspuffer und dem Aufschluss mittels Ultraschall folgen. Bisher war die Streuung der Werte beim Einsatz von CHAPS noch zu groß. Der tendenziell zu beobachtende Aktivitätsanstieg (Diagramm III.3.5.4) rechtfertigt jedoch weitergehende Tests, die zur potentiellen Verbesserung des Mikrosomenaufschlusses führen können. 60 VULULE et al. (1999) konnte für den aus Kenia stammenden Anopheles gambiae Laborstamm RSP eine erhöhte Permethrintoleranz mit einer erhöhten Menge Oxidasen und deren Aktivität in Zusammenhang bringen. RSP-Tiere, die zusammen mit dem spezifischen Oxidasehemmer Piperonylbutoxid (PBO) dem Wirkstoff Permethrin ausgesetzt wurden, zeigten nahezu dieselbe Mortalität wie der Referenzstamm. Ohne den Synergisten PBO konnte von VULULE eine starke Permethrintoleranz der Adulten des RSP-Stammes beobachtet werden. Für Monooxygenaseaktivitätstests wurden bei VULULE et al. (1999) nur männliche Anopheles gambiae verwendet. Dies geschah um Abweichungen durch das Haem in den Blutmahlzeiten der Weibchen zu verhindern. Auch in anderen Veröffentlichungen ist keine Trennung der Geschlechter erwähnt (ETANG et al., 2004; ETANG et al., 2007). Vor diesem Hintergrund sind die in dieser Arbeit erstmalig ermittelten Unterschiede der spezifischen Oxidaseaktivität bei Männchen und Weibchen beider Anopheles gambiae Stämme sehr interessant. Vor allem durch Pflanzenschutzmittel sind auch Männchen Insektiziden ausgesetzt. Dadurch gibt es Effekte zur Resistenzbildung, die auch mit dem Männchen zusammenhängen (MULLER et al., 2008). Die zurzeit zur Vektorenbekämpfung eingesetzten insektizidbeschichteten Bettnetze werden im Rahmen der Resistenzbildung kontrovers diskutiert (BROGDON & MCALLISTER, 1998; CASIMIRO et al., 2007; CHOUAIBOU et al., 2006; CURTIS & KANKI, 1998; FEYEREISEN, 1995; HEMINGWAY et al., 2004; VULULE et al., 1996; ZHANG & YANG, 1996). Weibchen suchen Häuser und Viehställe aktiv zum Stechen ihrer Blutwirte auf. Männchen sind möglicherweise eher Pflanzenschutzmitteln ausgesetzt. Da für männliche und weibliche Tiere unterschiedliche Ursachen zur Resistenzbildung führen können, ist das Betrachten beider Geschlechter sinnvoll. Wenn nur die Monooxygenaseaktivität der Männchen untersucht wird, fällt eine eventuell sehr hohe Monooxygenaseaktivität der Weibchen nicht auf. Die weiblichen Tiere sind als eigentliche Krankheitsüberträger aber Hauptziel der Vektorbekämpfung. Für Dipteren werden immer noch neue P450-Enzyme gefunden, die mit Pyrethroidresistenzen in Zusammenhang gebracht werden (ZHU et al., 2008). Speziell für einige Monooxygenasen konnte Pyrethroidresistenz durch quantitative Real-Time-PCR-Studien auch bei heute für Anopheles funestus belegt werden (AMENYA et al., 2008). Der evolutionäre Ursprung für metabolische Entgiftungssysteme, die Wirkstofftoleranzen verantwortlich gemacht werden, ist offenbar die Notwendigkeit der 61 Metabolisierung von Pflanzeninhaltsstoffen, die dem Fraßschutz dienen. Interaktionen zwischen Pflanze und Insekten haben zu Coevolution und Anpassungen geführt. Dies ermöglicht heute sowohl das Entgiften von pflanzlichen Fraßabwehrstoffen als auch in vielen Fällen das Entgiften von Insektiziden. Für Oxidasen besteht ein solcher Zusammenhang für das Saugen von Pflanzensäften (DESPRES et al., 2007). Nicht selten kommt es so zu Kreuzresistenzen mit Insektiziden (FEYEREISEN, 2005). Für Dipteren ist z.B. eine bereits bestehende Insektizidresistenz vor Einsatz von Insektiziden bekannt (FFRENCH-CONSTANT, 2007). Weibliche Culiciden nutzen Blutmahlzeiten nicht nur als Energiequelle zur Entwicklung der Eier, sonder auch als Nahrung (MAIER et al., 2003; PAGES et al., 2007). Anopheles-Männchen nehmen als Imagines ausschließlich Wasser und zuckerhaltige Pflanzensäfte auf (GARY & FOSTER, 2006). Die Notwendigkeit der Metabolisierung von pflanzlichen Fraßhemmstoffen könnte daher Ursache der höheren Monooxygenaseaktität der männlichen Tiere sein. Cumarinderivate, die dem 7-Ethoxycumarin ähneln, für sind den typische Monooxygenasetest Fraßhemmer in verwendeten Pflanzen. Vor Substrat allem Doldenblütengewächse schützen sich durch Hydroxycumarine und durch lineare und angulare Furanocumarine vor Herbivorie (HARBORNE, 1995). Es kann angenommen werden, dass Cumarine für die P450-Enzyme als übliche Substrate dienen. Die Leistung eines Enzymsystems bei der Insektizidentgiftung, ist mittels eines Substrats nur schwer zu beurteilen. Für die Korrelierbarkeit einer Insektizidresistenz mit einem Enzym müssen daher zusätzliche Versuche folgen. Es besteht z.B. die Möglichkeit, mit spezifischen Hemmstoffen wie PBO den Einfluss von Oxidasen nachzuweisen. Ein weiterer wichtiger Schritt wäre das Verwenden verschiedener Substrate, um so die Oxidaseaktivität bei unterschiedlichen Substanzklassen beurteilen zu können. Als Substrate kommen z.B. noch p-Nitroanisol und Methoxyresorufin infrage (YANG et al., 2004). In dieser Arbeit konnten die Insektizide als Substrat nicht untersucht werden. Dies wäre jedoch mit dem in dieser Arbeit etablierten Monooxygenasetest möglich. Die Messung der Monooxygenaseaktivität könnte durch Verfolgen des NADPH-Verbrauchs kontinuierlich erfolgen. Dabei müsste Fluoreszenzoder Absorptionsabnahme gemessen werden. Beachtet werden muss, dass das Endprodukt der Reaktion nicht im Wellenlängenbereich der Messung fluoreszieren oder absorbieren darf. Andere NADPH-verbrauchende Enzyme müssen durch einen Blindwert ausgeschlossen werden. Für eine auf Oxidaseaktivität beruhende Insektizidresistenz können viele Faktoren eine Rolle spielen, die das Bestimmen der Oxidaseaktivität zu einem wichtigen Schwerpunkt dieser 62 Arbeit machen. Neben der Quantität der vorhandenen Enzyme, ist die Affinität zum Substrat entscheidend. Höhere Umsatzeffektivität als auch höhere Substrataffinität können enzymatische Entgiftungssysteme durch Mutationen in wenigen Generationen zu potenten Resistenzursachen machen (LI et al., 2007). Die im ABTS-Test ermittelten Peroxidaseaktivitäten und die mit der Methode II.4.5 bestimmten Monooxygenaseaktivitäten zeigen deutliche Ähnlichkeiten (Diagramme III.3.5.5 und III.3.6.2). Korrelationen von verschiedenen Oxidasen sind bereits bekannt (BROGDON et al., 1997). Da es deutliche Vorteile (z.B. mögliche Messungen von Einzeltierhomogenaten, Zeitersparnis) für den ABTS-Test gibt, wäre die Korrelierbarkeit beider Methoden eine bedeutende Vereinfachung. Der ABTS-Test wurde vom Kooperationspartner Bayer CropScience AG, wie in dieser Arbeit beschrieben, übernommen und konnte gut reproduzierbar durchgeführt werden. Die mit den Methoden II.4.5 und II.4.6 bestimmten Monooxygenase- und Peroxidaseaktivitäten konnten von Bayer CropScience für Bettwanzen (Cimex lectularius) korreliert werden. Für Musca domestica als Vertreter der Dipteren war die Korrelation nicht möglich (NAUEN, Bayer CropScience AG, pers. Mitteilung). Ob diese Korrelation auch mit Anopheles gambiae durchführbar ist, kann erst nach Tests mit weiteren Mücken-Stämmen der gleichen Gattung ermittelt werden, da zwei getestete Stämme statistisch nicht genügen. Die Monooxygenaseaktivitäten der KISUMU-Larven (MO-Test), wiesen eine starke Streuung auf. Erstaunlicherweise ist für KISUMU bei der Messung adulter Weibchen und Männchen eine größere Differenz der Monooxygenaseaktivität als zwischen den Geschlechtern von RSP zu beobachten gewesen. Für KISUMU lag die Differenz der Monooxygenaseaktivitäten zwischen den Geschlechtern bei 615 pmol/45 min*mg Protein, für RSP bei 236 pmol/45 min*mg Protein. Die Streuung der Monooxygenaseaktivitäten der KISUMULarven lag mit 515 pmol/45 min*mg Protein vergleichbar der Differenz der KISUMUMännchen und -Weibchen. Eine Vermutung dazu wäre, dass bereits vor der Imaginalhäutung geschlechtsspezifische Unterschiede in der Oxidaseaktivität bestehen. Zum Prüfen der These werden Einzeltiermessungen von Larven, des in seinen Ergebnissen sehr ähnlichen ABTS-Tests, folgen, da beim Test mit 7-Ethoxycumarin keine Einzeltierhomogenate gemessen werden können. 63 Peroxidasen als den Monooxygenasen zugehöriges Enzymsystem werden häufig im Zusammenhang mit metabolischer Resistenz bei Anopheles untersucht. (BROGDON et al., 1997; ETANG et al., 2007; VULULE et al., 1999) Im Peroxidaseaktivitätstest mit dem Substrat 3,3’,5,5’-Tetramethylbenzidin (TMBZ) (BROGDON et al., 1997) wird Methanol als Lösungsmittel für TMBZ verwendet. TMBZ fiel bei eigenen Versuchen, auch bei der in der Methode beschriebenen Konzentration von 25 % im Testansatz, aus. Daher und wegen der guten Wasserlöslichkeit von ABTS, wurde die alternative Methode mit ABTS entwickelt und etabliert. Enzymtests mit ABTS sind bekannt. So wird ABTS z.B. in der Forschung an Phenoloxidasen und zum Laccase vermittelten Ligninabbau angewendet (FLOCH et al., 2007; JOHANNES & MAJCHERCZYK, 2000; MARUYAMA et al., 2006; POZDNYAKOVA et al., 1994). Bisher ist ABTS für die Forschung an Insektizidresistenz und deren enzymatischen Grundlagen für Anopheles noch nicht verwendet worden. Die großen Vorteile von ABTS sind dessen sehr gute Wasserlöslichkeit, so dass keine potentiell enzymhemmenden Lösungsmittel verwendet werden müssen, und die hohe Sensitivität, die auch die Messung von Einzeltierhomogenaten und die Untersuchung von Isoenzymen in einer nativen PAGE erlaubt. Spezifische Phenoloxidasehemmer wie N-Hydroxyglycin (HATTORI et al., 2005) sind bekannt und können im ABTS-Test Aufschluss über die Beteiligung von Oxidasen an Insektizidresistenz geben. Potential und Möglichkeiten der kurz vor Abschluss der Arbeit entwickelten Methode sollen in weiteren Versuchen zur Anwendung kommen. 64 V. Zusammenfassung Anopheles gambiae ist einer der wichtigsten Überträger der Malaria, an der jährlich über eine Million Menschen sterben. Die Vektorbekämpfung und die möglicherweise mit dem Einsatz von Insektiziden verbundene Resistenzbildung sind bedeutend für die Wissenschaft, denn Insektizide sind in den betroffenen Gebieten unerlässlicher Bestandteil der Malariaprävention. Ziel der vorliegenden Arbeit war die Etablierung von Biotests und Enzymtests zur Erfassung von entstehenden oder bereits vorhandenen metabolisch bedingten Insektizidresistenzen in Anopheles gambiae. Die nach heutigem Stand des Wissens dafür wichtigsten Enzymsysteme sind Carboxylesterasen, Glutathion-S-Transferasen und Cytochrom P450 assoziierte Oxidasen. Voraussetzung für alle Tests war der Aufbau einer eigenen Mückenhaltung. Dazu wurden in einer Kooperation mit Bayer CropScience zwei Anopheles gambiae Stämme (KISUMU und RSP) im Labor an der TU-Dresden zur Entwicklung gebracht. Für die Bestimmung potentieller Insektizidresistenzen, wurde ein Larvenbiotest in 24-Well-Zellkulturtestplatten entwickelt, der schnell zuverlässige Ergebnisse lieferte. Als Alternative zur von der WHO anerkannten Methode (WHO, 2002) wurde ein Biotest für adulte Mücken in 20 ml Gläschen etabliert und auf Vorteile geprüft. Zwei in der Laborpraxis für Anopheles gängige Methoden zur Bestimmung der Enzymaktivität von Carboxylesterasen (GRANT et al., 1989) und Glutathion-S-Transferasen (HABIG et al., 1974) wurden im eigenen Labor etabliert und teils modifiziert. Der eigentlich für Spinnenmilben entwickelte Glutathion-S-Transferase-Test mit Monochlorbiman (NAUEN & STUMPF, 2002), wurde für Anopheles gambiae etabliert und modifiziert. Zur Messung der Enzymaktivität mikrosomaler Monooxygenasen wurde die Methode von DE SOUSA et al. (1995) angewandt und modifiziert. In dieser Arbeit konnte erstmalig die Monooxygenaseaktivität mit 7-Ethoxycumarin in Imagines von Anopheles gambiae bestimmt werden. Außerdem wurde erstmalig die Monooxygenaseaktivität männlicher und weiblicher Tiere getrennt voneinander betrachtet. Männchen und Weibchen zeigten dabei starke Unterschiede in ihrer Monooxygenaseaktivität. Dies ist sehr bedeutend, da die Weibchen die alleinige Vektorfunktion haben. Ein weiteres Ziel war, den sehr aufwendigen Monooxygenasetest über Korrelation mit einer anderen Methode zu vereinfachen, dazu wurde eine Methode zur Peroxidaseaktivitätsmessung mittels ABTS (2,2'-Azinobis-(3- ethylbenzthiazolin-6-sulfonsäure)) entwickelt und etabliert. Der ABTS-Test lieferte zuverlässige Ergebnisse und erlaubt Peroxidaseaktivitäten mit sehr geringen Homogenatmengen zu messen. Die Wasserlöslichkeit von ABTS ist ein weiterer Vorteil, da so auf potentiell störende organische Lösungsmittel verzichtet werden kann. 65 Die etablierten Methoden sollen in Zukunft dazu dienen eine Insektizidresistenz von Culiciden-Feldstämmen mit dem zugrundeliegenden metabolischen Mechanismus zu korrelieren. 66 VI. Literatur AMENYA, D. A., NAGURAN, R., LO, T. C., RANSON, H., SPILLINGS, B. L., WOOD, O. R., BROOKE, B. D., COETZEE, M. and KOEKEMOER, L. L. (2008). Over expression of a cytochrome P450 (CYP6P9) in a major African malaria vector, Anopheles Funestus, resistant to pyrethroids. Insect Mol Biol, 17, 19-25. AMICHOT, M., BRUN, A., CUANY, A., DE SOUZA, G., LE MOUEL, T., BRIDE, J. M., BABAULT, M., SALAUN, J. P., RAHMANI, R. and BERGE, J. B. (1998). Induction of cytochrome P450 activities in Drosophila melanogaster strains susceptible or resistant to insecticides. Comp Biochem Physiol C Pharmacol Toxicol Endocrinol, 121, 311-319. ARMSTRONG, J. A. and BRANSBY-WILLIAMS, W. R. (1961). The maintenance of a colony of Anopheles gambiae, with observations on the effects of changes in temperature. Bull World Health Organ, 24, 427-435. BALKEW, M., ELHASSEN, I., IBRAHIM, M., GEBRE-MICHAEL, T. and ENGERS, H. (2006). Very high DDT-resistant population of Anopheles pharoensis Theobald (Diptera: Culicidae) from Gorgora, northern Ethiopia. Parasite, 13, 327-329. BERNERTH and TOBIAS (1997). Exponat des Monats Juli: Stechmücken (Moskitos) als Krankheitsüberträger. Natur und Museum, 127, 240-241. BRADFORD, M. M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 72, 248-254. BRIEGEL, H. (2003). Physiological bases of mosquito ecology. J Vector Ecol, 28, 1-11. BROGDON, W. G. (1998a). Insecticide Resistance an Vector Control. Emerging Infectous Diseases. BROGDON, W. G. (1998b). Measurement of flight tone differentiates among members of the Anopheles gambiae species complex (Diptera: Culicidae). J Med Entomol, 35, 681684. BROGDON, W. G. and MCALLISTER, J. C. (1998). Insecticide resistance and vector control. Emerg Infect Dis, 4, 605-613. BROGDON, W. G., MCALLISTER, J. C. and VULULE, J. (1997). Heme peroxidase activity measured in single mosquitoes identifies individuals expressing an elevated oxidase for insecticide resistance. J Am Mosq Control Assoc, 13, 233-237. CASIMIRO, S. L., HEMINGWAY, J., SHARP, B. L. and COLEMAN, M. (2007). Monitoring the operational impact of insecticide usage for malaria control on Anopheles funestus from Mozambique. Malar J, 6, 142. 67 CDC (2002). Larval Bioassays. In Evaluating Mosquitos for Insecticide Resistance (ed. DISEASES, N. C. F. I.). CHELVANAYAGAM, P. M., BOARD PG (2001). Fly fishing for GSTs: a unified nomenclature for mammalian and insect glutathione transferases. Chemico-Biological Interactions, 133, 256-260. CHOUAIBOU, M., SIMARD, F., CHANDRE, F., ETANG, J., DARRIET, F. and HOUGARD, J. M. (2006). Efficacy of bifenthrin-impregnated bednets against Anopheles funestus and pyrethroid-resistant Anopheles gambiae in North Cameroon. Malar J, 5, 77. CUI, F., WEILL, M., BERTHOMIEU, A., RAYMOND, M. and QIAO, C. L. (2007). Characterization of novel esterases in insecticide-resistant mosquitoes. Insect Biochem Mol Biol, 37, 1131-1137. CURTIS, C. F., MILLER, J. E., HODJATI, M. H., KOLACZINSKI, J. H. and KASUMBA, I. (1998). Can anything be done to maintain the effectiveness of pyrethroid-impregnated bednets against malaria vectors? Philos Trans R Soc Lond B Biol Sci, 353, 1769-1775. CURTIS, V. and KANKI, B. (1998). Bednets and malaria. Afr Health, 20, 22-23. DAHL, C., SAHLEN, G., GRAWE, J., JOHANNISSON, A. and AMNEUS, H. (1993). Differential particle uptake by larvae of three mosquito species (Diptera: Culicidae). J Med Entomol, 30, 537-543. DAS, P. K. and SUBRAMANIAN, S. (2002). Modelling the epidemiology, transmission and control of lymphatic filariasis. Ann Trop Med Parasitol, 96 Suppl 2, S153-164. DE SOUSA, G., CUANY, A., BRUN, A., AMICHOT, M., RAHMANI, R. and BERGE, J. B. (1995). A microfluorometric method for measuring ethoxycoumarin-O-deethylase activity on individual Drosophila melanogaster abdomens: interest for screening resistance in insect populations. Anal Biochem, 229, 86-91. DESPRES, L., DAVID, J. P. and GALLET, C. (2007). The evolutionary ecology of insect resistance to plant chemicals. Trends Ecol Evol, 22, 298-307. DIALLO, M., NABETH, P., BA, K., SALL, A. A., BA, Y., MONDO, M., GIRAULT, L., ABDALAHI, M. O. and MATHIOT, C. (2005). Mosquito vectors of the 1998-1999 outbreak of Rift Valley Fever and other arboviruses (Bagaza, Sanar, Wesselsbron and West Nile) in Mauritania and Senegal. Med Vet Entomol, 19, 119-126. DING, Y., ORTELLI, F., ROSSITER, L. C., HEMINGWAY, J. and RANSON, H. (2003). The Anopheles gambiae glutathione transferase supergene family: annotation, phylogeny and expression profiles. BMC Genomics, 4, 35. ENAYATI, A. A., RANSON, H. and HEMINGWAY, J. (2005). Insect glutathione transferases and insecticide resistance. Insect Mol Biol, 14, 3-8. 68 ETANG, J., CHANDRE, F., GUILLET, P. and MANGA, L. (2004). Reduced bio-efficacy of permethrin EC impregnated bednets against an Anopheles gambiae strain with oxidase-based pyrethroid tolerance. Malar J, 3, 46. ETANG, J., MANGA, L., TOTO, J. C., GUILLET, P., FONDJO, E. and CHANDRE, F. (2007). Spectrum of metabolic-based resistance to DDT and pyrethroids in Anopheles gambiae s.l. populations from Cameroon. J Vector Ecol, 32, 123-133. FEYEREISEN, R. (1995). Molecular biology of insecticide resistance. Toxicol Lett, 82-83, 8390. FEYEREISEN, R. (1999). Insect P450 enzymes. Annu Rev Entomol, 44, 507-533. FEYEREISEN, R. (2005). Insect cytochrome P450. Comprehensive Molecular Insect Science, 177. FEYEREISEN, R., KOENER, J. F., FARNSWORTH, D. E. and NEBERT, D. W. (1989). Isolation and sequence of cDNA encoding a cytochrome P-450 from an insecticide-resistant strain of the house fly, Musca domestica. Proc Natl Acad Sci U S A, 86, 1465-1469. FFRENCH-CONSTANT, R. H. (2007). Which came first: insecticides or resistance? Trends Genet, 23, 1-4. FLOCH, C., ALARCON-GUTIERREZ, E. and CRIQUET, S. (2007). ABTS assay of phenol oxidase activity in soil. J Microbiol Methods, 71, 319-324. FOURNIER, D., BRIDE, J. M., POIRIE, M., BERGE, J. B. and PLAPP, F. W., JR. (1992). Insect glutathione S-transferases. Biochemical characteristics of the major forms from houseflies susceptible and resistant to insecticides. J Biol Chem, 267, 1840-1845. GARY, R. E., JR. and FOSTER, W. A. (2006). Diel timing and frequency of sugar feeding in the mosquito Anopheles gambiae, depending on sex, gonotrophic state and resource availability. Med Vet Entomol, 20, 308-316. GIMNIG, J. E., OMBOK, M., OTIENO, S., KAUFMAN, M. G., VULULE, J. M. and WALKER, E. D. (2002). Density-dependent development of Anopheles gambiae (Diptera: Culicidae) larvae in artificial habitats. J Med Entomol, 39, 162-172. GONZALEZ AUDINO, P., BARRIOS, S., VASSENA, C., MOUGABURE CUETO, G., ZERBA, E. and PICOLLO, M. I. (2005). Increased monooxygenase activity associated with resistance to permethrin in Pediculus humanus capitis (Anoplura: Pediculidae) from Argentina. J Med Entomol, 42, 342-345. GRANT, D. F., BENDER, D. M. and HAMMOCK, B. D. (1989). Quantitative kinetic assays for Glutathion-S-Transferase and general Esterase in individual mosquitos using an EIA Reader. Insect Biochem, 19, 741-751. 69 GUIMARAES, R. M., ASMUS, C. I. and MEYER, A. (2007). DDT reintroduction for malaria control: the cost-benefit debate for public health. Cad Saude Publica, 23, 2835-2844. HABIG, W. H., PABST, M. J. and JAKOBY, W. B. (1974). Glutathione S-transferases. The first enzymatic step in mercapturic acid formation. J Biol Chem, 249, 7130-7139. HARBORNE, J. B. (1995). Ökologische Biochemie, 4 edn. Sektrum Akademischer Verlag, Heidelberg, Berlin, Oxford. HATTORI, M., KONISHI, H., TAMURA, Y., KONNO, K. and SOGAWA, K. (2005). Laccase-type phenoloxidase in salivary glands and watery saliva of the green rice leafhopper, Nephotettix cincticeps. J Insect Physiol, 51, 1359-1365. HAYES, J. D. and PULFORD, D. J. (1995). The glutathione S-transferase supergene family: regulation of GST and the contribution of the isoenzymes to cancer chemoprotection and drug resistance. Crit Rev Biochem Mol Biol, 30, 445-600. HAZELTON, G. A. and LANG, C. A. (1983). Glutathione S-transferase activities in the yellowfever mosquito [Aedes aegypti (Louisville)] during growth and aging. Biochem J, 210, 281-287. HEMINGWAY, J. (1982). Genetics of organophosphate and carbamate resistance in Anopheles atroparvus (Diptera: Culicidae). J Econ Entomol, 75, 1055-1058. HEMINGWAY, J. (1983a). Biochemical studies on malathion resistance in Anopheles arabiensis from Sudan. Trans R Soc Trop Med Hyg, 77, 477-480. HEMINGWAY, J. (1983b). The genetics of malathion resistance in Anopheles stephensi from Pakistan. Trans R Soc Trop Med Hyg, 77, 106-108. HEMINGWAY, J., BEATY, B. J., ROWLAND, M., SCOTT, T. W. and SHARP, B. L. (2006). The Innovative Vector Control Consortium: improved control of mosquito-borne diseases. Trends Parasitol, 22, 308-312. HEMINGWAY, J., HAWKES, N., PRAPANTHADARA, L., JAYAWARDENAL, K. G. and RANSON, H. (1998). The role of gene splicing, gene amplification and regulation in mosquito insecticide resistance. Philos Trans R Soc Lond B Biol Sci, 353, 1695-1699. HEMINGWAY, J., HAWKES, N. J., MCCARROLL, L. and RANSON, H. (2004). The molecular basis of insecticide resistance in mosquitoes. Insect Biochem Mol Biol, 34, 653-665. HEMINGWAY, J. and KARUNARATNE, S. H. (1998). Mosquito carboxylesterases: a review of the molecular biology and biochemistry of a major insecticide resistance mechanism. Med Vet Entomol, 12, 1-12. HEMINGWAY, J. and RANSON, H. (2000). Insecticide resistance in insect vectors of human disease. Annu Rev Entomol, 45, 371-391. 70 HEMMER, C. J., FRIMMEL, S., KINZELBACH, R., GURTLER, L. and REISINGER, E. C. (2007). [Global warming: trailblazer for tropical infections in Germany?]. Dtsch Med Wochenschr, 132, 2583-2589. HILL, N., LENGLET, A., ARNEZ, A. M. and CARNEIRO, I. (2007). Plant based insect repellent and insecticide treated bed nets to protect against malaria in areas of early evening biting vectors: double blind randomised placebo controlled clinical trial in the Bolivian Amazon. BMJ, 335, 1023. HODGSON, E., ROSE, R. L., GOH, D. K., ROCK, G. C. and ROE, R. M. (1993). Insect cytochrome P-450: metabolism and resistance to insecticides. Biochem Soc Trans, 21, 1060-1065. HODJATI, M. H. and CURTIS, C. F. (1999). Effects of permethrin at different temperatures on pyrethroid-resistant and susceptible strains of Anopheles. Med Vet Entomol, 13, 415422. IRAC (2007). Prevention and management of insecticide resistance in vectors and pests of public health importance. IRAC meeting 2007 manual. JOHANNES, C. and MAJCHERCZYK, A. (2000). Laccase activity tests and laccase inhibitors. J Biotechnol, 78, 193-199. KAMAU, L. and VULULE, J. M. (2006). Status of insecticide susceptibility in Anopheles arabiensis from Mwea rice irrigation scheme, Central Kenya. Malar J, 5, 46. KARUNARATNE, S. H., HEMINGWAY, J., JAYAWARDENA, K. G., DASSANAYAKA, V. and VAUGHAN, A. (1995). Kinetic and molecular differences in the amplified and nonamplified esterases from insecticide-resistant and susceptible Culex quinquefasciatus mosquitoes. J Biol Chem, 270, 31124-31128. KAUFMAN, M. G., WANJA, E., MAKNOJIA, S., BAYOH, M. N., VULULE, J. M. and WALKER, E. D. (2006). Importance of algal biomass to growth and development of Anopheles gambiae larvae. J Med Entomol, 43, 669-676. KILLEEN, G. F., MCKENZIE, F. E., FOY, B. D., BOGH, C. and BEIER, J. C. (2001). The availability of potential hosts as a determinant of feeding behaviours and malaria transmission by African mosquito populations. Trans R Soc Trop Med Hyg, 95, 469476. KISZEWSKI, A., JOHNS, B., SCHAPIRA, A., DELACOLLETTE, C., CROWELL, V., TAN-TORRES, T., AMENESHEWA, B., TEKLEHAIMANOT, A. and NAFO-TRAORE, F. (2007). Estimated global resources needed to attain international malaria control goals. Bull World Health Organ, 85, 623-630. KLIMM, R. (2002). Malaria: Malaria war in Mitteleuropa heimisch. Dtsch Arztebl. 71 KOENRAADT, C. J., PAAIJMANS, K. P., GITHEKO, A. K., KNOLS, B. G. and TAKKEN, W. (2003). Egg hatching, larval movement and larval survival of the malaria vector Anopheles gambiae in desiccating habitats. Malar J, 2, 20. KOMALAMISRA, N., TRONGTOKIT, Y., PALAKUL, K., PRUMMONGKOL, S., SAMUNG, Y., APIWATHNASORN, C., PHANPOOWONG, T., ASAVANICH, A. and LEEMINGSAWAT, S. (2006). Insecticide susceptibility of mosquitoes invading tsunami-affected areas of Thailand. Southeast Asian J Trop Med Public Health, 37 Suppl 3, 118-122. KOSTAROPOULOS, I., PAPADOPOULOS, A. I., METAXAKIS, A., BOUKOUVALA, E. and PAPADOPOULOU-MOURKIDOU, E. (2001). Glutathione S-transferase in the defence against pyrethroids in insects. Insect Biochem Mol Biol, 31, 313-319. LAHL, U. and HAWXWELL, K. A. (2006). REACH- The new european chemicals law. Environmental Science & Technology, 7115-7121. LI, X., SCHULER, M. A. and BERENBAUM, M. R. (2007). Molecular mechanisms of metabolic resistance to synthetic and natural xenobiotics. Annu Rev Entomol, 52, 231-253. LUMJUAN, N., STEVENSON, B. J., PRAPANTHADARA, L. A., SOMBOON, P., BROPHY, P. M., LOFTUS, B. J., SEVERSON, D. W. and RANSON, H. (2007). The Aedes aegypti glutathione transferase family. Insect Biochem Mol Biol, 37, 1026-1035. MAIER, W. A. (2004). Das Verschwinden des Sumpffiebers in Europa: Zufall oder Notwendigkeit? Denisia, 13, 515-527. MAIER, W. A., GRUNEWALD, J., HABEDANK, B., HARTELT, K., KAMPEN, H., KIMMIG, P., NAUCKE, T., OEHME, R., VOLLMER, A., SCHÖLER, A. and SCHMITT, C. (2003). Mögliche Auswirkungen von Klimaveränderungen auf die Ausbreitung von primär humanmedizinisch relevanten Krankheitserregern über tierische Vektoren sowie auf die wichtigen Humanparasiten in Deutschland. Vol. 200 61 218/11 (ed. UMWELTBUNDESAMT), pp. 1-389. Bonn. MAK, J. W. (1987). Epidemiology of lymphatic filariasis. Ciba Found Symp, 127, 5-14. MARR, J. S. and CALISHER, C. H. (2003). Alexander the Great and West Nile virus encephalitis. Emerg Infect Dis, 9, 1599-1603. MARTINI (1933). Epidemiologische Plauderei Über Boden und Malaria. Journal of Molecular Medicine, 12, 29-30. MARTINEZ-TORRES, D, CHANDRE, F, WILLIAMSON, MS, DARRIET, F, BERGE, JB, DEVONSHIRE, AL, GUILLET, P, PASTEUR, N, PAURON, D. (1998). Molecular characterization of pyrethrois knockdown resistance (kdr) in the major malaria vector Anopheles gambiae s.s. Insect Biochem Mol Biol, 7, 179-184 72 MARUYAMA, T., KOMATSU, C., MICHIZOE, J., ICHINOSE, H. and GOTO, M. (2006). Laccasemediated oxidative degradation of the herbicide dymron. Biotechnol Prog, 22, 426430. MATTINGLY, P. F. (1977). Names for the Anopheles gambiae Complex. Mosquito Systematics, 9(3), 223-228. MCABEE, R. D., KANG, K. D., STANICH, M. A., CHRISTIANSEN, J. A., WHEELOCK, C. E., INMAN, A. D., HAMMOCK, B. D. and CORNEL, A. J. (2004). Pyrethroid tolerance in Culex pipiens pipiens var molestus from Marin County, California. Pest Manag Sci, 60, 359-368. MEHLHORN, H. and PIEKARSKI, G. (1998). Grundriß der Parasitenkunde, 5 edn. Gustav Fischer Verlag. MULLER, P., CHOUAIBOU, M., PIGNATELLI, P., ETANG, J., WALKER, E. D., DONNELLY, M. J., SIMARD, F. and RANSON, H. (2008). Pyrethroid tolerance is associated with elevated expression of antioxidants and agricultural practice in Anopheles arabiensis sampled from an area of cotton fields in Northern Cameroon. Mol Ecol, 17, 1145-1155. NAUEN, R. and STUMPF, N. (2002). Fluorometric microplate assay to measure glutathione Stransferase activity in insects and mites using monochlorobimane. Anal Biochem, 303, 194-198. NAZNI, W. A., LEE, H. L. and AZAHARI, A. H. (2005). Adult and larval insecticide susceptibility status of Culex quinquefasciatus (Say) mosquitoes in Kuala Lumpur Malaysia. Trop Biomed, 22, 63-68. NG'HABI, K. R., JOHN, B., NKWENGULILA, G., KNOLS, B. G., KILLEEN, G. F. and FERGUSON, H. M. (2005). Effect of larval crowding on mating competitiveness of Anopheles gambiae mosquitoes. Malar J, 4, 49. OKECH, B. A., GOUAGNA, L. C., YAN, G., GITHURE, J. I. and BEIER, J. C. (2007). Larval habitats of Anopheles gambiae s.s. (Diptera: Culicidae) influences vector competence to Plasmodium falciparum parasites. Malar J, 6, 50. ORNSTEIN, L. (1964). Disc Electrophoresis. I. Background and Theory. Ann N Y Acad Sci, 121, 321-349. PAGES, F., ORLANDI-PRADINES, E. and CORBEL, V. (2007). [Vectors of malaria: biology, diversity, prevention, and individual protection]. Med Mal Infect, 37, 153-161. PAILY, K. P., HOTI, S. L. and BALARAMAN, K. (2006). Development of lymphatic filarial parasite Wuchereria bancrofti (Spirurida: Onchocercidae) in mosquito species (Diptera: Culicidae) fed artificially on microfilaremic blood. J Med Entomol, 43, 1222-1226. 73 POZDNYAKOVA, N., LEONTIEVSKY, A. and GOLOVLEVA, L. (1994). Oxidase of the white rot fungus Panus tigrinus 8/18. FEBS Lett, 350, 192-194. PRAPANTHADARA, L. A. and KETTERMAN, A. J. (1993). Qualitative and quantitative changes in glutathione S-transferases in the mosquito Anopheles gambiae confer DDTresistance. Biochem Soc Trans, 21 ( Pt 3), 304S. RANSON, H. and HEMINGWAY, J. (2005). Mosquito glutathione transferases. Methods Enzymol, 401, 226-241. RANSON, H, JENSEN, B, VULULE, JM, WANG, X, HEMINGWAY, J, COLLINS, FH. (2000). Identification of mutation in the voltage-gated sodium channel gene of Kenyan Anopheles gambiae associated with resistance to DDT and pyrethroids. Insect Biochem Mol Biol,9, 491-497 RANSON, H., ROSSITER, L., ORTELLI, F., JENSEN, B., WANG, X., ROTH, C. W., COLLINS, F. H. and HEMINGWAY, J. (2001). Identification of a novel class of insect glutathione Stransferases involved in resistance to DDT in the malaria vector Anopheles gambiae. Biochem J, 359, 295-304. RAUCH, N. and NAUEN, R. (2004). Characterization and molecular cloning of a glutathione Stransferase from the whitefly Bemisia tabaci (Hemiptera: Aleyrodidae). Insect Biochem Mol Biol, 34, 321-329. ROBERTS, D. R. and ANDRE, R. G. (1994). Insecticide resistance issues in vector-borne disease control. Am J Trop Med Hyg, 50, 21-34. RODRIGUEZ, M. M., BISSET, J., RUIZ, M. and SOCA, A. (2002). Cross-resistance to pyrethroid and organophosphorus insecticides induced by selection with temephos in Aedes aegypti (Diptera: Culicidae) from Cuba. J Med Entomol, 39, 882-888. RODRIGUEZ, M. M., BISSET, J. A., DIAZ, C. and SOCA, L. A. (2003). [Cross resistance to pyrethroids in Aedes aegypti from Cuba induced by the selection with organophosphate malathion]. Rev Cubana Med Trop, 55, 105-111. ROGAN, W. J. and CHEN, A. (2005). Health risks and benefits of bis(4-chlorophenyl)-1,1,1trichloroethane (DDT). Lancet, 366, 763-773. SAWICKI, R., SINGH, S. P., MONDAL, A. K., BENES, H. and ZIMNIAK, P. (2003). Cloning, expression and biochemical characterization of one Epsilon-class (GST-3) and ten Delta-class (GST-1) glutathione S-transferases from Drosophila melanogaster, and identification of additional nine members of the Epsilon class. Biochem J, 370, 661669. SCHINER (1862). Die Fliegen (Diptera). Fauna Austriaca, 1, 674. STRAIF, S. C. and BEIER, J. C. (1996). Effects of sugar availability on the blood-feeding behavior of Anopheles gambiae (Diptera:Culicidae). J Med Entomol, 33, 608-612. 74 TIMMERMANN and BRIEGEL (1996). Effect of plant, fungal and animal diets on mosquito development. Entomologia Experimentalis et Applicata, 80, 173-176. TIMMERMANN and BRIEGEL (1999). Larval growth and biosynthesis of reserves in mosquitoes. Journal of Insect Physiology, 45, 461-470. TURUSOV, V., RAKITSKY, V. and TOMATIS, L. (2002). Dichlorodiphenyltrichloroethane (DDT): ubiquity, persistence, and risks. Environ Health Perspect, 110, 125-128. TUTEJA, R. (2007). Malaria - an overview. FEBS J, 274, 4670-4679. UDOMSINPRASERT, R., PONGJAROENKIT, S., WONGSANTICHON, J., OAKLEY, A. J., PRAPANTHADARA, L. A., WILCE, M. C. and KETTERMAN, A. J. (2005). Identification, characterization and structure of a new Delta class glutathione transferase isoenzyme. Biochem J, 388, 763-771. VONTAS, J., BLASS, C., KOUTSOS, A. C., DAVID, J. P., KAFATOS, F. C., LOUIS, C., HEMINGWAY, J., CHRISTOPHIDES, G. K. and RANSON, H. (2005). Gene expression in insecticide resistant and susceptible Anopheles gambiae strains constitutively or after insecticide exposure. Insect Mol Biol, 14, 509-521. VONTAS, J. G., SMALL, G. J. and HEMINGWAY, J. (2001). Glutathione S-transferases as antioxidant defence agents confer pyrethroid resistance in Nilaparvata lugens. Biochem J, 357, 65-72. VULULE, J. M., BEACH, R. F., ATIELI, F. K., MCALLISTER, J. C., BROGDON, W. G., ROBERTS, J. M., MWANGI, R. W. and HAWLEY, W. A. (1999). Elevated oxidase and esterase levels associated with permethrin tolerance in Anopheles gambiae from Kenyan villages using permethrin-impregnated nets. Med Vet Entomol, 13, 239-244. VULULE, J. M., BEACH, R. F., ATIELI, F. K., MOUNT, D. L., ROBERTS, J. M. and MWANGI, R. W. (1996). Long-term use of permethrin-impregnated nets does not increase Anopheles gambiae permethrin tolerance. Med Vet Entomol, 10, 71-79. WENK, P. and RENZ, A. (2003). Parasitologie Biologie der Humanparasiten, 1. edn. Georg Thieme Verlag. WEYER, F. (1954). Bestimmungsschlüssel für die Anopheles-Weibchen und Larven in Europa, Nordafrika und Westasien. Medizinisch wichtige Insekten, Merkblatt 12. WHO (2002). SUPPLIES FOR MONITORING INSECTICIDE RESISTANCE IN DISEASE VECTORS Procedures and conditions. In WHO/CDS/CPE/PVC/2001.2. WHO, R., UNICEF (2005). Malaria World Report 2005. 75 WINAYANUWATTIKUN, P. and KETTERMAN, A. J. (2004). Catalytic and structural contributions for glutathione-binding residues in a Delta class glutathione S-transferase. Biochem J, 382, 751-757. WONGSANTICHON, J. and KETTERMAN, A. J. (2006). An intersubunit lock-and-key 'clasp' motif in the dimer interface of Delta class glutathione transferase. Biochem J, 394, 135-144. YANG, Y., WU, Y., CHEN, S., DEVINE, G. J., DENHOLM, I., JEWESS, P. and MOORES, G. D. (2004). The involvement of microsomal oxidases in pyrethroid resistance in Helicoverpa armigera from Asia. Insect Biochem Mol Biol, 34, 763-773. ZHANG, J., LAN, W., QIAO, C., JIANG, H., MULCHANDANI, A. and CHEN, W. (2004). Bioremediation of organophosphorus pesticides by surface-expressed carboxylesterase from mosquito on Escherichia coli. Biotechnol Prog, 20, 1567-1571. ZHANG, Z. and YANG, C. (1996). Application of deltamethrin-impregnated bednets for mosquito and malaria control in Yunnan, China. Southeast Asian J Trop Med Public Health, 27, 367-371. ZHU, F., FENG, J. N., ZHANG, L. and LIU, N. (2008). Characterization of two novel cytochrome P450 genes in insecticide-resistant house-flies. Insect Mol Biol, 17, 27-37. ZLOTKIN, E. (1999). The insect voltage-gated sodium channel as target of insecticides. Annu Rev Entomol, 44, 429-455. 76 Selbständigkeitserklärung Die vorliegende Arbeit ist am Institut für Zoologie, Abteilung Spezielle Zoologie und Parasitologie der TU-Dresden unter Leitung von Herrn Prof. Dr. R. Entzeroth angefertigt worden. Hiermit versichere ich, dass ich die vorliegende Arbeit ohne unzulässige Hilfe Dritter und Benutzung anderer als der angegebenen Hilfsmittel angefertigt habe. Aus fremden Quellen direkt oder indirekt übernommene Gedanken sind als solche kenntlich gemacht. Die Arbeit wurde bisher weder im Inland noch im Ausland in gleicher oder ähnlicher Form einer anderen Prüfungsbehörde vorgelegt. Dresden, März 2008 Sacha Hanig 77