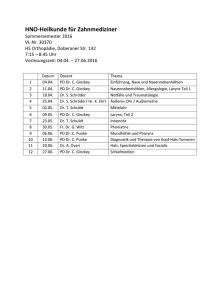
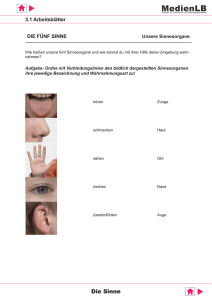
Dokument_16.
Werbung

Aus der Hals-Nasen-Ohren-Klinik, Kopf- und Halschirurgie der Friedrich-Alexander-Universität Erlangen-Nürnberg Direktor: Prof. Dr. med. Heinrich Iro Retrospektive Erhebung zum Krankheitsverlauf von Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen Prognosefaktoren der Plattenepithelkarzinome der inneren Nase und der Nasennebenhöhlen Inaugural-Dissertation zur Erlangung der Doktorwürde an der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg vorgelegt von Christian Hubert Giesen aus Wesel Gedruckt mit Erlaubnis der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg Dekan: Prof. Dr. Dr. h.c. J. Schüttler Referent: Prof. Dr. H. Iro Korreferent: Priv.-Doz. Dr. M. Koch Tag der mündlichen Prüfung: 18. Januar 2012 Diese Dissertation widme ich meinen Eltern Ulrike und Hubert Giesen Inhaltsverzeichnis 1 2 3 Zusammenfassung...................................................................................................1 1.1 Hintergrund und Ziele .................................................................................................. 1 1.2 Methoden ...................................................................................................................... 1 1.3 Ergebnisse und Beobachtungen.................................................................................... 1 1.4 Praktische Schlussfolgerungen..................................................................................... 2 Abstract....................................................................................................................3 2.1 Background and objectives........................................................................................... 3 2.2 Materials and methods ................................................................................................. 3 2.3 Results........................................................................................................................... 3 2.4 Conclusions .................................................................................................................. 4 Einleitung.................................................................................................................5 3.1 Topographische Anatomie der Nasenhöhle und Sinus paranasales............................. 6 3.2 Anatomie aus onkologischer Sicht................................................................................ 7 3.3 Klassifikation und Stadieneinteilung ............................................................................ 8 4 Material und Methoden........................................................................................15 5 Ergebnisse ..............................................................................................................16 5.1 Alters- und Geschlechtsverteilung.............................................................................. 16 5.2 Lokalisation des Primärtumors .................................................................................. 17 5.3 Seitenlokalisation........................................................................................................ 18 5.4 Klinische T-Klassifikation des Primärtumors ............................................................ 19 5.4.1 C-Faktor für die T-Klassifikation des Primärtumors ........................................ 19 5.4.2 Verteilung der klinischen T-Klassifikation des Primärtumors in den Therapiegruppen ............................................................................................... 20 5.5 Pathologische T-Klassifikation des Primärtumors..................................................... 23 5.5.1 Verteilung der pathologischen T-Klassifikation des Primärtumors in den Therapiegruppen ............................................................................................... 24 5.6 Klinische N-Klassifikation Diagnostik, klinische N-Klassifikation ............................ 26 5.7 Klinische M-Klassifikation Diagnostik, klinische M-Klassifikation........................... 27 5.8 Befall von Schädelbasis und Zentralnervensystem (ZNS) .......................................... 27 5.9 Orbitabefall ................................................................................................................ 28 5.9.1 Therapie und Operationstechnik bei Orbitabefall............................................. 28 5.10 Chemotherapie............................................................................................................ 29 5.11 Radiotherapie ............................................................................................................. 29 5.12 Operation.................................................................................................................... 29 5.13 Therapiegruppen ........................................................................................................ 31 5.14 Histopathologische Klassifikation, Grading .............................................................. 32 5.15 UICC-Stadieneinteilung ............................................................................................. 34 5.15.1 Verteilung der UICC-Stadien in den Therapiegruppen .................................... 35 6 5.17 pT-Klassifikation des Primärtumors........................................................................... 36 5.18 Rezidivmuster.............................................................................................................. 38 5.19 Todesursache .............................................................................................................. 39 5.20 Überlebensanalysen.................................................................................................... 40 5.20.1 Therapieunabhängige Prognosefaktoren........................................................... 43 5.20.2 Therapieabhängige Prognosefaktoren............................................................... 51 5.20.3 Therapieunabhängige und therapieabhängige Prognosefaktoren kombiniert ... 54 Diskussion ..............................................................................................................62 6.1 Häufigkeit und Ätiologie von Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen...................................................................................................... 62 6.2 Alters- und Geschlechtsverteilung.............................................................................. 63 6.3 Symptomatik................................................................................................................ 65 6.4 Lokalisation, Histologie und Grading ........................................................................ 67 6.5 Orbitabeteiligung........................................................................................................ 68 6.6 Schädelbasisbeteiligung und ZNS-Beteiligung........................................................... 69 6.7 UICC-Stadium ............................................................................................................ 71 6.8 Pathologische T-Klassifikation................................................................................... 71 6.9 R-Klassifikation .......................................................................................................... 71 6.10 Diagnostik................................................................................................................... 72 6.10.1 Klinische Diagnostik......................................................................................... 72 6.10.2 Bildgebende Diagnostik.................................................................................... 72 6.10.3 Diagnostik: Vergleich Klinische T-Klassifikation und pathologische TKlassifikation .................................................................................................... 74 6.10.4 Biopsie .............................................................................................................. 75 6.11 Therapie...................................................................................................................... 75 6.12 Therapieprinzipien...................................................................................................... 77 6.13 Zusammenfassung der signifikanten Prognosefaktoren ............................................. 80 7 Abkürzungsverzeichnis ........................................................................................81 8 Literatur.................................................................................................................82 9 Anhang ...................................................................................................................92 10 Danksagung ...........................................................................................................96 Abbildungsverzeichnis Abbildung 1: Die 3 Etagen nach Sébileau (97; 39)...........................................................9 Abbildung 2: Geschlechtsverteilung der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen .........................................................16 Abbildung 3: Altersverteilung der 168 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen (Von einem der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhle war das Alter zum Zeitpunkt der Diagnosestellung nicht bekannt.) ....................................17 Abbildung 4: Überblick über die Lokalisation des Primärtumors der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen.............18 Abbildung 5: Verteilung der Seitenlokalisation der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen ...................18 Abbildung 6: Verteilung der klinischen T-Klassifikation der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen ...................19 Abbildung 7: Verteilung der klinischen T-Klassifikation der 10 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die keiner Therapie unterzogen wurden...................................................................................20 Abbildung 8: Verteilung der klinischen T-Klassifikation der 10 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer Radiotherapie und Chemotherapie unterzogen wurden ..........................................21 Abbildung 9: Verteilung der klinischen T-Klassifikation der 31 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer alleinigen Operation unterzogen wurden ................................................................21 Abbildung 10: Verteilung der klinischen T-Klassifikation der 29 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer alleinigen Radiotherapie unterzogen wurden..........................................................22 Abbildung 11: Verteilung der klinischen T-Klassifikation der 62 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer Operation und Radiotherapie unterzogen wurden...................................................22 Abbildung 12: Verteilung der klinischen T-Klassifikation der 25 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer Operation und Radiotherapie und Chemotherapie unterzogen wurden ..................23 Abbildung 13: Verteilung der pathologischen T-Klassifikation der 118 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen ...................24 Abbildung 14: Verteilung der pathologischen T-Klassifikation der 31 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer alleinigen Operation unterzogen wurden ................................................................25 Abbildung 15: Verteilung der pathologischen T-Klassifikation der 62 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer Operation und Radiotherapie unterzogen wurden...................................................25 Abbildung 16: Verteilung der klinischen T-Klassifikation der 25 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer Operation und Radiotherapie und Chemotherapie unterzogen wurden ..................26 Abbildung 17: Verteilung der klinischen N-Klassifikation der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen ...................27 Abbildung 18: Übersicht über den Befall von Schädelbasis und Zentralnervensystem der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen ..................................................................................................28 Abbildung 19: Übersicht über die Therapiegruppen der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen ...................32 Abbildung 20: Histopathologische Klassifikation bei 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen ...............33 Abbildung 21: Grading bei 143 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen (bei 26 der 169 Patienten lagen keine Angaben über das Grading vor)..............................................................................................33 Abbildung 22: UICC-Stadieneinteilung der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen .........................................................34 Abbildung 23: Gesamtüberleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen ...............................................................41 Abbildung 24: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen ...............42 Abbildung 25: Rezidivfreies Überleben von 115 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der pathologischen T-Klassifikation (3 Patienten pTX; aus Berechnung ausgeschlossen) (p=0,048) ......................................................................................43 Abbildung 26: Rezidivfreies Überleben von 115 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der pathologischen T-Klassifikation gruppiert (3 Patienten pTX; aus Berechnung ausgeschlossen) (p=0,122) ......................................................................................44 Abbildung 27: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom UICC-Stadium gruppiert (p<0,001) ........................................................................45 Abbildung 28: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Orbitabefall (p=0,063) ............................................................................................46 Abbildung 29: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Schädelbasisbefall und ZNS-Befall (p=0,011) .......................................................47 Abbildung 30: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Schädelbasisbefall und ZNS-Befall (p=0,025) .......................................................48 Abbildung 31: Rezidivfreies Überleben von 143 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Grading gruppiert (bei 26 Patienten lag keine Angabe über das Grading vor; von der Berechnung ausgeschlossen) (p=0,071)............................................................49 Abbildung 32: Rezidivfreies Überleben von 111 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der RKlassifikation gruppiert (7 Patienten R-Klassifikation RX vor; von der Berechnung ausgeschlossen) (p<0,001)..................................................................50 Abbildung 33: Rezidivfreies Überleben von 159 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der Therapiegruppe (10 Patienten keine Therapie; wurden aus der Berechnung ausgeschlossen) (p<0,001) ......................................................................................51 Abbildung 34: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der Operation (p<0,001)................................................................................................52 Abbildung 35: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der Radiotherapie ..........................................................................................................53 Abbildung 36: Rezidivfreies Überleben von 115 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der path. T-Klassifikation und der Therapiegruppe (3 Patienten pTX; aus den Berechnung ausgeschlossen) (p=0,030)..................................................................54 Abbildung 37: Rezidivfreies Überleben von 43 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von den Therapiegruppen OP und OP+RT und der pT-Klassifikation gruppiert pT4a+ pT4b (p=0,015) .......................................................................................................55 Abbildung 38: Rezidivfreies Überleben von 38 operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen und Orbitabefall in Abhängigkeit von der Therapiegruppe ...........................................56 Abbildung 39: Rezidivfreies Überleben von 17 nicht operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen und Orbitabefall in Abhängigkeit von den Therapiegruppen RT und RT+CT (p=0,017).................................................................................................................57 Abbildung 40: Rezidivfreies Überleben von 16 nicht operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen und Schädelbasisbefall und/ oder ZNS-Befall in Abhängigkeit von den Therapiegruppen RT und RT+CT (p=0,009)..........................................................58 Abbildung 41: Rezidivfreies Überleben von 107 operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Grading und der Therapiegruppe (36 Pat. ohne OP, 26 Pat. k.A. Grading; von der Berechnung ausgeschlossen) ..............................................59 Abbildung 42: Rezidivfreies Überleben von 37 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen bei einer pT1- bis pT3Klassifikation mit einer R0-Klassifikation im Vergleich der beiden Gruppen OP und OP+RT (p=0,515) ............................................................................................60 Abbildung 43: Rezidivfreies Überleben von 29 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen bei einer pT4a- oder pT4bKlassifikation mit einer R0-Klassifikation im Vergleich der beiden Gruppen OP und OP+RT (p=0,013) ............................................................................................61 Abbildung 44: Dokumentationsbogen, Maligne Tumore des HNO-Bereichs ................95 Tabellenverzeichnis Tabelle 1: Operationstechnik und Therapiegruppen der 59 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen mit Orbitabefall (die 38 operierten Patienten mit Orbitabefall sind in der Tabelle grau unterlegt) .........................................................................................................29 Tabelle 2: Operationstechnik und die Therapiegruppen der 118 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die operiert wurden .......................................................................................................30 Tabelle 3: Operationstechnik und die Lokalisation der 118 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die operiert wurden .......................................................................................................31 Tabelle 4: Operationstechnik und die klinische T-Klassifikation der 118 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die operiert wurden .......................................................................................................31 Tabelle 5: T- und N-Klassifikation der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen ...............................................................34 Tabelle 6: Verteilung der UICC-Stadien in den Therapiegruppen der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen.............35 Tabelle 7: R-Klassifikation und die Therapiegruppen der 118 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die operiert wurden .......................................................................................................36 Tabelle 8: Operationstechnik und die pathologische T-Klassifikation der 118 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die operiert wurden.....................................................................................37 Tabelle 9: Pathologische T-Klassifikation und die Lokalisation der 118 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen ...................37 Tabelle 10: Vergleich zwischen klinischer T-Klassifikation und pathologischer TKlassifikation der 118 Patienten mit Plattenepithelkarzinom der inneren Nase und Nasennebenhöhlen, die einer Operation unterzogen wurden...........................38 Tabelle 11: Vergleich zwischen klinischer T-Klassifikation und pathologischer TKlassifikation der 31 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, bei denen eine alleinige Operation durchgeführt wurde.......................................................................................................................38 Tabelle 12: Rezidivmuster der 163 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen (bei 6 der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen lag keine Angabe über das Rezidivmuster vor)......................................................................39 Tabelle 13: Todesursache der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen unterteilt nach Therapiegruppen ........................40 Tabelle 14: Gesamtüberleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen ...............................................................41 Tabelle 15: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen .............................................42 Tabelle 16: Rezidivfreies Überleben von 115 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der pathologischen T-Klassifikation (3 Patienten pTX; aus Berechnung ausgeschlossen) (p=0,048) ......................................................................................43 Tabelle 17: Rezidivfreies Überleben von 115 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der pathologischen T-Klassifikation gruppiert (3 Patienten pTX; aus Berechnung ausgeschlossen) (p=0,122) ......................................................................................44 Tabelle 18: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom UICCStadium gruppiert (p<0,001)...................................................................................45 Tabelle 19: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Orbitabefall (p=0,063).................................................................................................................46 Tabelle 20: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Schädelbasisbefall und ZNS-Befall (p=0,011) .......................................................47 Tabelle 21: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Schädelbasisbefall und ZNS-Befall (p=0,025) .......................................................48 Tabelle 22: Rezidivfreies Überleben v. 143 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Grading gruppiert (bei 26 Patienten lag keine Angabe über das Grading vor; von der Berechnung ausgeschlossen) (p=0,071)..................................................................49 Tabelle 23: Rezidivfreies Überleben von 111 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der RKlassifikation gruppiert (7 Patienten R-Klassifikation RX vor; von der Berechnung ausgeschlossen) (p<0,001) .............................................................................50 Tabelle 24: Rezidivfreies Überleben von 159 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der Therapiegruppe (10 Patienten keine Therapie; wurden aus der Berechnung ausgeschlossen) (p<0,001) ......................................................................................51 Tabelle 25: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der Operation (p<0,001).................................................................................................................52 Tabelle 26: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der Radiotherapie ..........................................................................................................53 Tabelle 27: Rezidivfreies Überleben von 115 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der path. TKlassifikation und der Therapiegruppe (3 Patienten pTX; aus den Berechnung ausgeschlossen) (p=0,030) ......................................................................................54 Tabelle 28: Rezidivfreies Überleben von 43 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von den Therapiegruppen OP und OP+RT und der pT-Klassifikation gruppiert pT4a+ pT4b (p=0,015) .......................................................................................................55 Tabelle 29: Rezidivfreies Überleben von 38 operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen und Orbitabefall in Abhängigkeit von der Therapiegruppe ...........................................56 Tabelle 30: Rezidivfreies Überleben von 17 nicht operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen und Orbitabefall in Abhängigkeit von den Therapiegruppen RT und RT+CT (p=0,017).................................................................................................................57 Tabelle 31: Rezidivfreies Überleben von 16 nicht operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen und Schädelbasisbefall und/ oder ZNS-Befall in Abhängigkeit von den Therapiegruppen RT und RT+CT (p=0,009)..........................................................58 Tabelle 32: Rezidivfreies Überleben von 107 operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Grading und der Therapiegruppe (36 Pat. ohne OP, 26 Pat. k.A. Grading; von der Berechnung ausgeschlossen) ..............................................59 Tabelle 33: Rezidivfreies Überleben von 37 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen bei einer pT1- bis pT3-Klassifikation mit einer R0-Klassifikation im Vergleich der beiden Gruppen OP und OP+RT (p=0,515) ...................................................................................................60 Tabelle 34: Rezidivfreies Überleben von 29 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen bei einer pT4a- oder pT4bKlassifikation mit einer R0-Klassifikation im Vergleich der beiden Gruppen OP und OP+RT (p=0,013) ............................................................................................61 Tabelle 35: Zusammenfassung der signifikanten Prognosefaktoren ..............................80 1 1 Zusammenfassung 1.1 Hintergrund und Ziele Die Ziele sind, die Prognosefaktoren für das Überleben bei Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen zu untersuchen und die Kombination einer Operation und Radiotherapie hinsichtlich des rezidivfreien Überlebens zu beurteilen. 1.2 Methoden Es wurden 169 Patienten (119 m, 50 w) aufgrund von Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen behandelt, die in der Hals-Nasen-OhrenKlinik, Kopf- und Halschirurgie des Universitätsklinikums Erlangen zwischen 1970 und 2006 diagnostiziert wurden. Die klinischen und radiologischen Daten dieser Patienten wurden ausgewertet. Das mediane Alter zum Zeitpunkt der Diagnose betrug 65 Jahre (Intervall: 31-88 Jahre). Zum Zeitpunkt der Datenanalyse waren 50 Patienten am Leben. Alle Tumore wurden unter Verwendung der 6. Auflage der TNM-Klassifikation (2002) klassifiziert. Aufgrund des retrospektiven Beobachtungszeitraums von 36 Jahren musste ein Teil der Patienten auf Grundlage ihrer Akten rückwirkend re-klassifiziert werden. Die statistische Analyse wurde unter Verwendung der Computersoftware SPSS (Version 15.0 und 17.0; SPSS, Inc., Chicago, IL) durchgeführt. Die Berechnungen des rezidivfreien Überlebens und Gesamtüberlebens beruhen auf der Kaplan-MeierMethode. 1.3 Ergebnisse und Beobachtungen Die rezidivfreien 5- und 10- Jahresüberlebensraten aller Patienten betrug 29,2% und 25,6%. Die schlechte Prognose dieses Karzinoms kann durch die große Anzahl fortgeschrittener Tumoren erklärt werden. Eine fortgeschrittene Erkrankung war vorherrschend mit 49,2% der pT4-Klassifikation. Bei 59 Patienten (34,9%) hatte der Tumor die Orbita infiltriert. Die Schädelbasis war bei 17 (10,1%) Patienten beteiligt, das ZNS bei 29 (17,2%) Patienten. ZNS-Infiltration und/ oder Schädelbasisinfiltration lag als ein signifikant negativer Prognosefaktor für ein rezidivfreies Überleben vor (p=0,011). Die Kriterien Tumorgrading (p=0,071) und Beteiligung der Orbita (p=0,063) hatten keine signifikante Auswirkungen auf die Prognose. Patienten, die eine Operation oder eine Kombination Operation/ Radiotherapie hatten, überlebten signifikant länger 2 als diejenigen, die nur mit einer alleinigen Radiotherapie behandelt wurden (p<0,001). Dies zeigt die Überlegenheit des Konzeptes einer operativen Behandlung. Operative Techniken variierten, jedoch wurde die R-Klassifikation als Prognosefaktor ermittelt. Das rezidivfreie Überleben stieg von 1,0 Jahren in der Gruppe mit Patienten mit R1und R2- bis 9,8 Jahre bei Patienten mit R0-Klassifikation (p<0,001). In der pT1-3 Gruppe mit R0-Klassifikation hatte die adjuvante Radiotherapie keine signifikante Auswirkung auf die Prognose (p=0,515). In der pT4 Gruppe mit R0-Klassifikation hat sich bei der adjuvanten Radiotherapie eine signifikant überlegene Verlängerung des rezidivfreien Überlebens im Vergleich zur alleinigen Operation ergeben (p=0,013). 1.4 Praktische Schlussfolgerungen Trotz verschiedener negativer Prognosefaktoren zeigen die Ergebnisse, dass eine R0Resektion als ein hauptsächliches Ziel bei einer operativen Behandlung bleibt. Selbst bei einer R0-Resektion sollte immer eine adjuvante Radiotherapie in Fällen einer pT4Klassifikation in Betracht kommen. 3 2 Abstract 2.1 Background and objectives The aims are to investigate prognostic factors of survival for squamous cell carcinoma of the inner nose and paranasal sinuses and evaluate the combination of surgery and radiotherapy on disease-free survival. 2.2 Materials and methods 169 patients (119 m, 50 f) treated for squamous cell carcinoma arising from the inner nose and paranasal sinuses, diagnosed in the Department of Otorhinolaryngology, Head- and Neck-Surgery at the University Hospital of Erlangen between 1970 and 2006, were identified and their clinical and radiological data evaluated. The median age at time of diagnosis was 65 years (range: 31-88 years). At the time of data analysis 50 patients were still alive. All tumors were staged using the 2002 TNM-classification, but because of the retrospective character with 36 years of observation, a number of patients had to be retrospectively re-staged on the basis of their records. Statistical analysis was performed using SPSS computer software (Version 15.0 and 17.0; SPSS, Inc., Chicago, IL). Estimates of disease-free and overall survival were based on Kaplan-Meier method. 2.3 Results The 5- and 10- year disease-free survival for all patients was 29,2% and 25,6%. The overall poor prognosis of this cancer could be explained by the large number of advanced tumours. Advanced disease was predominant with 49,2% of pT4 category. 59 (34,9%) tumours had infiltrated the orbit; the base of the skull was involved in 17 (10,1%) patients. The CNS was involved in 29 (17,2%) patients. CNS infiltration and/ or the infiltration of the skull base presented as significant negative prognostic factors on disease-free survival (p=0.011). The criteria of tumour grade (p=0.071) and involvement of the orbit (p=0.063) had no statistically significant effects on prognosis. Patients who had surgery or combined surgery/radiotherapy survived significantly longer than those who were treated with radiotherapy alone (p<0.001), showing the superiority of the surgical treatment concept. 4 Surgical techniques varied, however the R-status counted as prognostic factor. The disease-free survival increased from 1.0 years in the group of patients with R1- and R2to 9.8 years in patients with R0-status (p<0.001). ). In the pT1-3 group with R0-status adjuvant radiotherapy had no statistically significant effects on prognosis (p=0.515). In the pT4 group with R0-status adjuvant radiotherapy resulted in significantly superior prolongation of disease-free survival compared to surgery only (p=0.013). 2.4 Conclusions Despite different negative prognostic factors, the results indicate that R0 resection remains the main intention in surgical treatment. Even with R0 resection adjuvant radiotherapy is always to be considered in cases of a pT4 category. 5 3 Einleitung Bösartige Neubildungen der inneren Nase und der Nasennebenhöhlen sind nicht nur mit einem Anteil von 0,2%-0,5% aller Malignome und etwa 3% der Kopf- und Halstumoren selten (5; 18; 35), sondern zeigen auch eine große histopathologische Vielfalt. Eine wichtige Aufgabe ist die Definition von Prognosekriterien einzelner Tumorentitäten an entsprechend großen Patientenkollektiven mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen. Als häufigste Tumorentität wird in der vorliegenden retrospektiven Studie das Plattenepithelkarzinom betrachtet. Plattenepithelkarzinome bilden mit ca. 58%-73% die größte Gruppe der sinunasalen Karzinome (80; 35; 110; 79), wobei das männliche Geschlecht häufiger betroffen ist (114; 25). Das Plattenepithelkarzinom dominiert im Bereich der Kieferhöhle und wird somit in dieser Lokalisation als die häufigste Tumorentität angegeben. Bei einer Gesamtzahl von 650 Malignomen der Kieferhöhle wurden in 61,7% (401/650) Plattenepithelkarzinome beobachtet (12). Ihre Prognose bleibt trotz Fortschritten in Diagnostik und Therapie unverändert schlecht. Wegen ihrer meist uncharakteristischen Beschwerdesymptomatik werden 80% der Plattenepithelkarzinome erst in weit fortgeschrittenen Stadien diagnostiziert (7; 80; 65; 35; 110). Der Aufbau des nasalen Plattenepithelkarzinoms unterscheidet Plattenepithelkarzinomen aus anderen sich histologisch Körperregionen. Ein nicht von Großteil der Plattenepithelkarzinome ist hochdifferenziert, es lassen sich aber auch mittelgradig bis niedrig differenzierte nachweisen. Letztere sind in Einzelfällen schwierig gegen andere Läsionen, wie z.B. maligne Melanome oder maligne Lymphome, abzugrenzen (103). Plattenepithelkarinome der inneren Nase und der Nasennebenhöhle entstehen vermutlich auf dem Boden einer Metaplasie der normalen glandulären Mukosa (108). Die Mehrzahl der sinunasalen Tumoren bleibt lange Zeit stumm, da sie in den pneumatisierten Kavitäten des Mittelgesichtes wachsen können, ohne funktionelle Auswirkungen zu haben. Dies hat zur Folge, dass zum Zeitpunkt der Diagnosestellung ein bereits fortgeschrittenes Tumorwachstum vorliegt, welches über mehrere Nasennebenhöhlen und umliegende Strukturen progredient sein kann (27). Der ungünstige Sitz dieser Tumoren in der Nähe zu funktionell wichtigen Strukturen wie Orbita, ZNS oder A. carotis interna verhindert oft eine vollständige Entfernung im Gesunden (41; 51; 74). Ziel der vorliegenden Arbeit ist es, Diagnostik, Therapiekonzepte, die Prognosefaktoren und die Ergebnisse in der Behandlung von Plattenepithelkarzinomen der inneren Nase 6 und der Nasennebenhöhlen anhand des Patientengutes von 169 Patienten retrospektiv auszuwerten. 3.1 Topographische Anatomie der Nasenhöhle und Sinus paranasales Die rechte und linke Nasenhöhle wird durch die Nasenscheidewand (Septum nasi) getrennt. Diese bildet jeweils die mediale Nasenwand. Ein vorderer knorpeliger Teil (Cartilago septi nasi) und ein hinterer knöcherner Teil, der sich aus der Lamina perpendicularis des Siebbeins und dem Vomer zusammensetzt, sind Bestandteile des Septums. Das Dach der Nasenhaupthöhle wird vom Nasenbein, der Lamina cribrosa des Siebbeins und dem Keilbeinkörper gebildet. Der Boden ist der harte Gaumen. Die laterale Nasenwand besteht aus Teilen des Oberkiefers, des Tränenbeins, des Gaumenbeins und des Keilbeins (13). Die Nasenhöhle steht durch die Lamina cribrosa mit der vorderen Schädelgrube in Verbindung. Das Septum nasi zeigt häufig Deviationen durch eine vorspringende Crista septi, welche die Entfaltung der rechten mittleren Muschel beeinträchtigt und dadurch klinische Symptome hervorrufen kann. Die Septumschleimhaut ist reich vaskularisiert. Besonders im vorderen Bereich bilden sich ausgedehnte Venenplexus, von denen häufig eine Nasenblutung ausgeht (Locus Kiesselbachii). Die Concha nasalis inferior ist ein selbständiger Knochen, der von einer schwellkörperreichen Schleimhaut überzogen wird. Es genügen schon geringe Reize, um die Schleimhaut zur Schwellung zu bringen und den unteren Nasengang zu verlegen. Die Concha nasalis med. und sup. sind Teile des Siebbeins und meist in ihrem hinteren Abschnitt kavernös verdickt. Die drei Hauptmuscheln grenzen die drei Nasengänge (Meatus nasi inf., med. und sup.) vom gemeinsamen Nasengang (Meatus nasi communis) ab. In diesen Gängen befinden sich die Zugänge zu den Nebenhöhlen der Nase (Sinus paranasales). Zwischen Bulla ethmoidalis und Proc. uncinantus entsteht ein halbmondförmiger Spalt (Hiatus semilunaris), dessen Schleimhautüberzug sich trichterförmig gegen die Kieferhöhle verengt (Infundibulum ethmoidale) (94). Die Kieferhöhle (Sinus maxillaris) ist die größte Nasennebenhöhle. Ihre pyramidenförmige Gestalt höhlt den Körper des Oberkiefers fast vollständig aus. Ihre obere Wand ist sehr dünn und bildet zugleich den Boden der Augenhöhle. In Höhe des unteren und mittleren Nasengangs liegt die mediale Wand. Sie steht durch das Infundibulum ethmoidale mit dem mittleren Nasengang in Verbindung. Der Boden hat die Form einer Rinne, die nach hinten zu ansteigt und dem Alveolarfortsatz folgt (94). 7 Die Stirnhöhlen (Sinus frontales) sind in Größe und Form sehr variabel. Sie dehnen sich nach hinten unten im Dach der Orbita aus, aber auch nach oben in den Bereich des Stirnbeins. Die beiden Höhlen sind in der Regel ungleich groß. Ihr Boden geht unten kontinuierlich in den Ductus nasofrontalis über, der unter der mittleren Muschel ausmündet (94). Die Keilbeinhöhlen (Sinus sphenoidales) sind ebenfalls paarig ausgebildet und werden durch ein unregelmäßig verlaufendes Septum getrennt. Sie füllen den Keilbeinkörper weitgehend aus. Allerdings ergeben sich klinisch wichtige topographische Beziehungen zum Canalis opticus, zur A. carotis int., eventuell auch zu den hinteren Siebbeinzellen und zur Kieferhöhle durch das Vortreiben schleimhautausgekleideter Taschen in die angrenzenden Knochenabschnitte des Keilbeins bei ausgedehnter Pneumatisation. Durch die Lage der Keilbeinhöhle ergibt sich ein operativer Zugangsweg zur Hypophysenregion (94). Die Siebbeinzellen (Cellulae ethmoidales) liegen in den zahlreichen Knochenkapseln des Siebbeins, d.h. in der lateralen Wand der Nasenhöhle (Siebbeinlabyrinth). Die hinteren Siebbeinzellen (Cellulae ethmoidales post.) schließen sich an die Keilbeinhöhle an und münden in den oberen Nasengang. Die vorderen Siebbeinzellen (Cellulae ethmoidales ant.) liegen daran anschließend zwischen Nasenwurzel, Stirnbein und Oberkiefer und münden in der Region des Infundibulum ethmoidale in den mittleren Nasengang aus (94). 3.2 Anatomie aus onkologischer Sicht Der histologische Aufbau der Auskleidung der Nasennebenhöhle ermöglicht die Entstehung einer Vielzahl an verschiedenen malignen Tumorentitäten, da sich in dieser zusammenhängenden anatomischen und funktionellen Einheit Plattenepithel, respiratorisches Epithel, lymphatisches und neurales Gewebe auf einem engen Raum konzentrieren (60). Im Gegensatz zur knöchernen Infrastruktur des spongiösen Oberkieferknochens der lateralen Kieferhöhlenwand, der durch seine relative Dicke eine natürliche Barriere für das Malignomwachstum darstellt, sind die dünnen Trennwände aus trabekulärem Knochen wie die Lamina papyracea kein Hindernis für ein expansives Tumorwachstum (108). 8 Von onkologischer Bedeutsamkeit ist die Lymphgefäßversorgung der Nase und der Nasennebenhöhlen. Lymphkapillaren sind in vielen Schichten der Submukosa lokalisiert. Man unterscheidet anhand der Lymphdrainage drei Gruppen: 1. die Lymphkapillaren des Vestibulum nasi, welche zu den submandibulären Lymphknoten ziehen. 2. differenziert man die Lymphkapillaren der Regio olfactoria (ein mit Riechzellen ausgestattetes Riechfeld unter der Lamina cribrosa am Nasenseptum und der seitlichen Nasenwand). Diese sind mit den Lymphkapillaren des subarachnoidalen Raumes verbunden und drainieren die oberen lateropharyngealen Lymphknoten. 3. die Lymphkapillaren der Regio respiratoria (ein mit Flimmerepithel ausgekleideter Teil der Nasenschleimhaut, der mit Ausnahme der Regio olfactoria die gesamte Nasenhöhle versorgt). An der lateralen Pharynxwand, zwischen dem hinteren Ende der unteren Muschel und der Öffnung der Eustachischen Röhre vereinigen sich diese in einem Lymphplexus, dem so genannten prätubären Plexus (108). Diese beiden prätubären Plexus sind über Septum und weichem Gaumen über Queranastomosen verbunden. Über die Queranastomosen können bilaterale Metastasierungen stattfinden (108). Zu den jugulo-digastrischen Lymphknoten ziehen hintere Lymphgefäße aus den Plexus zu den latero- und retropharyngealen Lymphknoten nahe der Schädelbasis sowie laterale Lymphgefäße direkt durch die seitliche Pharynxwand. Die Lymphkapillaren der Kieferhöhle und der Siebbeinzellen stehen in Verbindung mit den Lymphkapillaren der Regio respiratoria und zeigen von dort aus den entsprechenden Lymphabfluss (108) 3.3 Klassifikation und Stadieneinteilung Die Klassifikation von Tumoren soll Hinweise auf die Prognose des einzelnen Patienten geben, zu geeigneten Behandlungsstrategien führen, den Vergleich von Behandlungsergebnissen ermöglichen und einen Informationsaustausch zwischen Ärzten und Kliniken erleichtern. Die älteste Einteilung geht auf Sébileau (97) zurück. Hierbei wird der Gesichtsschädel in drei Etagen unterteilt, wobei die schädelbasisnahe Lokalisation als prognostisch ungünstiger als die schädelbasisferne eingestuft wird. (I Untere Etage = Infrastruktur: Alveolarfortsätze, Gaumendach, Velum und Kieferhöhlenboden; II Mittlere Etage = Mesostruktur: Sinus maxillaris und Nasenhaupthöhle zwischen Nasenboden und Kieferhöhlendach bzw. Orbitaboden; III Obere Etage = Suprastruktur: Sinus ethmoidalis, sphenoidalis und frontalis, Regio olfactoria der Nase, Orbitae) (27). 9 Abbildung 1: Die 3 Etagen nach Sébileau (97; 39) Eine weitere Einteilung stellt die Klassifikation nach Öhngren dar. Es werden zwei topographische Bereiche durch die gedachte Grenze, der Öhngrenschen Ebene, unterschieden (85). Diese Ebene muss als ideell bezeichnet werden, da sie im Hinblick auf die Lokalisation und Ausbreitung keine reale Grenze darstellt. Etwa im Verlauf der Sutura zygomatico-maxillaris gelegen, verläuft die Ebene durch die Nasenpyramide und den äußeren Kieferwinkel. Ventral und kaudal dieser Ebene soll die Prognose maligner Tumoren günstiger sein als dorsal und kranial davon. Die in der vorliegenden Erhebung verwendete Klassifikation und Stadiengruppierung entspricht denen der 6. Auflage des AJCC Cancer Staging Manual (2002) (116) und hat die Zustimmung aller nationalen TNM-Kommitees. Im Folgenden werden die Klassifikationen für Tumoren der Nasenhöhle und Nasennebenhöhlen dargestellt. Regeln zur Klassifikation Die Klassifikation gilt nur für Karzinome. Histologische Diagnosesicherung ist erforderlich. Verfahren zur Bestimmung der T-, N- und M-Kategorien sind: T-Kategorien: Klinische Untersuchung und bildgebende Verfahren N-Kategorien: Klinische Untersuchung und bildgebende Verfahren M-Kategorien: Klinische Untersuchung und bildgebende Verfahren 10 Anatomische Bezirke und Unterbezirke 1. Nasenhöhle (C30.0) - Septum - Nasenboden - Laterale Wand - Vestibulum 2. Kieferhöhle (C31.0) 3. Siebbeinzellen (C31.1) - Links - Rechts Regionäre Lymphknoten Regionäre Lymphknoten sind die Halslymphknoten. TNM: Klinische Klassifikation T-Primärtumor TX Primärtumor kann nicht beurteilt werden T0 Kein Anhalt für Primärtumor Tis Carzinoma in situ Kieferhöhle T1 Tumor auf die antrale Schleimhaut begrenzt ohne Arrosion oder Destruktion des Knochens T2 Tumor mit Arrosion oder Destruktion des Knochens (ausgenommen die posteriore Wand) einschließlich Ausdehnung auf harten Gaumen und/ oder mittleren Nasengang T3 Tumor infiltriert eine oder mehrere der folgenden Strukturen: Knochen der dorsalen Wand der Kieferhöhle, Subkutangewebe, Boden oder mediale Wand der Orbita, Fossa pterygopalatina, Sinus ethmoidalis T4a Tumor infiltriert eine oder mehrere der folgenden Strukturen: Inhalt der vorderen Orbita, Wangenhaut, Processus pterygoideus, Fossa infratemporalis, Lamina cribrosa, Siebbeinzellen, Stirnhöhle 11 T4b Tumor infiltriert eine oder mehrere der folgenden Strukturen: Orbitaspitze, Dura, Gehirn, mittlere Schädelgrube, Hirnnerven ausgenommen den maxillären Ast des N. trigeminus V2, Nasopharynx, Clivus Nasenhöhle und Siebbeinzellen T1 Tumor auf einen Unterbezirk der Nasenhöhle oder Siebbeinzellen beschränkt, mit oder ohne Arrosion des Knochens T2 Tumor in zwei Unterbezirken eines Bezirkes oder Ausbreitung auf einen Nachbarbezirk innerhalb des Nasen-Siebbeinzellen-Areals, mit oder ohne Arrosion des Knochens T3 Tumor breitet sich in die mediale Orbita oder den Orbitaboden aus oder in Kieferhöhle, harten Gaumen oder Lamina cribrosa T4a Tumor infiltriert eine oder mehrere der folgenden Strukturen: Inhalt der vorderen Orbita, Haut von Nase oder Wange, minimale Ausbreitung in vordere Schädelgrube, Processus pterygoideus, Keilbeinhöhle oder Stirnhöhle T4b Tumor infiltriert eine oder mehrere der folgenden Strukturen: Orbitaspitze, Dura, Gehirn, mittlere Schädelgrube, Hirnnerven ausgenommen den maxillären Ast des N. trigeminus V2, Nasopharynx, Clivus N – Regionäre Lymphknoten NX Regionäre Lymphknoten können nicht beurteilt werden N0 Keine regionären Lymphknotenmetastasen N1 Metastase(n) in solitärem ipsilateralem Lymphknoten, 3 cm oder weniger in größter Ausdehnung N2 Metastase(n) in solitärem ipsilateralem Lymphknoten, mehr als 3 cm, aber nicht mehr als 6 cm in größter Ausdehnung, oder in multiplen ipsilateralen Lymphknoten, keiner mehr als 6 cm in größter Ausdehnung oder in bilateralen oder kontralateralen Lymphknoten, keiner mehr als 6 cm in größter Ausdehnung N2a Metastase(n) in solitärem ipsilateralem Lymphknoten, mehr als 3 cm, aber nicht mehr als 6 cm in größter Ausdehnung 12 N2b Metastasen in multiplen ipsilateralen Lymphknoten, keiner mehr als 6 cm in größter Ausdehnung N2c Metastasen in bilateralen oder kontralateralen Lymphknoten, keiner mehr als 6 cm in größter Ausdehnung N3 Metastase(n) in Lymphknoten, mehr als 6 cm in größter Ausdehnung M – Fernmetastasen MX Fernmetastasen können nicht beurteilt werden M0 keine Fernmetastasen M1 Fernmetastasen Fernmetastasen Die Definitionen der M-Kategorien für alle Kopf- und Halsregionen sind gleichlautend. Die Kategorien M1 und pM1 können wie folgt spezifiziert werden: Lunge PUL Knochenmark MAR Knochen OSS Pleura PLE Leber HEP Peritoneum PER Hirn BRA Nebenniere ADR Lymphknoten LYM Haut SKI Andere Organe OTH Histopathologisches Grading Die Definitionen der G-Kategorien gelten für alle Kopf- und Hals-Lokalisationen, ausgenommen der Schilddrüse. 13 G: Histopathologisches Grading GX Differenzierungsgrad kann nicht bestimmt werden G1 Gut differenziert G2 Mäßig differenziert G3 Schlecht differenziert G4 Undifferenziert R-Klassifikation Das Fehlen oder Vorhandensein von Residualtumor nach Behandlung wird durch die RKlassifikation beschrieben. Die folgenden Definitionen gelten für alle Kopf- und Halslokalisationen: RX Vorhandensein von Residualtumor kann nicht beurteilt werden R0 Kein Residualtumor R1 Mikroskopischer Residualtumor R2 Makroskopischer Residualtumor Stadiengruppierung Stadium 0 Tis N0 M0 Stadium I T1 N0 M0 Stadium II T2 N0 M0 Stadium III T1, T2 N1 M0 T3 N0, N1 M0 T1, T2, T3 N2 M0 T4a N0, N1, N2 M0 T4b Jedes N M0 Jedes T N3 M0 Jedes T Jedes N M1 Stadium IVA Stadium IVB Stadium IVC 14 C-Faktor Der C-Faktor (C = Abkürzung von „Certainty“ = Diagnosesicherheit) drückt die von den verwendeten diagnostischen Methoden abhängige Zuverlässigkeit der Klassifikation aus. Seine Verwendung ist fakultativ. Die Definitionen des C-Faktors sind: C1 Aussage aufgrund von diagnostischen Standardmethoden, z.B. Inspektion, Palpation und Standardröntgenaufnahmen, intraluminale Endoskopie bei bestimmten Organen C2 Aussage aufgrund spezieller diagnostischer Maßnahmen, z.B. bildgebender Verfahren: Röntgenaufnahmen in speziellen Projektionen, Schichtaufnahmen, Computertomographie (CT), Sonographie, Lymphographie, Angiographie; nuklearmedizinische Untersuchungen; Kernspintomographie (MRT); Endoskopie, Biopsie und Zytologie C3 Aussage aufgrund chirurgischer Exploration einschließlich Biopsie und zytologischer Untersuchung des Tumorresektats C4 Aussage nach definitiver chirurgischer Behandlung und pathologischer Untersuchung des Tumorresektats C5 Aussage aufgrund einer Autopsie Die klinische TNM-Klassifikation entspricht den verschiedenen Sicherheitsgraden C1, C2 und C3, die pathologische Klassifikation im Allgemeinen der C4-Kategorie. 15 4 Material und Methoden Im Rahmen der retrospektiven Studie wurden Erfahrungen in der Behandlung von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen an der Hals-Nasen-Ohren-Klinik, Kopf- und Halschirurgie der Friedrich-AlexanderUniversität Erlangen-Nürnberg ausgewertet. Der Erhebungszeitraum erstreckte sich vom April 1970 bis zum 30. September 2006. Die einzelnen Daten zur Erfassung der Lokalisation, Ausdehnung, Tumorklassifikation sowie zu Therapie und Krankheitsverlauf wurden den Krankenakten der Hals-NasenOhren-Klinik, Kopf- und Halschirurgie des Universitätsklinikums Erlangen entnommen und auf einem eigens dafür entwickelten vierseitigen Dokumentationsbogen festgehalten. Mit Hilfe des Statistikprogramms SPSS (Version 15.0 und 17.0) erfolgte nach der Extraktion der erhobenen Daten aus der Tumordatenbank der Klinik (TUREK) die statistische Evaluation. Festgelegt wurde der 30. September 2006 als Stichtag für die Überlebensanalyse. Die Unterschiede zwischen den rezidivfreien Überlebenszeiten wurde mit Hilfe des Log Rank (Mantel-Cox) Tests analysiert. Als statistisch signifikant wurde ein p-Wert weniger als 0,05 angesehen. Alle Tumore wurden unter Verwendung der 6. Auflage der TNM-Klassifikation (2002) klassifiziert. Es war teilweise notwendig, die in den Krankenakten vorhandenen Angaben, welche mittels älterer Auflagen ermittelt wurden, nach den Regeln der 6. Auflage der TNM-Klassifikation zu aktualisieren. Zur Vervollständigung von Akten wurden Kliniken, Patienten und Angehörige telefonisch um Auskunft gebeten. Auch die Möglichkeit über das Tumorzentrum Auskünfte aus den Melderegistern der Einwohnermeldeämter zu erhalten, wurde genutzt. Der zur Datenerhebung verwendete Dokumentationsbogen, Maligne Tumoren des HNO-Bereichs, ist dem Anhang beigefügt. 16 5 Ergebnisse 5.1 Alters- und Geschlechtsverteilung Von den insgesamt 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen waren 50 (29,6%) Frauen und 119 (70,4%) Männer. Hieraus ergibt sich eine Geschlechtsverteilung von 1 zu 2,38 zugunsten der Männer. Geschlechtsverteilung (n=169) 29,6% 70,4% weiblich männlich Abbildung 2: Geschlechtsverteilung der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen Zum Zeitpunkt der Diagnosestellung betrug das mediane Alter 65 Jahre (31-88 Jahre). Das mittlere Alter betrug 62,52 Jahre ± 13 Jahre Standardabweichung. Von einem der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhle war das Alter zum Zeitpunkt der Diagnosestellung nicht bekannt, so dass das mediane Alter, das mittlere Alter und die Altersverteilung im Detail, die aus der Abbildung 3 hervorgeht, mit 168 Patienten errechnet wurde und dargestellt ist. 17 3 30-34 Jahre 35-39 Jahre 8 4 40-44 Jahre Altersverteilung 45-49 Jahre 15 19 50-54 Jahre 55-59 Jahre 20 14 60-64 Jahre 65-69 Jahre 23 32 70-74 Jahre 75-79 Jahre 18 80-84 Jahre 6 85-89 Jahre 6 0 10 20 30 40 50 Gesamt (n=168) Abbildung 3: Altersverteilung der 168 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen (Von einem der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhle war das Alter zum Zeitpunkt der Diagnosestellung nicht bekannt.) 5.2 Lokalisation des Primärtumors Die meisten Karzinome fanden sich in der Nasenhaupthöhle (108, 63,9%) und Kieferhöhle (34, 20,1%). An dritter Stelle der Häufigkeitsverteilung waren mit 16,0% der Plattenepithelkarzinome (bei 27 Patienten) in den Siebbeinzellen lokalisiert. Abbildung 4 gibt einen zusammenfassenden Überblick über die Lokalisation des Primärtumors der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen. 18 100% 80% 63,9% 60% 40% 20,1% 20% 16,0% 0% Nasenhöhle Kieferhöhle Siebbeinzellen Lokalisation Gesamt (n=169) Abbildung 4: Überblick über die Lokalisation des Primärtumors der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen 5.3 Seitenlokalisation Es fanden sich rechts 77 (45,5%), links 75 (44,4%), in der Mitte 12 (7,1%) und beidseits 5 (3,0%) Plattenepithelkarzinome. Abbildung 5 gibt einen Überblick über die Verteilung der Seitenlokalisation der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen. 100% 80% 60% 45,5% 44,4% 40% 20% 7,1% 3,0% 0% links Mitte rechts beidseits Seitenlokalisation Gesamt (n=169) Abbildung 5: Verteilung der Seitenlokalisation der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen 19 5.4 Klinische T-Klassifikation des Primärtumors 132 (78,2%) der 169 Patienten wiesen zum Zeitpunkt der Diagnosestellung bereits eine T3, T4a und T4b Kategorie auf. 28 (16,6%) Patienten hatten eine T3-Kategorie, 76 (45,0%) zeigten eine T4a-Kategorie und 28 (16,6%) der Patienten wiesen eine T4bKategorie auf. Eine T1-Kategorie wurde bei 23 (13,6%) Patienten und eine T2-Kategorie bei 14 (8,2%) der Patienten zum Zeitpunkt der Diagnosestellung festgestellt. Die Abbildung 6 zeigt die Verteilung im Überblick. 100% 80% 60% 45,0% 40% 20% 13,6% 16,6% 16,6% 8,2% 0% T1 T2 T3 T4a T4b klinische T-Klassifikation Gesamt (n=169) Abbildung 6: Verteilung der klinischen T-Klassifikation der Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen 169 Patienten mit 5.4.1 C-Faktor für die T-Klassifikation des Primärtumors Bei 22 (13,0%) der 169 Patienten wurde die Ausdehnung des Plattenepithelkarzinoms ohne apparative Hilfsmittel bestimmt, so dass in diesen Fällen ein Sicherungsfaktor C1 vorlag. Bei 6 (3,6%) Patienten wurde das Plattenepithelkarzinom im Rahmen einer endonasalen Nasennebenhöhlenoperation wegen vermeintlicher Sinusitis paranasalis am Resektat als Zufallsbefund gefunden (C4). Bei 139 (82,2%) der 169 Patienten wurde die Ausdehnung des Plattenepithelkarzinoms mit Hilfe der Computertomographie bestimmt. In diesen Fällen ist der C-Faktor für die T-Klassifikation des Primärtumors C2. Bei 2 (1,2%) der Patienten wurde eine Probefreilegung (C3) durchgeführt. 20 5.4.2 Verteilung der klinischen T-Klassifikation des Primärtumors in den Therapiegruppen Die Abbildungen 7 bis 12 zeigen die Verteilung der klinischen T-Klassifikation in den einzelnen Therapiegruppen. 7 der 10 Patienten, die keiner Therapie unterzogen wurden, wiesen die klinische T-Klassifikation T4a auf. Von den 10 Patienten, bei denen eine Radiotherapie und Chemotherapie durchgeführt wurde, wiesen 4 eine T4a- und 5 eine T4b-Klassifikation auf. 31 Patienten erhielten eine alleinige Operation, wobei 13 Patienten eine T1-, 5 Patienten eine T2- und 7 Patienten eine T4a-Klassifikation aufwiesen. Von den 29 Patienten, die einer alleinigen Radiotherapie unterzogen wurden, wiesen 16 Patienten eine T4a-Kategorie, 6 Patienten eine T3 und 5 Patienten eine T4bKategorie auf. Etwa die Hälfte der 62 Patienten, die eine Operation und eine Radiotherapie bekamen (30 Patienten), wiesen die klinische Klassifikation T4a auf. Bei 7 Patienten lag T1, bei 4 Patienten lag eine klinische Klassifikation T2, bei 16 Patienten T3 und bei 5 Patienten T4b vor. In der Therapiegruppe „Operation und Radiotherapie und Chemotherapie“ wurden beim Staging von den insgesamt 25 Patienten 11 als klinische T-Klassifikation T4a und 8 Patienten als T4b eingestuft. Aufgrund einer zu geringen Fallzahl von 2 Patienten, wobei ein Patient die klinische T-Klassifikation T4a und ein Patient eine T4b-Kategorie aufwies, war eine Auswertung der Therapiegruppe „nur Chemotherapie“ nicht möglich. 10 8 7 6 4 2 1 1 1 0 0 T1 T2 T3 T4a T4b klinische T-Klassifikation keine Therapie (n=10) Abbildung 7: Verteilung der klinischen T-Klassifikation der 10 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die keiner Therapie unterzogen wurden 21 10 8 6 5 4 4 2 0 1 0 0 T1 T2 T3 T4a T4b klinische T-Klassifikation Radiotherapie und Chemotherapie (n=10) Abbildung 8: Verteilung der klinischen T-Klassifikation der 10 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer Radiotherapie und Chemotherapie unterzogen wurden 20 18 16 14 12 10 8 6 4 2 0 13 7 5 3 T1 T2 T3 3 T4a T4b klinische T-Klassifikation nur Operation (n=31) Abbildung 9: Verteilung der klinischen T-Klassifikation der 31 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer alleinigen Operation unterzogen wurden 22 20 18 16 14 12 10 8 6 4 2 0 16 6 1 1 T1 T2 T3 5 T4a T4b klinische T-Klassifikation Radiotherapie (n=29) Abbildung 10: Verteilung der klinischen T-Klassifikation der 29 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer alleinigen Radiotherapie unterzogen wurden 40 35 30 30 25 20 16 15 10 7 5 4 5 0 T1 T2 T3 T4a T4b klinische T-Klassifikation Operation und Radiotherapie (n=62) Abbildung 11: Verteilung der klinischen T-Klassifikation der 62 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer Operation und Radiotherapie unterzogen wurden 23 20 18 16 14 12 10 8 6 4 2 0 11 8 4 1 T1 1 T2 T3 T4a T4b klinische T-Klassifikation Operation und Radiotherapie und Chemotherapie (n=25) Abbildung 12: Verteilung der klinischen T-Klassifikation der 25 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer Operation und Radiotherapie und Chemotherapie unterzogen wurden 5.5 Pathologische T-Klassifikation des Primärtumors 71 (60,2%) der 118 Patienten wiesen zum Zeitpunkt der Operation eine T3, T4a und T4b-Klassifikation auf. 13 (11,0%) der Patienten hatten eine T3-Klassifikation, 48 (40,7%) zeigten eine T4a-Klassifikation und 10 (8,5%) der Patienten wiesen eine T4bKlassifikation auf. Eine T1-Kategorie wurde bei 21 (17,8%) der Patienten und eine T2-Klassifikation bei 23 (19,5%) der Patienten zum Zeitpunkt der Diagnosestellung festgestellt. Die Abbildung 13 zeigt die Verteilung im Überblick. Das kleinste Kollektiv, 3 Patienten (2,5%), war die Gruppe mit der TX-Klassifikation. 24 Abbildung 13: Verteilung der pathologischen T-Klassifikation der 118 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen 5.5.1 Verteilung der pathologischen T-Klassifikation des Primärtumors in den Therapiegruppen Die Abbildungen 14 bis 16 zeigen die Verteilung der pathologischen T-Klassifikation in den einzelnen Therapiegruppen. Das größte Kollektiv mit 48 von 118 Patienten wies die pathologische T-Klassifikation pT4a auf. 31 Patienten erhielten eine alleinige Operation, wobei 14 Patienten eine T1-, 4 Patienten eine T2- und 9 Patienten eine T4aKlassifikation aufwiesen. Etwas weniger als die Hälfte der 62 Patienten, die eine Operation und eine Radiotherapie bekamen (27 Patienten), wiesen die pathologische Klassifikation T4a auf. Bei 6 Patienten lag T1, bei 11 Patienten lag eine pathologische Klassifikation T2, bei 12 Patienten T3 und bei 5 Patienten T4b vor. In der Therapiegruppe „Operation und Radiotherapie und Chemotherapie“ wurden beim Staging von den insgesamt 25 Patienten 12 als pathologische T-Klassifikation T4a und 3 Patienten als T4b eingestuft. 8 der 25 Patienten wiesen eine T2-Klassifikation auf. Es gab keinen Patienten der pathologischen T-Klassifikation pT3, der in der Therapiegruppe „Operation und Radiotherapie und Chemotherapie“ vertreten war. 3 Patienten wiesen die pathologische T-Klassifikation pTX auf, diese verteilten sich mit je einem Patienten auf die drei Therapiegruppen. 25 Abbildung 14: Verteilung der pathologischen T-Klassifikation der 31 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer alleinigen Operation unterzogen wurden Abbildung 15: Verteilung der pathologischen T-Klassifikation der 62 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer Operation und Radiotherapie unterzogen wurden 26 Abbildung 16: Verteilung der klinischen T-Klassifikation der 25 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die einer Operation und Radiotherapie und Chemotherapie unterzogen wurden 5.6 Klinische N-Klassifikation Diagnostik, klinische N-Klassifikation Die Erfassung des Lymphknotenstatus erfolgte bei allen Patienten zunächst palpatorisch. Ab Mitte der achtziger Jahre wurde zur Diagnosesicherung zusätzlich die ultrasonographische Untersuchung der Halsweichteile eingesetzt. Insgesamt fand die Sonographie bei 66 (39,1%) Patienten Anwendung, so dass der C-Faktor hier C2 ist. Die klinische N-Klassifikation fand bei 103 (60,9%) der 169 Patienten ohne apparative Diagnostik statt (C1). Bei 137 (81,1%) wurde eine N0 Klassifikation diagnostiziert. Die klinische N-Klassifikation war in 8 (4,7%) Fällen N1, in 2 (1,2%) Fällen N2a, in 8 (4,7%) Fällen N2b sowie bei 14 (8,3%) Patienten N2c. 27 100% 80% 81,1% 60% 40% 20% 4,7% 0% N0 N1 1,2% N2a 4,7% N2b 8,3% N2c klinische N-Klassifikation Gesamt (n=169) Abbildung 17: Verteilung der klinischen N-Klassifikation der Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen 5.7 169 Patienten mit Klinische M-Klassifikation Diagnostik, klinische M-Klassifikation Auch die Festlegung der M-Klassifikation im Rahmen des prätherapeutischen Stagings erfolgte nach den Richtlinien der TNM-Klassifikation. Bei 166 (98,2%) Patienten ergab sich klinisch kein Hinweis auf das Vorliegen von Fernmetastasen, wobei in 116 (68,6%) der 169 Fälle der Sicherungsgrad C1 und in 53 (31,4%) der Fälle der Sicherungsgrad C2 vorlag. Nur bei 3 der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhle, dies sind 1,8% des Gesamtkollektivs, wurden Fernmetastasen zum Zeitpunkt der Diagnosestellung diagnostiziert. Es handelte sich um ossäre und pulmonale Metastasen. 5.8 Befall von Schädelbasis und Zentralnervensystem (ZNS) Schädelbasis und Zentralnervensystem wiesen bei 123 (72,7%) der 169 Patienten keinen Befall auf. Bei 17 (10,1%) Patienten infiltrierte das Plattenepithelkarzinom die Schädelbasis ohne Frontalhirnbeteiligung und bei weiteren 29 (17,2%) Patienten lag eine Beteiligung des Zentralnervensystems vor. 28 Abbildung 18 gibt eine Übersicht über den Befall von Schädelbasis und Zentralnervensystem der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen. 100% 80% 72,7% 60% 40% 20% 10,1% 17,2% 0% kein Befall Schädelbasis infiltriert ZNS und Schädelbasis infiltriert Befall von Schädelbasis und Zentralnervensystem (ZNS) Gesamt (n=169) Abbildung 18: Übersicht über den Befall von Schädelbasis und Zentralnervensystem der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen 5.9 Orbitabefall Im klinischen Staging wurde auch auf den Befall der Orbita geachtet. Insgesamt war bei 59 (34,9%) Patienten der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die Orbita klinisch bzw. radiologisch infiltriert. 38 dieser 59 Patienten wurden operiert. 5.9.1 Therapie und Operationstechnik bei Orbitabefall Die Tabelle 1 gibt einen Überblick sowohl über die verschiedenen Therapiegruppen der 59 Patienten mit Orbitabefall, als auch über die Operationstechnik der 38 operierten Patienten, deren Orbita infiltriert war (operierte Patienten sind in der Tabelle grau unterlegt). Bei 21 von 38 Patienten, die einen Befall der Orbita aufwiesen, wurde eine transfaziale Resektion durchgeführt. Aus dieser Gruppe wurden 16 Patienten operiert und dazu kombiniert einer Radiotherapie unterzogen. Bei 4 der 38 operierten Patienten wurde eine Exenteratio der Orbita durchgeführt, von denen je zwei Patienten zu den Therapiegruppen „Operation und Radiotherapie“ und „Operation und Radiotherapie und Chemotherapie“ zugehörig waren. 29 Tabelle 1: Operationstechnik und Therapiegruppen der 59 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen mit Orbitabefall (die 38 operierten Patienten mit Orbitabefall sind in der Tabelle grau unterlegt) 5.10 Chemotherapie Bei 132 (78,1%) der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen wurde keine Chemotherapie durchgeführt, wohingegen 37 (21,9%) der Patienten einer Chemotherapie unterzogen wurden. 5.11 Radiotherapie Eine Radiotherapie wurde bei 126 (74,6%) der 169 Patienten durchgeführt. Bei 43 (25,4%) der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen fand keine Radiotherapie statt. 5.12 Operation 118 (69,8%) Patienten wurden operiert und 51 (30,2%) Patienten wurden keiner Operation unterzogen. Dabei war die Operation in 31 (18,3%) Fällen die alleinige Therapie. In 62 (36,7%) Fällen fand eine kombinierte Therapie mit Operation und Radiotherapie statt, und in 25 (14,8%) Fällen wurde eine Kombination aus Operation, Radiotherapie und Chemotherapie angewendet. 30 Entsprechend der Tumorlokalisation und Tumorausbreitung kamen unterschiedliche Operationsverfahren bzw. Zugangswege zum Einsatz (Tabelle 2). Neben einem endonasalen Zugangsweg, der in 40 Fällen gewählt wurde, fanden überwiegend (in 55 Fällen) transfaziale Operationstechniken Anwendung. In 3 Fällen wurde eine transkranielle Resektion durchgeführt. Viermal fand sich in den Patientendaten eine nicht genau definierte Operationstechnik, die als radikale Tumorausräumung bezeichnet wurde. In 8 Fällen fand eine enorale, transorale Resektion statt. Eine bifrontale Extripation war in 4 Fällen die Operationstechnik der Wahl, und viermal wurde eine Exenteratio der Orbita durchgeführt. Diese wurde je bei zwei Patienten der Therapiegruppen „Operation und Radiotherapie“ und „Operation und Radiotherapie und Chemotherapie“ durchgeführt. In Tabelle 2, 3, und 4 sind Therapiegruppen, Tumorlokalisation und klinische T-Klassifikation dargestellt. Tabelle 2: Operationstechnik und die Therapiegruppen der 118 Patienten Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die operiert wurden mit 31 Tabelle 3: Operationstechnik und die Lokalisation der 118 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die operiert wurden Tabelle 4: Operationstechnik und die klinische T-Klassifikation der 118 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die operiert wurden 5.13 Therapiegruppen Die Abbildung 19 gibt eine Übersicht über die Therapiegruppen der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen. 32 Die vier größten Therapiegruppen seien hier noch mal kurz beschrieben. Das größte Kollektiv stellte die Therapiegruppe „Operation und Radiotherapie“ mit 62 (36,7%) Patienten dar, gefolgt von alleinig operierten 31 (18,3%) Patienten und 29 (17,2%) Patienten, die einer alleinigen Radiotherapie unterzogen wurden. Die Anzahl der Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhle der Therapiegruppe „Operation und Radiotherapie und Chemotherapie“ betrug 25 (14,8%). Abbildung 19: Übersicht über die Therapiegruppen der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen 5.14 Histopathologische Klassifikation, Grading Aus Abbildung 20 ist die histopathologische Klassifikation des Primärtumors ersichtlich. Bei den 118 (69,8%) der operierten Patienten basierte die histologische Klassifikation auf der Untersuchung des Operationspräparates, bei den nicht operierten 51 (30,2%) Patienten auf dem entnommenen Biopsiematerial. Es lagen bei 72 (42,6%) Patienten verhornende Plattenepithelkarzinome, bei 65 (38,5%) Patienten Plattenepithelkarzinome ohne nähere Angabe und bei 32 (18,9%) Patienten nicht verhornende Plattenepithelkarzinome vor. 33 100% 80% 60% 42,6% 38,5% 40% 18,9% 20% 0% Plattenepithelkarzinom nicht verhornend Plattenepithelkarzinom verhornend Plattenepithelkarzinom ohne nähere Angabe Histologie Gesamt (n=169) Abbildung 20: Histopathologische Klassifikation bei 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen Die Abbildung 21 gibt eine Übersicht über das Grading von 143 Patienten mit Plattenepithelkarzinomen. Bei 26 der 169 Patienten lagen keine Angaben über das Grading (GX) vor. Die größte Gruppe (55,9 % der 143 Patienten) wies eine mäßige Differenzierung auf (G2). Bei 21% der Patienten wurde das Grading G3, schlecht differenziert, festgestellt, gefolgt von 16,1% der Patienten, deren Grading eine gute Differenzierung (G1) aufwies. Das Grading undifferenziert (G4) lag bei 7,0% der Patienten vor. 100% 80% 55,9% 60% 40% 20% 21,0% 16,1% 7,0% 0% G1 G2 G3 G4 Grading Gesamt (n=143) Abbildung 21: Grading bei 143 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen (bei 26 der 169 Patienten lagen keine Angaben über das Grading vor) 34 5.15 UICC-Stadieneinteilung Entsprechend der Einteilung der UICC wurde aus der TNM-Formel das Stadium ermittelt (Abbildung 22). Dabei waren 85 (50,3%) der 169 Patienten dem Stadium IV a zugehörig. In 26 (15,4%) Fällen ergab sich die Zuweisung zu Stadium IV b. Drei Patienten wiesen das Stadium IV c aufgrund von Fernmetastasen auf. Einzelheiten zeigt Tabelle 5, welche die T- und N-Klassifikation zeigt. 100% 80% 60% 50,3% 40% 20% 11,8% 15,4% 14,2% 6,5% 1,8% 0% I II III IV a IV b IV c UICC-Stadium Gesamt (n=169) Abbildung 22: UICC-Stadieneinteilung der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen Tabelle 5: T- und N-Klassifikation der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen * (je ein Patient T3 N0 M1; T4b N1 M1; T4b N2c M1) 35 5.15.1 Verteilung der UICC-Stadien in den Therapiegruppen Die Tabelle 6 gibt einen Überblick über die Verteilung der UICC-Stadien in den Therapiegruppen der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen. Die größte Gruppe bilden die 34 Patienten mit dem UICCStadium IV a, die in einer Kombination aus Operation und Radiotherapie behandelt wurden. Von den 31 Patienten, die einer alleinigen Operation unterzogen wurden, wiesen 11 Patienten ein UICC-Stadium I auf. In der Therapiegruppe „Radiotherapie und Chemotherapie“ waren von 10 Patienten 5 im UICC-Stadium IV a und 5 Patienten im UICC-Stadium IV b. Auch die Therapiegruppe „nur Chemotherapie“ wies keine Patienten in den UICC-Stadien I, II, III auf. Tabelle 6: Verteilung der UICC-Stadien in den Therapiegruppen der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen 36 Tabelle 7: R-Klassifikation und die Therapiegruppen der 118 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die operiert wurden 5.17 pT-Klassifikation des Primärtumors Tabelle 8 zeigt zunächst die pathologische T-Klassifikation im Zusammenhang mit der operativen Technik. Nach erfolgter Tumorresektion und histologischer Aufarbeitung wurde anhand des pathologischen Befundes die pT-Klassifikation festgelegt. Die Tabelle 9 zeigt die Lokalisation des Plattenepithelkarzinoms und die pathologische TKlassifikation. Die häufigste Lokalisation war bei 73 Patienten die Nasenhöhle. Die größten Gruppen innerhalb dieser 73 Patienten waren die Patienten mit T4a (25 Fälle), die Patienten mit T1 (18 Fälle) und die Patienten mit T2 (16 Fälle). Alle 3 Patienten, bei denen ein TX festgestellt wurde, wiesen ebenfalls als Lokalisation die Nasenhöhle auf. 26 Patienten wiesen die Kieferhöhle als Lokalisation auf, wovon 14 Patienten die größte Gruppe mit einer pathologischen T4a-Klassifikation waren. Die kleinste Gruppe bildete mit 19 Patienten die Lokalisation Siebbeinzellen, wobei sich auch hier zeigte, dass etwa die Hälfte dieser Patienten, nämlich 9, eine pathologische T4a-Klassifikation zeigten. 37 Tabelle 8: Operationstechnik und die pathologische T-Klassifikation der 118 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, die operiert wurden Tabelle 9: Pathologische T-Klassifikation und die Lokalisation der 118 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen In Tabelle 10 und 11 wird die klinische T-Klassifikation der pathologischen TKlassifikation gegenübergestellt, um die Übereinstimmung der klinischen Diagnose und des pathologischen Befundes darzustellen und zu überprüfen. In 84 von 118 Fällen wurde die T-Klassifikation im Rahmen des klinischen Stagings richtig bestimmt, in zehn Fällen wurde die T-Klassifikation unterschätzt und in 21 Fällen überschätzt. In drei Fällen konnte die Richtigkeit des klinischen Stagings wegen unvollständiger Daten nicht überprüft werden (Tabelle 10). 38 Tabelle 10: Vergleich zwischen klinischer T-Klassifikation und pathologischer T-Klassifikation der 118 Patienten mit Plattenepithelkarzinom der inneren Nase und Nasennebenhöhlen, die einer Operation unterzogen wurden Die Tabelle 11 zeigt den klinischen und pathologischen Befund der Patienten, bei denen eine alleinige Operation durchgeführt wurde, also keine Vorbestrahlung oder Chemotherapie stattgefunden hat. In 24 von 31 Fällen wurde die pT-Klassifikation im Rahmen des klinischen Stagings richtig bestimmt, in drei Fällen wurde die pT-Klassifikation unterschätzt und in drei Fällen überschätzt. In einem Fall konnte die Richtigkeit des klinischen Stagings wegen unvollständiger Daten nicht überprüft werden. Tabelle 11: Vergleich zwischen klinischer T-Klassifikation und pathologischer T-Klassifikation der 31 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen, bei denen eine alleinige Operation durchgeführt wurde 5.18 Rezidivmuster Das Rezidivmuster für 163 Patienten mit Plattenepithelkarzinom der inneren Nase und Nasennebenhöhlen, sowie das der einzelnen Therapiegruppen, ist aus Tabelle 12 ersichtlich. Bei 6 der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen lagen keine Angaben über das Rezidivmuster vor. Von den 29 Patienten, die nur eine Radiotherapie bekamen, unterlagen 13 Patienten einer Progression des Plattenepithelkarzinoms, die insgesamt in allen Therapiegruppen 39 28mal auftrat. Auffällig ist, dass in allen Therapiegruppen, die als Bestandteil eine Operation enthielten, in der Nachbetrachtungsphase eine erhöhte Anzahl an tumorfreien Patienten vorzufinden war. Von 30 Patienten, die eine alleinige Operation bekamen, waren 19 Patienten tumorfrei. 34 der 61 Patienten, die einer Operation und einer Radiotherapie unterzogen wurden, waren ebenfalls tumorfrei. Ebenso wiesen 14 von 25 Patienten eine Tumorfreiheit auf, die operiert wurden, eine Radiotherapie bekamen und einer Chemotherapie unterzogen wurden. Tabelle 12: Rezidivmuster der 163 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen (bei 6 der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen lag keine Angabe über das Rezidivmuster vor) 5.19 Todesursache Die Tabelle 13 zeigt die Todesursache des Gesamtkollektivs von 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen in der Übersicht. 50 Patienten lebten zum Zeitpunkt des festgelegten Stichtages. 86 Patienten verstarben tumorabhängig. 26 der 169 Patienten verstarben tumorunabhängig. Eine therapiebedingte Todesursache fand sich bei einem Patienten, und ein Patient verstarb an einem Zweit-Malignom außerhalb des HNO-Bereiches. 40 Zu 5 der 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen lagen keine Angaben zu ihrer Todesursache vor. Von den 50 lebenden Patienten sind 13 aus der Therapiegruppe „nur Operation“, 22 aus „Operation und Radiotherapie“ und 13 Patienten aus „Operation und Radiotherapie und Chemotherapie“. .Die Gruppen „keine Therapie“, „nur Radiotherapie“ und „nur Chemotherapie“ weisen keinen lebenden Patienten auf. Die Therapiegruppe „nur Radiotherapie“ trägt mit 27 von 29 Patienten eine große Anzahl von tumorabhängig verstorbenen Patienten. In der Gruppe „keine Therapie“ sind alle 10 Patienten tumorabhängig verstorben. Tabelle 13: Todesursache der 169 Patienten mit Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen unterteilt nach Therapiegruppen 5.20 Überlebensanalysen Die Überlebensanalyse erfolgt zunächst für das Gesamtkollektiv von 169 Patienten. In den zwei folgenden Überlebenskurven werden das Gesamtüberleben Gesamtkollektivs und das rezidivfreie Gesamtüberleben des Kollektivs dargestellt. des 41 1,0 Überlebensfunktion zensiert kumuliertes Überleben 0,8 0,6 0,4 0,2 0,0 0 10 20 30 Überlebenszeit [Jahre] Abbildung 23: Gesamtüberleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen Gesamtüberleben n=169 Zeit Überlebensrate in % 1 Jahr 68,6 2 Jahre 55,6 3 Jahre 47,7 4 Jahre 38,9 5 Jahre 34,9 10 Jahre 22,5 20 Jahre 10,0 30 Jahre 2,0 Tabelle 14: Gesamtüberleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen 42 1,0 Überlebensfunktion zensiert kumuliertes Überleben 0,8 0,6 0,4 0,2 0,0 0 5 10 15 20 Rezidivfreies Überleben [Jahre] Abbildung 24: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen Gesamtüberleben n=169 Zeit Rezidivfreie Überlebensrate in % 1 Jahr 55,5 2 Jahre 40,4 3 Jahre 36,3 4 Jahre 29,2 5 Jahre 29,2 10 Jahre 25,6 Mittlere rezidivfreie Überlebenszeit 5,7 Jahre Tabelle 15: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen Die folgenden grafischen und tabellarischen Darstellungen zeigen die rezidivfreien Überlebensraten für therapieunabhängige, therapieabhängige und therapieunabhängigtherapieabhängig kombinierte Prognosefaktoren. Des Weiteren wird die mittlere Überlebenszeit für das rezidivfreie Überleben einiger Prognosefaktoren angegeben. Die rezidivfreie Jahresüberlebenszeit kann aus den Tabellen entnommen werden. 43 5.20.1 Therapieunabhängige Prognosefaktoren 1,0 pathologische T-Klassifikation kumuliertes Überleben 0,8 pT1 pT2 pT3 pT4a pT4b pT1-zensiert pT2-zensiert pT3-zensiert pT4a-zensiert pT4b-zensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 25: Rezidivfreies Überleben von 115 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der pathologischen T-Klassifikation (3 Patienten pTX; aus Berechnung ausgeschlossen) (p=0,048) Pathologische T-Klassifikation n=115 Rezidivfreie Überlebensrate in % Zeit pT1 n=21 pT2 n=23 pT3 n=13 pT4a n=48 pT4b n=10 1 Jahr 76,7 73,2 75,0 65,7 33,3 2 Jahre 68,2 68,3 38,1 53,9 14,2 3 Jahre 68,2 62,1 46,3 4 Jahre 51,2 62,1 46,3 5 Jahre 51,2 62,1 46,3 Tabelle 16: Rezidivfreies Überleben von 115 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der pathologischen T-Klassifikation (3 Patienten pTX; aus Berechnung ausgeschlossen) (p=0,048) 44 1,0 pathologische T-Klassifikation gruppiert kumuliertes Überleben 0,8 pT1,pT2,pT3 pT4a, pT4b pT1,pT2,pT3-zensiert pT4a, pT4b-zensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 26: Rezidivfreies Überleben von 115 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der pathologischen T-Klassifikation gruppiert (3 Patienten pTX; aus Berechnung ausgeschlossen) (p=0,122) Pathologische T-Klassifikation gruppiert n=115 Rezidivfreie Überlebensrate in % Zeit pT1-3 n=57 pT4a+4b n=58 1 Jahr 74,0 60,1 2 Jahre 59,9 47,7 3 Jahre 56,9 41,4 4 Jahre 52,2 41,4 5 Jahre 52,2 41,4 Tabelle 17: Rezidivfreies Überleben von 115 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der pathologischen T-Klassifikation gruppiert (3 Patienten pTX; aus Berechnung ausgeschlossen) (p=0,122) 45 1,0 UICC-Stadium gruppiert kumuliertes Überleben 0,8 I-III IVa-IVc I-III-zensiert IVa-IVc-zensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 27: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom UICC-Stadium gruppiert (p<0,001) UICC-Stadium gruppiert n=169 Rezidivfreie Überlebensrate in % Zeit Stadium I-III n=55 Stadium IVa,IVb,IVc n=114 1 Jahr 71,7 47,5 2 Jahre 62,4 29,1 3 Jahre 59,7 24,2 4 Jahre 47,3 19,8 5 Jahre 47,3 19,8 Mittlere rezidivfreie Überlebenszeit Stadium I-III 6,7 Jahre Mittlere rezidivfreie Überlebenszeit Stadium IVa-IVc 4,0 Jahre Tabelle 18: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom UICC-Stadium gruppiert (p<0,001) 46 1,0 Orbitabefall kumuliertes Überleben 0,8 nein ja nein-censored ja-censored 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 28: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Orbitabefall (p=0,063) Orbitabefall n=169 Rezidivfreie Überlebensrate in % Zeit ja n=59 nein n=110 1 Jahr 45,0 60,5 2 Jahre 28,3 46,2 3 Jahre 22,6 43,3 4 Jahre 18,9 34,6 5 Jahre 18,9 34,6 Mittlere rezidivfreie Überlebenszeit ja 3,6 Jahre Mittlere rezidivfreie Überlebenszeit nein 5,1 Jahre Tabelle 19: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Orbitabefall (p=0,063) 47 1,0 Schädelbasisbefall und ZNS-Befall kumuliertes Überleben 0,8 kein Befall Schädelbasis und/oder ZNS infiltriert kein Befall-zensiert Schädelbasis und/oder ZNS infiltriert-zensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 29: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Schädelbasisbefall und ZNS-Befall (p=0,011) Schädelbasisbefall und ZNS-Befall n=169 Rezidivfreie Überlebensrate in % Zeit Kein Befall n=123 Schädelbasis und/oder ZNS infiltriert n=46 1 Jahr 59,7 44,3 2 Jahre 45,5 26,0 3 Jahre 44,2 13,6 4 Jahre 35,2 13,6 5 Jahre 35,2 Mittlere rezidivfreie Überlebenszeit kein Befall 6,7 Jahre Mittlere rezidivfreie Überlebenszeit Schädelbasis und/oder ZNS infiltriert 1,4 Jahre Tabelle 20: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Schädelbasisbefall und ZNS-Befall (p=0,011) 48 1,0 ZNS- und Schädelbasisbefall kumuliertes Überleben 0,8 kein Befall Schädelbasis infiltriert ZNS u. Schädelbasis infiltriert kein Befall-zensiert Schädelbasis infiltriertzensiert ZNS u. Schädelbasis infiltriert-zensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 30: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Schädelbasisbefall und ZNS-Befall (p=0,025) Schädelbasisbefall und ZNS-Befall n=169 Rezidivfreie Überlebensrate in % Zeit Kein Befall Schädelbasis infiltriert ZNS infiltriert n=123 n=17 n=29 1 Jahr 59,7 44,9 43,9 2 Jahre 45,5 23,1 13,7 3 Jahre 44,2 23,1 4 Jahre 35,2 5 Jahre 35,2 Mittlere rezidivfreie Überlebenszeit kein Befall 6,7 Jahre Mittlere rezidivfreie Überlebenszeit Schädelbasis infiltriert 1,7 Jahre Mittlere rezidivfreie Überlebenszeit ZNS infiltriert 0,9 Jahre Tabelle 21: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Schädelbasisbefall und ZNS-Befall (p=0,025) 49 1,0 Grading gruppiert kumuliertes Überleben 0,8 G1,G2 G3,G4 G1,G2-zensiert G3,G4-zensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 31: Rezidivfreies Überleben von 143 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Grading gruppiert (bei 26 Patienten lag keine Angabe über das Grading vor; von der Berechnung ausgeschlossen) (p=0,071) Grading n=143 Rezidivfreie Überlebensrate in % Zeit G1+G2 n=103 G3+G4 n=40 1 Jahr 62,8 48,8 2 Jahre 45,0 32,0 3 Jahre 41,6 21,4 4 Jahre 36,0 14,2 5 Jahre 36,0 Mittlere rezidivfreie Überlebenszeit G1+G2 6,9 Jahre Mittlere rezidivfreie Überlebenszeit G3+G4 1,6 Jahre Tabelle 22: Rezidivfreies Überleben v. 143 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Grading gruppiert (bei 26 Patienten lag keine Angabe über das Grading vor; von der Berechnung ausgeschlossen) (p=0,071) 50 1,0 R-Klassifikation gruppiert kumuliertes Überleben 0,8 R0 R1+R2 R0-zensiert R1+R2-zensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 32: Rezidivfreies Überleben von 111 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der R-Klassifikation gruppiert (7 Patienten R-Klassifikation RX; von der Berechnung ausgeschlossen) (p<0,001) R-Klassifikation n=111 Rezidivfreie Überlebensrate in % Zeit R0 n=80 R1,R2 n=34 1 Jahr 74,4 40,1 2 Jahre 62,3 18,8 3 Jahre 57,9 4 Jahre 54,2 5 Jahre 54,2 Mittlere rezidivfreie Überlebenszeit R0 9,8 Jahre Mittlere rezidivfreie Überlebenszeit R1,R2 1,0 Jahre Tabelle 23: Rezidivfreies Überleben von 111 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der R-Klassifikation gruppiert (7 Patienten R-Klassifikation RX; von der Berechnung ausgeschlossen) (p<0,001) 51 5.20.2 Therapieabhängige Prognosefaktoren 1,0 Therapiegruppen kumuliertes Überleben 0,8 nur OP RT CT OP+RT RT+CT OP+RT+CT nur OP-zensiert RT-zensiert OP+RT-zensiert RT+CT-zensiert OP+RT+CT-zensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 33: Rezidivfreies Überleben von 159 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der Therapiegruppe (10 Patienten keine Therapie; wurden aus der Berechnung ausgeschlossen) (p<0,001) Zeit OP n=31 1 Jahr 2 Jahre 3 Jahre 4 Jahre 5 Jahre 66,6 54,5 48,5 48,5 48,5 Therapiegruppen n=159 Rezidivfreie Überlebensrate in % RT n=29 CT n=2 OP+RT RT+CT n=62 n=10 41,2 67,6 18,7 53,0 15,0 50,2 46,8 46,8 - OP+RT+CT n=25 66,9 55,9 47,9 - Tabelle 24: Rezidivfreies Überleben von 159 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der Therapiegruppe (10 Patienten keine Therapie; wurden aus der Berechnung ausgeschlossen) (p<0,001) 52 1,0 Operation kumuliertes Überleben 0,8 nein ja nein-zensiert ja-zensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 34: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der Operation (p<0,001) Operation n=169 Rezidivfreie Überlebensrate in % Zeit ja n=118 nein n=51 1 Jahr 66,9 29,5 2 Jahre 53,9 11,4 3 Jahre 49,4 9,1 4 Jahre 46,9 5 Jahre 46,9 Mittlere rezidivfreie Überlebenszeit ja 8,6 Jahre Mittlere rezidivfreie Überlebenszeit nein 0,9 Jahre Tabelle 25: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der Operation (p<0,001) 53 1,0 Radiotherapie kumuliertes Überleben 0,8 nein ja nein-zensiert ja-zensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 35: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der Radiotherapie Radiotherapie n=169 Rezidivfreie Überlebensrate in % Zeit ja n=126 nein n=43 1 Jahr 57,0 51,6 2 Jahre 41,7 36,3 3 Jahre 37,7 32,2 4 Jahre 28,7 32,2 5 Jahre 28,7 32,2 Tabelle 26: Rezidivfreies Überleben von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der Radiotherapie 54 5.20.3 Therapieunabhängige und therapieabhängige Prognosefaktoren kombiniert 1,0 pathologische T-Klassifikation und Therapiegruppen kumuliertes Überleben 0,8 pT1-3 OP pT1-3 OP+RT pT1-3 OP+RT+CT pT4a-4b OP pT4a-4b OP+RT pT4a-4b OP+RT+CT pT1-3 OP-zensiert pT1-3 OP+RT-zensiert pT1-3 OP+RT+CTzensiert pT4a-4b OP-zensiert pT4a-4b OP+RTzensiert pT4a-4b OP+RT+CTzensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 36: Rezidivfreies Überleben von 115 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der path. T-Klassifikation und der Therapiegruppe (3 Patienten pTX; aus den Berechnung ausgeschlossen) (p=0,030) Zeit 1 Jahr 2 Jahre 3 Jahre 4 Jahre 5 Jahre Pathologische T-Klassifikation und Therapiegruppe n=115 Rezidivfreie Überlebensrate in % pT1-3 OP pT1-3 pT1-3 pT4a+4b pT4a+4b n=19 OP+RT OP+RT+ OP OP+RT n=29 CT n=11 n=32 n=9 81,6 73,4 63,5 33,7 64,5 72,5 56,0 50,8 52,1 63,4 56,0 50,8 46,9 63,4 49,0 50,8 46,9 63,4 49,0 46,9 pT4a+4b OP+RT+ CT n=15 66,7 57,1 - Tabelle 27: Rezidivfreies Überleben von 115 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von der path. T-Klassifikation und der Therapiegruppe (3 Patienten pTX; aus den Berechnung ausgeschlossen) (p=0,030) 55 1,0 pathologische T-Klassifikation T4a+4b kumuliertes Überleben 0,8 pT4a+4b OP pT4a+4b OP+RT pT4a+4b OP-zensiert pT4a+4b OP+RTzensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 37: Rezidivfreies Überleben von 43 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von den Therapiegruppen OP und OP+RT und der pT-Klassifikation gruppiert pT4a+ pT4b (p=0,015) Pathologische T-Klassifikation und Therapiegruppe n=43 Rezidivfreie Überlebensrate in % pT4a+4b pT4a+4b OP OP+RT n=11 n=32 33,7 64,5 52,1 46,9 46,9 46,9 Mittlere rezidivfreie Überlebenszeit pT4a+4b OP 0,7 Jahre Mittlere rezidivfreie Überlebenszeit pT4a+4b OP+RT 7,9 Jahre Tabelle 28: Rezidivfreies Überleben von 43 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit von den Therapiegruppen OP und OP+RT und der pT-Klassifikation gruppiert pT4a+ pT4b (p=0,015) 56 1,0 Orbitabefall Therapiegruppen mit einer Operation kumuliertes Überleben 0,8 nur OP OP+RT OP+RT+CT OP+RT-zensiert OP+RT+CT-zensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 38: Rezidivfreies Überleben von 38 operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen und Orbitabefall in Abhängigkeit von der Therapiegruppe Orbitabefall Therapiegruppen mit einer Operation n=38 Rezidivfreie Überlebensrate in % Zeit OP n=3 OP+RT n=24 OP+RT+CT n=11 1 Jahr 33,3 64,8 54,5 2 Jahre 45,4 36,4 3 Jahre 37,8 4 Jahre 37,8 5 Jahre 37,8 Tabelle 29: Rezidivfreies Überleben von 38 operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen und Orbitabefall in Abhängigkeit von der Therapiegruppe 57 1,0 Orbitabefall Therapiegruppen ohne eine Operation kumuliertes Überleben 0,8 RT RT+CT RT-zensiert RT+CT-zensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 39: Rezidivfreies Überleben von 17 nicht operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen und Orbitabefall in Abhängigkeit von den Therapiegruppen RT und RT+CT (p=0,017) Orbitabefall n=17 Rezidivfreie Überlebensrate in % Zeit RT n=11 RT+CT n=6 1 Jahr 40,0 2 Jahre 20,0 3 Jahre 10,0 4 Jahre 5 Jahre Tabelle 30: Rezidivfreies Überleben von 17 nicht operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen und Orbitabefall in Abhängigkeit von den Therapiegruppen RT und RT+CT (p=0,017) 58 1,0 Schädelbasisbefall und/oder ZNS-Befall Therapiegruppen ohne eine Operation kumuliertes Überleben 0,8 RT RT+CT RT-censored RT+CT-censored 0,6 0,4 0,2 0,0 0 0,5 1 1,5 2 2,5 Rezidivfreies Überleben [Jahre] Abbildung 40: Rezidivfreies Überleben von 16 nicht operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen und Schädelbasisbefall und/ oder ZNS-Befall in Abhängigkeit von den Therapiegruppen RT und RT+CT (p=0,009) Schädelbasisbefall und/oder ZNS-Befall n=16 Rezidivfreie Überlebensrate in % Zeit RT n=9 RT+CT n=7 1 Jahr 50,0 2 Jahre 12,5 3 Jahre 4 Jahre 5 Jahre Tabelle 31: Rezidivfreies Überleben von 16 nicht operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen und Schädelbasisbefall und/ oder ZNS-Befall in Abhängigkeit von den Therapiegruppen RT und RT+CT (p=0,009) 59 1,0 Grading und Therapiegruppen kumuliertes Überleben 0,8 G1+2 OP G1+2 OP+RT G1+2 OP+RT+CT G3+4 OP G3+4 OP+RT G3+4 OP+RT+CT G1+2 OP-zensiert G1+2 OP+RT-zensiert G1+2 OP+RT+CTzensiert G3+4 OP-zensiert G3+4 OP+RT-zensiert G3+4 OP+RT+CTzensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 41: Rezidivfreies Überleben von 107 operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Grading und der Therapiegruppe (36 Pat. ohne OP, 26 Pat. k.A. Grading; von der Berechnung ausgeschlossen) Zeit 1 Jahr 2 Jahre 3 Jahre 4 Jahre 5 Jahre G1+2 OP n=23 59,8 42,7 34,2 34,2 34,2 Grading und Therapiegruppe n=107 Rezidivfreie Überlebensrate in % G1+2 G1+2 G3+4 G3+4 OP+RT OP+RT+CT OP OP+RT n=45 n=17 n=4 n=10 72,8 63,0 66,7 62,5 58,0 56,0 37,5 53,2 53,2 53,2 - G3+4 OP+RT+CT n=8 75,5 56,3 56,3 56,3 - Tabelle 32: Rezidivfreies Überleben von 107 operierten Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen in Abhängigkeit vom Grading und der Therapiegruppe (36 Pat. ohne OP, 26 Pat. k.A. Grading; von der Berechnung ausgeschlossen) 60 1,0 R-Klassifikation und Therapiegruppen von Patienten mit einer pT1- bis pT3Klassifikation kumuliertes Überleben 0,8 R0 OP R0 OP+RT R0 OP-zensiert R0 OP+RT-zensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 42: Rezidivfreies Überleben von 37 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen bei einer pT1- bis pT3-Klassifikation mit einer R0-Klassifikation im Vergleich der beiden Gruppen OP und OP+RT (p=0,515) R0-Klassifikation pT1-3 n=37 Rezidivfreie Überlebensrate in % Zeit R0 pT1-3 OP n=16 R0 pT1-3 OP+RT n=21 1 Jahr 78,6 69,1 2 Jahre 68,8 51,8 3 Jahre 58,9 51,8 4 Jahre 58,9 43,2 5 Jahre 58,9 43,2 Mittlere rezidivfreie Überlebenszeit R0 pT1-3 OP 7,5 Jahre Mittlere rezidivfreie Überlebenszeit R0 pT1-3 OP+RT 6,1 Jahre Tabelle 33: Rezidivfreies Überleben von 37 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen bei einer pT1- bis pT3-Klassifikation mit einer R0-Klassifikation im Vergleich der beiden Gruppen OP und OP+RT (p=0,515) 61 1,0 R-Klassifikation und Therapiegruppen von Patienten mit einer pT4a- oder pT4bKlassifikation kumuliertes Überleben 0,8 R0 OP R0 OP+RT R0 OP-zensiert R0 OP+RT-zensiert 0,6 0,4 0,2 0,0 0 1 2 3 4 5 Rezidivfreies Überleben [Jahre] Abbildung 43: Rezidivfreies Überleben von 29 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen bei einer pT4a- oder pT4b-Klassifikation mit einer R0Klassifikation im Vergleich der beiden Gruppen OP und OP+RT (p=0,013) R0-Klassifikation pT4a oder pT4b n=29 Rezidivfreie Überlebensrate in % Zeit R0 pT4a oder pT4b OP n=8 R0 pT4a oder pT4b OP+RT n=21 1 Jahr 57,1 83,1 2 Jahre 70,8 3 Jahre 62,9 4 Jahre 62,9 5 Jahre 62,9 Mittlere rezidivfreie Überlebenszeit R0 pT4a oder pT4b OP 1,0 Jahre Mittlere rezidivfreie Überlebenszeit R0 pT4a oder pT4b OP+RT 10,5 Jahre Tabelle 34: Rezidivfreies Überleben von 29 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen bei einer pT4a- oder pT4b-Klassifikation mit einer R0Klassifikation im Vergleich der beiden Gruppen OP und OP+RT (p=0,013) 62 6 Diskussion Bösartige Neubildungen der inneren Nase und der Nasennebenhöhlen sind nicht nur mit einem Anteil von 0,2%-0,5% aller Malignome und etwa 3% der Kopf und Halstumoren selten (5; 18; 35), sondern zeigen auch eine histopathologische Vielfalt. Eine Fragestellung, mit der sich bisher vorliegende Studien häufig beschäftigen, ist die Frage nach relevanten Prognosekriterien. Bei der Gesamtauswertung aller Tumorentitäten im gesamten Abschnitt der Nasennebenhöhlen wurden Aspekte des Stagings, die Bedeutung der Infiltration wichtiger angrenzender Strukturen wie der Orbita, der Schädelbasis und des Zentralnervensystems, der Befund tumorfreier Resektionsränder, der Stellenwert der Tumorentität, der Einfluss des Differenzierungsgrades und der Stellenwert der unterschiedlichen Therapieform beachtet. Ein Vergleich der Behandlungsergebnisse bei Tumoren der Nasenhaupthöhle und der Nasennebenhöhle ist aufgrund der bestehenden Inhomogenitäten der Erfahrungsberichte (u.a. kleine Studiengrößen, variierende Anteile einzelner Tumorentitäten, unterschiedliche Stadienverteilungen, verschiedene Therapieformen, differierende Anteile in kurativer Absicht ausgeführter Behandlungen) problematisch. Für eine Gruppe maligner Tumoren (davon 68% Plattenepithelkarzinome der Nasennebenhöhle) werden bei Berücksichtigung aller Tumorstadien 5- Jahresüberlebensraten von 39% angegeben (83). In der Literatur der letzten 10 Jahre variierten die tumorspezifischen 5-Jahresüberlebensraten zwischen 35% und 65% (35; 89; 100; 110; 11; 79), bei einer durchschnittlichen Gesamtüberlebensrate von 43% (35), die in einer Metaanalyse festgestellt wurde. Im eigenen Patientenkollektiv lag die Gesamt-5-Jahresüberlebensrate bei 34,9%. Es wurde darauf hingewiesen, dass sich die Überlebensraten seit den 60er Jahren je Dekade mit Werten von 25%, 34%, 45%, 50% bei Plattenepithelkarzinomen der Nasenhaupthöhle und der Nasennebenhöhle verbessert haben (35). 6.1 Häufigkeit und Ätiologie von Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen Als häufigste Tumorentität wird an dieser Stelle das Plattenepithelkarzinom betrachtet. Plattenepithelkarzinome stellen mit etwa 50% den größten Anteil der Malignome dar (120). Im eigenen Patientenkollektiv von 169 Patienten wurde ausschließlich diese 63 Entität betrachtet. Hier zeigte sich eine große Anzahl von Plattenepithelkarzinomen in der Nasenhaupthöhle und der Kieferhöhle mit insgesamt 84% (142/169 Patienten). Zbären diagnostizierte in 56% der Fälle Plattenepithelkarzinome (120). Bei Harbo ergab sich eine Verteilung von 46% Plattenepithelkarzinome (46). Bei Ganzer et al. stellten Plattenepithelkarzinome 60% der Malignome dar (39). Diese Zahlen wurden durch weitere umfangreiche Studien belegt (72; 105). Hache et al. diagnostizierten 42,2% Plattenepithelkarzinome (44), Parsons et al. 43,8% (88), Müller et al. 44% (77), Alth und Kolbabek 53% (4), Backhouse 55,8% (6), Tabb und Barranco 51,3% (107), Thorup et al. 55% (109), Carrillo et al. 67,58% (19) und schließlich Naszaly und Németh 57,1% (81). Ein Grund für die prozentualen Differenzen der verschiedenen Forschungszentren liegt möglicherweise in einer unterschiedlichen pathologischen Klassifikation. Als Kofaktoren bei der Entstehung können die humanen Papillomaviren 6 bzw. 11 wirken. Bei 4% aller Plattenepithelkarzinome der Nase soll dies der Fall sein (86). Für die Inzidenz sinunasaler Tumoren ist die Exposition gegenüber exogenen, gewerblichen Noxen von entscheidender Bedeutung. In holzverarbeitenden Berufen, der Nickelindustrie, Chromsalz und Chromsäure verarbeitenden Industriezweigen ist das Karzinomrisiko z. T. auf das 140-fache der Normalbevölkerung erhöht (48). Besonders bei einer Nickelexposition findet man eine Häufung von Plattenepithelkarzinomen (40; 47). Auch eine Asbestexposition (29) steht im Zusammenhang mit der Entwicklung von Plattenepithelkarzinomen. Die lange Latenzzeit von durchschnittlich 30-50 Jahren (48; 73; 111) erklärt das gehäufte Auftreten von Tumoren in einem höheren Lebensalter. Laut Literatur besteht ein erhöhtes Risiko bei Gebrauch von Schnupftabak (1). Der Konsum inhalativer Tabake wird unterschiedlich beurteilt. Brinton et al. ermittelten ein zwei- bis dreifach höheres Risiko für die Erkrankung an einem Malignom der Nase und der Nasennebenhöhlen (14). Casal Lareo et al. resümierten diesbezüglich jedoch kein erhöhtes Risiko (20). Auch das Schnupfen von Kokain wurde als ätiologischer Faktor diskutiert (39). In verschiedenen Studien wurden Noxen mit der Entstehung von Malignomen der Nase und der Nasennebenhöhlen in Verbindung gebracht. Hierbei handelte es sich insbesondere um Nickel (70; 31), Formaldehyd (95), Tannine (2), Senfgas (36) und Isopropylalkohol (3). Van den Oever und Luce et al. berichten über Stäube von Textilien, Hölzer, Getreide, Leder und Zement (112; 69). 6.2 Alters- und Geschlechtsverteilung Die Analyse dieses Patientenkollektivs ergibt in Übereinstimmung mit zahlreichen anderen Studien (50; 78), dass das männliche Geschlecht im 6. und 7. Lebensjahrzehnt 64 die Hauptrisikogruppe für maligne Nasennebenhöhlentumoren darstellt. So stellten z.B. Beale und Garret (9) ein mittleres Erkrankungsalter von 61 Jahren fest. Im hier untersuchten Kollektiv lag das mediane Alter bei 65 Jahren. Das mittlere Alter betrug 62,52 Jahre ± 13 Jahre Standartabweichung. Die Ergebnisse des Durchschnittsalters von 63,6 Jahren bzw. dem Altersgipfel von 61-70 Lebensjahren bei Bayer stimmen mit denen dieser Studie überein, wobei dort eine große Vielfalt maligner Tumoren der inneren Nase und der Nasennebenhöhle ausgewertet wurden (8). In der hier vorliegenden Studie wurde der Blick hingegen ausschließlich auf die häufigste Tumorentität der malignen Tumoren der inneren Nase und der Nasennebenhöhlen, die Plattenepithelkarzinome, gerichtet. In der Studie von Jurkiewicz et al. wurde ein Altersintervall zwischen 14 und 74 Jahren beobachtet. Das mittlere Alter betrug 68,2 Jahre. Die größten Häufigkeiten fanden sich dort in den Altersgruppen 60 bis 69 Jahren (50 Patienten) und von 70 bis 79 Jahren (44 Patienten). Dies entspricht den Ergebnissen der eigenen Untersuchungen. Es fanden sich in den Gruppen 65-69 Jahren (23 Patienten), 70 bis 74 Jahren (32 Patienten) und 75 bis 79 Jahren (18 Patienten) die größten Kollektive (59). Betlejewski et al. fand in seiner Studie mit 55% die meisten Erkrankungen in der Altersgruppe 50 bis 69 Jahren (10). Diese Ergebnisse geben einen Hinweis darauf, dass es häufig einer langfristigen Aussetzung des Gewebes durch die in diesem Kapitel beschriebenen Noxen bedarf, um ein kanzerogenes Geschehen der inneren Nase und der Nasennebenhöhlen auszulösen. Die Altersgrenzen wurden auf der Grundlage des Alters zum Zeitpunkt der Diagnosestellung erhoben. Da sich zum Zeitpunkt der Diagnosestellung viele Patienten bereits in einer fortgeschrittenen Tumorklassifikation befanden, liegt das wirkliche Erkrankungsalter unterhalb der beschriebenen Werte und kann aufgrund unterschiedlicher Progression nicht bestimmt werden. Hicsonmez et al. bestimmten in multivariaten Analysen das Geschlecht als einen statistisch signifikanten Faktor für Frauen (p=0,013) (49). In einer von Ströhmann und Haake durchgeführten Studie über maligne Tumoren der Nasenhöhle und der Nasennebenhöhlen wurde eine Verteilung von 1,5:1 ermittelt (105). Vollrath und Lasch gaben ein Verhältnis von 1,3:1 an (113). Demgegenüber berichten Ganzer et al. von einem Verhältnis von Männern zu Frauen von etwa 2:1 (39). Das im eigenen Patientengut gefundene Verhältnis Männer zu Frauen von 2,38:1 wurde bereits ähnlich in anderen Studien beschrieben (5; 35; 79; 80; 120). Ebenfalls deckt sich dieses Verhältnis mit der Studie von Giri (40). Bei Dilhuydy et al. war das Verhältnis sogar 3:1 (30). Die Studie von Jurkiewicz et al. zeigte eine Verteilung von Frauen zu Männern 65 von 2,23:1 (59). Dies gleicht nahezu den Ergebnissen des eigenen Patientenguts. In der retrospektiven Studie von Thorup et al. waren von 242 Patienten 162 (67%) Männer und 80 (33%) Frauen (109). Diese ungleiche Geschlechtsverteilung lässt sich mit der erhöhten beruflichen Exposition von Männern gegenüber kanzerogenen Noxen sowie mit dem höheren Tabakkonsum von Männern erklären. So berechneten Brinton, Blot, Becker, Winn, Browder, Farmer und Fraumeni Jr sowie Hayes, Kardaun und Bruyn ein zwei- bis dreifach erhöhtes Risiko für sinunasale Karzinome bei Rauchern gegenüber Nichtrauchern unabhängig von der beruflichen Exposition (15; 48). 6.3 Symptomatik Bei den in der Studie von Bayer nachuntersuchten Patienten blieben die Tumoren der Nasenhaupthöhle und der Nasennebenhöhle lange Zeit symptomarm. Erst größere Geschwülste machten durch entsprechende Beschwerden auf sich aufmerksam, die jedoch meist recht unspezifisch und mit denjenigen chronischer Entzündungen in diesem Bereich identisch waren. Dies birgt die Gefahr einer Fehlinterpretation sowohl des Patienten, als auch des Arztes und erklärt den zum Teil sehr späten Arztbesuch und die späte Diagnosestellung, die meist erst in fortgeschrittenem Tumorstadium erfolgte (8). Im eigenen Patientenkollektiv von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen zeigte sich dies ebenfalls. Der Anteil an Tumoren, die sich bei der Klinikaufnahme in der Kategorie T3 oder T4 befinden, wird in der Literatur mit Werten zwischen 60% und 88% angegeben (26; 53; 71; 96; 99; 119). Jurkiewicz et al. mit 72%, Betlejewski et al. mit 72,3% und Hicsonmez et al. mit 67,5% zeigten ebenfalls einen hohen Anteil an Patienten mit einer fortgeschrittenen Tumorklassifikation in ihren Patientenkollektiven (59; 10; 49). Die Ergebnisse des eigenen Patientengutes bestätigten diese Angaben. 132 (78,2%) der 169 Patienten wiesen zum Zeitpunkt der Diagnosestellung bereits eine T3, T4a und T4b Kategorie auf. Zum Zeitpunkt der Diagnosestellung befanden sich 81,7% (138/169) der Patienten bereits in fortgeschrittenen Stadien (III, IV a, IV b, IV c). Es lag eine pT3-Klassifikation in 11% und eine pT4-Klassifikation in 49,2% der Fälle vor. Ähnliche Ergebnisse ergab die Studie von Baier, in der man die Patienten entsprechend den in der Nasennebenhöhlenonkologie verwendeten Klassifikationen unterteilte. Es lag in 95% der Fälle fortgeschrittene Tumoren der Kategorien T3 (29%) und T4 (66%) bzw. der zusammenfassenden Stadien III und IV vor (7). 66 Eine Aufgliederung der anamnestisch und klinisch erhobenen Initialsymptome zeigt, dass insbesondere eine Behinderung der Nasenatmung (48,6%), Epistaxis (30,6%), frontale Cephalgien (30,6%), sowie die Gesichtsschwellung (37,8%) als klinische Leitsymptome anzusehen sind. Aufgrund der spät auftretenden und unspezifischen Symptome sowie der schwer einsehbaren Anatomie des Nasennebenhöhlensystems wird ein malignes Geschehen meist erst in einem fortgeschrittenen Stadium diagnostiziert (61; 82). Dies wird durch die Zahlen der oben genannten Tumorkategorien T3, T4a und T4b und der UICC-Stadien III, IVa, IVb bestätigt. Zur Therapie sind somit meist sehr ausgedehnte Eingriffe erforderlich, was die Prognose für eine Heilung deutlich verschlechtert (117; 118). Auch Zbären et al. berichten in ihren Untersuchungen, dass 46% der Karzinome erst in einem weit fortgeschrittenen Stadium diagnostiziert wurden (120). Die meisten malignen Tumore der Nasennebenhöhlen wurden im frühen Stadium fälschlicherweise mit einer Sinusitis verwechselt und deshalb erst in einem fortgeschrittenen und späteren Stadium diagnostiziert (83). Viele Patienten leiden zum Zeitpunkt der Diagnosestellung unter asymptomatischen, nur unspezifischen Symptomen (16) oder es liegen bereits Zeichen für ein weit fortgeschrittenes Stadium der Nasennebenhöhlentumoren vor. Nach Tabb und Barranco suchen Patienten in der Regel erst 6-9 Monate nach dem Auftreten unspezifischer rhinologischer Symptome einen Arzt auf (107). Studien zeigen, dass die Latenz zwischen einem Auftreten von ersten Symptomen bis zur Diagnose durchschnittlich 6 Monate beträgt (91; 100). Als unpezifische Erstsymptome treten eine Obstruktion der Nase und blutig tingierte Rhinorrhoe auf (87). Zu einem späteren Zeitpunkt treten rezidivierende Epistaxis, eine Dysfunktion der Hirnnerven I-VI, Schmerzen, Schwellungen, Sensibilitätsstörungen, Doppelbilder sowie Gaumenulzera auf. Exophthalmus, Sehminderung, Sehverlust, Verlagerung des Auges, Knochenarrosion, Bewegungseinschränkung des Bulbus und Tränenträufeln sind Hinweise auf eine orbitale Beteiligung bei Malignomen der inneren Nase und der Nasennebenhöhlen. Aufgrund des langen Fehlens pathognomischer Symptome und der schlecht überschaubaren Lokalisation des Nasennebenhöhlensystems ist die Früherkennung der Nasennebenhöhlenmalignome ein Problem. Deshalb sollte gerade bei beruflich prädisponierten Personen auch bei unspezifischen rhinologischen Symptomen eine möglichst zeitnahe Überweisung in eine Fachklinik oder zu einem Facharzt zur genaueren Abklärung durchgeführt werden. Von großer Bedeutung ist in diesem 67 Zusammenhang auch die Sensibilisierung der Allgemeinärzte, HNO-Ärzte aber auch der Zahnärzte (118). 6.4 Lokalisation, Histologie und Grading Die exakte Bestimmung des Ursprungsortes ist bei Tumoren der Nasenhaupthöhle und der Nasennebenhöhlen schwierig, da diese häufig bei Diagnosestellung bereits in fortgeschrittenen Stadien vorliegen. Jakobsen et al. konnten bei 11% ihres Studienkollektivs keine Lokalisationsangaben machen (54). Eine geringe Beteiligung der Kieferhöhle und der häufige Befall der Siebbeinzellen in der Studie von Ströhmann und Haake erklärten sich durch die Zurechnung des maxilloethmoidalen Winkels zum Siebbein durch die Autoren (105). In unserer Studie fanden sich die meisten Karzinome in der Nasenhaupthöhle (108 Patienten, 63,9%) und Kieferhöhle (34 Patienten, 20,1%). An dritter Stelle der Häufigkeitsverteilung waren mit 16,0% der Plattenepithelkarzinome (27 Patienten) in den Siebbeinzellen lokalisiert. In der Studie von Bayer befielen die Malignome in 48,8% die Nasenhaupthöhle, gefolgt von der Kieferhöhle und den Siebbeinzellen mit jeweils 9,8%. Nur selten war die Keilbeinhöhle mit 1,8% betroffen (8). Diese Verteilung weist somit nach ihrer Häufigkeitsverteilung die gleiche Reihenfolge wie unsere Studie auf, wobei die Ergebnisse in Bezug auf die prozentuale Verteilung abweichend sind. Es muss hier erwähnt werden, dass es sich in unserem Patientengut ausschließlich um Plattenepithelkarzinome handelte und die Studie von Bayer eine große Anzahl an verschiedenen Tumorentitäten beinhaltet hat (8). Prozentuale Differenzen lassen sich auf Abwandlungen bei den Einteilungen in den verschiedenen Studien erklären. Bei Wustrow zum Beispiel wurde die Lokalisation Kieferhöhle und Siebbeinzellen als eigener Unterpunkt aufgeführt. Wenn man diese Tatsachen berücksichtigt, zeigt sich generell ein einheitliches Ergebnis (117; 118; 119). Bei Baier et al., Dulguerov et al. und Myers et al. zeigte sich ebenfalls, dass sinunasale Malignome am häufigsten Kieferhöhle, Siebbeinzellen und Nasenhaupthöhle befallen, während Stirnhöhle und Keilbeinhöhle nur in seltenen Fällen betroffen waren (7; 35; 79). Bei Carrillo et al. fanden sich in einer Gruppe von 109 Patienten 95 Tumore in der Kieferhöhle (19). Es gibt eine große Zahl von Literatur für die Verteilung der Histologie von Malignomen der inneren Nase und der Nasennebenhöhlen (7; 76; 93; 38; 45). Die Histologie wurde in verschiedenen Studien untersucht. Bei Thorup et al. fanden sich Plattenepithelkarzinome (55%), Adenokarzinome (28,5%), Adenoid-zystische 68 Karzinome (5,0%) und undifferenziertes Karzinom (4,5%) (109). Guo et al. berichten in den Ergebnissen von einer Verteilung der 151 Patienten von 72 Plattenepithelkarzinomen, 44 Adenokarzinomen, 16 Sarkomen und 19 anderen histologischen Typen (42). Die histologischen Typen der Karzinome von 97 Patienten waren bei Le et al. wie folgt verteilt: 58 Plattenepithelkarzinome, 4 Adenokarzinome, 16 undifferenzierte Karzinome und 19 Adenoid-zystische Karzinome (65). In unserer Studie bestand das Patientenkollektiv ausschließlich aus Patienten mit Plattenepithelkarzinomen, so dass die histopathologische Klassifizierung, anders als in anderen Studien mit Malignomen der inneren Nase und der Nasennebenhöhlen, einen sehr differenzierten Überblick innerhalb dieser Tumorentität gewährte. Bei den 118 (69,8%) der operierten Patienten im eigenen Patientenkollektiv basierte die histologische Klassifikation auf der Untersuchung des Operationspräparates, bei den nicht operierten 51 (30,2%) Patienten auf dem entnommenen Biopsiematerial. Es lag bei 72 (42,6%) Patienten verhornende Plattenepithelkarzinome, bei 65 (38,5%) Patienten Plattenepithelkarzinome ohne nähere Angabe und bei 32 (18,9%) Patienten nicht verhornende Plattenepithelkarzinome vor. Die Tumorhistologie wurde in der Analyse des eigenen Patientengutes nicht als unabhängiger Prognosefaktor bestimmt, jedoch zeigte die Analyse des Gradings gruppiert eine Tendenz zu einer besseren rezidivfreien 5-Jahresüberlebensrate der Gruppe G1 und G2 als der Gruppe mit dem Grading G3 und G4 (p=0,071). Von 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen waren bei 26 Patienten keine Angaben zum Grading vorhanden und weitere 36 Patienten (7 Patienten keine Therapie, 18 Patienten RT;1 Patient CT und 10 Patienten RT+CT) hatten keine OP als Bestandteil ihrer Therapie, so dass ein Kollektiv von 107 Patienten untersucht wurde, die eine OP als Bestandteil ihrer Therapie hatten. Die verschiedenen Therapiegruppen (OP, OP+RT und OP+RT+CT) hatten keinen signifikanten Einfluss auf den Prognosefaktor Grading. In der Gruppe G1 und G2 scheint die kombinierte Therapie einer Operation und einer adjuvanten Radiotherapie eine Tendenz zu einem besseren rezidivfreien 5-Jahresüberleben zu ergeben (G1+G2 OP 34,2% entgegen G1+G2 OP+RT 53,2%). 6.5 Orbitabeteiligung Im eigenen, nur Plattenepithelkarzinome umfassenden, Patientenkollektiv, lag die Orbitabeteiligung bei 169 Patienten mit Plattenepithelkarzinomen bei 34,9%. Insgesamt war bei 59 (34,9%) von den 169 Patienten mit Plattenepithelkarzinom der inneren Nase 69 und der Nasennebenhöhlen, die Orbita klinisch bzw. radiologisch infiltriert. 38 dieser 59 Patienten wurden operiert. Bei 4 der 38 operierten Patienten wurde eine Exenteratio der Orbita durchgeführt, von denen je zwei Patienten zu den Therapiegruppen „Operation und Radiotherapie“ und „Operation und Radiotherapie und Chemotherapie“ zugehörig waren. Die Studie zeigt bei einem Orbitabefall eine deutlich schlechtere Tendenz eines rezidivfreien Überlebens als bei den Patienten ohne Orbitabefall (p=0,063). Das rezidivfreie 5-Jahresüberleben bei Patienten mit einer Infiltration der Orbita betrug 18,9% und ohne einen Orbitabefall 34,6%. Guntinas-Lichius et al. zeigten in ihrer Arbeit einen Wert von p=0,041 bei einer Infiltration der Orbita auf (43). Carrillo et al. schlussfolgerten in ihrer Arbeit, das Tumoren mit einer T4-Klassifikation und Infiltration der Orbita eine schlechtere Prognose im Vergleich zu den anderen T4 klassifizierten Tumoren zeigen (19). Bei Johnson, Krohel, Yeon und Parnes (58) lag eine Beteiligung der Orbita bei 45% aller Malignomen der Nase und der Nasennebenhöhle vor. Diese Prozentsätze lassen sich durch die Anatomie erklären. Die Orbita grenzt mit drei Seiten an das Nasennebenhöhlensystem (98). Als Leitschiene für das Tumorwachstum bestehen zusätzlich verschiedene Fissuren und Foramina für den Durchtritt von Gefäßen und Nerven. 25% der Patienten weisen bei der Diagnosestellung ein oder mehrere richtungsweisende Symptome auf. Bei der Orbitabeteiligung werden nach Michel und Rüßmann drei Stadien definiert (75): A Der Tumor sitzt tief in der Orbita und infiltriert den Bulbus. B Der Tumor zerstört die knöcherne Orbita und erreicht die Periorbita. C Der Tumor erreicht die knöcherne Orbita, jedoch ohne deren Destruktion. 6.6 Schädelbasisbeteiligung und ZNS-Beteiligung In manchen Fällen lag zum Zeitpunkt der Diagnosestellung bereits eine Infiltration im Bereich der Schädelbasis oder des ZNS vor, welche häufig anterior gelegen ist und vom Siebbeinkarzinom ausgeht (22; 32). Der Tumor wächst durch die Lamina cribosa und infiltriert den Knochen direkt oder entlang der Perineuralscheiden der Fila olfactoria (104). Im eigenen Patientenkollektiv wiesen 10,1% der Patienten einen Befall der Schädelbasis auf und bei 17,2% lag eine Beteiligung des Zentralnervensystems vor. Patienten, die an einer Frontalhirninfiltration leiden, weisen im Allgemeinen selten typische Symptome wie Cephalgien, Hirndruckzeichen und/ oder epileptische Anfälle auf, da es sich um ein funktionell stummes Hirnareal handelt. Deutlicher dagegen 70 entwickeln die betroffenen Patienten nach Klug und Firsching im Laufe der Zeit ein hirnorganisches Psychosyndrom mit einer Wesensänderung, einer Antriebslosigkeit und einer Interesselosigkeit (62). Im Falle einer frühen Infiltration im Bereich der Lamina cribosa klagen die Patienten häufig über eine Hyp- bzw. Anosmie (21). Die Autoren Draf und Samii stellten ihr chirurgisches Konzept und Technik für die Behandlung von bösartigen Tumoren der Nasennebenhöhlen mit einem Befall der Schädelbasis vor. Bei einer Infiltration der Schädelbasis sind grundsätzlich drei unterschiedliche chirurgische Behandlungsmethoden denkbar: 1. Eine extrakranielle Teilresektion der vorderen Schädelbasis, wobei der Inhalt der Orbita ausgespart wird. 2. Eine radikale Revision des Oberkiefers, des Siebbeins und der Schädelbasis, einschließlich einer Exenteratio orbitae. 3. Ein kombiniert intra-extrakranielles Vorgehen. Sie schlussfolgerten, dass eine interdisziplinäre Kooperation und die Kombination von Chirurgie und Mikrochirurgie erfolgreichere Überlebenschancen ermöglichen. Die funktionellen und ästhetischen Ergebnisse wurden verbessert (33). Bei Schädelbasisbefall und/ oder ZNS-Befall stellte sich im eigenen Patientenkollektiv eine rezidivfreie 4-Jahresüberlebensrate von 13,6 % und demgegenüber eine 4Jahresüberlebensrate von 35,2% ohne eine Infiltration der Schädelbasis und/ oder des ZNS heraus. 123 Patienten ohne Befall der Schädelbasis oder des ZNS wiesen eine mittlere rezidivfreie Überlebenszeit von 6,7 Jahren auf. War die Schädelbasis infiltriert sank die mittlere rezidivfreie Überlebenszeit auf 1,7 Jahre. Eine besonders schlechte mittlere rezidivfreie Überlebenszeit stellte sich bei Infiltration des ZNS dar (0,9 Jahre mittlere rezidivfreie Überlebenszeit). Im eigenen Patientenkollektiv zeigt sich eine Signifikanz der rezidivfreien Überlebensanalyse beim ZNS- und Schädelbasisbefall der einzelnen Gruppen (p=0,025) und der Gruppe Schädelbasisbefall und/ oder ZNS-Befall (p=0,011) im Vergleich zu den Patienten ohne Infiltration. Ähnliche Ergebnisse finden sich auch in der Studie von Nazar, Rodrigo, Llorente, Baragano und Suárez, die bei einem Befall der Schädelbasis (p=0,013) einen signifikanten Prognoseparameter aufzeigte (83). Eine intrakranielle Tumorinfiltration (p=0,008) und die Infiltration der Schädelbasis (p=0,021) resultierten bei Guntinas et al. ebenfalls als signifikante Prognosen. Schädelbasisbefall und/ oder ZNS-Befall erwies sich somit als ein signifikanter Prognosefaktor (43). 71 6.7 UICC-Stadium Im eigenen Patientengut beträgt die rezidivfreie Gesamt-5-Jahresüberlebensrate 29,2%. Sie ist niedrig, da das eigene Patientengut einen sehr großen Anteil von fortgeschrittenen UICC-Stadien aufweist (UICC IVa-IVc 67,5%), welche die Prognose negativ beeinflussen. In dieser retrospektiven Studie mit 169 Paienten, die ein Plattenepithelkarzinom der inneren Nase und der Nasennebenhöhlen aufweisen, wird ein rezidivfreies 5-Jahresüberleben von 19,8% für die Stadien IVa bis IVc aufgezeigt. Die rezidivfreie 5-Jahresüberlebensrate ist in den Stadien I-III mit 47,3% signifikant besser (p<0,001). 6.8 Pathologische T-Klassifikation In den Ergebnissen des eigenen Patientenkollektivs zeigte sich, dass sich der Prognosefaktor pathologische T-Klassifikation in der Analyse der einzelnen pTKlassifikationen als signifikant erwies (p=0,048). Die Analyse der pT-Klassifikation gruppiert zeigte eine Tendenz (p=0,122), die einen Nachteil der pT4a und pT4b Gruppe gegenüber der pT1-3 Gruppe aufzeigte. Die rezidivfreie 5-Jahresüberlebensrate wies für die pathologische T-Klassififkation 4a und 4b gruppiert 41,4% und für die Gruppe pT13 52,2% auf. 6.9 R-Klassifikation Im eigenen Patientengut wurden 70,3% (83/118 Patienten) der Patienten mit R0 und 23,7% (28/118) der Patienten mit R1- und R2-Klassifikation eingestuft. RX trat in 7 Fällen auf. In der eigenen erstellten Analyse, in der die Gruppen R0 und R1, R2 gegenübergestellt wurden, erwies sich der Resektionsgrad ebenfalls als ein signifikanter therapieabhängiger Prognosefaktor (p<0,001). Das rezidivfreie Überleben stieg von 1,0 Jahren in der Gruppe der Patienten mit R1- und R2- bis 9,8 Jahre bei Patienten mit R0Klassifikation (p<0,001). In der pT1-3 Gruppe mit R0-Klassifikation hatte die adjuvante Radiotherapie keine signifikante Auswirkung auf die Prognose (p=0,515), was auf die geringe Ausdehnung des Tumors zurückzuführen ist. Es war jedoch eine fortgeschrittene Erkrankung vorherrschend mit 49,2% der pT4 Klassifikation. In der pT4 Gruppe mit R0-Klassifikation hat sich bei der adjuvanten Radiotherapie eine signifikant überlegene Verlängerung des rezidivfreien Überlebens im Vergleich zur alleinigen Operation ergeben (p=0,013). 72 6.10 Diagnostik 6.10.1 Klinische Diagnostik Eine umfassende klinische Diagnostik ist unumgänglich. Hierzu gehören zunächst die Anamnese, einschließlich einer Berufs- und Familienanamnese, um eine eventuelle Exposition bzw. Disposition zu erkennen (27). Eine ausführliche Inspektion ist zum Erkennen von Gesichtsasymmetrien, Weichteilschwellungen, Hautrötungen und eventueller Hautinfiltration von großer Bedeutung. Ein weiterer wichtiger Teil der klinischen Diagnostik ist die Palpation von Haut, Weichteilen, Unterlagen von Mittelgesicht und Stirn, Parotis, Kiefergelenken und Halslymphknotenstationen. Hierbei ist allerdings zu beachten, dass das primäre Abflussgebiet des hinteren Nasengangs und der Nasennebenhöhlen die retropharyngealen Lymphknotenstationen sind (27). Eine Rhinoskopie/ Endoskopie der inneren Nase und des Nasopharynx hilft bei der Abklärung von eventuellen Sekretstraßen, Blut, Polypen oder Verlegungen. Bei der Untersuchung der Mundhöhle inklusive intraorale Palpation ist auf Kieferklemme, Schleimhautveränderungen und Verwölbungen an Gaumensegel bzw. Hartgaumen, Alveolarfortsätzen und Oberkiefervestibulum zu achten. Ebenso ist eine Inspektion der Parotisausführungsgänge sowie der Zahnstatus mit Vitalitätsprobe und Lockerungsgrad durchzuführen (27). Bei der Untersuchung der Periorbita/ Orbita sollte auf Lidschwellungen, eine eventuelle Diskontinuität der Knochenränder und auf einen Exophthalamus geachtet werden. Eine umfassende klinische Diagnostik enthält ebenfalls eine Otoskopie und eine Hörprüfung. Auch der Hirnnervenstatus (Riechprüfung, Visus, Optomotorik, Trigeminus, usw.) sind wichtige Bestandteile einer ausführlichen klinischen Diagnostik (27). 6.10.2 Bildgebende Diagnostik Der Stellenwert der konventionellen Röntgendiagnostik (Nasennebenhöhlenaufnahme) kann heute allenfalls noch als initiales Screening-Verfahren angesehen werden (27). Der heutige Standard in der Differentialdiagnostik von Tumoren des Naseninneren und der Nasennebenhöhlen sind multiplanare CT- und NMR-Untersuchungen (axial, koronal, 73 sagittal) (27). Hierbei werden Schnittbilder des menschlichen Körpers erzeugt. Im Gegensatz zur Computertomographie werden bei der Magnetresonanztomographie (auch MRT, NMR) keine Röntgenstrahlen, sondern lediglich ein starkes Magnetfeld und Radiowellen benötigt. Im CT kommen Arrosionen und/ oder Destruktionen der Kompaktalamellen des Gesichtschädels problemlos zur Darstellung, während sich Weichteilprozesse in NMRs unterschiedlicher Wichtung exakter darstellen lassen. Aufgrund des guten Weichteilkontrastes ist die MRT in der Tumordiagnostik und der Abklärung von Komplikationen allerdings anderen Verfahren überlegen, insbesondere bei Vorliegen einer intrazerebralen Ausbreitung. Zudem können pathologische Befunde durch multiplanare Schichtorientierung in vielen Fällen besser beurteilt und dargestellt werden (63). Jedoch können Knochenzerstörungen und Verkalkungen durch die verlängerte Untersuchungsdauer, die mit einer verschlechterten Bildqualität einhergeht, leichter übersehen werden. Eine Kombination beider Verfahren ermöglicht eine hohe Genauigkeit bei der Bestimmung von Lokalisation, Größe, Ausdehnung und anatomischer Beziehungen eines Tumorprozesses. Dennoch bleibt bei beiden Verfahren eine bestätigende histologische Diagnostik im Sinne einer Probeexzision bzw. Biopsie unumgänglich (27; 23; 24). Des Weiteren können Panoramaschichtaufnahmen (Orthopantomogramm, OPG) - durch eine detaillierte Übersicht über dentale Strukturen, Gaumendach, Alveolarfortsätzen, Nasenboden und Kieferhöhlen – gute Zusatzinformationen liefern. Zur Abklärung und Therapieplanung (z.B. präoperative Embolisation) bei Verdacht auf einen stark vaskularisierten Tumor ist die Indikation zur Angiographie bzw. seit neuestem zur MRA (Magnetresonanzangiographie) gegeben. Auch könnte in diesem Kontext laut Lloyd und Barker (67) die Technik einer photographischen Subtraktion kombiniert mit der Gadolinium-Magnetresonanztomographie (GdMRT) bedeutsam sein (34; 67; 68). Wangenregion, Parotis und Halslymphknotenstatus sind unter Zuhilfenahme der Sonographie gut darstellbar. Bei erkrankten Patienten reduziert sich die Fehlerbeurteilungsquote durch Hinzunahme von Ultraschall in der Diagnostik um 6% (52). Der Lymphknotenstatus ist für das weitere Prozedere des therapeutischen Vorgehens bei Malignomerkrankungen des oberen Aero-Digestiv-Traktes von großer Bedeutung. 74 Die Sonographie ist sowohl der Palpation, der Computertomographie als auch der MRT im Auffinden von zervikalen Lymphknotenschwellungen überlegen. Alle im Rahmen von Staginguntersuchungen bei malignen Kopf-Hals-Erkrankungen aufgefundenen vergrößerten Lymphknoten müssen als potentiell bösartig angesehen werden, da es keine sicheren sonomorphologischen Dignitätskriterien gibt. Bei sonographisch nachgewiesenen Lymphknoten, die eine Größe von 10 mm nicht überschreiten, kann in bis zu 50% der Fälle eine metastatische Absiedlung histologisch nachgewiesen werden (52). Die Suche und Erfassung von Fernmetastasen in Lunge (Röntgen-Thorax, CT), Skelett (Szintigraphie), Leber (Sonographie, Szintigraphie) und im Gehirn (CT, MRT) sind unabdingbar. Knochenfiliae lassen sich mit der Skelettszintigraphie diagnostizieren. PET (Positronenemissionstomographie)-Untersuchungen können ebenfalls zur Metastasensuche eingesetzt werden (27). Die Panendoskopie steht zum Ausschluss synchroner Zweittumoren im oberen Aerodigestivtrakt zur Verfügung (27). 6.10.3 Diagnostik: Vergleich Klinische T-Klassifikation und pathologische T-Klassifikation Es wurde die klinische T-Klassifikation mit der pathologischen T-Klassifikation von Patienten verglichen, bei denen eine alleinige Operation durchgeführt wurde, also keine Vorbestrahlung oder Chemotherapie stattgefunden hat, so dass eine Beeinflussung der klinisch diagnostizierten Tumorausdehnung bei der Überprüfung auszuschließen ist. Eine mögliche Progression des Tumorgeschehens als beeinflussende Größe zwischen dem Zeitpunkt der klinischen Diagnose und der Operation bleibt. In 24 von 31 Fällen wurde die pT-Klassifikation im Rahmen des klinischen Stagings richtig bestimmt, in drei Fällen wurde die pT-Klassifikation unterschätzt und in drei Fällen überschätzt. In einem Fall konnte die Richtigkeit des klinischen Stagings wegen unvollständiger Daten nicht überprüft werden. In 77,4% wurde die klinische Diagnose richtig gestellt, bzw. stimmte die klinische T-Klassifikation mit der pathologischen T-Klassifikation überein. Dieses Ergebnis sollte in Zukunft durch eine weiter ausgedehnte klinische Diagnostik und eine verbesserte bildgebende Diagnostik übertroffen werden, da die Entwicklung im Bereich der apparativen Diagnostik kontinuierlich voranschreitet. 75 6.10.4 Biopsie Erst nach Abschluss der bildgebenden Diagnostik wird die Biopsie aus dem Tumor durchgeführt, um Artefakte wie Gewebeeinblutungen zu verhindern. Dabei richtet sich der Zugangsweg nach der Erreichbarkeit und der Lokalisation des Tumors (15): 1. endonasal: Nasenhöhle 2. transoral: Gaumen, gingivoalveolär, Vestibulum 3. endoskopisch/transmaxillär 6.11 Therapie Das eigene Patientenkollektiv mit 169 Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen zeigte, dass bei 48,4% der Patienten mit einem UICC-Stadium I und II eine alleinige Operation durchgeführt wurde und bei 55% der Patienten mit dem UICC-Stadium IVa, IVb und IVc ein multimodales Konzept zumeist in Form einer Tumorresektion mit nachfolgender Radiotherapie oder Radiochemotherapie verfolgt wurde. Die Betrachtung der pathologischen T-Klassifikation unter diesem Gesichtspunkt sei hier auch noch einmal hervorgehoben. Die Studie ergab, dass 61,3% (19/31 Patienten) der Patienten mit einem pathologischen T-Status von pT1-3 mit einer alleinigen Operation behandelt wurden. Davon wiesen alleine 73,7% (14/19 Patienten) der Patienten eine pT1-Klassifikation auf. 51,3% (32/62 Patienten) der Patienten mit einem pathologischen T-Status von pT4a-4b wurden mit einem multimodalen Therapiekonzept behandelt. Alleine 27 der 32 Patienten wiesen einen pT4a-Status auf. Bei der Analyse des rezidivfreien Überlebens wurde im Vergleich innerhalb der Gruppe pT4a+4b eine Signifikanz zwischen den alleinig Operierten (rezidivfreie 1-Jahresüberlebensrate von 33,7%) und denjenigen Patienten, die einer Operation sowie einer Radiotherapie unterzogen wurden (1-Jahresüberlebensrate von 64,5%) festgestellt (p=0,015). Es zeigte sich hier eine deutliche Verbesserung der Prognose bei kombiniert behandelten Patienten, die eine pT4a- oder pT4b-Klassifikation aufweisen. In den Klassifikationen pT1-3 zeigte sich diese deutliche Verbesserung nicht (p=0,518). In dieser Klassifikation hatte ein multimodales Therapiekonzept keinen signifikanten Einfluss auf das rezidivfreie Überleben der Patienten. 76 Bei weiterer Betrachtung des rezidivfreien Überlebens wurde im Vergleich innerhalb der Gruppe pT4a+4b ebenfalls eine Signifikanz zwischen den alleinig Operierten (rezidivfreie 1-Jahresüberlebensrate von 33,7%) und denjenigen Patienten, die einer Operation sowie einer Radiotherapie und Chemotherapie unterzogen wurden (1Jahresüberlebensrate von 66,7%), festgestellt. Es zeigte sich auch hier eine deutliche Verbesserung der Prognose bei kombiniert behandelten Patienten, die eine pT4a- oder pT4b-Klassifikation aufweisen. Dies unterstreicht die Forderung multimodaler Therapiekonzepte bei Patienten mit pT-Klassifikationen von pT4a und pT4b, die sich in dieser Patientengruppe sehr viel deutlicher darstellt, als in der Gruppe der Patienten mit einer pT-Klassifikation 1-3. Hier nimmt die Ausdehnung des Tumors, der bereits als ein einflussreicher Prognosefaktor beschrieben wurde, einen großen Einfluss auf die Vorgehensweise bei der Behandlung. Eine Exenteratio der Orbita ist im eigenen Patientengut mit 2,36% selten. Weymüller et al. berichten darüber, dass eine Resektion des Inhaltes der Orbita bei ausgesuchten Fällen von Patienten mit einem T3 und T4 Karzinom der Nasennebenhöhlen vermieden werden konnte (115). Es wurde bei vier Patienten eine Exenteratio der Orbita durchgeführt. Da bei 59 Patienten eine Infiltration der Orbita diagnostiziert wurde, zeigt dieses Verhältnis eine zurückhaltende Einstellung gegenüber einer Exenteratio der Orbita innerhalb der Therapiekonzepte. Die Untersuchung von 17 Patienten mit einem Orbitabefall, die keiner Operation unterzogen wurden, ergab eine signifikant bessere rezidivfreie Überlebensrate (p=0,017) zugunsten der Radiotherapie gegenüber der Radiotherapie und Chemotherapie kombiniert. Eine Chemotherapie beeinflusst die rezidivfreie Überlebensrate bei Patienten mit Orbitabefall nicht positiv. Dieses Ergebnis des rezidivfreien Überlebens ist durch Patienten, die auf Grund von Metastasen kombiniert zusätzlich zur Radiotherapie mit einer Chemotherapie behandelt wurden, beeinflusst. Patienten, bei denen bereits die Orbita befallen war, zeigten im Vergleich der beiden Therapiegruppen „Operation“ und demgegenüber „Operation und Radiotherapie“ eine unterschiedliche rezidivfreie Überlebensrate innerhalb des ersten Jahres von 33,3% (Operation) und 64,8% (Operation und Radiotherapie), wobei erwähnt werden muss, dass die Fallzahl der alleinig Operierten gegenüber dem multimodalen Therapiekonzept gering war. Jedoch liegt auch in diesen Ergebnissen ein Hinweis auf die Überlegenheit multimodaler Therapiekonzepte, auch bei einem Orbitabefall. 77 Ein Vergleich des rezidivfreien Überlebens von Patienten, die nicht operiert werden konnten oder eine Operation ablehnten, im Rahmen der Therapiegruppen „Radiotherapie alleine“ und „Radiotherapie und Chemotherapie kombiniert“ zeigte sowohl für die Patienten mit Orbitabefall (p=0,017) als auch für die Patienten mit Schädelbasisbefall und/ oder ZNS-Befall (p=0,009) einen signifikanten Vorteil für die alleinige Radiotherapie. Dies zeigt, dass die Chemotherapie keinen Einfluss auf eine bessere Prognose bezüglich des Überlebens bei dieser Patientengruppe aufweist. Die Chemotherapie wurde zumeist bei palliativen Behandlungsmethoden verwendet. Im Vergleich der operativ und strahlentherapeutisch behandelten Patienten zeigte sich ein statistisch signifikant höheres rezidivfreies Überleben zugunsten operativer Therapiekonzepte (p<0,001). 6.12 Therapieprinzipien Behandlungsrichtlinien des Kopf- und Halstumorprogramms des Medical University of South Carolina Holling Cancer Center beinhalten zunächst eine Operation mit oder ohne Radiotherapie für frühe Stadien (I oder II) von Plattenepithelkarzinomen und Kombinationen von Chemotherapie, Radiotherapie und/ oder Operation für fortgeschrittene Stadien (III oder IV) von Plattenepithelkarzinomen. Für Tumoren der inneren Nase und der Nasennebenhöhlen, die die Orbita, Dura und/ oder das Gehirn infiltrieren, ist eine Induktionschemotherapie gefolgt von einer simultanen Chemoradiotherapie (CRT) oder Operation gefolgt von einer Radiotherapie indiziert (28; 90). Als geeignetes Behandlungskonzept etablierte sich in den letzten Jahren bei fast allen histologischen Malignomtypen der Nase und der Nasennebenhöhlen eine vollständige chirurgische Tumorentfernung mit anschließender adjuvanter Strahlentherapie (35; 92). In der Chirurgie der Nasenhaupthöhlen- und Nasennebenhöhlenmalignome haben sich neben transfazialen und kombinierten kraniofazialen Zugängen in den letzten Jahren auch endonasal-endoskopische Zugänge bewährt. Durch die Hyperfraktionierung und die dreidimensionale Dosisanpassung hat die Strahlentherapie in den letzten Jahrzehnten eine wesentliche Verbesserung erfahren (92). Dennoch ist die Prognose auch bei geringer Metastasierung vor allem durch die hohe Rate an lokalen Rezidiven eingeschränkt (35). Eine optimale Dosis bei der Radiotherapie liegt bei der Behandlung von Tumoren der inneren Nase und der Nasennebenhöhlen bei etwa 60-70 Gy (2 Gy pro Fraktion) (28). 78 Es wurde über eine bevorzugte Antwort der Plattenepithelkarzinome von Kopf und Hals auf die Chemotherapie mit 5-Fluorouracil (5-FU) und Cisplatin berichtet. Diese könnten eine effektive adjuvante Behandlung von Plattenepithelkarzinomen der inneren Nase und Nasennebenhöhlen sein (84). Die meisten Autoren, z.B. Bush et al., Jesse , Lee und Ogura, Leroux-Robert und Som, sind der Meinung, dass eine Kombination von Chirurgie und Strahlentherapie die besten Resultate erzielt, wobei der Zeitpunkt der Strahlentherapie, ob vor oder nach der Operation, keinen Einfluss auf die Überlebensrate hat (17; 57; 64; 66; 102). Jurkiewicz empfiehlt eine Operation kombiniert mit einer postoperativen Radiotherapie (59). Ebenso empfehlen Guo et al. und Le et al. eine Kombination von Operation und Radiotherapie (42; 65). Le et al. favorisieren ein kombiniertes Therapiekonzept vor einer alleinigen Radiotherapie Untersuchungsergebnissen der (p<0,001) eigenen (65). Dies therapieabhängigen entspricht den Prognosefaktoren Therapiegruppen. Diese Studie stimmt mit Carrillo et al. überein, dass chirurgische Resektionen in die Behandlungsstrategie von Patienten mit Plattenepithelkarzinomen der inneren Nase und der Nasennebenhöhlen eingeschlossen werden sollten. Die signifikante Überlegenheit des rezidivfreien Überlebens operierter Patienten zeigt sich in der Untersuchung (p<0,001) und unterstreicht diese Meinung (19). Die kombinierte Therapie ist eine gute Wahl bei der Behandlung von Patienten mit Plattenepithelkarzinomen der Nasennebenhöhlen, denn eine multimodale Therapie ist effizienter als eine einzelne Behandlungsform, besonders für fortgeschrittene Plattenepithelkarzinome der Nasennebenhöhle (121; 106). Eine radikale Chirurgie empfiehlt sich für die Tumorstadien I und II wohingegen die Tumorstadien III und IV eine schlechtere Prognose bedeuten, aber ein multimodales Therapiekonzept ein besseres Ergebnis begünstigt (43), wie es auch das eigene Patientenkollektiv zeigt. Die Ergebnisse einer Untersuchung von Betlejewski et al. weisen darauf hin, dass die Indikationen für eine zusätzliche Bestrahlung ausgeweitet werden sollten (10). Eine alleinige Chemotherapie führt laut Zbären et al. und Snow et al. nicht zu einer signifikanten Erhöhung der Überlebensrate (120; 101), daher sollte eine Chemotherapie in der Kombination mit einer chirurgischen oder radiotherapeutischen Primärtherapie, durchgeführt werden. Die topographische Situation mit ihrer Nähe zu kritischen Strukturen schränkt die chirurgische Resektabilität ein, so dass die Radiotherapie einen wesentlichen Bestandteil der Therapie sinunasaler Malignome darstellt. Bei primär inoperablen Tumoren wäre der Weg nach Zbären et al. in der transkutanen Vorbestrahlung mit 45 Gy, Neubeurteilung und einer anschließenden Durchführung 79 einer chirurgischen Resektion zu wählen (120). Wenn dies nicht möglich ist, dann folgt eine Weiterbehandlung bis 75 Gy. Bei Halslymphknotenmetastasen wird eine Neck dissection und, je nach pathohistologischen Resultaten, die Nachbestrahlung empfohlen (120; 37; 55; 56). Hat der Tumor bereits infiltrierend und destruierend lebenswichtige Strukturen erreicht, sind die Grenzen der kurativen Therapie überschritten. Ist ein kurativ-chirurgischer Ansatz mit der daraus resultierenden Lebensqualität für den betroffenen Patienten nicht verantwortbar oder nicht gewünscht, beschränkt sich die Behandlung auf palliative Maßnahmen mit den Möglichkeiten einer geeigneten Radiotherapie ggf. Schmerztherapie in und Kombination gegebenenfalls mit einer einem Chemotherapie chirurgischen sowie einer Eingriff zur Tumorverkleinerung (82). Bei der Vielfalt der angewendeten Therapieformen mit den bestehenden Einschränkungen in der Bestimmung ihres jeweiligen Stellenwertes zeichnet sich in der Literatur die Empfehlung einer multimodalen Therapie mit Berücksichtigung von chirurgischen, strahlentherapeutischen und chemotherapeutischen Behandlungen bei fortgeschrittenen Nasennebenhöhlenmalignomen ab. Die Tumorresektion ist fester Bestandteil moderner Therapiekonzepte, die in ein multimodales Therapieprotokoll eingebunden werden sollen. Trotz verschiedener negativer Prognosefaktoren zeigen die vorliegenden Ergebnisse, dass eine R0-Resektion als ein hauptsächliches Ziel bei einer operativen Behandlung bleibt. Selbst bei einer R0Resektion sollte immer eine adjuvante Radiotherapie in Fällen einer pT4- Klassifikation in Betracht kommen. 80 6.13 Zusammenfassung der signifikanten Prognosefaktoren Therapieunabhängige Prognosefaktoren Pathologische T-Klassifikation p=0,048 UICC-Stadium gruppiert p<0,001 Schädelbasisbefall und ZNS-Befall p=0,025 Schädelbasisbefall und/oder ZNS-Befall gruppiert p=0,011 R-Klassifikation gruppiert p<0,001 Therapieabhängige Prognosefaktoren Therapiegruppen p<0,001 Operation p<0,001 Therapieunabhängige und therapieabhängige Prognosefaktoren kombiniert Pathologische T-Klassifikation und Therapiegruppen p=0,030 Pathologische T-Klassifikation 4a + 4b und Therapiegruppen p=0,015 Orbitabefall und Therapiegruppen ohne Operation p=0,017 Schädelbasisbefall und/oder ZNS-Befall und Therapiegruppen ohne Operation p=0,009 R-Klassifikation und Therapiegruppen mit einer pT4a- oder pT4b-Klassifikation p=0,013 Tabelle 35: Zusammenfassung der signifikanten Prognosefaktoren 81 7 Abkürzungsverzeichnis C = certainty CT = Chemotherapie cT = klinische Tumorklassifikation f = feminin G = histopathologisches Grading inf. = inferior k.A. = keine Angabe m = männlich M = Fernmetastasen med. = medialis n = Anzahl N = Nodus (regionärere Lymphknoten) OP = Operation Pat. = Patient pT = pathologische Tumorklassifikation RT = Radiotherapie sup.= superior T = Primärtumor UICC = Union internationale contre le cancer w = weiblich ZNS = zentrales Nervensystem 82 8 (1) Literatur Acheson ED, Cowdell RH, Jolles B. Nasal cancer in Nothhamptonshire boot and shoe industry. Br. Med. J., 1970, 1: 385-393. (2) Acheson ED, Cowdell RH, Rang E. Adenocarcinoma of nasal cavity and sinuses in England and Wales. Br. J. Industr. Med., 1972, 29: 21-30. (3) Alderson MR, Rattan NS. Mortality of workers on an isopropyl alcohol plant and two MEK dewying plants. Br. J. Industr. Med., 1980, 37: 85-89. (4) Alth G, Kolbabeck H. Malignome der Nasennebenhöhlen. Wien Klin. Wochenschr., 1976, 88: 660-664. (5) Ayomamitis A, Parker L, Havar T. The epidemiology of malignant neoplasms of the nasal cavities, the paranasal sinuses and the middle ear in Canada. Arch. Otorhinolaryngol, 1988, 244: 367-371. (6) Backhouse TW. The treatment of malignant tumors of the maxillary antrum. Clin Radiol, 1986, 37: 179-182. (7) Baier G, Völter C, Steigerwald I, Müller J, Schwager K. Maligne Nasennebenhöhlentumoren. Diagnostik, Therapie und Ergebnisse. HNO, Springer Medizin Verlag, Tübingen, 2005, 53: 957-965. (8) Bayer K. Langzeitergebnisse nach Behandlung maligner Nasenhaupt- und Nasennebenhöhlentumoren. Ruhr-Universität Bochum, 2006, 50. (9) Beale FA, Garrett PG. Cancer of the paranasal sinuses with particular reference to maxillary sinus cancer. J Otolaryngol, 1983, 12: 377-382. (10) Betlejewski S, Bilewicz R, Stankiewicz C, Skorek A, Gierek T, Wardas P, Gołqbek W, Szymański M, Gryczyński M, Szmeja Z, Szyfter W, OsuchWójcikiewicz E, Korolkowa O, Jurkiewicz D, Kenig D, Pośpiech L, Preś K, Namysłowski G. Malignant tumors of the nose and paranasal sinuses in the years 1992-2001. Otolaryngol Pol., 2006, 60: 729-736. (11) Bhattacharyya N. Survival and staging characteristics for non squamous cell malignancies of the maxillary sinus. Arch. Otolaryngol Head Neck Surg, 2003, 129: 334-337. (12) Bhattacharyya N. Factors affecting survival in maxillary sinus cancer. Oral Mxillofac Surg, 2003, 61: 1016-1021. 83 (13) Boenninghaus HG, Lenarz T. Hals-Nasen-Ohrenheilkunde für Studierende der Medizin. 11. Aufl., Springer, Berlin, 2001, 208-209. (14) Brinton L, Blot WJ, Becker JA, Hoover R, Fraumeni, JF. A case control study of cancers in the nasal cavity and sinuses. Amer. J. Epidemiol., 1983, 118: 436-437. (15) Brinton LA, Blot WJ, Becker JA, Winn DM, Browder JP, Farmer JC Jr, Fraumeni JF Jr. A case control study of cancers in the nasal cavity and paranasal sinues. Am J Epidemiol, 1984, 119: 896-906. (16) Budihna M, Smid L. Carcinoma of the paranasal sinuses: Results of treatment and some prognostic factors. Strahlen Onkol, 1992, 168: 322-327. (17) Bush SE, Bagshaw MA. Carcinoma of the paranasal sinuses. Cancer, 1982, 50: 154-158. (18) Carrau RL, Myers EM, Johnson JT. Paranasal sinus carcinoma--diagnosis, treatment, and prognosis. Oncology (Williston Park), 1992, 6: 43-50; discussion 55-56; Review. (19) Carrillo JF, Güemes A, Ramírez-Ortega MC, Oñate-Ocaña LF. Prognostic factors in maxillary sinus and nasal cavity carcinoma. Eur J Surg Oncol., 2005, 10: 12061212. (20) Casal Lareo C, Luce D, Leclerc A, Rodriguez J. Brgere J. History of previous disease and sinonasal cancer: a case control study. Laryngoskope, 1992, 102: 439442. (21) Catalano PJ, Sen C. Management of Anterior Ethmoid and Frontal Sinus Tumors, Otolaryngol Clin N Am, 1995, 28: 1157-1174. (22) Cheesman AD, Lund VJ, Howard DJ. Craniofacial resection for tumors of the nasal cavity and paranasal sinuses. Head Neck Surg, 1986, 8: 429-435. (23) Chong VF, Fan YF. Comparison of CT an MIT features in sinusitis. Eur. J. Radiol, 1998, 29: 47-54. (24) Chong VF, Fan YF, Khoo JB. Computed tomographic and magnetic resonance imagining findings in paranasal sinus involvement in nasopharyngeal carcinoma. Ann. Acad. Med. Singapore, 1998, 27: 800-804. (25) Clasen B, Schwab W. Zur Klassifikation und Dokumentation der Malignome der inneren Nase und Nebenhöhlen. Strahlenther. Onkol., 1989, 165: 416-419. 84 (26) Cocchi U. Die Strahlentherapie der malignen Tumoren der inneren Nase und Nasennebenhöhlen. Oncologia, 1960, 13: 370-375. (27) Cornelius CP, Wollenberg B. Maligne Tumoren der inneren Nase und der Nasennebenhöhlen. In: Wollenberg B, Zimmermann F (Hg.): Empfehlungen zur Diagnostik, Therapie und Nachsorge. Kopf-Hals-Malignome. 3. Aufl., Tumorzentrum München, Zuckerschwerdt, 2003, 204-215. (28) Day TA, Beas RA, Schlosser RJ, Woodworth BA, Barredo J, Sharma AK, Gillespie MB. Management of paranasal sinus malignancy. Curr. Treat. Options Oncol., 2005, 6: 3-18. (29) Deitmer T. Tumoren der inneren Nase und Nasennebenhöhlen durch Asbestexposition? Strahlenther Onkol, 1989, 165: 444-446. (30) Dilhuydy JM, Lagarde P, Allal AS, Bécouarn Y, Soubeyran P, Richaud P, Faucher A, Traissac L, Stoll D. Ethmoidal Cancers: A Retrospective Study of 22 Cases, In J Radiat Oncol Biol Phys, 1992, 25: 113-116. (31) Doll R, Morgan LÖG, Speizer FE. Cancer of the lung and nasal sinuses in nickel workers. Br. J. Cancer, 1970, 24: 623-632. (32) Donald PJ. Skull Base Surgery for Sinus Neoplasms. In: Donald PJ, Gluckman JL, Rice DH (eds.). The Sinuses. Raven Press, New York, 1995, 445-493. (33) Draf W, Samii M. Surgical treatment of malignant tumors of the paranasal sinuses with involvement of the base of the skull. Strahlenther Onkol, 1989, 165: 474-477. (34) Draf W, Bergheus A. Tumoren und Pseudotumoren der frontalen Schädelbasis, ausgehend von der Nase, den Nasennebenhöhlen und dem Nasenrachenraum. Rhinochirurgisches Referat. Eur. Arch. Otorhinolaryngol. Suppl., 1993, 1: 105203. (35) Dulguerov P, Jacobsen MS, Allal AS, Lehmann W, Calcaterra T, Nasal and paranasal sinuscarcinoma: are we making progress? A series of 220 patients and a systematic review. Cancer Dec, 2001, 92(12): 3012-29. (36) Easton DF, Peto J, Doll R. Cancer of the respiratory tract in mustard gas workers. Br. J. Industr. Med., 1988, 45: 652-659. (37) Feyerabend T. Die Stellung der Radiotherapie bei der Behandlung des Ästhesioneuroblastoms. HNO, 1990, 38: 20-23. 85 (38) Gadeberg CC, Hjelm-Hansen M, Søggard H, Elbrønd O. Malignant Tumors of the Paranasal Sinuses and Nasal Cavity. Acta Radiol Oncol, 1984, 23: 181-187. (39) Ganzer U, Donath K, Schmelzle R. Geschwülste der inneren Nase, der Nebenhöhlen, des Ober- und Unterkiefers. In: Naumann HH, Helms J, Herberhold C, Kastenbauer ER (Hg.). Oto-Rhino-Laryngologie in Klinik und Praxis. Bd. 2, Thieme, Stuttgart, 1992, 312-356. (40) Giri PGS. Cancer of the Maxillary Sinus. South Med J, 1991, 84: 897-902. (41) Gosepath J, Mann W. Nasennebenhöhlenkarzinom mit orbitaler Beteiligung. HNO, 1998, 46: 592-595. (42) Guo GF, Yang AK, Xie RH, Chen ZH, Wu QL, Ou SM, Liu WW, Xia LP, Chen MY, Zhang JX, Wu JH. Prognostic analysis of 151 patients with maxillary sinus malignant neoplasms. Ai Zheng, 2004, 11 Suppl: 1546-1550. (43) Guntinas-Lichius O, Kreppel MP, Stuetzer H, Semrau R, Eckel HE, Mueller RP. Single modality and multimodality treatment of nasal and paranasal sinuses cancer: a single institution experience of 229 patients. Eur J Surg Oncol, 2007, 33: 222-228. (44) Hache B, Bärwolff J, Mau S. Bestrahlungsergebnisse von malignen Nasennebenhöhlen. Radiobiolog Radiother, 1981, 22: 256-261. (45) Haraguchi H, Ebiara S, Saikawa M, Mashima K, Haneda T, Hirano K. Malignant Tumors of the Nasal Cavity: Reviw of a 60-case Series. Jpn J Clin Oncol, 1995, 25: 188-194. (46) Harbo G, rau C, Bundgaard T, Overgaard M, Elbrond O, Sogaard H, Overgaard J. Cancer of the nasal cavity and paranasal sinuses. A clinico-pathological study of 277 patients. Acta. Oncol., 1997, 36: 45-50. (47) Hartung M. Bösartige Erkrankungen der inneren Nase – Epidemiologie und arbeitsmedizinische Aspekte. Strahlenther Onkol, 1989, 165: 441-443. (48) Hayes RB, Kardaun WPF, Bruyn A. Tobacco use and sinunasal cancer: a casecontrol study. Br J Cancer, 1987, 56: 843-846. (49) Hicsonmez A, Andrieu MN, Karaca M, Kurtman C. Treatment outcome of nasal and paranasal sinus carcinoma. J Otolaryngol., 2005, 34: 379-383. 86 (50) Hone SW, O`Leary TG, Maguire A, Burns H, Timon CI. Malignant Sinonasal Tumors: The Dublin Eye and Ear Hospital Experience. Clin Otolaryngol, 1985, 10: 139-141. (51) Imola MJ, Schramm VL. Orbital preservation in surgical management of sinonasal malignancy. Laryngoscope, 2002, 112: 1357-1365. (52) Iro H, Uttenweiler V, Zenk J. Kopf-Hals-Sonographie. Eine Anleitung zur praxisbezogenen Ultraschalluntersuchung. Springer, Berlin, 2000, 14-137. (53) Itami J, Uno T, Aruga M, Ode S. Squamous cell carcinoma of the maxillary sinus treated with radiation therapy and conservative surgery. Cancer, 1998, 82: 104107. (54) Jackobsen MH, Larsen SK, Kirkegaard J, Hansen HS. Cancer of the nasal cavity and paranasal sinuses. Prognosis and outcome of treatment. Acta oncologica, 1997, 36: 27-31. (55) Jackson RT, Fitz-Hugh GS, Constable WC. Malignant neoplasmas of the nasal cacity and paranasal sinuses. Laryngoscope, 1976, 86: 726-736. (56) Jackson SR, Stell PM. Second radical neck dissection. Clin. Otolaryngol., 1991, 16: 52-58. (57) Jesse RH. Preoperative Versus Postoperative Radiation in the Treatment of Squamous Carcinoma of the Paranasal Sinuses. Am J Surg, 1965, 110: 552-556. (58) Johnson LN, Krohel GB, Yeon EB, Parnes SM. Sinus Tumors Invading the Orbit, Ophthalmology, 1984, 91: 209-217. (59) Jurkiewicz D, Wojdas A, Hermanowski M. Malignant tumors of the nose and paranasal sinuses in the years 1971-2005 in the material of the Otolaryngology Clinic WIM. Otolaryngol Pol., 2007, 61: 572-575. (60) Kainz J, Stammberger H. Gefahrenpunkte der hinteren Rhinobasis. Anatomische, histologische und endoskopische Befunde. Laryngol. Rhinol. Otol., 1991, 66: 142149. (61) Kennedy DW. Prognostic factors, outcomes and staging in ethmoid sinus surgery. Laryngoscope, 1992, 102: 1-18. (62) Klug N, Firsching R. Tumoren und Pseudotumoren der frontalen Schädelbasis, Eur Arch Otorhinolaryngol Suppl., 1993, I: 187-203. 87 (63) Langnickel R, Held P. Wertigkeit der MRT in der Diagnostik von Tumoren im Bereich des Schläfenbeins, des Nasopharynx, der Nase, der Nebenhöhlen und der kranialen Abschnitte des Parapharyngealraumes. Laryngo-Rhino-Otol., 1992, 71: 283-292. (64) Lee F.,Ogura JH. Maxillary sinus carcinoma. Laryngosope, 1981, 91: 133-139. (65) Le Q-T, Fu KK, Kaplan M. Treatment of maxillary sinus carcinoma. A comparison of the 1997 and 1977 American Joint Committee on Cancer staging systems. Cancer, 1999, 86: 1700-1711. (66) Leroux-Robert J. Cancer of the nasal cavity and the paranasal sinuses. J. Laryngol., 1974, 86: 255-262. (67) Lloyd GA, Barker PB. Subtraction magnetic resonance for tumours of the skull base and sinuses. A new imaging technique. J. Laryngol. Otol., 1991, 105: 628631. (68) Lloyd GA. Diagnostic imaging of the nose and paranasal sinuses. J. Laryngol. Otol., 1989, 103: 453-460. (69) Luce D, Gerin M, Morcet JF, Leclerc A. Sinonasal cancer occupational exposure to textile dust. Am. J. Industr. Med., 1997, 32: 205-210. (70) Magnus K, Andersen A, Hogetveit AC. Cancer of respiratory organs among workers at a nickel refinery in Norway. Int. J., 1982, 30: 681-685. (71) Mann W, Schuler-Voith C. Tumors of the paranasal sinuses and the nose – a retrospective study in 136 patients. Rhinol., 1983, 21: 173-177. (72) Mann W, Rareshide E, Schidwächter A. Nasennebenhhöhlentumore mit orbitaler Beteiligung. Laryngo-Rhino-Otol, 1989, 68: 67-670. (73) Malker HSR, Mclaughin JK, Blott JW, Weiner JA, Malker BK, Ericcson JLE, Stone BJ. Nasal cancer and occupation in Sweden. 1961-1979. Am J Industr Med, 1986, 9: 477-485. (74) McCary WS, Levine PA, Cantrell RW. Preservation of the eye in the treatment of sinonasal malignant neoplasms with orbital involvement. A confirmation of the original treatise. Arch Otolaryngol Head Neck Surg, 1996, 122: 657-659. (75) Michel O, Rüßmann W. Indikationen und Praxis der simultanen OphthalmoRhinochirurgie. Eur Arch. Otorhinolaryngol Suppl., 1993, I: 255-271. 88 (76) Muir CS, Nectoux J. Descriptive epidemiology of malignant neoplasms of nose, nasal cavities, middle ear and accessory sinuses. Clin Otolaryngol, 1980, 5: 195211. (77) Müller RP, Castrup W, Baumeister S, Burkhardtsmaier G. Zur Therapie der Malignome der Nasenhaupt- und Nebenhöhlen. Strahlentherapie, 1979, 155: 149153. (78) Mundy EA, Neiders ME, Sako K, Greene GW. Maxillary sinus cancer: a study of 33 cases. J Oral Pathol, 1985, 14: 27-36. (79) Myers LL, Nussenbaum B, Bradford CR, Teknos T, Esclamado RM, Wolf GT Paranasal sinus malignancies. An 18 year single institution experience. Laryngoscope, 2002, 112: 1964-1969. (80) Myers LL, Oxford LE. Differential diagnosis and treatment options in paranasal sinus cancers. Surg Oncol Clin N Am., 2004, 13: 167-186. (81) Naszaly A, Németh G. Behandlungsergebnisse bei bösartigen Nasennebenhöhlentumoren. Strahlentherapie, 1982, 158: 270-274. (82) Naumann HH, Helms J, Heberhold C, Kastenbauer E. Oto-Rhino-Laryngologie in Klinik und Praxis. Thieme, Stuttgart, 1992. (83) Nazar G, Rodrigo JP, Llorente JL, Baragano L, Suárez C. Prognostic Factors of Maxillary Sinus Malignancies. OceanSide Publications, Inc., U.S.A, 2004, 233238. (84) Nibu K, Sugasawa M, Asai M. Results of multimodality therapy for squamous cell carcinoma of maxillary sinus. Cancer, 2002, 112: 1964-1969. (85) Öhngren LG. Malignant tumors of maxillo-ethmoidal region. Acta Otolaryngol. Suppl., 1933, 19. (86) Osguthorpe JD. Sinus Neoplasia. Arch Otolaryngol Head Neck Surg, 1994, 120: 19-25. (87) Pantelakos ST, McGuirt WF, Nussear DW. Squamous Cell Carcinoma of the Nasal Vestibule and Anterior Nasal Passages. Am J Otolaryngol, 1994, 15: 33-36. (88) Parsons JT, Mendenhall WM, Mancuso AA, Cassisi NJ, Million RR. Malignant tumors of the nasal cavity and ethmoid and sphenoid sinusis. 1988. 89 (89) Paulino AC, Marks JE, Bricker P. Results of treatment of patients with maxillary sinus carcinoma. Cancer, 1998, 83: 457-465. (90) Pfister DG, Ang K, Brockstein B. National Comprehensive Cancer Network (NCCN) Practice Guidelines for Head and Neck Cancers. Oncology (Huntingt), 2000, 14: 163-194. (91) Rice DH, Stanley RB. Surgical therapy of tumors of thenasal cavity, ethmoid sinus, and maxillary sinus. In: Thawley SE, Panje WR, Batsakis JG, Lindberg RD (eds.). Comprehensive management of head and neck tumors. Saunders, Philadelphia, 1999, 558-581. (92) Roa WHY, Hazuka MB, Sandler HM, Martel MK, Thornton AF, Turrisi AT, Urba S, Wolf GT, Lichter AS. Results of primary and adjuvant CT-based 3-dimensional radiotherapy for malignant tumors of the paranasal sinuses. Int. J. Radiation Onkology Biol. Phys., 1994, 28: 857-865. (93) Robin PE, Powell DJ. Treatmanet of carncinoma of the nasal cavity and paranasal sinuses. Clin Otolarygol, 1981, 6: 401-414. (94) Rohen JW. Topographische Anatomie. Lehrbuch mit besonderer Berücksichtigung der klinischen Aspekte und der bildgebenden Verfahren. 10. völlig neu gestaltete Aufl. Schattauer, Stuttgart, 2000, 302-305. (95) Roush GC, Schymura MJ, Stevenson MJ, Holford TR. Time and age trends for sinunasal cancer in Connecticut incidence and US mortality rates. Cancer, 1987, 60: 422-428. (96) Schwab W. Erfahrungen bei Anwendungen des TNM-Systems im Kopf-HalsBereich. HNO, 1973, 21: 321-335. (97) Sébileau P. Les formes cliniques du carcinoma sinus maxillaire. Ann. Mal. Oreil. Larynx., 1906, 32: 517. (98) Simon C, Toussaint B, Coffinet L. Tumeurs malignes des cavités nasals st paranasales In: Encyclopedie Medico-chirurgicale, o.J., 1-19. (99) Sisson GA, Johnson NE, Amiri CS. Cancer of the maxillary sinus, clinical classification and management. Ann. Otol., 1963, 72: 1050-1054. (100) Sisson GA, Toriumi DM, Atiyah RA. Paranasal sinus malignancy: a comprehensive update. Laryngoscope, 1989, 99: 143-150. 90 (101) Snow GB, Vermorken JB, Pinedo HM. Present role of chemotherapy in the treatment of head and neck cancer. In: Scheunemann H.,Schürmann K., Helms J.: Tumors of the Skull Base. De Gryter, Berlin, 1986. (102) Som ML. Surgical management of carcinoma of the maxilla. Arch Otolaryngol Head Neck Surg, 1974, 99: 270- 273. (103) Ståhle-Bäckdahl M, Parks WC. 92-kd gelatinase is actively expressed by eosinophils and stored by neutrophils in squamous cell carcinoma. Am J Pathol., 1993, 142: 995–1000. (104) Stern SJ, Hanna E: Cancer of the Nasal Cavity and Paranasal Sinuses. In: Myers EN, Suen JY (eds.). Cancer of the Head and Neck. W.B. Saunders, 3rd edition, Philadelphia, 1996, 205-233. (105) Ströhmann B, Haake K. Nasenhöhlen- und Nasennebenhöhlen- Malignome an der HNO-Klinik der Charité seit 1959. Laryngo-Rhino-Otol., 1991, 70, 138-141. (106) Su YR, Wu GH, Zeng ZY, Guo ZM, Chen WK, Wei MW, Chen YF. Treatment of advanced maxillary sinus squamous carcinoma: an analysis of 92 cases. Ai Zheng. 2008, 27: 535-538. (107) Tabb HG, Barranco SJ. Cancer of the maxillary sinus: an analysis of 108 cases. Laryngoscope, 1971, 81: 818-827. (108) Thiel HJ, Rettinger G. Der heutige Stand in der Erkennung und Behandlung maligner Nasen- und Nasennebenhöhlen-Tumoren. 2. Teil. Therapie und Behandlungsergebnisse. HNO, 1986, 34: 96-107. (109) Thorup C, Sebbesen L, Danø H, Leetmaa M, Andersen M, Buchwald C, Kristensen CA, Bentzen J, Godballe C, Johansen J, Grau C. Carcinoma of the nasal cavity and paranasal sinuses in Denmark 1995-2004. Acta Oncol., 2010, 49: 389-394. (110) Tiwari R, Hardillo JA, Mehta D, et al. Squamous cell carcinoma of the maxillary sinus. Head Neck, 2000, 22: 164-169. (111) Vader JP, Minder CE. Die Sterblichkeit an Krebsen der Nasen- und Nasennebenhöhlen bei Schweizer Schreinern. Schweiz Med Wochenschr, 1987, 117: 481-486. 91 (112) Van den Oever R. Occupational exposure to dust and sinonasal cancer. An analysis of 386 cases reported to the N.C.C.S.F. Cancer Registry. Acta Oto-RhinoLaryngol. Belg., 1996, 50: 19-24. (113) Vollrath M, Lasch V. Klinik und Prognose der Nasennebenhöhlenmalignome unter besonderer Berücksichtigung ihrer Ätiologie. HNO, 1988, 36: 22-27. (114) Wannenmacher M. Nasen und Nasennebenhöhlen. In: Scherer E (Hg.): Strahlentherapie. Radiologische Onkologie. 3. Aufl., Springer, Berlin, 1987, 512520. (115) Weymüller EA, Reardon EJ, Nash D. A comparison of treatment modalities in carcinoma of the maxillary antrum. Arch Otolaryngol, 1980, 106: 625-629. (116) Wittekind C, Meyer HJ, Bootz F (Hg.). Klassifikation maligner Tumoren. 6. Aufl., Springer, Berlin, 2002, 40-44. (117) Wustrow F. Über die Ursachen für die unbefriedigenden Heilungserfolge bei der Behandlung der malignen Nasen- und Nebenhöhlentumoren. Arch. Klein. Exp. Ohren Nasen Kehlkopfheilkd., 1966, 187: 402-406. (118) Wustrow F. Bösartige Tumoren der Nase und ihrer Nebenhöhlen. In Benderes J., Link R., Zöllner F.: Hals-Nasen-Ohren-Heilkunde in der Praxis und Klinik, Bd. 2 Thieme, Stuttgart, 1977. (119) Wustrow J, Rudert H, Diercks M, Beigel A. Squamous epithelial carcinoma of the inner nose and paranasal sinuses. Strahlenther. Onkol., 1989, 165: 468-473. (120) Zbären P, Richard JM, Schwaab G, Mamelle G. Malignome der Nasen- und Nasennebenhöhlen HNO, 1987, 35: 246-249. (121) Zhang ZX, Li ZJ, Xu ZG, Tang PZ, Zhang ZM, An CM. Clinical analysis of 60 cases with maxillary squamous cell carcinoma. Zhonghua Er Bi Yan Hou Tou Jing Wai Ke Za Zhi, 2010, 45:560-564. 92 9 Anhang 93 94 95 Abbildung 44: Dokumentationsbogen, Maligne Tumore des HNO-Bereichs 96 10 Danksagung Mein Dank gilt Herrn Prof. Dr. med. Heinrich Iro, dem Direktor der Hals-Nasen-Ohren Klinik, Kopf- und Halschirurgie des Universitätsklinikums Erlangen für die Überlassung des Promotionsthemas und die Ermöglichung der Promotionsarbeit. Besonders bedanken möchte ich mich bei Frau Dr. med. Susanne Mayr und Herrn Dr. med. Frank Waldfahrer, die mich geduldig und gewinnbringend unterstützt haben. Ebenso bedanken möchte ich mich bei den Mitarbeiterinnen und Mitarbeitern der Tumordokumentationsabteilung der Hals-Nasen-Ohren Klinik, Kopf- und Halschirurgie des Universitätsklinikums Erlangen für ihre Hilfe. Mein ganz besonderer Dank gilt Julia Langner, die viel Zeit geopfert hat, um mich zu unterstützen und die mir liebevoll und motivierend zur Seite gestanden hat. Besonders danken möchte ich an dieser Stelle meinen Eltern, dafür, dass sie immer an mich geglaubt haben und für mich da waren.