Potenzmittel für Zellen - Max-Planck
Werbung
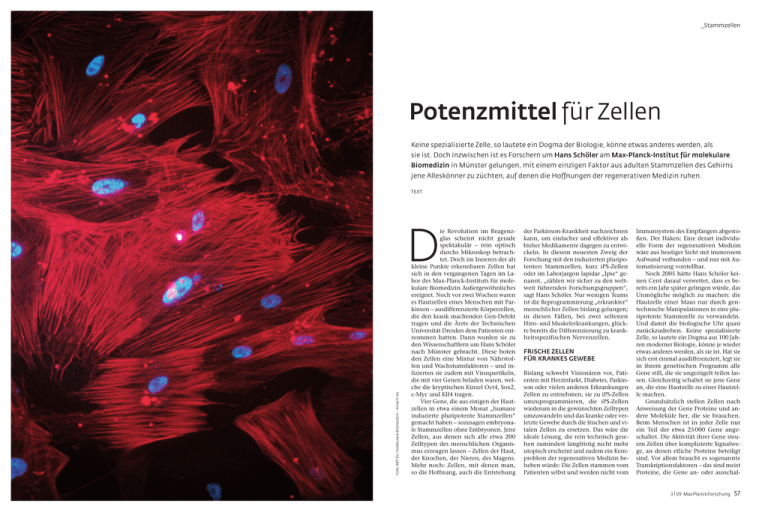
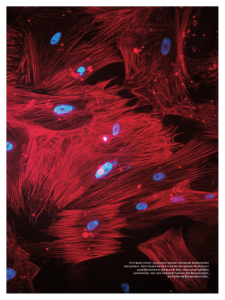
_Stammzellen Potenzmittel für Zellen Keine spezialisierte Zelle, so lautete ein Dogma der Biologie, könne etwas anderes werden, als sie ist. Doch inzwischen ist es Forschern um Hans Schöler am Max-Planck-Institut für molekulare Biomedizin in Münster gelungen, mit einem einzigen Faktor aus adulten Stammzellen des Gehirns jene Alleskönner zu züchten, auf denen die Hoffnungen der regenerativen Medizin ruhen. TEXT & # ! ! # " $ % # # 56 MaxPlanckForschung 3 | 09 Foto: MPI für molekulare Biomedizin – Kinarm Ko D ie Revolution im Reagenzglas scheint nicht gerade spektakulär – rein optisch durchs Mikroskop betrachtet. Doch im Inneren der als kleine Punkte erkennbaren Zellen hat sich in den vergangenen Tagen im Labor des Max-Planck-Instituts für molekulare Biomedizin Außergewöhnliches ereignet. Noch vor zwei Wochen waren es Hautzellen eines Menschen mit Parkinson – ausdifferenzierte Körperzellen, die den krank machenden Gen-Defekt tragen und die Ärzte der Technischen Universität Dresden dem Patienten entnommen hatten. Dann wurden sie zu den Wissenschaftlern um Hans Schöler nach Münster gebracht. Diese boten den Zellen eine Mixtur von Nährstoffen und Wachstumsfaktoren – und infizierten sie zudem mit Viruspartikeln, die mit vier Genen beladen waren, welche die kryptischen Kürzel Oct4, Sox2, c-Myc und Klf4 tragen. Vier Gene, die aus einigen der Hautzellen in etwa einem Monat „humane induzierte pluripotente Stammzellen“ gemacht haben – sozusagen embryonale Stammzellen ohne Embryonen. Jene Zellen, aus denen sich alle etwa 200 Zelltypen des menschlichen Organismus erzeugen lassen – Zellen der Haut, der Knochen, der Nieren, des Magens. Mehr noch: Zellen, mit denen man, so die Hoffnung, auch die Entstehung der Parkinson-Krankheit nachzeichnen kann, um einfacher und effektiver als bisher Medikamente dagegen zu entwickeln. In diesem neuesten Zweig der Forschung mit den induzierten pluripotenten Stammzellen, kurz iPS-Zellen oder im Laborjargon lapidar „Ipse“ genannt, „zählen wir sicher zu den weltweit führenden Forschungsgruppen“, sagt Hans Schöler. Nur wenigen Teams ist die Reprogrammierung „erkrankter“ menschlicher Zellen bislang gelungen; in diesen Fällen, bei zwei seltenen Hirn- und Muskelerkrankungen, glückte bereits die Differenzierung zu krankheitsspezifischen Nervenzellen. FRISCHE ZELLEN FÜR KRANKES GEWEBE Bislang schwebt Visionären vor, Patienten mit Herzinfarkt, Diabetes, Parkinson oder vielen anderen Erkrankungen Zellen zu entnehmen, sie zu iPS-Zellen umzuprogrammieren, die iPS-Zellen wiederum in die gewünschten Zelltypen umzuwandeln und das kranke oder verletzte Gewebe durch die frischen und vitalen Zellen zu ersetzen. Das wäre die ideale Lösung, die rein technisch gesehen zumindest langfristig nicht mehr utopisch erscheint und zudem ein Kernproblem der regenerativen Medizin beheben würde: Die Zellen stammen vom Patienten selbst und werden nicht vom Immunsystem des Empfängers abgestoßen. Der Haken: Eine derart individuelle Form der regenerativen Medizin wäre aus heutiger Sicht mit immensem Aufwand verbunden – und nur mit Automatisierung vorstellbar. Noch 2005 hätte Hans Schöler keinen Cent darauf verwettet, dass es bereits ein Jahr später gelingen würde, das Unmögliche möglich zu machen: die Hautzelle einer Maus nur durch gentechnische Manipulationen in eine pluripotente Stammzelle zu verwandeln. Und damit die biologische Uhr quasi zurückzudrehen. Keine spezialisierte Zelle, so lautete ein Dogma aus 100 Jahren moderner Biologie, könne je wieder etwas anderes werden, als sie ist. Hat sie sich erst einmal ausdifferenziert, legt sie in ihrem genetischen Programm alle Gene still, die sie ungezügelt teilen lassen. Gleichzeitig schaltet sie jene Gene an, die eine Hautzelle zu einer Hautzelle machen. Grundsätzlich stellen Zellen nach Anweisung der Gene Proteine und andere Moleküle her, die sie brauchen. Beim Menschen ist in jeder Zelle nur ein Teil der etwa 25 000 Gene angeschaltet. Die Aktivität ihrer Gene steuern Zellen über komplizierte Signalwege, an denen etliche Proteine beteiligt sind. Vor allem braucht es sogenannte Transkriptionsfaktoren – das sind meist Proteine, die Gene an- oder ausschal- 3 | 09 MaxPlanckForschung 57 _Stammzellen » 58 MaxPlanckForschung 3 | 09 wachsener Mäuse adulte Stammzellen, die sich zu verschiedenen Zelltypen des zentralen Nervensystems entwickeln. In diesen sind die Sox2- und cMyc-Gene bereits angeschaltet. Rasch zeigten die beiden Zellbiologen, dass bereits ein Viren-Cocktail mit Oct4 und Klf4 diese Zellen zu iPS-Zellen umprogrammiert. WANDLUNG ERFORDERT GEDULD Nur einige Monate später kam dann der nächste Coup aus dem Stammzelllabor in Münster: Oct4 allein genügt, um aus adulten Stammzellen des Mäusehirns iPS-Zellen zu züchten – sofern man sich in Geduld übt. Verfrachtet man nur zwei Reprogrammier-Gene in die Zellen, so dauert die Wandlung mindestens zwei Wochen. Setzt man allein auf Oct4 für den Neustart, verstreichen drei bis vier Wochen, bis die Forscher pluripotente Zellen ernten können. Und inzwischen ist es den Münsteranern sogar gelungen, diese Ergebnisse auf Stammzellen des menschlichen Gehirns zu übertragen. Damit kristallisiert sich heraus, „dass Oct4 wie ein Kapitän die Umprogrammierung von Zellen zu bestimmen scheint“, erklärt Hans Schöler. „Die anderen Gene, wie Sox2, c-Myc oder Klf4, sind die Matrosen.“ Dass Oct4 eine dermaßen zentrale Rolle für die Pluripotenz spielt, hat Schöler bislang nur vermuten können – obwohl er sich seit gut zwei Jahrzehnten mit diesem Molekül und seinen Funktionen beschäftigt. Genau genommen hat der Biologe Ende der 1980er-Jahre als Erster Oct4 und verwandte Moleküle in den Eizellen von Mäusen entdeckt – seinerzeit am Göttinger Max-Planck-Institut für biophysikalische Chemie. In der Folgezeit stellt sich heraus, dass Oct4 in allen Zellen aktiv ist, „die das Leben von MPI für molekulare Biomedizin - Jeong Beom Kim Der Forscher Jeong Beom Kim (links) beobachtet unter dem Mikroskop einen Mausembryo im Keimbläschenstadium (rechts), das sich etwa fünf bis sechs Tage nach Befruchtung der Eizelle bildet. In Grün werden die Zell-Zellkontakte der äußeren Zellschicht dargestellt, in Rot die Zellkerne. Fotos: MPI für molekulare Biomedizin – Dirk Hans (links); Mit den Genen einiger Transkriptionsfaktoren hat Shinya Yamanaka von der Universität Kyoto im Jahre 2006 experimentiert. Wenn Hans Schöler von der Pioniertat und der Beharrlichkeit seines japanischen Kollegen erzählt, hört man aus jedem Wort Respekt – ungeachtet der immensen Konkurrenz im Feld der internationalen Stammzellforschung. „Das Programm der Körperzellen schien so festgelegt“, erzählt der Max-PlanckWissenschaftler, „dass die meisten Forscher dachten, das kann sowieso nicht funktionieren.“ Doch der unbeirrbare Yamanaka lieferte die Initialzündung für all das, was seitdem „in atemberaubendem Tempo“ in den Stammzelllabors weltweit folgen sollte. Der Japaner schleuste mithilfe von Viren, die als Gen-Fähren dienten, zunächst 24 Gene von Transkriptionsfaktoren in allen denkbaren Kombinationen in die Hautzellen ein. „Schon dass man ein solches Experiment mit 24 Ge- Zellteilungen bildet. Die pluripotenten Stammzellen versorgen den größer und komplexer werdenden Embryo mit allen Zelltypen, die er braucht: damit Muskeln wachsen, innere Organe, das Gehirn, Arme oder Beine. Seinerzeit war es eine große Kunst, die extrem empfindlichen embryonalen Stammellen – so heißen die pluripotenten Stammzellen, nachdem sie dem Embryo entnommen wurden – im Labor so zu vermehren, dass sie unspezialisiert und genetisch intakt bleiben. Heute gibt es mehr als 500 menschliche embryonale Stammzelllinien – Tendenz steigend. Allerdings werfen die zellulären Alleskönner auch ethische Fragen auf. Schließlich geht der Embryo bei ihrer Entnahme zugrunde. Nicht nur deshalb konzentrierten sich vor allem deutsche Wissenschaftler zu Beginn dieses Jahrzehnts auf adulte Stammzellen, die sich aus verschiedenen Quellen des ausgewachsenen Körpers gewinnen lassen. Doch sie sind nicht pluripotent und können sich deshalb nur zu wenigen bestimmten Zelltypen ausdifferenzieren. So kam Yamanakas Kunststück gerade recht. Seine iPS-Zellen sind nicht nur pluripotent; sie haben auch die Foto: Dpa- Picture Alliance (links); MPI für molekulare Biomedizin - Sarah Eick INITIALZÜNDUNG AUS JAPAN nen erfolgreich durchführen kann, hätte ich für sehr unwahrscheinlich gehalten“, sagt Schöler. In einer ganzen Serie von Folge-Experimenten reduzierte Yamanaka die Zahl der eingeschleusten Gene auf letztlich vier: das Quartett Oct4, Sox2, c-Myc und Klf4, das in den Hautzellen normalerweise abgeschaltet ist. Und erntete am Schluss pluripotente Stammzellen. Zwar ist das Verfahren nicht gerade effizient – nur jede tausendste bis zehntausendste Hautzelle wird reprogrammiert –, aber es funktioniert! Mit den sich unbegrenzt selbsterneuernden iPS-Zellen beginnt ein neues Kapitel in der Stammzellforschung, das immer schneller fortgeschrieben wird. Schon 1998 hatte der US-Amerikaner James Thomson embryonale Stammzellen (ES-Zellen) des Menschen im Labor gezüchtet und damit den ersten Meilenstein gesetzt. Normalerweise wachsen pluripotente Stammzellen nur in einem sehr frühen Stadium der Embryonalentwicklung: Sie sammeln sich im Inneren der Blastozyste, einem kugelförmigen Gebilde aus 150 bis 200 Zellen, das sich eine knappe Woche nach der Befruchtung einer Eizelle und den darauffolgenden ersten etwa acht Die anderen Gene sind die Matrosen. Stammzelldiskussion entschärft, weil sie ohne Embryonen gewonnen werden können. Ein großes Problem allerdings blieb: Spritzt man sie Mäusen, so erkranken viele der Tiere an Tumoren. Die Gründe sind nachvollziehbar: Zum einen klinken sich die Viren mit den vier eingebauten Genen Oct4, Sox2, c-Myc und Klf4 wahllos in das Erbgut der Mäuse ein. Dadurch können beispielsweise Krebsgene aktiviert oder Anti-Krebsgene zerstört werden. Zum anderen fördert beispielsweise das eingeschleuste c-Myc-Gen in erhöhter Dosis Tumore. „Für eine therapeutische Anwendung am Menschen kommt das Yamanaka-Verfahren daher nicht in Frage“, erklärt Hans Schöler. Emsig fahndeten die Max-PlanckForscher mithin nach Zellen, in denen das eine oder andere der vier Reprogrammier-Gene natürlicherweise aktiv ist. Tatsächlich fanden Jeong Beom Kim und Holm Zaehres im Gehirn er- Pioniere der Stammzellforschung: Shinya Yamanaka von der Universität Kyoto (links) gelang es erstmals, Hautzellen der Maus in Zellen zu verwandeln, die embryonalen Stammzellen sehr ähnlich sind. Hans Schöler vom Max-Planck-Institut für molekulare Biomedizin (rechts) kam mit einem Faktor (Oct4) aus, um aus Mäusehirn-Zellen diese pluripotenten Alleskönner zu züchten. ten. Aber auch die Transkriptionsfaktoren werden von Genen kodiert und ihrerseits von einem komplexen Informationsnetzwerk gesteuert. Oct4 scheint wie ein Kapitän die Umprogammierung von Zellen zu bestimmen. 3 | 09 MaxPlanckForschung 59 _Stammzellen einer Generation in die nächste tragen und damit quasi unsterblich sind“, wie Schöler sagt. Oct4 ist für den 56-Jährigen auch ein Schlüssel, um die Biologie der Reprogrammierung en detail zu begreifen. „Der Kapitän muss immer an Bord sein“, sagt Schöler, „die Matrosen kann man austauschen.“ Offenbar regulieren sich Oct4, Sox2 und die anderen beteiligten Gene beziehungsweise Proteine gegenseitig. Wie genau, das bleibt einstweilen ein Geheimnis. VERZICHT AUF VIREN-FÄHREN Ungeachtet dessen wird die Reprogrammierungs-Technik in rasantem Tempo praxisfreundlicher. Im Frühjahr 2009 berichteten kalifornische Wissenschaftler zusammen mit dem MaxPlanck-Team, dass sie Zellen ohne Viren und deren genetische Reprogrammierungs-Fracht in iPS-Zellen umgemünzt haben. Stattdessen schleusten die Wissenschaftler die entsprechenden Proteine direkt in die Hautzellen von Mäusen ein. Das ist nicht trivial, denn zumindest im molekularen Maßstab sind Proteine extrem groß. Doch ein Trick half: Die Wissenschaftler koppelten eine kleine Kette der Aminosäure Arginin an die zuvor eigens in Bak- 60 MaxPlanckForschung 3 | 09 terien hergestellten Proteine an. Dieses molekulare „Ticket“ erleichtert deren Eintritt in die Zellen. Insgesamt viermal versetzten die Stammzell-Experten die Hautzellen mit dem Cocktail aus Oct4-, Klf4-, Sox2und c-Myc-Proteinen. Ohne die Dauerbehandlung wären die Zellen immer wieder in ihren alten Zustand zurückgefallen. Dazu gaben die Forscher ein sogenanntes small molecule – eine kleine chemische Substanz, die den Proteinen dabei hilft, ihre Funktion zu erfüllen. Nach mehr als einem Monat entdeckten die Forscher dann in manchen Zellen sichere Zeichen der Reprogrammierung. Erstmals war damit bewiesen: Man kann auf den gefahrvollen Einsatz der Viren-Fähren verzichten. Die Zugabe der Proteine dagegen birgt nach heutigen Kenntnissen kein Risiko – auch weil die Proteine im Inneren der Zelle recht schnell abgebaut werden. „Pipse“ haben die Forscher ihre neuen Kreationen getauft: Protein-induzierte pluripotente Stammzellen (piPS-Zellen). Selbst wenn noch große Proteinmoleküle nötig sind, so scheint damit vor dem Hintergrund einer therapeutischen Anwendung am Menschen eines der Kernprobleme der Zellreprogrammierung gelöst (tatsächlich haben ko- 2 reanische Forscher die Methode bereits für menschliche Zellen beschrieben). „Wir haben jetzt den Fuß in der Tür, aber die Methode muss noch wesentlich effizienter werden“, betont Hans Schöler. „Ich warte nur darauf, dass jemand die Reprogrammierung allein mit small molecules schafft.“ Also allein mit Substanzen, die leicht in Zellen einzuschleusen sind und die die wichtigsten Reprogrammierungsgene anschalten und somit den pluripotenten Zustand sichern. „Es würde mich nicht wundern, wenn das bald passiert“, sagt der MaxPlanck-Direktor. Anders als beim Einschleusen von Genen lässt sich die Dauer und Stärke der Wirkung kleiner Moleküle viel genauer steuern: Sobald die Zellen erst einmal reprogrammiert sind, kann in ihnen das normale Entwicklungsprogramm ablaufen. Eingeschleuste Viren dagegen bleiben für immer im Erbgut – mit den entsprechenden Risiken. Derweil hat Schöler schon zum nächsten Paukenschlag ausgeholt: Zellen, die sich fast von selbst in pluripotente Stammzellen verwandeln, isoliert aus den Hoden, einem Organ mit höchst erstaunlichen Eigenarten. Noch im hohen Alter produzieren die Hoden funk- 3 Foto: MPI für molekulare Biomedizin (3), Katharina Psathaki (links), Holm Zaehres (Mitte), Jeong Beom Kim (rechts) 1 tionstüchtige Spermien. Nicht nur deshalb vermuteten Wissenschaftler, dass sie dort ideales Ausgangsmaterial für eine Reprogrammierung finden könnten. Zuvor waren bereits unterschiedliche Gruppen auf Zellen im Hoden gestoßen, die sie zu Verwandlungsprozes- 1 Die Forschung mit iPS-Zellen entwickelt sich im rasanten Tempo: Nach und nach werden embryonale Stammzellen – hier von der Maus – durch induzierte pluripotente Stammzellen abgelöst, die aus ausdifferenzierten Zellen gewonnen werden. 2 Um sogenannte adulte Zellen in pluripotente Alleskönner umzuprogrammieren, benötigten die Forscher zunächst vier Faktoren (Oct4, Sox2, Klf4, c-Myc). Diese Stammzellen sind auf diese Weise aus Bindegewebszellen der Maus entstanden. 3 Da diese Faktoren Krebs auslösen können, wenn sie in Zellen eingeschleust werden, ist es das Ziel der Forscher, möglichst ganz ohne diese Faktoren auszukommen. Dabei gehen die Wissenschaftler auf Nummer sicher: Diese Kolonie menschlicher induzierter pluripotenter Stammzellen wurde bereits nur durch das Einschleusen von Oct4 gezüchtet. sen animierten. So glückte es Tübinger Wissenschaftlern, aus menschlichem Hodengewebe wandlungsfähige Zellen zu isolieren. Allerdings ist bis heute nicht zweifelsfrei geklärt, ob die daraus reprogrammierten Zellen wirklich pluripotent sind. SIND SIE WIRKLICH PLURIPOTENT? Immer wieder berichten Forscher davon, dass sie Körperzellen oder adulte Stammzellen zu pluripotenten Stammzellen („iPS-Zellen“) umprogrammiert haben. Mitunter aber fehlt der zweifelsfreie Nachweis der Pluripotenz – selbst wenn die entsprechenden Resultate in hochrangigen wissenschaftlichen Journalen veröffentlicht wurden. Ein seriöser Nachweis von Pluripotenz fußt auf verschiedenen Tests: • Nachweis von Marker-Genen: In iPS-Zellen sind Gene wie Oct4 angeschaltet, die in ausdifferenzierten Körperzellen verstummt sind. • Nachweis der Teratom-Bildung: Injiziert man pluripotente iPS-Zellen unter die Haut von Mäusen, entsteht eine besondere Tumor-Form, das sogenannte Teratom. Diese Geschwulst enthält verschiedene Typen von Körperzellen und ähnelt embryonalen Tumoren mit Bildung der drei „Keimblätter“, aus denen sich verschiedene Gewebearten entwickeln. Die Max-Planck-Forscher haben nun im Hoden von Mäusen KeimbahnStammzellen aufgespürt, die extrem selten sind: Nur zwei bis drei von 10 000 Zellen aus dem Hoden zählen zu diesem Typus. „Wir wussten, dass in diesen Keimbahn-Zellen Oct4 in geringem • Nachweis der Zelldifferenzierung: Aus iPS-Zellen lassen sich in der Kulturschale im Prinzip alle Zelltypen des Körpers herstellen. Auch hier ist es unabdingbar, Zellen der drei Keimblätter zu züchten und funktionell nachzuweisen. • Nachweis der Chimären-Bildung: Man spritzt die iPS-Zellen in Maus-Embryonen und beweist, dass sie im heranwachsenden Organismus enthalten sind. Üblicherweise werden die iPS-Zellen mit einem Fluoreszenz-Gen markiert, das sie unter einem Mikroskop als leuchtendes Gewebe sichtbar macht. Der Nachweis von iPS-Zellen, die zu Zellen der Keimbahn herangereift sind, gilt hierbei als besonders wichtig, weil er beweist, dass die Zellen ihre Erbinformation in die nächste Generation tragen könnten. Den ultimativen Nachweis der grundsätzlichen Pluripotenz von iPS- Zellen haben übrigens im Sommer 2009 chinesische Forscher mit einer besonderen Variante der Chimären-Bildung erbracht: Sie erzeugten aus reprogrammierten Körperzellen lebensfähige Mäuse, die zu fast 100 Prozent von den iPS-Zellen abstammen. 3 | 09 MaxPlanckForschung 61 _Stammzellen » Wir haben jetzt verschiedene Systeme, um Pluripotenz herzustellen, und sie werden immer besser. Maße angeschaltet ist“, sagt Schöler, „weil es auch für die Bildung von Spermien wichtig ist.“ Sprich: Der Kapitän für die Pluripotenz ist eigentlich da, aber noch nicht ganz wach, um seine Matrosen ebenfalls zu aktivieren. Geweckt haben die Wissenschaftler Oct4 mit speziellen Kultivierungsbedingungen. Als sie die Zellen aus dem Hoden kultivierten, fiel ihnen eines auf: Immer wenn ein bestimmter Abstand benachbarte Keimbahn-Stammzellen trennte, programmierten sie sich binnen zwei Wochen in pluripotente Stammzellen um – ohne das Einbringen von Proteinen, fremden Genen oder small molecules. „Wir haben jetzt verschiedene Systeme, um Pluripotenz herzustellen“, resümiert Schöler, „und sie werden immer besser.“ Hinzu kommt, dass Forscher im menschlichen Körper immer neue Quellen von adulten Stammzellen finden, die sich wahrscheinlich hervorragend reprogrammieren lassen und die leicht erreichbar sind. So wurden vor Kurzem adulte neurale Stammzellen im Gaumen gefunden. Die Riechschleimhaut der Nase wäre eine weitere optimale Quelle dafür. Das alles sind prächtige Aussichten, um eines Tages die Vision der ethisch unbedenklichen und medizinisch risikoarmen wie wirkungsvollen regenerativen Medizin zu verwirklichen. Zunächst aber will Schöler die Resultate klinischer Studien abwarten, die Mediziner mit „klassischen“ embryonalen Stammzellen erzielen. Die erste Studie dieser Art soll demnächst in den USA starten – mit querschnittsgelähmten Patienten. In der geplanten, aber noch nicht von der US-Zulassungsbehörde FDA freigegebenen Pilotstudie soll es vor allem darum gehen, Sicherheitsrisiken einer Therapie mit aus humanen ES-Zellen abgeleiteten Nervenzellen zu klären. „Nach den Vorarbeiten 62 MaxPlanckForschung 3 | 09 an Tieren ist es unwahrscheinlich, dass sich Tumore bilden“, glaubt Schöler und hofft auf eine erfolgreiche Studie. Bei querschnittsgelähmten Tieren sind die injizierten neuronalen Abkömmlinge von ES-Zellen an den verletzten Stellen im Rückenmark weiter ausgereift und haben gesundes Gewebe gebildet. NABELSCHNURBLUT HILFT DEN FORSCHERN Entsprechende Untersuchungen mit Abkömmlingen von humanen ES-Zellen an Patienten könnten den Wissenschaftlern helfen, eines Tages ähnliche Studien mit iPS-Zellen optimal zu gestalten. Idealerweise würden dabei dem kranken Menschen Zellen entnommen, die im Reagenzglas in iPS-Zellen verwandelt und dann in gesunde Körperzellen nach Wahl ausdifferenziert würden – etwa Herzmuskelzellen für Infarktpatienten oder Nervenzellen für Parkinson-Patienten. Doch wegen dieses vermutlich kaum zu leistenden Aufwands arbeitet Hans Schöler mit der NabelschnurblutBank in Düsseldorf zusammen. Dort lagern Tausende Proben mit Blut aus Nabelschnüren. Die Vorzüge: Zum einen enthält Nabelschnurblut spezielle Stammzellen (umbilical cord derived stem cells). Darüber hinaus ließe sich über eine Art immunologisches Profil abgleichen, welche Proben aus der Nabelschnurblut-Bank besonders gut zu einem potenziellen Empfänger passen würden. Und außerdem ist die in den Zellen enthaltene Erbsubstanz jung, also mit wenigen Schäden behaftet. Alles ideale Voraussetzungen, um Proben zu nehmen, die die immunologische Bandbreite der Bevölkerung weitgehend abdecken, und die darin enthaltenen adulten Stammzellen umzuprogrammieren. Aus den iPS-Zellen würden die Forscher dann Vorläuferzel- len für spezialisierte Zellen herstellen – von der Haut- bis zur Herzmuskelzelle –, die sich Patienten mit entsprechenden Erkrankungen einpflanzen ließen. „Das würde sich alles in einem übersichtlichen Rahmen bewegen“, vermutet Schöler, „mit vielleicht 10000 Proben für die gesamte deutsche Bevölkerung.“ Ein derartiges System wäre finanzierbar, praktikabel und effizient. Doch bis es so weit ist, gehen noch viele Jahre ins Land. Zumindest die ersten Schritte des langen Weges sind die Max-Planck-Forscher bereits gegangen: Sie haben Stammzellen aus menschlichem Nabelschnurblut zu iPS-Zellen reprogrammiert – noch mit der Yamanaka-Methode. Jetzt soll das Gleiche mit dem Protein-Verfahren gelingen. „Daran“, sagt Schöler, „arbeiten wir mit Hochdruck.“ = + 0* # ; ! . ! $ ! 0-+ , ! * + 0-* ( + " %! * ! * # % . . ! * . $ " /. ) ! % /-5# ! * & 0* # ! - % . . ! * . $ " /( % $ ! -. /1! -6 ff! * /( % $ 0* # ! * 0* . ! 0! . /! 0. /0-2 % . . ! * . $ " / /$ ! ) /% ' * # ! * % ! 0-2 % . . ! * . $ " / 0* * " + -) /% ' ! $ * + (+ # ? % ! * , -/* ! - ! . % . . ! * . $ " /. & $ -! . 0- % ) + % ! -) ( % ) $ - ! 2 . 0. + -. $ 0* # 0* ! $ * %' ! - * . / ( /0* # ! * + -/-5/. /0 % ! * 0* ! -0" . , -+ 7 ( ! + GLOSSAR Induzierte pluripotente Stammzellen (iPS-Zellen) Stammzellen, die aus Körperzellen gewonnen wurden und sich in ebenso viele verschiedene Körperzellen differenzieren können wie embryonale Stammzellen. - $ ! - ! $ Ausdifferenzierte Zelle Zelle, die auf eine Aufgabe im Körper spezialisiert ist. . ! % * 4% # ! ! 0-+ , 5% . $ ! 4% * ) % / ! # 0/ $ /! /! * $ 2 0 $ . " + -. $ ! - Ausgabe Nr. 82 // 24. Jahrgang // 2009 " ! ! . /! ( ( 0* # 0* /! - ! ! . ! , -+ # $ # Themen: + * + * * ! * ( 0) ! * 40) + ( ? ! /$ ? ( ! * . $ ! * + $ * ! ; ! 0! : ( ! % * ! 9! ( " ! - % ) # -+ D! * : ) , " # ! # ! * : -! . /! # -? , / ! . . ! -! ! ! * . ! % * # 0* # ! * " E- $ ) ! //! -( % * # ! Außerdem im Heft: 8-E* ! > 0' 0* " / A * ' % ' -+ ( # ! * < ) 2 ! ( / ) , 0. B % -' ! * " ! ( @ /0 % ! * " E$ -! - % + /! $ * + ( + # % ! 0* . # 4% * + ! - ! * " + - ! -* 0* /! - 3 " E- < ) 2 ! ( //! $ * % ' 0* 1% ! ( ! . ) ! $ -C Adulte Stammzellen Stammzellen, die auch in zahlreichen Geweben Erwachsener vorhanden sind. Sie sind nicht pluripotent, lassen sich aber teilweise in iPS-Zellen verwandeln. Nabelschnurblut-Stammzellen Die Blutbildung wandert am Ende der Schwangerschaft von der Leber und Milz ins Knochenmark, und zwar durch das Blut des Kindes. Daher finden sich bei der Geburt auch im Nabelschnurblut besonders vermehrungsfähige Stammzellen, die sich auch in besonders viele Körperzellen differenzieren können. $ %..! * . "/ $ ! %..! * . % ! 0* # !% & 0* # ! $ -! (. ! / ( 5 % $ / + * * * 0* ! % /- # 1 ! * ! * $ ! 2+ ( ( $ " /( % $ ! * ) ..! * . % 2 * ff! * /( % ! 6 ! 1 ! %# ! * * 0* , # ! * ( ..! - 9+ ) ! ! ! 2 ! -/ ! ! . * 0 % $ 0" ) ! ( ! ! - ! * " /( ! - 2 ! %* ! * % . / 0* / ! -* 80/ $ * * / 6 $ /! .