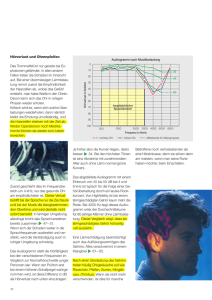
Auswirkungen von rezidivierenden nächtlichen
Werbung

Auswirkungen von rezidivierenden nächtlichen Sauerstoffentsättigungen ausgelöst durch das obstruktive Schlafapnoe-Syndrom auf die Distorsionsprodukte otoakustischer Emissionen Diplomarbeit an der Medizinischen Universität Graz Universitätsklinik für Hals-, Nasen- und Ohrenheilkunde, klinische Abteilung für Neurootologie A-8036 Graz, Österreich vorgelegt von Bettina Pletschko (Matr.Nr.: 0311996) zur Erlangung des akademischen Grades Doktorin der gesamten Heilkunde (Dr. med. univ.) Dezember 2010 Begutachter: Prof. Dr. Christian Walch Ass. Dr. Thorsten Ropposch Kurzfassung Das obstruktive Schlafapnoe-Syndrom (OSAS) gehört zu den schlafbezogenen Atmungsstörungen und ist durch wiederholte Obstruktion der oberen Luftwege mit erhöhter Atemanstrengung, intermittierender Hypoxie sowie gestörtem Schlaf gekennzeichnet. Bei langfristig bestehendem OSAS besteht durch rezidivierende nächtliche Sauerstoffentsättigungen ein erhöhtes Risiko für das Auftreten kardiovaskulärer Erkrankungen wie Insult, KHK, arterielle Hypertonie oder Herzrhythmusstörungen. Die genauen Entstehungsmechanismen funktioneller Hörstörungen wie plötzlicher Hörsturz, Tinnitus oder Presbyakusis sind bis heute nicht geklärt. Es gibt jedoch diesbezüglich zahlreiche Theorien, wie die der vaskulären, der viralen oder der autoimmunen Genese. Der Einfluss von Hypoxie auf das Innenohr könnte in der Entstehung von funktionellen Hörstörungen ein bedeutender Faktor sein. Mit Hilfe der Messung von Distorsionsprodukten otoakustischer Emissionen (DPOAE) kann man Innenohrschäden, im Speziellen Schädigungen der äußeren Haarzellen, frequenzselektiv erfassen. Die äußeren Haarzellen sind für die nichtlineare Schallverarbeitung in der Kochlea unabdingbar. Ziel dieser klinischen Studie ist es, herauszufinden ob und inwiefern sich die DPOAE - und somit auch die Funktion der äußeren Haarzellen - bei OSAS-Patienten nach Phasen rezidivierender Sauerstoffentsättigungen verändern. Im Tiermodell konnte bereits eine temporäre Schädigung der äußeren Haarzellen unter hypoxischen Bedingungen nachgewiesen werden. Bei 39 Patienten (davon 26 mit einem Schlafapnoe-Syndrom), die sich planmäßig einer Polysomnographie auf der Abteilung für Pulmologie am LKH Universitätsklinikum Graz unterzogen, wurden DPOAE-Ausgangswerte bei guter Sauerstoffsättigung tagsüber mit DPOAE-Werten nachts in den Frequenzen 1, 1.4, 2, 2.8, 4 und 6 kHz verglichen. Bei 6 kHz zeigte sich ein Absinken der mittleren DPOAE von -5,65 db bei den OSAS-Patienten. Bei 4 kHz war, im Vergleich zu NonOSAS-Probanden, ein um 3,66 db erniedrigter mittlerer DPOAE-Ausgangswert zu beobachten. Die Ergebnisse in diesen beiden Frequenzen wären durch eine Beeinträchtigung der Innenohrfunktion ausgelöst durch intermittierende hypoxische Verhältnisse aufgrund des Schlafapnoe-Syndroms zu erklären. Schlagwörter: OSAS - Hypoxie - DPOAE - funktionelle Hörstörungen Abstract Obstructive sleep apnoea syndrome (OSAS) is a sleep disorder characterized by repetitive episodes of upper airway obstruction accompanied by hypoxia and disturbed sleep. Long-term OSAS-patients have a greater risk to develop cardiovascular diseases such as stroke, coronary heart disease, arterial hypertension or cardiac arrhythmias because of the recurring blood oxygen-desaturations. The exact pathomechanisms of inner ear diseases such as sudden sensorineural hearing loss, tinnitus or presbyacusis still remain unknown. Among the numerous theories concerning their pathogenesis there are the vascular, the viral and the immunological theory. By measuring distortion products otoacoustic emissions (DPOAE) it is possible to detect inner ear damage, particularly the functional status of the outer hair cells, which are crucial in terms of amplifying the incoming sound. The presented study is supposed to detect possible changes in the DPOAE-levels in OSAS-patients as an attribute to the repetitive blood oxygen-desaturations. In animals a temporary decline in DPOAE-levels during hypoxia has already been observed. Measurements were performed in 39 patients (among them 26 with OSAS) who underwent polysomnography at the department of pulmology, university hospital Graz. DPOAE-baseline-levels in the daytime were compared to the levels by night at the frequencies 1, 1.4, 2, 2.8, 4 and 6 kHz. At 6 kHz mean DPOAE-levels decreased in OSAS-patients about -5,65 db. At 4 kHz average DPOAE-baseline-levels were 3,66 db less in OSAS-patients than in nonOSAS-patients. The present results can indeed be explained by an impairment of the inner ear function as an attribute to hypoxia during sleep apnoeas. keywords: OSAS - hypoxia - DPOAE - inner ear diseases Eidesstattliche Erklärung Ich versichere ehrenwörtlich, dass ich diese Arbeit selbständig verfasst habe, dass sämtliche Arbeiten von Anderen entsprechend gekennzeichnet und mit Quellenangaben versehen sind, und dass ich keine anderen als die angegebenen Quellen benutzt habe. ......................... Ort, Datum ............................ Unterschrift Aus Gründen der einfacheren Lesbarkeit und Verständlichkeit habe ich mich entschlossen, im gesamten Text das generische Maskulinum zu verwenden. Falls nicht explizit anders deklariert, sind mit dieser Schreibweise beide Geschlechter gleichermaßen gemeint. Inhaltsverzeichnis Abbildungsverzeichnis iii Tabellenverzeichnis v Abkürzungsverzeichnis vi Danksagung viii 1 Einleitung 1.1 Anatomische Grundlagen . . . . . . . . . . . . . . . . . . . . . . 1.1.1 Äußeres Ohr . . . . . . . . . . . . . . . . . . . . . . . . . . 1.1.2 Mittelohr . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.1.3 Innenohr . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.2 Physiologie des Ohres . . . . . . . . . . . . . . . . . . . . . . . . 1.2.1 Der Schall . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.2.2 Die Schallweiterleitung des menschlichen Ohres . . . . . . 1.2.3 Die Schalltransformation im Innenohr . . . . . . . . . . . . 1.2.4 Hörbahn . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.3 Otoakustische Emissionen . . . . . . . . . . . . . . . . . . . . . . 1.3.1 Distorsionsprodukte otoakustischer Emissionen (DPOAE) . 1.4 Schlafbezogene Atmungsstörungen . . . . . . . . . . . . . . . . . . 1.4.1 Auswirkungen des obstruktiven Schlafapnoe-Syndroms . . 1.4.2 Therapie . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.5 Entstehungstheorien zu funktionellen Hörstörungen . . . . . . . . 1.5.1 Vaskuläre Genese . . . . . . . . . . . . . . . . . . . . . . . 1.5.2 Hypoxie und oxidativer Stress . . . . . . . . . . . . . . . . 1.5.3 Virale Genese . . . . . . . . . . . . . . . . . . . . . . . . . 1.5.4 Autoimmune Genese . . . . . . . . . . . . . . . . . . . . . 1.6 Ziel der Studie . . . . . . . . . . . . . . . . . . . . . . . . . . . . i . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1 1 1 2 3 9 9 11 11 16 17 17 21 24 27 29 30 31 32 33 34 2 Material und Methoden 2.1 Patientenkollektiv . . . . . . 2.2 Untersuchungsablauf . . . . 2.2.1 Otoskopie . . . . . . 2.2.2 Audiometrie . . . . . 2.2.3 Tympanometrie . . . 2.2.4 1. DPOAE-Messung 2.2.5 Polysomnographie . . 2.2.6 2. DPOAE-Messung 2.3 Datenanalyse . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3 Ergebnisse 3.1 Gruppen . . . . . . . . . . . . . . 3.2 DPOAE-Messungen . . . . . . . . 3.2.1 Störgeräusche . . . . . . . 3.2.2 OSAS-Gruppe . . . . . . . 3.2.3 NOSAS-Gruppe . . . . . . 3.2.4 Vergleich beider Gruppen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 35 35 36 36 37 38 39 39 41 41 . . . . . . 42 42 44 45 47 48 49 4 Diskussion 51 Literaturverzeichnis 54 ii Abbildungsverzeichnis 1.1 1.2 Mittel- und Innenohr, schematisch (Klinke et al., 2005), (Seite 661) . . Querschnitt durch die Kochlea, schematisch (Klinke et al., 2005), (Seite 662) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.3 Querschnitt durch das Corti-Organ, schematisch (Klinke et al., 2005), (Seite 663) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.4 Ton (Klinke et al., 2005), (Seite 658) . . . . . . . . . . . . . . . . . . . 1.5 Klang (Klinke et al., 2005), (Seite 658) . . . . . . . . . . . . . . . . . . 1.6 Geräusch (Klinke et al., 2005), (Seite 658) . . . . . . . . . . . . . . . . 1.7 Wanderwelle (Klinke et al., 2005), (Seite 664) . . . . . . . . . . . . . . 1.8 Stereovilli und tip links einer äußeren Haarzelle, rasterelektronenmikroskopische Aufnahme (Klinke et al., 2005), (Seite 663) . . . . . . . . . . 1.9 Schematische Abbildung der Funktionsweise einer DPOAE Sonde (Janssen, 2005), (Seite 125) . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.10 Der Einfluss von ROS auf die Haarzellen unter hypoxischen Bedingungen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6 7 10 10 10 12 14 18 32 2.1 2.2 2.3 2.4 Audiogramm . . . . . . . . . . GSI 33 Middle Ear Analyzer . . DPOAE-Sonde . . . . . . . . . Beispiel einer DPOAE-Messung . . . . . . . . . . . . . . . . . . . . 37 38 39 41 3.1 3.2 3.3 3.4 3.5 3.6 3.7 3.8 3.9 3.10 Geschlechterverteilung . . . . . . . . . . . . . . . . . . . . . . . Altersverteilung . . . . . . . . . . . . . . . . . . . . . . . . . . . Apnoe-Hypopnoe-Index in der OSAS-Gruppe . . . . . . . . . . Geringste Sauerstoffsättigung in der OSAS-Gruppe . . . . . . . Verwertbare Ohren beider Gruppen in Prozent . . . . . . . . . . DPOAE-Messungen der OSAS-Gruppe . . . . . . . . . . . . . . DPOAE-Messungen der NOSAS-Gruppe . . . . . . . . . . . . . Störgeräusche während den Messungen . . . . . . . . . . . . . . Vergleich der Tag- und Nacht-Messungen in der OSAS-Gruppe . Vergleich der Tag- und Nacht-Messungen in der NOSAS-Gruppe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42 43 43 44 44 45 45 46 47 48 iii . . . . 5 3.11 Vergleich der Ausgangswerte beider Gruppen . . . . . . . . . . . . . . . 3.12 Vergleich der Nacht-Werte beider Gruppen . . . . . . . . . . . . . . . . 3.13 Vergleich aller DPOAE-Mittelwerte . . . . . . . . . . . . . . . . . . . . iv 49 50 50 Tabellenverzeichnis 1.1 Schlafbezogene Atmungsstörungen gemäß ICSD-2 (American Academy of Sleep Medicine, 2005) . . . . . . . . . . . . . . . . . . . . . . . . . . . . v 21 Abkürzungsverzeichnis A. /Aa. AASM AHI AT BGA BMI cGMP CMV CPAP CRP db DPOAE EEG EKG EMG EOAE EOG f HHV HL Hz/ kHz ICSD IgM K KHK L M. Mb. MS mV N. Na Arteria/ Arteriae American Academy of Sleep Medicine Apnoe-Hypopnoe-Index Angiotensin Blutgasanalyse Body Mass Index zyklisches Guanosinmonophosphat Zytomegalievirus continuous positive airway pressure C-reaktives Protein Dezibel Distorsionsprodukte Otoakustischer Emissionen Elektroenzephalogramm Elektrokardiogramm Elektromyogramm Evozierte Otoakustische Emissionen Elektrookulogramm Frequenz humane Herpesviren hearing level (Hörpegel) Hertz/ Kilohertz Internationale Klassifikation von Schlafstörungen Immunglobulin M Kalium Koronare Herzkrankheit Schallpegel Musculus Morbus Multiple Sklerose Millivolt Nervus Natrium vi NO N-OSAS OAE OSAS Pa REM RERAs ROS SLE SNR SOAE SPL TEOAE TNF-α Stickstoffmonoxid NonOSAS Otoakustische Emissionen Obstruktives Schlafapnoe-Syndrom Pascal Rapid Eye Movement Respiratory Effort Related Arousals reaktive Sauerstoffspezies Systemischer Lupus erythematodes sound to noise ratio Spontan emittierte Otoakustische Emissionen sound pressure level Transitorisch evozierte Otoakustische Emissionen Tumornekrosefaktor α vii Danksagung Herzlichen Dank an Prof. Dr. Christian Walch und Ass. Dr. Thorsten Ropposch für die Bereitstellung des Themas und die fachliche Unterstützung, die maßgeblich zur Entstehung dieser Arbeit beigetragen hat. Vor allem möchte ich meiner Familie, insbesondere meiner Mutter Barbara, für die bedingungslose Unterstützung während meiner gesamten Studienzeit danken. Des Weiteren danke ich herzlichst meinem Lebensgefährten Härry, der immer hinter mir stand und nicht zuletzt die Durchführung der Studienmessungen nachts ermöglicht hat, sowie seiner Familie. Ein großes Dankeschön auch an Olivia für die umfassende technische Unterstützung. Danke an all meine Freunde, die mich während meiner Studienzeit begleiteten und mit denen ich viele kostbare Augenblicke erleben durfte. viii 1 Einleitung 1.1 Anatomische Grundlagen 1.1.1 Äußeres Ohr Das äußere Ohr (Auris externa) setzt sich aus der Ohrmuschel (Auricula), dem äußeren Gehörgang (Meatus acusticus externus) und dem Trommelfell (Membrana tympanica) zusammen. (Drenckhahn, 2004) Der äußere Gehörgang erstreckt sich von der äußeren Gehörgangsöffnung bis zum Trommelfell und setzt sich aus einem äußeren knorpeligen Anteil und einem inneren knöchernen Anteil zusammen. An deren Übergang findet sich eine Enge (Isthmus). (Boenninghaus & Lenarz, 2007) Das Trommelfell ist eine sehnige, perlgraue, ovale Membran zwischen äußerem Gehörgang und Paukenhöhle, die in der Mitte trichterförmig zum Nabel (Umbo membranae tympanicae) eingezogen ist. Hinter dem Trommelfell befinden sich die Gehörknöchelchen des Mittelohres. Der Umbo entspricht dem unteren Ende des Hammergriffes, der nach vorne oben weiter verläuft und durch das Trommelfell als Stria mallearis durchschimmert. Am oberen Ende der Stria mallearis springt der kurze Hammerfortsatz nach außen vor. Von hier aus ziehen 2 Falten (vorderer und hinterere Grenzstrang) nach vorne bzw. hinten oben und schließen zwischen sich den schlaffen Teil des Trommelfells (Pars flaccida) ein. Der gespannte Teil des Trommelfells (Pars tensa), der im Gegensatz zur Pars flaccida zusätzlich zu einer Epithelschicht und einer Schleimhautschicht auch aus einer Bindegewebsschicht besteht, wird in 4 Quadranten eingeteilt. Das Trommelfell ist mit seinem verdickten Rand aus Faserknorpel (Anulus fibrocartilagineus) in einen knöchernen Rahmen (Sulcus tympanicus) im Paukenteil des Schläfenbeins eingelassen. Dieser Ring ist im Bereich des schlaffen Anteils unterbrochen. (Fanghaenel & Waldeyer, 2003) 1 1.1.2 Mittelohr Das Mittelohr (Auris media) ist ein mit Luft gefüllter und von Schleimhaut ausgekleideter Raum und besteht aus der Paukenhöhle mit den Gehörknöchelchen, 2 quergestreiften Muskeln, der Ohrtrompete und den Paukennebenhöhlen. (Drenckhahn, 2004) 1.1.2.1 Paukenhöhle (Cavitas tympani) Die spaltförmige Paukenhöhle besteht aus 3 ineinander übergehenden Stockwerken (Epi-, Meso- und Hypotympanon) und hat folgende Begrenzungen: • Das Dach wird durch eine dünne Knochenplatte (Tegmen tympani) gebildet und grenzt die Paukenhöhle zur mittleren Schädelgrube und zum Schläfenlappen hin ab. • Der ebenfalls aus einer dünnen Knochenplatte bestehende Boden trennt das Hypotympanon von der Fossa jugularis und dem Bulbus superior venae jugularis internae. • Die vordere Wand ist dem Canalis caroticus benachbart. Hier befindet sich auch die Tubenöffnung und der M. tensor tympani tritt aus. • Die hintere Wand bildet die Grenze zum Warzenfortsatz (Processus mastoideus). Hier findet sich der Zugang (Aditus) zum Antrum mastoideum und der Austritt der Sehne des M. stapedius. • Die laterale Wand besteht aus dem Trommelfell und dem darüberliegenden Schuppenteil des Felsenbeines. • An die mediale Wand der Paukenhöhle schließt das Innenohr an. Sie beherbergt eine Erhebung, verursacht durch die basale Schneckenwindung (Promontorium), das ovale und inferior das runde Fenster, den Wulst der knöchernen Wand des Fazialiskanals, darüber den Wulst der knöchernen Wand des lateralen Bogenganges, den Kanal des M. tensor tympani sowie den knöchernen Teil der Ohrtrompete. (Fanghaenel & Waldeyer, 2003) 1.1.2.2 Gehörknöchelchen (Ossicula auditoria) Hammer (Malleus), Amboss (Incus) und Steigbügel (Stapes) bilden zusammen die bewegliche Gehörknöchelchenkette und stehen gelenkig miteinander in Verbindung. Der Hammer ist über seinen Griff fest mit dem Trommelfell verbunden, während der 2 Steigbügel als letztes Glied der Gehörknöchelchenkette mit seiner Fußplatte durch das Steigbügelband in das ovale Fenster eingelassen ist. (Fanghaenel & Waldeyer, 2003; Boenninghaus & Lenarz, 2007) 1.1.2.3 Ohrtrompete (Tuba auditiva) Die 3,5 bis 4 cm lange Ohrtrompete stellt die Verbindung des Mittelohrs mit dem Nasopharynx dar und besteht aus einem vorderen medialen knorpeligen Teil und einem hinteren, im Felsenbein liegenden lateralen knöchernen Teil. Das Lumen des knöchernen Anteils ist rundlich und offen, das des knorpeligen Teils spaltförmig und die Wände liegen hier aneinander. Beim Schluckakt wird die Tube geöffnet und es kommt zum Druckausgleich. (Boenninghaus & Lenarz, 2007) 1.1.2.4 Paukennebenhöhlen Die pneumatisierten cellulae mastoideae (Warzenfortsatzzellen) sind die wichtigsten Nebenhöhlen der Paukenhöhle und sind mit dieser an ihrer oberen Hinterwand verbunden. 1.1.2.5 Muskeln des Mittelohres 1. Der M. stapedius setzt am Steigbügelköpfchen an und reagiert auf zu starke Steigbügelausschläge mit einer Dämpfung (Stapediusreflex). 2. Der M. tensor tympani setzt am Hammergriff an, zieht diesen nach innen und versteift die Gehörknöchelchenkette. (Drenckhahn, 2004) 1.1.3 Innenohr Das Innenohr (Auris interna) ist im Felsenbein eingebettet und von einem knöchernen Labyrinth umgeben. Neben dem auditorischen Teil (der Gehörschnecke oder Kochlea) besteht es auch aus dem Gleichgewichtsorgan (Vestibularapparat), welches sich aus 2 Maculaorganen (Utriculus und Sacculus) und 3 Bogengangsorganen zusammensetzt und im Wesentlichen die Orientierung im Raum ermöglicht. (Speckmann, 2008) Das häutige mit Endolymphe gefüllte Labyrinth beherbergt die spezifischen Sinnesapparate. Um das häutige Labyrinth schließt sich das knöcherne Labyrinth. Dazwischen befindet sich der ebenfalls mit Flüssigkeit gefüllte Perilymphraum. 3 1.1.3.1 Labyrinthus osseus Das knöcherne Labyrinth besteht aus dem Vorhof (Vestibulum), der Kochlea und den Bogengängen (Canales semicirculares). Während die Kochlea das Cortiorgan enthält, ist im Vestibulum und in den Bogengängen das Gleichgewichtsorgan enthalten. Der Vorhof umgibt Utriculus und Sacculus. In ihn mündet vorne der basale Abschnitt der Schnecke und hinten die Bogengänge sowie der Vorhofskanal, der den Ductus endolymphaticus enthält. An der lateralen Wand des Vestibulums befindet sich das ovale Fenster, welches mit der Stapesfußplatte die Verbindung zum Mittelohr darstellt. Die knöcherne Schnecke besitzt 2 1 /2 Windungen. Ihre Basis ist zum inneren Gehörgang gerichtet, während die Spitze (Cupula cochleae) nach vorne, lateral unten zeigt. Der Schneckenkanal beginnt im Vorhof und windet sich um seine Achse, die Schneckenspindel (Modiolus). (Drenckhahn, 2004) Um den Modiolus läuft eine Knochenlamelle (Lamina spiralis ossea), die zusammen mit der an ihrem Rand befestigten häutigen Lamina spiralis membranacea (Basilarmembran) sowie dem darauf liegenden häutigen Ductus cochlearis (Scala media oder mittlere Treppe) die Schneckenwindung in 2 mit Perilymphe gefüllte Treppen teilt. Die Scala vestibuli (obere Treppe) mündet in den Vorhof und geht an der Schneckenspitze am Helikotrema in die Scala tympani (untere Treppe) über, welche am runden Fenster an die Paukenhöhle grenzt. Eine zweite Knochenlamelle (Septum cochleare) zieht vom Modiolus zur Außenwand und stellt damit die Grenze einer Windung zur nächsten dar. Modiolus und Lamina spiralis ossea enthalten feine Kanäle für den Durchtritt des N. cochlearis und sein Ganglion spirale. An der Basis ist der Knochen siebartig perforiert, damit die Fasern des Ganglion spirale in den inneren Gehörgang eintreten können. Die Scala tympani ist nahe dem runden Fenster über den Ductus perilymphaticus (Aquaeductus cochleae) mit dem Subarachnoidalraum verbunden. (Fanghaenel & Waldeyer, 2003) 4 Abbildung 1.1: Mittel- und Innenohr, schematisch (Klinke et al., 2005), (Seite 661) 1.1.3.2 Labyrinthus membranaceus Das im knöchernen Labyrinth gelegene häutige Labyrinth besteht aus dem Labyrinthus cochlearis und dem Labyrinthus vestibularis. Die häutige Schnecke (Ductus cochlearis) ist ein 3 cm langer, im Querschnitt dreieckiger, an beiden Enden blind endender, mit Endolymphe gefüllter Gang. Dieser kommuniziert über den Ductus reuniens mit dem Sacculus. (Fanghaenel & Waldeyer, 2003) Der Gang hat 3 Wandabschnitte: 1. Der äußere Wandabschnitt liegt der knöchernen Schnecke breitbasig an und besteht in der äußeren Schicht aus dem Ligamentum spirale, welches mit dem Periost verwachsen ist, und innen aus der Stria vascularis (Gefäßstreifen), der Prominentia spiralis und dem Sulcus spiralis externus. 2. Der 2-5 μm dünne vestibuläre Wandabschnitt (Reissner-Membran) erstreckt sich von der Basis der Lamina spiralis ossea zur knöchernen Schnecke und strahlt dort in das Ligamentum spirale ein. 3. Der tympanale Wandabschnitt besteht aus den tragenden Strukturen Lamina 5 spiralis ossea und Membrana basilaris. In dem Winkel, der sich zwischen ReissnerMembran und Lamina spiralis ossea bildet, wölbt sich der bindegewebige Limbus spiralis in den Schneckengang vor, welcher rinnenförmig ausgehöhlt ist (Sulcus spiralis internus oder Canalis spiralis). Von der in den Ductus cochlearis vorspringenden Kante des Limbus (Labium limbi verstibulare) geht die Membrana tectoria (Deckmembran) aus, die sich über das Organum spirale ausdehnt und es bedeckt. (Drenckhahn, 2004) Abbildung 1.2: Querschnitt durch die Kochlea, schematisch (Klinke et al., 2005), (Seite 662) Die Scala vestibuli und Scala tympani enthalten Perilymphe (grün), die Scala media ist mit Endolymphe (rot) gefüllt. Organum spirale (Corti-Organ) Das Corti-Organ liegt der Basilarmembran auf und befindet sich zwischen Sulcus spiralis internus und externus. Es besteht aus Sinneszellen (Haarzellen), die von Stützzellen im Epithel gehalten werden. Die Kopfabschnitte der Stützzellen sind mit den Haarzellen zur mosaikartigen Retikularmembran verbunden. • Zu den Stützzellen zählen Pfeilerzellen und Phalangenzellen. Die inneren Pfeilerzellen bilden mit den äußeren Pfeilerzellen die Begrenzung des mit Perilymphe gefüllten inneren Tunnels (Corti-Tunnel). Sie bestimmen und stabilisieren die 6 Höhe des Sinnesepithels. Es gibt 3 Reihen von äußeren Phalangenzellen (DeitersZellen) und eine Reihe innerer Phalangenzellen. In einer schüsselförmigen Vertiefung in der Mitte dieser Zellen sind die Basalabschnitte der Haarzellen mit ihren Synapsen eingelassen. In Richtung Ligamentum spirale gehen die Stützzellen in Grenzzellen (Hensen-Zellen und Claudius-Zellen) über. (Drenckhahn, 2004) • Ein menschliches Ohr besitzt etwa 3500 innere und 15000 äußere Haarzellen. Medial der inneren Pfeilerzellen befindet sich eine Reihe von Stützzellen umhüllter innerer Haarzellen. (Fanghaenel & Waldeyer, 2003) Innere Haarzellen sind birnenförmig und jede besitzt an ihrer apikalen Fläche durchschnittlich 75 Stereozilien, die jeweils aus einem Bündel von 200-800 Actinfilamenten bestehen. An der Zellbasis finden sich afferente Synapsen des Ganglion cochleare, welche ihrerseits widerrum von efferenten Synapsen kontaktiert werden. Die säulenförmigen, ebenfalls mit Stereozilien ausgestatteten äußeren Haarzellen bilden zwischen innerem und äußerem Tunnel (Nuel-Raum) 3 Reihen. Sie werden nicht von Stützzellen eingehüllt, um frei mit der Corti-Lymphe (Perilymphe) des Nuel-Raums kommunizieren zu können. An der Zellbasis finden sich ein paar afferente und auffällig viele efferente Synapsen. Die langen Stereozilien der äußeren Haarzellen haften an der Tektorialmembran. (Drenckhahn, 2004) Abbildung 1.3: Querschnitt durch das Corti-Organ, schematisch (Klinke et al., 2005), (Seite 663) Perilymphe und Endolymphe Die Zusammensetzung der Perilymphe entspricht weitgehend der der normalen Extrazellulärflüssigkeit: K+ = 3mmol, Na+ = 145mmol. (Speckmann, 2008) Sie entstammt 7 zum Teil dem Liquor cerebrospinalis, wird aber auch aus dem Blut filtriert. (Boenninghaus & Lenarz, 2007) Die Endolymphe wird hingegen von der Stria vascularis produziert und ist äußerst K+ reich (K+ = 150mmol, Na+ = 1 mmol). Um den Elektrolytgradienten zwischen Periund Endolymphe aufrechtzuerhalten werden die Epithelien um die Scala media durch Tight Junctions abgedichtet. (Speckmann, 2008) 1.1.3.3 Blutversorgung des Innenohrs Das Innenohr wird von der A. labyrinthi (A. auditiva interna) versorgt, die normalerweise von der A. inf. ant. cerebelli (AICA) oder in einigen Fällen auch direkt von der A. basilaris abzweigt. Nach dem Durchtritt durch den inneren Gehörgang teilt sie sich in die A. cochlearis communis und in die A. vestibularis anterior. Die A. cochlearis communis wiederum zweigt sich in die A. cochlearis propria (A. spiralis modioli) und in die A. vestibulocochlearis auf, von denen letztere die A. vestibularis posterior und den Ramus cochlearis abgibt. Der Vestibularapparat wird von den Aa. vestibulares anterior und posterior versorgt. Der Hauptanteil der Kochlea, nämlich die apikalen 3/4tel, wird von der A. cochlearis propria gespeist, während der Ramus cochlearis das basale Viertel ernährt. Der venöse Abfluss des Innenohres erfolgt über den Sinus petrosus inferior und den Sinus lateralis. (Axelsson, 1968; Mazzoni, 1990; Schuknecht, 1974) 8 1.2 Physiologie des Ohres 1.2.1 Der Schall Schall ist die Bezeichnung für Druckwellen, die sich in einem elastischen Medium ausbreiten. Diese Druckwellen entstehen, wenn Luftmoleküle von einem vibrierenden Körper in Schwingung versetzt werden. Da die Moleküle in der Ausbreitungsrichtung der Schallwelle schwingen, sind Schallwellen Longitudinalwellen. Das Medium (z.B. Luft) wird hierbei periodisch komprimiert und verdünnt. Eine Schallwelle ist durch folgende Variablen charakterisiert: 1. Die Frequenz wird in Schwingungen pro Sekunde [1Hz (Hertz) = 1 Schwingung / sec] angegeben. Hohe Frequenzen werden als hoher Ton und tiefe Frequenzen als tiefer Ton wahrgenommen. Das menschliche Ohr nimmt Frequenzen von 16 Hz bis 20 kHz wahr, während der Bereich darunter Infraschall und jener Bereich darüber Ultraschall genannt wird. 2. Die Amplitude wird als Schalldruck (Pa=Pascal) oder als Schalldruckpegel (db SPL=Dezibel sound pressure level) angegeben, wobei der Schalldruckpegel das logarithmische Maß für den Schalldruck ist. Mit ihr ändert sich die empfundene Lautstärke. Die menschliche Hörschwelle ist der niedrigste Schalldruck, der zu einer Schallempfindung (Hören) führt und ist frequenzabhängig. Die subjektiv empfundene Lautstärke ist nun aber kein direktes Abbild der physikalischen Größe Schalldruckpegel, sondern reflektiert die stark frequenzabhängige Empfindlichkeit des Gehörs. Deshalb wurde als Maß für die Lautstärkeempfindlichkeit der Lautstärkepegel mit der Einheit phon eingeführt. Hierbei wird allen gleich laut empfundenen Tönen der gleiche Lautstärkepegel zugeordnet. (Speckmann, 2008) 9 Schall kann in drei verschiedenen Formen auftreten: 1. Als Ton wird eine Sinusschwingung bezeichnet. (z.B. Signaltöne in technischen Geräten) Abbildung 1.4: Ton (Klinke et al., 2005), (Seite 658) 2. Ein Klang setzt sich aus mehreren Sinusschwingungen zusammen, einem Grundton und einem oder mehreren Obertönen, deren Frequenz ganzzahlige Vielfache des Grundtons sind. (z.B. ein auf einem Musikinstrument gespielter Ton) Abbildung 1.5: Klang (Klinke et al., 2005), (Seite 658) 3. Ein Geräusch ist Schall, der aus zahlreichen Frequenzen besteht, die keinen regelhaften Bezug zueinander aufweisen. (z.B. Konsonanten in der Sprache) Abbildung 1.6: Geräusch (Klinke et al., 2005), (Seite 658) 10 1.2.2 Die Schallweiterleitung des menschlichen Ohres 1.2.2.1 Äußeres Ohr Eintreffende Schallwellen werden durch Erhebungen und Vertiefungen von Ohrmuschel und -knorpel reflektiert und in Richtung äußerer Gehörgang geleitet. (Fanghaenel & Waldeyer, 2003) 1.2.2.2 Mittelohr Trifft der Schall auf das Trommelfell, wird dieses zusammen mit der Gehörknöchelchenkette in Vibration versetzt und der Schall wird so über das ovale Fenster in das Innenohr übertragen (=Luftleitung). Um nun zu verhindern, dass der überwiegende Teil der Schallenergie beim Übertritt vom leicht kompimierbaren Medium Luft in das schwer komprimierbare flüssigkeitsgefüllte Innenohr reflektiert wird, nimmt das Mittelohr eine Impedanzanpassung vor. (Impedanz=Schallwellenwiderstand) In erster Linie beruht diese Druckerhöhung der Schwingungen auf dem Flächenverhältnis zwischen Trommelfell (90mm2 ) und ovalem Fenster (3mm2 ), durch das der Druck am ovalen Fenster um den Faktor 30 gegenüber dem Trommelfell erhöht wird. Zusätzlich wir der Druck durch die Hebelwirkung der Gehörknöchelchen erhöht. Durch die reflexartige Kontraktion der beiden Mittelohrmuskeln M. tensor tympani und M. stapedius bei hohen Schalldruckpegeln wird die Effektivität der Schallübertragung zum Schutz des Innenohres verringert. Schall wird ebenso, wenn auch in geringerem Ausmaß, direkt über Schwingungen des Schädelknochens an das Innenohr weitergeleitet (=Knochenleitung). Mittels klinischen Tests der Luft- sowie der Knochenleitung kann man Schwerhörigkeiten unterschiedlicher Genese voneinander differenzieren. (Speckmann, 2008) Durch die Tuba Eustachii wird der Luftdruck im Mittelohr an den Umgebungsdruck angeglichen. Dieser Druckausgleich, der z.B. durch Schlucken erreicht wird, ist wichtig für die Schwingungsfähigkeit des Trommelfells und somit für das Hörvermögen und spielt beim Tauchen oder Fliegen eine besonders große Rolle. (Klinke et al., 2005) 1.2.3 Die Schalltransformation im Innenohr 1.2.3.1 Wanderwelle, Frequenzdispersion und Tonotopie Die Aufgabe der Kochlea besteht darin, mechanische Energie in elektrische umzuwandeln (mechanoelektrische Transduktion). (Boenninghaus & Lenarz, 2007) Nachdem der Schalldruck im Mittelohr verstärkt wurde, versetzt nun die Vibration 11 des Stapes am ovalen Fenster die praktisch inkompressible Perilymphe der Scala vestibuli und der Scala tympani in Bewegung. So wird ein Wechseldruck erzeugt, indem das ovale und runde Fenster abwechselnd eingedrückt werden. Dies wiederum führt zu einer Schwingung der Basilarmembran mit dem aufliegenden Cortiorgan in Form einer Wanderwelle. Die Basilarmembran ist nun von der Basis der Kochlea bis zum Apex anders beschaffen. Während die Breite der Basilarmembran in Richtung Apex auf das 5-Fache zunimmt, nimmt gleichzeitig die Stärke und somit auch die Steifigkeit ab. Dies führt dazu, dass die verschiedenen Abschnitte nicht in gleichem Maße ausgelenkt werden, sondern die Trennwand in Form einer Wanderwelle, bei der sich die Schwingungsmaxima von basal nach apikal bewegen, schwingt. Der Ort der höchsten Schwingungsamplitude ist frequenzspezifisch: Hohe Frequenzen haben ihr Maximum nahe der Basis und je tiefer die Frequenzen werden, desto weiter verlagert sich die stärkste Auslenkung der Trennwand nach apikal. Diese sogenannte Frequenzdispersion sorgt dafür, dass jeder Stelle der Basilarmembran und ihren zugehörigen Sinneszellen eine spezifische Frequenz zugeordnet ist. Dieses Prinzip nennt man Tonotopie oder Ortsprinzip. (Speckmann, 2008) Abbildung 1.7: Wanderwelle (Klinke et al., 2005), (Seite 664) 1.2.3.2 Mechanoelektrische Transduktion durch die Haarzellen Durch die Basilarmembranschwingung werden die Stereozilienbündel der Haarzellen abwechselnd in Richtung der längsten und dann der kürzesten Stereozilien ausgelenkt. 12 Diese Scherbewegungen der Haarbündel lösen ein Rezeptorpotenzial in den inneren und äußeren Haarzellen aus. Jede Spitze eines Stereoziliums ist nun mit dem nächstgrößeren Stereozilium über einen elastischen Faden (tip link) miteinander verbunden, welcher wiederum wahrscheinlich direkt mit dem Transduktionskanal am distalen Ende der Stereozilien kommuniziert. Wenn die Stereozilienbündel in Richtung der längsten Stereozilien ausgelenkt werden (exzitatorische Auslenkungsrichtung), werden die tip links gedehnt und die Transduktionskanäle geöffnet. Dies hat einen Einstrom von K+ aus der Endolymphe und somit eine Depolarisation der Zelle zur Folge. Die Auslenkung in die entgegengesetzte Richtung (inhibitorische Auslenkungsrichtung) entdehnt die tip links und die Transduktionskanäle werden geschlossen. Die Haarzelle wird hyperpolarisiert. Während die apikale Membran der Haarzellen in die sehr K+ -reiche Endolymphe der Scala media ragt, ist die basolaterale Membran von Na+ -reicher Perilymphe umgeben. Der depolarisierende K+ -Einstrom an der apikalen Membran wird nun ausschließlich von elektrischem Potenzial angetrieben, einerseits durch das positive elektrische Potenzial der Scala media (+80 bis +100 mV) gegenüber der übrigen Scalae (endocochleäres Potenzial), welches mittels Ionenpumpen in der Stria vascularis aufrecht erhalten wird, und andererseits durch das Membranpotenzial der Haarzelle gegenüber der Scala tympani (-50mV bis -70 mV). Durch die Summe der beiden ergibt sich ein Potenzialgefälle für K+ von -130 bis -150mV. Das so apikal in die Haarzelle einströmende K+ verlässt diese dann durch K+ -Kanäle an der basolateralen Membran. (Boenninghaus & Lenarz, 2007; Speckmann, 2008) 13 Abbildung 1.8: Stereovilli und tip links einer äußeren Haarzelle, rasterelektronenmikroskopische Aufnahme (Klinke et al., 2005), (Seite 663) 1.2.3.3 Der kochleäre Verstärker Der Dynamikbereich der Kochleamechanik umfasst im Gegensatz zu jenem des Trommelfells (130 db) nur 60 db. Würde der gesamte Dynamikbereich des Schalls linear in der Kochlea abgebildet werden, würden die kochleären Strukturen zerstört werden. (Janssen, 2005) Um dies zu verhindern werden die Schwingungseigenschaften der Basilarmembran durch einen mechanischen Verstärkungsprozess in der Kochlea im Sinne einer Dynamikkompression optimiert. Dabei bilden die äußeren Haarzellen den kochleären Verstärker, indem sich bei Elektrostimulation die Länge ihres Zellkörpers durch ihr Aktinfilamentskelett mit ihrem Membranpotenzial ändert: Depolarisation führt zur Kontraktion und Hyperpolarisation zur Elongation (=Elektromotilität). Auf diese Weise fließt zusätzliche Energie in die Schwingung der Basilarmembran ein und eine lokale Verstärkung ist die Folge. Bei normaler Kochleafunktion verstärken nun die äußeren Haarzellen kleine Schallpegel durch eine gesteigerte Basilarmembranauslenkung, während sie bei hohen Schallpegeln ihre Verstärkerfunktion verlieren. (Speckmann, 2008) Verglichen mit einer linearen passiven Kochlea verleiht das Prinzip des kochleären Verstärkers dem Gehör wesentlich mehr Sensitivität und Trennschärfe. (Boenninghaus & Lenarz, 2007; Janssen, 2005; Franklin et al., 1992; Kim, 1986) So wird den inneren Haarzellen ermöglicht, auch bei sehr schwachen akustischen Reizen sensorisch wirksam zu werden und leise Töne/ Geräusche werden überhaupt erst hörbar. (=niedrige 14 Hörschwelle). Eine Hemmung der kochleären Verstärkung durch die Aktivierung von efferenten Nervenfasern schützt die Kochlea vor akustischer Überstimulation. (Speckmann, 2008) 1.2.3.4 Funktion der inneren Haarzellen Die inneren Haarzellen sind für die Übermittlung der Sinnesinformationen zuständig. (Boenninghaus & Lenarz, 2007) Jede innere Haarzelle wird von 10-20 primären auditorischen Neuronen innerviert, von denen jede Kochlea insgesamt ungefähr 30.000 besitzt. Die Zellkörper dieser Neurone bilden das Ganglion spirale in der Kochlea und deren Axone formieren sich zum N. cochlearis, welcher die auditorische Information dem Nucleus cochlearis übermittelt. Die depolarisierende Phase des Rezeptorpotenzials löst an der afferenten Synapse der inneren Haarzelle die Transmitterfreisetzung (Glutamat) aus. Dies geschieht über die Öffnung spannungsgesteuerter Calcium-Kanäle. Das freigesetzte Glutamat bindet an postsynaptische Glutamatrezeptoren, deren Öffnung schnelle exzitatorische postsynaptische Potenziale im auditorischen Neuron generiert, welche schließlich Aktionspotentiale auslösen. (Speckmann, 2008) 1.2.3.5 Prinzipien der Schallcodierung im auditorischen Nerv Die Schallamplitude wird im Hörnerv durch die Aktionspotenzialfrequenz codiert. Je größer der Schalldruckpegel ist, desto höher wird die Frequenz, bis sie bei maximal 100 Hz sättigt. Die Aktionspotentialfrequenz eines einzelnen Neurons kann deshalb jedoch nur über einen Bereich von etwa 50 db variiert werden. Um den gesamten dynamischen Bereich von 120 db abzudecken, erreichen jede Haarzelle Neuronen unterschiedlicher Erregungsschwelle, sodass bei steigendem Schalldruckpegel zunehmend Neurone mit höherer Erregungsschwelle rekrutiert werden. Die Schallfrequenz wird mittels 2 Prinzipien analysiert: 1. Ortscodierung: Die unterschiedlichen Nervenfasern repräsentieren jeweils spezifische Frequenzen (Prinzip der Tonotopie). 2. Periodizitätsanalyse: Das zeitliche Muster der Aktionspotentiale steht in fester Beziehung zur Phase des Rezeptorpotenzials und somit auch zur Schallschwingung. Diese sogenannte Phasenkoppelung tritt bei Frequenzen bis zu 5 kHz auf. Durch sie wird auch das räumliche Hören ermöglicht, da hierzu die Laufzeitunterschiede des Schalls zu den beiden Ohren analysiert werden. (Speckmann, 2008) 15 1.2.4 Hörbahn Zur Hörbahn zählen alle Strukturen des Zentralnervensystems, die an der Weiterleitung und Verarbeitung des Reizes bis hin zur bewussten Wahrnehmung (Hören) beteiligt sind. 1.2.4.1 Afferentes System Das erste Neuron bilden die bipolaren Ganglienzellen des Ganglion spirale cochleae, deren periphere Fortsätze bis zu den Haarzellen reichen, während sie zentral als N. cochlearis im Kleinhirnbrückenwinkel in den Hirnstamm eintreten und im dorsalen und ventralen Cochleariskern enden. Während die Fasern des zweiten Neurons vom dorsalen Kern zum Colliculus inferior der anderen Seite kreuzen, ziehen die vom ventralen Kern hauptsächlich gekreuzt, ein Teil jedoch auch ungekreuzt zur oberen Olive. Von der oberen Olive laufen die Fasern des dritten Neurons im Lemniscus lateralis über den Colliculus inferior zum Corpus geniculatum mediale. Von dort zieht das vierte Neuron zum primären auditorischen Kortex im Schläfenlappen und zu der diesen umgebenden sekundären Hörrinde. 1.2.4.2 Efferentes System Die efferenten Bahnen dienen der Anpassung und Filterung akustischer Wahrnehmungen und ziehen von der kontralateralen Olive gekreuzt vorwiegend zu den äußeren Haarzellen und in geringer Anzahl von der ipsilateralen Olive ungekreuzt zu den von den inneren Haarzellen abgehenden afferenten Fasern. (Boenninghaus & Lenarz, 2007) 16 1.3 Otoakustische Emissionen Otoakustische Emissionen (OAE) beim Menschen wurden erstmals 1978 von Kemp nachgewiesen. (Kemp, 1978) Sie ermöglichen es, die individuelle Schallverarbeitung in der Kochlea (kochleärer Verstärker) und somit die Funktion der äußeren Haarzellen nicht-invasiv und objektiv zu detektieren. (Janssen, 2005) Generell kann man OAE nur bei annähernd Hörgesunden nachweisen und sie nehmen mit zunehmendem Alter ab. (Stenklev & Laukli, 2003; Mazelova et al., 2003) Es gibt verschiedene Arten von OAE: Spontan emittierte OAE (SOAE) kann man bei ca. 50% der Normalhörenden nachweisen; SOAE spielen für den klinischen Alltag eine untergeordnete Rolle. (Janssen, 2005; Kemp, 1981) Evozierte OAE (EOAE) hingegen werden als Antwort auf einen Stimulus von den äußeren Haarzellen durch mechanische Oszillation generiert. (Brownell, 1990; Kemp et al., 1990) In einer gesunden Kochlea wird der Stimulus vom Corti-Organ verarbeitet und ein Teil der Energie wird als OAE wieder in den äußeren Gehörgang ausgesandt. (Franklin et al., 1992) Die wichtigsten EOAE sind die transitorisch evozierten otoakustischen Emissionen (TEOAE) und die Distorsionsprodukte otoakustischer Emissionen (DPOAE). TEOAE werden durch Klicks oder Tonimpluse ausgelöst und repräsentieren die Impulsantworten der äußeren Haarzellen. (Kemp, 1979; Shera & Guinan Jr, 1999) 1.3.1 Distorsionsprodukte otoakustischer Emissionen (DPOAE) DPOAE entstehen, indem man 2 Sinustöne benachbarter Frequenz (f1 und f2) mittels einer im äußeren Gehörgang platzierten Sonde simultan appliziert. Durch die nichtlineare Schallverarbeitung in der Kochlea werden nun Töne in den äußeren Gehörgang emittiert, wo sie als Distorsionsprodukte otoakustischer Emissionen mit einem in der Sonde integrierten Mikrofon gemessen werden können. Auf diese Weise können Funktionsstörungen des Innenohrs frequenzselektiv erfasst werden. (Janssen, 2005; Wagner et al., 2008) 17 Abbildung 1.9: Schematische Abbildung der Funktionsweise einer DPOAE Sonde (Janssen, 2005), (Seite 125) Die in den äußeren Gehörgang eingebrachte Sonde besteht aus 2 Lautsprechern, welche simultan die beiden Primärtöne mit den Primärtonpegeln L1 und L2 aussenden, und einem rauscharmen Mikrofon zur Erfassung der DPOAE. Die Emissionen entstehen im Überlappungsbereich der beiden Wanderwellen auf der Basilarmembran, die durch die Primärtöne hervorgerufen werden. (Kummer et al., 1995; Martin et al., 1998) Die Frequenz der DPOAE setzt sich aus der Kombination der Primärtonfrequenzen f1 und f2 zusammen. Beim Menschen hat die Emission mit der Frequenz 2f1-f2 die größte Amplitude und findet daher in der Praxis die häufigste Anwendung. (Lonsbury-Martin & Martin, 1990; Lonsbury-Martin et al., 1990; Probst et al., 1991; Janssen, 2005) Ebenfalls ist ein Verhältnis der Frequenzen der Primärtöne von f2/f1=1,21 Voraussetzung für das Erreichen maximaler Emissionspegel. (Harris et al., 1989) Um die kompressive Schallverarbeitung in der Kochlea so gut es geht darstellen zu können, werden die DPOAE mit einem speziellen Reizparadigma ausgelöst. (Boege & Janssen, 2002) Diese sogenannte Pegelschere (L1 = 0,4 L2 + 39) gibt jene optimale Relation der Primärtonschallpegel L1 und L2 zueinander vor, die einen maximalen DPOAE-Pegel gewährleisten. (Kummer et al., 2000; Janssen et al., 1995a,b) So steigen gemäß des Prinzips des kochleären Verstärkers die DPOAE-Pegel bei niedrigen Primärtonpegeln stark an und bei hohen Primärtonpegeln findet sich nur ein geringer Anstieg. (Janssen, 2005) 18 DPOAE können auf zwei verschiedene Arten dargestellt werden: • DP-Gramm: Hierbei wird der Pegel der DPOAE bei verschiedenen f2-Frequenzen und konstanten Primärtonschallpegeln gemessen. Weil die Emission nahe f2 entsteht, wird der Schallpegel Ldp als Funktion der Frequenz f2 aufgetragen. • DPOAE-Wachstumsfunktion: Hier wird der Schallpegel Ldp als Funktion des Primärtonschallpegels L2 aufgetragen. Im Vergleich zum DP-Gramm werden die Primärtonschallpegel variiert, die Frequenz dagegen bleibt konstant. (Janssen, 2005) Ein Kriterium für die Verwendbarkeit der Messungen ist die Berücksichtigung des Signal-Rausch-Verhältnisses (=SNR oder Sound to Noise Ratio), welches definiert wird als Quotient von Nutzsignalleistung durch Rauschleistung. Um die Daten sinnvoll verwerten zu können, sollte das Signal-Rausch-Verhältniss größer sein als 6 db. (Kummer et al., 2000; Wagner et al., 2008) Deshalb ist es wichtig, während den Messungen alle Störgeräusche (z.B. Umgebungslärm, Atemgeräusche) möglichst zu minimieren. DPOAE sind im Frequenzbereich zwischen 500 Hz und 8 kHz messbar. (Janssen, 2005) Die Varianz der Messresultate von verschiedenen DPOAE Messungen bei einer Person ist im Bereich von 2-8kHz sehr gering (durchschnittlich etwa 2 db). Bei 1 kHz ist die Zuverlässigkeit/ Reproduzierbarkeit für die Konstanz der Messwerte bei Wiederholungsmessungen auch noch als gut einzustufen. Frequenzen <1 kHz haben auf Grund des mit niedrigeren Frequenzen immer mehr an Bedeutung gewinnenden Störschalls keine gute Reproduzierbarkeit. (Franklin et al., 1992) Um möglichst qualitativ wertvolle Messergebnisse zu erhalten, ist es weiters wichtig folgende Dinge zu beachten: • Minimierung der Umgebungsgeräusche • Verwenden eines rauscharmen Mikrofons • Korrektes Einsetzen der Sonde in den äußeren Gehörgang mit dem Ohrstöpsel der richtigen Größe (komplettes Abdichten nach außen) • Ausschluss von Pathologien des Trommelfells und des Mittelohres mit der Durchführung einer Otoskopie und einer Tympanometrie (Kemp et al., 1990; Wagner et al., 2008) 19 1.3.1.1 Vor-und Nachteile der DPOAE 1. Vorteile: Nachdem die Emissionen frequenzspezifisch sind, ist es möglich über verschiedene Abschnitte der Kochlea Informationen zu gewinnen. Mit DPOAEWachstumsfunktionen ist eine quantitative Erfassung einer Innenohrfunktionsstörung möglich. (Janssen, 2005) Die Testung dauert nur wenige Minuten und ist nicht-invasiv und objektiv. Diesen Vorteil kann man sich bei Patienten zu Nutze machen, die eine geringe Compliance aufweisen (z.B. Kinder). (Kemp et al., 1990) Weiters ist das individuelle Messergebnis eines einzelnen Probanden bei verschiedenen Messungen annähernd gleich. (hohe Reproduzierbarkeit) (Franklin et al., 1992; Kemp et al., 1986; Lonsbury-Martin et al., 1991) 2. Nachteile: Man kann von den gewonnenen Messwerten nicht exakt auf die Hörschwelle des Patienten rückschließen. Obwohl die Distorsionprodukte otoakustischer Emissonen mit der Hörschwelle korrelieren, (Gaskill & Brown, 1990; Martin et al., 1990; Nelson & Kimberley, 1992; Stover et al., 1996) kann die Messung die Audiometrie nicht ersetzen. Des weiteren kann man die Emissionen nur bei annähernd Hörgesunden nachweisen (bis zu einem Hörverlust von 50 db). (Janssen, 2005; Wagner et al., 2008) 1.3.1.2 Anwendung der DPOAE im klinischen Alltag • Durch das Hörscreening von Neugeborenen mittels DPOAE oder TEOAE kann man die Diagnose einer frühkindlichen Hörstörung früh genug stellen und rechtzeitig eine Therapie einleiten. (Janssen et al., 2005, 2003) Seit 2003 ist das Neugeborenen-Hörscreening in Österreich im Mutter-Kind-Pass verankert. (Weichbold et al., 2005) • Differentialdiagnostisch kann man mit OAE zwischen einem kochleären und einem retrokochleärem Hörverlust unterscheiden. Sind OAE trotz Hörverlust messbar, ist anzunehmen, dass sich die Funktionsstörung zentral der äußeren Haarzellen befindet. (Ohlms et al., 1991) • Mit OAE kann die Innenohrfunktion unter einer Therapie mit ototoxischen Medikamenten monitorisiert werden und bei Absinken der Werte noch vor subjektiv wahrgenommenem Hörverlust ein Therapiewechsel durchgeführt werden. (Brown et al., 1989; Stavroulaki et al., 2002) 20 1.4 Schlafbezogene Atmungsstörungen Zu den schlafbezogenen Atmungsstörungen gehören gemäß der Internationalen Klassifikation von Schlafstörungen (ICSD-2) der American Academy of Sleep Medicine (AASM) insgesamt 14 verschiedene Krankheitsbilder. (siehe Tabelle 1.1) Das folgende Kapitel beschäftigt sich hauptsächlich mit dem obstruktiven Schlafapnoe-Syndrom (OSAS) Erwachsener, da es für die durchgeführte Studie die größte Relevanz besitzt. Schlafbezogene Atmungsstörungen Zentrale Schlafapnoe-Syndrome Primäre zentrale Schlafapnoe Zentrale Schlafapnoe mit Cheyne Stokes Atemmuster Zentrale Schlafapnoe bei Höhenaufenthalt Zentrale Schlafapnoe bei internistischen/ neurologischen Erkrankungen (außer Cheyne Stokes Atmung) Zentrale Schlafapnoe bei Drogen- oder Medikamentengebrauch Primäre Schlafapnoe in der frühen Kindheit Obstruktive Schlafapnoe-Syndrome Obstruktive Schlafapnoe, Erwachsene Obstruktive Schlafapnoe, Pädiatrie Schlafbezogene Hypoventilation/ hypoxämische Syndrome Schlafbezogene nicht-obstruktive alveoläre Hypoventilation, idiopathisch Kongenitales zentrales alveoläres Hypoventilations-Syndrom Schlafbezogene Hypoventilation/ Hypoxämie bei internistischen/ neurologischen Erkrankungen Schlafbezogene Hypoventilation/ Hypoxämie bei Lungenparenchymoder Gefäß-Erkrankungen Schlafbezogene Hypoventilation/ Hypoxämie bei obstruktiver Atemwegserkrankung Schlafbezogene Hypoventilation/ Hypoxämie bei neuromuskulären Erkrankungen oder Thoraxerkrankungen Andere schlafbezogene Atmungsstörungen Schlafapnoe/ schlafbezogene Atmungsstörung, unklassifiziert Tabelle 1.1: Schlafbezogene Atmungsstörungen gemäß ICSD-2 (American Academy of Sleep Medicine, 2005) Das obstruktive Schlafapnoe-Syndrom ist gekennzeichnet durch rezidivierende Obstruktionen der oberen Atemwege während des Schlafes von definitionsgemäß mindestens 10 Sekunden Dauer, die komplett (Apnoe) oder inkomplett (Hypopnoe) sein können. Die Atmungsmuskulatur ist währenddessen jedoch weiterhin gänzlich aktiv. Durch den dadurch bedingten Abfall der Sauerstoffsättigung (Hypoxämie) und einem Anstieg 21 des Kohlenstoffdioxidgehaltes (Hyperkapnie) im Blut wird eine Weckreaktion (Arousal) im Körper hervorgerufen, die die Apnoe/Hypopnoe wieder beendet. Dies kann, muss aber nicht, vom Betroffenen als plötzliches Erwachen mit Erstickungsangst und nach Luft schnappen bemerkt werden. Der erhöhte Atemwegswiderstand während der Obstruktionen verursacht meist lautes Schnarchen oder Atemstillstände, die oft vom Bettpartner des Betroffenen wahrgenommen werden. Durch die unerholsame Schlaffragmentierung verspüren die Betroffenen tagsüber vermehrte Müdigkeit und eventuell ungewollte Einschlafepisoden (sogenannter Sekundenschlaf). (American Academy of Sleep Medicine, 2005) Um ein OSAS diagnostizieren zu können, wird eine Polysomnographie im Schlaflabor duchgeführt. Folgende Parameter werden dabei kontinuierlich während des Schlafes erfasst und ausgewertet: • Atemfluss: Definitionsgemäß ist die Unterbrechung des Atemflusses für länger als 10 Sekunden als Apnoe und die Verminderung des Atemflusses um mindestens 50% vom Ausgangswert mit darauffolgender Sauerstoffentsättigung (Abfall um mindestens 3%) oder Weckreaktion als Hypopnoe zu bezeichnen. • Atemanstrengung: Atembewegungen geben Auskunft über die Entität der Schlafapnoe. Während sie beim zentralen Schlafapnoe-Syndrom fehlen, ist die Tätigkeit der Atemmuskulatur beim OSAS ausreichend vorhanden. • Pulsoxymetrie: Die Dauer und die Höhe der Sauerstoffentsättigungen lassen auf das Ausmaß an Hypoxie schließen. • Elektrokardiogramm, (EKG) Puls- und Blutdruckmessung: Die Kreislaufparameter geben Aufschluss über den Allgemeinzustand des Patienten, begleitende kardiovaskuläre Erkrankungen oder eine Sympathikusaktivierung. • Schlafposition, Bewegung, Geräusche: Mittels Video- und Mikrofonaufzeichnung lassen sich lageabhängige Apnoen/Hypopnoen und richtungsweisende Schnarchgeräusche erfassen. • Elektroenzephalogramm (EEG): Das EEG dient der Unterscheidung der einzelnen Schlafstadien [Non-REM (Rapid Eye Movement) 1–4 und REM-Schlaf oder Traumschlaf]. (Hader et al., 2004) Im Vergleich zu Schlafgesunden finden sich bei OSAS-Patienten vermehrt Phasen des Schlafstadiums 1 (Einschlafphasen), während diese des Stadiums 2 (Leichtschlafphasen) vermindert sind. Zusätzlich finden vermehrt Weckreaktionen statt. Bei Patienten mit einem moderaten und schweren OSAS liegt weiters ein Tief- und Traumschlaf-Defizit vor. (Fietze et al., 2004) 22 • Elektrookulogramm (EOG): Die Detektion von Augenbewegungen mittels EOG ist ebenso erforderlich zur Bestimmung der Schlafstadien, insbesondere des REMSchlafes. • Elektromyogramm (EMG): Die Bestimmung des basalen Muskeltonus ist ein weiteres Kriterium zur Einordnung in die verschiedenen Schlafstadien. Differenzialdiagnostisch werden mittels EMG auch Beinbewegungen erfasst, da auch ein Restless-Legs-Syndrom zu Arousal und somit auch zu Tagesmüdigkeit führen kann. (Hader et al., 2004) Zur Diagnosestellung wird der Apnoe-Hypopnoe-Index (AHI) verwendet, der die aufgetretene Anzahl an Apnoen, Hypopnoen und RERAs (Respiratory Effort Related Arousals) pro Stunde angibt. RERAs sind obstruktive Schnarchepisoden ohne Apnoen und Hypopnoen im eigentlichen Sinn, die jedoch auf Grund der konsekutiven Weckreaktionen ebenfalls zu Schlaffragmentierung und ausgeprägter Tagesmüdigkeit führen und deshalb zum obstruktiven Schlafapnoe-Syndrom gezählt werden. Ein OSAS kann nun diagnostiziert werden wenn ohne dem Auftreten von Symptomen der AHI ≥ 15 beträgt oder wenn der AHI ≥ 5 ist und begleitet wird von mindestens einem der charakteristischen Symptome (Tagesmüdigkeit, ungewollte Einschlafepisoden, nicht erholsamer Schlaf, nächtliche Erstickungsanfälle, lautes Schnarchen oder Atemstillstände im Schlaf). Schweregradeinteilung: AHI: < 5: physiologisch AHI: 5-15: leichtes OSAS AHI: 16-30: moderates OSAS AHI: > 30: schweres OSAS (American Academy of Sleep Medicine, 2005) Die obstruktive Schlafapnoe ist ein in der Bevölkerung weit verbreitetes Syndrom, denn 4% der Männer und 2% der Frauen zwischen dem 30. und 60. Lebensjahr erfüllen die Kriterien zur Diagnosestellung. (Young et al., 1993) OSAS kann prinzipiell in jeder Altersgruppe auftreten, jedoch nimmt die Häufigkeit mit dem Alter zu. (Duran et al., 2001; Bixler et al., 1998) Die Ursachen, die im Schlaf zur Obstruktion der oberen Atemwege führen, sind multifaktoriell. Bestimmte anatomische Verhältnisse führen zur Verengung der oberen Atemwege und gelten als Faktoren zur Entwicklung eines OSAS: 23 • Spezielle kraniofaziale Gegebenheiten (z.B.: Hypoplasie oder Rückverlagerung von Maxilla oder Mandibula) (Watanabe et al., 2002) • Verdickung des Weichteilgewebes durch Hypertrophie, Entzündungsprozesse/ Ödeme in der Mukosa (Anastassov & Trieger, 1998) oder vermehrte Fettgewebseinlagerung in der Rachenwand bei adipösen Patienten (BMI≥30) (Horner et al., 1989; Shelton et al., 1993) Zusätzlich zu den verengten Atemwegen besteht eine vermehrte Kollapsneigung der oberen Atemwege bei OSAS Patienten im Schlaf. Die Erschlaffung der Pharynxmuskeln M. tensor veli palatini und M. genioglossus führt in Kombination zu den anatomischen Gegebenheiten zur Obstruktion und dadurch zu rezidivierenden Apnoen bzw. Hypopnoen. (Mezzanotte et al., 1996) Es gibt auch Hinweise dafür, dass genetische Faktoren eine gewisse Rolle in der Ätiologie des OSAS spielen. (Patel, 2005) Adipositas ist der signifikanteste prädisponierende Faktor für die Entwicklung des Syndroms. (Young & McDonald, 2004) Schon geringe Veränderungen des BMI können den AHI und die Ausprägung der Symptome beeinflussen. (Peppard et al., 2000a) Prädisponierend wirken weiters Akromegalie (Grunstein et al., 1991), ein Down-Syndrom (Marcus et al., 1991), Hypothyreose (Rajagopal et al., 1984) sowie Nikotinabusus (Kashyap et al., 2001). 1.4.1 Auswirkungen des obstruktiven Schlafapnoe-Syndroms Zahlreiche Studien bringen einen Zusammenhang zwischen dem obstruktiven SchlafapnoeSyndrom und verschiedenen Erkrankungen ans Licht, deren exakte pathogenetische Entwicklung noch nicht vollständig geklärt ist. Es ist jedoch wahrscheinlich, dass es sich um ein multifaktorielles Geschehen handelt. OSAS ist assoziiert mit dem vermehrten Auftreten von arterieller Hypertonie (Peppard et al., 2000b; Hla et al., 1994; Grote et al., 1999; Lavie et al., 2000), Schlaganfällen (Arzt et al., 2005; Yaggi et al., 2005), KHK (Koronare Herzkrankheit) (Shahar et al., 2001), pulmonaler Hypertonie (Arias et al., 2006), Herzrhythmusstörungen (Harbison et al., 2000) und Typ-2-Diabetes (Babu et al., 2005; Ip et al., 2002; Punjabi et al., 2002). Außerdem sind Patienten mit OSAS aufgrund der Tagesmüdigkeit vermehrt in Autounfälle involviert. (George et al., 1987) Als pathogenetische Faktoren werden folgende Mechanismen angenommen: 1.4.1.1 Gesteigerte Aktivität des Sympathikus • Die vorübergehende Hypoxie, Hyperkapnie und die intrathorakalen Druckveränderungen während den Apnoen/Hypopnoen führen zu einer gesteigerten Aktivität des Sympathikus und einer vermehrten Ventilation. (Somers & Abboud, 1993) 24 Die vermehrte Ventilation hemmt unter physiologischen Bedingungen die sympathische Überaktivität. Da dies bei der obstruktiven Schlafapnoe aufgrund der Verengung der oberen Atemwege aber nicht möglich ist, kommt es zu einer Potenzierung der sympathischen Antwort. Diese wird zusätzlich noch von Arousals gesteigert. (Somers et al., 1989, 1988) Eine periphere Vasokonstriktion mit einer konsekutiven Blutdrucksteigerung ist die Folge. (Somers et al., 1995) Bei vielen OSAS-Patienten findet man auch tagsüber eine gesteigerte Aktivität des Sympathikus (Carlson et al., 1993), die sich auch durch erhöhte Katecholaminspiegel in Urin und Serum messen lässt. (Marrone et al., 1993) • Es wird vermutet, dass eine abnormale Antwort von peripheren Chemorezeptoren auf die intermittierenden Hypoxien mit einem erhöhten kardiovaskulären Stress und einer erhöhten Morbidität bei OSAS-Patienten in Zusammenhang steht. (Narkiewicz et al., 1999) Periphere Chemorezeptoren befinden sich in den Glomera carotica und lösen ab einer gewissen Sauerstoffentsättigung im Blut einerseits durch eine Sympathikusaktivierung eine Vasokonstriktion und somit eine Blutdrucksteigerung aus. Andererseits wird aber auch der vagale Einfluss auf die Herzaktivität dadurch gesteigert und führt zu einer Bradykardie. (de Burgh Daly et al., 1979) Bei Menschen mit OSAS ist die Funktion der peripheren Chemorezeptoren gestört und die Antwort auf Hypoxie wird potenziert. (Narkiewicz et al., 1999) Dies könnte für das Auftreten von plötzlichem Herztod bei OSAS-Patienten verantwortlich sein. • Die Unterdrückung der Sensitivität der Barorezeptoren im Sinus caroticus bei OSAS-Patienten, die den Blutdruck registrieren und über das autonome Nervensystem anpassen, könnte ebenso in die gesteigerte sympathische Aktivierung involviert sein. Dies könnte zur vermehrten kardiovaskulären Morbidität und Mortalität im Zusammenhang mit dem obstruktiven Schlafapnoe-Syndrom beitragen. (Parati et al., 1997) 1.4.1.2 Systemische Entzündung Es hat sich gezeigt, dass OSAS-Patienten ohne kardiovaskuläre Vorerkrankungen frühe Zeichen einer Atherosklerose zeigen, die in ihrer Ausprägung signifikant mit dem Schweregrad des Syndroms korrelieren. (Drager et al., 2005) Eine systemische Entzündung nimmt einen entscheidenden Platz in der Entwicklung und Progression der Atherosklerose ein. Eine Erhöhung der Entzündungsparameter CRP (C-reaktives Protein) und TNF-α (Tumornekrosefaktor α) wurden bei Patienten mit OSAS beobachtet. (Sham- 25 suzzaman et al., 2002; Minoguchi et al., 2004) Ebenso konnten Ohga et al. vermehrt zirkulierende, lösliche Adhäsionsmoleküle bei OSAS-Patienten messen, die durch eine Vermittlung der Leukozytenadhäsion am Gefäßendothel zum Entzündungsvorgang beitragen. (Ohga et al., 1999) Dies unterstützt die These, dass OSAS als Risikofaktor in der Entstehung der Atherosklerose durch Entzündungsprozesse beteiligt ist. 1.4.1.3 Oxidativer Stress Freie Sauerstoffradikale könnten auch zur Entwicklung kardiovaskulärer Erkrankungen beitragen. (Halliwell, 1993) Bei Patienten mit obstruktiver Schlafapnoe wurde eine vermehrte Produktion an reaktiven Sauerstoffspezies nachgewiesen. Dyugovskaya et al. und Yamauchi at al. fanden heraus, dass der Schweregrad von OSAS signifikant mit dem Ausmaß an oxidativem Stress korreliert. (Dyugovskaya et al., 2002; Yamauchi et al., 2005) Zu erklären wäre dies damit, dass während der Reoxygenierung nach einer Hypoxie reaktive Sauerstoffspezies produziert werden, die durch Oxidation zu Schäden am Gewebe führen. (McCord, 2000) 1.4.1.4 Endotheliale Dysfunktion Ross zeigte auf, dass eine endotheliale Dysfunktion der Entwicklung von Atherosklerose vorausgeht oder diese beschleunigt. (Ross, 1999) Bei OSAS-Patienten stellte man auch eine Beeinträchtigung der Endothel-abhängigen Vasodilatation fest. (Ip et al., 2004; Kato et al., 2000) Das Gefäßendothel sorgt für das Gleichgewicht zwischen vasodilatatorischen und vasokonstriktorischen Substanzen. Bei der obstruktiven Schlafapnoe fand man eine verminderte Freisetzung des Vasodilatators Stickstoffmonoxid (NO) (Schulz et al., 2000; Ip et al., 2000a) und erhöhte Spiegel von Vasokonstriktoren wie Endothelin oder Angiotensin II (AT II). (Phillips et al., 1999) Dieser Umstand könnte zur erhöhten kardiovaskulären Morbidität und Mortalität bei Patienten mit OSAS beitragen. 1.4.1.5 Erhöhte Blutkoagulabilität Diverse Studien entdeckten bei Patienten mit OSAS eine vermehrte Thrombozytenaktivierung während des Schlafens. (Bokinsky et al., 1995; Eisensehr et al., 1998; Geiser et al., 2000) Auch ein erhöhter Fibrinogen-Spiegel im Plasma von OSAS-Patienten wurde postuliert.(Wessendorf et al., 2000; Nobilia et al., 2000) Die daraus resultierende erhöhte Koagulabilität des Blutes könnte einen entscheidenden Faktor in der Pathogenese von kardio- und zerebrovaskulären Ereignissen darstellen. 26 1.4.1.6 Metabolische Dysregulation Es besteht ein Zusammenhang zwischen dem OSAS und einer gestörten GlukoseToleranz bzw. erhöhten Insulinresistenz unabhängig von Adipositas, in Korrelation mit dem AHI. (Ip et al., 2002; Punjabi et al., 2002) Hypoxie könnte die gestörte Glukosetoleranz über erhöhte Epinephrinspiegel direkt auslösen. (Oltmanns et al., 2004) Weiters könnte das aus Fettzellen sezernierte Hormon Leptin, das bei OSAS-Patienten erhöht ist, (Ip et al., 2000b) in der Pathogenese der kardiovaskulären Morbiditäten eine Rolle spielen. 1.4.2 Therapie Die Therapie des OSAS ist eine kontinuierliche pneumatische Schienung der oberen Atemwege durch Überdruck während des Schlafes. Über eine CPAP (continuous positive airway pressure) - Maske werden durch den erhöhten Druck die Atemwege freigehalten und bei richtiger Anwendung Apnoen und Hypopnoen wirkungsvoll verhindert. (Sullivan et al., 1981) CPAP wirkt allerdings nicht kausal, denn bei Absetzen der Therapie kehren die Symptome wieder. Bei konsequenter Anwendung der CPAP-Therapie bessert sich die Symptomatik wie Tagesmüdigkeit und viele der Auswirkungen, die OSAS mit sich bringt, werden reduziert oder verhindert. (Peker et al., 2006; MartinezGarcia et al., 2005; Koehler et al., 1998; Brooks et al., 1994) Es gibt wenige, seltene Nebenwirkungen im Zuge der CPAP-Therapie, wie gelegentliche Rhinitis, Trockenheit der oberen Atemwege, (Richards et al., 1996) Beschwerden, die durch den erhöhten thorakalen Druck einhergehen, wie z.B. erhöhter Augeninnendruck (Alvarez-Sala et al., 1992) oder durch falsche Anwendung entstehen, wie z.B. Hautschäden (Pepin et al., 1995). Ein Problem ist jedoch die geringe Akzeptanz der Maskentherapie und die dadurch oft unregelmäßige Anwendung unter den Patienten. (Kribbs et al., 1993) Zusätzlich kann man durch Modifikation des Lebensstils, wie Gewichtsabnahme bei Adipositas, (Smith et al., 1985) Verbesserung der Schlafhygiene, Veränderung der Schlafposition im Sinne einer Rückenlageverhinderung (McEvoy et al., 1986) sowie Optimierung des Nikotin- und Alkoholverhaltens die Lebensqualität verbessern. Alternativ zur CPAP-Therapie gibt es chirurgische Methoden, wie z.B. die Uvulopalatopharyngoplastik, (Sher et al., 1996) die maxillo-mandibuläre Umstellungsosteotomie oder ein Genioglossus Advancement, (Riley et al., 2000) deren Wirksamkeit jedoch widersprüchlich ist. Die Tracheotomie stellte in den Anfängen der OSAS-Behandlung die erste effektive Therapiemethode dar und wird bis heute noch angewandt. Auf Grund der damit verbundenen Einschränkung der Lebensqualität muss die Indikation jedoch streng gestellt 27 werden. (Simmons, 1979) Des weiteren gibt es pharmakologische Ansätze zur Behandlung der Symptome, wie z.B. die Gabe von Modafinil bei einzelnen Patienten, welches als Psychostimulator bei exzessiver Tagesmüdigkeit wirkt. (Arnulf et al., 1997) In der OSAS-Therapie finden auch Aufbissschienen Verwendung, die auf die Position der Zunge, des Unterkiefers oder andere oropharyngeale Strukturen Einfluss nehmen und auf diese Weise den Atemfluss verbessern. (Lowe, 2000) 28 1.5 Entstehungstheorien zu funktionellen Hörstörungen Zu den funktionellen oder auch idiopathischen Hörstörungen gehören der Hörsturz, Tinnitus oder die Altersschwerhörigkeit (Presbyakusis). Die Erkrankungen sind, wie der Name schon sagt, noch keinem eindeutigen Pathomechanismus zuzuordnen. Es existieren jedoch zahlreiche Theorien dazu, wie es wahrscheinlich durch ein Zusammenspiel mehrerer Faktoren zu den Störungen kommen kann. Die wichtigsten davon werden im Anschluss besprochen. Für den Hörsturz gibt es keine einheitliche Definition; gebräuchlich ist die Beschreibung, dass eine sensorineurale Schwerhörigkeit von mindestens 30 db in 3 aufeinander folgenden Frequenzen auftritt, die sich in einem Zeitraum von maximal 3 Tagen entwickelt. (Byl, 1977) Meistens tritt der Hörverlust unilateral auf (Oh et al., 2007) und wird in 80% der Fälle von Tinnitus und in 30% von Schwindel begleitet. (NosratiZarenoe et al., 2007) Einer aktuellen Studie zufolge beträgt die Inzidenz des Hörsturzes 160/100.000 Einwohner und zählt somit nicht mehr zu den seltenen Erkrankungen. (Klemm et al., 2009) Presbyakusis wird als Hörverlust, der durch den physiologischen Alterungsprozess des auditorischen Systems ab dem 5. bis 6. Lebensjahrzehnt verursacht wird, definiert. (Ganz & Jahnke, 1996) Doch nicht nur der Alterungsprozess, sondern auch diverse exogene und endogene Faktoren spielen vermutlich bei der Pathogenese eine Rolle. Altersschwerhörigkeit tritt sehr häufig auf; 37% der 61-70-Jährigen sind von einem Hörverlust von mindestens 25 db betroffen. (Davis, 1989) “Tinnitus ist definiert als subjektive Wahrnehmung eines Geräusches bei Fehlen einer äußeren Schallquelle. In der Regel geht Tinnitus mit Hörstörungen einher, kann aber auch als unabhängiges Symptom auftreten.” (Mazurek et al., 2006) Tinnitus kann man je nach Entstehungsort einteilen in einen Schallleitungstinnitus, einen sensorineuralen Tinnitus oder einen zentralen Tinnitus. Beim sensorineuralen Tinnitus können entweder der kochleäre Verstärker, die Transduktion der inneren Haarzellen, der Signaltransfer auf die afferenten Hörnervenfasern oder extrasensorische Elemente wie die Stria vascularis gestört sein. (Zenner, 1998) Aufgrund der schweren Zugänglichkeit des Innenohres kann man die Erkrankung jedoch meist nicht 100%ig einer Untergruppe zuordnen. Für die Genese der verschiedenen funktionellen Hörstörungen gibt es zahlreiche gemeinsame Theorien, wovon im Folgenden die wichtigsten anhand des Hörsturzes besprochen werden: 29 1.5.1 Vaskuläre Genese Die Hypothese, dass sich der idiopathische Hörsturz aufgrund einer vaskulären Pathophysiologie enwickelt, wird unterstützt durch das plötzliche Eintreten der Symptomatik, meist innerhalb von ein paar Stunden, so wie es auch bei anderen vaskulär bedingten Pathologien, wie z.B. dem Insult der Fall ist. Weiters stellt die A. labyrinthi, die das Innenohr versorgt, eine funktionelle Endarterie dar. Dies bedeutet, dass die Anastomosen zu anderen Gefäßen bei Verschluss der A. labyrinthi die Blutversorgung des Innenohrs nicht aufrechterhalten können. (Nakashima et al., 2003) Hinzu kommt, dass die Kapillaren der Stria vascularis einen sehr kleinen Durchmesser haben, der zum Teil kleiner ist als ein Erythrozytendurchmesser. Außerdem gibt es sehr viele und lange Kapillaren, die zusätzlich noch eine niedrige Fließgeschwindigkeit besitzen. (Mazurek et al., 2006) Diese Tatsachen machen die Kochlea sehr anfällig auf Störungen der Dynamik und Rheologie des Blutes, wie u.a. bei thromboembolischen Ereignissen. Eine verminderte Durchblutung des Innenohrs könnte durch verschiedene Ursachen zustande kommen, die die Viskosität des Blutes erhöhen. Dazu zählen eine vermehrte Erythrozytenaggregation oder eine reduzierte Verformbarkeit der Erythrozyten, die z.B. durch akute Virusinfekte der oberen Atemwege zustande kommen kann. (Hall et al., 1991) Weiters könnten Viren eine Hämagglutination verursachen, die einen temporären Verschluss der versorgenden Gefäße zur Folge hat. (Mattox & Simmons, 1977) Fibrinogen bestimmt die Plasmaviskosität ebenfalls mit. In einer Studie zeigten sich erhöhte Fibrinogenspiegel bei Patienten mit idiopathischem Hörsturz. (Rudack et al., 2006) Die erhöhten Fibrinogenspiegel könnten über eine vermehrte Plasmaviskosität und Thrombozytenaggregation zur Entstehung des Hörsturzes beitragen. Da Fibrinogen ein Akut-Phasen-Protein ist, könnten die erhöhten Fibrinogenspiegel z.B. durch akute Entzündungsvorgänge im Körper herrühren. Es spricht auch für die vaskuläre Hypothese, dass bei Erkrankungen, die mit vermehrter Plasmaviskosität einhergehen, wie z.B. Waldenstroms Makroglobulinämie (Platia & Saral, 1979) oder Sichelzellanämie (Schreibstein et al., 1997), die Inzidenz von idiopathischen Hörstürzen erhöht ist. Ebenso sind Menschen mit westlicher Ernährungsweise anfälliger für einen idiopathischen Hörsturz als Personen, die weniger gesättigte Fettsäuren zu sich nehmen. Die vermehrte Zufuhr gesättigter Fettsäuren hat nämlich eine erhöhte Thrombozytenaggregation und eine Faktor VII Aktivierung zur Folge, worauf sich eine Hyperkoagulabilität einstellt. Dies könnte zu einer verminderten Sauerstoffversorgung im Innenohr und zu einer kochleären Unterfunktion führen. (Nakamura et al., 2001) Die Kochlea besitzt autoregulatorische Eigenschaften, die zur Folge haben, dass bei 30 Änderungen des systemischen Blutdrucks innerhalb gewisser Grenzen der kochleäre Blutdruck annähernd konstant bleibt. (Nakashima et al., 2003) Die Autoregulation erfolgt einerseits über das sympathische Nervensystem und andererseits über das NO (Stickstoff-monoxid)- Endothelin-System. Da in der Stria vascularis jedoch keine adrenergen Muskelfasern vorkommen, erfolgt die Autoregulation hier lediglich über das NO-Endothelin-System. NO vermittelt hierbei eine Vasodilatation, während Endothelin für die Vasokonstriktion verantwortlich ist. (Mazurek et al., 2006) In der Stria vascularis sorgen vermutlich Perizyten, hochkontraktile Zellen, die auf aus dem Endothel ausgeschüttete Substanzen wie NO und Endothelin reagieren, für die Aufrechterhaltung des Vasotonus. (Chakravarthy & Gardiner, 1999) Eine Störung der Perizyten- oder der Endothelfunktion hätte auch eine negative Auswirkung auf die kochleäre Durchblutung zur Folge. Vasospasmen der A. spiralis modioli könnten in der Pathophysiologie des Hörsturzes ebenso eine Rolle spielen. (Scherer et al., 2002) Dafür würde auch die hohe Remissionsrate der Krankheit sprechen, die für den Tieftonhörsturz in einer Studie 70% beträgt. (Linssen & Schultz-Coulon, 1997) Bei einer längerdauernden Okklusion der versorgenden Gefäße wäre eine irreversible Zerstörung kochleärer Strukturen zu erwarten. 1.5.2 Hypoxie und oxidativer Stress Hypoxie kann, z.B. als Folge von Durchblutungsstörungen der Kochlea, Membranveränderungen, Ödembildung, Entzündung, Störungen der Ionenhomöostase und die Bildung von reaktiven Sauerstoffspezies (ROS) und Stickstoffspezies in der Kochlea auslösen. (Mazurek et al., 2006) Unter normoxischen Bedingungen sind ROS, wie z.B. Superoxidanionen, Hydroxylradikale und Wasserstoffperoxide, Nebenprodukte der oxidativen Phosphorylierung, die durch das antioxidative System neutralisiert werden. (Evans & Halliwell, 1999) Unter hypoxischen Bedingungen werden durch eine Störung des ATP-Stoffwechsels und der Mitochondrienfunktion ROS gebildet. (Gross, 2005) Reaktive Sauerstoffspezies wirken auf die Haarzellen toxisch. Es erfolgt eine verstärkte Glutamatausschüttung an den Haarzellen, die zum intrazellulären Kalziumanstieg in den angrenzenden Neuronen führt. Daraufhin wird verstärkt Stickstoffmonoxid produziert, (Kopke et al., 1999) welches unter physiologischen Bedingungen eine Vasodilatation und Neurotransmission in der Kochlea vermittelt. (Ruan, 2002) Unter Sauerstoffmangel verbindet sich NO jedoch mit Superoxidanionen zu Peroxinitriten, die ihrerseits wiederum das endokochleäre Potential beeinflussen und einen toxischen Effekt auf die Haarzellen ausüben. 31 Gleichzeitig bewirkt NO eine Erhöhung des zyklischen Guanosinmonophosphats (cGMP) in den Haarzellen. Dieser Botenstoff vermittelt eine Öffnung der Ionenkanäle, was eine weitere Glutamatausschüttung und eine Verstärkung der Haarzellschädigung im Sinne eines Circulus vitiosus zur Folge hat. (Kopke et al., 1999) ROS cGMP in den Haarzellen Glutamatausschüttung NO-Produktion Su pe ro + an io Ca-Anstieg in den Neuronen xid ne n Peroxinitrite Haarzellschädigung Abbildung 1.10: Der Einfluss von ROS auf die Haarzellen unter hypoxischen Bedingungen 1.5.3 Virale Genese Eine virale Infektion könnte über mehrere Wege das Innenohr betreffen und in weiterer Folge zum Hörsturz führen. Man unterscheidet einerseits zwischen der akuten viralen Infektion, entweder der oberen Atemwege oder intrakraniell, und andererseits zwischen einer Reaktivierung einer latenten Infektion. Die Viren können das Innenohr potenziell über den hämatogenen Weg, über den Ductus perilymphaticus oder den inneren Gehörgang erreichen. Die virale Hypothese beruht unter anderem auf der Assoziation von histopathologischen Entdeckungen im Temporalknochen bei verstorbenen Patienten, die einmal einen idiopathischen Hörsturz erlitten haben. Verschiedene Studien konnten zwar kei- 32 nen direkten Virusnachweis erbringen, jedoch indirekte Zeichen einer Virusinfektion, vor allem eine Atrophie der Haar- und Stützzellen sowie der Stria vascularis und des Ligamentum spirale im Corti-Organ nachweisen. (Vasama & Linthicum Jr, 2000; Schuknecht & Donovan, 1986) Viele Studien beschäftigten sich auch mit dem Zusammenhang von Hörstürzen mit einer positiven Serokonversion für verschiedene Viren. Fukuda et al. fanden in 7,2% der erwachsenen Patienten mit idiopathischem Hörsturz anti-Mumps-IgM Antikörper. (Fukuda et al., 2001) Westmore et al. konnten aus der Perilymphe einer 26-jährigen Patientin mit idiopathischem Hörsturz Mumpsviren isolieren. (Westmore et al., 1979) Eine Infektion mit Influenza-, Masern- oder Rötelnviren könnte auch eine ursächliche Rolle in der Hörsturzentwicklung haben. (Kobayashi et al., 1994; Veltri et al., 1981) Viren aus der Gruppe der Herpes-Familie stehen hauptsächlich unter dem Verdacht, mit einer Reaktivierung einer latenten Infektion zum Hörsturz zu führen. (Koide et al., 1988; Wilson, 1986) Zu den Herpes-Viren zählen der Herpes simplex Virus Typ 1 und 2, Varizella Zoster Virus (VZV), Zytomegalievirus (CMV), Eppstein-Barr Virus und die humanen Herpesviren (HHV) 6, 7 und 8. Das Problem ist jedoch, dass eine Reaktivierung einer latenten Infektion eines Herpesvirus serologisch nicht nachzuweisen ist. Mentel et al. konnten zwar keine Assoziation zwischen dem idiopathischen Hörsturz und Herpesviren finden, fanden jedoch einen Zusammenhang mit dem Auftreten von Enteroviren. (Mentel et al., 2004) Untermauert wird die virale Hypothese auch durch von Patienten berichtete virale Infekte in der unmittelbaren Vorgeschichte von idiopathischen Hörstürzen. (Van Dishoeck & Bierman, 1957) Insgesamt kann man annehmen, dass Viren in der Pathogenese des Hörsturzes eine Rolle spielen, jedoch klare Beweise dafür sind noch ausstehend. 1.5.4 Autoimmune Genese Die Annahme, dass immunologische Vorgänge zur Entstehung des idiopathischen Hörsturzes beitragen, wird durch das Ansprechen der Patienten auf eine KortikosteroidTherapie unterstützt. Ein immun-vermittelter Hörsturz könnte entweder alleine, begrenzt auf das Innenohr auftreten, oder in Zusammenhang mit einer systemischen Erkrankung. Zu den systemischen Immunerkrankungen, bei welchen Hörstürze gehäuft vorkommen zählen das Cogan-Syndrom (St Clair & McCallum, 1999), der systemische Lupus erythematodes (SLE) (Naarendorp & Spiera, 1998), die Arteriitis temporalis (Loffredo et al., 2004), die rheumatoide Arthritis, das Sjögren-Syndrom (Tumiati et al., 1997), die Colitis ulcerosa (Hoistad et al., 1998), der Mb. Behcet (Brama & Fainaru, 1980) oder die Multiple Sklerose (MS) (Oezuenlue et al., 1998). 33 Es wird angenommen, dass eine Kreuzreaktion zirkulierender Antikörper mit Antigenen des Innenohrs oder eine Infiltration aktivierter T-Lymphozyten eine Schädigung im Innenohr verursacht. (Veldman, 1986; Berrocal & Ramirez-Camacho, 2002) Die Antikörper könnten möglicherweise wiederum durch Viren getriggert werden. (Oldstone, 1989) 1.6 Ziel der Studie Die Literatur bezüglich dem Einfluss von Hypoxie auf das Innenohr, gemessen an Distorsionsprodukten otoakustischer Emissionen, ist rar. Jiang et al. führten bei Neugeborenen, die eine perinatale Hypoxie erlitten haben, DPOAE-Messungen jeweils 3-5 Tage und ein Monat nach der Geburt durch. Speziell in den Frequenzen 1-5 kHz konnte ein Absinken der DPOAE festgestellt werden, die auch nach einem Monat nicht wieder anstiegen. (Jiang et al., 2005) Olzowy et al. induzierten in einer Studie bei Meerschweinchen hypoxische Phasen mit einer Sauerstoffsättigung von höchstens 75%. Während diesen hypoxischen Phasen konnte ein Rückgang der DPOAE beobachtet werden, der mit der Abnahme der Sauerstoffsättigung korrelierte. (Olzowy et al., 2008b) Eine Studie an 13 Bergsteigern in Höhen von bis zu 7400 Metern zeigte ein Absinken der DPOAE bei einer Frequenz von 4 kHz bei 5 Personen. Potentielle Ursachen dafür, wie z.B. eine Erhöhung des intrakraniellen Drucks, eine Einnahme von Salicylaten, Druckschwankungen im Mittelohr oder Veränderungen der Serumosmolarität konnten in der Studie das Absinken der DPOAE nicht zufriedenstellend erklären. Deshalb nahmen die Autoren an, dass die Hypoxie, die in großer Höhe auftritt, zumindest einen Teil dazu beitragen könnte. (Olzowy et al., 2008a) Das Ziel der Studie ist herauszufinden, ob bei Patienten mit schlafbezogenen Atmungsstörungen unter hypoxischen Bedingungen die DPOAE im Vergleich zum normoxischen Wachzustand absinken. Obwohl noch keine vergleichbaren Studien in der Literatur beschrieben wurden, kann man anhand der oben erwähnten Untersuchungen am Tier annehmen, dass ein nächtliches Absinken der DPOAE nicht unwahrscheinlich ist. Wäre dies tatsächlich der Fall, würde die Studie einen weiteren Hinweis dafür liefern, dass sich Hypoxie auf die kochleäre Funktion auswirkt und in der Pathophysiologie von funktionellen Hörstörungen eine Rolle spielt. 34 2 Material und Methoden 2.1 Patientenkollektiv Insgesamt wurden während des Zeitraums von 31. Jänner bis 24. Oktober 2010 39 Patienten in die Studie eingeschlossen. Es handelt sich dabei um Patienten, die sich planmäßig bei Verdacht auf eine schlafbezogene Atmungsstörung einer Polysomnographie auf der Abteilung für Pulmologie am LKH Universitätsklinikum Graz unterzogen. Die Rekrutierung der Probanden erfolgte im Vorfeld telefonisch. Einschlusskriterien: 1. Detektierbare DPOAE 2. Normaler Befund in der Otoskopie 3. Reintonaudiometrieschwellen besser/gleich 40 db HL (Hearing level) 4. Normales Tympanogramm 5. Zustimmung zur Studienteilnahme mittels Einverständniserklärung Ausschlusskriterien: 1. Nicht detektierbare DPOAE 2. Bekannte Ohrenerkrankung in der Anamnese 3. Pathologischer Otoskopiebefund 4. Reintonaudiometrieschwellen schlechter als 40 db HL 5. Pathologisches Tympanogramm 6. Fehlende Einverständniserklärung 35 2.2 Untersuchungsablauf Jeweils am Abend vor der Durchführung der geplanten Polysomnographie erfolgte die Untersuchung der Probanden an der Abteilung für HNO am LKH Universitätsklinikum Graz. Nach einer otologischen Inspektion und der Durchführung einer Audiosowie Tympanometrie wurden die DPOAE in Form von DP-Grammen unter normoxischen Bedingungen im Wachzustand erfasst. Die zweite DPOAE-Messung erfolgte während der Polysomnographie zwischen 03:30 und 04:30 Uhr nachts. Bei den Patienten mit einem diagnostizierten OSAS gingen der zweiten DPOAE-Messung im Verlauf der Nacht Phasen von Sauerstoffentsättigungen zuvor. Das Prozedere der Untersuchung wurde bei allen Patienten in gleicher Weise durchgeführt. 2.2.1 Otoskopie Zum Ausschluss von Pathologien des äußeren Gehörgangs und des Trommelfells wurde erst eine Otoskopie durchgeführt und, falls notwendig, Cerumen entfernt. 36 2.2.2 Audiometrie Anschließend wurden die Hörschwellen für die Frequenzen 0.125, 0.25, 0.5, 0.75, 1, 1.5, 2, 3, 4, 6, 8, 10, 12.5 und 16 kHz mit einem AD 17 Computer Audiometrie System (Audio-Data GmbH, Duvensee, Deutschland) bestimmt. Es wurden in weiterer Folge nur Frequenzen verwertet, die eine Reintonaudiometrieschwelle von besser oder gleich 40 db HL aufwiesen. Abbildung 2.1: Audiogramm 37 2.2.3 Tympanometrie Für die Erfassung des Mittelohrstatus wurden Tympanogramme mit einem GSI 33 Middle Ear Analyzer (Grason-Stadler Inc., Milford, USA) erstellt und eventuell vorhandene Pathologien ausgeschlossen. Abbildung 2.2: GSI 33 Middle Ear Analyzer 38 2.2.4 1. DPOAE-Messung Die Messungen der DPOAE wurden im Liegen in einem schallisolierten Raum durchgeführt. Es wurden an beiden Ohren jeweils 3 Messungen durchgeführt und deren Mittelwert als Ausgangswert bei guter Sauerstoffsättigung herangezogen. Die Sonde wurde bei jeder Messung neu im Gehörgang platziert (multiple-fit-mode/ MF-mode) und die Probanden wurden angehalten, Atemgeräusche und Kopfbewegungen so gut wie möglich zu vermeiden, um den Störgeräuschpegel gering zu halten. 2f1-f2-DPOAE wurden bei 1, 1.4, 2, 2.8, 4, 6 und 8 kHz bei einem Verhältnis der Frequenzen der Primärtone von f2/f1=1,2 gemessen. Die Primärtonschallpegel wurden bei L1=63db und L2=60 db entsprechend der Pegelschere für alle Messungen festgelegt. Es wurden ausschließlich Messergebnisse weiterverwertet, bei welchen die SNR größer/gleich 6db betrug. Die DPOAE wurden mit einem DP Echoport ILO 292 USB II device, einer ILO V6 Clinical OAE Software (Otodynamics Ltd., Hertfordshire, United Kingdom) und einem ACER Laptop gemessen. Abbildung 2.3: DPOAE-Sonde 2.2.5 Polysomnographie Vor der Polysomnographie wurden die Patienten statuiert, es wurde ein EKG angefertigt und der Blutdruck gemessen. Ein Epworth-Sleepiness-Scale (ESS)-Score zur anamnestischen Erfassung von Tagesmüdigkeit wurde ebenso erhoben wie ein International Restless-Legs-Syndrome Severity-Scale (IRLS)-Score zur Erfassung eines eventuell vor- 39 handenen Restless-Legs-Syndroms. Die Polysomnographie wurde mit der Software Domino Version 2.3.0 (Firma Somnomedics, Randersacker, Deutschland) durchgeführt. Folgende Parameter wurden kontinuierlich gemessen: 1. EEG 2. EOG beidseits 3. Submentales EMG 4. EMG des M. tibialis anterior beidseits 5. EKG 6. Blutdruck 7. Pulsoxymetrie 8. Atemfluss mittels oronasalem Thermistor (Messung anhand des Temperaturunterschieds zwischen ausgeatmeter und eingeatmeter Luft) 9. Atemanstrengung mittels thorakalen und abdominellen Piezosensoren 10. Video- und Mikrofonaufzeichnung Nach der Polysomnographie erfolgte eine venöse Blutabnahme, eine Blutgasanalyse (BGA) und eine Lungenfunktionsprüfung. 40 2.2.6 2. DPOAE-Messung Die Messung der DPOAE während der Polysomnographie erfolgte bei jedem Probanden zwischen 03:30 und 04:30 Uhr, unabhängig von eventuell vorangegangenen Sauerstoffentsättigungen. Die nächtliche Messung erfolgte unter denselben Bedingungen wie die 1. DPOAE-Messung am Vorabend. Es wurde pro Ohr eine Messung durchgeführt, die anschließend mit dem zuvor erhaltenen Ausgangswert verglichen wurde. Abbildung 2.4: Beispiel einer DPOAE-Messung 2.3 Datenanalyse Die Datenanalyse und die Erstellung der Grafiken erfolgte mit Microsoft Excel 2011. 41 3 Ergebnisse 3.1 Gruppen Die 39 Patienten, die an der Studie teilnahmen, wurden im Zuge der Auswertung in 2 Gruppen eingeteilt. 26 Patienten wiesen einen Apnoe-Hypopnoe-Index ≥ 5 auf und wurden als OSAS-Gruppe zusammengefasst. In der NOSAS (NonOSAS)-Gruppe befinden sich 13 Patienten mit einem gemessenen AHI < 5, bei welchen sich keine schlafbezogene Atmungsstörung diagnostizieren ließ. Insgesamt nahmen 13 Frauen und 26 Männer an der Studie teil, wovon der OSASGruppe 7 Frauen und 19 Männer angehörten. Abbildung 3.1: Geschlechterverteilung Die Probanden in der OSAS-Gruppe waren zum Untersuchungszeitpunkt zwischen 22 und 75 Jahre alt (im Durchschnitt 54,8 Jahre), die der NOSAS-Gruppe waren im Alter von 19 bis 73 Jahre (im Durchschnitt 51,5 Jahre). 42 Abbildung 3.2: Altersverteilung Der AHI variierte in der OSAS-Gruppe von 5,1 bis hin zu 77,1 (im Schnitt 29,74), in der NOSAS-Gruppe zwischen 0 und 4,7 (im Schnitt 2,16). Abbildung 3.3: Apnoe-Hypopnoe-Index in der OSAS-Gruppe Die niedrigste Sauerstoffsättigung, die vor der 2.DPOAE-Messung detektierbar war, betrug in der OSAS-Gruppe zwischen 88,9% und 52% (im Schnitt 77,1%), in der NOSAS-Gruppe zwischen 95,5% und 81,9% (im Schnitt 89,5%). 43 Abbildung 3.4: Geringste Sauerstoffsättigung in der OSAS-Gruppe 3.2 DPOAE-Messungen Insgesamt wurden in der OSAS-Gruppe bei 52 Ohren DPOAE-Messungen durchgeführt, wobei die Ergebnisse bei 41 Ohren (21 rechts, 20 links) verwertbar waren. In der NOSAS-Gruppe waren bei einer Anzahl von insgesamt 26 Ohren die Messungen an 25 Ohren (12 rechts, 13 links) zur Auswertung heranziehbar. Es wurden pro Patient jeweils 3 Messungen pro Ohr am Tag bei guter Sauerstoffsättigung (deren Mittelwert wird zusammengefasst unter OSAS bzw. NOSAS Tag) und 1 Messung in der Nacht (OSAS bzw. NOSAS Nacht) durchgeführt. Abbildung 3.5: Verwertbare Ohren beider Gruppen in Prozent Insgesamt wurden 2730 DPOAE-Messungen durchgeführt. Von den detektierbaren Werten wiesen 927 eine SNR von ≤ 6 auf. Nachdem mit der Frequenz 8 kHz zu wenig 44 DPOAE-Werte (7 in der OSAS- und 16 in der NOSAS-Gruppe) messbar waren, wurden sie in der Auswertung nicht berücksichtigt. Dementsprechend konnten von insgesamt 2340 Messungen 904 DPOAE-Werte (38,6%) für die Auswertung herangezogen werden. (36,3% in der OSAS- und 43,2% in der NOSAS-Gruppe) Abbildung 3.6: DPOAE-Messungen der OSAS-Gruppe Abbildung 3.7: DPOAE-Messungen der NOSAS-Gruppe 3.2.1 Störgeräusche Die Störgeräusche, die bei jeder Messung in db SPL registriert wurden, dienten dazu, die SNR zu ermitteln. In der Frequenz 1 kHz wurde bei den Nacht-Messungen der OSAS-Gruppe ein höherer Schalldruckpegel gemessen als bei der NOSAS-Gruppe (im Durchschnitt um 2,75 db SPL mehr). In der Frequenz 1,4 kHz war der Unterschied 45 zwischen den Störgeräusch-Schalldruckpegeln der Nacht-Messungen zwischen den beiden Gruppen am größten (im Durchschnitt bei der OSAS-Gruppe um 6,25 db mehr als bei der NOSAS-Gruppe). Bei den Tag-Messungen gab es keine bedeutenden Unterschiede zwischen den beiden Gruppen in diesen Frequenzen. Die Schalldruckpegel der Störgeräusche in den Frequenzen 2, 2.8, 4 und 6 kHz waren jeweils zwischen beiden Gruppen bei den Nacht- und Tag-Messungen annähernd gleich. Somit kann man die Untersuchungsbedingungen und die Vergleichbarkeit zwischen den einzelnen Messungen tagsüber in allen Frequenzen und nachts zumindest in den Frequenzen 2, 2.8, 4 sowie 6 kHz als sehr gut bezeichnen. Abbildung 3.8: Störgeräusche während den Messungen Unter OSAS bzw. NOSAS Tag sind die Störgeräusche aller 3 Vormessungen an allen Patienten an beiden Ohren zusammengefasst und gemittelt. OSAS bzw. NOSAS Nacht stellt den Mittelwert der Störgeräusche aller Messungen nachts für alle Ohren dar. 46 3.2.2 OSAS-Gruppe In der OSAS-Gruppe wurden die gemessenen Ausgangswerte am Tag mit den Werten in der Nacht für die gesamte Gruppe verglichen. Bei 1 kHz kommt es zu einem Anstieg der DPOAE-Werte nachts im Vergleich zum Tag um +2,09 db, bei 1,4 kHz um +2,2 db und bei 2 kHz um +1,51 db. Bei den Frequenzen 2,8 und 4 kHz blieben die DPOAEWerte annähernd gleich (-0,36 db bei 2,8 kHz und -0,08 db bei 4 kHz). Bei 6 kHz ergibt sich ein Absinken der DPOAE-Werte in der Nacht um -5,65 db. Abbildung 3.9: Vergleich der Tag- und Nacht-Messungen in der OSAS-Gruppe 47 3.2.3 NOSAS-Gruppe In der NOSAS-Gruppe wurden ebenfalls die Ausgangswerte tagsüber mit den Werten in der Nacht für die gesamte Gruppe verglichen. Dabei ergeben sich bei 1 kHz annähernd gleiche DPOAE-Werte (Absinken der Nacht-Werte um -0,48 db), bei 1,4 kHz ist ein Absinken um -1,5 db zu beobachten, in den Frequenzen 2, 2.8 und 4 kHz bleiben die Werte annähernd gleich (+0,06 db bei 2 kHz, +0,08 db bei 2,8 kHz und +0,23 db bei 4 kHz). Bei 6 kHz kommt es zu einem Anstieg der Nacht-Werte um +1,48. Abbildung 3.10: Vergleich der Tag- und Nacht-Messungen in der NOSAS-Gruppe 48 3.2.4 Vergleich beider Gruppen Wenn man die mittleren Ausgangswerte tagsüber beider Gruppen vergleicht, sind die DPOAE-Werte in 4 Frequenzen annähernd gleich (bei 1 kHz OSAS +0,03 db, bei 1,4 kHz OSAS -0,73 db, bei 2,8 kHz OSAS +0,61 db und bei 6 kHz OSAS +0,24 db). Bei 2 kHz sind die Werte der NOSAS-Gruppe im Durchschnitt um 1,89 db niedriger als bei der OSAS-Gruppe. Zu bemerken ist der um 3,66 db niedrigere Ausgangswert bei 4 kHz in der OSAS-Gruppe. Abbildung 3.11: Vergleich der Ausgangswerte beider Gruppen Beim Vergleich der mittleren Nacht-Werte zwischen beiden Gruppen ergeben sich bei der OSAS-Gruppe in den niedrigen Frequenzen höhere DPOAE-Werte als in der NOSAS-Gruppe (bei 1 kHz +2,6 db, bei 1,4 kHz +2,97 db und bei 2 kHz +3,34 db). Bei 2,8 kHz sind die DPOAE-Werte der beiden Gruppen wieder annähernd gleich (OSAS +0,17 db). Festzustellen ist nun auch nachts ein im Vergleich zur NOSASGruppe erniedrigter DPOAE-Mittelwert bei 4 kHz in der OSAS-Gruppe von -3,97 db. Bei 6 kHz ergibt sich der größte Unterschied zwischen den DPOAE-Mittelwerten beider Gruppen (OSAS -6,89 db). Abbildung 3.13 vermittelt eine Übersicht über die gesamten DPOAE-Mittelwerte beider Gruppen. 49 Abbildung 3.12: Vergleich der Nacht-Werte beider Gruppen Abbildung 3.13: Vergleich aller DPOAE-Mittelwerte 50 4 Diskussion Die Fragestellung der Studie war, inwiefern sich die Distorsionsprodukte otoakustischer Emissionen unter rezidivierenden Sauerstoffentsättigungen ausgelöst durch das obstruktive Schlafapnoesyndrom verändern. Die Erwartungshaltung lag in einem nächtlichen Absinken der DPOAE im Vergleich zu den Ausgangswerten bei den OSASPatienten ähnlich wie Olzowy et al. schon im Tiermodell beobachteten. (Olzowy et al., 2008b) Wenn man das Patientenkollektiv betrachtet, ergeben sich folgende Punkte: Bezüglich der Gruppengröße umfasst die NOSAS-Gruppe um 50% weniger Probanden als die OSAS-Gruppe. Dies schränkt die Vergleichbarkeit zwischen den beiden Gruppen etwas ein. Wenn man den Altersschnitt betrachtet (54,8 Jahre in der OSASbzw. 51,5 Jahre in der NOSAS-Gruppe) sind die Probanden beider Gruppen gut miteinander zu vergleichen. Betrachtet man die Geschlechterverteilung, so finden sich in der OSAS-Gruppe bedeutend mehr Männer als Frauen (Verhältnis: 2,7:1), während das Verhältnis in der NOSAS-Gruppe ausgeglichen ist. Diese Beobachtung lässt sich sehr gut mit der Studie von Young et al. vereinbaren, in der sich auch eine etwa doppelt so hohe Prävalenz der Krankheit für Männer ergab. (Young et al., 1993) Das Verhältnis von gültigen zu insgesamt möglichen Messungen ist in beiden Gruppen nicht hoch, in der NOSAS-Gruppe jedoch mit 43,2% verglichen mit der OSASGruppe (36,3%) doch höher. Das schlechte Verhältnis könnte auf den Altersdurchschnitt von insgesamt 53,2 Jahren zurückzuführen sein. Dass es in der OSAS-Gruppe vergleichsweise weniger valide Messungen gegeben hat könnte auch daran liegen, dass insgesamt die Funktion der äußeren Haarzellen durch die Schlafapnoen/ -hypopnoen beeinträchtigter sein könnte. Bei den Messungen der DPOAE-Werte fielen vor allem zwei Ergebnisse auf: • Bei 4 kHz konnte man einen um im Mittel 3,66 db niedrigeren Ausgangswert in der OSAS-Gruppe als in der NOSAS-Gruppe beobachten, der sich nachts nicht weiter veränderte. • Bei 6 kHz erfolgte ein Absinken der mittleren DPOAE-Werte nachts um -5,65 db im Vergleich zu den Ausgangswerten tagsüber in der OSAS-Gruppe. 51 Den Ergebnissen einer Studie von Wagner et al. zufolge kann man Veränderungen der DPOAE in den Frequenzen 1-5 kHz um mehr als 3,1 db, sowie bei 6 kHz um mehr als 3,7 db bei Anwendung des multiple-fit-mode als signifikant bezeichnen. (Wagner et al., 2008) Das nächtliche Absinken der Werte von -5,65 db bei 6 kHz in der OSAS-Gruppe ist demnach als aussagekräftig zu betrachten. Schädigungen im Innenohr betreffen als erstes am ehesten die Basalwindung der Schnecke. Bei Hörschädigungen verursacht durch Lärm oder durch ototoxische Substanzen ist die Funktion der äußeren Haarzellen dieser Region als erstes beeinträchtigt. (Ganz & Jahnke, 1996) Entsprechend des Prinzips der Frequenzdispersion finden sich hier Frequenzen von 4-6 kHz und höher. Su-Hua Sha et al. postulierten, dass bei Meerschweinchen die basale Schneckenwindung gegenüber Traumata am empfindlichsten ist und führten dies auf die hohe Empfindlichkeit der äußeren Haarzellen dieses Bereiches auf reaktive Sauerstoffspezies zurück. Dies wiederum könnte darauf zurückzuführen sein, dass in den apikalen Haarzellen eine höhere Konzentration des Antioxidans Glutathion anzufinden ist. (Sha et al., 2001) Die ROS, die unter hypoxischen Bedingungen, wie bei OSAS-Patienten nach Apnoen bzw. Hypopnoen entstehen, könnten temporäre Schäden an den äußeren Haarzellen im basalen Bereich verursachen, die sich in einem Abfall der DPOAE-Werte im höheren Frequenzbereich bemerkbar machen. Dies könnte das Absinken der Messwerte nachts bei 6 kHz in der OSAS-Gruppe erklären. Dyugovskaya et al. und Yamauchi et al. beobachteten dementsprechend eine vermehrte Bildung von reaktiven Sauerstoffspezies nach Apnoen/ Hypopnoen bei OSAS-Patienten. (Dyugovskaya et al., 2002; Yamauchi et al., 2005) Zum Vergleich veränderten sich die DPOAE-Werte bei der NOSAS-Gruppe gegenüber der Tag-Messung nachts nicht bemerkenswert, was wiederum oben erwähnte Theorie bekräftigt. Die im Vergleich zur NOSAS-Gruppe erniedrigten Tag- sowie auch Nacht-Werte der OSAS-Patienten bei 4 kHz könnten auf eine persistierende Haarzellschädigung in diesem Bereich durch die vermehrte Bildung von ROS unter hypoxischen Bedingungen zurückzuführen sein. In der oben erwähnten Studie an Bergsteigern kam es unter hypoxischen Verhältnissen ebenso vor allem im Bereich von 4 kHz zu einem Absinken der DPOAE-Werte. (Olzowy et al., 2008a) Jedoch konnte in der Nacht-Messung der OSASGruppe im Vergleich zu den Ausgangswerten kein weiteres Absinken der DPOAE-Werte beobachtet werden. Dass die DPOAE-Werte in der OSAS-Gruppe nachts bei 1, 1.4 und 2 kHz nicht absanken, sondern im Gegenteil sogar etwas anstiegen, war im Vorfeld nicht zu erwarten. Dennoch könnte sich das Nicht-Absinken der Werte auch dadurch erklären lassen, dass zuerst die Haarzellen der basalen Schneckenwindung von einer Schädigung betroffen sind und die Sinneszellen an den tiefen Frequenzen im apikalen Bereich ungeschädigt 52 bleiben. Limitationen der Studie umfassen einerseits eine relativ niedrige Anzahl an validen DPOAE-Messwerten, andererseits erfolgten die Messungen nachts zu definierten Zeitpunkten und nicht exakt nach rezidivierenden Sauerstoffentsättigungen. Mit einer derartigen Vorgehensweise könnte man die Ergebnisse eindeutiger mit den hypoxischen Phasen in ursächliche Verbindung bringen. Da die Studienergebnisse zu einem großen Teil mit den erwarteten Ergebnissen korrelieren, wäre die Durchführung größer angelegter Studien mit eventuellen NachtMessungen direkt nach den Sauerstoffentsättigungen empfehlenswert. 53 Literaturverzeichnis Alvarez-Sala, R., Diaz, S., Prados, C., Villasante, C., & Villamor, J. (1992). Increase of intraocular pressure during nasal CPAP. Chest, 101(5), 1477. American Academy of Sleep Medicine, . (2005). The international classification of sleep disorders: diagnostic and coding manual. Anastassov, G. & Trieger, N. (1998). Edema in the upper airway in patients with obstructive sleep apnea syndrome. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology, 86(6), 644–647. Arias, M., Garcia-Rio, F., Alonso-Fernandez, A., Martinez, I., & Villamor, J. (2006). Pulmonary hypertension in obstructive sleep apnoea: effects of continuous positive airway pressure. European Heart Journal, 27(9), 1106–1113. Arnulf, I., Homeyer, P., Garma, L., Whitelaw, W., & Derenne, J. (1997). Modafinil in obstructive sleep apnea-hypopnea syndrome: a pilot study in 6 patients. Respiration, 64(2), 159–161. Arzt, M., Young, T., Finn, L., Skatrud, J., & Bradley, T. (2005). Association of sleepdisordered breathing and the occurrence of stroke. American journal of respiratory and critical care medicine, 172(11), 1447–1451. Axelsson, A. (1968). The vascular anatomy of the cochlea in the guinea pig and in man. Acta oto-laryngologica, Suppl 243:3. Babu, A., Herdegen, J., Fogelfeld, L., Shott, S., & Mazzone, T. (2005). Type 2 diabetes, glycemic control, and continuous positive airway pressure in obstructive sleep apnea. Archives of internal medicine, 165(4), 447–452. Berrocal, J. & Ramirez-Camacho, R. (2002). Sudden sensorineural hearing loss: supporting the immunologic theory. The Annals of otology, rhinology, and laryngology, 111(11), 989–997. 54 Bixler, E., Vgontzas, A., Ten, H., et al. (1998). Effects of age on sleep apnea in men. I. Prevalence and severity. American journal of respiratory and critical care medicine, 157(1), 144–148. Boege, P. & Janssen, T. (2002). Pure-tone threshold estimation from extrapolated distortion product otoacoustic emission I/O-functions in normal and cochlear hearing loss ears. The Journal of the Acoustical Society of America, 111, 1810–1818. Boenninghaus, H. & Lenarz, T. (2007). Hals-Nasen-Ohren-Heilkunde. Springer. Bokinsky, G., Miller, M., Ault, K., Husband, P., & Mitchell, J. (1995). Spontaneous platelet activation and aggregation during obstructive sleep apnea and its response to therapy with nasal continuous positive airway pressure. Chest, 108(3), 625–630. Brama, I. & Fainaru, M. (1980). Inner ear involvement in Behçet’s disease. Archives of Otolaryngology- Head and Neck Surgery, 106(4), 215–217. Brooks, B., Cistulli, P., Borkman, M., Ross, G., McGhee, S., Grunstein, R., Sullivan, C., & Yue, D. (1994). Obstructive sleep apnea in obese noninsulin-dependent diabetic patients: effect of continuous positive airway pressure treatment on insulin responsiveness. Journal of Clinical Endocrinology & Metabolism, 79(6), 1681–1685. Brown, A., McDowell, B., & Forge, A. (1989). Acoustic distortion products can be used to monitor the effects of chronic gentamicin treatment. Hearing research, 42(2-3), 143–156. Brownell, W. (1990). Outer hair cell electromotility and otoacoustic emissions. Ear and Hearing, 11(2), 82–92. Byl, F. (1977). Seventy-six cases of presumed sudden hearing loss occurring in 1973: Prognosis and incidence. The Laryngoscope, 87(5), 817–825. Carlson, J., Hedner, J., Elam, M., Ejnell, H., Sellgren, J., & Wallin, B. (1993). Augmented resting sympathetic activity in awake patients with obstructive sleep apnea. Chest, 103(6), 1763–1768. Chakravarthy, U. & Gardiner, T. (1999). Endothelium-derived agents in pericyte function/dysfunction. Progress in retinal and eye research, 18(4), 511–527. Davis, A. (1989). The prevalence of hearing impairment and reported hearing disability among adults in Great Britain. International Journal of Epidemiology, 18(4), 911– 917. 55 de Burgh Daly, M., Angell-James, J., & Elsner, R. (1979). Role of carotid-body chemoreceptors and their reflex interactions in bradycardia and cardiac arrest. The Lancet, 313, 764–767. Drager, L., Bortolotto, L., Lorenzi, M., Figueiredo, A., Krieger, E., & Lorenzi-Filho, G. (2005). Early signs of atherosclerosis in obstructive sleep apnea. American journal of respiratory and critical care medicine, 172(5), 613–618. Drenckhahn, D. (2004). Anatomie, makroskopische Anatomie, Embryologie und Histologie des Menschen: Band 2: Herz-Kreislauf-System, lymphatisches System, endokrine Druesen, Nervensystem, Sinnesorgane, Haut. Elsevier, Urban&FischerVerlag. Duran, J., Esnaola, S., Rubio, R., & Iztueta, A. (2001). Obstructive sleep apneahypopnea and related clinical features in a population-based sample of subjects aged 30 to 70 yr. American journal of respiratory and critical care medicine, 163(3), 685–689. Dyugovskaya, L., Lavie, P., & Lavie, L. (2002). Increased adhesion molecules expression and production of reactive oxygen species in leukocytes of sleep apnea patients. American journal of respiratory and critical care medicine, 165(7), 934–939. Eisensehr, I., Ehrenberg, B., Noachtar, S., Korbett, K., Byrne, A., McAuley, A., & Palabrica, T. (1998). Platelet activation, epinephrine, and blood pressure in obstructive sleep apnea syndrome. Neurology, 51(1), 188–195. Evans, P. & Halliwell, B. (1999). Free radicals and hearing: cause, consequence, and criteria. Annals of the New York Academy of Sciences, 884, 19–40. Fanghaenel, J. & Waldeyer, A. (2003). Waldeyer Anatomie des Menschen. Walter De Gruyter Inc. Fietze, I., Ziegert, D., Diefenbach, K., Blau, A., & Glos, M. (2004). Schlafstruktur bei OSAS-Patienten in Abhaengigkeit vom Ausmass der naechtlichen Atmungsstoerung. Somnologie, 8(3), 75–82. Franklin, D., McCoy, M., Martin, G., & Lonsbury-Martin, B. (1992). Test/Retest Reliability of Distortion-Product: and Transiently Evoked Otoacoustic: Emissions. Ear and hearing, 13(6), 417–429. Fukuda, S., Chida, E., Kuroda, T., Kashiwamura, M., & Inuyama, Y. (2001). An antimumps IgM antibody level in the serum of idiopathic sudden sensorineural hearing loss. Auris Nasus Larynx, 28, 3–5. 56 Ganz, H. & Jahnke, V. (1996). Hals-Nasen-Ohren-Heilkunde. Walter de Gruyter. Gaskill, S. & Brown, A. (1990). The behavior of the acoustic distortion product, 2f1f2, from the human ear and its relation to auditory sensitivity. The Journal of the Acoustical Society of America, 88, 821–839. Geiser, T., Buck, F., Meyer, B., Bassetti, C., Haeberli, A., & Gugger, M. (2000). In vivo platelet activation is increased during sleep in patients with obstructive sleep apnea syndrome. Respiration, 69(3), 229–234. George, C., Nickerson, P., Hanly, P., Millar, T., & Kryger, M. (1987). Sleep apnoea patients have more automobile accidents. Lancet, 2(8556), 447. Gross, J. (2005). Molekulare Grundlagen von Hypoxie und Asphyxie. Molekularmedizinische Grundlagen von fetalen und neonatalen Erkrankungen, 6, 573–605. Grote, L., Ploch, T., Heitmann, J., Knaack, L., Penzel, T., & Peter, J. (1999). Sleeprelated breathing disorder is an independent risk factor for systemic hypertension. American journal of respiratory and critical care medicine, 160(6), 1875–1882. Grunstein, R., Ho, K., & Sullivan, C. (1991). Sleep apnea in acromegaly. Annals of Internal Medicine, 115(7), 527–532. Hader, C., Sanner, B., & Rasche, K. (2004). Das obstruktive Schlafapnoe-SyndromDiagnostik. Dtsch Med Wochenschr, 129, 566–569. Hall, S., McGuigan, J., & Rocks, M. (1991). Red blood cell deformability in sudden sensorineural deafness: another aetiology? Clinical Otolaryngology & Allied Sciences, 16(1), 3–7. Halliwell, B. (1993). The role of oxygen radicals in human disease, with particular reference to the vascular system. Pathophysiology of Haemostasis and Thrombosis, 23(1), 118–126. Harbison, J., O Reilly, P., & McNicholas, W. (2000). Cardiac Rhythm Disturbances in the Obstructive Sleep Apnea Syndrome. Chest, 118(3), 591–595. Harris, F., Lonsbury-Martin, B., Stagner, B., Coats, A., & Martin, G. (1989). Acoustic distortion products in humans: Systematic changes in amplitude as a function of f/f ratio. The Journal of the Acoustical Society of America, 85, 220–229. 57 Hla, K., Young, T., Bidwell, T., Palta, M., Skatrud, J., & Dempsey, J. (1994). Sleep apnea and hypertension: a population-based study. Annals of internal medicine, 120(5), 382–388. Hoistad, D., Schachern, P., & Paparella, M. (1998). Autoimmune sensorineural hearing loss: A human temporal bone study 1. American journal of otolaryngology, 19(1), 33–39. Horner, R., Mohiaddin, R., Lowell, D., Shea, S., Burman, E., Longmore, D., & Guz, A. (1989). Sites and sizes of fat deposits around the pharynx in obese patients with obstructive sleep apnoea and weight matched controls. European Respiratory Journal, 2(7), 613–622. Ip, M., Lam, B., Chan, L., Zheng, L., Tsang, K., Fung, P., & Lam, W. (2000a). Circulating nitric oxide is suppressed in obstructive sleep apnea and is reversed by nasal continuous positive airway pressure. American journal of respiratory and critical care medicine, 162(6), 2166–2171. Ip, M., Lam, B., Ng, M., Lam, W., Tsang, K., & Lam, K. (2002). Obstructive sleep apnea is independently associated with insulin resistance. American journal of respiratory and critical care medicine, 165(5), 670–676. Ip, M., Lam, K., Ho, C., Tsang, K., & Lam, W. (2000b). Serum Leptin and Vascular Risk Factors in Obstructive Sleep Apnea. Chest, 118(3), 580–586. Ip, M., Tse, H., Lam, B., Tsang, K., & Lam, W. (2004). Endothelial function in obstructive sleep apnea and response to treatment. American journal of respiratory and critical care medicine, 169, 348–353. Janssen, T. (2005). Diagnostik des kochleaeren Verstaerkers mit DPOAEWachstumsfunktionen. HNO, 53(2), 121–133. Janssen, T., Gehr, D., Klein, A., & Mueller, J. (2005). Distortion product otoacoustic emissions for hearing threshold estimation and differentiation between middle-ear and cochlear disorders in neonates. The Journal of the Acoustical Society of America, 117, 2969–2979. Janssen, T., Klein, A., & Gehr, D. (2003). Automatisierte Hoerschwellenbestimmung bei Neugeborenen mit extrapolierten DPOAE-Wachstumsfunktionen. HNO, 51(12), 971–980. 58 Janssen, T., Kummer, P., & Arnold, W. (1995a). Wachstumsverhalten der Distorsionsproduktemissionen bei kochleaeren Hoerstoerungen. Oto-Rhino-Laryngologia Nova, 5(1), 34–46. Janssen, T., Kummer, P., & Arnold, W. (1995b). Wachstumsverhalten der Distorsionsproduktemissionen bei normaler Hoerfunktion. Oto-Rhino-Laryngologia Nova, 5(5), 211–221. Jiang, Z., Zhang, Z., & Wilkinson, A. (2005). Distortion product otoacoustic emissions in term infants after hypoxia-ischaemia. European journal of pediatrics, 164(2), 84– 87. Kashyap, R., Hock, L., & Bowman, T. (2001). Higher prevalence of smoking in patients diagnosed as having obstructive sleep apnea. Sleep and Breathing, 5(4), 167–172. Kato, M., Roberts-Thomson, P., Phillips, B., Haynes, W., Winnicki, M., Accurso, V., & Somers, V. (2000). Impairment of endothelium-dependent vasodilation of resistance vessels in patients with obstructive sleep apnea. Circulation, 102(21), 2607–2610. Kemp, D. (1978). Stimulated acoustic emissions from within the human auditory system. The Journal of the Acoustical Society of America, 64, 1386–1391. Kemp, D. (1979). Evidence of mechanical nonlinearity and frequency selective wave amplification in the cochlea. European Archives of Oto-Rhino-Laryngology, 224(1), 37–45. Kemp, D. (1981). Physiologically active cochlear micromechanics–one source of tinnitus. In Ciba Foundation Symposium, volume 85 (pp. 54–81). Kemp, D., Bray, P., Alexander, L., & Brown, A. (1986). Acoustic emission cochleography–practical aspects. Scandinavian audiology. Supplementum, 25, 71–95. Kemp, D., Ryan, S., & Bray, P. (1990). A guide to the effective use of otoacoustic emissions. Ear and Hearing, 11(2), 93–105. Kim, D. (1986). Active and nonlinear cochlear biomechanics and the role of outerhair-cell subsystem in the mammalian auditory system. Hearing Research, 22(1-3), 105–114. Klemm, E., Deutscher, A., & Moesges, R. (2009). Aktuelle Stichprobe zur Epidemiologie des idiopathischen Hoersturzes. Laryngo-, Rhino-, Otologie, 88(08), 524–527. 59 Klinke, R., Pape, H., & Silbernagl, S. (2005). Physiologie. Thieme. Kobayashi, H., Suzuki, A., & Nomura, Y. (1994). Unilateral hearing loss following rubella infection in an adult. Acta Oto-Laryngologica, 114, 49–51. Koehler, U., Fus, E., Grimm, W., Pankow, W., Schafer, H., Stammnitz, A., & Peter, J. (1998). Heart block in patients with obstructive sleep apnoea: pathogenetic factors and effects of treatment. European Respiratory Journal, 11(2), 434–439. Koide, J., Yanagita, N., Hondo, R., & Kurata, T. (1988). Serological and clinical study of herpes simplex virus infection in patients with sudden deafness. Acta OtoLaryngologica, 105, 21–26. Kopke, R., Allen, K., Henderson, D., Hoffer, M., Frenz, D., & van de Water, T. (1999). A radical demise: toxins and trauma share common pathways in hair cell death. Annals of the New York Academy of Sciences, 884(1), 171–191. Kribbs, N., Pack, A., Kline, L., Smith, P., Schwartz, A., Schubert, N., Redline, S., Henry, J., Getsy, J., & Dinges, D. (1993). Objective measurement of patterns of nasal CPAP use by patients with obstructive sleep apnea. The American review of respiratory disease, 147(4), 887–895. Kummer, P., Janssen, T., & Arnold, W. (1995). Suppression tuning characteristics of the 2 f- f distortion-product otoacoustic emission in humans. The Journal of the Acoustical Society of America, 98, 197–210. Kummer, P., Janssen, T., Hulin, P., & Arnold, W. (2000). Optimal L1-L2 primary tone level separation remains independent of test frequency in humans. Hearing Research, 146(1-2), 47–56. Lavie, P., Herer, P., & Hoffstein, V. (2000). Obstructive sleep apnoea syndrome as a risk factor for hypertension: population study. British Medical Journal, 320(7233), 479–482. Linssen, O. & Schultz-Coulon, H. (1997). Prognostische Kriterien beim Hoersturz. HNO, 45(1), 22–29. Loffredo, L., Parrotto, S., & Violi, F. (2004). Giant cell arteritis, oculomotor nerve palsy, and acute hearing loss. Scandinavian journal of rheumatology, 33(4), 279–280. Lonsbury-Martin, B., Harris, F., Stagner, B., Hawkins, M., & Martin, G. (1990). Distortion product emissions in humans. II. Relations to acoustic immittance and stimulus 60 frequency and spontaneous otoacoustic emissions in normally hearing subjects. The Annals of otology, rhinology & laryngology. Supplement, 147, 15–29. Lonsbury-Martin, B. & Martin, G. (1990). The clinical utility of distortion-product otoacoustic emissions. Ear and hearing, 11(2), 144–154. Lonsbury-Martin, B., Whitehead, M., & Martin, G. (1991). Clinical applications of otoacoustic emissions. Journal of Speech and Hearing Research, 34(5), 964–981. Lowe, A. (2000). The durability of intraoral devices for snoring and sleep apnea: another view. Journal-Canadian Dental Association, 66(9), 486–487. Marcus, C., Keens, T., Bautista, D., von Pechmann, W., & Ward, S. (1991). Obstructive sleep apnea in children with Down syndrome. Pediatrics, 88(1), 132–139. Marrone, O., Riccobono, L., Salvaggio, A., Mirabella, A., Bonanno, A., & Bonsignore, M. (1993). Catecholamines and blood pressure in obstructive sleep apnea syndrome. Chest, 103(3), 722–727. Martin, G., Jassir, D., Stagner, B., Whitehead, M., & Lonsbury-Martin, B. (1998). Locus of generation for the 2 f1- f2 vs 2 f2- f1 distortion-product otoacoustic emissions in normal-hearing humans revealed by suppression tuning, onset latencies, and amplitude correlations. The Journal of the Acoustical Society of America, 103, 1957– 1971. Martin, G., Ohlms, L., Franklin, D., Harris, F., & Lonsbury-Martin, B. (1990). Distortion product emissions in humans. III. Influence of sensorineural hearing loss. The Annals of otology, rhinology & laryngology. Supplement, 147, 30–42. Martinez-Garcia, M., Galiano-Blancart, R., Roman-Sanchez, P., Soler-Cataluna, J., Cabero-Salt, L., & Salcedo-Maiques, E. (2005). Continuous Positive Airway Pressure Treatment in Sleep Apnea Prevents New Vascular Events After Ischemic Stroke. Chest, 128(4), 2123–2129. Mattox, D. & Simmons, F. (1977). Natural history of sudden sensorineural hearing loss. The Annals of otology, rhinology, and laryngology, 86, 463–80. Mazelova, J., Popelar, J., & Syka, J. (2003). Auditory function in presbycusis: peripheral vs. central changes. Experimental gerontology, 38(1-2), 87–94. Mazurek, B., Haupt, H., & Gross, J. (2006). Pharmakotherapie des akuten Tinnitus. HNO, 54(1), 9–15. 61 Mazzoni, A. (1990). The vascular anatomy of the vestibular labyrinth in man. Acta Oto-Laryngologica, 110, 1–83. McCord, J. (2000). The evolution of free radicals and oxidative stress. The American journal of medicine, 108(8), 652–659. McEvoy, R., Sharp, D., & Thornton, A. (1986). The effects of posture on obstructive sleep apnea. The American review of respiratory disease, 133(4), 662–666. Mentel, R., Kaftan, H., Wegner, U., Reissmann, A., & Guertler, L. (2004). Are enterovirus infections a co-factor in sudden hearing loss? Journal of medical virology, 72(4), 625–629. Mezzanotte, W., Tangel, D., & White, D. (1996). Influence of sleep onset on upperairway muscle activity in apnea patients versus normal controls. American journal of respiratory and critical care medicine, 153(6), 1880–1887. Minoguchi, K., Tazaki, T., Yokoe, T., Minoguchi, H., Watanabe, Y., Yamamoto, M., & Adachi, M. (2004). Elevated Production of Tumor Necrosis Factor-α by Monocytes in Patients With Obstructive Sleep Apnea Syndrome. Chest, 126(5), 1473–1479. Naarendorp, M. & Spiera, H. (1998). Sudden sensorineural hearing loss in patients with systemic lupus erythematosus or lupus-like syndromes and antiphospholipid antibodies. Journal of rheumatology, 25(3), 589–592. Nakamura, M., Whitlock, G., Aoki, N., Nakashima, T., Hoshino, T., Yokoyama, T., Morioka, S., Kawamura, T., Tanaka, H., Hashimoto, T., et al. (2001). Japanese and Western diet and risk of idiopathic sudden deafness: a case-control study using pooled controls. International journal of epidemiology, 30(3), 608–615. Nakashima, T., Naganawa, S., Sone, M., Tominaga, M., Hayashi, H., Yamamoto, H., Liu, X., & Nuttall, A. (2003). Disorders of cochlear blood flow. Brain Research Reviews, 43(1), 17–28. Narkiewicz, K., van de Borne, P., Pesek, C., Dyken, M., Montano, N., & Somers, V. (1999). Selective potentiation of peripheral chemoreflex sensitivity in obstructive sleep apnea. Circulation, 99(9), 1183–1189. Nelson, D. & Kimberley, B. (1992). Distortion-product emissions and auditory sensitivity in human ears with normal hearing and cochlear hearing loss. Journal of speech and hearing research, 35(5), 1142–1159. 62 Nobilia, L., Schiavia, G., Bozanoa, E., De Carlib, F., Ferrilloa, F., & Nobilic, F. (2000). Morning increase of whole blood viscosity in obstructive sleep apnea syndrome. Clinical hemorheology and microcirculation, 22(1), 21–27. Nosrati-Zarenoe, R., Arlinger, S., & Hultcrantz, E. (2007). Idiopathic sudden sensorineural hearing loss: results drawn from the Swedish national database. Acta oto-laryngologica, 127(11), 1168–1175. Oezuenlue, A., Mus, N., & Guelhan, M. (1998). Multiple sclerosis: a cause of sudden hearing loss. International Journal of Audiology, 37(1), 52–58. Oh, J., Park, K., Lee, S., Shin, Y., & Choung, Y. (2007). Bilateral versus unilateral sudden sensorineural hearing loss. Otolaryngology-Head and Neck Surgery, 136(1), 87–91. Ohga, E., Nagase, T., Tomita, T., Teramoto, S., Matsuse, T., Katayama, H., & Ouchi, Y. (1999). Increased levels of circulating ICAM-1, VCAM-1, and L-selectin in obstructive sleep apnea syndrome. Journal of applied physiology, 87(1), 10–14. Ohlms, L., Lonsbury-Martin, B., & Martin, G. (1991). Acoustic-distortion products: separation of sensory from neural dysfunction in sensorineural hearing loss in human beings and rabbits. Otolaryngology–head and neck surgery: official journal of American Academy of Otolaryngology-Head and Neck Surgery, 104(2), 159–174. Oldstone, M. (1989). Virus-induced autoimmunity: molecular mimicry as a route to autoimmune disease. Journal of autoimmunity, 2, 187–194. Oltmanns, K., Gehring, H., Rudolf, S., Schultes, B., Rook, S., Schweiger, U., Born, J., Fehm, H., & Peters, A. (2004). Hypoxia causes glucose intolerance in humans. American journal of respiratory and critical care medicine, 169(11), 1231–1237. Olzowy, B., von Gleichenstein, G., Canis, M., & Mees, K. (2008a). Distortion product otoacoustic emissions for assessment of intracranial hypertension at extreme altitude? European journal of applied physiology, 103(1), 19–23. Olzowy, B., von Gleichenstein, G., Canis, M., Plesnila, N., & Mees, K. (2008b). Complex level alterations of the 2 f 1- f 2 distortion product due to hypoxia in the guinea pig. European Archives of Oto-Rhino-Laryngology, 265(11), 1329–1333. Parati, G., Di Rienzo, M., Bonsignore, M., Insalaco, G., Marrone, O., Castiglioni, P., Bonsignore, G., & Mancia, G. (1997). Autonomic cardiac regulation in obstructive 63 sleep apnea syndrome: evidence from spontaneous baroreflex analysis during sleep. Journal of hypertension, 15(12), 1621–1626. Patel, S. (2005). Shared genetic risk factors for obstructive sleep apnea and obesity. Journal of Applied Physiology, 99(4), 1600–1606. Peker, Y., Carlson, J., & Hedner, J. (2006). Increased incidence of coronary artery disease in sleep apnoea: a long-term follow-up. European Respiratory Journal, 28(3), 596–602. Pepin, J., Leger, P., Veale, D., Langevin, B., Robert, D., & Levy, P. (1995). Side effects of nasal continuous positive airway pressure in sleep apnea syndrome. Chest, 107(2), 375–381. Peppard, P., Young, T., Palta, M., Dempsey, J., & Skatrud, J. (2000a). Longitudinal study of moderate weight change and sleep-disordered breathing. Jama, 284(23), 3015–3021. Peppard, P., Young, T., Palta, M., & Skatrud, J. (2000b). Prospective study of the association between sleep-disordered breathing and hypertension. New England Journal of Medicine, 342(19), 1378–1384. Phillips, B., Narkiewicz, K., Pesek, C., Haynes, W., Dyken, M., & Somers, V. (1999). Effects of obstructive sleep apnea on endothelin-1 and blood pressure. Journal of hypertension, 17(1), 61–66. Platia, E. & Saral, R. (1979). Deafness and Waldenstrom’s macroglobulinemia. Southern Medical Journal, 72(11), 1495–1496. Probst, R., Lonsbury-Martin, B., & Martin, G. (1991). A review of otoacoustic emissions. The Journal of the Acoustical Society of America, 89, 2027–2067. Punjabi, N., Sorkin, J., Katzel, L., Goldberg, A., Schwartz, A., & Smith, P. (2002). Sleep-disordered breathing and insulin resistance in middle-aged and overweight men. American journal of respiratory and critical care medicine, 165(5), 677–682. Rajagopal, K., Abbrecht, P., Derderian, S., Pickett, C., Hofeldt, F., Tellis, C., & Zwillich, C. (1984). Obstructive sleep apnea in hypothyroidism. Annals of internal medicine, 101(4), 491–494. 64 Richards, G., Cistulli, P., Ungar, R., Berthon-Jones, M., & Sullivan, C. (1996). Mouth leak with nasal continuous positive airway pressure increases nasal airway resistance. American journal of respiratory and critical care medicine, 154(1), 182–186. Riley, R., Powell, N., Li, K., & Guilleminault, C. (2000). Surgical therapy for obstructive sleep apnea-hypopnea syndrome. Principles and Practice of Sleep Medicine. Philadelphia, Pa: WB Saunders Co, (pp. 913–928). Ross, R. (1999). Atherosclerosis–an inflammatory disease. The New England journal of medicine, 340(2), 115–126. Ruan, R. (2002). Possible roles of nitric oxide in the physiology and pathophysiology of the mammalian cochlea. Annals of the New York Academy of Sciences, 962, 260–274. Rudack, C., Langer, C., Stoll, W., Rust, S., & Walter, M. (2006). Vascular risk factors in sudden hearing loss. Thrombosis and haemostasis, 95(3), 454–461. Scherer, E., Herzog, M., & Wangemann, P. (2002). Endothelin-1-induced vasospasms of spiral modiolar artery are mediated by rho-kinase-induced Ca2+ sensitization of contractile apparatus and reversed by calcitonin gene-related peptide. Stroke, 33(12), 2965–2971. Schreibstein, J., MacDonald, C., Cox, L., McMahon, L., & Bloom, D. (1997). Sudden hearing loss in sickle cell disease: a case report. Otolaryngology and head and neck surgery, 116(4), 541–544. Schuknecht, H. (1974). Pathology of the Ear. Harvard University Press Cambridge, MA. Schuknecht, H. & Donovan, E. (1986). The pathology of idiopathic sudden sensorineural hearing loss. European Archives of Oto-Rhino-Laryngology, 243(1), 1–15. Schulz, R., Schmidt, D., Blum, A., Lopes-Ribeiro, X., Luecke, C., Mayer, K., Olschewski, H., Seeger, W., & Grimminger, F. (2000). Decreased plasma levels of nitric oxide derivatives in obstructive sleep apnoea: response to CPAP therapy. Thorax, 55(12), 1046–1051. Sha, S., Taylor, R., Forge, A., & Schacht, J. (2001). Differential vulnerability of basal and apical hair cells is based on intrinsic susceptibility to free radicals. Hearing research, 155(1-2), 1–8. 65 Shahar, E., Whitney, C., Redline, S., Lee, E., Newman, A., Javier, N., et al. (2001). Sleep-disordered breathing and cardiovascular disease. Cross-sectional results of the Sleep Heart Health Study. American journal of respiratory and critical care medicine, 163(1), 19–25. Shamsuzzaman, A., Winnicki, M., Lanfranchi, P., Wolk, R., Kara, T., Accurso, V., & Somers, V. (2002). Elevated C-reactive protein in patients with obstructive sleep apnea. Circulation, 105(21), 2462–2464. Shelton, K., Woodson, H., Gay, S., & Suratt, P. (1993). Pharyngeal fat in obstructive sleep apnea. The American review of respiratory disease, 148(2), 462–466. Sher, A., Schechtman, K., & Piccirillo, J. (1996). The efficacy of surgical modifications of the upper airway in adults with obstructive sleep apnea syndrome. Sleep, 19(2), 156–177. Shera, C. & Guinan Jr, J. (1999). Evoked otoacoustic emissions arise by two fundamentally different mechanisms: a taxonomy for mammalian OAEs. The Journal of the Acoustical Society of America, 105, 782–798. Simmons, F. (1979). Tracheotomy in obstructive sleep apnea patients. The Laryngoscope, 89(10), 1702–1703. Smith, P., Gold, A., Meyers, D., Haponik, E., & Bleecker, E. (1985). Weight loss in mildly to moderately obese patients with obstructive sleep apnea. Annals of internal medicine, 103, 850–855. Somers, V. & Abboud, F. (1993). Chemoreflexes–responses, interactions and implications for sleep apnea. Sleep, 16(8 Suppl), 30–33. Somers, V., Dyken, M., Clary, M., & Abboud, F. (1995). Sympathetic neural mechanisms in obstructive sleep apnea. Journal of Clinical Investigation, 96(4), 1897–1904. Somers, V., Mark, A., & Abboud, F. (1988). Sympathetic activation by hypoxia and hypercapnia-implications for sleep apnea. Clinical and Experimental Hypertension, 10, 413–422. Somers, V., Mark, A., Zavala, D., & Abboud, F. (1989). Contrasting effects of hypoxia and hypercapnia on ventilation and sympathetic activity in humans. Journal of Applied Physiology, 67(5), 2101–2106. Speckmann, E. (2008). Physiologie. Elsevier, Urban&FischerVerlag. 66 St Clair, E. & McCallum, R. (1999). Cogan’s syndrome. Current Opinion in Rheumatology, 11(1), 47–52. Stavroulaki, P., Vossinakis, I., Dinopoulou, D., Doudounakis, S., Adamopoulos, G., & Apostolopoulos, N. (2002). Otoacoustic emissions for monitoring aminoglycosideinduced ototoxicity in children with cystic fibrosis. Archives of Otolaryngology-Head & Neck Surgery, 128(2), 150–155. Stenklev, N. & Laukli, E. (2003). Transient evoked otoacoustic emissions in the elderly. International journal of audiology, 42(3), 132–139. Stover, L., Gorga, M., Neely, S., & Montoya, D. (1996). Toward optimizing the clinical utility of distortion product otoacoustic emission measurements. The Journal of the Acoustical Society of America, 100, 956–967. Sullivan, C., Berthon-Jones, M., Issa, F., & Eves, L. (1981). Reversal of obstructive sleep apnoea by continuous positive airway pressure applied through the nares. The Lancet, 317, 862–865. Tumiati, B., Casoli, P., & Parmeggiani, A. (1997). Hearing loss in the Sjogren syndrome. Annals of internal medicine, 126(6), 450–453. Van Dishoeck, H. & Bierman, T. (1957). Sudden perceptive deafness and viral infection; report of the first one hundred patients. The Annals of otology, rhinology, and laryngology, 66(4), 963–980. Vasama, J. & Linthicum Jr, F. (2000). Idiopathic sudden sensorineural hearing loss: temporal bone histopathologic study. The Annals of otology, rhinology, and laryngology, 109(6), 527–532. Veldman, J. (1986). Cochlear and retrocochlear immune-mediated inner ear disorders. Pathogenetic mechanisms and diagnostic tools. The Annals of otology, rhinology, and laryngology, 95, 535–540. Veltri, R., Wilson, W., Sprinkle, P., Rodman, S., & Kavesh, D. (1981). The implication of viruses in idiopathic sudden hearing loss: primary infection or reactivation of latent viruses? Otolaryngology–head and neck surgery: official journal of American Academy of Otolaryngology-Head and Neck Surgery, 89(1), 137–41. Wagner, W., Heppelmann, G., Vonthein, R., & Zenner, H. (2008). Test-retest repeatability of distortion product otoacoustic emissions. Ear and hearing, 29(3), 378–391. 67 Watanabe, T., Isono, S., Tanaka, A., Tanzawa, H., & Nishino, T. (2002). Contribution of body habitus and craniofacial characteristics to segmental closing pressures of the passive pharynx in patients with sleep-disordered breathing. American journal of respiratory and critical care medicine, 165(2), 260–265. Weichbold, V., Nekahm-Heis, D., & Welzl-Mueller, K. (2005). Zehn Jahre Neugeborenen-Hoerscreening in Oesterreich. Eine Evaluierung. Wiener Klinische Wochenschrift, 117(18), 641–646. Wessendorf, T., Thilmann, A., Wang, Y., Schreiber, A., Konietzko, N., & Teschler, H. (2000). Fibrinogen levels and obstructive sleep apnea in ischemic stroke. American journal of respiratory and critical care medicine, 162(6), 2039–2042. Westmore, G., Pickard, B., & Stern, H. (1979). Isolation of mumps virus from the inner ear after sudden deafness. British Medical Journal, 1(6155), 14–15. Wilson, W. (1986). The relationship of the herpesvirus family to sudden hearing loss: a prospective clinical study and literature review. The Laryngoscope, 96(8), 870–877. Yaggi, H., Concato, J., Kernan, W., Lichtman, J., Brass, L., & Mohsenin, V. (2005). Obstructive sleep apnea as a risk factor for stroke and death. The New England journal of medicine, 353(19), 2034–2041. Yamauchi, M., Nakano, H., Maekawa, J., Okamoto, Y., Ohnishi, Y., Suzuki, T., & Kimura, H. (2005). Oxidative Stress in Obstructive Sleep Apnea. Chest, 127(5), 1674–1679. Young, J. & McDonald, J. (2004). An investigation into the relationship between the severity of obstructive sleep apnoea/hypopnoea syndrome and the vertical position of the hyoid bone. The Surgeon, 2(3), 145–151. Young, T., Palta, M., Dempsey, J., Skatrud, J., Weber, S., & Badr, S. (1993). The occurrence of sleep-disordered breathing among middle-aged adults. New England Journal of Medicine, 328(17), 1230–1235. Zenner, H. (1998). Eine Systematik fuer Entstehungsmechanismen von Tinnitus. HNO, 46(8), 699–704. 68 Curriculum vitae Name Geburtsdatum Geburtsort Staatsbürgerschaft Bettina Pletschko 27.01.1985 Klagenfurt Österreich Schulbildung 09/1991-1995 1995-06/2003 Grundschule VS 16 St. Ruprecht, Klagenfurt Gymnasium BG/BRG Mössingerstraße, Klagenfurt Hochschulbildung 10/2003 05/2005 02/2010 01/2011 Studium der Humanmedizin, Medizinische Universität, Graz I. Abschnitt Humanmedizin II. Abschnitt Humanmedizin III. Abschnitt Humanmedizin Spezielle Studienmodule Klinisch-topografische Anatomie der Eingeweide Klinisch-topografische Anatomie der Extremitäten Case-based learning in Klinik und Praxis Von der Theorie zur Praxis - Chirurgische Operationslehre Individualmedizin und Gesundheitsplanung Famulaturen 4 3 2 4 2 2 4 Wochen Wochen Wochen Wochen Wochen Wochen Wochen (07/2005) (08/2007) (02/2008) (02/2009) (07/2009) (09/2009) (01/2010) Interne, Klagenfurt Kinderchirurgie, LKH Klagenfurt Radiologie, Universitätsklinik Graz Psychiatrie, LKH Klagenfurt Plastic Surgery, Cho Ray Hospital Saigon Neurologie, Universitätsklinik Graz Interne, BHB I Marschallgasse Graz Praktisches Studienjahr 5 Wochen (03-04/2010) 10 Wochen (04-07/2010) 9 Wochen (07-09/2010) 5 Wochen (10-11/2010) Allgemeinmedizin, Praxis Dr. Fromm, Schwanberg Chirurgie, LKH Deutschlandsberg Neurologie, Charité Berlin Mitte Psychiatrie, BHB II Eggenberg, Graz Berufserfahrungen 4 Wochen (07/2001) 4 Wochen (08/2002) 8 Wochen (08/2003, 07/2004) 2 Wochen (07/2005) 16 Wochen (08/2005-2008) FA Copyplan, Klagenfurt LKH Klagenfurt Österreichische Post AG, Klagenfurt Naturfreunde Kärnten Herba Chemosan, Klagenfurt Fremdsprachenkenntnisse Englisch Italienisch sehr gut Grundkenntnisse