Haupt-VO Funktionelle Pathologie Endokrinologie
Werbung
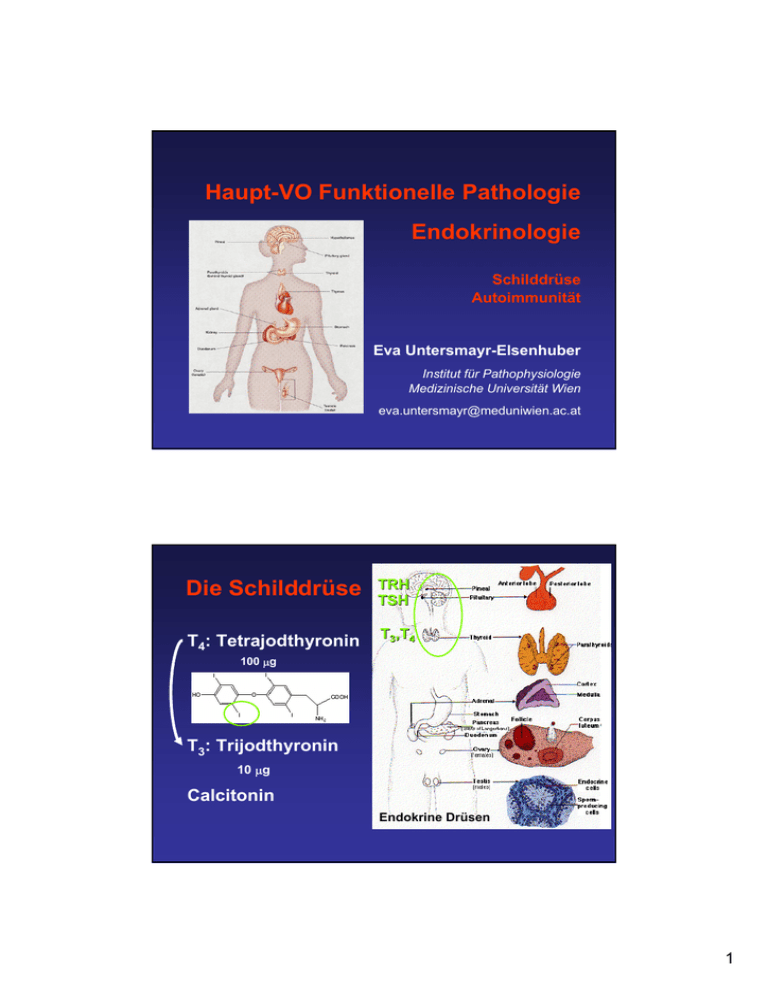
Haupt-VO Funktionelle Pathologie Endokrinologie Schilddrüse Autoimmunität Eva Untersmayr-Elsenhuber Institut für Pathophysiologie Medizinische Universität Wien [email protected] Die Schilddrüse TRH TSH T4: Tetrajodthyronin T3,T4 100 µg T3: Trijodthyronin 10 µg Calcitonin Endokrine Drüsen 1 Die Schilddrüse - Embryologie Größte endokrine Drüse Entsteht am Foramen caecum (Zungengrund) Æ kaudale Wanderung zum Schilddrüsenknorpel (7. SSW) Æ 2 Lappen, Mittellinie durch Isthmus verbunden Ab 10. SSW: Iodaufnahme, wenige später Hormonproduktion und Freisetzung Adulte Schilddrüse 20-25 g Æ nicht tastbar N. laryngeus recurrens OP Cave: N. laryngeus rec. Die Histologie der normalen SD Fibröse Kapsel (inneres und äußeres Blatt), an Trachea fixiert Æ folgt Schluckbewegung Von inneren Kapsel bindegewebige Septen Funktionelle Einheit: Follikel (C-Zellen: Calcitonin) 2 SD-Histologie Follikel: außen einschichtiges Epithel innen Kolloid (C-Zellen: Calcitonin) Kolloid enthält Schilddüsenhormone T3, T4 an Thyreoglobulin gebunden Im Epithelverband aber ohne Kontakt zum Kolloid: parafollikuläre Zellen (C-Zellen) Æ Calcitonin-Produktion Funktionszustand der Follikel Aktiv - Sekretbildung: kubisch bis hochprismatisch, Golgiapparat stark ausgebildet, Sekretgranula Speicherfollikel: Epithelzellen flache, keine Sekretionszeichen TSH: Sekretausschwemmung Æ Phagozytosevesikel, Lysosomen Æ Follikelinhalt mobilisiert Æ Blut 3 Ö: Speisesalz 20 mg Kaliumiodid/ kg Vollsalz SD-Hormon SD-Hormonsynthese Æ Iodversorgung wichtig WHO Empfehlung: 100-300 µg/Tag Schwangerschaft: 200 µg Iodid/Tag Iod Produktion der SD-Hormone - Iod Natürlich: Meeresfischen und Meerestieren Futtermittelzugesetzt Æ Fleisch, Milch, Milchprodukte Keine regelmäßige Zufuhr notwendig, da SD-Follikel als Hormonspeicher Iod rasch im DD resorbiert Æ Blut Æ Follikelepithelzelle Biosynthese der SD-Hormone Iodination: energieabhängige Aufnahme über Na+-IodidSymport In Zellen Glykoprotein Thyreoglobulin synthetisiert Æ viele Tyrosinreste Æ Abgabe ins Follikellumen 4 Biosynthese der SD-Hormone Iodisation: thyeoidale Peroxidase (TPO): oxidiert Iodid zu Iod Æ baut Iod in Tyrosinreste ein Æ kat. Kopplungsreaktion der Vorläuferstufen Monoiodtyrosin (MIT), Diiodtyrosin (DIT) Æ T3, T4, an Thyreoglobulin im Kolloid gespeichert Biosynthese der SD-Hormone An Thyreoglobulin gebundene SD-Hormone in Zelle aufgenommen Æ T3 und T4 in Phagolysosomen abgespalten Æ diffundieren aus Zelle 5 Metabolismus der SD-Hormone T4 90% der sezernierten SD-Hormone Überwiegender T3 Anteil entsteht extrathyreoidal in Peripherie oder Zielzelle durch Monodejodierung aus T4 = Konversion Deiodierung an anderen Stelle: aus T4 entsteht inaktive rT3 (reverse T3) Thyreostatika Propylthiouracil und Propranolol + Kortikosteroide Æ Konversion gehemmt Transportproteine Peripherie: 99,5% an Transportproteine gebunden, Proteine v.a. in Leber produziert • TBG: Thyroxin-bindendes Globulin • TBA: Thyroxin-bindendes Albumin • Albumin • TTR: Transthyretin (nur T4) Vorteile der Hormonbindung: - geringer renaler Verlust - großer SD-Pool Æ konstante Hormonkonz. - gleichmäßige Gewebeversorgung 6 SD-Hormonkonzentrationen Gesamthormonkonzentration: T4: 5-12 µg/100 ml T3: 70-300 ng/100 ml Freie Hormone: 0,3% T3 und 0,04% T4 HWZ: T4 7-10 Tage Æ peripherer Hormonspeicher für 10-fach potentere T3 T3 1 Tag Freigewordenes Iodid Æ Hormonsynthese Regulation Hormonproduktion - TSH KOLLOID Speicherung Thyreoglobulin H2O2 + TPO (Peroxidase) J+ FOLLIKEL -ZELLE TSH TSH SD HormonProduktion TSH Speicher Aufnahme ThyreoglobulinProduktion SD HormonFreisetzung T3, T4 IodidJAufnahme TSH Freisetzung T3 Periphere Konversion T4 7 Regelkreise Schilddrüse Hypothalamus: Thyreoliberin (TRH) Hypophyse: Thyreotropin (TSH) Schilddrüse: T3, T4 Schilddrüse: Regulation Regelkreis mit Rückkopplungsmechanismus Stress, Kä Kälte, Zirkadiane Trigger niedrige T3, T4T4-Spiegel T4 - Glukocortioide - + TSH + T3,T4 - Dopamin GH niedrige T3, T4T4-Spiegel - + TRH TRAK - Thyreostatika 8 Wirkungen der SD-Hormone • Wachstum und Entwicklung: normale ZNS- und Skelettentwicklung (Kretinismus) • Metabolische Effekte: Stimulation Na+K+-ATPase Æ O2-Verbrauch Æ Hyperventilation erhöhte Wärmeproduktion Æ gesteigerte Grundumsatzerhöhung • Kardiovaskuläre Effekte: positiv inotrop und chronotrop, Anstieg β-Adrenorezeptoren Æ erhöhte Katecholaminempfindlichkeit • Gastrointestinaltrakt: gesteigerte Darmmotilität Wirkungen der SD-Hormone • Bindegewebe und Knochen: erhöhter Calzium und Phosphat-Umsatz Æ Knochenumbau • Neuromuskulär: erhöhte Stimulierbarkeit und Erregbarkeit • KH: Steigerung der Glukoneogenese und Glykogenolyse – Anstieg BZ Æ Insulinbedarf gesteigert • Fett: gesteigerte Fettmobilisierung, vermehrt LDL Rezeptoren • Proteine: Physiologisch anabol, erhöhten Konz. katabol • Steigerung der Erythopoese, gesteigerter Abbau von Kortisol und Pharmaka in der Leber 9 Kretinismus Entwicklungsstörung des kindl. Organismus durch SD-Hormon-Mangel Endemischer Kretinismus: Schädigung im Mutterleib Iodmangel, Hypothyreose der Mutter (Æ Iodpropylaxe) irreparable, intrauterine Schädigung und Entwicklungsverzögerung (v.a. ZNS, Skelett, trockene Haut, flache Nase, dicke Zunge) Sporadischer Kretinismus: angeborene od. intrauterin erworbene Neugeborenenhypothyreose; Ursachen: SDDysgenesien, Defekt der Hormon-Synthese, Thyreostatikaeinnahme der Mutter Hypothyreose-Screening am 5. Tag nach der Geburt bei Hypothyreose Æ Hormon-Substitution T3-Wirkung ist gewebespezifisch T4 Spezif. ProteinRezeptoren im Zellkern Deiodisierungs Enzyme T3 T3-Responsive TRβ/T3 Element TRα/T3 Transkription T3: 10-fach stärkere Bindung Æ kernspezif. Wirkung T3RE Nukleäre Rezeptoren TR-α oder -β Ansprechbarkeit von Gewebe: Rezeptoren, Deiosierungsenzym 10 T3-Wirkung im Zellkern T4 Deiodisierungs Enzyme T3 TRβ/T3 Transkription TRα/T3 T3-Responsive Element T3RE T3 gebildet CoRepressorkomplex verdrängt Æ T3 an responsive element angedockt (nukleäre Rezeptoren) Æ Transkription Induktion von de-novo mRNA Synthese Æ Protein-Enzymproduktion im Zytoplasma Schilddrüse: Diagnostik Anamnese Fragen nach typischen Symptomen und bisherigen Erkrankungen (Strumektomie, Radioiodtherapie, Bestrahlung im Halsbereich) Familienanamnese! Körperliche Untersuchung Verschieblichkeit, gr. Zysten, Knoten Konsitenz, Druckschmerzhaftigkeit Auskultation: erhöhte Durchblutung 11 Schilddrüse: in vitro Diagnostik Serum TSH (mU/l) TSH sensitivster Parameter (0,4-4,0 mU/L) Risiko für Hypothyreose ab 2,5 mU/L Hyperthyreose: <0,1mU/L (durch TSH-Suppression) 100 Hypothyreose 10 1 Euthyreose 0.1 Nachweisgrenze 0 Hyperthyreose 10 20 30 Serum fT4 pmol/l Schilddrüse: in vitro Diagnostik Schilddrüsenhormone Gesamtkonzentration von Proteinbindungskapazität abhängig! Nur ungebundener Teil aktiv Æ freie Hormone gemessen Hypothyreose: T4 Hyperthyreose: durch vermehrte Deiodierung Æ T3 ev. alleine verantwortlich Æ beide Werte bestimmen 12 Schilddrüse: in vitro Diagnostik Schilddrüsenauto-AK: bei Autoimmunthyreopathien Thyreoglobulin (Tg-AK) - Autoimmunthyreoditis thyreoidale Peroxidase (TPO-AK) - Autoimmunthyreoditis TSH-Rezeptor (TRAK) – M. Basedow Tumormarker: medulläres SD-Ca Æ Calzitonin nach totaler SD-Ablation Æ Thyreoglobulin als Verlaufskontrolle Diagnostik SD Stoffwechsellage, Lage, Form, Größe • Sonographie • Szintigramm Tc-99m oder Jod-131 Größe, Morphologie 13 Szintigramm: Autonome Adenome - heiße Knoten (verstärkte Speicherung) Ca, Zysten, Narben - kalte Knoten (malignitätsverdächtig Æ Feinnadelpunktion!) SD-Ca: 1% aller Krebserkrankungen Thyreoglobulin ist ein Tu-Marker Struma: hypo-, eu-, hyperthyreot Vergrößerung der SD > 18 ml Frauen, > 25 ml Männer Ursachen: • Jodmangel (90%) D: 30% Prävalenz bei Erwachsenen Æ endemisch • Immunthyreopathien (M. Basedow, chron. Lymphozytäre Thyreoiditis) • Strumigene: Thyreostatika • Kongenital: T3,4 -Synthesedefekte, T4 Rezeptordefekte (Refetoff-Sy.) • Neoplasmen (1-3/100.000) 14 Struma - Pathogenese • Beginn: Hypertrophie (Zellvergrößerung) vorwiegend durch TSH (Kompensation Æ Versorgung des Körpers mit SD-Hormonen) • Später: Hyperplasie (Zellvermehrung) intrathyreoidaler Iodmangel (Threozyten bilden Iodabhängige Verbindungen Æ Hemmung von lokalen Wachstumsfaktoren Æ Hemmung fällt bei Iodmangel weg • Resorptionsvakuolen (Kolloid spärlich, inhomogen angefärbt) • Papilläre Formationen • Autonome Areale Struma Probleme: Autonomie – Hyperthyreose Gefahr maligne Entartung Verdrängung – Tracheomalazie Kosmetisch Therapie: Autonomie, Autoimmunthyroiditis ausschließen! Kindern, Erw.< 35 J.: Kaliumiodidtabletten Levothyroxin + Kaliumiodidtabletten Malignitätsverdacht: OP!, Radioiodtherapie 15 Hyperthyreosen Erhöhtes Angebot an SDHormonen Æ Vermehrte Rezeptoraktivierung • M. Basedow: 60-70% • Autonomes Adenom: 30% • SD-Entzündungen: passagere Hyperthyreose: subakute De Quervain (viral). Selten bakteriell • Jod induziert: Demaskierung einer Autonomie • TSH-prod. Adenom) Hyperthyreosen - Klinik • Unruhe und Nervosität • Wärmeintoleranz, Schwitzen, warme feuchte Haut, Haarausfall • Gewichtsverlust trotz gesteigerte Appetits • Diarrhö • Atemnot • Muskelschwäche, Schlafstörungen • Sinustachykardie, Arrhythmien, feinschlägiger Tremor 16 Morbus Basedow 1840 Carl Adolf von Basedow Merseburger Trias: • Struma • Exophthalmus • Tachykardie Diagnose Szintigramm einer Hyperthyreose: Tc-99m oder Jod-131 Homogene Mehrspeicherung oder Sonographie 17 M. Basedow: Autoimmunkrankheit Hyperthyreose T4 - - - Hohe T3, T4 Werte TSH niedrig Stimulierende Antikörper TSH gegen TRAK T3,T4 TSH-Rezeptor: TRAK (oder TSI: Thyr. Stim. Ig) Autoimmunität Def.: Spezifische, adaptive Immunantwort gegen Selbst-Antigene Chronische Erkrankungen mit klinisch, histologischem Bild einer Entzündung, ohne dass krankheitsspezifische Erreger nachweisbar sind. Gegen den Organismus gerichtete, immunologische Entzündungsreaktion vermittelt durch Autoantikörper und/oder autoreaktive T-Zellen, dieselben wie bei schützender Immunität und Allergie 18 Autoimmunkrankheit - Mechanismen Einteilung anhand Art der Immunantwort und Mechanismus der Gewebsschädigung Typ II: AK gegen Zelloberflächen- oder Matrixantigene Autoimmunkrankheit - Mechanismen Einteilung anhand Art der Immunantwort und Mechanismus der Gewebsschädigung Typ III: AK gegen lösliche Antigene - Immunkomplexerkrankungen 19 Autoimmunkrankheit - Mechanismen Einteilung anhand Art der Immunantwort und Mechanismus der Gewebsschädigung Typ IV: T-Zell-vermittelte Erkrankungen Autoimmunerkrankungen • meist chronisch, entzündlich • meist schubweiser Verlauf • Triggereffekte (Stress, Entzündungen) können Schub oder Erstmanifestation auslösen • Familiäre Häufung • Streng lokal oder systemische Erkrankungen 20 Autoimmunkrankheit - Einteilung Einteilung entsprechend „organspezifischer“ oder „systemischer“ Eigenschaften Organspezifische Autoimmunkrankheiten: - Diabetes mellitus Typ I - Goodpasture-Syndrom - Multiple Sklerose - Basedow-Krankheit - Hashimoto.Tyreoiditis - Autoimmune perniziöse Anämie Cluster - Autoimmune Addison- Krankheit bildung - Vitiligo - Myasthenia gravis Autoimmunkrankheit - Einteilung Einteilung entsprechend „organspezifischer“ oder „systemischer“ Eigenschaften Systemische Autoimmunkrankheiten: - Rheumatoide Arthritis - Sklerodermie - systemischer Lupus erythematoses - Sjörgen-Syndrom I - Polymyositis Cluster bildung Ein Patient oder versch. Mitglieder einer Familie können mehr als eine Krankheit aufweisen 21 Zentrale Toleranz-Thymus Lymphat. Vorläuferstammzelle aus KM Æ Reifung im Thymus Aus einzelner Zelle Æ riesige Anzahl von T-Zellen mit unterschiedl. AG-Rezeptor Selbstantigenspezif. T-Zelle Æ Apoptose Subkapsulär Unreife CD3-4-8-Thymozyten Cortex Unreife CD3+4+8+Thymozyten Reife CD4+8-/CD4-8+T-Zelle Medulla Fremdantigenspezif. T-Zelle klonale Vermehrung (Dauer 4-5 d) 1) Kortikale Thymusepithelzellen – positive Selektion Bindung T-Zellrezeptor an MHC Moleküle Zentrale Toleranz – T-Zellen 2) Negative Selektion Subkapsulär Unreife CD3-4-8-Thymozyten Cortex Medulläre Thymusepithelzelle Transkriptionsregulator AIRE (Autoimmune regulator) Æ Reife CD4+8-/CD4-8+T-Zelle Exprimieren organspezifische Medulla Selbst-Antigene Æ Apoptose Bei Fehlen des AIRE Gens Æ Multiorganautoimmunität (Autoimmune Polyendokrinopathie Syndrom) Unreife CD3+4+8+Thymozyten • • • • • Hypoparathyreoidismus Adrenokort. Ausfall DM Fehlentwicklung der Keimdrüsen Hypothyreose autosomal rezidiv in finnischer Bevölkerung (1 : 25.000) 22 Periphere Toleranz – T-Zellen Toleranzmechanismen für ungefährliches Fremd und Selbst 1) Ausschließlich „Signal 1“ MHC-TCR 2) „Signal 1“ MHC mit TCR und „Signal 3“ CTLA-4, PD-1 mit Gegenrezeptoren CD86, PD-L1,-L2 mit IL-10, TGF-β 3) Regulatorische T Zellen Mechanismus??? (IL-10, TGF-β) Ohne Co-Rezeptoraktivierung Æ Apoptose Æ Anergie (aktive Form der Toleranz) B-Zell Reifung - Toleranz unreife B-Zelle Oberfl.-IgM Æ Signal von AG-Rezeptor 1. Multivalentes körpereigenes Molekül Multivalent quervernetzt a) Rezeptor-Editing Æ neuer Rezeptor b) Apoptose im KM = klonale Elimination 2. Lösliches körpereigenes Molekül 3. 4. Keine Reaktion gegen Körpereigenes Weniger stark vernetzt Schwache AGInteraktion Keine SelbstAG-Interaktion Wenig IgM an Oberfläche, nicht T-Zell aktivierbar (Signaldefekt) klonale Anergie Zelle reift (IgM und IgD), keine TZellaktivierung oder für AG unerreichbar klonale Ignoranz Zelle reift (IgM und IgD) Æ Peripherie & somatische Hypermutation 23 Beteiligung genetische Faktoren • Untersuchungen bei Familien und Zwillingen: IDDM Typ I, Rheumatoide Arthitis, Multiple Sklerose, system. Lupus erythematodes: eineiige Zwillinge 20%, zweieiige Zwillinge 5% • Zusammenhang zwischen HLA-Genotyp und Anfälligkeit für Autoimmunerkrankungen: Goodpasture-Syndrom Æ HLA-DR2 Myasthenia gravis Æ HLA-DR3 Basedow-Krankheit Æ HLA-DR3 system. Lupus eryth. Æ HLA-DR3 Pemphigus vulgaris Æ HLA-DR4 Hashimoto-Thyreoiditis Æ HLA-DR5 Autoantikörper gegen Gewebszellen IgM oder IgG Auto-AK gegen gewebsspezifische AG Æ entzündliche Schädigung Bindung des Komplements Æ kernhaltige Zellen gegen Lyse rel. Resistent, jedoch Induktion von Zytokinausschüttung, respiratory burst, Membranphospholipid Mobilisierung (Æ Arachidonsäure Æ PG, LT) Æ Chemotaxis von Entzündungszellen (NK-Zellen, Leukozyten) Æ Gewebsschädigung Bsp.: Hashimoto-Thyreoiditis (ev. auch T-Zell Zytotoxizität) 24 Autoantikörper gegen Rezeptoren Krankheit wird verursacht durch Stimulation oder Blockade der Rezeptoren durch AK Bsp.: Morbus Basedow Bsp.: Myasthenia gravis Auto-AK gegen Acetylcholinrezeptor Æ Rezeptor-Fkt. und -zahl vermindert Normale neuromuskuläre Endplatte Myasthenia gravis Übertragung durch Serumtransfer Autoimmunkrankheiten können auch über die Plazenta auf den Fetus übertragen werden Anti-TSH-R-AK bei Schwangeren Plazentarer Transfer der AK M. Basedow Myasthenia gravis thrombocyt. Purpura Lupus-Ausschlag Pamphigus vulgaris Neugeborenes hat M. Basedow Anti-TSH-Rezeptor Anti-Acetylcholin-R. Anti-Blutplättchen Anti-Ro, Anti-La Anti-Desmoglein-3 Heilung durch Plasmapherese Hyperthyreose Muskelschwäche Blutergüsse, Blutungen Lichtempf., Bradykardie blasiger Ausschlag 25 M. Basedow: Autoimmunkrankheit Hyperthyreose Hohe T3, T4 Werte T4 - - - TSH niedrig Stimulierende Antikörper TSH gegen TRAK T3,T4 TSH-Rezeptor: TRAK (oder TSI: Thyr. Stim. Ig) Pathogenese M. Basedow Stimulierende Antikörper gegen TSH-Rezeptor: TRAK (oder TSI) TSH T3, T4 ...machen Hyperthyreose 26 Mechanismen der Autoimmunität Mechanismen für Autoimmunität an der Schilddrüse: Infektionen Freisetzung unzugänglicher Selbstantigene Molekulare Mimikry:Ak und T-Zellen Bakterien: Kostimulation gegen Selbst M. Basedow: autoimmun • Familiär gehäuft • Nicht erkrankte Angehörige: TRAKs • Eineiige Zwillinge • Assoziation mit HLA-B8 und HLA-DR3 Trigger: • Infektionen: Yersinia enterocolitica, Borrelien? • Schwangerschaft (Androgene dämpfend bei Autoimmunerkr.) • Rauchen • Stress • Röntgenuntersuchung, jodhältige Kontrastmittel 27 M. Basedow - die Immunerkrankung • Orbitopathie Mögl. Kombination: • Gelenkschmerzen • M. Addison • Muskelschmerzen • DM I. • Hautveränderungen • Pemphigoid • Haarausfall • Lupus erythem. • Vitiligo • Rheumat. KH. • Akropachie • Myasthenia gravis • prätibiales Myxödem • Zöliakie • ......... • Perniziöse Anämie Akropachie – M. Basedow Derbe Weichteilschwellung z.T. mit unregelmäßiger Periostproliferation an Hand, Finger, Fuß und Zehen schmerzlos, normotherm Æ Behinderung der Beweglichkeit 28 Klinik bei M. Basedow • • • • • • • • • Struma Unruhe, Tremor, Schlaflosigkeit Tachykardie, RR Wärmeintoleranz, Schwitzen Heisshunger, Gewichtsverlust Diarrhoen Prätibiales Ödem Osteopathie Exophtalmus, Endokrine Orbitopathie (50%) Thyreotoxische Krise Ursachen : Iodexzesse (Kontrastmittel, Amiodaron), Autonomie, M. Basedow (spontan) Leitsymptome: Tachykardie, Hyperthermie • Puls > 150 • Herzrhythmusstörungen, Extrasystolen • Unruhe, psychotische Zeichen • Bewusstseinstrübung bis Koma Intensivmedizinische Behandlung! (Thiamidazol i.v., Elektrolyt- und Flüssigkeitssubstitution, Betablocker) 29 Endokrine Orbitopathie 50% der Patienten • tränend • Druck • Lidschluss • Kopfschmerz • Doppelbilder • N. opticus • kosmetisch Endokrine Orbitopathie TRAK erkennen TSH-Rezeptorähnliche Strukturen an orbitalen Fibroblasten TRAK Entzündung Ödem Bindegewebe Raumnot ! 30 Therapie endokrine Orbitopathie • Cortison • Bestrahlung • Thyreoidektomie • Methotrexat • Operation • Rauchen unterlassen, nächtliche Hochlagerung, Kompressen, Sonnenbrille Therapie Hyperthyreose • Thyreostatika: Thiamazol, Carbimazol, Propylthiouracil β-Blocker • Radiojodbehandlung (131Jod) • Operation. Risiken: Stimmbandlähmung, Parathyreoidea-Entfernung • Spontanheilung 31 Thyreostatika Thioamide hemmen thyreoidale Peroxidase Æ gehemmte Hormonsynthese Thiamazol hemmt in hohen Konz. auchDeiodase Æ geringere Bildung des stärker wirksamen T3 Hypothyreose Mangel oder nicht ausreichende Versorgung der Körperzellen mit SD-Hormonen Hypothyreose TRH T4 Prävalenz: 10% (latent: 6-7%, manifest:1-3%) +TSH+ +++ Unterfunktion der SD häufiger als Überfuntkion 1:5000 eine der häufigsten angeborenen StoffwechselErkrankungen T3,T4 TPO 32 Hypothyreose im Kindesalter Neugeborenen: angeboren (Aplasie, Dysplasie, Hormon-Synthesestörung, periphere SD-Hormonresistenz intrauterin erworben (Iodmangel, Iodexzess, blockierende AK der Mutter oft verlängerte SS-Dauer, hohes Geburtsgewicht verlängert Neugeborenenikterus, Trinkfaulheit, Bewegungsarmut, Obstipation, kühle Haut Æunbehandelt: Vollbild des Kretinismus Kindern: verzögerter Wachstum, gestörte Zahnentwicklung, Nachlassen der intellektuellen Entwicklung, Schulleistungen Hypothyreose im Erwachsenenalter Ursachen 95% primär, mehr Frauen Entzündliche Ursachen: • chron. lymphozytäre Thyreoiditis (Hashimoto Thyreoiditis) in 50% Iatrogene Ursachen: • Therapie einer Hyperthyreose (SD Resektion, Radiojodbehandlung, Tyreostatike, Bestrahlung der Halsregionen Selten: extremer Iodmangel, Tumore, sekundäre od. tertiäre Hypothyreose 33 Hypothyreose: Symptome Symptome entwickeln sich langsam, typ.weise lange nicht wahrgenommen • Müdigkeit, Antriebslosigkeit • Frieren (Kälteintoleranz) • Gewichtzunahme, Obstipation • trockene, schuppige Haare, Haarausfall • Depression • Myxödem (nicht eindrückbare Schwellungen im Gesicht und Extremitäten, Ablagerung Glykosaminoglykane • Bradykardie • heisere Stimme, Muskelschwäche • Menstruationsstörungen, Libidoverlust • Hyperlipiämie (erhöhtes Arterioskleroserisiko), Anämie Myxödeme generalisierte Ablagerung von Glykosaminoglykanen (Mukopolysaccharide genannt) im Interzellulärraum infolge verminderten Abbaus beim Myxödem nach Druck keine Dellen zurück (Differentialdiagnose bei Ödemen) Glykosaminoglykanen: negativ geladen und binden dadurch Wassermoleküle 34 Myxödemkoma Sehr selten, länger bestehende Hypothyreose, v.a. bei älteren Personen Auslöser: Medikamente, Kälte, Infekte, Absetzen der SDHormonsubstitution Æ schwere Hypopthyreose • Schwäche, Hypothermie • Hypoventilation, Sinusbradykadie • Apathie, Somnolenz, Schock Æintensivmed. Behandlung Vitalfunktionen sichern, Thyroxin i.v., Glukose-haltige Lösung, Volumenersatz Diagnostik Manifeste Hypothyreose: basales TSH (> 4,0 mU7L) erhöht, fT4 erniedrigt Latente Hypothyreose: basales TSH erhöht, fT4 oder fT3 normal oder im unteren Bereich Chronisch-lymphozytäre Threoiditis: Nachweis von TPO-AK (95%), weniger spezif. Tg-AK, Sonografie Echoarme SD Sekundärer hypophysäre Hypothyreose: basales TSH, fT4 erniedrigt, auch andere Zeichen eines Hypopituitarismus 35 Therapie Manifeste Hypothyreose: Substitution der SD-Hormone, bei koronaren Herzerkrankungen und lange bestehender Hypothyreose: einschleichende Dosierung Einnahme unter konstanten Bedingungen Latente Hypothyreose: Substitution nur bei klin. Indikation (Kinderwunsch, Schwangerschaft, nachweisbaren TPO-AK) Verlaufskontrolle, da 2-4% der Patienten in 1 Jahr manifeste Hypothyreose Low-T3-Syndrom Bei schweren, nichtthyreoidalen Erkrankungen (Niereninsuffizienz, Myokardinfarkt, Leberzirrhose, Sepsis), nach Op., Traumata Æ verminderte Deiodierung Æ Absinken von fT3, Anstieg rT3 v.a. bei Intensivpatienten Problem: Hormoninterpretation aufgrund Medikamente (Glukokortikoide, Dopamin) Vermind. Konversion: physiologisch Æ Reduktion Energieumsatz in Peripherie Æ Substitution keine Prognoseverbesserung Æ zu unterlassen 36 Thyreoiditen Heterogene Gruppe, unterschiedliche Ursachen, Symptome und Therapien Bei verschied. Threoiditiden Æ Zellzerstörung Æ Hormonfreisetzung Æ transiente, selbstlimitierende Hyperthyreose Æ Bereits gebildete Hormone Æ Thyreostatika nicht indiziert (symptomatische Therapie mit β-Blockern) Thyreoiditen Immunologisch bedingt - Autoimmun: M. Basedow chron. lymphozytäre Threoiditis Post-partum-Thyroiditis (5% der Frauen, innerhalb 1 Jahr nach Entbindung, manche bereits vor Schwangerschaft TPO-AK) Immunologisch vermittelt Subakute Thyreoiditis de Quervain (einige Wochen nach Atemwegsinfekt, 37 Hashimoto Thyreoiditis Hypertrophe Form – atrophe Form TPOs - Antikörper gegen Threoidale Peroxidase Lympho-plasmozytäres Infiltrat, Follikelbildung, Hürtle-Zellen (Epithelzellen mit azidophilen Granula) Hashimoto Thyreoiditis: autoimmun • HLA-DR3, -DR5, -B8 • Antikörper gegen Peroxidase (TPO) • Antikörper gegen Thyreoglobulin • CTLs CTL ZELLULÄR ? TH Zellen ZYTOTOXIZITÄT NK ADCC Lymphozytäre Thyreoiditis 38 SD-Malignome Selten (Deutschland: 3/100.000 pro Jahr) Frauen 2-3 x häufiger als Männer Vor allem vor dem 30. und nach dem 60. Lebensjahr Klassifikation, Diagnose und Therapie anhand histologischer Differenzierung Ätiologie: ionisierende Strahlen, genetischen Faktoren Klinik: solitärer, derber, kalter Knoten, oft schmerzlos Spätsymptome: Schluckbeschwerden, Atembeschwerden, Heiserkeit bei Recurrensparese, Destruktion des Ganglion stellatum: Horner-Syndrom: Miosis, Ptosis, Enophthalmus SD-Malignome - Diagnose Sonographie unregelmäßig begrenzter, echoreduzierter Knoten Szintigraphie verminderte Aufnahme (aber nur 5% aller kalten Knoten maligne!) nur 1% hyperfunktionell Feinnadelpunktion zur Abklärung der Malignität 39 SD-Malignome - Formen Papilläres Karzinom 50-60%, papilläre Gewebestruktur, mit zentraler, fibrovaskulärer Achse, v.a. lymphogene Metas, günstige Pr. Follikuläres Karzinom 20-30%, Iodmangelgebiete mit Struma, v.a. hämatogene Metas Æ Prognose Medulläres Karzinom 5%, von C-Zellen aus Æ Tumormarker: Kalzitonin, rel. schlechte Prognose Undiff. Karzinom 5-10%, lokal destruierend, schlechte Pr. SD-Malignome - Therapie Totale Thyrektomie Æ Lebenslange LevothyroxinSubstitution Radioiodtherapie Metastasenresektion 40 Quellenangabe Die Schilddrüse (Jensen-Jarolim, Brämswig, Untersmayr) Immunology (Charles A. Janeway and P. Travers) Endokrinologie (Clemens Marischler) Innere Medizin (Gerd Herold) Histologie (Scharzenberg, Schnedl, Pavelka) Labor und Diagnose (Lothar Thomas) The contents of this presentation are designed for teaching purposes only, and may not be copied or published elsewhere. 41