Die Schilddrüse
Werbung

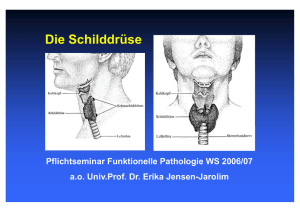
Die Schilddrüse Pflichtseminar aus Funktioneller Pathologie für das alte Mediziner-Curriculum Prof. Dr. Erika Jensen-Jarolim Inst.für Pathophysiologie der Med. Universität Wien Das Skriptum wurde unter Mitarbeit von cand. med. Kira Brämswig und Dr. Eva Untersmayr, gestaltet Inhaltsverzeichnis 1) 2) 3) 4) 5) 6) 7) 8) 9) 10) 11) 12) 13) 14) 15) 16) 17) 18) 19) Übersicht und Einleitung Histologie normale SD Produktion der SD-Hormone Transportproteine Physiologische Regulation Wirkungen der SD-Hormone Dysregulation SD-Hormon-Diagnostik Struma Hyperthyreosen Morbus Basedow M. Basedow - die Autoimmunerkrankung Mechanismen für Autoimmunität Klinik M. Basedow Thyreotoxische Krise Endokrine Orbitopathie Therapie der Hyperthyreosen Die Hypothyreose Hashimoto Thyreoiditis Seite 3 4 5 6 7 8-9 10 11-14 15-17 18 19-20 21-22 23-24 25 26 27 28 29,30 31,32 Die Schilddrüse TRH TSH T3,T4 T4: Tetrajodthyronin 100 μg T3: Trijodthyronin 10 μg Endokrine Drüsen Die Schilddrüse ist die größte endokrine Drüse des Körpers. Sie entsteht am Foramen caecum d.h am Zungengrund. Sie wandert kaudal bis auf die Höhe des Schilddrüsenknorpels. Dort wächst sie zu zwei Lappen aus, die in der vorderen Mittellinie durch einen Isthmus verbunden sind. Das Gesamtgewicht der adulten Schilddrüse beträgt ca. 20-25g und ist in diesem Zustand nicht tastbar. Ihre Aufgabe ist die Sekretion von Tetrajodthyronin (T4, Thyroxin) und Trijodthyronin (T3). Außerdem produzieren parafollikuläre C-Zellen das für die Kalziumhomöostase wichtige Kalzitonin. Eine normale Entwicklung ist ohne Schilddrüsenhormone nicht möglich. Auch im erwachsenen Organismus wird fast jedes Organsystem von der Schilddrüse beeinflusst, ihre Hauptaufgabe ist die Erhaltung metabolischer Stabilität. Erkrankungen der Schilddrüse sind aber häufig und betreffen Änderung der Größe und Form des Organs (Struma, Knoten, Neoplasien) und/oder Störungen der Funktion (Über-oder Unterfunktion). Die Schilddrüse gehört wie viele andere endokrine Organe (Hypophyse, Schilddrüse, Nebenschilddrüse, Nebenniere, Gonaden) zum neuroendokrinen System. Die Aufgabe des endokrinen Systems ist die Aufrechterhaltung und Feinregulierung der Homöostase. Als Homöostase bezeichnet man die Konstanz (Aufrechterhaltung) des sogenannten inneren Milieus des Körpers mit Hilfe von Regelkreisen, mit Rückkopplungs-, sowie FeedbackMechanismen. Die Histologie der normalen SD (C-Zellen: Calcitonin) Histologie der Schilddrüse Die Schilddrüse ist von einer Kapsel umhüllt, an der man ein äußeres und inneres Blatt unterscheidet. Von der inneren Kapsel dringen Bindegewebssepten in die Drüse ein, sodass eine Läppchengliederung zustande kommt. Die Schilddrüsenfollikel werden durch ein einschichtiges Epithel ausgekleidet. Die Höhe des Epithels ist vom Funktionszustand abhängig. Mit zunehmender Aktivität nimmt die Höhe des Epithels zu. In der intakten Schilddrüse ist das Epithel isoprismatisch, die Hohlräume sind mit Kolloid gefüllt. Dieses Sekret enthält die Schilddrüsenhormone T3 und T4, die in inaktiver Form an ein Glykoprotein (Thyreoglobulin) gebunden sind. Das Kolloid ist von Bindegewebssepten umhüllt. Im Epithelverband, aber ohne Kontakt zum Kolloid, liegen parafollikuläre Zellen (C-Zellen). Speicherung KOLLOID H2O2 + TPO Thyreoglobulin Jodination und Koppelung von Tyrosilresten (Peroxidase) J+ FOLLIKEL -ZELLE Propylthiouracil Thiamazol Speicher Aufnahme Proteolyt. Abspaltung der SD Hormone TSH Thyreostatika T3, T4 JodJodTransport J Freisetzung TSH Produktion der SDHormone (Technecium) T3 Periphere Konversion T4 Propylthiouracil Eine ausreichende Jodversorgung von 150 μg Jodid pro Tag ist für eine normale Schilddrüsenhormonsynthese notwendig. In den Schilddrüsen-hormonen ist ca. 60% des im Körper vorhandenen Jods gespeichert. Bei einer täglichen Zufuhr von weniger als 50 μg ist eine ausreichende Hormonproduktion nicht mehr möglich, es bildet sich ein Struma, oder eine Hypothyreose aus. Vor Einführung des jodiertem Speisesalzes konnte man diese Krankheitsbilder weitaus häufiger beobachten. Oral aufgenommenes Jod wird im Gastrointestinaltrakt resorbiert und verteilt sich im Extrazellularraum. Die Bildung der Schilddrüsenhormone beginnt durch raschen aktiven Transport von Jodid aus dem Blut in die Schilddrüsenzelle (sog. Jodfalle), TSH stimuliert den Jod-Transport. In der Schilddrüse wird das Jodid durch die Peroxidase rasch oxidiert und an den Tyrosylrest des Thyreoglobulins gebunden. Dies bezeichnet man als Jodination. Aus Mono- und Dijodtyrosilresten entstehen schließlich T3 und T4, die an Thyreoglobulin gekoppelt im Kolloid der Follikel gespeichert werden. Dieser Speicher reicht im Falle eines völligen Stops der Jodzufuhr für ca. 2 Monate aus. Vor der Sekretion werden T3 und T4 vom Thyreoglobulin getrennt. Der überwiegende Anteil von zirkulierendem T3 entsteht extrathyreoidal im peripheren Körpergewebe durch Monodejodierung von T4 zu T3. Die Thyreostatika Propylthiouracil und Thiamazol hemmen die Jodination als auch die Kopplung der Tyrosilreste. Transportproteine • TBG: Thyroxin-bindendes Transportprotein • Albumin • Lipoproteine • TTR: Transthyretin (Präalbumin) Frei: 0,5 % T3 und 0,05% T4 Der Transport der Schilddrüsenhormone im Blut erfolgt durch Bindungen an Transportproteine. Transportproteine sind vor allem in der Leber synthetisiertes Thyroxinbindendes Globulin, Albumin, Lipoproteine und Transthyretin. Da nur das freie Hormon in die Zelle diffundieren kann, wird die Stoffwechsellage von den freien Hormonen und nicht vom Gesamthormonspiegel bestimmt. Die Gesamthormonkonzentration von T4 beträgt 5-12 μg/100 ml, von T3 70-300ng/100 ml. Lediglich 0,05% des T4 und 0,5% des T3 liegen in freier Form vor. Aufgrund seiner geringen Eiweißbindung wird T3 schneller metabolisiert, was sowohl die kürzere biologische Halbwertszeit, als auch die gegenüber T4 höhere biologische Wirksamkeit erklärt. Stress, Kä Kälte, Zirkadianer Trigger T4 - - + TRH Glukocortioide Dopamin STH + - TSH + T3,T4 - - Schilddrüse: Regulation TRAK Thyreostatika Jod Die Ausschüttung und Regulation der Schilddrüsenhormone beruht auf einen Regelkreis mit Rückkopplungsmechanismen (Feedback-System). Bildung und Ausschüttung von T3 und T4, sowie das Schilddrüsenwachstum werden durch Thyreotropin (Thyroidea-stimulierendes Hormon, TSH), einem Peptidhormon aus dem Hypophysenvorderlappen, stimuliert. Die Ausschüttung von TSH wird durch das Thyreoliberin (Thyroidea-releasing Hormon, TRH) einem Glykoprotein aus dem Hyothalamus reguliert. Hypothalamus: - Stress, Östrogene, Kälte, niedriger T3-, T4 Spiegel verstärken die TRH-Ausschüttung. - Glukokortikoide hemmen die TRHAusschüttung Hypophyse: - niedrige T3-, T4-Spiegel verstärken die TSH-Ausschüttung - Dopamin, STH hemmen die Ausschüttung Wirkungen der SD-Hormone • Fetale Entwicklung: Kretinismus • Metabolische Effekte: Grundumsatzerhöhung (Na+K+-ATPase) • Kardiovaskuläre Effekte: positiv inotrop und chronotrop, Anstieg β-Adrenorezeptoren • Gastrointestinal: Motilität • Bindegewebe und Knochen: Umsatz • Neuromuskulär: Kontraktionsgeschwindigkeit • KH: Steigerung der Glukoneogenese und Glykogenolyse - DM • Fett: LDL Rezeptoren steigen an- Cholesterin fällt Die bekannteste Wirkung der Schilddrüsenhormone ist ihre Eigenschaft, den Sauerstoffverbrauch und die Wärmeproduktion zu steigern, was sich in einer Erhöhung des Grundumsatzes wiederspiegelt. Wie essentiell Schilddrüsenhormone für die normale geistige und körperliche Entwicklung und für das Wachstum des gesamten Organismus sind, erkennt man am deutlichsten anhand des Krankheitsbildes Kretinismus. Dies ist eine Entwicklungsstörung des kindlichen Organismus bedingt durch einen Mangel an Schilddrüsenhormonen. Es gibt zwei Formen: 1. endemischer Kretinismus: Schädigung bereits im Mutterleib, durch Jodmangel bzw. Hypothyreose der Mutter (Jodprophylaxe in der Schwangerschaft). Schilddrüsenanlage des Kindes und biochemische Ausstattung normal, postnatal meist hypothyreote Stoffwechsellage. Die Folge ist meist eine irreparable intrauterine Schädigung und Entwicklungsverzögerung, insbesondere des ZNS, Skelett und anderer Organe (trockene Haut, flache Nase, dicke Zunge) 2. sporadischer Kretinismus: angeborene oder intrauterin erworbene Neugeborenenhypothyreose. Ursachen: Schilddrüsendysgenesien, Defekt der Hormonsynthese, Thyreostatikaeinnahme der Mutter Wichtig ist eine möglichst frühe TSH-Bestimmung oder komplette Schilddrüsendiagnostik (TRH, TSH, T3, T4) bei Neugeborenen. Gesetzlich vorgeschrieben ist das Hypothyreose-Screening am fünften Tag nach der Geburt. Liegt bei einem Neugeborenen eine Hypothyreose vor, so ist, um eine geistige Retadierung zu verhindern, Hormon-Substitution obligat. T3-Wirkung ist Gewebespezifisch T4 Erst aktive Blockade T3 Dann Transkription TRβ/T3 TRα/T3 T3-Responsive Element Nukleäre Rezeptoren TR-α oder -β bestimmen T3-Aktionen abhängig vom Zelltyp Wirkung auf molekularer Ebene Schilddrüsenhormone werden an spezifischen Protein-Rezeptoren des Zellkerns gebunden. Da T3 etwa 10mal stärker als T4 an die Rezeptoren gebunden wird, ist anzunehmen, dass die kernspezifische Wirkung der Hormone in erster Linie von T3 ausgeht. Die Ansprechbarkeit der verschiedenen Gewebe ist wahrscheinlich vom entsprechenden Rezeptorgehalt und dem Vorhandensein von Deionidisierungsenzymen (D) abhängig, denn die Deionidisierung von T4 ist Vorraussetzung für die Umsetzung in das aktive T3. Fehlen einer Zelle diese Enzyme, kann T3 nicht an das T3-Responsive Element andocken und die dementsprechenden Events (Transkription der target-gene) einleiten. Wird T3 aber durch die Deionidisierung gebildet, kann es den CoRepressorkomplex verdrängen und an die nukleären Rezeptoren Trα und Trβ binden. Erst dadurch wird der Coaktivatorkomplex aktiviert und leitet die Transkription ein. Schilddrüsenhormone induzieren dann die de-novo-Synthese von mRNA , welche eine vermehrte Protein-Enzymproduktion im Zytoplasma bewirken. Schilddrüse: Regulation Hypothyreose Hyperthyreose TRH T4 T4 +TSH+ +++ T3,T4 --- TSH T3,T4 1. Die Hypothyreose ist durch einen Mangel an Schilddrüsenhormonen gekennzeichnet. Der Hormonmangel führt zu einem hypometabolischen Zustand. Der TSH-Spiegel ist kompensiert. Bei Auftreten vor der Geburt spricht man von Kretinismus (siehe oben), bei Auftreten im Erwachsenen- oder Adoleszentenalter von Myxödem. Die Hypothyreose kann pathogenetisch eingeteilt werden in: Primär: - Erkrankungen der Schilddrüse selbst, bei 95% aller Erkrankungen, sind durch erhöhte TSH-Spiegel und erniedrigte Schilddrüsenhormonwerte gekennzeichnet. - Reduktion des Schilddrüsengewebes (Autoimmunthyreoditis, Resektion, Radio-Jod-Therapie) - Gestörte Hormonsynthese (kongenital, Jodmangel, Thyreostatika) Sekundär: - Erkrankung/Verdrängungen der Hypophyse Tertiär: - Hypothalamische Erkrankungen 2. Die Hyperthyreose führt zu einem hypermetabolischen Zustand, der auf einer inadäquat erhöhten Sekretion von T3 und T4 beruht. Sie ist bei Frauen ca. fünfmal häufiger als bei Männern. Ursachen: - diffuse Struma (M.Basedow) - toxischer Knotenkopf - toxisches Adenom Schilddrüse: Diagnostik - 1950: PBI (protein-bound iodine) - 1970: RIA und immunometrische Tests (IMA) - Heute: Gesamthormone (T3 und T4), freie Anteile (FT3, FT4) und TSH (1. Generation: 0.5 mU/l 2., 3. Generation: 0.05-0.005 mU/l) Neben einer ausführlichen Anamnese und der Erhebung eines klinischen Befundes spielen die Bestimmung von T3, T4 und TSH im Serum eine große Rolle in der Schilddrüsendiagnostik. Während noch 1950 das gesamte Protein-gebundene Schilddrüsenhormon erfasst wurde, ist man heute dazu übergegangen, differenzierter zu messen: Neben den Gesamthormonen an Transportproteinen ist es essentiell, die freien T3 und T4 Spiegel zu messen, da diese Evaluierung am besten Auskunft über den gegenwärtigen aktiven Hormonhaushalt gibt. Bei Verdacht auf Hypothyreose gehört die Bestimmung der Gesamtkonzentration von T4 sowie des freien Hormonanteils die Basisdiagnostik. Schilddrüse: Diagnostik 100 Hypothyreose 10 Serum TSH (mU/l) 1 Euthyreose 0.1 Nachweisgrenze 0 10 Hyperthyreose 20 30 Serum FT4 pmol/l Jede nicht-entzündliche und nicht auf einen malignen Prozess basierende Vergrößerung der Schilddrüse bei noch ausgeglichener Bilanz der Hormonbildung wird als blande bzw. euthyreote Struma bezeichnet. Da die sekretorische Aktivität der Schilddrüse von einer intakten hypothalamischen-hypophysären Regelschleife abhängig ist, kann man die häufigen Schilddrüsenerkrankungen zuverlässig mit einer Bestimmung von T4 und TSH-erfassen. Bei einer Hyperthyreose findet man eine inadäquat erhöhte Sekretion von Schilddrüsenhormonen. Die Basisdiagnostik stellt die Bestimmung von T4 und T3 dar. Besteht darüber hinaus noch ein Zweifel an der Diagnose kann ein TRH-Test durchgeführt werden. Da die TSH-Provokation sehr empfindlich auf eine Erhöhung des freien Hormonspiegels reagiert, steigt TSH 30 Minuten nach intravenöser Gabe von TRH nicht an. Ein normaler Anstieg von TSH nach TRH schließt eine Hyperthyreose aus. Die Hypothyreose ist durch ein Mangel an Schilddrüsenhormonen gekennzeichnet. Findet man sowohl niedrige T4, als auch niedrige TSH-Spiegel, spricht dies für eine Hypothyreose, die durch eine Erkrankung im Bereich der Hypophyse oder des Hypothalamus hervorgerufen wird (sekundäre Hypothyreose=Hypopituitarismus). Um zwischen primärer und sekundärer Hypothyreose differenzieren zu können ist die Bestimmung des TSH-Spiegels sinnvoll, da dieser bei einer primären Hypothyreose erhöht ist. Diagnostik SD • Labor: Hormone • Sonographie • Szintigramm Tc-99m oder Jod-131 • Immunologie Neben der labordiagnostischen Bestimmung der Schilddrüsenhormone spielen bei der Diagnostik eine Rolle: • Sonographische Untersuchung • Szintigraphie mit radioaktivem Isotopen (Technetium oder Jod) • Immunologische Untersuchungsmethoden zum Antikörpernachweis bei möglicher autoimmuner Genese der Schilddrüsenerkrankung Szintigramm: Autonome Adenome - heisse Knoten Ca, Zysten, Narben - kalte Knoten SD-Ca: 1% aller Krebserkrankungen. Thyreoglobulin ist ein Tu-Marker Methodik: Bei der Szintigraphie wird das physiologische Prinzip der Jodfalle (siehe oben) genutzt. Nach Inkorporation (parenteral oder oral) von Isotopne, die ebenfalls den Jodtransporter in Anspruch nehmen, kann sich das Radiopharmakon entweder relativ selektiv anreichern (heißer Knoten) oder nicht gespeichert werden (kalter Knoten). Die räumliche Verteilungsdichte der freigesetzten Strahlung kann dann als zweidimensionales Szintigramm dargestellt werden. Die Farbskala von Rot nach Blau korreliert mit der Stoffwechselleistung. Die Schilddrüsenszintigraphie liefert Antworten zu folgenden Fragestellungen: • funktionelle Bedeutung morphologisch nachweisbare Veränderungen • quantitative Funktionsbeurteilung • Lage und Größe des Organs (nur bei extrem großen und atypischen Vergrößerungen) Hauptindikationen sind: • Abklärung von Herdbefunden bei Palpation oder durch die Sonographie • bei manifester oder latenter Hyper- oder Hypothyreose Struma: hypo-, eu-, hyperthyreot • Jodmangel: 10% Prävalenz - endemisch • M. Basedow • Strumigene: Thyreostatika, Jod (zB. in Antiarrhythmikum Amiodaron) • Kongenitale T3,4 Synthesedefekte, T4 Rezeptordefekte (Refetoff-Sy.) • Neoplasmen (1-3/100.000) Die Struma (Vergrößerung des Schilddrüsenparenchyms) kann mit einer verminderten, normalen oder vermehrten Schilddrüsenhormonproduktion einhergehen. Früher am häufigsten beobachtet war die Jodmangelstruma. In manchen Gebieten tritt sie immer noch endemisch auf (zB. in D 10%). Die Schilddrüsedrüse hypertrophiert dann kompensatorisch und das Resultat ist eine Struma mit einer euthyreoten Stoffwechsellage. Struma • Hypertrophie und Hyperplasie • Resorptionsvakuolen • Papilläre Formationen • Autonome Areale Histologie der Struma Die Schilddrüse ist hyperplastisch, es besteht keine Fixation an das umgebende Gewebe. Mikroskopisch sind die Follikel unregelmäßig, teils verzogen, die Lumen sind eng. Dies ist auf eine deutliche Hyperplasie der Follikelepithelzellen zurückzuführen. Das Follikelepithel ist hochzylindrisch, es bilden sich hyperplastische intrafollikuläre Papillen aus. Das Kolloid im Lumen ist spärlich ausgebildet und zeigt Resorptionsvakuolen. In der Struma besteht eine lymphozytäre Infiltration. Struma Probleme: Autonomie - Hyperthyreose Gefahr maligne Entartung Verdrängung - Tracheomalazie Kosmetisch In der hyperproliferativen Struma kann es immer wieder zur Bildung autonomer Areale kommen, die ausserhalb der Regulationskreise agieren und Hyperthyreosen verursachen. Hyperproliferation bedeutet ausserdem immer auch ein erhöhtes Risiko für maligne Entartungen. Aufgrund von Strumabildung kann es zur Tracheomalzie kommen. Darunter verstehen wir einen Stabilitätsverlust der Luftröhre durch Druck von außen, durch Erweichung der Knorpelringe oder durch eine Entzündung der Trachealwand. Der Patient entwickelt einen inspiratorischer Stridor, Husten, eventuell Synkopen. Diagnostik:Röntgen, Bronchoskopie Hyperthyreosen • M. Basedow: 60-70% • Autonomes Adenom: 30% • SD-Entzündungen: passagere Hyperthyreose: subakute De Quervain (viral). Selten bakteriell • Jod induziert: Demaskierung einer Autonomie • (TSH-prod. Adenom), Struma ovarii (Teratom) Wenn die Hormonbildung in der Schilddrüse den Bedarf in der Peripherie übersteigt, wird das Erscheinungsbild der Hyperthyreose deutlich. Im Serum ist die Konzentration von freiem T4 und meist auch freiem T3 erhöht. Morbus Basedow 1840 Carl Adolf von Basedow Merseburger Trias: • Struma • Exophthalmus • Tachykardie Der Morbus Basedow ist die häufigste Ursache für eine Hyperthyreose und betrifft vor allem Frauen im Alter zwischen 30-60 Jahren. Die Krankheit tritt familiär gehäuft auf und ist mit dem HLA-B8- und HLA-DR3-Genotyp assoziiert. Die Hyperthyreose beim Morbus Basedow ist auf einen immunpathologischen Prozess zurückzuführen. Ursache für die hyperthyreote Stoffwechsellage und der Strumabildung ist die Produktion von Autoantikörpern gegen TSH-RezeptorAnteile. Die Autoantikörper werden als Thyreotropin-Rezeptor-Antikörper, TRAK bezeichnet und sind oft auch bei nicht erkrankten Angehörigen nachweisbar. Sie sind in der Lage eine TSH-ähnliche Stimulation hervorzurufen, damit stimulieren sie eine T3/T4-Synthese und Sekretion. Dies bewirkt eine Hypertrophie und Hyperplasie des Follikelepithels. Auslösende Trigger für ein Manifestierung der Erkrankung können sein: •Infektionen: Yersinia enterocolitica, Borrelien •Schwangerschaft (Androgene wirken dämpfend bei Autoimmunerkrankungen •Rauchen •Stress •Röntgenuntersuchungen, jodhältige Kontrastmittel Typisches Erscheinungsbild des Morbus Basedow ist die oben aufgeführte Merseburger Trias, die der Merseburger Arzt Carl Adolf von Basedow beschrieb. Diagnose Szintigramm einer Hyperthyreose: Tc-99m oder Jod-131 Homogene Mehrspeicherung oder Sonographie Die Schilddrüsenszintigraphie ist beim Morbus Basedow nach der Durchführung einer Sonographie indiziert. Die Farbskala von Blau nach Rot korreliert mit der Stoffwechselaktivität bzw. der Organdicke. Im unterem Bild ist vermehrt Rot zu sehen, was auf eine deutlich vermehrte Speicherung von Schilddrüsenhormone hinweist. M. Basedow: Autoimmunkrankheit Hyperthyreose Hohe T3, T4 Werte T4 --- TSH niedrig Stimulierende Antikörper TSH gegen TRAK T3,T4 TSH-Rezeptor: TRAK (oder TSI: Thyr. Stim. Ig) Thyreoidea-stimulierende-Immunglobuline (TSI) auch TRAK (Thyreoidea Rezeptor Antikörper) genannt, stimulieren die T3-, T4-Synthese und -Sekretion. Dies bewirkt eine Hypertrophie und Hyperplasie des Follikelepithels und resultiert in einer Strumabildung. Welcher Trigger die fehlgeleiteten Antikörperbildung initiiert, ist derzeit noch nicht geklärt. Neben einer genetischen Disposition spielen möglicherweise Infektionen, Stress und Rauchen eine Rolle. Letztendlich führt der Trigger zu einer Zytokinsekretion und einer Expression von HLA-Klasse-2-Molekülen auf der Zelloberfläche der Thyroidea. Hierdurch wird die Präsentation des TSH-Rezeptors als Antigen für die CD4+-Lymphozyten ermöglicht. Diese Lymphozyten mediieren wiederum über Zytokine eine Produktion von TRAK durch B-Lymphozyten (Plasmazellen). Bedingt durch die autoimmune Genese kann diese Erkrankung zu den unterschiedlichsten klinischen Manifestationen führen, unter anderem: • Orbitopathie • Gelenk- und Muskelschmerzen • Hautveränderungen wie Vitiligo • Haarausfall • Akropachie, prätibiales Myxödem Außerdem können Kombinationen mit anderen Autoimmunerkrankungen wie M. Addison, DM I, Pemphigoid, Lupus erythematodes, rheumatische Erkrankungen, Myasthenia gravis, Zöliakie und perniziöse Anämie auftreten. Stimulierende Antikörper gegen TSH-Rezeptor: TRAK (oder TSI) TSH T3, T4 ...machen Hyperthyreose Die linke Abbildung zeigt schematisch die normale Stimulation der Schilddrüse, mit Darstellung des Regelkreislaufs. In der rechten Abbildung sieht man die Stimulation der Schilddrüse durch TRAKs (siehe oben), was zu einer vermehrten Freisetzung der Schilddrüsenhormone führt. Diese Stimulation entzieht sich dem normalen Regelkreis und bedeutet maximale Stimulation mit nachfolgender metabolischer Entgleisung. Mechanismen für Autoimmunität Infektion Thymus und KM Negative Selektion Ausschluss Autoreaktivität TOLERANZ Freisetzung unzugänglicher Selbstantigene AUTOIMMUNITÄT In der Reifung der T-Zellen spielt die negative Selektion zum Ausschluss potentieller autoreaktiver Zellen eine wichtige Rolle. Dabei spielen mTEC (medulläre Thymusepithelzellen) eine Schlüsselrolle. Sie haben das AIRE (AutoImmun REgulator), einen nukleären Regulator, der mTEC Zellen dazu bringt, wechselweise alle genetisch möglichen „Selbst“-Antigene (Proteine) zu produzieren. Erkennt eine T-Zelle diese, geht sie durch Apoptose zugrunde. Damit werden autoreaktive Klone ausgeschaltet. Ein AIRE Gendefekt wurde als Verursacher des eltenen Syndromes APECED (Autoimmune PolyEndokrinopathie-Candidiasis-Ektodermale Dystrophie) identifiziert. Bei diesen Patienten (besonders auf Sardinien), treten häufig kombinierte Autoimmunerkrankungen auf, zumeist M. Basedow mit Typ I. Diabetes. Der AIRE Gendefekt betrifft ein einzelnes Gen und verhindert die Expression der Autoantigene durch mTEC und damit die negative Selektion. Mechanismen für Autoimmunität an der Schilddrüse: Infektionen Molekulare Freisetzung unzugänglicher Mimikry:Ak Selbstantigene und T-Zellen Bakterien: Kostimulation gegen Selbst Auch späterer Kontakt mit Selbstantigenen (z.B. TSH-Rezeptoren), die bei der negativen Selektion im Thymus nicht berücksichtigt werden, ist eine mögliche Erklärung dafür, warum endokrine Drüsen besonders oft ein Target für Autoimmunität darstellen. Wie oben schon erwähnt, können Bakterieninfektionen hier triggern indem sie 1) Barrieren aufbrechen und Selbstantigene verfügbar machen, 2) über die Mechanismen der Molekularen Mimikry Antikörper induzieren, die zwischen Selbst- und Bakterienantigenen kreuzreagieren oder 3) die Expression von Kostimulatorischen Molekülen (B7) an APCs fördern. Ein von dieser Zelle gerade prozessiertes Autoantigen (andauernd werden auch Zellen, die des normalen Zelltodes sterben, abgeräumt) wird unter bakterieller Kostimulation gleichzeitig mit dem Bakterienantigen exprimiert, und somit kann Toleranz überwunden werden. Klinik bei M. Basedow • Unruhe, Tremor, Schlaflosigkeit • Tachykardie, RR • Wärmeintoleranz, Schwitzen • Heisshunger, Gewichtsverlust • Diarrhoen • Prätibiales Ödem • Osteopathie • Endokrine Orbitopathie Die Klinik beim Morbus Basedow ist bedingt durch die Hyperthyreose und lässt sich mit der dadurch bedingten Grundumsatzsteigerung und dem erhöhten Katabolismus erklären. Hyperthyreose-Symptomatik: • psychosomatische Unruhe und Tremor, vermindertes Schlafbedürfnis, durch erhöhte Stimulation des ZNS • Tachykardie mit Extrasystolen, da T3 eine Sensibilisierung der ß1adrenergen Rezeptoren des Myokards bedingt. • Wärmeintoleranz mit feuchter Haut, durch die vermehrte Thermogenese • Diarrhöen durch Stimulation der glatten Muskulatur • Osteopathie infolge negativer Kalzium-Bilanz Thyreotoxische Krise • Puls > 150 • Herzrhythmusstörungen, Extrasystolen • Unruhe, psychotische Zeichen • Bewusstseinstrübung bis Koma Die maximale Variante einer Hyperthyreose stellt die Thyreotoxische Krise dar. Die Therapie der thyreotoxischen Krise sollte, wenn möglich immer auf einer Intensivstation erfolgen. 1. Symptomatische Therapie - Flüssigkeits-, Elektrolyt-, Kalorienersatztherapie - Betarezeptorblocker - Glukokortikoide (hemmen die Konversion von T4 zuT3) - Temperatursenkung - Sedativa - Thromboembolieprophylaxe 2. kausale Therapie - Hemmung der Hormonsynthese mit Thiamazol - bei der bedrohlichen jodinduzierten thyreotoxischen Krise sind Plasmapherese und die annäherende totale Schilddrüsenresektion die wirksamste kausale Therapie. Endokrine Orbitopathie TRAK erkennen TSHRezeptorähnliche Strukturen an orbitalen Fibroblasten TRAK Glycosaminoglykane Entzündung Ödem Bindegewebe Raumnot ! Die endokrine Opthalmopathie zählt zur Merseburger Trias und tritt bei 50% der Morbus Basedow Patienten auf. Die Symptomatik ist auf zirkulierende TRAKAntikörper gegen ein kreuzreaktives Antigen der Bindegewebszellen im Retrobulbärraum zurückzuführen, die bei 80-90% der Patienten mit Opthalmopathie nachgewiesen werden können. Der Exopthalmus im Rahmen einer Orbitopathie entsteht, durch Ablagerung von Glykosaminoglykanen, durch ein retro-okuläres Ödem, durch lymphozytäre Infiltrate und zunehmender Fibrose. Die Patienten sind nicht nur kosmetisch beeinträchtigt, sondern leiden auch unter tränenden Augen, retro-okulären Druck und ein Lidschluss ist in fortgeschrittenen Fällen nicht möglich, was zu Kopfschmerzen und Sehstörungen wie Doppelbilder führt. Schwere Fälle gehen mit einer venösen Abflußstörung und einer Kompression des Nervus opticus einher, welches bis zur einer Erblindung führen kann. Therapiert wird die endokrine Orbitopathie mit Cortison, mit Methotrexat, mit Bestrahlung oder operativ mit Thyreoidektomie. Wichtig ist es das Rauchen zu unterlassen, in der Nacht den Kopf hochzulagern, Kompressen aufzulegen und Sonnenbrillen zu tragen. Therapie Hyperthyreose • Thyreostatika: Thiamazol, Carbimazol, Propylthiouracil β-Blocker • Radiojodbehandlung (131Jod) - 50% Verkleinerung • Operation. Risiken: Stimmbandlähmung, Parathyreoidea-Entfernung • Spontanheilung Therapeutisches Ziel bei der Hyperthyreose ist die Reduktion der gesteigerten Hormonsekretion durch medikamentöse Unterbindung der Hormonsynthese, durch dosierte Strahlenschädigung der Thyreozyten mit radioaktivem Jod oder operative Reduktion des Schilddrüsengewebes erreicht werden kann. 1.Thyreostatika blockieren die Synthese der Schilddrüsenhormone. Jede Hyperthyreose wir bis zum Erreichen der Euthyreose mit Thyreostatika behandelt. 2. Die Radiojodtherapie ist erst nach Wochen wirksam und muß deshalb mit Thyreostatika vor und nachbehandelt werden. 3. Vor der operativen Therapie sollte immer durch eine thyreostatische Therapie eine Euthyreose erreicht werden. Bei der Operation kommt es zu einer subtotalen Resektion der Schilddrüse unter Belassen von ca. 4 ml Restschilddrüse. Hypothyreose Ursachen 95% primär Hypothyreose TRH T4 • Hashimoto Thyreoiditis • post Radiojodbehandlung +TSH+ +++ • SD Resektion • Dysgenese • Infiltration T3,T4 TPO Wenn die Hormonproduktion der Schilddrüse nicht ausreicht, den Bedarf der Peripherie zu decken, entsteht das Krankheitsbild der Hypothyreose. Alle Formen gehen mit Herabsetzung der Stoffwechselleistung und somit der Wärmeproduktion und des Sauerstoffverbrauches einher. Hypothyreose: Symptome • Ablagerung Glykosaminoglykane • Kapillarpermeabilität - Ödeme • Verlangsamung, Müdigkeit • Bradykardie • Antriebsschwäche • Obstipation • Haare: struppig, stumpf • Kälteintoleranz, Gewichtszunahme Myxödemkoma • Schwäche, Hypothermie • Hypoventilation • Schock Die Hypothyreose führt zu einem hypometabolischen Zustand, der auf einer inadäquat niedrigen Hormonsekretion (T3,T4) beruht. Typische Symptome sind in der oberen Abbildung aufgelistet. Bei Auftreten vor der Geburt sprechen wir von einem Kretinismus, beim Auftreten im Adoleszenten- oder Erwachsenenalter handelt es sich um ein Myxödem. Beim Myxödem werden hydrophile Glykosaminoglykane in das Bindegewebe des gesamten Organismus eingelagert. Die Symptome des Myxödems treten schleichend auf. Es entsteht eine Verlangsamung des Stoffwechsels und damit auch der körperlichen und interlektuellen Aktivität. In maximaler Ausprägung spricht man vom Myxödemkoma. Hashimoto Thyreoiditis TPOs - Antikörper gegen Threoidale Peroxidase Lympho-plasmozytäres Infiltrat, Follikelbildung, Hürtle-Zellen (Epithelz. Mit azidophilen Granula) Hashimoto Thyreoditis ist die häufigste Schilddrüsenentzündung und betrifft vor allem Frauen im 4./5. Lebensjahrzehnt. Die Hashimoto Thyreoiditis ist eine chronische lymphozytäre Thyreoditis, die in einer immunologisch bedingten, ausgedehnten Zerstörung des Schilddrüsenparenchyms mündet. Zusätzliche Kennzeichen sind erhöhte TSH-Spiegel und niedrige Schilddrüsenhormonwerte. Die Schilddrüse ist im frühen Stadium deutlich, meist symmetrisch vergrößert. Sie ist derb aber nicht mit dem umgebenen Gewebe verwachsen. Die Lobuli sind vergrößert. In diesem Stadium kann man eine vorrübergehende Hyperthyreose sehen. Mikroskopisch besteht ein sehr dichtes, lympho-plasmazelluläres Infiltrat mit Makrophagen und meist Ausbildungen von Follikelzentren. Die Schilddrüsenfollikel sind ausgedehnt zerstört und konfluieren zu Zellsträngen. Früh tritt eine Fibrose auf. Der Beginn der Krankheit ist schleichend. Es bestehen meist weder Schmerzen noch allgemeine Entzündungszeichen. Aufgrund der Zerstörung des Schilddrüsenparenchyms entwickelt sich eine Hypothyreose, deren Schweregrad über Monate und Jahre sehr langsam zunimmt. Hashimoto Thyreoiditis: autoimmun • HLA-DR5 • Antikörper gegen Peroxidase (TPO) • Antikörper gegen Thyreoglobulin • CTLs CTL ZELLULÄR ? TH Zellen ZYTOTOXIZITÄT NK ADCC Lymphozytäre Thyreoiditis Ursache der Autoimmunthyreoiditis ist eine Aktivierung von THLymphozyten über bisher nicht eindeutige geklärte Mechanismen (Infektionen?). Die CD4+-T-Zellen rekrutieren sowohl zytotoxische CD8+-Lymphozyten als auch B-Lymphozyten. Die zytotoxische Zerstörung der Thyreozyten durch die CD8+-Zellen wird als Ursache für die Hypothyreose angesehen. Gleichzeitig induzieren Zytokine die Expression von HLA-2-Moleküle an den Thyreozyten. Dies ist eine Vorraussetzung für die häufig zu beobachtende Antikörperbildung gegen Bestandteile von Schilddrüsenzellen. Im klinischen Alltag sind thyroidale PeroxidaseAntikörper (TPA) Marker für das Vorliegen einer Autoimmunthyreoditis. Diese können im Zusammenspiel mit NK-Zellen ADCC (Antibodydependent cellular cytotoxicity), oder mit Complement CDC (complementdependent cytotoxicity) verursachen. Therapie: Unabhängig von der Genese der Hypothyreose ist immer die Substitution mit schrittweise steigenden Dosen von Schilddrüsenhormonen erforderlich.