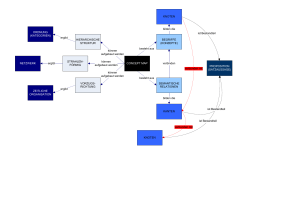
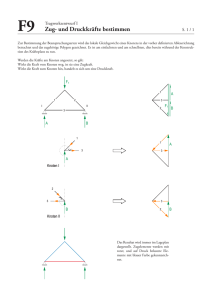
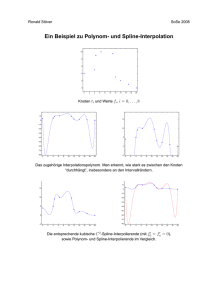
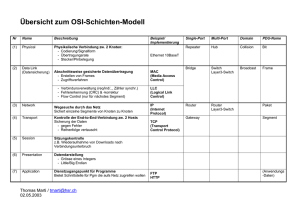
Vergleich verschiedener elastografischer Verfahren bei der
Werbung

Universität Ulm Zentrum für Innere Medizin Klinik für Innere Medizin I Ärztlicher Direktor: Prof. Dr. Thomas Seufferlein Vergleich verschiedener elastografischer Verfahren bei der Beurteilung fokaler Schilddrüsenläsionen Dissertation zur Erlangung des Doktorgrades der Medizin der Medizinischen Fakultät der Universität Ulm Caroline Hanna Schreiner Geboren in Ulm 2015 Amtierender Dekan: Prof. Dr. rer. nat. Thomas Wirth 1. Berichterstatter: Prof. Dr. med. Wolfgang Kratzer 2. Berichterstatter: Prof. Dr. med. Martin Wabitsch Tag der Promotion: 16.Juni 2016 Die Widmung wurde aus Gründen des Datenschutzes entfernt. II Inhaltsverzeichnis Abkürzungsverzeichnis 1 Einleitung ........................................................................................................1 1.1 Der Schilddrüsenknoten ........................................................................................ 1 1.2 Die Ultraschallelastografie ..................................................................................... 4 1.3 Unterschiedliche Arten der Elastografie ................................................................. 6 1.4 Aktuelle Studien zur Schilddrüsenelastografie ....................................................... 7 1.5 Fragestellung......................................................................................................... 8 2 Material und Methoden ..................................................................................9 2.1 Studienpopulation, Ablauf der Datenerhebung und der Untersuchung................... 9 2.2 Fragebogen ..........................................................................................................10 2.3 Ultraschalluntersuchung .......................................................................................11 2.4 Elastografische Untersuchung ..............................................................................14 2.5 Pathologisches Gutachten ....................................................................................22 2.6 Statistische Methoden ..........................................................................................22 2.7 Ethikvotum ...........................................................................................................23 2.8 Multicenter-Studie ................................................................................................24 3 Ergebnisse ....................................................................................................25 3.1 Geschlechts-, Alters- und Dignitätsverteilung im Gesamt- und Endkollektiv .........25 3.2 B-Bild-Kriterien der Schilddrüse deskriptiv und bivariat .........................................28 3.3 B-Bild Kriterien der Läsion deskriptiv und bivariat .................................................31 3.4 Grafische Darstellung der Kompressions- und Scherwellenelastografie ...............36 3.5 Semiquantitative Kompressionselastografie und numerische Darstellung der Scherwellenelastografie .......................................................................................42 III Inhaltsverzeichnis 4 Diskussion ....................................................................................................57 4.1 B-Bild-Parameter der Schilddrüse ........................................................................57 4.2 B-Bild-Kriterien, Durchblutungsmuster und TIRADS-Klassifikation der Läsion ......59 4.3 Geräteübergreifende Diskussionspunkte der Elastografie ....................................64 4.4 Vergleich der Arten der Elastografie .....................................................................70 4.5 Weitere Vergleichsmessungen der numerischen Scherwellenelastografie ...........93 4.6 Stärken und Schwächen der Studie......................................................................98 4.7 Schlussfolgerung ................................................................................................100 5 Zusammenfassung ....................................................................................101 6 Literaturverzeichnis ...................................................................................103 IV Abkürzungsverzeichnis A. Arteria Abb. Abbildung ARFI Acoustic Radiation Force Impulse AUROC area under the curve ASQ Acoustic Structure Quantification B-Bild Brightness-Bild BIRADS Breast Imaging Reporting and Data System BMI body mass index bzgl. bezüglich bzw. beziehungsweise ca. circa CAT chronisch autoimmune Thyreoiditis cm Zentimeter DEGUM Deutsche Gesellschaft für Ultraschall in der Medizin d.h. das heißt EFSUMB European Federation of Societies for Ultrasound in Medicine and Biology ES Elastografiescore FNAB Feinnadelaspirationsbiopsie GCP Good Clinical Practice Inc. Incorporated kg Kilogramm Kn Knoten kPa Kilopascal m Meter M. Musculus ml Milliliter mm Millimeter MNSR muscle-to-nodule strain ratio m/s Meter pro Sekunde OR odds ratio PNSR parenchyma-to-nodule strain ratio ROC receiver operating characteristic ROI region of interest V Abkürzungsverzeichnis RTE Realtime-Elastografie s. siehe SD Schilddrüse sog. sogenannte STD Standarddeviation Tab. Tabelle TSH Thyreotropin TIRADS Thyroid Imaging Reporting and Data System u.a. unter anderem US Ultraschall vgl. vergleiche vs. versus VTI Virtual Touch™ Imaging VTQ Virtual Touch™ Quantification VTIQ Virtual Touch™ IQ z.B. zum Beispiel 1 Einleitung 1 Einleitung 1.1 Der Schilddrüsenknoten 1.1.1 Epidemiologie und Einteilung Je nach angewandter Untersuchungsmethode sind existente Schilddrüsenknoten in der untersuchten Population unterschiedlich gut zu finden: in 4-7% bei der Palpation, in 20-76% bei der Ultraschalluntersuchung der Schilddrüse und in 5065% bei einer Autopsie [64]. In einer von Reiners et al. publizierten Studie wurde die Schilddrüse von 96278 Berufstätigen auf mögliche Schilddrüsenpathologien sonografisch untersucht, wobei die Daten Schilddrüsenbehandlung von aus Patienten den mit Analysen kürzlich stattgefundener ausgeschlossen wurden. Schilddrüsenknoten, die größer als 0,5 cm waren, fanden sich in 21,9% der Fälle. Mit steigendem Alter nahm in beiden Geschlechtern die Prävalenz von Knoten zu, Frauen waren in allen Altersklassen häufiger betroffen als Männer [67]. Von diesen Knoten stellen 4-6,5% maligne Veränderungen dar, der viel größere Anteil ist jedoch benignen Ursprungs: Ursachen für gutartige Knoten sind die unterschiedlichen Arten von Thyreoiditiden, einfache oder hämorrhagische Zysten, Kolloidzysten, follikuläre (autonome) oder Hürthle-Zell Adenome und adenomatöse Knoten [34, 62, 64]. Wird bei der palpatorischen oder sonografischen Untersuchung der Schilddrüse ein sog. Inzidentalom (=der zufällig entdeckte Schilddrüsenknoten) entdeckt, wird eine Differenzierung zwischen benignem und malignem Befund unumgänglich [64]. 1.1.2 Der maligne Schilddrüsenknoten Die Gruppe der Karzinome stellt mit mehr als 95% der Schilddrüsenmalignome die größte Entität dar. Die häufigsten histologischen Typen des malignen Schilddrüsenknotens sind die differenzierten Karzinome, das papilläre und das follikuläre Schilddrüsenkarzinom (85% bzw. 5-15% der Schilddrüsen-karzinome), gefolgt von medullärem (5%) und anaplastischem (weniger als 5%) Karzinom, selten sind 2 Einleitung maligne Hämangioendotheliome, Sarkome und primäre Lymphome, sowie Metastasen eines in einem anderen Gebiet lokalisierten Primärtumors [50, 52]. 4220 Frauen und 1670 Männer erkrankten in Deutschland im Jahr 2010 neu an einer malignen Neoplasie der Schilddrüse. Nach einer Prognose des Robert KochInstituts steigt die Inzidenz 2014 deutschlandweit auf 5100 Frauen und 2100 Männer, das sind 12,4 bzw. 5,2 neue Fälle pro 100000 Einwohner. Dieser kontrovers diskutierte Inzidenzanstieg ist seit 1980 zu beobachten, wohingegen sich die Mortalitätsraten gegensätzlich entwickelten und kontinuierlich abfallen. Das Robert Koch-Institut nimmt in seinem Bericht allerdings weniger einen tatsächlichen als vielmehr einen anscheinenden Inzidenzanstieg an. Dieser sei durch die stetige Verbesserung der technischen Untersuchungsmethoden begründet [5, 40]. Auch Pellegriti et al. führen diesen Grund für den Inzidenzanstieg in ihrer Arbeit an, gehen darüber hinaus jedoch auch von einem tatsächlichen Anstieg, möglicherweise bedingt durch eine erhöhte Strahlenbelastung der Bevölkerung und anderen, bisher nicht identifizierten Einflussfaktoren, aus [63]. Ebenfalls gelangen Brito et al. in ihrer Arbeit zu diesem Ergebnis [11]. Unabhängig von einem tatsächlichen Anstieg sieht sich die Klinik mit einer höheren Patientenanzahl und der erforderlichen Diagnostik und Therapie konfrontiert. Da das anaplastische Schilddrüsenkarzinom gehäuft bei Patienten mit positiver Anamnese eines differenzierten Karzinoms auftritt, wird vermutet, dass es sich pathogenetisch um ein aus den differenzierten Karzinomen genetisch weiterverändertes (insbesondere durch Verlust des p53-Tumorsuppressorgens)= „dedifferenziertes“ Karzinom handelt. Es zählt deswegen mit zu den aggressivsten Neoplasien des Menschen und führt durch unaufhaltsames lokales Wachstum und Kompression von vital wichtigen Strukturen im Halsbereich innerhalb von einem Jahr zum Tod. Die 10-Jahresüberlebensraten bei Patienten mit differenzierten Schilddrüsenkarzinomen sind dagegen sehr gut und betragen über 90% für das papilläre und 75-80% für das follikuläre Karzinom [50, 52]. So wie in der Ätiologie vieler anderer Tumoren auch, stehen Genmutationen von Onkogenen und Tumorsuppressorgenen oder strukturelle Chromosomen- aberrationen am Beginn der Pathogenese eines Schilddrüsenkarzinoms. Für die histologisch unterschiedlichen Genmutationen identifiziert. Tumortypen wurden bereits verschiedene 3 Einleitung Die chromosomalen Aberrationen werden entweder vererbt oder ereignen sich im Laufe des Patientenlebens sporadisch, wobei sie zum Teil durch Umwelteinflüsse oder endogene Faktoren begünstigt werden können. Einige Risikofaktoren werden hierbei im Zusammenhang mit der Entstehung von Schilddrüsenkarzinomen diskutiert, nur ein einziger gilt allerdings bisher als gesichert: die Exposition gegenüber ionisierender Strahlung (z.B. im Rahmen einer Radiotherapie) vor allem im Kindesalter. Zudem finden sich in der Anamnese der Patienten gehäuft Jodmangel und benigne Schilddrüsenerkrankungen, wie Strumae und Adenome, wobei die Jodversorgung sich wohl eher in der histologischen Verteilung der Karzinome zeigt. So nehmen bei einer erhöhten Jodzufuhr die papillären Karzinome anteilig zu. Weitere untersuchte Risikofaktoren sind große Körpergröße, hohes Körpergewicht und hormonelle Einflüsse, wie TSH-Stimulation der Schilddrüse und Östrogene, letztere vor allem deshalb, da Frauen in etwa doppelt so häufig betroffen sind [40, 50, 52]. 1.1.3 Diagnostik und Therapie Wird ein Schilddrüsenknoten entdeckt, erfolgen zunächst die Anamnese, die körperliche Untersuchung und die Bestimmung der schilddrüsenspezifischen Laborparameter. Anschließend finden die bildgebenden gerätegestützten und eventuell invasiven Untersuchungen statt. Heutiger Goldstandard für die zytologische Untersuchung von Schilddrüsenknoten ist die Feinnadelaspirationsbiopsie (FNAB) [34, 62]. Doch auch wenn die FNAB der Goldstandard der zytologischen Diagnostik ist, weist sie Schwächen auf: Zum einen birgt sie als invasive Untersuchungsmethode Risiken für die Patienten wie Infektion, Blutung und Beschädigung von Strukturen und zum anderen liefert sie in 10-20% der Fälle keine diagnostischen Ergebnisse [50, 62]. Die Sonografie wird in der Untersuchung von Schilddrüsenknoten eingesetzt, um eventuell vorhandene morphologische Hinweise für Malignität zu detektieren. In Nachfolgeuntersuchungen ist sie zudem aussagekräftig in Bezug auf das relative Knotenwachstum und kann somit zur Risikobewertung beitragen. Sie hat gegenüber der FNAB zwei wichtige Vorteile: Sie ist nicht invasiv und die Diagnostik kann zeitlich sofort erfolgen. 4 Einleitung Die Ergebnisse zweier großer Metaanalysen konnten sonografische Risikofaktoren für maligne Knoten identifizieren, jedoch gibt es außer dem invasiven Knotenwachstum keinen zuverlässig Knotenparameter [12, 16]. Die Therapie des Schilddrüsenknotens richtet sich nach den Diagnostikergebnissen: Bei malignen Knoten wird abhängig vom histologischen Typ und vorhandenen Metastasen eine Hemi- oder totale Thyreoidektomie mit oder ohne Lymphknotendissektionen durchgeführt. Die Therapie eines benignen Knotens besteht in der Verlaufskontrolle bzw. einer (subtotalen) Lappenresektion, Hemi- oder totalen Thyreoidektomie bei lokalen Symptomen oder anders nicht beherrschbarer Schilddrüsenüberfunktion [1, 20]. 1.2 Die Ultraschallelastografie Das Abtasten von Gewebe, die Palpation, gehört seit jeher zur ärztlichen Tätigkeit. Sie findet im Rahmen der körperlichen Untersuchung eines Patienten statt, um so eventuell vorhandene Pathologien des Gewebes oder der Organe zu detektieren, die sich aufgrund ihrer veränderten Gewebsstruktur vom normalen, gesunden Gewebe unterscheiden. Die Palpation ist limitiert durch die Subjektivität und Erfahrung des Arztes zum einen und zum anderen durch die Lage und Größe des zu untersuchenden Gewebes. Verändern sich mit der Entstehung einer Pathologie des Gewebes seine physikalischen und strukturellen Eigenschaften, findet häufig eine Zunahme der Steifigkeit mit resultierender Abnahme der Elastizität dieses Gewebes statt. Vor allem maligne Neoplasien sind verbunden mit einer Härtezunahme. Um nun die Elastizität eines Gewebes im Gegensatz zur Palpation objektiv sichtbar und messbar zu machen, wurde Anfang der neunziger Jahre zum ersten Mal Elastografie auf Basis der Sonografie erprobt. Wenige Jahre später wurde die Elastografie in der Magnetresonanztomografie vorgestellt. Die Elastografie ist eine dynamische Technik, die auf der physikalischen Tatsache beruht, dass sich weiches Gewebe unter Druckeinwirkung leichter deformieren lässt als hartes Gewebe. Diese Unterschiede in der Deformierung werden visualisiert. Die Idee, benigne Gewebeeigenschaften Knoten anders würden sich darstellen als aufgrund maligne ihrer Knoten, elastografische Untersuchung von Schilddrüsenknoten ein [48, 54, 58]. weicheren führte die 5 Einleitung In den letzten 20 Jahren wurden dann die beiden unterschiedlichen Elastografieverfahren weiterentwickelt, wobei vor allem die Ultraschallelastografie aufgrund ihres kostengünstigeren und weniger zeitintensiven Aufwands enormen Zuspruch und Fortschritt erfahren hat. Lyshchik et al. publizierten 2005 die erste Veröffentlichung zur elastografischen Untersuchung von Schilddrüsenknoten [49]. 2008 sprach sich die Deutsche Gesellschaft für Ultraschall in der Medizin e.V. (DEGUM) für den Einsatz der Elastografie in der Krebsdiagnostik aus: Tumorherde würden sich genauer lokalisieren lassen, eine Biopsie zur Untersuchung des Gewebes könne mit einer um 20% gesteigerten Genauigkeit im Vergleich zum konventionellen Ultraschall durchgeführt und Fehldiagnosen vermieden werden [21]. Die meisten marktführenden Hersteller von sog. „High-End-Ultraschallgeräten“ bieten eine Elastografieapplikation in ihren neueren Ultraschallgeräten an. Auch finden sich in aktuellen Lehrbüchern zur Schilddrüsenultraschalldiagnostik bereits ganze Kapitel zum Thema Elastografie von Schilddrüsenknoten [6, 36, 45, 72, 78]. Die Elastosonografie der Schilddrüse ist durch die oberflächliche Lage der Schilddrüse und ihre Komprimierbarkeit gegen die darunterliegenden anatomischen Strukturen gut anzuwenden und bietet die Vorteile einer Ultraschalluntersuchung: nicht-invasive Untersuchungsmethode, keine Risiken für den Patienten, keine Kontraindikationen und aufgrund der apparativen Möglichkeiten schnell durchführbar. Unsicherheit besteht darüber, ob alle Arten von Schilddrüsenmalignomen elastografisch beurteilbar sind und welchen Einfluss zystische Anteile und Kalzifizierungen auf die Messung haben [6]. Neben der Schilddrüse gibt es inzwischen weitere zahlreiche klinische Anwendungsmöglichkeiten für die Elastografie: Zu den häufigsten Fragestellungen zählen die Knotendiagnostik der Mamma, die Prostatakarzinomabklärung, sowie die Diagnostik der Leberzirrhose. Des Weiteren werden der Hoden oder auch Achillessehnenerkrankungen elastosonografisch geprüft. Neuere Publikationen beschäftigen sich zudem mit der endosonografisch durchgeführten Elastografie von mediastinal gelegenen Gastrointestinaltraktes [22]. Lymphknoten, dem Pankreas und des 6 Einleitung 1.3 Unterschiedliche Arten der Elastografie Je nach Hersteller und Gerät werden unterschiedliche Techniken und Bewertungen dieser für die elastografische Untersuchung verwendet. Basierend auf der Technik gibt es Ultraschallgeräte, bei welchen die Gewebskompression manuell vom Untersucher durch den Schallkopf auf das Gewebe aufgebracht wird. Wird das so entstandene Elastogramm vom Untersucher einer Farbklassifikation zugeordnet, spricht man von der sog. qualitativen Kompressions- oder Realtime-Elastografie (RTE). Die verschiedenen Farbklassifikationen unterscheiden drei bis sechs unterschiedliche Elastogrammfarbzusammensetzungen. Da die qualitative Kompressionselastografie jedoch aufgrund variierender Kompressionsstärke und subjektiver Klassifikationseinteilung untersucherabhängig ist, wurde von den Geräteherstellern die Kompressionselastografie in Form der sog. Strain-Ratio weiter entwickelt. Die Strain-Ratio bildet das Belastungsverhältnis von zwei vom Untersucher definierten Geweben oder Gewebsanteilen ab. Da sich durch die Division der beiden Belastungswerte Einflüsse auf beiden Seiten ausgleichen und absolute Zahlenwerte für das Verhältnis angegeben werden, spricht man von der semiquantitativen Elastografie. Auf der anderen Seite gibt es Ultraschallgeräte, die sich nicht einer manuellen Kompression durch den Untersucher bedienen, sondern bei welchen der Schallkopf selbstständig in der Lage ist, durch die Generierung von akustischen Druckimpulsen das Gewebe untersucherunabhängig zu komprimieren. Diese akustischen Druckimpulse bewirken im Gewebe die Entstehung von sog. Scherwellen, deren Geschwindigkeiten wiederum vom Ultraschallgerät mittels Detektionswellen gemessen werden können. Diese Ultraschallgeräte arbeiten mit Hilfe der Acoustic Radiation Force Impulse (ARFI) Technologie oder der Supersonic Shearwave Technologie, welche beide auch als quantitative Elastografie bezeichnet werden. Der Untersucher hat die Möglichkeit sich die gemessenen Geschwindigkeiten farblich als Elastogramm oder an von ihm festgesetzten Punkten als absolute Zahlen in m/s oder in kPa für die gemessene Elastizität anzeigen zu lassen. In ursprünglicheren Arbeiten findet sich vor allem die früher entwickelte, qualitative Elastografie. Doch aufgrund des Versuches die Messungen objektiver und Studien und Ergebnisse vergleichbarer zu machen, entwickelten sich die semiquantitative und die quantitative Elastografie, die sich immer stärker etablieren [6, 17]. 7 Einleitung 1.4 Aktuelle Studien zur Schilddrüsenelastografie Zahlreiche Studien zur Bestimmung der diagnostischen Wertigkeit der Schilddrüsenelastografie mit unterschiedlichen Versuchsaufbauten und Variablen sind bisher veröffentlicht. Bojunga et al. und Sun et al. fassten 2010 bzw. 2014 daher die bis dato publizierten Arbeiten und Ergebnisse in Metaanalysen zusammen. Während Bojunga et al. in ihrer Arbeit mit acht Studien noch eine sehr gute Sensitivität von 92% und Spezifität von 90% für die qualitative Elastografie in der Differenzierung zwischen benignen und malignen Knoten fanden, konnten Sun et al. diese hohen diagnostischen Werte in ihrer Arbeit mit 31 Studien nicht mehr bestätigen: für die qualitative Elastografie betrug die Sensitivität 79% und die Spezifität 77%, für die semiquantitative Elastografie die Sensitivität 85% und Spezifität 80% [10, 77]. Doch nur drei Studien haben bisher Schilddrüsenknoten an zwei unterschiedlichen Ultraschallgeräten untersucht: Friedrich-Rust et al., Bojunga et al. und Slapa et al. Friedrich-Rust et al. untersuchten 2011 Schilddrüsenknoten mittels ARFITechnologie und mittels Kompressionselastofgrafie. Den Schwerpunkt legten die Autoren weniger auf den direkten Vergleich der Methoden als vielmehr auf die Frage, ob Schilddrüsenknoten überhaupt für die ARFI-Technologie zugänglich seien und berechneten daher außer dem signifikanten Spearman Korrelationskoeffizienten von 0,31 zwischen den beiden Methoden keine weiteren diagnostischen Werte [27]. Die nachfolgende Studie dieser Arbeitsgruppe, publiziert von Bojunga et al., beinhaltete 158 Knoten, die zum einen mit der Realtime-Elastografie (RTE) eines Hitachi Ultraschallgerätes und zum anderen mit der ARFI-Bildgebung der Virtual Touch™ Quantification (VTQ) Software eines Siemens Acuson S2000 untersucht wurden. Zur statistischen Auswertung wurde im Rahmen der „receiver operating characteristics“ die Fläche unter der Kurve für beide Verfahren berechnet: Die RTE zeigte mit 0,74 die bessere Diskriminationsfähigkeit von benignen und malignen Knoten im Vergleich zur ARFI-Schwellengrenze von 2,57 m/s mit 0,69. Bei der Berechnung der einzelnen diagnostischen Werte wies die RTE mit 76% die höhere Sensitivität, die ARFI-VTQ die höhere Spezifität mit 85% auf. Es gab keinen signifikanten Unterschied zwischen beiden Untersuchungsmethoden [9]. 8 Einleitung Eine letzte vergleichende Arbeit mit sechs Knoten (eine maligne Histopathologie) wurde publiziert von Slapa et al. Die Kompressionselastografie wurde an einem Toshiba Ultraschallgerät, die Scherwellenelastografie an einem Supersonic Image Ultraschallgerät untersucht: die Scherwellenelastografie wies ein richtig positives und fünf richtig negative Ergebnisse auf, die Kompressionselastografie fünf falsch positive und ein falsch negatives Ergebnis. Diagnostische Werte wurden aufgrund der kleinen Fallzahl nicht berechnet. Die falsch positiven Knoten wiesen mindestens eines der folgenden Kriterien auf: flüssiger oder degenerativer Inhalt, fokal erhöhte Steifigkeit durch Mikrokalzifikationen, die im B-Bild teilweise nicht sichtbar waren. Die Autoren folgerten, dass die Scherwellenelastografie im Gegensatz zur Kompressionselastografie auch bei Knoten mit diesen Charakteristika effektiv für eine Differenzierung eingesetzt werden könne [74]. Bisher gibt es keine Arbeiten, die die drei Ultraschallgeräte dieser Studie und ihrer Techniken miteinander verglichen haben. 1.5 Fragestellung Ziel dieser Arbeit ist es, die unterschiedlichen Elastografiemodalitäten der drei „High-End-Ultraschallgeräte“, des Hitachi HI VISION Ascendus, des Toshiba Aplio 500 und des Siemens Acuson S3000 Ultraschallgerätes für die Differenzierung zwischen benignen und malignen Schilddrüsenknoten zu untersuchen. Hierzu sollen ihre diagnostischen Wertigkeiten ermittelt und miteinander verglichen werden. 9 Material und Methoden 2 Material und Methoden 2.1 Studienpopulation, Ablauf der Datenerhebung und der Untersuchung Die Auswahl der Patienten erfolgte konsekutiv. Patienten, die in den folgenden Tagen in der Viszeralchirurgie der Universität Ulm an der Schilddrüse operiert werden sollten, wurden mündlich und schriftlich über die Studie aufgeklärt und das schriftliche Einverständnis der Patienten wurde eingeholt. Patienten, die folgende Einschlusskriterien erfüllten, wurden in die Studie aufgenommen: 1. Alter >18 Jahre 2. Ein oder mehrere Schilddrüsenknoten, die sonografisch untersucht werden konnten 3. Operation der Schilddrüse innerhalb von fünf Tagen nach der sonografischen Diagnostik 4. Histopathologische Diagnostik des bei der Operation entnommenen Schilddrüsengewebes 5. Schriftliche Einverständniserklärung des Patienten nach Aufklärung Bei Vorliegen eines der folgenden Ausschlusskriterien wurde der Patient von der Studie ausgeschlossen: 1. Alter <18 Jahre 2. Instabile medizinische Verfassung, welche die Untersuchungen beeinträchtigte 3. Jegliche Kontraindikation gegen eine Ultraschalluntersuchung 4. Kürzlich stattgefundene Schilddrüsenoperation 5. Schilddrüsenknoten mit folgenden Eigenschaften: Rein zystische Knoten Kalzifizierte Umhüllung des Knotens 6. Unzureichende Datensätze Insgesamt wurden 52 Patienten im Zeitraum von Dezember 2012 bis Juni 2013 untersucht, von welchen nach Ausschluss aufgrund unzureichender Datensätze noch 41 in die endgültige statistische Auswertung einbezogen wurden. 10 Material und Methoden Pro Patient wurden ein, zwei oder drei Knoten untersucht. Als Gesamtzahl der untersuchten Knoten ergab sich 69, in das Endkollektiv wurden noch 53 Knoten eingeschlossen. Am Beginn der Datenerhebung wurde zunächst gemeinsam mit den Patienten ein standardisierter Fragebogen ausgefüllt. Nachfolgend wurde die Ultraschalluntersuchung durchgeführt, bei welcher zunächst die B-Bild-Kriterien und anschließend die Elastografieparameter erhoben wurden. Das pathologische Gutachten als Referenz wurde postoperativ eingeholt. 2.2 Fragebogen Folgende Daten wurden mit den Patienten in einem Fragebogen erfasst: 1. Angaben zur Person: Name, Alter, Geschlecht; 2. Anamnese zur Schilddrüse allgemein: Erkrankungen (Hypo-/Hyperthyreose, Morbus Basedow, Hashimoto-Thyreoiditis) und deren Erstdiagnose, stattgefundene Operationen im Schilddrüsen- und Halsbereich; 3. Anamnese der aktuell im Fokus stehenden Schilddrüsenläsion: Erstdiagnose, aktuelle Beschwerden (Schmerzen, Globusgefühl, Heiserkeit, Stridor, Druck, Atembeschwerden, Dysphagie), vorangegangene Eingriffe (Biopsie, Operation), stattgefundene Radiojodtherapie, Gewichtsverlust; 4. Familienanamnese (Schilddrüsenerkrankungen, Schilddrüsenkrebs) Die Angaben zu Größe, Gewicht und Medikamenteneinnahme der Patienten wurden aus dem anästhesiologischen Narkoseprotokoll postoperativ erhoben. Der Body-Mass-Index (BMI) wurde anhand der Formel BMI berechnet. Gewicht kg Körpergröße ² m² 11 Material und Methoden 2.3 Ultraschalluntersuchung 2.3.1 Geräte, Einstellungen und Ablauf Die Ultraschalluntersuchung erfolgte an drei unterschiedlichen Ultraschallgeräten, dem HI VISION Ascendus (Schallkopf: L74M13-5), dem Toshiba Aplio 500 (Schallkopf: PLT-805AT 8MHz) und dem Siemens Acuson S3000 (Schallkopf: 9L4). Hierbei erfolgte die Erhebung der B-Bild-Kriterien in der Regel am HI VISION Ascendus, die Erhebung der Elastografiewerte an allen drei Geräten. Vor jeder Untersuchung wurden an allen drei Geräten identische Einstellungen vorgenommen und im Hinblick auf die bestmögliche Darstellung der Schilddrüse und der Läsion leichtgradig modifiziert. Jede Untersuchung erfolgte durch einen sehr erfahrenen Ultraschalldiagnostiker (mehr als 3000 Schalls pro Jahr) und zwei mehrere Monate in der Ultraschalldiagnostik ausgebildete Doktorandinnen. 2.3.2 B-Bild-Parameter Für die Untersuchung wurden die Patienten in Rückenlage mit überstrecktem Hals gelagert, sodass die Schilddrüse gut zugänglich war.Folgende B-Bild-Kriterien der Schilddrüse wurden im Rahmen der Untersuchung erhoben: 1. Volumina des rechten und linken Schilddrüsenlappens, Breite des Isthmus 2. Echogenität, Homogenität, zystische Anteile der Schilddrüse in Prozent 3. Anzahl der vorhandenen Läsionen Folgende Parameter wurden von der Läsion erhoben: 1. Größe, Form, Lage in der Schilddrüse 2. Volumen, V= nach folgender 4 𝐿ä𝑛𝑔𝑒+𝐵𝑟𝑒𝑖𝑡𝑒+𝑇𝑖𝑒𝑓𝑒 3 𝜋∗( ) 3 6 1000 Formel (Volumen einer Kugel): (ml) 3. Verhältnis von anteroposteriorem zu transversalem Durchmesser 4. Echogenität, Homogenität, zystische Anteile der Läsion in Prozent 5. Randbeschaffenheit (regelmäßig/unregelmäßig) 6. Vorhandensein des Halo-Zeichens (=echoarmer Randsaum) 7. Vorhandensein von Mikro- (<1 mm) und/oder Makrokalzifizierungen (≥1 mm) 12 Material und Methoden 2.3.3 Durchblutung der Läsion im Color-Doppler-Modus Die Durchblutung wurde mit Hilfe des Color-Doppler-Modus der Geräte dargestellt und einem der folgenden fünf Vaskularisationsmuster nach Ivanac et al. zugeordnet (Abbildung 1) [39]: Muster 0: keine sichtbare Durchblutung Muster 1: minimaler zentraler Blutfluss ohne peripheren Ring Muster 2: peripherer ringförmiger Blutfluss ohne oder mit minimalem zentralem Blutfluss Muster 3: peripherer ringförmiger Blutfluss und geringer bis mäßig ausgeprägter Blutfluss innerhalb des Knotens Muster 4: ausgeprägter zentraler Blutfluss mit oder ohne peripheren Ring Abbildung 1: Schematische Darstellung des allgemeinen Erscheinungsbildes Schilddrüsenknoten für die Vaskularisationsmuster 1 bis 4 nach Ivanac et al. [39] der 2.3.4 TIRADS-Klassifikation Abschließend erfolgte die Einteilung des Knotens anhand seiner sonografischen Charakteristika entsprechend der Thyroid Imaging Reporting and Data System (TIRADS) Klassifikation. Diese ist in Tabelle 1 gezeigt und wurde von Horvath et al. entwickelt [37]. Die Zuteilung des Knotens erfolgte hier neben dem Hauptuntersucher zusätzlich durch zwei weitere sehr erfahrene Ultraschalldiagnostiker (mehr als 3000 Ultraschalls pro Jahr), wobei bei Uneinigkeit der Mehrheitskonsens entschied. 13 Material und Methoden Tabelle 1: Thyroid Imaging Reporting and Data System (=TIRADS) nach Horvath et al. [37] Aufgeführt sind die TIRADS-Kategorien mit ihrem jeweiligen Risiko für Malignität, ihren Ultraschall-Mustern (=US-Muster) und der Beschreibung dieses Ultraschall-Musters. TIRADSKategorie 1 stellt die unauffällige, normale Schilddrüse dar. In der TIRADS-Kategorie 6 wurde mittels Biopsie die Malignität des Gewebes nachgewiesen. Thyroid Imaging Reporting and Data System (TIRADS) TIRADS-Kategorie TIRADS 1 TIRADS 2 TIRADS 3 Malignitätsrisiko US-Muster Beschreibung des US-Musters Kolloidtyp 1 anechogen mit hyperechogenen Punkten; nicht vaskularisiert Normale Schilddrüse Kolloidtyp 2 Gutartig Wahrscheinlich gutartig TIRADS Unbe- 4A stimmt TIRADS 4B Suspekt 0% < 5% 5-10% 10-80% Kolloidtyp 3 Hashimoto Pseudoknoten Hyper-, iso-, oder hypoechogen; unvollständige Kapsel mit peripherer Vaskularisation; bei Hashimoto-Thyreoiditis Einfaches neoplastisches Muster Solide oder gemischt hyper-, iso-, oder hypoechogen; mit dünner Kapsel De QuervainMuster Hypoechogene Läsion mit unscharfer Begrenzung; ohne Kalzifizierungen Suspektneoplastisch Hyper-,iso-, oder hypoechogen; hypervaskularisiert; vollständige, dicke Kapsel; mit (Makro- oder Mikro-) Kalzifizierungen Malignes Muster A Hypoechogen; keine Kapsel; mit unregelmäßiger, unscharfer Begrenzung; einwachsende Gefäße; mit oder ohne Kalzifizierung 5 mit Malignität 6 Bioptisch gesicherte Malignität 100% 8 Malignes Muster 0 B % Iso- oder Hypoechogen; keine Kapsel; mit multiplen peripheren Mikrokalzifizierungen und Hypervaskularisierung Malignes Muster Keine Kapsel; isoechogen; gemischt hypervaskularisiert mit oder ohne Kalzifi- C TIRADS Punkten; vaskularisiert; spongiforme Struktur keine Kapsel; gemischte Echogenität mit solidem Anteil; isoechogen; verdrängend; vaskularisierter Knoten mit hyperechogenen Punkten Vereinbar TIRADS keine Kapsel; gemischte Echogenität; nicht verdrängend; mit hyperechogenen zierungen; ohne hyperechogene Punkte 14 Material und Methoden 2.4 Elastografische Untersuchung Im Anschluss an die B-Bild-Diagnostik wurde die elastografische Untersuchung der Läsion an allen drei Ultraschallgeräten durchgeführt. 2.4.1 HI VISION Ascendus Im Elastografiemodus „Real-time Tissue Elastography“ des Gerätes wurden zunächst zwei Bilder nebeneinander im sog. Split-Screen-Modus dargestellt: ein farbiges Elastogramm neben dem herkömmlichen B-Bild. Auf dem Elastogramm wurde eine sog. region of interest (ROI) vom Untersucher festgelegt, welche den Knoten möglichst vollständig und Anteile der gesunden Schilddrüse mit einschloss. Anschließend wurde vom Untersucher manuell mit der Ultraschallsonde leichter Druck periodisch auf die Schilddrüse aufgebracht und dieser auf einer numerischen Skala am linken Bildrand überprüft: Befand sich der Druck zwischen 3 und 5 auf dieser Skala, wurde laut Hersteller der optimale Druck appliziert und der Untersucher konnte das Elastogramm für die Datenerhebung heranziehen. Sowohl im Quer- als auch im Längsschnitt wurde ein qualitatives Elastogramm erhoben. Auf diesen wurden die Farbkompositionen des Knotens und des umgebenden Parenchyms beurteilt und einem der folgenden und in Abbildung 2 schematisch dargestellten vier Elastografiescores (ES) nach Asteria et al. zugeordnet [2]: ES 1: homogen grüner Knoten ES 2: überwiegend grüner Knoten mit peripheren und/oder zentralen blauen Anteilen ES 3: überwiegend blauer Knoten mit grünen und roten Anteilen oder Punkten ES 4: homogen blauer Knoten Abbildung 2: Schematische Darstellung des allgemeinen Erscheinungsbildes Schilddrüsenknoten für die Elastografiescores (ES) 1 bis 4 nach Asteria et al. [2] der 15 Material und Methoden Es wurde vom Untersucher bewertet, wie eindeutig das Elastogramm einem der vier Elastografiescores zuzuordnen war und, ob die Läsion mit Hilfe der Elastografie zum restlichen Gewebe besser abgrenzbar war als im B-Bild. Zudem wurde beurteilt wie gut die Elastogrammqualität war. Diese Qualität wurde in der vorliegenden Arbeit definiert als der Flächenanteil der Elastogramm-ROI, der vom Ultraschallgerät auch tatsächlich farblich überlegt wurde. Gute Qualität bedeutete einen farbigen Flächenanteil von 80-100% und nur Elastogramme, die dieses Kriterium erfüllten, wurden ausgewertet. Lag der farbige Anteil darunter, wurde ein neues Elastogramm generiert. Im Anschluss an die Beurteilung des qualitativen Elastogramms erfolgte die Erhebung des semiquantitativen Elastogramms, die Ermittlung der Strain-RatioWerte. Dazu wurden vom Untersucher in der großen, anfangs gesetzten Elastogramm-ROI eine ROI A in der Läsion und eine ROI B im umgebenden Schilddrüsengewebe festgesetzt. Wie in Abbildung 3 zu sehen ist, gab das Ultraschallgerät die Durchschnittsdehnung der ROI A als Prozentangabe an und setzte sie ins Verhältnis zur Prozentangabe der Durchschnittsbelastung von ROI B. So erhielt man das Dehnungsverhältnis der beiden ROIs, die Strain-Ratio, wobei der Wert des Schilddrüsengewebes durch den Wert des Knotens dividiert wurde (B/A). Die Prozentangabe von ROI A und ROI B kommt durch die Dehnungsdifferenz im Verhältnis zur Objektgröße der ausgewählten ROI zustande. Beträgt die Objektgröße beispielsweise 100 mm und die Verkürzung durch Belastung im Durchschnitt 2 mm, würde die Dehnung mit 2% wiedergegeben. Je elastischer eine Läsion im Vergleich zum angrenzenden Schilddrüsenparenchym ist, desto größer wird der Wert in A, also im Nenner des Verhältnisses und desto kleiner wird das Verhältnis insgesamt. Umgekehrt wird das Verhältnis größer, je kleiner der Wert im Nenner ist, d.h. je unelastischer die Läsion ist [36]. Zunächst wurden vier verschiedene, ca. 1 cm² große ROIs A in der Läsion jeweils ins Verhältnis zur selben, ebenfalls 1 cm² großen ROI B im Schilddrüsengewebe gesetzt. So wurden vier Strain-Ratio-Werte ermittelt, aus welchen dann der Mittelwert errechnet wurde. 16 Material und Methoden Abbildung 3: Arbeitsoberfläche des Hitachi Ascendus Ultraschallgerätes bei der Erhebung der Strain-Ratio des Schilddrüsenknotens im Querschnitt. Links ist das Elastogramm, rechts das herkömmliche B-Bild abgebildet, in welchem die Ausmaße des hier untersuchten Knotens nachträglich eingezeichnet wurden (gelbe Linien). Das Gerät gibt die berechnete Strain-Ratio der durch den Untersucher gesetzten Regions of Interest A (Läsion) und B (Schilddrüse) an. Universitätsklinikum Ulm, 06/2013. Im Verlauf der Datenerhebung wurde dieses erste Schema um zwei Messungen erweitert: Ein ROI-Paar wurde auf gleicher Höhe gesetzt und der Strain-Ratio-Wert für dieses ermittelt. Zudem wurde eine Messung durchgeführt, bei welcher die ROI A so adjustiert wurde, dass sie die komplette Läsion umschloss, und ROI B im umgebenden Schilddrüsengewebe möglichst groß gewählt wurde (s. Abbildung 4). 17 Material und Methoden Abbildung 4: Arbeitsoberfläche am Hitachi Ascendus Ultraschallgerät bei der Erhebung der Strain-Ratio, bei welcher der komplette Knoten eingeschlossen wurde. Links ist das Elastogramm, rechts das herkömmliche B-Bild abgebildet, in welches nachträglich die Ausmaße des untersuchten Knotens eingetragen wurden (gelbe Linien). Das Gerät gibt die berechnete Strain-Ratio der durch den Untersucher gesetzten Regions of Interest A (Läsion) und B (Schilddrüse) an. Universitätsklinikum Ulm, 06/2013. 2.4.2 Toshiba Aplio 500 Die Elastografieuntersuchung am Toshiba Aplio 500 erfolgte analog zu der Untersuchung am HI VISION Ascendus im Programm „Elastografie“ (qualitative Elastografie) bzw. „Elasto-Q“ (semiquantitative Elastografie): Zur qualitativen Auswertung wurde im Programm „Elastografie“ des Gerätes ein Elastogramm im Querschnitt und eines im Längsschnitt erhoben. Im Unterschied zum HI VISION Ascendus wurde hier der periodisch applizierte Druck jedoch nicht in einer numerischen Skala angegeben, sondern dem Untersucher in einer „Zeit-relative Druckstärke-Kurve“ angezeigt. Um zwischen den untersuchten Patienten vergleichbare Bedingungen herzustellen, wurde bei der Auswahl der zur Auswertung herangezogenen Elastogramme darauf geachtet, den Zeitpunkt „im Tal“ der Kompressionskurve zu betrachten (s. Abbildung 5). 18 Material und Methoden Vom Untersucher wurde wiederum bewertet, wie eindeutig das Elastogramm einem der vier Elastografiescores zuzuordnen war, ob die Läsion mit Hilfe der Elastografie zum restlichen Gewebe besser abgrenzbar war als im B-Bild und wie gut die Elastogrammqualität war. Die semiquantitative Erhebung der Strain-Ratio-Werte erfolgte mit dem Programm „Elasto-Q“ ebenfalls wie beim HI VISION Ascendus im Querschnitt. Es wurden jeweils vier ROIs T in der Läsion ins Verhältnis zu einer ROI R im umgebenden Schilddrüsengewebe gesetzt und die Strain-Ratio-Werte aus dem Verhältnis R/T ermittelt. Im Verlauf der Datenerhebung kamen auch bei diesem Ultraschallgerät die beiden zusätzlichen Messungen wie beim Hitachi Ultraschallgerät hinzu. Abbildung 5: Arbeitsoberfläche am Toshiba Aplio 500 Ultraschallgerät bei der Erhebung der Strain-Ratio eines Schilddrüsenknotens im Querschnitt. Links ist das Elastogramm, rechts das herkömmliche B-Bild dargestellt, auf welchem nachträglich das Knotenausmaß eingezeichnet wurde (gelbe Linien). Die senkrechte weiße Linie zeigt den Messzeitpunkt im Zeit-Druck-Verlauf „im Tal“ an (weißer Pfeil). Das Gerät gibt die berechnete Strain-Ratio der durch den Untersucher gesetzten Regions of Interest T (Läsion) und R (Schilddrüse) an. Universitätsklinikum Ulm, 06/2013. 19 Material und Methoden 2.4.3 Siemens ACUSON S3000 Das Ultraschallgerät verwendet das Programm „Virtual Touch™ IQ“, um ein Elastogramm basierend auf der Acoustic Radiation Force Impulse (ARFI) Technologie zu erstellen. Bei dieser werden von der Ultraschallsonde durch einen akustischen Impuls Scherwellen generiert, die sich im Gewebe ausbreiten. Gleichzeitig werden sich kontinuierlich ausbreitende Detektionswellen in das Gewebe eingebracht, um die Lokalisation der Scherwellenfront festzustellen und durch die Zeitdifferenz zwischen der Aussendung der Scherwellen und ihrer Detektion die Ausbreitungsgeschwindigkeit der Scherwellen zu berechnen. Diese Scherwellengeschwindigkeiten werden vom Gerät zum einen als Farboverlay über dem B-Bild visualisiert und zum anderen in vom Untersucher festgesetzten ROIs in Meter pro Sekunde (m/s) angegeben. Sowohl die minimal als auch die maximal detektierbare Geschwindigkeit Scherwellengeschwindigkeitsskala kann vom eingestellt Untersucher werden. Liegen auf der gemessene Geschwindigkeitswerte ober- oder unterhalb des eingestellten Skalenbereiches, wird vom Gerät in den Messergebnissen Vs=HOCH bzw. Vs=TIEF angegeben. Die Ausbreitungsgeschwindigkeit der Scherwellen ist von der Gewebselastizität der Läsion abhängig: In weichem Gewebe breiten sich die Scherwellen langsamer, in hartem Gewebe schneller aus [72, 73]. Für die Datenerhebung wurde vom Untersucher zunächst eine große ROI definiert, die Anteile der Läsion und Anteile der Schilddrüse enthielt. Für diese ROI wurden vom Gerät nun mittels ARFI die Scherwellengeschwindigkeiten ermittelt und als Farboverlay präsentiert (s. Abbildung 6). 20 Material und Methoden Abbildung 6: Arbeitsoberfläche des Siemens Acuson S3000 Ultraschallgerätes bei der elastografischen Untersuchung eines Schilddrüsenknotens. Die Datenerhebung erfolgt im Querschnitt und einer Skalenkalibrierung von 0,5-6,5 Meter pro Sekunde (m/s). Die ersten acht ROIs erfassen die Scherwellengeschwindigkeit im Knoten, die anschließenden vier die Scherwellengeschwindigkeit im umgebenden Schilddrüsenparenchym. Universitätsklinikum Ulm, 06/2013. Für die Auswertung der grafischen Darstellung der Scherwellenelastografie teilte der Untersucher die Knoten anhand ihrer Darstellung im Elastogramm in vier Gruppen mit den dazugehörigen vier Elastografiescores (ES 1-4) ein, die für die vorliegende Arbeit von uns zuvor definiert worden waren. Die Farbskala am Siemens Gerät wurde so festgesetzt, dass langsame Scherwellengeschwindigkeiten und somit weiche Gewebe blau, mittlere Geschwindigkeiten und somit mittelharte Gewebe grün und gelb und schnelle Geschwindigkeiten und damit harte Gewebe rot dargestellt wurden. Diese Einteilung ist in Tabelle 2 und Abbildung 7 dargestellt. Tabelle 2: Einteilung der vier Elastografiegruppen, ihres mittleren Scherwellengeschwindigkeitsbereichs und ihrer Gewebebeschaffenheit für die Klassifikation der grafischen Darstellung der Scherwellengeschwindigkeit am Siemens Acuson S3000; Universitätsklinikum Ulm, 12/2012 - 06/2013. Mittlerer Gruppe Gewebebeschaffenheit Scherwellengeschwindigkeitsbereich (m/s) 1 0,5-2,0 Weich 2 2,0-3,5 Eher weich 3 3,5-5,0 Eher hart 4 5,0-6,5 Hart 21 Material und Methoden Abbildung 7: Schematische Darstellung des allgemeinen Erscheinungsbildes der Schilddrüsenknoten für die Elastografiescores (ES) 1 bis 4 am Siemens Acuson S3000. ES 1 stellt sich überwiegend blau, ES 2 gemischt blau-grün, ES 3 gemischt grün-gelb und ES 4 überwiegend rot dar. Universitätsklinikum Ulm, 12/2012 - 06/2013. Die grafische Darstellung ist beim Siemens Ultraschallgerät demnach anders als bei den Hitachi und Toshiba Ultraschallgeräten, bei welchen hartes Gewebe blau präsentiert wird. Die grafische Darstellung der Scherwellengeschwindigkeit wurde im Quer- und im Längsschnitt jeweils bei einer Skaleneinstellung von 0,5-6,5 m/s erhoben. Anschließend wurden vom Untersucher zwölf kleine ROIs, die bei diesem Verfahren eine vom Hersteller festgesetzte Größe von ca. 0,5 cm² haben, in die anfangs gesetzte, große ROI platziert: acht ROIs beliebig in die Läsion und vier ROIs beliebig in das umliegende Schilddrüsengewebe. Dies wurde im Längsschnitt für eine Skalenkalibrierung von 0,5-6,5 m/s und im Querschnitt für die Skalenkalibrierungen von 0,5-3,0 m/s, 0,5-6,5 m/s und 0,5-9,0 m/s durchgeführt. Hierfür wurde im Querschnitt kein neues Elastogramm generiert, sondern die Skaleneinstellung verändert und dann die insgesamt zwölf ROIs neu gesetzt. Das Siemens Ultraschallgerät gibt die ermittelte Scherwellengeschwindigkeit zusammen mit der Messtiefe in cm wie in Abbildung 6 gezeigt an. Zur Qualitätskontrolle der generierten Elastogramme wurde die geräteinterne Einstellung „Scherwellenqualität“ Ultraschallgerät in Abhängigkeit herangezogen. von Hierbei werden Scherwellenverschiebungshöhe vom und Rauschabstandsstufe unterschiedliche Bereiche des Elastogramms grün (gute Qualität), gelb (mittlere Qualität) und orange (schlechte Qualität) dargestellt [72]. Nur Elastogramme, deren grüner Flächenanteil mindestens 95% betrug, wurden in die Auswertung aufgenommen. 22 Material und Methoden 2.5 Pathologisches Gutachten Postoperativ wurden die vom Institut für Pathologie des Universitätsklinikums Ulm erstellten Gutachten eingeholt und die dort aufgeführte Diagnose der Läsion als Referenzkriterium übernommen. Die Diagnosen „Strumaknoten“, „follikuläres Adenom“ und „mikrofollikuläres Adenom“ wurden als benigne, das „papilläre Karzinom“ als maligner Knoten klassifiziert. Zusätzlich wurden aus diesen Gutachten entzündliche Veränderungen des umgebenden Schilddrüsenparenchyms ausgewertet. Hierbei wurde untersucht, ob eine Entzündung im umliegenden Gewebe vorlag und wenn ja, ob es sich bei dieser um eine chronische Entzündung oder um eine Entzündung im Rahmen einer Hashimoto-Thyreoiditis handelte. 2.6 Statistische Methoden Die erhobenen Daten wurden im Tabellenkalkulationsprogramm Microsoft Excel 14.0 und 15.0 (Microsoft Corporation, Redmond, Washington, USA) in eine Tabelle eingepflegt und die statistischen Berechnungen mit Hilfe der Statistiksoftware SAS 9.2 (SAS Institute Inc., Cary, North Carolina, USA) durchgeführt. Für stetige Merkmale wurden der Mittelwert, die Standardabweichung, der Median und der Wertebereich berechnet. Kategoriale Merkmale wurden mit absoluten und relativen Häufigkeiten dargestellt. Um Unterschiede hinsichtlich der Echogenität zwischen gesundem Schilddrüsengewebe, chronischer Thyreoiditis und Hashimoto-Thyreoiditis zu zeigen, wurde der Chi-Quadrat-Test angewendet. Um zwischen benignen und malignen Knoten Unterschiede aufzuzeigen wurde für stetige Variablen der Wilcoxon-Rangsummen-Test und für kategoriale Variablen der Chi-Quadrat-Test bzw. der Exakte Test nach Fisher bei zu kleinen Fallzahlen angewendet. Die grafischen Elastogramme wurden entsprechend ihrer farblichen Zusammensetzung in vier Gruppen eingeteilt. Die absoluten Häufigkeiten der einzelnen Gruppen wurden angegeben. Die Gruppen wurden in die Kategorien „benigne Knoten“ und „maligne Knoten“ unterteilt. Für den Vergleich der grafischen 23 Material und Methoden Elastografieuntersuchung der drei Geräte wurden anschließend die Sensitivitäten, Spezifitäten, positiven und negativen Vorhersagewerte bestimmt. Für die Strain-Ratio-Werte des Hitachi und Toshiba Ultraschallgerätes und für die Scherwellengeschwindigkeiten des Siemens Ultraschallgerätes wurden der Mittelwert, die Standardabweichung, der Median und der Wertebereich bestimmt. Um die elastografische Untersuchung mit Hilfe der Strain-Ratio-Werte und Scherwellengeschwindigkeiten der drei Ultraschallgeräte miteinander zu vergleichen, wurden die Cut-off-Punkte mittels der ROC-Analyse ermittelt. Anschließend wurden auch hier jeweils Sensitivität, Spezifität, positiver und negativer Vorhersagewert kalkuliert. Für einen Vergleich der Werte in Abhängigkeit von den einzelnen histologischen Befunden erfolgte die Berechnung mit Hilfe des Kruskal-Wallis-Tests. Bei den Scherwellengeschwindigkeitsmessungen Schilddrüsengewebes wurden Unterschiede im zwischen Bereich den des einzelnen Histopathologien der Schilddrüse ebenfalls mit Hilfe des Kruskal-Wallis-Tests untersucht. Zusätzlich wurden für die Scherwellengeschwindigkeiten in den unterschiedlichen Geweben bzw. Histopathologien jeweils die 95%-Intervalle der gemessenen Werte angegeben. Für alle statistischen Auswertungen wurden p-Werte kleiner 0,05 aus zweiseitigen Tests als signifikant angesehen. 2.7 Ethikvotum Die Studie wurde nach den Richtlinien der Deklaration von Helsinki und den GCPEmpfehlungen durchgeführt. Die Ethikkommission der Universität Ulm unter dem Vorsitz von Herrn Prof. Dr. H. Fangerau gab ein positives Votum für das Forschungsvorhaben (Zeichen 139/13 vom 10.06.2013) ab. Alle Studienteilnehmer willigten mündlich und schriftlich in die Studienteilnahme ein. 24 Material und Methoden 2.8 Multicenter-Studie Gleichzeitig mit der Datenerhebung für diese Arbeit wurden Daten für die Multicenter-Studie der Johann Wolfgang Goethe-Universität Frankfurt mit dem Titel „Multicenterstudie zur Evaluation der Realtime-Elastographie für die Differenzierung von Schilddrüsen-Knoten“ unter der Leitung von Privatdozent Dr. med. Jörg Bojunga der Medizinischen Klinik I erhoben und in eine Online-Maske eingepflegt. Insgesamt konnten für diese Studie 45 Patienten mit 55 Knoten rekrutiert und eingeschleust werden. 25 Ergebnisse 3 Ergebnisse 3.1 Geschlechts-, Alters- und Dignitätsverteilung im Gesamtund Endkollektiv 3.1.1 Deskriptive Analyse Im Gesamtkollektiv mit 52 Patienten befinden sich 17 Männer und 35 Frauen mit 𝑘𝑔 einem durchschnittlichen Alter von 52,1 Jahren und mittleren BMI-Wert von 27,1𝑚². Von den 69 insgesamt untersuchten Knoten weisen 63 eine als benigne und sechs eine als maligne klassifizierte Histopathologie auf. Das ausgewertete Endkollektiv mit 41 Patienten setzt sich aus 15 Männer und 26 Frauen zusammen. Das durchschnittliche Alter beträgt 51,5 Jahre, wobei die untere und die obere Grenze jeweils von einer Frau mit 22 bzw. 75 Jahren gebildet werden. 𝑘𝑔 Der durchschnittliche BMI-Wert beträgt 27,4𝑚². Von den 53 ins Endkollektiv eingebrachten Knoten sind 47 benigne und sechs maligne. Zwei der malignen Läsionen befinden sich in derselben Schilddrüse, sodass sich für die Anzahl der Patienten mit benigner Läsion n=36 und für die Anzahl der Patienten mit maligner Läsion n=5 ergeben. Die 47 benignen Knoten sind weiter untergliedert in 30 Knoten mit der Diagnose „Strumaknoten“, zehn Knoten mit der Diagnose „mikrofollikuläres Adenom“ und sieben Knoten mit der Diagnose „follikuläres Adenom“. Die sechs malignen Knoten sind papilläre Schilddrüsenkarzinome. Von den 41 sich im Endkollektiv befindenden Patienten weisen 26 eine Schilddrüse ohne entzündliche Veränderung, elf eine Schilddrüse mit chronischer Thyreoiditis und vier Patienten eine Hashimoto-Thyreoiditis auf. Abbildung 8 zeigt die Zusammensetzung der verschiedenen Kollektive. 26 Ergebnisse Abbildung 8: Gesamtkollektiv und Geschlecht der untersuchten Patienten, Gesamtanzahl und Dignität der untersuchten Schilddrüsenknoten. Nach Ausschluss unvollständiger Datensätze ausgewertetes Endkollektiv und Geschlecht der Patienten, Histologie der ausgewerteten Schilddrüsen, sowie Dignität und Histologie der ausgewerteten Schilddrüsenknoten. Universitätsklinikum Ulm, 12/2012 - 06/2013. 27 Ergebnisse 3.1.2 Bivariate Analyse der Läsionsdignitäten in Abhängigkeit von Patientenalter und -geschlecht Die Läsionsdignitäten in Abhängigkeit vom Patientenalter sind in Abbildung 9 gezeigt: Das Alter der Patienten mit diagnostizierter maligner Läsion liegt zwischen 23 und 52 Jahren. Es entfällt somit vollständig auf die jüngeren 3/5 des Endkollektivs. Abbildung 9: Absolute Anzahl der benignen (blau) und malignen Knoten (grau) in den unterschiedlichen Altersgruppen der Patienten im Endkollektiv. Universitätsklinikum Ulm, 12/2012 - 06/2013. Abbildung 10 stellt die Dignität der Läsion in Abhängigkeit vom Patientengeschlecht dar. Es zeigt sich folgende Verteilung: Fünf der insgesamt 38 bei Frauen untersuchten Knoten waren maligne, was einem Prozentanteil von 13,2% entspricht. Bei den Männern war einer der 15 untersuchten Knoten maligne, was einem Prozentanteil von 6,7% entspricht. In dieser Stichprobe sind Frauen etwa doppelt so häufig von einem papillären Schilddrüsenkarzinom betroffen wie Männer. Abbildung 10: Absolute Anzahl der benignen (blau) und malignen Knoten (grau) getrennt für weibliche und männliche Patienten im Endkollektiv. Universitätsklinikum Ulm, 12/2012 06/2013. 28 Ergebnisse 3.2 B-Bild-Kriterien der Schilddrüse deskriptiv und bivariat 3.2.1 Schilddrüsenvolumen Das mittlere Volumen der kompletten Schilddrüse beträgt im untersuchten Kollektiv 50,8 ml, wobei das Volumen des rechten Lappens durchschnittlich bei 25,8 ml und das des linken Schilddrüsenlappens durchschnittlich bei 24,9 ml liegen. Abbildung 11 zeigt die Auffälligkeit der Schilddrüsenvolumina: Das mittlere Volumen der Schilddrüsen mit malignen Läsionen (n=5) ist im Vergleich zum mittleren Volumen der Schilddrüsen mit benignen Läsionen (n=36) deutlich kleiner. So beträgt der Mittelwert der Schilddrüsenvolumina mit benigner Läsion 54,5 ml (100%), der Mittelwert der Schilddrüsenvolumina mit maligner Läsion 23,6 ml (43,3%). Dies entspricht einem Unterschied von 56,7%. Der p-Wert beträgt p=0,1202 und ist damit nicht signifikant, d.h. dass in dieser Arbeit zwar ein deutlicher Volumenunterschied festgestellt wird, dieser jedoch nicht ausreicht, um die in den Schilddrüsen liegenden Läsionen einer Dignität zuzuordnen (s. Tab. 17 im Anhang). Abbildung 11: Boxplot der Gesamtvolumina der Schilddrüsen in Milliliter (ml) für die Gruppe der Schilddrüsen mit mindestens einer benignen Läsion, mit mindestens einer malignen Läsion und die Gesamtanzahl der Schilddrüsen mit Angabe der jeweiligen Fallzahl (n). Ausreißer sind oberhalb der Volumenskala als Punkt mit der entsprechenden Volumenangabe dargestellt. Ausgewertet ist das Endkollektiv. ӿ markiert den jeweiligen Mittelwert, ‒ den jeweiligen Median. Universitätsklinikum Ulm, 12/2012 - 06/2013. 29 Ergebnisse 3.2.2 Echogenität und Echotextur der Schilddrüse Die Echogenität der Schilddrüse ist in 38 Schilddrüsen echonormal, in zwei Schilddrüsen echoarm und in einer Schilddrüse echoreich. Alle Schilddrüsen mit maligner Läsion sind echonormal. Die Verteilung der Schilddrüse nach Echogenität und histopathologischer Diagnose ist in Tabelle 3 gezeigt. Tabelle 3: Verteilung der absoluten Anzahlen der Schilddrüsen entsprechend ihrer Histopathologie und ihrer im B-Bild ermittelten Echogenität im Endkollektiv. Der p-Wert zur Differenzierung der Histopathologie anhand der Echogenität ist aufgeführt. In Klammern steht die Fallzahl der jeweiligen Gruppe (n). Universitätsklinikum Ulm, 12/2012 - 06/2013. Histopathologie der Schilddrüse Echogenität der Schilddrüse Gesundes Chronische Hashimoto- Schilddrüsengewebe Thyreoiditis Thyreoiditis (n=26) (n=11) (n=4) 25 10 3 Echoreich (n=1) 0 0 1 Echoarm (n=2) 1 1 0 Echonormal (n=38) pWert 0,2908 Die Echotextur ist in 32 der Schilddrüsen homogen, in neun Schilddrüsen inhomogen. Alle Schilddrüsen mit maligner Läsion weisen eine homogene Echotextur auf. Die neun inhomogenen Schilddrüsen gliedern sich bezüglich ihrer Pathologie der Schilddrüse wie folgt auf: Sechs haben keine entzündliche Veränderung, in zwei Schilddrüsen liegt eine Hashimoto-Thyreoiditis vor und in einer Schilddrüse eine chronische Thyreoiditis. Alle malignen Läsionen finden sich folglich in morphologisch unauffälligen, da homogenen und echonormalen Schilddrüsen. 30 Ergebnisse 3.2.3 Knotenanzahl in der Schilddrüse Für jeden Patienten wird die Gesamtanzahl der Knoten in der Schilddrüse ermittelt. In der Betrachtung wird zum einen die Gruppe der Patienten mit ausschließlich benignen Läsionen und zum anderen die Gruppe der Patienten, die mindestens eine maligne Läsion in ihrer Schilddrüse aufweisen, unterschieden. Die Verteilung ist in Abbildung 12 dargestellt: Alle Patienten, die eine maligne Läsion in ihrer Schilddrüse aufweisen, haben zusätzlich zu dieser noch mindestens eine benigne Läsion, d.h. dass keiner der malignen Knoten solitär in der Schilddrüse auftritt. Abbildung 12: Verteilung der absoluten Patientenanzahl nach der Gesamtanzahl der im B-Bild in ihrer Schilddrüse festgestellten Knoten. Ausgewertet ist das Endkollektiv. Patienten mit ausschließlich benignen Knoten sind blau, Patienten mit mindestens einer malignen Läsion sind grau dargestellt. Universitätsklinikum Ulm, 12/2012 - 06/2013. 31 Ergebnisse 3.3 B-Bild Kriterien der Läsion deskriptiv und bivariat 3.3.1 Maße, Lage und sonografische Merkmale der Läsion Die B-Bild-Kriterien der Läsionen (n=53) werden in Tabelle 4 und 5 getrennt für Läsionen mit benigner und maligner Histopathologie, sowie für die Gesamtanzahl dargestellt. Hier zeigt sich für kein Kriterium ein signifikanter Unterschied zwischen benignen und malignen Knoten. Tabelle 4: Mittelwert, Standardabweichung (STD), Median und Wertebereich der im B-Bild erhobenen Knotenmaße in Millimeter (mm) beziehungsweise Milliliter (ml) aufgeführt nach benigner Histopathologie, maligner Histopathologie und der Gesamtanzahl der Knoten im Endkollektiv. Die Fallzahl der jeweiligen Gruppe ist in Klammern (n) angegeben. Für jedes BBild-Kriterium ist der p-Wert für die Differenzierung der Histopathologien angegeben. Universitätsklinikum Ulm, 12/2012 - 06/2013. Benigne Maligne Gesamtanzahl Knoten (n=47) Knoten (n=6) (n=53) Mittelwert ± STD; Median (Wertebereich) Länge (mm) Breite (mm) Knotenmaße Tiefe (mm) Volumen (ml) Verhältnis Tiefe Breite zu 31,1 ± 16,5 31,2 ± 18,7 31,1 ± 16,5 26,6 (10,9-78,1) 26,7 (14,9-66,2) 26,6 (10,9-78,1) 26,0 ± 15,5 20,5 ± 9,4 25,4 ± 15,0 24,6 (7,0-88,8) 17,1 (13,5-38,6) 22,7 (7,0-88,8) 20,0 ± 10,5 14,7 ± 5,1 19,4 ± 10,2 18,8 (6,9-54,3) 13,5 (8,6-21,0) 17,4 (6,9-54,3) 20,4 ± 35,7 9,4 ± 14,3 19,2 ± 34,0 7,9 (0,4-209,9) 4,6 (1,2-38,2) 7,6 (0,4-209,9) 0,8 ± 0,2 0,8 ± 0,3 0,8 ± 0,2 0,8 (0,5-1,3) 0,7 (0,5-1,3) 0,8 (0,5-1,3) p-Wert 1,0 0,5841 0,3258 0,4569 0,3470 32 Ergebnisse Tabelle 5: Absolute Anzahl und relativer Anteil der Knoten bezüglich der folgenden im B-Bild erhobenen Charakteristika: Form, Lage, Echogenität, Homogenität, Vorhandensein von Mikro- und Makrokalzifizierungen, Randbeschaffenheit und Vorhandensein des HaloZeichens des Knotens, aufgeführt für die Knoten mit benigner und maligner Histopathologie, sowie die Gesamtanzahl der Knoten. Ausgewertet ist das Endkollektiv mit Angabe der Fallzahl der einzelnen Gruppen in Klammern (n). Für jedes Charakteristikum ist der p-Wert für die Differenzierung der Histopathologien angegeben. Universitätsklinikum Ulm, 12/2012 06/2013. Benigne Knoten Maligne Knoten Gesamtanzahl (n=47) (n=6) (n=53) Absolute Anzahl (relativer Anteil) Knotenform rund p-Wert 5 (10,6%) 28 (59,6%) 14 (29,8) 0 (0%) 3 (50,0%) 3 (50,0%) 5 (9,4%) 31 (58,5%) 17 (32,1%) 0,8136 24 (51,1%) 17 (36,2%) 5 (10,6%) 0 (0%) 1 (2,1%) 3 (50,0%) 2 (33,3%) 0 (0%) 1 (16,7%) 0 (0%) 27 (50,9%) 19 (35,9%) 5 (9,4%) 1 (1,9%) 1 (1,9%) 0,2910 25 (53,2%) 4 (8,5%) 14 (29,8%) 1 (16,7%) 2 (33,3%) 3 (50,0%) 26 (49,1%) 6 (11,3%) 17 (32,1%) 4 (8,5%) 0 (0%) 4 (4,5%) 1 (2,1%) 46 (97,9%) 1 (16,7%) 5 (83,3%) 2 (3,8%) 51 (96,2%) 0,2155 23 (48,9%) 24 (51,1%) 4 (66,7%) 2 (33,3%) 27 (50,9%) 26 (49,1%) 0,6687 Vorhanden 12 (25,5%) 35 (74,5%) 4 (66,7%) 2 (33,3%) 16 (30,2%) 37 (69,8%) 0,0602 Rand regelmäßig 23 (48,9%) 3 (50,0%) 26 (49,1%) unregelmäßig 24 (51,1%) 3 (50,0%) 27 (50,9%) 6 (12,8%) 21 (44,7%) 20 (42,6%) 0 (0%) 4 (66,7%) 2 (33,3%) 6 (11,3%) 25 (47,2%) 22(41,5%) oval polyzyklisch Lage des Knotens Re vorwiegend Li vorwiegend Isthmus Re + Isthmus Li + Isthmus Knoten Echogenität echokomplex echonormal echoarm echoreich 0,2302 Knoten Homogenität homogen inhomogen Makrokalzifizierung Nicht vorhanden Vorhanden Mikrokalzifizierung Nicht vorhanden 1,0 Halo-Zeichen nein ja unvollständig 0,7069 33 Ergebnisse 3.3.2 Durchblutung der Läsion im Color-Doppler-Modus In allen Läsionen konnte eine Durchblutung festgestellt werden, daher fällt das Muster 0 (keine Durchblutung) aus der Darstellung heraus. Bei der Zuordnung der Läsion zu einem der vier Durchblutungsmuster ergibt sich die in Abbildung 13 gezeigte Verteilung. Es zeigt sich, dass Muster 3 am häufigsten beobachtet wird, dass das Muster 1 und somit die geringste intranoduläre Durchblutung nie einer malignen Läsion zugeordnet ist und, dass der größte Anteil der malignen Läsionen das Muster 4 und somit eine starke intranoduläre Durchblutung aufweist. Untersuchung die Mit zunehmender Wahrscheinlichkeit Durchblutung für eine steigt maligne in dieser Läsion. Durchblutungsmuster Typ 3, was einer eher stärkeren Durchblutung entspricht, wird bei benignen Knoten insgesamt am häufigsten beobachtet. Der p-Wert für die Unterscheidung zwischen benignen und malignen Knoten anhand ihres Durchblutungsmusters ist mit 0,5930 nicht signifikant. Abbildung 13: Absolute Knotenanzahl der im Color-Doppler-Modus ermittelten Durchblutungsmuster 1 bis 4, aufgeführt für benigne (blau) und maligne (grau) Knoten des Endkollektivs. Die graue Linie stellt die lineare Trendlinie der malignen Knoten dar. Universitätsklinikum Ulm, 12/2012 - 06/2013. Untergliedert man nur die Gruppe der benignen Läsionen weiter in die drei Histopathologien „Strumaknoten“, „follikuläres Adenom“ und „mikrofollikuläres Adenom“ und teilt sie den Durchblutungsmustern zu, zeigt sich die in Abbildung 14 dargestellte Verteilung. 34 Ergebnisse Abbildung 14: Prozentualer Anteil der Vaskularisationsmuster 1 bis 4 an den drei benignen Histopathologien der Läsionen: Strumaknoten, Follikuläres Adenom und Mikrofollikuläres Adenom. Dunkelblau repräsentiert das Vaskularisationsmuster 1, hellblau das Vaskularisationsmuster 2, grau das Vaskularisationsmuster 3 und weiß das Vaskularisationsmuster 4. In den Balken der drei histopathlogischen Diagnosen sind die absoluten Anzahlen der Knoten mit dieser Histopathologie und dem entsprechenden Vaskularisationsmuster aufgeführt, ausgewertet ist das Endkollektiv. Universitätsklinikum Ulm, 12/2012 - 06/2013. Es zeigt sich in dieser Untergliederung der benignen Knoten keine besondere Verteilung der Durchblutungsmuster, was bedeutet, dass sich die Knoten aufgrund ihrer Durchblutung nicht genauer einer Histopathologie zuordnen lassen. Der p-Wert für die Durchblutungsmuster der Gesamtzahl der benignen Läsionen beträgt 0,1934 und ist somit nicht signifikant. 35 Ergebnisse 3.3.3 Einteilung der Läsion nach TIRADS-Klassifikation Alle Läsionen werden entsprechend ihrer Morphologie im B-Bild einer Thyroid Imaging Reporting and Data System (TIRADS) Kategorie zugeteilt. Diese Verteilung ist in Abbildung 15 getrennt für benigne und maligne Knoten dargestellt. Abbildung 15: Absolute Knotenanzahl in den Thyroid Imaging Reporting and Data System (TIRADS) Kategorien 2, 3, 4a und 4b, 5A, B und 5C aufgeführt für benigne (blau) und maligne (grau) Knoten des Endkollektivs. Kategorie 3 und 5B enthält keine malignen Knoten, Kategorie 5A und 5B sind keine Knoten zugeteilt. Universitätsklinikum Ulm, 12/2012 - 06/2013. Den TIRADS-Kategorien 5A und 5C werden in dieser Arbeit keine Läsionen zugeteilt. Für die Malignitätswahrscheinlichkeiten der Knoten in den einzelnen Kategorien ergeben sich in dieser Arbeit die in Tabelle 6 aufgeführten Werte. Tabelle 6: Darstellung der in dieser Arbeit berechneten Malignitätswahrscheinlichkeiten in Prozent (%) in den einzelnen Thyroid Imaging Reporting and Data System (TIRADS) Kategorien des Endkollektivs. Da Kategorie 5A und 5C keine Knoten zugeteilt wurden, entfällt die Berechnung der Malignitätswahrscheinlichkeit für diese Kategorien. Universitätsklinikum Ulm, 12/2012 - 06/2013. TIRADS-Kategorie Berechnete Malignitätswahrscheinlichkeit (%) 2 7,7 3 0,0 4a 28,6 4b 16,7 5A Entfällt 5B 0,0 5C Entfällt 36 Ergebnisse 3.4 Grafische Darstellung der Kompressions- und Scherwellenelastografie Zunächst wird die Verteilung der Läsionen nach Elastografiefarbklassifikation für jedes der drei Ultraschallgeräte aufgeführt. Im Anschluss daran werden die erreichten Sensitivitäten, Spezifitäten, positiven und negativen Vorhersagewerte und p-Werte der Geräte miteinander verglichen. 3.4.1 Hitachi HI VISION Ascendus Mit Hilfe der Elastografie sind nur 6,7% der benignen Läsionen und keine (0%) der malignen Läsionen subjektiv besser vom umgebenden Schilddrüsengewebe abgrenzbar als das im B-Bild möglich ist (Gesamt 5,7%). Gleich gut abgrenzbar sind 29,8% der benignen und 66,7% der malignen Läsionen (Gesamt 34,0%). Schlechter abgrenzbar sind 63,8% der benignen und 33,3% der malignen Läsionen (Gesamt 60,4%). Der Elastografiemodus des Ultraschallgerätes ist in der überwiegenden Anzahl der Fälle nicht geeignet, um die Läsion besser vom umgebenden Gewebe abzugrenzen. Die Knoten werden im Querschnitt und im Längsschnitt anhand ihrer Farbzusammensetzung einem der vier Elastografiescores (ES) zugewiesen. Diese Einteilung ist in Abbildung 16 gezeigt. Abbildung 16: Absolute Knotenanzahl in den 4 Elastografiescores (ES) bei der Erhebung der farblichen Elastogramme am Hitachi HI VISION Ascendus Ultraschallgerät für das Endkollektiv. Die Einteilung der Knoten zu den Elastografiescores ist getrennt für benigne und maligne Knoten (dunkelblau und grau) im Querschnitt (QS) und für benigne und maligne Knoten (hellblau und weiß) im Längsschnitt (LS) aufgeführt. Universitätsklinikum Ulm, 12/2012 - 06/2013. 37 Ergebnisse Die Wahrscheinlichkeit für eine maligne Läsion nimmt mit dem Anteil ihrer blau abgebildeten Fläche zu. Fast man Querschnitt und Längsschnitt zusammen, so beträgt die Wahrscheinlichkeit für Malignität in der homogen grünen Gruppe (ES 1) 0%, in der Gruppe mit überwiegend grüner Fläche (ES 2) 6,8 %, in der Gruppe mit überwiegend blauer Fläche (ES 3) 11,1 % und in der Gruppe mit homogen blauer Fläche (ES 4) 42,9%. Im Vergleich sind alle Läsionen im Längsschnittelastogramm durchschnittlich mit einem höheren Anteil an blauer Fläche abgebildet als im Querschnitt. 38 Ergebnisse 3.4.2 Toshiba Aplio 500 Die Abgrenzung der Läsion gegenüber dem umliegenden Schilddrüsenparenchym ist im Elastografiemodus bei keiner Läsion besser als im B-Bild, in 27,7% der benignen und 16,7% der malignen Läsionen gleich gut (Gesamt 26,4%) und in 72,3% der benignen und 83,3% der malignen Läsionen schlechter (Gesamt 73,6%). Der Elastografiemodus des Ultraschallgerätes kommt somit nicht für eine Differenzierung zwischen Läsion und umgebenden Parenchym in Betracht. Abbildung 17 zeigt die Anzahl der Läsionen in den vier Elastografiescores getrennt für Läsionen mit benigner und maligner Histopathologie für die Datenerhebung im Querschnitt und im Längsschnitt. Als homogen grün (ES 1) stellt sich keine Läsion in der Elastografie dar. Durchschnittlich sind die Läsionen im Längsschnitt mit einem höheren Anteil an blauer Fläche im Elastogramm abgebildet. Die Wahrscheinlichkeit, dass eine Läsion in der entsprechenden Kategorie maligne ist, ist in der Gruppe mit homogen blauer Fläche (Elastografiescore 4) mit 22,2% am größten, die Wahrscheinlichkeit in der Gruppe mit Elastografiescore 2 (überwiegend grün mit blauen Anteilen) beträgt 10,0% und in der Gruppe mit Elastografiescore 3 (überwiegend blau mit grünen Anteilen) 8,3%. Die Wahrscheinlichkeit steigt dementsprechend nicht kontinuierlich mit der Zunahme des blauen Flächenanteils an, ist jedoch bei vollständig blauer Fläche am größten. Abbildung 17: Absolute Knotenanzahl in den 4 Elastografiescores (ES) bei der Erhebung der farblichen Elastogramme am Toshiba Aplio 500 Ultraschallgerät für das Endkollektiv. Die Einteilung der Knoten zu den Elastografiescores ist getrennt für benigne und maligne Knoten (dunkelblau und grau) im Querschnitt (QS) und für benigne und maligne Knoten (hellblau und weiß) im Längsschnitt (LS) aufgeführt. Universitätsklinikum Ulm, 12/2012 - 06/2013. 39 Ergebnisse 3.4.3 Siemens Acuson S3000 Alle Werte für die grafische Darstellung der Scherwellenelastografie werden für das Siemens Acuson S3000 im Quer- bzw. Längsschnitt bei einer Skalenkalibrierung von 0,5-6,5 m/s erfasst. Die Abgrenzbarkeit der Läsion vom restlichen Schilddrüsengewebe ist im Elastografiemodus deutlich schlechter als im herkömmlichen B-Bild: Lediglich eine Läsion, die histopathologisch maligne ist, lässt sich besser abgrenzen (Gesamt 1,9%), gleich gut abgrenzen lassen sich 19,2% der benignen und 33,3% der malignen Läsionen (Gesamt 20,8%) und schlechter abgrenzen lassen sich 80,9% der benignen und 50,0% der malignen Läsionen (Gesamt 77,3%). Die Verteilung der grafischen Elastogrammauswertung ist in Abbildung 18 für die Erhebung im Quer- und Längsschnitt gezeigt. 86,1 % der gutartigen Knoten weisen eine gemischt blau-grüne oder grün-gelbe (ES 2 und 3) Farbkomposition auf. Die Wahrscheinlichkeit, dass eine Läsion in einer bestimmten Farbgruppe maligne ist, ist in der Gruppe mit überwiegend roter Fläche (ES 4) mit 40% am größten, beträgt jedoch auch in der der Gruppe mit Elastografiescore 1 beachtliche 23,1%. Abbildung 18: Absolute Knotenanzahl in den 4 Elastografiescores (ES) bei der Erhebung der farblichen Elastogramme am Siemens Acuson S3000 Ultraschallgerät für das Endkollektiv. Die Einteilung der Knoten zu den Elastografiescores ist getrennt für benigne und maligne Knoten (dunkelblau und grau) im Querschnitt (QS) und für benigne und maligne Knoten (hellblau und weiß) im Längsschnitt (LS) aufgeführt. Universitätsklinikum Ulm, 12/2012 06/2013. 40 Ergebnisse 3.4.4 Vergleich der grafischen Darstellung der Elastografie der drei Ultraschallgeräte Im Vergleich der Abgrenzbarkeit von Knoten zu umliegendem Schilddrüsengewebe ist der Elastografiemodus an allen drei Ultraschallgeräten in der Mehrheit der Fälle schlechter geeignet als das normale B-Bild. Am ehesten trägt hier noch der Elastografiemodus des Hitachi HI VISION Ascendus zu einer besseren Abgrenzung bei, jedoch auch nur in 5,7% der Fälle. Um die Vorhersagekraft der qualitativen Elastografie zu testen, erfolgt am Hitachi HI VISION Ascendus und am Toshiba Aplio 500 eine Zuordnung der Knoten der Farbklassifikation „homogen grün“ und „überwiegend grün mit blauen Anteilen“ zur Kategorie benigne und Knoten der Farbklassifikation „homogen blau“ und „überwiegend blau mit grünen Anteilen“ zur Kategorie maligne. Analog dazu erfolgt beim Siemens Acuson S3000 die Einteilung der Knoten der Kategorie „überwiegend blau“ und „gemischt blau-grün“ zur Gruppe benigne und die Knoten der Kategorie „gemischt grün-gelb“ sowie „überwiegend rot“ zur Gruppe maligne. Die so berechneten Sensitivitäten, Spezifitäten, positiver und negativer Vorhersagewert, sowie die p-Werte sind in Tabelle 7 gegenübergestellt. Tabelle 7: Diagnostische Werte (Sensitivität, Spezifität, Positiver Vorhersagewert, Negativer Vorhersagewert) der grafischen Darstellung der Elastografie der drei Ultraschallgeräte: Hitachi HI VISION Ascendus, Toshiba Aplio 500, Siemens Acuson S3000 für die Differenzierung zwischen benignen und malignen Knoten in Prozent. Ausgewertet ist das Endkollektiv. Aufgeführt sind die Werte für die Elastogrammerhebung im Querschnitt (QS) und Längsschnitt (LS). In der letzten Zeile findet sich der p-Wert des entsprechenden Gerätes und der Schnittebene für die Differenzierung zwischen benignen und malignen Knoten. Universitätsklinikum Ulm, 12/2012 - 06/2013. Ultraschallgerät Hitachi Toshiba Siemens Schnittebene QS LS QS LS QS LS Sensitivität (%) 66,7 83,3 66,7 66,7 66,7 50 Spezifität (%) 48,9 40,4 44,7 31,9 68,1 70,2 14,3 15,2 13,3 11,1 21,1 17,7 92,0 95,0 91,3 88,2 94,1 91,7 0,6718 0,3904 0,6868 1,0 0,1717 0,3717 Positiver Vorhersagewert (%) Negativer Vorhersagewert (%) p-Wert 41 Ergebnisse Die mit Abstand höchste Sensitivität erreicht das Hitachi HI VISION Ascendus im Längsschnitt mit 83,3 %. Die beste Kombination aus Sensitivität und Spezifität ergibt sich für die Erhebung im Querschnitt beim Siemens Acuson S3000 mit 66,7% und 68,1%. Keines der drei Geräte erreicht einen signifikanten p-Wert, was bedeutet, dass kein Gerät in diesem Setting in der grafischen Darstellung der Elastografie geeignet ist, um zwischen benignen und malignen Knoten zu unterscheiden. 42 Ergebnisse 3.5 Semiquantitative Kompressionselastografie und numerische Darstellung der Scherwellenelastografie 3.5.1 Hitachi HI VISION Ascendus Das durchschnittliche Dehnungsverhältnis von benignen Läsionen beträgt 10,7 mit einer Standardabweichung von ±15,2, von malignen Läsionen 6,5 mit einer Standardabweichung von ±7,0. Der p-Wert zur Unterscheidung zwischen benigner und maligner Läsion beträgt p=0,8552 und ist somit nicht signifikant. In diese Berechnungen geht nun jeweils der Mittelwert der vier erhobenen Strain-RatioWerte eines Knoten ein. Beim Vergleich der Strain-Ratio-Werte getrennt für die histopathologischen Befunde ergibt sich ein nicht signifikanter p-Wert von 0,7153 (s. Tabelle 8). Erstaunlicherweise findet sich in der Gruppe der papillären Schilddrüsenkarzinome der zweitkleinste Mittelwert. Niedrige Werte sprechen für eine elastische und somit tendenziell benigne Läsion. Tabelle 8: Mittelwert, Standardabweichung (STD), Median und Wertebereich der am Hitachi HI VISION Ascendus Ultraschallgerät erhobenen Strain-Ratio-Werte für das Endkollektiv, aufgeführt nach den unterschiedlichen histopathologischen Knotenbefunden, sowie für die Gruppe der benignen Knoten zusammen. In Klammern ist die jeweilige Fallzahl der Gruppe aufgeführt (n). In der letzten Spalte sind die p-Werte für die Differenzierung der Histopathologien anhand ihrer Strain-Ratio-Werte aufgeführt. Universitätsklinikum Ulm, 12/2012 - 06/2013. Histopathologie des Knotens Strain-Ratio Mittelwert ± STD Median (Wertebereich) Strumaknoten (n=30) Follikuläres Adenom (n=7) Mikrofollikuläres Adenom (n=10) 12,1 ± 16,8 4,2 (0,1-75,8) 12,1 ± 16,2 2,9 (1,7-39,6) 5,8 ± 8,0 2,2 (0,9-27,0) 10,7 ± 15,2 3,2 (0,1-75,8) Papilläres Karzinom (n=6) p-Wert 0,7153 6,5 ± 7,0 3,1 (0,6-18,1) 0,8552 Da im Laufe der Studie eine zusätzliche Erhebung der Strain-Ratio auf gleicher Höhe des Knotens und des Schilddrüsenparenchyms mit in das Studienprotokoll aufgenommen wurde, schließt sich hier eine Berechnung mit ausschließlich diesen Strain-Ratio-Werten an. 43 Ergebnisse Die Verteilung der Strain-Ratio-Werte der benignen und malignen Knoten ist in Abbildung 19 gezeigt. Es erfolgt ein Ausschluss von Werten, die größer als zehn (n=8) waren. Abbildung 19: Strain-Ratio-Werte der benignen und malignen Knoten, die auf gleicher Höhe wie das umgebende Schilddrüsenparenchym gemessen sind, am Hitachi HI VISION Ultraschallgerät. Die gepunktete graue Linie markiert den Strain-Ratio-Wert von zehn. Für Werte oberhalb dieser Linie ist der Strain-Ratio-Wert mitangegeben. Sie wurden aus der Analyse ausgeschlossen. Drei Werte oberhalb des maximalen Skalenwertes von 45 wurden außerhalb des Diagrammbereichs übereinander dargestellt. Universitätsklinikum Ulm, 12/2012 - 06/2013. Für die Fallzahl der benignen Knoten ergibt sich n=36 und für die der malignen Knoten n=5. Aufgrund der relativ kleinen Fallzahl wird nunmehr nur die Gesamtzahl der benignen Knoten betrachtet. Die berechneten Werte für diese Subgruppe sind in Tabelle 9 aufgeführt. Es zeigt sich, dass der berechnete p-Wert für diese Subanalyse signifikant ist. 44 Ergebnisse Tabelle 9: Mittelwert, Standardabweichung (STD), Median und Wertebereich der am Hitachi HI VISION Ascendus Ultraschallgerät auf gleicher Höhe erhobenen Strain-Ratio-Werte, aufgeführt nach benigner und maligner Dignität des Knotens. In Klammern ist die jeweilige Fallzahl der Gruppe aufgeführt (n). In der letzten Spalte steht der für die Differenzierung der Dignität anhand der Strain-Ratio ermittelte signifikante p-Wert. Universitätsklinikum Ulm, 12/2012 - 06/2013. Dignität des Knotens Benigne Knoten Maligne Knoten (n= 36) (n=5) 2,5 ± 1,8 4,1 ± 1,8 2,0 (0,04-7,7) 3,6 (2,2-6,6) p-Wert Strain-Ratio Mittelwert ± STD; Median 0,0462 (Wertebereich) Letztendlich wurde im Verlauf der Erhebung noch der Einschluss des kompletten Knotens mit in das Studienprotokoll aufgenommen. Dies erfolgte nur bei benignen Knoten (n=21). Mittelwert, Standardabweichung, Median und Wertebereich der Strain-Ratio dieser Knoten sind: 2,5 ± 1,6, 2,0 (0,2-5,8). Ein Strain-Ratio-Wert, der größer als zehn war, wurde aus der Berechnung ausgeschlossen. 45 Ergebnisse 3.5.2 Toshiba Aplio 500 Die durchschnittliche Strain-Ratio beträgt in benignen Läsionen 6,4 mit einer Standardabweichung von ±7,3, in malignen Läsionen 2,7 mit einer Standardabweichung von ±1,5. In diese Berechnung geht nun jeweils der Mittelwert der vier erhobenen Strain-Ratio-Werte eines Knoten ein. Der p-Wert zur Unterscheidung benigner und maligner Läsionen beträgt p=0,1909 und ist somit nicht signifikant. Ebenfalls ist der p-Wert für die Unterscheidung der einzelnen histopathologischen Diagnosen der Läsionen mit p=0,5557 nicht signifikant (s.Tab. 10). Den kleinsten Mittelwert für die Strain-Ratio erhält man in der Gruppe der Karzinome. Dies bedeutet, dass bei diesen die höchste Elastizität gemessen wird. Tabelle 10: Mittelwert, Standardabweichung (STD), Median und Wertebereich der am Toshiba Aplio 500 Ultraschallgerät erhobenen Strain-Ratio-Werte für das Endkollektiv, aufgeführt nach den unterschiedlichen histopathologischen Knotenbefunden, sowie für die Gruppe der benignen Knoten zusammen. In Klammern ist die jeweilige Fallzahl der Gruppe aufgeführt (n). In der letzten Spalte sind die p-Werte für die Differenzierung der Histopathologien anhand ihrer Strain-Ratio-Werte aufgeführt. Universitätsklinikum Ulm, 12/2012 - 06/2013. Histopathologie des Knotens Strain-Ratio Mittelwert ± STD; Median (Wertebereich) Strumaknoten Follikuläres Mikrofollikuläres Papilläres (n=30) Adenom (n=7) Adenom (n=10) Karzinom (n=6) 5,2 ± 10,4 1,8 (0,1-34,7) 2,7 ± 1,5 6,9 ± 7,4 3,4 (0,2-30,1) 6,1 ± 6,2 2,3 (1,9-17,9) 6,4 ± 7,8 2,8 (0,1-34,7) p-Wert 0,3617 2,9 (0,9-4,6) 0,5276 Auch bei der Erhebung der Daten am Toshiba Ultraschallgerät wurde im Verlauf der Studie eine zusätzliche Erhebung mit in das Untersuchungsprotokoll aufgenommen: Die Messung der Strain-Ratio auf gleicher Höhe von Knoten und Schilddrüse. Es folgt daher eine Berechnung der statistischen Maßzahlen mit diesen Strain-RatioWerten unter Ausschluss von Werten, die größer als zehn (n=5) sind. Die Verteilung der Strain-Ratio-Werte der benignen und malignen Knoten ist in Abbildung 20 gezeigt. 46 Ergebnisse Abbildung 20: Strain-Ratio-Werte der benignen und malignen Knoten, die auf gleicher Höhe wie das umgebende Schilddrüsenparenchym gemessen sind, am Toshiba Aplio 500 Ultraschallgerät. Die gepunktete graue Linie markiert den Strain-Ratio-Wert von zehn. Für Werte oberhalb dieser Linie ist der Strain-Ratio-Wert angegeben. Sie wurden aus der Analyse ausgeschlossen. Zwei Werte oberhalb des maximalen Skalenwertes von 25 wurden außerhalb des Diagrammbereichs übereinander dargestellt. Universitätsklinikum Ulm, 12/2012 - 06/2013. Für die Fallzahl der benignen Knoten ergibt sich n=33 und für die der malignen Knoten n=5. Aufgrund der relativ kleinen Fallzahl wird nunmehr nur die Gesamtzahl der benignen Knoten betrachtet. In Tabelle 11 finden sich die berechneten Werte. Tabelle 11: Mittelwert, Standardabweichung (STD), Median und Wertebereich der am Toshiba Aplio 500 Ultraschallgerät auf gleicher Höhe erhobenen Strain-Ratio-Werte, aufgeführt nach benigner und maligner Dignität des Knotens. In Klammern ist die jeweilige Fallzahl der Gruppe aufgeführt (n). In der letzten Spalte steht der für die Differenzierung der Dignität anhand der Strain-Ratio ermittelte p-Wert. Universitätsklinikum Ulm, 12/2012 - 06/2013. Dignität des Knotens Strain-Ratio Mittelwert ± STD; Median (Wertebereich) Benigne Knoten (n=33) Maligne Knoten (n=5) 3,2 ± 2,3 3,2 ± 1,9 2,7 (0,03-8,86) 2,5 (1,12-5,62) p-Wert 0,8342 47 Ergebnisse Letztendlich wurde im Verlauf der Datenerhebung am Toshiba Ultraschallgerät ebenfalls der Einschluss des kompletten Knotens mit in die Erhebung aufgenommen. Dies erfolgte nur bei benignen Knoten (n=19). Mittelwert, Standardabweichung, Median und Wertebereich der Strain-Ratio-Werte dieser Knoten sind: 3,2 ± 2,5, 2,6 (0,14-8,32). Ein Strain-Ratio-Wert größer als zehn wurde ausgeschlossen. 48 Ergebnisse 3.5.3 Siemens Acuson S3000 Die Auswertung für das Siemens Ultraschallgerät erfolgt für die drei Einstellungen Querschnitt 0,5-6,5 m/s, Querschnitt 0,5-9,0 m/s und Längsschnitt 0,5-6,5 m/s. Zusätzlich sind die Messungen für die Einstellung Querschnitt 0,5-3,0 m/s erhoben, da hierbei jedoch zu viele Messwerte oberhalb der Grenze von 3,0 m/s liegen und daher vom Gerät in dieser Einstellung nicht erfasst werden, kann die Auswertung dieser Messreihe nicht erfolgen. Für alle drei Untersuchungseinstellungen sind die Messwerte für die unterschiedlichen Histopathologien sowie für die Gruppe der benignen und malignen Läsionen in Tabelle 12 dargestellt. Die Scherwellengeschwindigkeit im Bereich des papillären Schilddrüsenkarzinoms weist durchschnittlich in beiden Querschnitteinstellungen die größten Werte mit 3,6 m/s und 4,0 m/s auf. Im Längsschnitt weisen die Scherwellen des Strumaknotens durchschnittlich die größte Geschwindigkeit mit 3,4 m/s auf, wobei die ermittelte Geschwindigkeit im papillären Schilddrüsenkarzinom mit 3,3 m/s nur knapp darunter liegt. Gemessene hohe Scherwellengeschwindigkeiten entsprechen hartem, unelastischem und somit malignitätssuspektem Gewebe. Insgesamt bilden das papilläre Schilddrüsenkarzinom und der Strumaknoten die Gruppe mit den schnelleren Geschwindigkeiten, follikuläres und mikrofollikuläres Adenom die Gruppe mit den langsameren Geschwindigkeiten. In malignen Läsionen werden in allen drei Einstellungen durchschnittlich höhere Geschwindigkeiten gemessen als in den benignen Läsionen. Der größte und damit am leichtesten feststellbare Unterschied zwischen den mittleren Werten der benignen und malignen Knoten findet sich im Querschnitt in der Skaleneinstellung 0,5-9,0 m/s. Jedoch ergeben sich weder für diese noch für die beiden anderen Einstellungen signifikante Unterschiede zwischen den Geschwindigkeiten. Die pWerte liegen hier zwischen 0,5095 und 0,6035. Auch in einer weiteren Untergliederung der benignen Knoten in ihre Histopathologien ergeben sich für keine der drei Einstellungen signifikante Unterschiede. Die p-Werte liegen zwischen 0,2322 und 0,4798. 49 Ergebnisse Tabelle 12: Mittelwert, Standardabweichung (STD), Median und Wertebereich der am Siemens Acuson S3000 Ultraschallgerät erhobenen Scherwellengeschwindigkeiten des Endkollektives für die drei Schnittebenen und Skaleneinstellungen: Querschnitt 0,5-6,5 m/s und 0,5-9,0 m/s und Längsschnitt 0,5-6,5 m/s, aufgeführt nach den unterschiedlichen histopathologischen Knotenbefunden, sowie für die Gruppe der benignen Knoten zusammen. In Klammern ist die jeweilige Fallzahl der Gruppe aufgeführt (n). In der letzten Zeile sind die p-Werte für die Differenzierung der Histopathologien anhand ihrer Scherwellengeschwindigkeiten aufgeführt. Universitätsklinikum Ulm, 12/2012 - 06/2013. Querschnitt Querschnitt Längsschnitt 0,5- 6,5 m/s 0,5- 9,0 m/s 0,5- 6,5 m/s Mittelwert ± Standardabweichung; Median (Wertebereich) Strumaknoten (n=30) Follikuläres Knoten- Adenom (n=7) 3,1 (1,6-6,0) 2,9 ± 0,7 2,7 (2,0-4,2) histologie Mikrofollikuläres Adenom (n=10) Papilläres Karzinom (n=6) p-Wert 3,6 ± 1,3 3,1 (1,5- 3,3 ± 0,9 7,5) 3,1 ± 0,8 2,9 (1,66,0) 2,8 ± 0,4 2,8 (2,1-3,6) 3,6 ± 1,5 3,6 (1,8-6,1) 0,4798 3,4 ± 1,1 3,1 (1,2-6,3) 0,5095 3,0 ± 1,0 3,0 (1,94,8) 2,8 ± 0,5 2,8 (2,13,8) 3,3 ± 1,1 3,0 (1,57,5) 2,9 ± 1,0 2,8 (1,8-5,6) 4,0 ± 2,4 3,7 (1,8-8,4) 0,2322 2,6 ± 0,8 2,9 (1,1-3,2) 3,2 ± 1,1 2,9 (1,16,3) 0,5841 3,3 ± 1,9 2,5 (1,6-6,1) 0,2839 0,6035 Untersucht man die Scherwellengeschwindigkeiten der benignen und malignen Knoten differenziert nach den verschiedenen Histopathologien des Schilddrüsengewebes, ergeben sich die in Tabelle 20 im Anhang gezeigten Ergebnisse. 50 Ergebnisse 3.5.4 Vergleich der drei Ultraschallgeräte Für einen Vergleich der drei Ultraschallgeräte in der semiquantitativen Elastografie bzw. numerischen Darstellung der Scherwellenelastografie werden die bestmöglichen Cut-off-Punkte zur Unterscheidung von benignen und malignen Läsionen mit den jeweiligen diagnostischen Werte berechnet. Sowohl beim Hitachi als auch beim Toshiba Ultraschallgerät erfolgt diese Berechnung für die Werte der Subanalyse mit Strain-Ratio-Werten, die auf gleicher Höhe gemessen wurden, da nur bei dieser die benignen Knoten einen kleineren Strain-Ratio-Wert aufwiesen als die malignen Knoten. Tabelle 13 zeigt die Ergebnisse. Für den gewählten Cut-off-Punkt am Hitachi Ultraschallgerät ergibt sich ein signifikanter p-Wert, was bedeutet, dass der berechnete Cut-off-Punkt in der vorliegenden Arbeit geeignet ist, um maligne von benignen Knoten zu differenzieren. Tabelle 13: Berechnete Cut-off-Punkte der Strain-Ratio-Werte der semiquantitativen Kompressionselastografie des Hitachi HI VISION Ascendus und Toshiba Aplio 500 Ultraschallgerätes und die Cut-off-Punkte der Scherwellengeschwindigkeiten in Meter pro Sekunde (m/s) der numerischen Darstellung der scherwellenbasierten Elastografie des Siemens Acuson S3000 Ultraschallgeräts unter Angabe der jeweiligen Fallzahl (n). Aufgeführt sind die diagnostischen Werte (Sensitivität, Spezifität, Positiver und Negativer Vorhersagewert) bei den gewählten Cut-off-Punkten für die Datenerhebung im Querschnitt (QS) bzw. Längsschnitt (LS). Am Siemens Ultraschallgerät wurde eine Skaleneinstellung von 0,5-6,5 m/s gewählt. In der letzten Zeile findet sich der p-Wert für die Differenzierung der Kategorien benigne und maligne Knoten. Universitätsklinikum Ulm, 12/2012 - 06/2013. Hitachi Toshiba Siemens (n=41) (n=38) (n=53) Schnittebene (Skaleneinstellung) QS QS QS (0,5-6,5m/s) LS (0,5-6,5 m/s) Cut-off-Punkt 2,97 2,48 3,29 m/s 2,90 m/s Sensitivität (%) 80,0 60,0 66,7 50,0 Spezifität (%) 72,2 48,5 68,1 46,8 Positiver Vorhersagewert (%) 28,6 15,0 21,1 10,7 96,3 88,9 94,1 88,0 0,0387 1,0 0,1717 1,0 Ultraschallgerät Negativer Vorhersagewert (%) p-Wert 51 Ergebnisse 3.5.5 Weitere Vergleichsmessungen der numerischen Scherwellenelastografie Neben der Unterscheidung zwischen benignen und malignen Läsionen werden beim Siemens Ultraschallgerät weitere folgende Vergleichsmessungen in den drei bereits oben genannten Einstellungen ausgewertet: Vergleich der Scherwellengeschwindigkeiten von Läsion und Schilddrüsengewebe und Vergleich der Scherwellengeschwindigkeiten innerhalb der unterschiedlichen Schilddrüsengewebe. 3.5.5.1 Vergleich der Scherwellengeschwindigkeiten von Läsion und Schilddrüsenparenchym In Abbildung 21 werden die gemessenen Scherwellengeschwindigkeiten der Läsion und des Schilddrüsengewebes getrennt für die drei Einstellungen am Siemens Acuson S3000 gegenübergestellt. Hierbei werden auch die Schilddrüsengewebe mit entzündlicher Veränderung miteinbezogen. In allen drei Einstellungen zeigen sich für die Läsion höhere Mittelwerte als für das umliegende Schilddrüsengewebe. Die mittlere Scherwellengeschwindigkeit und Standardabweichung der Läsion beträgt im Querschnitt (0,5-6,5 m/s) 3,2 ± 0,9 m/s und des Schilddrüsenparenchyms 2,8 ± 0,7 m/s. Für die Unterscheidung der beiden Parenchyme ergeben sich für alle drei Einstellungen signifikante p-Werte von p=0,0101 (Querschnitt 0,5-6,5 m/s), p=0,0280 (Querschnitt 0,5-9,0 m/s) und p=0,0010 (Längsschnitt 0,5-6,5 m/s). Die weiteren statistischen Daten sind der Tabelle 18 im Anhang zu entnehmen. Auch bei einer Unterteilung der Läsionen in ihre histopathologischen Diagnosen zeigen sich für die Läsionen, mit Ausnahme des Mikrofollikulären Adenoms im Querschnitt mit einer Skalenkalibrierung von 0,5-6,5 m/s, höhere mittlere Scherwellengeschwindigkeiten (Tabelle 18 im Anhang). Folglich können die gemessenen Scherwellengeschwindigkeiten für die Unterscheidung zwischen Läsions- und Schilddrüsengewebe herangezogen werden. 52 Ergebnisse Abbildung 21: Boxplot der Scherwellengeschwindigkeiten in Meter pro Sekunde (m/s) im Bereich von Läsion und umgebenden Schilddrüsenparenchym (Schilddrüse) im Querschnitt bei einer Skalenkalibrierung von 0,5-6,5 m/s und 0,5-9,0 m/s und im Längsschnitt bei einer Skalenkalibrierung von 0,5-6,5 m/s. Datenerhebung am Siemens Acuson S3000 und Auswertung des Endkollektives. ӿ markiert den jeweiligen Mittelwert, ‒ den jeweiligen Median. Universitätsklinikum Ulm, 12/2012 - 06/2013. Um zukünftig erhobene Messwerte bei einer ARFI-Untersuchung zu Läsions- oder zu Schilddrüsengewebe zuordnen zu können, sind die 95%-Intervalle der beiden Scherwellengeschwindigkeitsbereiche dieser Arbeit in Tabelle 14 angegeben. Tabelle 14: 95%-Intervalle der Scherwellengeschwindigkeiten für Läsions- und Schilddrüsengewebe in Meter pro Sekunde (m/s) in den drei Einstellungen Querschnitt 0,56,5 m/s und 0,5-9,0 m/s sowie Längsschnitt 0,5-6,5 m/s für die Erhebung am Siemens Acuson S3000 Ultraschallgerät mit Auswertung des Endkollektivs. Universitätsklinikum Ulm, 12/2012 - 06/2013. Schnittebene und Skaleneinstellung 95%-Intervall der Scherwellengeschwindigkeiten Querschnitt Querschnitt Längsschnitt 0,5-6,5 m/s 0,5-9,0 m/s 0,5-6,5 m/s Im Bereich der Läsion (m/s) 2,9 – 3,4 3,1 – 3,8 2,9 – 3,5 Im Bereich des Schilddrüsengewebes (m/s) 2,6 – 3,0 2,6 – 3,2 2,4 – 2,7 53 Ergebnisse Nimmt man aus dieser Gesamtanzahl der Schilddrüsen die Schilddrüsen, die eine unauffälligen Histologie (n=34) aufweisen, heraus und vergleicht die darin gemessenen Scherwellengeschwindigkeiten mit den Geschwindigkeiten der sich darin befindenden Knoten, zeigen sich auch hier durchgehend höhere Mittelwerte bei den Läsionen als bei dem Schilddrüsengewebe (s. Abbildung 22). Wiederum ergeben sich für alle drei Einstellungen signifikante p-Werte (Tabelle 19 im Anhang). Abbildung 22: Boxplot der Scherwellengeschwindigkeiten in Meter pro Sekunde (m/s) im Bereich des Schilddrüsenparenchyms und der sich ausschließlich in diesem gesunden Gewebe befindenden Läsionen im Querschnitt bei einer Skalenkalibrierung von 0,5-6,5 m/s und 0,5-9,0 m/s sowie im Längsschnitt bei einer Skalenkalibrierung von 0,5-6,5 m/s. Datenerhebung am Siemens Acuson S3000 und Auswertung einer Subanalyse des Endkollektivs mit ausschließlich gesundem Schilddrüsengewebe. ӿ markiert den jeweiligen Mittelwert, ‒ den jeweiligen Median. Universitätsklinikum Ulm, 12/2012 - 06/2013. Auch in dieser Subanalyse zeigt sich, dass die Scherwellengeschwindigkeit eine Differenzierung zwischen Läsion und umgebenden Schilddrüsenparenchym zulässt. Daher werden die für diese Erhebung geltenden 95%-Intervalle der Messwerte in Tabelle 15 angegeben. 54 Ergebnisse Tabelle 15: 95%-Intervalle der Scherwellengeschwindigkeiten im Bereich des gesunden Schilddrüsengewebes und der sich darin befindenden Läsionen in Meter pro Sekunde (m/s) in den Einstellungen Querschnitt 0,5-6,5 m/s und 0,5-9,0 m/s, Längsschnitt 0,5-6,5 m/s für die Erhebung am Siemens Acuson S3000 mit Auswertung einer Subanalyse des Endkollektivs. Universitätsklinikum Ulm, 12/2012 - 06/2013. Schnittebene und Skaleneinstellung 95%-Intervall der Scherwellengeschwindigkeiten Querschnitt Querschnitt Längsschnitt 0,5-6,5 m/s 0,5-9,0 m/s 0,5-6,5 m/s Im Bereich der Läsion (m/s) 2,7 – 3,4 2,8 – 3,8 2,6 – 3,4 Im Bereich des gesunden Schilddrüsengewebes (m/s) 2,6 – 3,1 2,6 – 3,4 2,4 – 2,8 55 Ergebnisse 3.5.5.2 Vergleich der Scherwellengeschwindigkeiten des Schilddrüsenparenchyms Im ersten Teil dieses Kapitels erfolgt der Vergleich der Scherwellengeschwindigkeiten zwischen den unterschiedlichen Histopathologien der Schilddrüsengewebe. Dies erfolgt für die drei Einstellungen am Siemens Ultraschallgerät: Querschnitt 0,5-6,5 m/s und 0,5-9,0 m/s sowie für den Längsschnitt 0,5-6,5 m/s. Für die erste dieser Einstellungen zeigt sich ein signifikanter Unterschied zwischen den einzelnen Histopathologien. Dabei weist das gesunde Schilddrüsengewebe durchschnittlich die geringste Scherwellengeschwindigkeit auf, gefolgt von der Hashimoto-Thyreoiditis und abschließend von der chronischen Thyreoiditis wie Tabelle 16 zeigt. Tabelle 16: Diagnostische Werte (Mittelwert, Standardabweichung (STD) , Median und Wertebereich) der Scherwellengeschwindigkeiten in Meter pro Sekunde (m/s) der Schilddrüsengewebe mit unterschiedlicher Histopathologie unter Angabe der jeweiligen Fallzahl in Klammern (n). Ausgewertet ist das Endkollektiv für die drei Schnittebenen und Skaleneinstellungen: Querschnitt 0,5-6,5 m/s und 0,5-9,0 m/s und Längsschnitt 0,5-6,5 m/s am Siemens Acuson S3000 Ultraschallgerät. In der letzten Zeile steht der für die Differenzierung der einzelnen Histopathologien anhand der Scherwellengeschwindigkeit ermittelte p-Wert. Universitätsklinikum Ulm, 12/2012 - 06/2013. Schnittebene und Skaleneinstellung Querschnitt Querschnitt Längsschnitt 0,5-6,5 m/s 0,5-9,0 m/s 0,5-6,5 m/s Mittelwert ± STD, Median, Wertebereich Gesundes SchilddrüsenHistopathologie des Schilddrüsengewebes gewebe (n= 26) Chronische Thyreoiditis (n= 11) HashimotoThyreoiditis (n= 4) p- Wert 3,1± 1,0 2,8 (1,6 - 6,1) 3,3 ± 1,5 2,8 (1,5-8,4) 3,0 ± 1,2 2,8 (1,1-6,3) 3,5 ± 0,8 3,5 (2,1 – 4,6) 3,6 ± 0,9 3,7 (2,1-5,2) 3,7 ± 1,3 3,1 (2,0-5,6) 3,3 ± 0,7 3,1 (2,7 – 4,4) 3,6 ± 1,1 3,1 (3,0-5,6) 3,2 ± 0,6 3,3 (2,4-4,0) 0,0322 0,2052 0,1636 56 Ergebnisse Im zweiten Abschnitt dieses Kapitels wird die durchschnittliche Scherwellengeschwindigkeit von Schilddrüsengewebe mit benigner Läsion dem Schilddrüsengewebe mit maligner Läsion gegenübergestellt. Da für jeden Knoten eigene Messwerte im Schilddrüsenparenchym erhoben werden, ergibt sich für die Anzahl der ausgewerteten Schilddrüsengewebe die Knotenanzahl des Endkollektivs mit n=53. In allen drei Einstellungen ergeben sich durchschnittlich deutlich größere Geschwindigkeitswerte bei den Schilddrüsengeweben mit maligner Läsion als bei den Schilddrüsengeweben mit benigner Läsion (s. Abbildung 23). In den beiden Querschnittserhebungen ergeben sich hierfür signifikante Unterschiede mit pWerten von 0,0365 für die Skalenkalibrierung 0,5-6,5 m/s bzw. 0,0306 für die Skalenkalibrierung von 0,5-9,0 m/s. Auch werden für eine künftige Einordnung der absoluten Zahlenwerte die Intervalle angegeben, in denen sich 95% der Zahlenwerte der Schilddrüsengewebe mit benigner bzw. maligner Läsion befinden (s. Tabelle 21 im Anhang). Abbildung 23: Boxplot der Scherwellengeschwindigkeiten in Meter pro Sekunde (m/s) im Bereich des Schilddrüsenparenchym, das mindestens eine benigne Läsionen enthält, und im Bereich des Schilddrüsenparenchyms, das mindestens eine maligne Läsion enthält in den drei unterschiedlichen Schnittebenen und Einstellungen: Querschnitt bei einer Skalenkalibrierung von 0,5-6,5 m/s und 0,5-9,0 m/s sowie Längsschnitt bei einer Skalenkalibrierung von 0,5-6,5 m/s. Datenerhebung am Siemens Acuson S3000 und Auswertung des Endkollektivs. ӿ markiert den jeweiligen Mittelwert, ‒ den jeweiligen Median. Universitätsklinikum Ulm, 12/2012 - 06/2013. 57 Diskussion 4 Diskussion Die im vorherigen Kapitel aufgeführten Ergebnisse werden im Folgenden nun in die aktuelle Literatur eingeordnet und diskutiert. Auch werden die Stärken und Schwächen der vorliegenden Arbeit aufgeführt und abschließend ein Resümee abgeleitet. 4.1 B-Bild-Parameter der Schilddrüse 4.1.1 Schilddrüsenvolumen Das durchschnittliche Schilddrüsenvolumen von 50,8 ml überschritt die in der Literatur angegebenen Grenzwerte von maximal 18 ml für Frauen bzw. maximal 25 ml für Männer. Morphologisch wird die gleichmäßige Vergrößerung der Schilddrüse, die Struma diffusa, von der in dieser Studie ausschließlich vorkommenden Struma nodosa, einer Vergrößerung der Schilddrüse mit existentem Knoten, unterschieden. Zum einen war daher die Vergrößerung des Schilddrüsenvolumens auf die Knoten, von denen in 85,4% der Fälle mindestens zwei in jeder Schilddrüse zu finden waren, zurückzuführen. Weitere Gründe könnten zum anderen die Volumenzunahme durch eine Hashimoto-Thyreoiditis, die in dieser Arbeit in vier Fällen beschrieben wurde, oder auch eine Jodunterversorgung dieser Population sein [53]. Zwar wurde in der vorliegenden Arbeit ein eventuell vorhandener Jodmangel der Patienten nicht untersucht, aber Hampel et al. konnten in ihrem Bericht über die Jodversorgung in Deutschland einen regional unabhängigen Jodmangel bei 36% der Bevölkerung zeigen [33]. Daher ist auch für einen Teil des Patientenkollektives in der vorliegenden Arbeit ein Jodmangel anzunehmen. Die zudem beobachtete Diskrepanz zwischen den Volumina der Schilddrüsen mit benigner und maligner Läsion ist nun zu diskutieren. Die Volumina der Schilddrüsen, die ausschließlich benigne Läsionen enthielten, waren durchschnittlich mehr als doppelt so groß wie die Volumina der Schilddrüsen mit mindestens einer malignen Läsion. Diese Beobachtung bestätigte auch die Arbeit von Erbil et al., die in ihrer Arbeit ein signifikant kleineres Volumen bei Schilddrüsen, die eine maligne Läsion enthielten, nachweisen konnten. Mögliche Ursachen für dieses Ergebnis wurden jedoch von den Autoren nicht diskutiert [24]. 58 Diskussion Analog zu der oben aufgeführten Überlegung, dass Knoten wesentlich zu einer Schilddrüsenvergrößerung beitragen können, war auch ein Unterschied zwischen den Volumina von benignen und malignen Läsionen festzustellen: Das durchschnittliche Volumen der benignen Läsionen war mehr als doppelt so groß als das durchschnittliche Volumen der malignen Läsionen. Mögliche Gründe für diesen Unterschied werden später in der Diskussion zur Knotengröße aufgeführt. 4.1.2 Echogenität und Echotextur Alle malignen Läsionen fanden sich in sonografisch unauffälligen Schilddrüsen, d.h. die Schilddrüsengewebe stellten sich echonormal und homogen dar. Die Karzinome nahmen daher zum Zeitpunkt der Untersuchung keinen Einfluss auf das sonomorphologische Aussehen des umliegenden Parenchyms. Auch die aktuelle Literatur zur Ultraschalldiagnostik von Schilddrüsenknoten legt den Schwerpunkt der Diagnostik nicht auf das Aussehen des Schilddrüsenparenchyms, sondern auf die B-Bild-Kriterien des Knotens selbst [1, 34, 37, 50]. Diese sind im nachfolgenden Kapitel 4.2.1 diskutiert. 4.1.3 Knotenanzahl 85,4% der untersuchten Patienten wiesen mehr als einen Knoten in ihrer Schilddrüse auf. Papilläre Karzinome, die in dieser Arbeit die einzige maligne Entität darstellten, traten in vier Fällen solitär und in einem Fall multifokal, d.h. zwei maligne Knoten befanden sich in derselben Schilddrüse, auf. Dieses Verhältnis bestätigte die aktuelle Literatur, die davon ausgeht, dass papilläre Karzinome zumeist allein und in 10-20% der Fälle multifokal vorkommen [52, 86]. Viele Arbeiten beschäftigten sich seit den 1990er-Jahren mit der Frage, ob die Inzidenz für ein Schilddrüsenkarzinom in einem einzeln auftretenden Knoten oder in einer multinodulär vergrößerten Schilddrüse, also im Rahmen einer Struma multinodosa, größer sei. Erschwert wird ein direkter Vergleich zwischen den Arbeiten allerdings durch die unterschiedliche Definition der Autoren von „Multinodularität“. Eine große Metaanalyse von Brito et al. mit 18288 Schilddrüsenknoten aus den Vereinigten Staaten konnte ein höheres Risiko für Malignität bei solitären Knoten zeigen (OR= 4,45) [12]. Auch Campanella et al., die in ihrer Metaanalyse 29678 Knoten untersuchten, errechneten ein erhöhtes Karzinomrisiko 59 Diskussion für solitäre Knoten, jedoch war die Odds-Ratio in ihrer Arbeit mit 1,43 kleiner als die von Brito et al. berechnete [16]. Frates et al. fanden in ihrer Studie mit 3483 Knoten das Krebsrisiko für Patienten mit solitärem Knoten in etwa gleich groß wie das Risiko für Patienten mit multinodöser Struma. Das Malignitätsrisiko eines einzelnen Knotens sank mit Zunahme der Gesamtknotenanzahl in der Schilddrüse [25]. In dieser Arbeit wurde eine Schilddrüse als multinodulär definiert, wenn sie mindestens zwei Knoten aufwies. Keiner der untersuchten sechs solitären Knoten war in dieser Studie maligne, d.h. dass sich alle malignen Knoten in einer multinodulären Schilddrüse befanden. Dieses Ergebnis weicht zwar von den Ergebnissen der Metaanalysen ab, diese geben allerdings nur das Malignitätsrisiko an, das ein solitärer Knoten zusätzlich aufweist. Ihre Aussage besteht nicht darin, dass ein maligner Knoten in jedem Fall allein auftritt. Diese Diskrepanz und die Tatsache, dass sich in dieser Arbeit neben jedem malignen Knoten mindestens ein benigner Knoten fand, unterstreicht die Bedeutung der sorgfältigen Ultraschalluntersuchung eines jeden einzelnen Knotens in einer multinodulären Schilddrüse. 4.2 B-Bild-Kriterien, Durchblutungsmuster und TIRADS- Klassifikation der Läsion 4.2.1 B-Bild-Kriterien 4.2.1.1 Sonografische Parameter Keiner der in dieser Arbeit erhobenen B-Bild-Parameter zeigt einen signifikanten Unterschied zwischen benignen und malignen Läsionen. In der Vergangenheit wurden unterschiedliche B-Bild-Parameter für eine Differenzierung zwischen benignen und maligen Knoten diskutiert. Beispielsweise waren dies das Halo-Zeichen, eine unscharfe Randbegrenzung, Mikro- und Makrokalzifizierungen, Hypoechogenität oder eine „Tiefer-als-Breit“-Form des Knotens. Kein Parameter konnte jedoch für sich alleine genommen eine ausreichende Sensitivität und Spezifität aufzeigen, lediglich konnten sogenannte Risikofaktoren identifiziert werden, die in ihrer Summe die Vorhersagekraft für Malignität erhöhen können. Die einzigen verlässlichen Anzeichen für Malignität sind 60 Diskussion das invasive Knotenwachstum in das Schilddrüsengewebe oder in Halsstrukturen und zervikale Lymphknotenmetastasen [6, 50, 55, 64]. Die bereits im vorherigen Kapitel aufgeführte, im April 2014 publizierte Metaanalyse von Brito et al. konnte in der Auswertung von über 31 Studien mit 18288 Knoten und 14 unterschiedlichen B-Bild- Parametern den stärksten Zusammenhang zwischen Malignität und „Tiefer-als-Breit“-Form des Knotens aufzeigen (OR=11,14), die Autoren rieten jedoch ebenfalls von einer Verwendung als alleiniges Malignitätskriterium ab. Eine weitere, ebenfalls im vorherigen Kapitel bereits aufgeführte, 2014 publizierte Metaanalyse von Campanella et al. evaluierte die klinischen und sonografischen Parameter von 29678 Schilddüsenknoten und fand ebenfalls das größte Malignitätsrisiko bei Knoten, die eine Tiefer-als-Breit-Form aufwiesen (OR=10,15) [16]. In meiner Arbeit zeigte sich bezüglich dieses Merkmals kein Unterschied, die Mittelwerte der Verhältnisse von Tiefe zu Breite waren mit 0,8 sogar identisch. Brito et al. schlugen statt der Verwendung eines einzelnen Malignitätskriteriums vor, die Kriterien „zystischer Knoten“ und „schwammförmiges Aussehen“ als zuverlässige Kriterien für Benignität heranzuziehen [12]. Rein zystische Knoten wurden in meiner Arbeit als Ausschlusskriterium definiert und kamen daher in der Auswertung nicht vor. Das schwammartige Aussehen, das als TIRADS-Kategorie 2 eingestuft wird, zeigten in meiner Arbeit allerdings zwei der sechs malignen Knoten. Die Aussage von Brito et al. konnte somit nicht bestätigt werden. Brito et al. und Campanella et al. berechneten u.a. für folgende sonografischen Kriterien ebenfalls ein erhöhtes Malignitätsrisiko: (Mikro-) Kalzifikationen, fehlendes Halo-Zeichen, irregulärer Rand und Hypoechogenität des Knotens [12, 16]. In der vorliegenden Arbeit fand sich außer bei letztgenanntem Charakteristikum ein höherer relativer Anteil jedoch in der Gruppe der benignen Knoten. Hypoechogenität wurde in 50% der malignen Knoten beobachtet. Zweifellos lässt sich keines dieser Kriterien als alleiniges Unterscheidungsmerkmal zwischen Benignität und Malignität heranziehen, auch die vorliegende Untersuchung bestätigt diese Aussage. Eine fortführende Diskussion unterschiedlicher Kombinationen sonografischer Merkmale übersteigt den Rahmen dieser Dissertation und könnte Bestandteil zukünftiger Arbeiten sein. 61 Diskussion 4.2.1.2 Knotengröße Ausführlicher soll der in der vorliegenden Arbeit beobachtete Unterschied der Knotengröße zwischen benignen und malignen Knoten diskutiert werden. Zwar wurde in dieser Arbeit kein signifikanter Unterschied zwischen den Knotenvolumina festgestellt, es ist jedoch auffällig, dass das Volumen gutartiger Knoten durchschnittlich mehr als doppelt so groß ist als das Volumen bösartiger Knoten. Auch wenn die folgenden Arbeiten teilweise den größtmöglichen Diameter diskutierten, der in dieser Arbeit nicht erhoben wurde, lassen sich daraus Aussagen über die Knotengröße ableiten. Die folgenden zwei Studien beobachteten diese Diskrepanz in der Knotengröße zwischen benignen und malignen Knoten ebenfalls: Moon et al. zeigten in ihrer retrospektiven Arbeit mit 849 Knoten einen signifikanten Unterschied zwischen den maximalen Durchmessern von malignen und benignen Knoten, wobei der der malignen signifikant kleiner war als der der benignen [55]. In der von Rossi et al. publizierten Arbeit waren von 233 malignen Knoten 144 (61,8%) kleiner als ein Zentimeter im maximalen Durchmesser [68]. Genauso gibt es jedoch auch Studien, die keinen Unterschied in der Größe zwischen gut- und bösartigen Knoten feststellen konnten [42, 59]. Campanella et al. publizierten in ihrer Metaanalyse ein erhöhtes Krebsrisiko (OR=1,63) für Knoten, die mindestens vier Zentimeter groß waren [16]. Der Gedanke, dass Malignität ein schnelles Wachstum und somit eine gewisse Knotengröße zum Zeitpunkt der Diagnostik impliziert, zeigte sich demnach in dieser Datenerhebung. Zusammenfassend sind die verschiedenen Ergebnisse so zu bewerten, dass der Untersucher sehr vorsichtig sein muss, wenn er basierend auf der Knotengröße Empfehlungen für oder gegen weitere diagnostische Schritte veranlasst. 4.2.2 Durchblutungsmuster Die Ergebnisse der vorliegenden Arbeit wiesen zwar keinen signifikanten Unterschied zwischen der Durchblutung von benignen und malignen Läsionen auf, jedoch zeigte sich, dass mit Zunahme der intranodulären Durchblutung auch das Risiko für Malignität stieg. Dieses Ergebnis entspricht der aktuellen Lehrmeinung, 62 Diskussion in welcher die erhöhte intranoduläre Durchblutung als unabhängiger Risikofaktor für Malignität angesehen wird [1, 16, 64]. In einer gegenwärtigen Metaanalyse von Woliński et al. berechneten die Autoren jedoch nur eine nicht zufriedenstellende Sensitivität von 44,2% und Spezifität von 81,5% für diesen Parameter und blieben damit hinter den Erwartungen zurück [85]. Da es unterschiedliche Einteilungen bezüglich des Vaskularisationsmusters gibt, wird ein direkter Vergleich zwischen verschiedenen Studien erschwert. Daher wird im Folgenden nur eine Arbeit aufgeführt, in der bzgl. der Vaskularisation die gleiche Einteilung wie in dieser Arbeit vorgenommen wurde: Bojunga et al. fassten in ihrer Arbeit die Muster 3 und 4 zusammen. Sie fanden so in der Gruppe der malignen Läsionen 52,3% Knoten und in der Gruppe der benignen Läsionen 27,0% Knoten mit diesen Vaskularisationsmustern [9]. In der vorliegenden Arbeit fielen die Anteile der Muster 3 und 4 sowohl an den malignen Läsionen mit 83,3% als auch an den benignen Läsionen mit 66,0% deutlich größer aus. Da beide Studien an einem Hitachi Ultraschallgerät durchgeführt wurden, könnten für diese Diskrepanz noch eine untersucherabhängige Einstellung des Ultraschallgerätes, wie zum Beispiel die Intensität des Color-Doppler-Modus oder andere Untersuchungsparameter, wie der vom Untersucher applizierte Druck, ursächlich sein. Es bleibt jedoch festzustellen, dass die Zuteilung zu einem Vaskularisationsmuster allein in diesen beiden Studien stark variiert und als alleiniger Parameter zunächst ungeeignet für eine Differenzierung zwischen benignen und malignen Knoten erscheint. 4.2.3 TIRADS-Klassifikation Um dem Untersucher eine Hilfestellung bei der Unterscheidung zwischen benignen und malignen Knoten bzw. bei der Indikationsstellung für oder gegen eine Feinnadelbiopsie bei der Fülle der identifizierten Risikofaktoren zu geben, wurde das Thyroid Imaging Reporting and Data System (TIRADS) von Horvath et al. 2009 eingeführt [37]. Jüngst wurde eine Metaanalyse mit über 10400 Schilddrüsenknoten veröffentlicht, die die Zuverlässigkeit dieses Systems überprüfte und zu einer bestätigenden Sensitivität von 79% und einer Spezifität von 71% kam [83]. Eine Arbeit von Friedrich-Rust et al. befasste sich mit der Interobserver-Variabilität der TIRADS-Klassifikation nach Horvath et al.: 114 Schilddrüsenknoten wurden von drei Untersuchern unabhängig voneinander zu einer TIRADS-Kategorie zugeteilt. 63 Diskussion Die Ergebnisse waren jedoch nicht zufriedenstellend, denn die drei Werte des Spearmans Korrelationskoeffizienten lagen zwischen 0,257 und 0,407 und somit alle in einem Bereich, der nur eine schwache bis mäßige Übereinstimmung zwischen den gewählten TIRADS-Kategorien der Untersucher aufzeigte [26]. In der vorliegenden Arbeit wurde die TIRADS-Klassifikation insgesamt durch drei sehr erfahrene Untersucher vorgenommen, wobei bei Uneinigkeit der Mehrheitskonsens entschied. Ein Vergleich zwischen den in der vorliegenden Arbeit ermittelten Malignitätswahrscheinlichkeiten und den von Horvath et al. angegebenen Wahrscheinlichkeiten zeigte, dass diese nur in zwei der sieben Kategorien miteinander übereinstimmten: in Kategorie 3 und 4b (s. Tabelle 1 und Tabelle 6). Ein Grund hierfür ist sicherlich die relativ kleine Fallzahl der vorliegenden Arbeit und dadurch mitbedingt, wurden zwei Kategorien keine einzige Läsion zugeordnet. Doch ungeachtet der kleinen Fallzahl, muss im klinischen Alltag für jede einzelne Läsion eine zuverlässige Einteilung zu einer Kategorie unter Angabe der Malignitätswahrscheinlichkeit gemacht werden können. Dies gelang für die vorliegende Arbeit mit Hilfe der TIRADS-Klassifikation nach Horvath et al. nicht. Eine auffällige Verteilung der Karzinome zu einer bestimmten Kategorie konnte in der vorliegenden Arbeit nicht beobachtet werden. Neben dieser TIRADS-Klassifikation gibt es jedoch noch weitere Klassifikationen, die in dieser Arbeit nicht berücksichtigt wurden [43, 60, 70]. Horvath et al. gründeten damals ihre Arbeit auf den etablierten Malignitätswahrscheinlichkeitsangaben ihres Vorbildes, dem Breast Imaging Reporting and Data System (BIRADS). Zukünftig muss evaluiert werden, ob diese Wahrscheinlichkeitswerte für die Schilddrüse adjustiert werden können bzw. müssen, ob es Vor- und Nachteile der einzelnen Klassifikationen gibt und vor allem, ob sie sich hinsichtlich ihrer diagnostischen Aussagekraft unterscheiden. Folgernd aus den Ergebnissen von Friedrich-Rust et al. muss nach einer Möglichkeit gesucht werden, die Interobserver-Variabilität für die TIRADS-Klassifizierung Zuordnungsalgorithmus im zu senken. Sinne eines Es wäre denkbar, Flussdiagramms, das einen einzelne Knotencharakteristika der Reihe nach abfragt, zu etablieren. In Bezug auf den Schwerpunkt dieser Arbeit, soll auf die Ergebnisse von Russ et al. eingegangen werden, die in ihrer Arbeit die von ihnen entwickelte TIRADSKlassifikation mit der semiquantitativen Kompressionselastografie an einem 64 Diskussion Toshiba Ultraschallgerät kombinierten. Sie erhielten eine sehr gute Sensitivität von 98,5% [71]. Für zukünftige Untersuchungen muss überlegt werden, ob die Aufnahme der Elastografie in die TIRADS-Klassifikation als zusätzliches Kriterium sinnvoll ist und so die statistischen Werte der TIRADS-Klassifikation verbessert werden können. Auch für den Gebrauch der Elastografie in der Evaluation von Schilddrüsenknoten als additionales Diagnostikum spricht sich die European Federation of Societies for Ultrasound in Medicine and Biology (EFSUMB) in ihrer aktuellen Leitlinie aus [19]. Eine Integration der Elastografie in die TIRADSKlassifikation scheint daher folgerichtig und praktikabel. 4.3 Geräteübergreifende Diskussionspunkte der Elastografie Während der Auswertung und Recherche für diese Arbeit, präsentierten sich mehrere Diskussionspunkte, die alle drei Ultraschallgeräte betreffen. Diese sind aufgrund der besseren Übersichtlichkeit in diesem Kapitel zusammengefasst und werden nicht für jedes Ultraschallgerät einzeln aufgeführt. 4.3.1 Schnittebene der elastografischen Untersuchung In diesem Kapitel soll kurz auf den Unterschied der elastografischen Untersuchung zwischen Quer- und Längsschnitt eingegangen werden. Vor allem in der Kompressionselastografie muss der verwendeten Schnittebene Beachtung geschenkt werden, da die Elastografie im Längsschnitt vermutlich bessere Ergebnisse als im Querschnitt erzielen kann. Diese These gründet sich auf Beobachtungen während der Datenerhebung für diese Arbeit und der Leitlinie der European Federation of Societies for Ultrasound in Medicine and Biology (EFSUMB): Im Längsschnitt treten erstens weniger Artefakte durch die A. carotis und die Trachea auf. Zweitens kann der Druck, da er im Längsschnitt parallel zu Trachea und Ösophagus, die als unterliegende Strukturen der Schilddrüse als Widerstand fungieren, aufgebracht wird, gleichmäßiger auf die Schilddrüse verteilt werden. Drittens nennt Elastografieuntersuchung die aktuelle Fehlerquellen, die Leitlinie sich der ohne EFSUMB weiteres auf zur die Schnittebene der Untersuchung übertragen lassen: ein im Verhältnis zum untersuchten Objekt zu kleiner Schallkopf oder umliegende Strukturen, die die 65 Diskussion Ausbreitung des Knotens bei Kompression und somit die gemessene Elastizität beeinflussen [4]. Erstaunlicherweise werden in den meisten Studien keine Angaben darüber gemacht, ob der Schallkopf für die Erhebung der Elastografiedaten im Quer- oder im Längsschnitt aufgesetzt wurde, was einen Vergleich der diagnostischen Werte erschwert, wenn nicht gar unsinnig macht. Auch liegt nach derzeitigem Wissensstand keine Studie vor, die diesen Unterschied in der Schnittebene explizit untersucht hätte. In der Erhebung am Hitachi Ultraschallgerät zeigte die qualitative Elastografie im Längsschnitt mit 83,3% eine höhere Sensitivität als im Querschnitt mit 66,7%. Dieser Wert war innerhalb der vorliegenden Arbeit der höchste Prozentwert für die Sensitivität. Die semiquantitative Elastografie wurde nur im Querschnitt erhoben, hätte aber auf obigen Argumenten gründend im Längsschnitt vermutlich noch bessere diagnostische Werte erzielen können. Die Auswertung am Toshiba Ultraschallgerät konnte diesen Zusammenhang nicht zeigen. Cakir et al. erhoben in ihrer Arbeit die Daten der semiquantitativen Elastogafie sowohl im Quer- als auch im Längsschnitt. Auch sie erhielten höhere diagnostische Werte für die Messungen im Längsschnitt und bestätigten somit das Ergebnis am Hitachi Ultraschallgerät [14]. Zukünftige Arbeiten müssen diese Fragestellung berücksichtigen, bzw. zumindest eine Angabe über die verwendete Schnittebene machen. Nur so wird ein guter und standardisierter Vergleich zwischen den Arbeiten möglich und zulässig. Anders muss in dieser Diskussion die Elastografieuntersuchung am Siemens Ultraschallgerät bewertet werden, da dieses eine andere Technologie für die Datenerhebung benutzt: Hitachi und Toshiba verwenden das Verfahren der Kompressionselastografie, die für eine gleichmäßige Druckverteilung in der Tiefe einen gleichförmigen Widerstand benötigt, wohingegen das Siemens Gerät sich der Scherwellentechnologie bedient. Hierbei werden die Geschwindigkeiten der vom Schallkopf ins Gewebe gebrachten Scherwellen gemessen und daher wird kein gleichförmiger Widerstand benötigt. Folglich ist ein Unterschied zwischen den beiden Schnittebenen aufgrund der Technologie bei diesem Gerät zunächst nicht zu erwarten. Widersprüchliche Aussagen fanden sich in der Arbeit von Calvete et al., die als einzige Angaben und Überlegungen zu den von ihnen gewählten Schnitt- 66 Diskussion ebenen am Siemens Ultraschallgerät machten: Das Elastogramm in der grafischen Darstellung der Scherwellenelastografie erhoben sie im Längsschnitt, um die Karotiden und die Trachea als Störfaktoren aus dem Bild auszuschließen, die Erhebung der numerischen Darstellung der Scherwellengeschwindigkeiten als absolute Zahlen führten sie dagegen anschließend im Querschnitt und im Längsschnitt durch und bildeten aus den Werten beider Schnittebenen den Mittelwert [15]. In der vorliegenden Arbeit lagen die Summen aus Sensitivitäten und Spezifitäten der Messreihe am Siemens Gerät sowohl in der grafischen als auch in der numerischen Darstellung der Scherwellenelastografie im Querschnitt (beides Mal eine Sensitivität von 66,7% und Spezifität von 68,1%) über denen des Längsschnitts (grafisch: 50,0% bzw. 70,2% und numerisch 50,0% bzw. 46,8%). Wodurch diese Diskrepanz entstand, konnte nicht abschließend geklärt werden. Denkbar wären neben einem tatsächlichen Unterschied der Schnittebenen, Messfehler oder Zufall, letztgenannter bedingt durch die relativ kleine Fallzahl. Abschließend bleibt festzuhalten, dass auch im Bereich der scherwellenbasierten Elastografie bzgl. der Schnittebene noch Uneinigkeit besteht. Nur durch die Angaben und Vergleiche zukünftiger Autoren kann Klarheit entstehen. 4.3.2 Einteilung der Elastografiescores Die Entscheidung, die qualitativen Elastogramme des Hitachi und Toshiba Ultraschallgerätes und die grafische Darstellung der Scherwellengeschwindigkeiten des Siemens Ultraschallgerätes in vier Gruppen einzuteilen, liegt in dem Umstand begründet, dass teilweise Daten, die am Hitachi Gerät erhoben wurden, in die Multicenterstudie der Universität Frankfurt einflossen und das Studienprotokoll dies dort so vorsah [8]. Für die anderen beiden Ultraschallgeräte wurde für einen geeigneten Vergleich die gleiche Einteilung gewählt. Die Einteilung der elastischeren Elastografiescores 1 und 2 als benigne Knoten und der härteren Elastografiescores 3 und 4 als maligne Knoten erfolgte auf Grundlage der Einteilung und Validierung in vorangegangenen Arbeiten. Zudem ermöglichte diese Einteilung einen guten Vergleich zwischen den Arbeiten [2, 3, 9, 28, 47, 69, 79, 87, 90]. Die Untersucher in dieser Studie fanden gewählte Einteilung in die vier Gruppen sehr übersichtlich und leicht verständlich, was eine schnelle Zuordnung ermöglichte 67 Diskussion und daher als Methode geeignet scheint, um zukünftig im klinischen Alltag gut und regelmäßig Anwendung zu finden. Es wurden jedoch auch Studien mit 3, 5 oder 6 unterschiedlichen Elastografiegruppen veröffentlicht [77]. Diesbezügliche fehlt eine Metaanalyse, die evaluiert, ob Arbeiten, die eine Einteilung der qualitativen Elastografie in mehr als vier Gruppen vornehmen, möglicherweise bessere diagnostische Werte erzielen können. Denkbar wäre, dass sie aufgrund von mehr Wahlmöglichkeiten eine genauere Einteilung der Knoten vornehmen können. 4.3.3 Knotengröße Eine Fragestellung, die im Rahmen der Elastografieuntersuchung auftaucht, ist die nach der für diese Untersuchung geeigneten Knotengröße. Da der Knotendurchmesser von einem Zentimeter häufig als Grenzwert für eine Szintigrafie der Schilddrüse angesehen wird und auch eine Punktionszytologie bei kleinen Knoten schwieriger als bei großen Knoten durchzuführen ist, scheiden diese beiden Verfahren bei kleinen Knoten als weiterführende diagnostische Maßnahme aus [50]. Die Bedeutung des Ultraschalls und der Elastografie als alternative diagnostische Option steigt. Dass sich die Elastografie sehr gut gerade für die Diagnostik kleiner Knoten eignet, stellten Ünlütürk et al. in ihrer Studie mit 237 Knoten fest: Sie zeigten eine inverse Korrelation zwischen Knotengröße und richtiger Elastografieklassifizierung, d.h. dass die kleinsten Knoten am besten zugeordnet wurden. Der kleinste Knoten in ihrer Arbeit maß 0,5 cm im maximalem Durchmesser [80]. Weiterhin gibt es Arbeiten, die sich speziell mit der elastografischen Untersuchung von Knoten, die kleiner als 10 mm sind, beschäftigen. Wang et al. publizierten eine Studie mit einer Population von 51 Knoten, die im maximalen Durchmesser kleiner als 10 mm waren, und fanden für die Kompressionselastografie basierend auf einer Einteilung in fünf Gruppen eine Sensitivität und Spezifität von 90,6% und 89,5%. Der kleinste Knoten in ihrer Studie wies 3 mm auf [82]. Eine weitere Arbeit in dieser Reihe ist die von Dighe et al.: Die Autoren ermittelten den semiquantitativen Schilddrüsensteifigkeitsindex in Knoten, die kleiner als ein Zentimeter waren, und erreichten eine Sensitivität von 100% und Spezifität von 60% [23]. Folglich kann die 68 Diskussion Elastografieuntersuchung auch für kleine Knoten mit guten Resultaten durchgeführt werden. Das kleinste Maß eines Knotens in dieser Arbeit betrug 6,9 mm. Ob ein Zusammenhang zwischen Knotengröße und richtiger Elastogafieeinteilung bestand, wurde in dieser Arbeit nicht untersucht. Aufgrund der Ergebnisse in der Differenzierung zwischen Knoten und Schilddrüsenparenchym in der farbigen Elastografiedarstellung, nämlich das die Elastografie in den meisten Fällen keine bessere Differenzierung zwischen Knoten und Schilddrüsenparenchym zuließ, muss über eine Knotenmindestgröße für eine Untersuchung mittels Kompressionselastografie diskutiert werden. Für Knoten, die diese Mindestgröße nicht erfüllen, wäre alternativ eine Untersuchung mittels der numerischen Darstellung der Scherwellenelastogafie denkbar. Diese Untersuchungsmethode hätte den Vorteil, dass sie als quantitative Methode die Scherwellengeschwindigkeit in einem kleinen Knoten exakt messen kann, aber der Untersucher aufgrund der geringen Knotengröße nur wenige der vom Gerät vorgegebenen ROIs von 0,5 cm x 0,5 cm setzen muss, um den kompletten Knoten abzudecken. 4.3.4 Metaanalysen Da bereits viele Arbeiten zur Kompressions- und Scherwellenelastografie erschienen sind, wächst die Bedeutung von Metaanalysen, die die Ergebnisse zusammenfassend beurteilen und dadurch eine gewisse Übersichtlichkeit gewähren. Inzwischen wurden bereits zwei Metaanalysen zum Nutzen der Elastografie veröffentlicht: Die erste, 2010 von Bojunga et al. veröffentlichte Arbeit mit acht Studien und insgesamt 639 Knoten, errechnete eine beachtliche Sensitivität und Spezifität von 92% bzw. 90%. In diese Analyse gingen ausschließlich Ergebnisse der Kompressionselastografie ein [10]. Eine zweite Metaanalyse mit dem Titel „Real-time Ultrasound Elastography for Differentiation of Benign and Malignant Thyroid Nodules“ wurde 2014 von Sun et al. publiziert, in welche die bemerkenswerte Anzahl von 31 Arbeiten mit 5481 Knoten einbezogen wurde. Der Titel dieser Arbeit ist jedoch nicht korrekt, da die Autoren mindestens zwei Arbeiten in ihre Berechnungen mit einbezogen, welche die 69 Diskussion Elastografie auf Basis der Scherwellentechnologie und nicht in „real time“ mittels Kompression untersuchten. Die Werte dieser Arbeiten führten sie zudem unter der Kategorie „qualitative Elastografie“ auf. Dies ist allerdings nicht die richtige Bezeichnung für die grafische Darstellung mittels Scherwellentechnologie, da das Siemens Ultraschallgerät die zugrunde liegenden Zahlenmesswerte der Scherwellengeschwindigkeiten misst und für die farbige Darstellung verwendet. Es werden folglich quantitative Ergebnisse, da durch die Scherwellentechnologie ermittelt, angezeigt. Lässt man diesen Diskussionspunkt außer Acht und präsentiert die diagnostischen Werte aus dieser Metaanalyse unter der von den Autoren gewählten Bezeichnung, zeigen sich Sensitivitäten und Spezifitäten von 79% und 77% für die qualitative Elastografie bzw. 85% und 80% für die semiquantitative Elastografie. Die semiquantitative Methode wies in ihrer Arbeit in der Summe demnach die höhere diagnostische Genauigkeit auf [77]. In der vorliegenden Arbeit lagen die Werte der qualitativen Elastografie zusammen mit denen der grafischen Darstellung der Scherwellenelastografie durchschnittlich noch weitere 10% unter den Ergebnissen der Metaanalyse von Sun et al., die Ergebnisse der semiquantitativen und der numerischen Darstellung der Scherwellenelastografie zwar auch unter den Ergebnissen der Metaanalyse, die Diskrepanz war jedoch kleiner. Ein Hinweis darauf, dass die semiquantitative und die numerische Darstellung der quantitativen Scherwellenelastografie weniger untersucherabhängig und reproduzierbarer sind. Im Vergleich der Studien von Bojunga et al. und Sun et al. bestätigte sich allerdings auch der Verdacht, dass sich die anfangs publizierten, extrem guten diagnostischen Werte für die Realtime-Elastografie von über 90% nicht auf größere Fallzahlen und inhomogenere Populationen übertragen lassen. Eine inzwischen schön häufig aufgezeigte Möglichkeit, die statistischen Werte der Elastografie zu erhöhen, zeigten unter anderem Trimboli et al. in ihrer MulticenterStudie, indem sie Malignitätskriterien der Elastografie mit Kriterien des herkömmlichen B-Bild-Ultraschallbildes kombinierten. Ihre Untersuchungs- durchführung, die Erhebung und Einteilung der Messwerte an einem Hitachi HI VISION Gerät entsprachen den Bedingungen dieser Arbeit und wären daher ohne Weiteres auf sie anwendbar. Trimboli et al. erhielten für die Elastografiescores 3 und 4 eine Sensitivität und Spezifität von 81% bzw. 62% und konnten die Sensitivität 70 Diskussion auf 97% erhöhen, indem sie einen Knoten als maligne klassifizierten, wenn dieser eines der folgenden Charakteristika aufwies: Hypoechogenität, Mikrokalzifizierungen, irreguläre Grenzen, intranoduläre Vaskularisation, TallerThan-Wide-Shape, Elastografiescore 3 oder 4. Sie schlugen vor, Knoten mit mindestens einem dieser Charakteristika zu punktieren [79]. Kwak et al. stellten in ihrem Bericht eine tabellarische Übersicht der Arbeiten vor, die sich in den letzten Jahren mit der Nützlichkeit von B-Mode-Ultraschall in Kombination mit Elastografie befassten: Sechs der neun dort aufgelisteten Arbeiten konnten durch eine Kombination der beiden Methoden ihre Sensitivität erhöhen. Die Sensitivitäten erlangten bei fünf dieser Arbeiten sogar Werte von mehr als 92%. Dieser Prozentsatz würde einen guten Suchtest mit der Aufgabenstellung, alle malignen Knoten zu erkennen, auszeichnen [44]. In diesem Zusammenhang sei auch noch einmal auf die Möglichkeit hingewiesen, die Elastografie zukünftig als festen Bestandteil in die TIRADS-Klassifikation mitaufzunehmen. 4.4 Vergleich der Arten der Elastografie Bei einem Vergleich der Elastografie zwischen den Geräten müssen die verschiedenen Aussagewerte der Geräte beachtet werden: die Interpretation eines Farbbildes, sowohl bei der qualitativen Kompressionselastografie (Hitachi, Toshiba) als auch bei der quantitativen Scherwellenelastografie (Siemens), die Erhebung eines Verhältniswertes von Schilddrüsengewebe zu Knotengewebe durch manuelle Kompression des Untersuchers, die semiquantitative Elastografie (Hitachi und Toshiba), und letztendlich die kompressionsfreie numerische Scherwellengeschwindigkeitsmessung, die quantitative Elastografie (Siemens). Zielsetzung dieser Arbeit war es, diese in ihrer Leistung und Untersucherfreundlichkeit zu untersuchen und miteinander zu vergleichen. Ein Vergleich zwischen Studien, die jeweils nur ein Gerät getestet haben, ist bei dieser Fragestellung nachteilig, da die Fallzahlen, Populationen und die Testdurchführung zwischen den Studien sehr unterschiedlich sein können. Daher muss als Stärke dieser Arbeit betont werden, dass die Knoten an allen drei Geräten untersucht wurden und somit ein unmittelbarer Vergleich der Geräte und Technologien ohne diese Störgrößen ermöglicht wird. 71 Diskussion Vorteile eines semi- bzw. quantitativen Verfahrens können eine bessere Reproduzierbarkeit und ein untersucherunabhängigeres Ergebnis sein. Bei einer Gegenüberstellung verschiedener Arbeiten zu Belastungs- (qualitativ), Belastungsverhältnis- (semiquantitativ) und Scherwellenelastografie (quantitativ) fanden Kwak et al. die höchste Reproduzierbarkeit bei den semiquantitativen und quantitativen Verfahren. Für die beiden letztgenannten wurden bisher jedoch keine Cut-off-Punkte etabliert und festgelegt, sodass der mögliche Vorteil der höheren Objektivität zum jetzigen Zeitpunkt hinten angestellt werden muss, da die erhobenen Zahlenwerte nicht eingeordnet und interpretiert werden können [44]. Nach derzeitigem Wissensstand gibt es keine Studie, welche die drei Ultraschallgeräte dieser Arbeit miteinander verglichen hat. Es existieren jedoch Arbeiten, die an jeweils einem der drei Geräte die zwei unterschiedlichen Elastografiemodalitäten untersucht haben und Arbeiten, die jeweils zwei der Geräte miteinander verglichen haben. Diese Arbeiten folgen in den letzten beiden Unterpunkten dieses Kapitels, zunächst erfolgt ein Vergleich der grafischen Interpretation der Kompressions- und Scherwellenelastografie, sowie ein Vergleich zwischen der semiquantitativen Kompressionselastografie und der numerischen Darstellung der Scherwellenelastografie. 4.4.1 Vergleich der grafischen Darstellung der Kompressions- und der Scherwellenelastografie Bei keinem der drei Ultraschallgeräte trug die Elastografie im Vergleich zum B-Bild zu einer besseren oder gleich guten Abgrenzbarkeit des Knotens vom umliegenden Schilddrüsenparenchym bei. Beim Hitachi Ultraschallgerät gelang dies mit 39,7% der Fälle noch am besten. Die Auflösung der Elastografie ist daher nicht so gut wie die Auflösung des B-Bildes und scheint auch zwischen den drei Ultraschallgeräten nicht gleich gut zu sein. Dies wirft zwangsläufig die Frage nach der Mindestgröße des Knotens für eine elastogafische Untersuchung auf und verdeutlicht die Wichtigkeit der bereits oben aufgeführten Diskussion. Durch dieses Ergebnis wird außerdem verdeutlicht, dass es für eine gute Untersuchung unerlässlich ist, das Elastogramm im sogenannten Split-ScreenModus neben dem herkömmlichen B-Bild darzustellen, damit der Untersucher für 72 Diskussion das exakte Setzen der ROIs im Elastogramm den genauen Verlauf der Knotengrenze nachvollziehen kann. Bei der Verteilung der Elastografiescores zeigte sich, dass bei allen drei Ultraschallgeräten die Wahrscheinlichkeit für eine maligne Läsion in der Gruppe, die das härteste Gewebe abbildete, am größten war. Die Wahrscheinlichkeit einer malignen Läsion in dieser Gruppe war beim Hitachi Ultraschallgerät mit 42,9% der Wahrscheinlichkeit des Siemens Ultraschallgerätes mit 40,0% sehr ähnlich, das Toshiba Gerät unterschied sich mit nur 22,2% Malignitätswahrscheinlichkeit für einen Knoten in dieser Gruppe deutlich von diesen beiden. Zwar zeigten die Ultraschallgeräte diese Diskrepanz in der Härtemessung dieser einzelnen Gruppe, fügte man jedoch für die Ermittlung von diagnostischen Werten die Gruppen mit Elastografiescore 3 und 4 zusammen, also die beiden Gruppen mit den am härtesten gemessenen Knoten, erhielt man interessanterweise für alle drei Ultraschallgeräte vergleichbare diagnostische Werte und der beobachtete Unterschied verkleinerte sich. In diesem Zusammenhang kann daher angenommen werden, dass die Einteilung der Elastografiescores 3 und 4 als maligne geräteübergreifend in etwa dieselben diagnostischen Werte liefert, auch wenn es Unterschiede zwischen den Messgenauigkeiten für einzelne Elastografiegruppen zwischen den Geräten zu geben scheint. Außerdem stellt sich ein Vergleich zwischen den Arbeiten an unterschiedlichen Ultraschallgeräten mit dieser Elastografiescoreeinteilung als legitim dar. 4.4.2 Vergleich der semiquantitativen Kompressionselastografie und der numerischen Darstellung der Scherwellenelastografie Die semiquantitative Kompressionselastografie am Hitachi und Toshiba Ultraschallgerät zeigte für den Einschluss aller Knoten ernüchternde Ergebnisse, da die gemessenen Strain-Ratio-Werte der benignen Knoten jeweils größer waren als die Werte der papillären Karzinome. Die benignen Knoten wurden folglich härter gemessen. Dies steht im Widerspruch zur aktuellen wissenschaftlichen Lehr- 73 Diskussion meinung, nach welcher die papillären Karzinome strukturell härtere Gewebeeigenschaften aufweisen als gutartige Knoten [4, 54]. Erst bei der Betrachtung der Subanalyse, in welche ausschließlich Strain-RatioWerte, die auf gleicher Höhe von Knoten und Schilddrüse erhoben wurden, einflossen, drehte sich das Größenverhältnis der Werte von benignen und malignen Knoten auf Seite des Hitachi Ultraschallgeräts um: Der Mittelwert der Strain-RatioWerte der benignen Knoten am Hitachi Ultraschallgerät betrug 2,5 und war somit kleiner als der Mittelwert der papillären Karzinome mit 4,1. Ableitend aus diesen Werten war das Gewebe der benignen Knoten elastischer einzustufen als das der malignen Knoten, was das bei dieser Untersuchung zu erwartende Ergebnis war. Diese Beobachtung zeigt deutlich, dass die Strain-Ratio-Werte stark von der gewählten Messtiefe abhängig sind und unterstreicht dabei die Bedeutung der ROIAuswahl für Knoten und Schilddrüse auf gleicher Höhe. Die Auswertung der Subanalyse am Toshiba Ultraschallgerät zeigte diese Umkehr des Größenverhältnisses von benignen und malignen Knoten nicht. Die Mittelwerte von benignen und malignen Knoten nahmen jedoch den gleichen Wert an, sie verschoben sich folglich in Richtung des erwarteten Verhältnisses. Dies bedeutete auf jeden Fall eine Verbesserung gegenüber den ersten Ergebnissen. Auch am Toshiba Ultraschallgerät wurde durch diese Ergebnisauswertung die Wichtigkeit einer Messung auf gleicher Höhe deutlich. Zusammenfassend lieferte das Hitachi Ultraschallgerät im direkten Vergleich der beiden Geräte die zufriedenstellenderen Ergebnisse. Bei der Messung der Scherwellengeschwindigkeit am Siemens Ultraschallgerät zeigten sich höhere mittlere Geschwindigkeiten für das papilläre Karzinom als für die benignen Knoten in den beiden Querschnittseinstellungen. Da Scherwellen sich schneller in festem als in lockerem Gewebe fortbewegen, stellten sich die papillären Karzinome in dieser Untersuchung folglich als härter und unelastischer als die benignen Knoten dar. Im Gegensatz zu den beiden anderen Ultraschallgeräten lieferte die Untersuchung am Siemens Gerät bereits für die Gesamtheit der Knoten und nicht erst für eine Subanalyse das zu erwartende Ergebnis. Der Hauptgrund hierfür ist höchstwahrscheinlich in der Abhängigkeit der am Hitachi und Toshiba Gerät erhobenen Strain-Ratio-Werte von der Messtiefe zu sehen: Unterschiede in der Messtiefe von Läsion und Schilddrüse führten hier zu falschen Ergebnissen. 74 Diskussion Nach Behebung dieser Störgröße konnten in dieser Arbeit die theoretisch überlegten Ergebnisse erzielt werden. Bei der Scherwellengeschwindigkeitsmessung des Siemens Gerätes werden dagegen keine Verhältnisse, sondern absolute Zahlen erfasst. Daher müssen keine zwei ROIs auf gleicher Höhe gesetzt werden. In Zusammenhang mit der gewählten Messtiefe soll an diesem Punkt auf das Ergebnis einer weiteren Studie dieser Arbeitsgruppe eingegangen werden: In dieser Studie konnte gezeigt werden, dass die Messungen der Scherwellen- geschwindigkeiten dennoch tiefenabhängig sind. So gab es einen signifikanten Unterschied zwischen den Messwerten der ventralen und der dorsalen Schilddrüsenhälfte [56]. Da in der vorliegenden Arbeit acht ROIs auf unterschiedlicher Höhe in der Läsion gesetzt wurden, ist jedoch davon auszugehen, dass die Unterschiede in der Messtiefe sich gegenseitig aufhoben und sich daher trotzdem das erwartete Ergebnis zeigte. Neben der gemessenen Scherwellengeschwindigkeit wird vom Siemens Ultraschallgerät auch die Messtiefe als Zahlenwert in cm angegeben. In der vorliegenden Arbeit wurde die Messtiefe bei der Erhebung am Siemens Gerät nicht berücksichtigt. Aufgrund der Ergebnisse der Arbeitsgruppe scheint dies jedoch zukünftig unabdingbar zu sein. Um eine gute Integration in den klinischen Alltag zu ermöglichen, muss die Frage nach einer direkten, geräteinternen Verrechnung der Messtiefe mit der Scherwellengeschwindigkeit gestellt werden. 4.4.3 Vergleich innerhalb der einzelnen Ultraschallgeräte 4.4.3.1 Vergleich der qualitativen und der semiquantitativen Kompressionselastografie am Hitachi Ultraschallgerät Insgesamt liegen sieben Arbeiten über einen Vergleich der qualitativen und semiquantitativen Elastografie an einem Hitachi Ultraschallgerät vor [13, 14, 41, 57, 66, 80, 87]. Diese sind in Tabelle 22 im Anhang aufgeführt. Aus folgenden Gründen wurde sich in der vorliegenden Arbeit dafür entschieden, die Werte für die semiquantitative Elastografie aus der Subanalyse mit Werten in gleicher Tiefe und nicht aus der ursprünglichen Erhebung mit den Mittelwerten zu berechnen. Erstens ist die Messung der Elastizität abhängig von der Messtiefe: 75 Diskussion Tiefer gelegenere Strukturen werden bei Kompression weniger stark belastet und verformt als oberflächlichere Strukturen, d.h. ein Vergleich zwischen der Härte von Strukturen ist nur in derselben Tiefe zu treffen, da dort die Gewebe die gleiche Belastung erfahren [4]. Zweitens erhoben viele Arbeiten, mit denen diese Studie verglichen werden soll, ihre Werte von Knoten und Schilddrüsenparenchym für die Berechnung der Strain-Ratio ebenfalls auf gleicher Höhe [57, 80, 87]. Als dritter Grund sind die im vorherigen Kapitel 4.4.2 aufgeführten Ergebnisse zu nennen. Leider gaben nicht alle Autoren ihre Messtiefe oder die Berücksichtigung dieser an, sodass ein standardisierter Vergleich zwischen den Arbeiten erschwert wurde [13]. Aus den Arbeiten von Refaat et al. war sogar ersichtlich, dass die Messungen nicht auf gleicher Höhe durchgeführt wurden [66]. In Tabelle 22 im Anhang ist daher jeweils die Angabe zur Messtiefe der einzelnen Arbeiten aufgeführt. Zudem wurden Strain-Ratio-Werte, die größer als 10 (n=8) waren, aus der Auswertung ausgeschlossen. Der Wert von 10 wurde basierend auf der Abbildung 19 im Ergebnisteil gewählt. Diese veranschaulicht, wie die Werte größer 10 aus der Anzahl der übrigen Strain-Ratio-Werte für Knoten ausreißen. In drei Studien fand sich eine Angabe, welche Bandbreiten die Strain-Ratio-Werte in den Messungen annahmen: Benigne Knoten lagen zwischen 0,3-54,5 und maligne Knoten zwischen 0,3-20,9 in der Arbeit von Ünlütürk et al., zwischen 0,39-151,0 lag die Gesamtheit der Knoten in der Arbeit von Cakir et al. und zwischen 0,4-5,4 befanden sich die benignen bzw. zwischen 1,47-3,61 die malignen Knoten in der Arbeit von Ciledag et al. [14, 18, 80]. Der Bereich, in dem Strain-Ratio-Werte aufgrund der physikalischen Gewebeeigenschaften von Knoten und Schilddrüse liegen sollten, muss diskutiert werden, denn ein Wert größer als 10 bedeutet, dass die Schilddrüse mehr als zehnmal so elastisch gemessen wurde als das Knotenparenchym [36]. Dies wirft die Frage nach der Validität der Messung auf. Da in der vorliegenden Arbeit jedoch nur jeweils eine Messung pro Knoten auf gleicher Höhe gemacht wurde, lässt sich diese Aussage nicht verifizieren. Andere Einflussgrößen, die eine hohe Strain-Ratio begünstigen könnten, wie die Pathologie des Knotens, zystische Knotenanteile, die Vaskularisation des Knotens, Mikro- und Makrokalzifizierungen, die TIRADSKlassifikation, die Lokalisation (rechter/ linker Schilddrüsenlappen, Isthmus), die Knotengröße, die Schilddrüsenhistopathologie und die unterschiedlichen 76 Diskussion Untersucher konnten in dieser Arbeit ausgeschlossen werden. Zukünftige Studien müssen der Frage nach einem gültigen Strain-Ratio-Bereich nachgehen. Beim unmittelbaren Vergleich der diagnostischen Werte dieser Arbeit lagen die Werte der semiquantitativen Elastografie insgesamt mit einer Sensitivität und Spezifität von 80,0% bzw. 72,2% über den Werten der qualitativen Elastografie mit einer Sensitivität von 66,7% im Querschnitt bzw. 83,3% im Längsschnitt und Spezifität von 48,5% im Quer- und 40,4% im Längsschnitt. Der ermittelte Cut-offPunkt von 2,97 für die semiquantitative Elastografie lieferte sogar einen signifikanten Unterschied zwischen den Gruppen der benignen und der malignen Knoten. Die Überlegenheit der semiquantitativen Elastografie zeigte sich bereits in der Mehrzahl der bisher publizierten Arbeiten [14, 41, 57, 87]. Die am besten mit dieser vergleichbare Arbeit, da sie die gleiche ElastografiescoreEinteilung vornahm, einen ähnlichen Cut-off-Punkt von 3,79 errechnete und die Messungen ebenfalls standardisiert in gleicher Tiefe durchgeführt wurden, wurde publiziert von Xing et al. mit 98 Knoten, von welchen 45 (45,6%) maligne waren. Xing et al. berechneten für beide Verfahren höhere diagnostische Werte als die vorliegende Arbeit (s. Tabelle 22 im Anhang). Diese sind zum einen erklärbar durch den Ausschluss von (teilweise) zystischen Knoten und Knoten mit verkalkter Schale, wodurch eine homogenere Untersuchungspopulation entstand. Zum anderen bedingt der wesentlich größere Anteil der malignen Knoten an der Gesamtknotenzahl eine höhere diagnostische Genauigkeit [6, 87]. Aktuelle Leitartikel zur Schilddrüsenelastografie schlagen aufgrund der Tatsache, dass Messungen durch entstehende Artefakte in zystischen und kalzifizierten Knoten fehlerhaft sein können, vor, diese von einer elastografischen Untersuchung auszunehmen [17, 44]. Eine verkalkte Schale war ein Ausschlusskriterium der vorliegenden Arbeit, jedoch wurde ein wenn auch meist kleiner zystischer Anteil bei mehr als 64% aller Knoten und speziell in 50% der papillären Karzinome beobachtet. Letztere wiesen allerdings durchgehend nur einen kleinen zystischen Anteil von ca. 5% auf. Einen größeren zystischen Anteil in Schilddrüsenkarzinomen fanden Henrichsen et al. in ihrer Arbeit mit 360 Schilddrüsenkarzinomen. Sie kamen zu dem Ergebnis, dass in 11,7% der Karzinome der zystische Anteil mehr als 5% betrug [35]. 77 Diskussion Die sich anschließende Frage ist, wieviel zystischen Knotenanteil man für eine elastografische Untersuchung zu Lasten der diagnostischen Genauigkeit tolerieren kann. Doch unabhängig davon bei welchem Anteil man eine Grenze zieht, für einen Teil der malignen Knoten wird die Elastografie als zusätzliche Untersuchungsoption ausfallen. Als weiterführende Diagnostik kommen dann invasiven Methoden, wie die Feinnadelpunktion oder die operative Entfernung der Läsion, in Frage. Folgt man den Leitartikeln und schließt nur Knoten ohne zystische Veränderung in elastografische Untersuchungen ein, muss evaluiert werden, ob sich weitere Geldund Zeitinvestitionen in diese Technik lohnen, da die Gruppe der Menschen, die davon profitieren kann, eventuell zu klein wird. Ein Vorteil der vorliegenden Studie gegenüber der von Xing et al. war, dass die Population, für die eine elastografische Untersuchung generell in Betracht kommt nämlich alle Menschen mit einem Schilddrüsenknoten - besser abgebildet und erfasst wurde, da sie näher an der tatsächlichen Prävalenz von 4,0-6,5% von Schilddrüsenkrebs an der Gesamtzahl der Schilddrüsenknoten in der Bevölkerung lag und zudem Knoten mit zystischem Anteil nicht von vorneherein ausgeschlossen wurden [64]. In diesem Punkt besser mit der vorliegenden Arbeit vergleichbar war die Arbeit von Cakal et al., die von 601 Knoten in Knotenstrumen keine Knoten im Vorfeld ausschloss und einen die tatsächliche Prävalenz abbildenden Anteil von 4,8% malignen Knoten hatte. Cakal et al. erhielten für beide elastografischen Verfahren beachtliche diagnostische und wesentlich höhere Werte als die vorliegende Arbeit (vgl. Tabelle 22). Die semiquantitative Elastografie zeigte sich der qualitativen Elastografie leicht überlegen und die Autoren schlugen diese als zukünftiges diagnostisches Tool vor. Jedoch äußerten sie auch, dass mit Hilfe der Scherwellentechnologie vermutlich noch bessere Resultate erzielt werden könnten, da sie weniger untersucherabhängig sei. Cakal et al. machten keine Angabe zur Schnittebene [13]. Für das oft hervorgebrachte Argument die Elastografie sei nicht reproduzierbar, entwickelte die Firma Hitachi eine Lösung: Sie integrierte eine Druckmessung im Sinne einer numerischen Skala, auf welcher der Untersucher in Echtzeit seinen aufgebrachten Druck überprüfen und gegebenenfalls anpassen kann. Dem Untersucher wird so zum einen eine größere Sicherheit während der Untersuchung 78 Diskussion gegeben und zum andern sind die Ergebnisse zwischen Untersuchungen besser vergleichbar. Bei einem Vergleich der bisher publizierten Arbeiten fiel auf, dass nicht alle Autoren eine Angabe über den von ihnen gewählten Druck machten. Dies erschwerte wie gesagt einen Vergleich zwischen den Studien und sollte zukünftig standardisiert werden. Der berechnete Cut-off-Punkt der Strain-Ratio in der vorliegenden Arbeit betrug 2,97 und befand sich somit im Bereich der bisher publizierten Werte von 2,1 bis 16,7. Die obere Grenze stellt vermutlich einen Ausreißer dar, da die Werte der übrigen fünf Arbeiten inklusive der vorliegenden Arbeit zwischen einer relativ kleinen Spannbreite von 2,1 und 3,79 lagen [13, 14, 66, 80, 87]. Der von Ning et al. berechnete Cut-off-Punkt von 4,225 fiel aus der Betrachtung raus, da die Autoren die Berechnung der Strain-Ratio als Verhältnis von Knoten zu Parenchym und nicht wie sonst üblich als das Verhältnis von Parenchym zu Knoten angaben [57]. Auch hier muss zukünftig eine einheitliche Definition erfolgen. Weitere Fallzahlen sowie eine Metaanalyse könnten helfen, den Bereich der Strain-Ratio weiter einzugrenzen. Außerdem ist mit Spannung das Ergebnis der großen MulticenterStudie zur Leistung der qualitativen und semiquantitativen Elastografie des Hitachi Ultraschallgerätes unter der Leitung der Goethe-Universität in Frankfurt am Main zu erwarten, zu welcher im Rahmen der vorliegenden Studie Daten von 45 Patienten beigetragen werden konnten. 4.4.3.2 Vergleich der qualitativen und semiquantitativen Kompressionselastografie am Toshiba Ultraschallgerät Mit einem Vergleich zwischen qualitativer und semiquantitativer Elastografie an einem Toshiba Ultraschallgerät befassten sich bisher deutlich weniger Studien mit einer insgesamt geringeren Knotenanzahl als das für ein Hitachi Ultraschallgerät der Fall war. Dies ist wichtig im Hinblick auf die Reliabilität mit der die Ergebnisse miteinander verglichen werden. Für einen Vergleich liegen drei Arbeiten, wie in Tabelle 23 im Anhang gezeigt, vor [3, 18, 81]. Beim Vergleich der qualitativen und der semiquantitativen Elastografie wurde sich in der vorliegenden Arbeit aus denselben Gründen wie beim Hitachi Ultraschallgerät für die Subanalyse mit den Messungen der Strain-Ratios aus Werten, die auf gleicher Höhe lagen, entschieden. Im Gegensatz zu den Arbeiten am Hitachi 79 Diskussion Ultraschallsystem, gaben beim Toshiba Gerät alle Autoren an, dass die ROIs für die Berechnung der Strain-Ratio auf gleicher Höhe gewählt wurden. Dies ermöglichte einen guten Vergleich der Arbeiten. Entgegengesetzt zu den Ergebnissen am Hitachi Ultraschallgerät lagen die diagnostischen Werte der qualitativen Elastografie beim Toshiba Gerät über den Werten der semiquantitativen Elastografie. Diese waren im Gegensatz zum Hitachi Gerät jedoch eher ernüchternd und zeigten wie bereits erwähnt keinen wesentlichen Unterschied zwischen Quer- und Längsschnitt. Für einen Vergleich mit der Arbeit von Ciledag et al. wurden in der vorliegenden Arbeit nachträglich die diagnostischen Werte für erstgenannte berechnet: Die qualitative Elastografie wies die diagnostisch höhere Sensitivität und Spezifität als die semiquantitative Elastografie auf (vgl. Tabelle 23 im Anhang). Insgesamt zeigten beide Elastografiearten in der Arbeit von Ciledag et al. wesentlich höhere Werte als die vorliegende Arbeit. Dabei zu beachten ist, dass die Autoren bei der semiquantitativen Elastografie das Verhältnis von Knoten zu Muskelgewebe und nicht von Knoten zu Schilddrüsengewebe maßen [18]. Im Gegensatz zu der Arbeit von Ciledag et al. und der vorliegenden Arbeit berechneten die beiden anderen Arbeiten von Aydin et al. und Wang et al. die diagnostische Wertigkeit für den Bereich der semiquantitativen Elastografie höher [3, 81]. Interessanterweise maßen Aydin et al. zum einen das Verhältnis zwischen Schilddrüsenparenchym und Knoten (PNSR) und zum anderen das Verhältnis zwischen Muskelgewebe und Knoten (MNSR). Sie fanden einen к-Wert von 0,87, was bedeutete, dass es eine fast vollständige Übereinstimmung zwischen diesen beiden Methoden hinsichtlich ihrer Testgenauigkeit gab [3]. Klinisch relevant ist dieses Ergebnis, da es im Rahmen von Erkrankungen Schilddrüsen mit strukturellen Veränderungen gibt, die die herkömmliche Messung von Knoten und Schilddrüsenparenchym schwierig bzw. unmöglich machen: Denkbar wären beispielsweise ein das umgebende Schilddrüsenparenchym verdrängender Knoten oder ein durch eine Thyreoiditis geschädigtes Schilddrüsenparenchym. Bisher veranlassten diese Veränderungen einige Autoren zu der Aussage, dass die semiquantitative Elastografie in dem Moment wertlos sei, in dem kein gesundes Schilddrüsenparenchym für einen Vergleich mehr zur Verfügung stehe [6, 54]. Als Antwort wäre für diese Fälle folglich eine Modifikation der Mes- 80 Diskussion sung, ein Vergleich von Knoten zu Muskelgewebe, denkbar. Voraussetzung wäre, dass die Patienten nicht an einer Erkrankung des Skelettmuskelgewebes leiden. Die Verhältniswerte von Muskel- zu Knotengewebe scheinen kleiner zu sein als die von Schilddrüsenparenchym zu Knotengewebe, Aydin et al. fanden den Verhältniswert von 1,85 und Ciledag et al. den Wert von 2,31 als besten Cut-offPunkt für diese Strain-Ratio zur Unterscheidung zwischen benignen und malignen Knoten. Kagoya et al., die diesen Vergleich an einem Hitachi Ultraschallgerät durchführten, fanden den optimalen Cut-off-Punkt bei 1,5, der auch unter den für das Hitachi Gerät ermittelten Cut-off-Punkten für den Vergleich zwischen Schilddrüsengewebe und Knoten lag [41]. Beim Vergleich der berechneten Cut-off-Punkte für die Strain-Ratios von Knoten und Schilddrüsenparenchym am Toshiba Gerät zeigte sich, dass die Werte sich nah beieinander und inklusive der vorliegenden Arbeit im Bereich von 2,48 und 3,85 befanden. Der dem wahren Wert vermutlich am nächsten liegende Wert von 3,14, wurde von Aydin et al. publiziert. Aydin et al. führten zum einen sehr standardisierte Messungen durch und erhielten zum anderen sehr hohe diagnostische Sensitivitäten und Spezifitäten für diesen Cut-off-Wert [3, 81]. Für eine bessere Reproduzierbarkeit der Messungen findet sich am Toshiba Ultraschallgerät die Darstellung eines Zeit-Druck-Kurvenverlaufs, die dem Untersucher die Option bietet, die Messungen auf gleicher Höhe der Kurve und somit mit ähnlichem Druck durchzuführen. Abschließend bleibt für den Vergleich der qualitativen und der semiquantitativen Elastografie an einem Hitachi bzw. einem Toshiba Ultraschallgerät zusammenfassend zu sagen, dass die qualitative Elastografie einfacher und schneller in eine Ultraschalluntersuchung integrierbar ist als die semiquantitative Elastografie, bei welcher für eine Messung zunächst vom Untersucher ROIs festgelegt werden müssen und die Messungen für eine Validierung eventuell wiederholt werden müssen. Zudem ist eine Bewertung des erhobenen Messwertes zum gegenwärtigen Zeitpunkt aufgrund fehlender Normwerte schwer praktikabel und es bleibt fraglich, ob diese Normwerte innerhalb der nächsten Jahre so genau festgesetzt werden können, dass es für eine zuverlässige Unterscheidung zwischen benignen und malignen Knoten reicht. Schneller und einfacher könnte wahrscheinlich ein Intervall für einen kritischen Übergangsbereich bestimmt 81 Diskussion werden: Werte unterhalb dieses Bereiches sprechen für Gutartigkeit, Werte oberhalb dieses Bereichs sprechen für Bösartigkeit und Knoten mit Werten innerhalb dieses Intervalls müssen verlaufskontrolliert und gegebenenfalls punktiert oder operiert werden. Erschwert wird der Findungsprozess des passenden Cut-off-Punktes durch eine bisher fehlende Standardisierung der elastografischen Untersuchung, die einen Vergleich der Studien und ihrer Messwerte quasi nicht zulässt. Für eine Standardisierung sind folgende Messangaben unerlässlich und sollten in der Datenerhebung künftiger Studien an Hitachi und Toshiba Ultraschallgeräten beachtet werden: 1. Schnittebene der Bildgebung (Längs- oder Querschnitt) 2. Druckintensität (numerische Skala (Hitachi), Zeit-Druck-Kurve (Toshiba)) 3. Tiefe, in der die Messwerte erhoben werden (bestenfalls in gleicher Tiefe) Auch wenn die semiquantitative Elastografie die höheren diagnostischen Werte aufwies, ist zum jetzigen Zeitpunkt für den klinischen Alltag der größere Nutzen in der qualitativen Elastografie aufgrund der oben aufgeführten Gründe zu sehen. 4.4.3.3 Vergleich der grafischen und numerischen Darstellung der Scherwellenelastografie am Siemens Ultraschallgerät 4.4.3.3.1 Vergleich der diagnostischen Performance der grafischen und numerischen Darstellung Bisher gibt es keine Veröffentlichungen von Arbeiten, die sich mit der Elastografiedarstellung von Schilddrüsenknoten mittels des Programms Virtual Touch™ IQ (VTIQ) des Siemens Acuson S3000 Ultraschallgerät befasst haben. Daher beschäftigt sich der erste Teil dieses Kapitel mit einem Vergleich von Arbeiten, die mit den Vorgänger-Programmen gearbeitet haben, und der zweite Teil dieses Kapitels mit einer Arbeit, die das Programm Virtual Touch™ IQ für die Untersuchung von Brustknoten verwendet hat. Vier Arbeiten mit dem Vergleich der Vorgängerprogramme Virtual Touch™ Imaging (VTI) und Virtual Touch™ Quantification (VTQ) am Siemens Acuson S2000, die in der nächsten Generation im Siemens Acuson S3000 zum Programm Virtual Touch™ IQ zusammengefasst wurden, wurden publiziert [15, 46, 88, 90]. Diese sind in Tabelle 24 im Anhang aufgeführt. In dieser Arbeit wird die Farbklassifikation des 82 Diskussion Programms Virtual Touch™ IQ als grafische Darstellung der quantitativen Elastografie bezeichnet. Einige Autoren publizierten diese Methode als qualitative Darstellung der Scherwellenelastografie [15, 31, 38]. Diese Bezeichnung ist sicherlich nicht ganz exakt, da auch die Farbgebung des Elastogramms nicht durch manuelle Kompression wie bei Hitachi und Toshiba, sondern mittels Scherwellen generiert wird und somit nicht als rein qualitatives Verfahren zu werten ist. Die Bezeichnung „qualitativ“ in diesem Kontext bleibt also diskussionswürdig. Die Messung der Scherwellengeschwindigkeit wird als numerische Angabe der quantitativen Methode bezeichnet, da hier absolute Zahlenwerte vom Gerät gemessen und angegeben werden und durch diese zusätzliche Bezeichnung eine deutlichere Abgrenzung zwischen den beiden Anteilen der Scherwellenelastografie erfolgt. Im Vergleich der grafischen und der numerischen Aussage des Programms fanden sich in dieser Arbeit für den Querschnitt interessanterweise die gleichen diagnostischen Werte für beide Methoden. In den Arbeiten von Calvete et al., Liang et al., Xu et al. und Zhang et al. lieferte die grafische VTI jeweils die höheren diagnostischen Werte [15, 46, 88, 90]. Zu beachten in der Arbeit von Calvete et al. war, dass die Autoren zwei unterschiedliche Cut-off-Punkte wählten: Für den Cutoff-Punkt von 2,5 m/s erhielten sie für die VTQ minimal höhere diagnostische Werte als für die VTI. Dass die VTI in der überwiegenden Anzahl der Fälle die besseren diagnostischen Werte liefert, ist nicht verwunderlich, da die für die Messung der Scherwellengeschwindigkeiten gesetzten ROIs bereits vom Programm VTQ in den Maßen 0,5 mm x 0,5 mm unveränderlich fest eingestellt sind und so, mit Zunahme der Knotengröße, ein immer kleiner werdender Anteil des Knotens repräsentiert und gemessen wird. Im Gegensatz dazu bildet die grafische Elastografie in der Bildgebung den ganzen Knoten ab. Zwar versuchen alle fünf Arbeiten inklusive der vorliegenden durch das Setzen mehrerer ROIs innerhalb des Knotens diesen in seiner Gesamtheit besser abzubilden und dadurch die Genauigkeit der Messung zu erhöhen, doch scheint dies nur mäßig erfolgreich gewesen zu sein, da diese Methode hinsichtlich der diagnostischen Werte unterlegen blieb. Zhang et al. beschrieben in ihrer Arbeit sehr anschaulich, wie die Bandbreite der Messwerte mit zunehmender Knotengröße immer größer wurde und sie große Knoten in kleinere 83 Diskussion Flächen unterteilten, um diese dann einzeln zu messen und so den Knoten in seiner Gesamtheit besser zu erfassen [90]. Eine weitere Arbeit, die zwar keinen Vergleich der beiden Programme VTI und VTQ durchführte, sondern die Interobserver-Übereinstimmung des Programms VTQ bei der Untersuchung von Schilddrüsenknoten prüfte, wurde publiziert von Grazhdani et al. Zwei Untersucher wählten jeweils unabhängig voneinander fünf ROIs pro Knoten aus, aus welchen der Mittelwert für den Vergleich erhoben wurde. Cohens Kappa für die Interobserver-Übereinstimmung wies einen Wert von к=0,755 auf [31]. Ein Wert, der zwar eine beachtliche Übereinstimmung der Ergebnisse der beiden Untersucher anzeigte, jedoch dafür dass es sich um eine rein quantitative - bis auf das subjektive Setzen der ROIs - Untersuchung handelt, unerwartet niedrig war. Das Setzen mehrerer ROIs konnte bzw. kann dieser Subjektivität wohl entgegenwirken, wohl aber nicht in ausreichender Weise. Dieses Ergebnis verdeutlicht, wie untersucherabhängig dieses vermeintlich „objektivere“ Untersuchungsverfahren trotzdem ist. Ein weiterer Einflussfaktor, der in dieser Arbeitsgruppe zur Generierung von Normwerten mittels ARFI-VTIQ für unterschiedliche Organe von Neuwirt et al. für das gesunde Schilddrüsengewebe gezeigt werde konnte, ist, dass sich die Messwerte je nach Messtiefe unterscheiden: Die Scherwellengeschwindigkeiten, die in der ventralen Schilddrüsenhälfte gemessen wurden, waren signifikant größer als die Scherwellengeschwindigkeiten der dorsal gelegenen Hälfte [56]. Übertragen auf die Messungen von Geschwindigkeiten an Schilddrüsenknoten bedeutet dies, dass die Cut-off-Punkte in Abhängigkeit von der Messtiefe betrachtet werden müssen, da diese offensichtlich ein Störfaktor ist. Bisher wurde in den veröffentlichten Arbeiten dieser Umstand nicht berücksichtigt, was eine weitere Erklärung für die schlechteren Ergebnisse der numerischen Elastografie sein könnte [15, 46, 88, 90]. Alle vier publizierten Arbeiten wiesen in den beiden Untersuchungsmethoden VTI und VTQ höhere diagnostische Werte als die vorliegende Arbeit auf. Zur Qualitätssicherung wurden in der vorliegenden Arbeit zum einen für jedes erhobene Elastogramm die geräteinterne Qualitätsüberprüfung durchgeführt und nur die Elastogramme akzeptiert, bei welchen mindestens 95% der Fläche als „gute Qualität“ erkannt wurden, zum anderen wurden für jeden Knoten acht 84 Diskussion Scherwellengeschwindigkeitsmessungen vorgenommen, sodass ein repräsentativer Mittelwert gebildet werden konnte. Zhang et al. führten für ihre größeren Knoten ebenfalls acht Messungen durch, schlossen von vornherein allerdings alle Knoten, die größer als 2 cm waren oder mehr als 20% zystischen Inhalt hatten, aus [90]. Ähnlich verfuhren Liang et al., die nur Knoten in ihre Studie mitaufnahmen, deren solider Anteil größer als 75% war [46]. So entstanden in beiden Arbeiten homogenere Gruppen als das in der vorliegenden Arbeit der Fall war und könnte die höhere Sensitivität und Spezifität erklären. Calvete et al. wiesen zwar eine größere Fallzahl auf als die vorliegende Arbeit, führten jedoch nur eine Messung pro Knoten und Schnittebene in der VTQ, von einem einzigen Untersucher ausgewählt, durch. Diese Verfahrensweise erscheint aufgrund des einzelnen Untersuchers sehr subjektiv und begünstigt durch eine homogenere Auswahl der ROIs auf diese Weise höhere diagnostische Werte. Die Arbeit von Xu et al. wies mit 441 Knoten die größte Fallzahl der Vergleichsarbeiten auf. Es erfolgte kein Ausschluss von Knoten aufgrund ihrer Morphologie, jedoch wurden die ROIs im Programm VTQ von den Untersuchern nicht zufällig wie in der vorliegenden Arbeit in der Läsion platziert, sondern es wurden gezielt zystische oder kalzifizierte Knotenanteile ausgespart. Xu et al. führten sieben Messungen pro Knoten durch, von denen sie jeweils den niedrigsten und höchsten Wert ausschlossen. Dagegen gingen in der vorliegenden Arbeit alle Messwerte ohne Ausschluss in die Berechnung mit ein. Durch diese beiden Anwendungsverfahren erhielten Xu et al. ein homogeneres Kollektiv für die Auswertung des Programms VTQ. Für die Klassifikation der grafischen Scherwellenelastografie der Knoten mittels des Programms VTI wählten Xu et al. die Einteilung in sechs Elastografiescores. Durch diese Einteilung wurden mehr Möglichkeiten der Elastogrammzusammensetzung abgebildet und die Knoten konnten differenzierter zugeordnet werden. Wie bereits im Kapitel 4.3.2 in der Diskussion zur Elastografiescore-Einteilung aufgeführt, werden so womöglich höhere diagnostische Werte bedingt, auf der anderen Seite entsteht für den Untersucher ein höherer Zeitaufwand, da mehr Optionen von ihm in Betracht gezogen werden müssen. Bei einem Vergleich der publizierten Cut-off-Punkte für die Scherwellengeschwindigkeit von benignen und malignen Knoten fand sich, dass die Werte von Xu et al. von 2,87 m/s und Zhang et al. von 2,90 m/s dem in der 85 Diskussion vorliegenden Arbeit im Längsschnitt berechneten von Wert von 2,90 m/s entsprachen. Die Autoren machten jedoch keine validen Angaben zu den von ihnen gewählten Schnittebenen [88, 90]. Calvete et al. berechneten für ihre Erhebung im Längsschnitt einen Cut-off-Punkt von 2,5 m/s [15]. Liang et al. wählten in der Angabe der Cut-off-Punkte eine andere Vorgehensweise: Sie berechneten einen Cut-off-Punkt für benigne Knoten (2,01 m/s) und einen für maligne Knoten (3,65 m/s): Knoten mit benigner Histologie und unter 2,01 m/s wurden als richtig negativ, benigne Knoten über 3,65 m/s als falsch positiv gewertet. Knoten mit maligner Histologie und kleiner 2,01 m/s wurden als falsch negativ angesehen [46]. Diese Vorgehensweise scheint in der klinischen Praxis nicht umsetzbar zu sein, da der Untersucher in der Regel zum Zeitpunkt der elastografischen Untersuchung die Dignität des Knotens nicht kennt und daher nicht weiß, welchen Grenzwert er für die Unterscheidung anwenden soll. In der Zusammenschau ist zum jetzigen Zeitpunkt aus folgenden Gründen der größere klinische Nutzen in der grafischen Darstellung der Scherwellenelastografie zu sehen: Die Messungen der numerischen Elastografie sind durch das Setzen mehrere ROIs zeitintensiv und daher schlecht in den klinischen Alltag integrierbar. Die Beurteilung der grafischen Darstellung benötigt dagegen nur die Erhebung eines einzelnen Elastogramms. Das Problem des hohen Zeitaufwandes der numerischen Elastografie wäre zukünftig zum einen dadurch zu lösen, dass nur kleine Knoten, die eine Fläche von beispielsweise einem Quadratzentimeter nicht überschreiten und daher mit drei bis vier ROIs vollständig abgebildet werden könnten, mittels der numerischen Scherwellenmessungen evaluiert werden. Dass kleine Knoten mindestens genauso häufig wie große Knoten Malignität aufweisen, wurde bereits im Kapitel 4.2.1.2 der vorliegenden Arbeit diskutiert und lässt die Überlegung, die kleinen Knoten mittels der numerischen Scherwellenelastografie zu untersuchen, lohnenswert erscheinen. Zum anderen wäre denkbar, dass in der nächsten Generation der Siemens Ultraschallgeräte das Programm VTIQ dahingehend weiterentwickelt würde, dass die Größe der ROI an die Knotengröße manuell adjustiert werden könnte. Auch dort könnten dann vom Gerät innerhalb dieser ROI mehrere Messungen durchgeführt und ein Mittelwert gebildet werden, aber der Untersucher wäre durch das Setzen von nur einer ROI zeitlich entlastet und zusätzlich würde die Objektivität der 86 Diskussion Messung steigen, da die subjektive Auswahl der ROIs durch den Untersucher wegfallen würde. Des Weiteren muss der Aspekt beachtet werden, dass die Messungen der Scherwellen tiefenabhängig sind. Dies muss zukünftig entweder durch den Untersucher in der Betrachtung von Cut-off-Punkten getrennt für ventrale und dorsale Messungen Berücksichtigung finden - was die Untersuchung verkomplizieren würde - oder wiederum durch den Ultraschallhersteller in einer Weiterentwicklung des Programms bedacht werden. Als letzter und sehr wichtiger Punkt muss als weiterer Nachteil des Programms VTQ aufgeführt werden, dass zum jetzigen Zeitpunkt keine Cut-off-Werte der Scherwellengeschwindigkeiten zur Differenzierung benigner von malignen Knoten etabliert sind, sodass dem Untersucher derzeit keine valide Einordnung seiner Messergebnisse möglich ist. Der zweite Teil dieses Kapitels beschäftigt sich abschließend noch mit einer Arbeit von Ianculescu et al., die 110 Brustknoten sowohl mit der grafischen als auch mit der numerischen Elastografiekomponente des Programms Virtual Touch™ IQ untersuchten [38]. Knoten in Brust- und in Schilddrüsengewebe weisen viele Gemeinsamkeiten, wie beispielsweise die Verhärtung des Knotengewebes im Vergleich zum umgebenden Gewebe und die oberflächliche und damit gut zugängliche Lage, auf [49, 89]. Auch wurden bereits Klassifikationen für die Schilddrüse aus dem Bereich der Brustdrüse übernommen: So leitete sich die TIRADS-Klassifikation beispielsweise von der BIRADS-Klassifikation (Breast Imaging Reporting and Data System) ab und die Farbklassifikation des Elastogramms für die Schilddrüse ging in einigen Arbeiten auf die Klassifikationen von Ueno et al., die diese ursprünglich für Brustknoten entwickelt hatten, zurück [30, 37, 65, 70, 82]. Daher erscheint die Betrachtung und Diskussion der Arbeit von Ianculescu et al. an dieser Stelle als angebracht und sinnvoll: Die Autoren gaben für die grafische Darstellung der Scherwellenelastografie eine Sensitivität und Spezifität von 92% bzw. 64,6% und für die numerische Darstellung bei einem Cut-off-Punkt von 3,31 m/s eine Sensitivität und Spezifität von 80,4% bzw. 73% an. Allerdings strebten sie weniger einen direkten Vergleich der beiden Komponenten an, als dass sie den möglichen zusätzlichen diagnostischen Nutzen der Scherwellentechnologie zur BIRADS-Klassifikation feststellen wollten. Tatsächlich konnten sie durch eine Anwendung des Schwellenwertes von 3,31 m/s auf alle Knoten, die zuvor in die BIRADS-Kategorie 87 Diskussion 4a eingestuft worden waren, die Sensitivität auf 92% erhöhen, die Spezifität blieb mit 72,9% in etwa konstant [38]. Zwei Aussagen sind in Zusammenhang mit dieser Arbeit wichtig: Zum einen zeigten Ianculescu et al., dass die grafische Darstellung des Programms VTIQ besser zwischen gut- und bösartigen Knoten unterscheiden konnte als die numerische Darstellung. Dies hatten auch Calvete et al. und Zhang et al. bei der Untersuchung mit den Vorgängerprogrammen festgestellt. Zum anderen verstanden Ianculescu et al. die Elastografie weniger als isoliert anzuwendende Untersuchungsmethode, sondern unterstrichen den Nutzen der Elastografie für die Kombination mit anderen diagnostischen Methoden bzw. für eine vorausgewählte und dadurch homogenere Population (Analyse der Knoten in BIRADS-Kategorie 4a). Analog zur letztgenannten Vorgehensweise könnte bei den Schilddrüsenknoten eine Vorauswahl mittels der TIRADS-Klassifikation erfolgen. 4.4.3.3.2 Vergleich der unterschiedlichen Skaleneinstellungen Am Kapitelende der Scherwellenelastografie des Siemens Ultraschallgerätes sollen die verwendeten, unterschiedlichen Skaleneinstellungen diskutiert werden. Aufgrund fehlender Erfahrungswerte seitens des Geräteherstellers und der klinischen Praxis wurden die Messwerte für die Skaleneinstellung von 0,5-3,0 m/s, 0,5-6,5 m/s, 0,5-9,0 m/s im Querschnitt und 0,5-6,5 m/s im Längsschnitt erhoben [84]. Liegt eine gemessene Scherwellengeschwindigkeit außerhalb dieses Bereiches wird der Wert mit Vs=HOCH bzw. Vs=TIEF und in der Farbgebung mit dunkelrot präsentiert [73]. Der Vorteil eines kleineren Skalenintervalls ist eine bessere Farbdifferenzierung zwischen sich gering unterscheidenden Geschwindigkeiten. Der Nachteil ist, dass Messgeschwindigkeiten, die außerhalb des Wertebereichs der Skala liegen, nicht erfasst werden können. Andersherum werden bei einem großen Skalenintervall alle Geschwindigkeiten erfasst, die optische Unterscheidung zwischen kleinen Geschwindigkeitsunterschieden aber erschwert. Die Arbeit von Monpeyssen et al. griff bisher als einzige die Frage nach der korrekten Skaleneinstellung für eine Scherwellenuntersuchung der Schilddrüse auf. War der obere Grenzwert laut den Autoren zu hoch angesetzt, unterschied sich das härtere Knotengewebe farblich nicht mehr vom umgebenden Schilddrüsenparenchym und die beiden Gewebe wurden einheitlich als weich dargestellt [54] . 88 Diskussion Da in der vorliegenden Ergebnisauswertung zu viele Ergebnisse in der Skaleneinstellung 0,5-3,0 m/s außerhalb des Messbereichs lagen, wurde diese Datenreihe nicht mit in die vorliegende Arbeit aufgenommen und ist auch für zukünftige Untersuchungen nicht empfehlenswert. Um nun die anderen Skaleneinstellungen zu bewerten, wurden die einzelnen Ergebnisse der numerischen Scherwellenelastografie gegenübergestellt: In der numerischen Darstellung der Scherwellengeschwindigkeiten zeigte die Skaleneistellung 0,5-9,0 m/s im Querschnitt das beste Ergebnis, da hier der größte Unterschied zwischen den mittleren Scherwellengeschwindigkeiten von benignen Knoten auf der einen Seite und malignen Knoten auf der anderen Seite zu beobachten war. Ein großer Unterschied zwischen den Messwerten ermöglichte eine gute Differenzierung zwischen den beiden Gruppen. Dieser Unterschied war jedoch nicht signifikant. Die gemessenen Scherwellengeschwindigkeiten in dieser Einstellung bewegten sich für benigne Knoten zwischen 1,5 und 7,5 m/s und für maligne Knoten zwischen 1,8 und 8,4 m/s. Eine Erhebung der grafischen Scherwellenelastografie fand nur für eine Skaleneinstellung von 0,5-6,5 m/s im Quer- und Längsschnitt statt. Möchte man aus diesen Ergebnissen und den Vor- bzw. Nachteilen ableitend zum einen ein möglichst kleines Skalenintervall für eine gute farbliche Differenzierung einstellen, zum anderen aber trotzdem alle Knoten in der Einstellung erfassen, wäre eine optimale Skaleneinstellung für den Querschnitt folglich 1,5-8,4 m/s bzw. 1,5-8,5 m/s, da vom Ultraschallgerät nur Intervallsprünge von 0,5 m/s eingestellt werden können. Mit einem Toleranzbereich für die Messwerte und einer möglichst untersucherfreundlichen Einstellung könnte sich das Intervall auf 1,0-9,0 m/s erweitern. Anzunehmen ist jedoch, dass dieses relativ große Intervall wiederum in der Abgrenzung der grafischen Scherwellendarstellung Schwierigkeiten bereitet, wie in der Arbeit von Monpeyssen et al. beschrieben. Zukünftige Arbeiten müssen die Reliabilität dieses Bereiches in der klinischen Anwendung prüfen. 89 Diskussion 4.4.4 Vergleich der verschiedenen Arten der Elastografie zwischen den Geräten 4.4.4.1 Vergleich der Ergebnisse bisher publizierten Arbeiten Wie bereits erwähnt, wurden zudem Arbeiten publiziert, die nicht einen Vergleich zwischen Elastografiemodalitäten an einem Gerät, sondern zwischen verschiedenen Geräten durchführten [9, 27, 74]. Dadurch konnten gezielt die Vorund Nachteile der einzelnen Technologien, die der Elastografie zugrunde liegen, verglichen werden. Zunächst wird in diesem Kapitel kurz auf die drei vergleichenden Arbeiten eingegangen und anschließend erläutert, welches der drei Ultraschallgeräte nach den Ergebnissen der vorliegenden Arbeit unter welchen Gesichtspunkten vorteilig ist. Friedrich-Rust et al. untersuchten 2011 als erste die ARFI-Technologie an Schilddrüsenknoten und untersuchten diese Knoten gleichzeitig auch mittels Kompressionselastografie. Den Schwerpunkt legten die Autoren weniger auf den direkten Vergleich der Methoden als vielmehr auf die Frage, ob Schilddrüsenknoten überhaupt für die ARFI-Technologie zugänglich seien und ob diese Technik vergleichbare Ergebnisse in der Beurteilung erzielen könne. Daher wurden außer dem signifikanten Spearman Korrelationskoeffizienten von 0,31 zwischen den beiden Methoden keine weiteren diagnostischen Werte für einen Vergleich angegeben. Dieser Wert des Korrelationskoeffizienten zeigte jedoch nur einen schwachen Zusammenhang zwischen den beiden Methoden an [27]. Die Nachfolgestudie dieser Arbeitsgruppe, publiziert von Bojunga et al., beinhaltete 158 Knoten, die zum einen mit der Realtime-Elastografie (RTE) eines Hitachi Ultraschallgerätes und zum anderen mit der ARFI-Bildgebung des Programms Virtual-Touch™ Quantification (VTQ) eines Siemens Acuson S2000 untersucht wurden. Die Einteilung der farblichen Elastogramme erfolgte in vier Elastografiescores (ES) und ES 3 und 4 wurden als maligne definiert. Die gemessenen Scherwellengeschwindigkeiten wurden in m/s angegeben und ein optimaler Cut-off-Wert von 2,57 m/s bestimmt. Zur statistischen Auswertung wurde im Rahmen der ROC-Analyse die Fläche unter der Kurve für beide Verfahren berechnet: Die RTE wies mit 0,74 die bessere Diskriminierungsfähigkeit von benignen und malignen Knoten im Vergleich zur ARFI-Schwellengrenze von 2,57 90 Diskussion m/s mit 0,69 auf. Die einzelnen diagnostischen Werte der beiden Verfahren sind in Tabelle 25 im Anhang aufgeführt: Die RTE hatte mit 76% die höhere Sensitivität, die ARFI-VTQ die höhere Spezifität mit 85%. Es gab jedoch keinen signifikanten Unterschied zwischen beiden Untersuchungsmethoden. Auch durch eine Kombination der beiden Elastografiearten RTE und ARFI konnten Bojunga et al. die diagnostische Genauigkeit nicht erhöhen [9]. Die letzte vergleichende Arbeit mit sechs Knoten (eine maligne Histopathologie) wurde publiziert von Slapa et al. Die Kompressionselastografie wurde an einem Toshiba Ultraschallgerät, die Scherwellenelastografie an einem Supersonic Image Ultraschallgerät untersucht. Letzteres wurde in der vorliegenden Arbeit nicht benutzt. Zudem war es eine sehr kleine Fallzahl. Dennoch fanden Slapa et al. diskussionswürdige Ergebnisse: Die Scherwellenelastografie wies ein richtig positives und fünf richtig negative Ergebnisse auf, die Kompressionselastografie fünf falsch positive und ein falsch negatives Ergebnis. Die falsch positiven Knoten wiesen mindestens eins der folgenden Kriterien auf: flüssiger oder degenerativer Inhalt, fokal erhöhte Steifigkeit durch Mikrokalzifizierungen, die im B-Bild teilweise nicht sichtbar waren. Die Autoren folgerten, dass die Scherwellenelastografie im Gegensatz zur Kompressionselastografie auch bei Knoten mit diesen Charakteristika effektiv für eine Differenzierung eingesetzt werden konnte [74]. Eine derartige Diskrepanz in der diagnostischen Performance konnte in der vorliegenden Arbeit nicht beobachtet werden, obwohl auch diese teilweise zystische Knoten und Knoten mit Mikrokalzifizierungen enthielt: Zwar lagen die Messung der Scherwellengeschwindigkeit beim Siemens Ultraschallgerät im Querschnitt mit 66,7% Sensitivität und 68,1% Spezifität über den Werten der semiquantitativen Elastografie des Toshiba mit 60,0% bzw. 48,5%, jedoch übertrafen sie nicht die ebenfalls mit Kompressionselastografie ermittelten semiquantitativen Werte des Hitachi Ultraschallgerätes von 80,0% bzw. 72,2%. Die Ergebnisse von Slapa et al. zeigten sich in der vorliegenden Arbeit folglich nicht und dürfen aufgrund der geringen Fallzahl auch zunächst nicht im Allgemeinen gelten. 91 Diskussion 4.4.4.2 Zusammenfassender Vergleich der drei Ultraschallgeräte Im Folgenden sollen die Ergebnisse der vorliegenden Arbeit zusammengefasst dargestellt werden: Betrachtete man bei der Frage, welches der Ultraschallgeräte das beste Gerät sei, allein die diagnostischen Werte für die qualitative, semiquantitative und quantitative Elastografie der drei Ultraschallgeräte, fand man die höchste Sensitivität mit 83,3% bei der qualitativen Elastografie im Längsschnitt am Hitachi HI VISION Ascendus. Die höchste Spezifität mit 72,2% erreichte ebenfalls das Hitachi Ultraschallgerät jedoch in der semiquantitativen Elastografie. Ebenso erhielt man die größte Summe aus Sensitivität und Spezifität beim Hitachi Gerät in der semiquantitativen Elastografie, gefolgt vom Siemens Ultraschallgerät, das im Querschnitt in der grafischen und in der numerischen Darstellung der Scherwellenelastografie die gleichen diagnostischen Werte aufwies. In der Summe die schlechtesten Werte erzielten das Toshiba Gerät im Längsschnitt in der qualitativen Elastografie und das Siemens Gerät im Längsschnitt in der numerischen Messung der Scherwellengeschwindigkeit. Den einzigen signifikanten p-Wert für die Differenzierung zwischen benignen und malignen Knoten erhielt man bei der semiquantitativen Elastografie am Hitachi Ultraschallgerät bei der Erhebung von Strain-Ratio-Werten für die Subanalyse. Dieses Ergebnis ist jedoch aufgrund der geringen Fallzahl mit Zurückhaltung zu betrachten. Keines der Geräte war aufgrund seiner diagnostischen Wertigkeit in dem Maße überlegen, als dass zukünftig die elastografische Untersuchung von Schilddrüsenknoten nur an einem dieser Geräte durchgeführt werden sollte. Da zudem oft nur eines der Geräte vor allem in kleineren Krankenhäusern oder Praxen vorhanden ist, kann der Knoten an diesem elastografisch untersucht werden. Knoten mit zystischen Anteilen sollten jedoch ausgeschlossen werden, da ihr Einfluss auf die Messung zum jetzigen Zeitpunkt nicht klar abgeschätzt werden kann. Die Elastografie sollte immer in Kombination mit der Untersuchung des Knotens im herkömmlichen B-Bild erfolgen und muss als additionale Untersuchungsmethode verstanden werden. Nur durch eine Darstellung im B-Bild können die sicheren Malignitätskriterien wie infiltratives Wachstum oder Lymphknotenmetastasten erkannt bzw. ausgeschlossen werden. Ein Vorteil des Hitachi Ultraschallgerätes im Vergleich zum Toshiba Ultraschallgerät ist die Messung der applizierten Druckstärke in Form einer Zahlenskala. Zwischen 92 Diskussion unterschiedlichen Untersuchern kann für die Reproduzierbarkeit der Messung eine Zahl als Standarduntersuchungsdruck festgelegt werden. Das Toshiba Gerät zeigt dem Untersucher den applizierten Druck in Form einer „Zeit-relative Druckstärke“Kurve an. Auch wenn hier beispielsweise der Messzeitpunkt „im Tal“ standardmäßig gewählt wird, ist diese Angabe nur relativ, da das Tal bei dem einen Untersucher trotzdem tiefer liegen kann als bei einem anderen Untersucher. Deshalb liegt die größere Objektivität bzw. Reproduzierbarkeit der beiden Ultraschallgeräte, die sich der Kompressionselastografie bedienen, auf Seiten des Hitachi Gerätes. Bei der Generierung von Cut-off-Punkten für die Strain-Ratio der beiden Geräte stellt sich die Frage, ob nicht ein geräteübergreifender Wert ermittelt werden kann. Zwar kann es Unterschiede zwischen den Messungen der Geräte geben, aber durch die Berechnung eines Quotienten sollten diese sich ausgleichen. Zukünftige Metaanalysen mit großen Fallzahlen könnten die Ermittlung eines gemeinsamen Cut-off-Punktes für die Stain-Ratio für eine Vereinheitlichung der Geräte als Aufgabe haben. In der Zusammenschau aller Ergebnisse erscheint die elastografische Untersuchung von Schilddrüsenknoten am Siemens Acuson Ultraschallgerät in der grafischen Darstellung der Scherwellenelastografie mit Hilfe der Software VTI oder VTIQ aufgrund folgender Aspekte am sinnvollsten: Bei der Scherwellenelastografie handelt es sich zum einen um die objektivste Untersuchungstechnologie. Die grafische Darstellung hat gegenüber der numerischen Messung den Vorteil, dass der komplette Knoten als Ganzes sofort abgebildet und dem Untersucher das zeitintensive Setzen der einzelnen Mess-ROIs erspart wird. Dies wiederum ermöglicht eine gute Integration in den klinischen Alltag im Anschluss an die herkömmliche B-Bild-Untersuchung. Ein weiterer Grund für diese Untersuchung am Siemens Gerät ist, dass sie in der vorliegenden Arbeit die zweitbesten diagnostischen Werte aufweist und auch die Ergebnisse der übrigen Publikationen sehr zufriedenstellend sind mit Sensitivitäten und Spezifitäten über 95% bzw. 82% [15, 90]. Zukünftig überlegenswert erscheint, ob die numerische Darstellung der Scherwellenelastografie des Siemens Ultraschallgerätes für eine Gruppe von vorausgewählte Knoten, die beispielsweise in eine bestimmte TIRADS-Kategorie fallen oder eine bestimmte Größe nicht überschreiten, Anwendung finden kann. 93 Diskussion Bisher war das Setzen mehrerer ROIs in diesem Verfahren zeitintensiv, doch könnte eine Zeitersparnis durch eine Vorauswahl der Knoten oder durch die Festlegung einer maximal zulässigen Knotengröße erwirkt werden. Die zugrunde liegende Scherwellentechnologie liefert wie bereits aufgeführt vielversprechende Ergebnisse und besitzt daher großes Potential für zukünftige elastografische Forschung. 4.5 Weitere Vergleichsmessungen der numerischen Scherwellenelastografie Während der Untersuchung wurden Scherwellengeschwindigkeiten in dem den Knoten umgebenden Schilddrüsenparenchym erhoben. Dieses wurde ebenso wie der Knoten anschließend histopathologisch untersucht. Dies lässt im Folgenden zum einen den Vergleich der Messwerte von Knoten und Schilddrüsengewebe und zum anderen den Vergleich der Schilddrüsengewebe mit unterschiedlicher Histopathologie zu. Der Unterschied zwischen den Messwerten von benignen und malignen Knoten wurde bereits in einem vorangehenden Kapitel diskutiert. 4.5.1 Vergleich der Scherwellengeschwindigkeiten von Läsion und Schilddrüsenparenchym Die gemessenen mittleren Scherwellengeschwindigkeiten der Läsionen waren in der vorliegenden Arbeit signifikant größer als die mittleren Geschwindigkeiten des umgebenden Schilddrüsenparenchyms. Dabei ist zu beachten, dass dies für die Gesamtheit der Läsionen gilt, die benignen und malignen Knoten folglich zu einer Gruppe zusammengefasst wurden. Bisher veröffentlichte Werte entsprechen dem in dieser Arbeit beobachteten Verhältnis: Die Scherwellengeschwindigkeiten der Läsionen waren größer als die Scherwellengeschwindigkeiten des umgebenden Schilddrüsenparenchyms, wobei von den Autoren immer die Werte getrennt für benigne und maligne Knoten und nicht für die Gesamtheit angegeben wurden [9, 27, 29, 31, 32]. Die einzige davon abweichende Arbeit wurde 2014 von Calvete et al. veröffentlicht: Sie fanden die kleinsten Scherwellengeschwindigkeiten in der Gruppe der benignen Knoten, gefolgt vom Schilddrüsenparenchym und den malignen Knoten [15]. Die Ergebnisse dieser Studien sind in Tabelle 26 im Anhang aufgeführt. 94 Diskussion Es zeigte sich, dass die Gewebeveränderungen, die im Rahmen einer fokalen Läsion unabhängig von ihrer Dignität entstehen, zu einer Erhöhung der Scherwellengeschwindigkeiten und somit einer Gewebeverhärtung führen. Diese Erkenntnis könnte klinisch hilfreich bei der Untersuchung echonormaler Läsionen, die schwer vom umliegenden Gewebe abgrenzbar sind, sein. Die Messung der Scherwellengeschwindigkeit würde es ermöglichen, dieses Gewebe als Läsion zu identifizieren bzw. ihre genaue Ausdehnung zu beurteilen. Da die Patienten neben ihren fokalen Knoten teilweise auch Erkrankungen des gesamten Schilddrüsenparenchyms aufwiesen und diese durch strukturelle Gewebeveränderungen möglicherweise Einfluss auf die gemessenen Scherwellengeschwindigkeiten nahmen, wurde diese Störgröße in einer folgenden Berechnung der Scherwellengeschwindigkeiten für histopathologisch bestätigtes, gesundes Schilddrüsenparenchym und der sich darin befindenden Läsion ausgeschlossen. Wie Tabelle 19 im Anhang verdeutlicht, zeigten sich auch hier trotz der kleinen Fallzahl (n=34) signifikante Unterschiede zwischen den beiden Geweben. Zukünftige Studien müssen evaluieren, wie diese Ergebnisse in der klinischen Diagnostik eingesetzt werden können. 4.5.2 Vergleich der Scherwellengeschwindigkeiten des Schilddrüsenparenchyms Die Messung der Scherwellengeschwindigkeiten in nicht fokal verändertem Schilddrüsenparenchym ist bisher nicht in dem Maße untersucht worden, wie die Messung von Scherwellengeschwindigkeiten in fokalen Läsionen. Auch die aktuellen Leitlinien zur Elastografie der European Federation of Societies for Ultrasound in Medicine Elastografieuntersuchung nicht and auf Biology [19]. (EFSUMB) Da aber führen Erkrankungen diese des Schilddrüsenparenchyms Veränderungen der Strukturbeschaffenheit in diesem hervorrufen können, ist eine Anwendung der Scherwellentechnologie durchaus für diese Fragestellungen denkbar [52]. In der vorliegenden Arbeit wurden daher zum einen ein Vergleich der Scherwellengeschwindigkeiten der unterschiedlichen Histopathologien der Schilddrüse und zum anderen ein Vergleich zwischen Schilddrüsenparenchym mit benignen und malignen Knoten durchgeführt. 95 Diskussion 4.5.2.1 Vergleich der Scherwellengeschwindigkeiten von Schilddrüsenparenchym mit unterschiedlicher Histopathologie Die in der vorliegenden Arbeit gemessenen Scherwellengeschwindigkeiten waren durchschnittlich für das gesunde Schilddrüsenparenchym in allen drei Einstellungen am Siemens Ultraschallgerät am kleinsten, gefolgt von den Messwerten des Schilddrüsenparenchyms mit Hashimoto-Thyreoiditis und Schilddrüsenparenchym mit chronischer Thyreoiditis. In unserer Arbeitsgruppe wurden die Scherwellengeschwindigkeiten des Schilddrüsengewebes von 194 Probanden ohne bekannte Schilddrüsenerkrankung gemessen. Die mittleren Geschwindigkeiten waren tiefenabhängig und betrugen im rechten Schilddrüsenlappen für die ventrale Hälfte 2,52 m/s bzw. 2,43 m/s für die dorsale Hälfte und im linken Schilddrüsenlappen 2,56 m/s für die ventrale Hälfte bzw. 2,48 m/s für die dorsale Hälfte [56]. Die durchschnittlichen Scherwellengeschwindigkeiten der vorliegenden Arbeit bewegten sich für die drei Einstellungen Querschnitt 0,5-6,5 m/s und 0,5-9,0 m/s bzw. Längsschnitt 0,5-6,5 m/s zwischen 3,0 m/s und 3,3 m/s und lagen somit über den Messwerten der Arbeitsgruppe. Die Messtiefe wurde in der vorliegenden Arbeit nicht berücksichtigt. Sporea et al. untersuchten in ihrer Arbeit 74 Patienten mit unterschiedlicher Histopathologie der Schilddrüse: Das gesunde Schilddrüsenparenchym wies mit 2,07 m/s eine geringere durchschnittliche Scherwellengeschwindigkeit auf als Schilddrüsenparenchym bei Patienten mit Autoimmunerkrankung, wobei zum einen Patienten mit Morbus Basedow und zum anderen Patienten mit chronischer autoimmuner Thyreoiditis (CAT) untersucht wurden [76]. Eine weitere Arbeit von Sporea et al. mit einer größeren Patientenanzahl (n=136) bestätigte dieses Ergebnis. Zusätzlich untersuchten Sporea et al. in der letztgenannten Arbeit den Einfluss des Serum TSH-Levels auf die Scherwellengeschwindigkeit: Die mittlere Scherwellengeschwindigkeit bei Patienten mit einer Schilddrüsenerkrankung und pathologischen TSH-Werten war signifikant höher als bei Patienten mit Schilddrüsenerkrankung und normwertigen TSH-Werten [75]. Die TSH-Level der Patienten wurden in der vorliegenden Arbeit nicht berücksichtigt, sollten allerdings aufgrund der Ergebnisse von Sporea et al. in zukünftigen Arbeiten über Scherwellengeschwindigkeitsmessung ein zu beachtender Aspekt sein. 96 Diskussion Die Arbeitsgruppe von Magri et al. ermittelte die Steifigkeitswerte von Schilddrüsenparenchym bei Patienten, die einen Schilddrüsenknoten aufwiesen. Die eine Gruppe bildeten Patienten, die außer dem Knoten keine pathologische Veränderung des Schilddrüsenparenchyms hatten, und die andere Gruppe die Patienten, die neben ihrem Knoten eine koexistierende Hashimoto-Thyreoiditis aufwiesen. Die Steifigkeit wurde in Kilopascal (kPa) gemessen und anschließend die mittleren Werte der beiden Gruppen miteinander verglichen. Die höheren Steifigkeitswerte fanden sich in den Schilddrüsengeweben bei Patienten mit Hashimoto-Thyreoiditis [51]. Zusammenfassend sind die Ergebnisse der beiden Arbeiten von Sporea et al. und der Arbeit von Magri et al. mit den Ergebnissen der vorliegenden Arbeit vergleichbar, da auch in dieser im gesunden Schilddrüsenparenchym niedrigere Scherwellengeschwindigkeitswerte als das pathologisch veränderte Schilddrüsengewebe gemessen wurden. Ein gültiger Vergleich wird jedoch aufgrund folgender Gesichtspunkte erschwert: Magri et al. verwendeten für ihre Arbeit eine von einem anderen Ultraschallhersteller entwickelte scherwellentechnologiebasierte Messmethode als die vorliegende Arbeit. Sowohl die Arbeiten von Sporea et al. als auch die vorliegende Arbeit gaben die Scherwellengeschwindigkeiten nicht in Abhängigkeit von der Messtiefe an. Unsere Arbeitsgruppe konnte bei der Erhebung der Scherwellengeschwindigkeiten im gesunden Schilddrüsengewebe jedoch einen signifikanten Unterschied zwischen Messwerten in der ventralen und der dorsalen Schilddrüsenhälfte beobachten, d.h. dass die Scherwellengeschwindigkeiten messtiefenabhängig sind [56]. Außerdem fanden sich in den Arbeiten von Sporea et al. keine Angaben über die verwendete Skaleneinstellung. Wir erhielten jeweils für die drei Skaleneinstellungen leicht differierende mittlere Scherwellengeschwindigkeiten. Als letzter Diskussionspunkt ist des Weiteren die Frage anzuführen, ob das Schilddrüsengewebe in der Arbeit von Magri et al. und in der vorliegenden Arbeit überhaupt als „gesund“ zu werten war, da sich in diesem zum Zeitpunkt der Messung mindestens ein Schilddrüsenknoten befand. Dass die Knoten und ihre Histopathologie jedoch anscheinend Einfluss auf die gemessene Scherwellengeschwindigkeit des Schilddrüsenparenchyms nehmen, zeigt das folgende Kapitel. 97 Diskussion 4.5.2.2 Vergleich der Scherwellengeschwindigkeit von Schilddrüsenparenchym mit benignen und malignen Knoten Überleitend aus dem vorausgehenden Kapitel ergab sich in der vorliegenden Arbeit interessanterweise ein signifikanter Unterschied der Scherwellengeschwindigkeiten zwischen Schilddrüsenparenchym, das benigne Knoten enthielt, und Schilddrüsenparenchym, das maligne Knoten enthielt, wobei die mittlere Scherwellengeschwindigkeit in Schilddrüsengeweben mit malignen Knoten für die beiden Einstellungen im Querschnitt signifikant höher war als in Schilddrüsengeweben mit benignen Knoten. Wenn die These stimmt, dass maligne Knoten die Scherwellengeschwindigkeit des umgebenden Schilddrüsenparenchyms auf eine andere Weise beeinflussen als benigne Knoten, muss folgender Aspekt in der Betrachtung der Werte beachtet werden: Maligne Knoten traten in dieser Arbeit nie solitär auf, d.h. dass die Messwerte der Scherwellengeschwindigkeiten des Schilddrüsenparenchym mit malignen Knoten zum einen in die Gruppe der Schilddrüsenparenchyme mit malignen und zusätzlich in die Gruppe der Schilddrüsenparenchyme mit benignen Knoten einflossen. Daher wurden die mittleren Messwerte der letztgenannten Gruppe eventuell noch zu hoch berechnet. Grazhdani et al. und Gu et al. veröffentlichten in ihren Arbeiten 2,04 m/s bzw. 1,97 m/s als mittlere Scherwellengeschwindigkeiten von Schilddrüsenparenchym, das benigne Knoten enthält, und 2,11 m/s bzw. 2,01 m/s für Schilddrüsenparenchym, das maligne Knoten enthält. Wie in der vorliegenden Arbeit zeigten sich auch hier höhere mittlere Geschwindigkeiten in Schilddrüsenparenchym mit malignen Knoten. Ob es einen signifikanten Unterschied zwischen diesen beiden Werten gab, berechneten die Autoren jedoch nicht [31, 32]. 98 Diskussion 4.6 Stärken und Schwächen der Studie Zusammenfassend hat die vorliegende Arbeit folgende Limitationen: Es wurde ein relativ kleines Kollektiv untersucht. Da die Datenerhebung für jeden Knoten in etwa 1,5 Stunden beanspruchte, war jedoch die Untersuchung eines größeren Kollektivs im Rahmen dieser Studie nicht realisierbar und auch nicht angedacht. Die Ergebnisse sollen weiteren Studien zur Schilddrüsenelastografie zur Orientierung, Planung und Durchführung dienen. Des Weiteren wurde die Intra- und Interobserver-Variabilität nicht getestet. Park et al. untersuchten diese in ihrer Studie mit drei Radiologen an 52 Knoten und kamen zu dem ernüchternden Ergebnis, dass es keine statistisch signifikante Konkordanz zwischen den Untersuchern bezüglich der qualitativen und semiquantitativen Elastografie gab [61]. Sicher ist dieses Ergebnis nicht ohne Weiteres auf die vorliegende Studie übertragbar, zumal bei den Untersuchungen dieser Studie immer mindestens zwei Untersucher anwesend waren und bei Unstimmigkeit ein Konsens gebildet wurde, aber es zeigt, dass die Variabilität nicht unterschätzt werden darf und in künftigen Studien mit erhoben werden sollte. Da der mögliche Vorteil des Längsschnitts zu Beginn der Erhebung nicht abzusehen war, wurden die Strain-Ratio-Werte nur im Querschnitt erfasst und folglich wurde ein Vergleich zwischen den beiden Schnittebenen nicht durchführbar. Knoten, die einen zystischen Anteil aufwiesen, wurden in meiner Arbeit nicht ausgeschlossen. Bhatia et al. konnten in ihrer Arbeit jedoch zeigen, dass zystische Veränderungen eine Störgröße für die Realtime-Elastografie darstellten und die zystisch veränderten Knoten im Elastogramm härter erschienen. Als mögliche Gründe nannten die Autoren einen tatsächlichen Anstieg der Knotenhärte oder entstandene Artefakte [7]. Leider konnten im Rahmen dieser Studie keine Daten an einem Supersonic Ultraschallgerät erhoben werden. Dieses benutzt wie das Siemens Ultraschallgerät die Scherwellentechnologie für die elastografische Untersuchung. Es ist daher vermutlich genauso objektiv wie das Siemens Ultraschallgerät und könnte dieses in der Untersuchungsdurchführung und den diagnostischen Werten möglicherweise überbieten. Zukünftig wären Studien denkbar, die die Untersuchung von Schilddrüsenknoten mit Hilfe der beiden unterschiedlichen scherwellenbasierten Technologien vergleichen. 99 Diskussion Die Stärken dieser Arbeit gründen sich auf folgenden Punkten: Die Patienten wurden an allen drei Ultraschallgeräten untersucht. Einflüsse, die durch verschiedene Charakteristika der Knoten und Schilddrüsen in unterschiedlichen Populationen entstehen, können im Vergleich verschiedener Studien sonst nicht ausgeschlossen werden. Diese Störgröße trat in der vorliegenden Arbeit nicht auf. Dadurch wurde ein unmittelbarer Vergleich der Elastografiearten und der zugrundliegenden Techniken ermöglicht. Als zweiter wichtiger Punkt ist aufzuführen, dass für jeden Knoten die histopathologische Referenz in die Auswertung aufgenommen wurde. In der Mehrheit der übrigen Studien wird die weniger zuverlässige, zytopathologische Diagnose aus einer Feinnadelbiopsie als Referenz herangezogen. Die FNAB liefert in 10-20% der Fälle jedoch fehlerhafte bzw. keine diagnostischen Ergebnisse [50, 62]. Eine weitere Stärke dieser Arbeit liegt darin, dass mit dem Verhältnis von benignen zu malignen Knoten die tatsächliche Prävalenz von Schilddrüsenkarzinomen in der Bevölkerung abgebildet werden konnte. Liegt der Anteil der malignen Knoten wie in vielen Arbeiten deutlich über der tatsächlichen Prävalenz, werden die diagnostischen Werte unter Umständen falsch hoch gemessen [34, 62, 64]. Als limitierender Faktor der Elastografie wird in der Literatur inzwischen immer häufiger das follikuläre Schilddrüsenkarzinom angeführt, weil sich sein Gewebewachstum im Vergleich zum papillären Schilddrüsenkarzinom nicht durch Härtezunahme auszeichnet [6, 54]. Da in dieser Arbeit alle malignen Knoten ausschließlich papilläre Schilddrüsenkarzinome waren, konnte die Elastografie an der für diese Untersuchung zulässigen Karzinomart untersucht werden. Leider löst sich dadurch jedoch nicht das Problem, dass die elastografische Untersuchung nicht für alle Schilddrüsenkarzinomarten gleich gut geeignet ist. 100 Diskussion 4.7 Schlussfolgerung Die elastografische Untersuchung eines Schilddrüsenknotens kann im Anschluss an jede herkömmliche Ultraschalluntersuchung im B-Mode erfolgen. Sie ist in der Regel nicht zeitaufwendig und kann dem Untersucher wertvolle Informationen bezüglich der Gewebeelastizität des Knotens liefern, wodurch sich ein zusätzliches Kriterium für die Unterscheidung zwischen benignen und malignen Knoten ergibt. Die drei Ultraschallgeräte lieferten in der Erhebung der vorliegenden Arbeit vergleichbare Ergebnisse. Folgende Punkte gilt es jedoch in Zusammenhang mit der verwendeten Elastografietechnik für eine valide elastografische Untersuchung zu beachten: Bei der Ermittlung der Strain-Ratio mit Hilfe der Kompressionselastografie müssen die beiden ROIs von Knoten und Schilddrüse unbedingt auf gleicher Höhe gesetzt werden. Bei der elastografischen Untersuchung mittels der Scherwellentechnologie müssen sowohl die Skaleneinstellungen als auch die Messtiefe beachtet werden. Auch wenn die Geräte und die Technologien wie gesagt in dieser Arbeit vergleichbare Ergebnisse lieferten, ist für die Zukunft zu erwarten, dass sich die quantitative Scherwellentechnologie durchsetzen wird. Diese liefert schon heute viel versprechende Ergebnisse und ist aufgrund ihrer Technologie objektiver und reproduzierbarer. Dennoch gibt es für sie Verbesserungspotential: Die Hersteller sollten zum einen die Größe der ROI an die Größe des Knotens adaptierbar machen. Zum anderen sollte die Messtiefe direkt in die Messung der Scherwellengeschwindigkeiten integriert werden. Des Weiteren müssen hier Cutoff-Punkte für zukünftige Messungen etabliert werden. Ein weiterer Ansatzpunkt für die Verwendung der Scherwellentechnologie ist sicherlich die Anwendung in der Diagnostik von generalisierten Schilddrüsenparenchymerkrankungen. Die vorliegende Arbeit konnte hier signifikante Unterschiede zwischen gesundem und krankem Parenchym in den Messwerten zeigen. Für künftige Forschung bietet die Untersuchung von Schilddrüsenknoten mit Hilfe der Elastografie viel Potential, die in Anbetracht der steigenden Inzidenz von Schilddrüsenkarzinomen lohnenswert scheint. 101 Zusammenfassung 5 Zusammenfassung Ziel dieser Arbeit war es, die unterschiedlichen Elastografietechniken der drei Ultraschallgeräte Hitachi HI VISION Ascendus, Toshiba Aplio 500 und Siemens Acuson S3000 in der Differenzierung zwischen benignen und malignen Schilddrüsenknoten zu untersuchen und hinsichtlich ihrer diagnostischen Werte miteinander zu vergleichen. Während sich das Hitachi und das Toshiba Gerät der Kompressionselastografie in der Erstellung eines farblichen Elastogramms und einer Strain-Ratio bedienen, verwendet das Siemens Gerät die sogenannte Acoustic Radiation Force Imaging (ARFI) Technologie und misst die Geschwindigkeit der generierten Scherwellen. In dieser Arbeit wurden 41 Patienten mit 53 Schilddrüsenknoten an diesen drei Geräten untersucht. Anschließend wurden diese Patienten an der Schilddrüse operiert und das histopathologische Gutachten als Referenz übernommen. Neben den Elastografiewerten wurden folgende Parameter erhoben: Patienten- charakteristika, B-Bild Kriterien der Schilddrüse und der Läsion mit Zuteilung zu einer Thyroid Imaging Reporting and Data System (TIRADS) Kategorie, Vaskularisation der Läsion. Für die elastografische Untersuchung wurden am Hitachi und am Toshiba Ultraschallgerät zum einen ein qualitatives farbliches Elastogramm, das entsprechend seiner Farbzusammensetzung in eine Klassifikation eingeordnet wurde, und zum anderen die semiquantitative StrainRatio von Schilddrüsen- zu Knotenparenchym erhoben. Am Siemens Gerät wurde die elastografische Untersuchung mittels des Programms Virtual Touch™ IQ (VTIQ) durchgeführt. Hierbei wurde die grafische Darstellung der Scherwellen- geschwindigkeiten interpretiert und anhand der Farbzusammensetzung einer Klassifikation zugeordnet. Außerdem wurden die Scherwellengeschwindigkeiten innerhalb der Läsion und innerhalb des umgebenden Schilddrüsenparenchyms in vom Untersucher platzierten ROIs ermittelt. Die Erhebung der qualitativen und der scherwellenbasierten Elastografiedaten erfolgte im Quer- und im Längsschnitt, die Daten der semiquantitativen Strain-Ratio wurden nur im Querschnitt erhoben. Für die Klassifikation der farblichen Elastogramme wurden vier Elastografiescores (ES) unterschieden: ES 1 und ES 2 wurden als Vorhersage für Benignität, ES 3 und ES 4 als Vorhersage für Malignität definiert. Für die Strain-Ratio-Werte und die 102 Zusammenfassung numerische Darstellung der Scherwellengeschwindigkeiten wurden jeweils die bestmöglichen Cut-off-Punkte ermittelt. Anschließend wurden für alle elastografischen Verfahren die entsprechenden diagnostischen Werte berechnet. Im Vergleich der B-Bild-Kriterien, der Vaskularisation und der TIRADS-Klassifikation zwischen benignen und malignen Knoten zeigten sich keine signifikanten Unterschiede. Im Vergleich der Werte der farblichen Elastogramme erreichte das Hitachi Gerät im Längsschnitt die höchste Sensitivität mit 83,3%, die höchste Summe aus Sensitivität und Spezifität das Siemens Gerät im Querschnitt mit 66,7% bzw. 68,1%. Im Vergleich der Strain-Ratio-Werte und der numerischen Darstellung der Scherwellengeschwindigkeitsmessung konnte sowohl die höchste Sensitivität als auch die höchste Spezifität am Hitachi Gerät mit 80,0% bzw. 72,2% im Querschnitt errechnet werden. In einer weiterführenden Betrachtung der Scherwellengeschwindigkeitswerte zwischen Knoten- und Schilddrüsengewebe konnten signifikant höhere Geschwindigkeiten im Knoten gemessen werden. Zudem zeigte sich ein signifikanter Unterschied der Geschwindigkeiten zwischen den verschiedenen Histopathologien der Schilddrüse. Zusammenfassend ist zu sagen, dass keines der drei Ultraschallgeräte in dem Maße überlegen war, als dass zukünftig elastografische Untersuchungen von Schilddrüsenknoten ausschließlich an diesem Gerät erfolgen sollten. Die Elastografie kann dem Untersucher wichtige Hinweise bezüglich des Härtegrades einer Läsion liefern, muss aber in diesem Kontext als additionale Untersuchungsmethode zur herkömmlichen B-Bild-Sonografie verstanden werden. Zukünftig wird sich höchstwahrscheinlich die Elastografie basierend auf der Messung der Scherwellengeschwindigkeiten durchsetzen, da diese Methode aufgrund ihrer Technologie als die objektivste und damit vergleichbarste gilt. Sie lieferte bereits in anderen Arbeiten ausgezeichnete diagnostische Werte und weist auch in der vorliegenden Arbeit zufriedenstellende Werte auf. 103 Literaturverzeichnis 6 Literaturverzeichnis [1] Arbeitsgemeinschaft Fachgesellschaften der (AWMF): Wissenschaftlichen Leitlinie “Operative Medizinischen Therapie maligner Schilddrüsenerkrankungen”:http://www.awmf.org/uploads/tx_szleitlinien/088002l_S2k_Maligne_Schilddr?senerkrankungen_Operative_Therapie_201211.pdf.(10.01.2013) [2] Asteria C, Giovanardi A, Pizzocaro A, Cozzaglio L, Morabito A, Somalvico F and Zoppo A: US-elastography in the differential diagnosis of benign and malignant thyroid nodules. Thyroid : official journal of the American Thyroid Association. 18, 523–531 (2008). [3] Aydin R, Elmali M, Polat AV, Danaci M and Akpolat I: Comparison of muscleto-nodule and parenchyma-to-nodule strain ratios in the differentiation of benign and malignant thyroid nodules: which one should we use? European journal of radiology. 83, e131–e136 (2014). [4] Bamber J, Cosgrove D, Dietrich CF, Fromageau J, Bojunga J, Calliada F, Cantisani V, Correas J-M, D’Onofrio M, Drakonaki EE, Fink M, Friedrich-Rust M, Gilja OH, Havre RF, Jenssen C, Klauser AS, Ohlinger R, Saftoiu A, Schaefer F, Sporea I and Piscaglia F: EFSUMB guidelines and recommendations on the clinical use of ultrasound elastography. Part 1: Basic principles and technology. Ultraschall in der Medizin (Stuttgart, Germany : 1980). 34, 169–184 (2013). [5] Bertz J, Dahm S, Haberland J, Kraywinkel K, Kurth B-M and Wolf U: Ergebnisse zur Prävalenz nach ICD-10: Schilddrüse. Verbreitung von Krebserkrankungen in Deutschland. Entwicklung der Prävalenzen zwischen 1990 und 2010. Beiträge zur Gesundheitsberichterstattung des Bundes. Robert Koch- Institut, ed. Robert Koch- Institut Berlin. 124–131 (2010). 104 Literaturverzeichnis [6] Bhatia KSS, Rasalkar DD and Ahuja AT: Thyroid Elastography. Ultrasound of the Thyroid and Parathyroid Glands. R.A. Sofferman and A.T. Ahuja, eds. Springer. 263–281 (2012). [7] Bhatia KSS, Rasalkar DP, Lee YP, Wong KT, King AD, Yuen HY and Ahuja AT: Cystic change in thyroid nodules: a confounding factor for real-time qualitative thyroid ultrasound elastography. Clinical radiology. 66, 799–807 (2011). [8] Bojunga J: Multicenterstudie zur Evaluation der Realtime-Elastographie für die Differenzierung von Schilddrüsenknoten. Studienprotokoll. Unveröffentlichte Befunde. [9] Bojunga J, Dauth N, Berner C, Meyer G, Holzer K, Voelkl L, Herrmann E, Schroeter H, Zeuzem S and Friedrich-Rust M: Acoustic radiation force impulse imaging for differentiation of thyroid nodules. PloS one. 7, e42735 (2012). [10] Bojunga J, Herrmann E, Meyer G, Weber S, Zeuzem S and Friedrich-Rust M: Real-time elastography for the differentiation of benign and malignant thyroid nodules: a meta-analysis. Thyroid : official journal of the American Thyroid Association. 20, 1145–1150 (2010). [11] Brito JP and Davies L: Is there really an increased incidence of thyroid cancer? Current opinion in endocrinology, diabetes, and obesity. 21, 405–408 (2014). [12] Brito JP, Gionfriddo MR, Al Nofal A, Boehmer KR, Leppin AL, Reading C, Callstrom M, Elraiyah TA, Prokop LJ, Stan MN, Murad MH, Morris JC and Montori VM: The accuracy of thyroid nodule ultrasound to predict thyroid cancer: systematic review and meta-analysis. The Journal of clinical endocrinology and metabolism. 99, 1253–1263 (2014). [13] Cakal E, Sahin M, Öztürk Ünsal I, Güngünes A, Akkaymak E, Özkaya EC, Bozkurt NC, Özbek M and Delibasi T: Elastography in the Differential 105 Literaturverzeichnis Diagnosis of Thyroid Nodules. Ultrasonic Imaging: http://uix.sagepub.com/content/early/2014/09/01/0161734614547542. (27.10.2014) [14] Cakir B, Aydin C, Korukluoğlu B, Ozdemir D, Sisman IC, Tüzün D, Oguz A, Güler G, Güney G, Kuşdemir A, Sanisoglu SY and Ersoy R: Diagnostic value of elastosonographically determined strain index in the differential diagnosis of benign and malignant thyroid nodules. Endocrine. 39, 89–98 (2011). [15] Calvete AC, Mestre JDB, Gonzalez JMR, Martinez ES, Sala BT and Zambudio AR: Acoustic radiation force impulse imaging for evaluation of the thyroid gland. Journal of ultrasound in medicine : official journal of the American Institute of Ultrasound in Medicine. 33, 1031–1040 (2014). [16] Campanella P, Ianni F, Rota CA, Corsello SM and Pontecorvi A: Quantification of cancer risk of each clinical and ultrasonographic suspicious feature of thyroid nodules: a systematic review and meta-analysis. European journal of endocrinology / European Federation of Endocrine Societies. 170, R203–R211 (2014). [17] Cantisani V, Lodise P, Grazhdani H, Mancuso E, Maggini E, Di Rocco G, D’Ambrosio F, Calliada F, Redler A, Ricci P and Catalano C: Ultrasound elastography in the evaluation of thyroid pathology. Current status. European Journal of Radiology. 83, 420–428 (2014). [18] Ciledag N, Arda K, Aribas BK, Aktas E and Köse SK: The utility of ultrasound elastography and MicroPure imaging in the differentiation of benign and malignant thyroid nodules. AJR. American journal of roentgenology. 198, W244–W249 (2012). [19] Cosgrove D, Piscaglia F, Bamber J, Bojunga J, Correas J-M, Gilja OH, Klauser AS, Sporea I, Calliada F, Cantisani V, D’Onofrio M, Drakonaki EE, Fink M, Friedrich-Rust M, Fromageau J, Havre RF, Jenssen C, Ohlinger R, Săftoiu A, Schaefer F and Dietrich CF: EFSUMB guidelines and recommendations on the clinical use of ultrasound elastography. Part 2: 106 Literaturverzeichnis Clinical applications. Ultraschall in der Medizin (Stuttgart, Germany : 1980). 34, 238–253 (2013). [20] Deutsche Gesellschaft für Allgemein- und Viszeralchirurgie- Chirurgische Arbeitsgemeinschaft Endokrinologie: Leitlinie “Operative Therapie benigner Schilddrüsenerkrankungen”:http://www.awmf.org/uploads/tx_szleitlinien/003002l_01.pdf. (10.01.2013) [21] Deutsche Gesellschaft für Ultraschall in der Medizin e.V.: http://www.degum.de/fileadmin/dokumente/presse/pressemitteilungen/PM_E lastografie_Dietrich.pdf. (27.03.2015) [22] Dietrich CF: Elastography, the new dimension in ultrasonography. Praxis. 100, 1533–1542 (2011). [23] Dighe M, Luo S, Cuevas C and Kim Y: Efficacy of thyroid ultrasound elastography in differential diagnosis of small thyroid nodules. European journal of radiology. 82, e274–e280 (2013). [24] Erbil Y, Barbaros U, Salmaslioglu A, Mete O, Issever H, Ozarmagan S, Yilmazbayhan D and Tezelman S: Effect of thyroid gland volume in preoperative detection of suspected malignant thyroid nodules in a multinodular goiter. Archives of surgery. 143, 558–563 (2008). [25] Frates MC, Benson CB, Doubilet PM, Kunreuther E, Contreras M, Cibas ES, Orcutt J, Moore FD, Larsen PR, Marqusee E and Alexander EK: Prevalence and distribution of carcinoma in patients with solitary and multiple thyroid nodules on sonography. The Journal of clinical endocrinology and metabolism. 91, 3411–3417 (2006). [26] Friedrich-Rust M, Meyer G, Dauth N, Berner C, Bogdanou D, Herrmann E, Zeuzem S and Bojunga J: Interobserver agreement of Thyroid Imaging Reporting and Data System (TIRADS) and strain elastography for the assessment of thyroid nodules. PloS one. 8, e77927 (2013). 107 Literaturverzeichnis [27] Friedrich-Rust M, Romenski O, Meyer G, Dauth N, Holzer K, Grünwald F, Kriener S, Herrmann E, Zeuzem S and Bojunga J: Acoustic Radiation Force Impulse-Imaging for the evaluation of the thyroid gland: a limited patient feasibility study. Ultrasonics. 52, 69–74 (2012). [28] Friedrich-Rust M, Sperber A, Holzer K, Diener J, Grünwald F, Badenhoop K, Weber S, Kriener S, Herrmann E, Bechstein WO, Zeuzem S and Bojunga J: Real-time elastography and contrast-enhanced ultrasound for the assessment of thyroid nodules. Experimental and clinical endocrinology & diabetes : official journal, German Society of Endocrinology [and] German Diabetes Association. 118, 602–609 (2010). [29] Fukuhara T, Matsuda E, Fujiwara K, Tanimura C, Izawa S, Kataoka H and Kitano H: Phantom experiment and clinical utility of quantitative shear wave elastography for differentiating thyroid nodules. Endocrine journal. 61, 615– 621 (2014). [30] Gietka-Czernel M, Kochman M, Bujalska K, Stachlewska-Nasfeter E and Zgliczyński W: Real-time ultrasound elastography - a new tool for diagnosing thyroid nodules. Endokrynologia Polska. 61, 652–657 (2010). [31] Grazhdani H, Cantisani V, Lodise P, Di Rocco G, Proietto MC, Fioravanti E, Rubini A and Redler A: Prospective evaluation of acoustic radiation force impulse technology in the differentiation of thyroid nodules: accuracy and interobserver variability assessment. Journal of ultrasound. 17, 13–20 (2014). [32] Gu J, Du L, Bai M, Chen H, Jia X, Zhao J and Zhang X: Preliminary study on the diagnostic value of acoustic radiation force impulse technology for differentiating between benign and malignant thyroid nodules. Journal of Ultrasound in Medicine: Official Journal of the American Institute of Ultrasound in Medicine. 31, 763–771 (2012). [33] Hampel R, Bennöhr G, Gordalla A and Below H: [Urinary iodine excretion in German adults in 2005 meets WHO target]. Medizinische Klinik (Munich, Germany : 1983). 104, 425–428 (2009). 108 Literaturverzeichnis [34] Hegedüs L: Clinical practice. The thyroid nodule. The New England journal of medicine. 351, 1764–1771 (2004). [35] Henrichsen TL, Reading CC, Charboneau JW, Donovan DJ, Sebo TJ and Hay ID: Cystic change in thyroid carcinoma: Prevalence and estimated volume in 360 carcinomas. Journal of clinical ultrasound : JCU. 38, 361–366 (2010). [36] Hitachi Medical Corperation: Real-Time Tissue Elastography. Benutzerhandbuch HI Vision Ascendus. Hitachi Medical Corporation. 14–16 (2010). [37] Horvath E, Majlis S, Rossi R, Franco C, Niedmann JP, Castro A and Dominguez M: An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management. The Journal of clinical endocrinology and metabolism. 94, 1748–1751 (2009). [38] Ianculescu V, Ciolovan LM, Dunant A, Vielh P, Mazouni C, Delaloge S, Dromain C, Blidaru A and Balleyguier C: Added value of Virtual Touch IQ shear wave elastography in the ultrasound assessment of breast lesions. European journal of radiology. 83, 773–777 (2014). [39] Ivanac G, Brkljacic B, Ivanac K, Huzjan R, Skreb F and Cikara I: Vascularisation of benign and malignant thyroid nodules: CD US evaluation. Ultraschall in der Medizin. 28, 502–506 (2007). [40] Kaatsch P, Spix C, Hentschel S, Katalinic A, Luttmann S and Stegmaier C: Ergebnisse nach ICD-10. Krebs in Deutschland 2009/2010. Robert KochInstitut and Gesellschaft der epidemiologischen Krebsregister in Deutschland. e.V., eds. Robert Koch-Institut Berlin. 16–111 (2013). [41] Kagoya R, Monobe H and Tojima H: Utility of elastography for differential diagnosis of benign and malignant thyroid nodules. Otolaryngology--head and neck surgery : official journal of American Academy of Otolaryngology-Head and Neck Surgery. 143, 230–234 (2010). 109 Literaturverzeichnis [42] Kim E-K, Park CS, Chung WY, Oh KK, Kim DI, Lee JT and Yoo HS: New sonographic criteria for recommending fine-needle aspiration biopsy of nonpalpable solid nodules of the thyroid. AJR. American journal of roentgenology. 178, 687–691 (2002). [43] Kwak JY, Han KH, Yoon JH, Moon HJ, Son EJ, Park SH, Jung HK, Choi JS, Kim BM and Kim E-K: Thyroid Imaging Reporting and Data System for US Features of Nodules: A Step in Establishing Better Stratification of Cancer Risk. Radiology. 260, 892–899 (2011). [44] Kwak JY and Kim E: Ultrasound elastography for thyroid nodules: recent advances. Ultrasonography (Seoul, Korea). 33, 75–82 (2014). [45] Levine RA: Ultrasound Elastography of the Thyroid. Thyroid Ultrasound and Ultrasound-Guided FNA. H.J. Baskin, D.S. Duick, and R.A. Levine, eds. Springer New York. 355–363 (2013). [46] Liang X-N, Guo R-J, Li S, Zheng Z-M and Liang H-D: Binary logistic regression analysis of solid thyroid nodules imaged by high-frequency ultrasonography, acoustic radiation force impulse, and contrast-enhanced ultrasonography. European review for medical and pharmacological sciences. 18, 3601–3610 (2014). [47] Lippolis P V., Tognini S, Materazzi G, Polini A, Mancini R, Ambrosini CE, Dardano A, Basolo F, Seccia M, Miccoli P and Monzani F: Is elastography actually useful in the presurgical selection of thyroid nodules with indeterminate cytology? The Journal of clinical endocrinology and metabolism. 96, E1826–E1830 (2011). [48] Lorenzen J, Sinkus R and Adam G: Elastography: Quantitative imaging modality of the elastic tissue properties. RoFo : Fortschritte auf dem Gebiete der Rontgenstrahlen und der Nuklearmedizin. 175, 623–630 (2003). 110 Literaturverzeichnis [49] Lyshchik A, Higashi T, Asato R, Tanaka S, Ito J, Mai JJ, Pellot-Barakat C, Insana MF, Brill AB, Saga T, Hiraoka M and Togashi K: Thyroid gland tumor diagnosis at US elastography. Radiology. 237, 202–211 (2005). [50] Mäder U, Reiners C, Schmid K-W and Verburg FA: Grundlagen, Klinik, Diagnose. Diagnostik, Therapie und Nachsorge des Schilddrüsenkarzinoms. C. Reiners, ed. Uni-Med Verlag Ag. 11–52 (2010). [51] Magri F, Chytiris S, Capelli V, Alessi S, Nalon E, Rotondi M, Cassibba S, Calliada F and Chiovato L: Shear wave elastography in the diagnosis of thyroid nodules: Feasibility in the case of coexistent chronic autoimmune Hashimoto’s thyroiditis. Clinical Endocrinology. 76, 137–141 (2012). [52] Maitra A: Endocrine System. Robbins Basic Pathology. V. Kumar, A.K. Abbas, and J.C. Aster, eds. Elsevier Saunders. 715–763 (2012). [53] Michels G and Jaspers N: Schilddrüse. Sonographie, organ- und leitsymptomorientiert: Grundlagen, Diagnostik, Differentialdiagnostik, Befundung, Dokumentation. G. Michels and N. Jaspers, eds. Springer Berlin Heidelberg. 197–207 (2011). [54] Monpeyssen H, Tramalloni J, Poirée S, Hélénon O and Correas J-M: Elastography of the thyroid. Diagnostic and interventional imaging. 94, 535– 544 (2013). [55] Moon W-J, Jung SL, Lee JH, Na DG, Baek J-H, Lee YH, Kim J, Kim HS, Byun JS and Lee DH: Benign and malignant thyroid nodules: US differentiation-multicenter retrospective study. Radiology. 247, 762–770 (2008). [56] Neuwirt C: Acoustic Radiation Force Imaging der Schilddrüse - Generierung von Normwerten mittels Virtual Touch Imaging Quantification. (Unveröffentlichte Befunde). [57] Ning C-P, Jiang S-Q, Zhang T, Sun L, Liu Y-J and Tian J-W: The value of strain ratio in differential diagnosis of thyroid solid nodules. European journal of radiology. 81, 286–291 (2012). 111 Literaturverzeichnis [58] Ophir J, Céspedes I, Ponnekanti H, Yazdi Y and Li X: Elastography: a quantitative method for imaging the elasticity of biological tissues. Ultrasonic imaging. 13, 111–134 (1991). [59] Papini E, Guglielmi R, Bianchini A, Crescenzi A, Taccogna S, Nardi F, Panunzi C, Rinaldi R, Toscano V and Pacella CM: Risk of malignancy in nonpalpable thyroid nodules: predictive value of ultrasound and color-Doppler features. The Journal of clinical endocrinology and metabolism. 87, 1941– 1946 (2002). [60] Park J-Y, Lee HJ, Jang HW, Kim HK, Yi JH, Lee W and Kim SH: A proposal for a thyroid imaging reporting and data system for ultrasound features of thyroid carcinoma. Thyroid : official journal of the American Thyroid Association. 19, 1257–1264 (2009). [61] Park SH, Kim SJ, Kim E-K, Kim MJ, Son EJ and Kwak JY: Interobserver agreement in assessing the sonographic and elastographic features of malignant thyroid nodules. AJR. American journal of roentgenology. 193, W416–W423 (2009). [62] Paschke R, Schmid KW, Gärtner R, Mann K, Dralle H and Reiners C: Epidemiology, pathophysiology, guideline-adjusted diagnostics, and treatment of thyroid nodules. Medizinische Klinik (Munich, Germany : 1983). 105, 80–87 (2010). [63] Pellegriti G, Frasca F, Regalbuto C, Squatrito S and Vigneri R: Worldwide increasing incidence of thyroid cancer: Update on epidemiology and risk factors. Journal of Cancer Epidemiology. 2013, 1–10 (2013). [64] Popoveniuc G and Jonklaas J: Thyroid nodules. The Medical clinics of North America. 96, 329–349 (2012). [65] Rago T, Santini F, Scutari M, Pinchera A and Vitti P: Elastography : New Developments in Ultrasound for Predicting Malignancy in Thyroid Nodules. J Clin Endocrinol Metab. 92, 2917–2922 (2007). 112 Literaturverzeichnis [66] Refaat R, Kamel A, Elganzory M and Awad NM: Can real-time ultrasound elastography using the color score and strain ratio differentiate between benign and malignant solitary thyroid nodules? The Egyptian Journal of Radiology and Nuclear Medicine. 45, 75–87 (2014). [67] Reiners C, Wegscheider K, Schicha H, Theissen P, Vaupel R, Wrbitzky R and Schumm-Draeger P-M: Prevalence of thyroid disorders in the working population of Germany: ultrasonography screening in 96,278 unselected employees. Thyroid : official journal of the American Thyroid Association. 14, 926–932 (2004). [68] Rossi M, Buratto M, Bruni S, Filieri C, Tagliati F, Trasforini G, Rossi R, Beccati MD, Degli Uberti EC and Zatelli MC: Role of ultrasonographic/clinical profile, cytology, and BRAF V600E mutation evaluation in thyroid nodule screening for malignancy: a prospective study. The Journal of clinical endocrinology and metabolism. 97, 2354–2361 (2012). [69] Rubaltelli L, Corradin S, Dorigo A, Stabilito M, Tregnaghi A, Borsato S and Stramare R: Differential diagnosis of benign and malignant thyroid nodules at elastosonography. Ultraschall in Der Medizin (Stuttgart, Germany: 1980). 30, 175–179 (2009). [70] Russ G, Bigorgne C, Royer B, Rouxel A and Bienvenu-Perrard M: The Thyroid Imaging Reporting and Data System (TIRADS) for ultrasound of the thyroid (Abstract). Journal de Radiologie. 92, 701–713 (2011). [71] Russ G, Royer B, Bigorgne C, Rouxel A, Bienvenu-Perrard M and Leenhardt L: Prospective evaluation of thyroid imaging reporting and data system on 4550 nodules with and without elastography. European Journal of Endocrinology. 168, 649–655 (2013). [72] Siemens Medical Solutions USA I: Anhang A Technische Beschreibung. Acuson S1000 Acuson S2000 Acuson S3000 Diagnose-Ultraschallsystem Gebrauchsanweisung. Siemens Medical Solutions USA Inc. A–15 (2012). 113 Literaturverzeichnis [73] Siemens Medical Solutions USA I: Anhang D Erweiterte Funktionsregler. Acuson S1000 Acuson S2000 Acuson S3000 Diagnose-Ultraschallsystem Gebrauchsanweisung. Siemens Medical Solutions USA, Inc. D 5–D 6 (2012). [74] Slapa RZ, Piwowonski A, Jakubowski WS, Bierca J, Szopinski KT, SlowinskaSrzednicka J, Migda B and Mlosek RK: Shear wave elastography may add a new dimension to ultrasound evaluation of thyroid nodules: case series with comparative evaluation. Journal of Thyroid Research. 2012, 1–6 (2012). [75] Sporea I: ARFI elastography for the evaluation of diffuse thyroid gland pathology: Preliminary results. World Journal of Radiology. 4, 174–178 (2012). [76] Sporea I, Vlad M, Bota S, Sirli RL, Popescu A, Danila M, Sendroiu M and Zosin I: Thyroid stiffness assessment by acoustic radiation force impulse elastography (ARFI). Ultraschall in der Medizin (Stuttgart, Germany : 1980). 32, 281–285 (2011). [77] Sun J, Cai J and Wang X: Real-time ultrasound elastography for differentiation of benign and malignant thyroid nodules: a meta-analysis. Journal of ultrasound in medicine : official journal of the American Institute of Ultrasound in Medicine. 33, 495–502 (2014). [78] Toshiba Medical Systems GmbH: http://www.toshiba- medical.de/ultraschall/aplio-500. (25.05.2012) [79] Trimboli P, Guglielmi R, Monti S, Misischi I, Graziano F, Nasrollah N, Amendola S, Morgante SN, Deiana MG, Valabrega S, Toscano V and Papini E: Ultrasound sensitivity for thyroid malignancy is increased by real-time elastography: a prospective multicenter study. The Journal of clinical endocrinology and metabolism. 97, 4524–4530 (2012). [80] Unlütürk U, Erdoğan MF, Demir O, Güllü S and Başkal N: Ultrasound elastography is not superior to grayscale ultrasound in predicting malignancy 114 Literaturverzeichnis in thyroid nodules. Thyroid : official journal of the American Thyroid Association. 22, 1031–1038 (2012). [81] Wang H, Brylka D, Sun L-N, Lin Y-Q, Sui G-Q and Gao J: Comparison of strain ratio with elastography score system in differentiating malignant from benign thyroid nodules. Clinical imaging. 37, 50–55 (2013). [82] Wang Y, Dan H-J, Dan H-Y, Li T and Hu B: Differential diagnosis of small single solid thyroid nodules using real-time ultrasound elastography. The Journal of international medical research. 38, 466–472 (2010). [83] Wei X, Li Y, Zhang S and Gao M: A Meta-analysis of thyroid imaging reporting and data system in the ultrasonographic diagnosis of 10,437 thyroid nodules. Head & Neck. 38, 309-315 (2016). [84] Wieczorek P: Applikationsspezialistin Ultraschalldiagnostik Siemens Healthcare (2012 persönliche Mitteilung). [85] Woliński K, Szkudlarek M, Szczepanek-Parulska E and Ruchała M: Usefulness of different ultrasound features of malignancy in predicting the type of thyroid lesions: a meta-analysis of prospective studies. Polskie Archiwum Medycyny Wewnętrznej. 124, 97–104 (2014). [86] Wong KT and Ahuja AT: Ultrasound of thyroid cancer. Cancer imaging : the official publication of the International Cancer Imaging Society. 5, 157–166 (2005). [87] Xing P, Wu L, Zhang C, Li S, Liu C and Wu C: Differentiation of benign from malignant thyroid lesions: calculation of the strain ratio on thyroid sonoelastography. Journal of ultrasound in medicine : official journal of the American Institute of Ultrasound in Medicine. 30, 663–669 (2011). [88] Xu J-M, Xu X-H, Xu H-X, Zhang Y-F, Zhang J, Guo L-H, Liu L-N, Liu C and Zheng S-G: Conventional US, US elasticity imaging, and acoustic radiation force impulse imaging for prediction of malignancy in thyroid nodules. Radiology. 272, 577–586 (2014). 115 Literaturverzeichnis [89] Zaleska-Dorobisz U, Kaczorowski K, Pawluś A, Puchalska A and Inglot M: Ultrasound elastography - review of techniques and its clinical applications. Advances in clinical and experimental medicine : official organ Wroclaw Medical University. 23, 645–655 (2014). [90] Zhang F-J, Han R-L and Zhao X-M: The value of virtual touch tissue image (VTI) and virtual touch tissue quantification (VTQ) in the differential diagnosis of thyroid nodules. European journal of radiology. 83, 2033–2040 (2014). 116 Anhang Volumen der Schilddrüse Tabelle 17: Diagnostische Werte (Mittelwert, Standardabweichung (STD), Median, Wertebereich) der Schilddrüsenvolumina von rechten und linken Schilddrüsenlappen (SDLappen), sowie das Gesamtvolumen der Schilddrüsen in Milliliter (ml). Aufgeführt für die Gruppe der Schilddrüsen mit benigner Läsion, Schilddrüsen mit maligner Läsion, sowie für die Gesamtanzahl der Schilddrüsen. In Klammern ist die jeweilige Fallzahl der Gruppe angegeben (n). In der letzten Zeile steht der errechnete p-Wert für die Differenzierung der Schilddrüsen mit benignen und malignen Läsionen anhand ihrer Volumina. Ausgewertet ist das Endkollektiv. Universitätsklinikum Ulm, 12/2012 - 06/2013. Schilddrüsen mit Schilddrüsen mit Gesamtanzahl der benigner Läsion maligner Läsion Schilddrüsen (n= 36) (n=5) (n=41) p-Wert Mittelwert ± STD; Median (Wertebereich) Volumen rechter SD- 27,2 ± 28,7 16,2 ± 14,9 25,8 ± 27,5 18,2 (0,2-127,2) 9,0 (5,9-42,0) 15,4 (0,2-127,2) 27,4 ± 38,2 7,4 ± 2,8 24,9 ± 36,3 13,4 (1,4-178,7) 7,9 (3,5-10,7) 10,7 (1,4-178,7) 54,5 ± 60,3 23,6 ± 16,0 50,8 ± 57,6 37,2 (1,6-305,9) 19,7 (9,4-50,9) 35,0 (1,6-305,9) 0,4372 Lappen (ml) Volumen linker SD- 0,0558 Lappen (ml) Volumen der SD gesamt (ml) 0,1202 117 Anhang Scherwellengeschwindigkeitsmessungen Tabelle 18: Diagnostische Werte (Mittelwert, Standardabweichung (STD), Median, Wertebereich) der Scherwellengeschwindigkeiten in Meter pro Sekunde (m/s) von Läsion und Schilddrüsenparenchym in den drei unterschiedlichen Schnittebenen und Skaleneinstellungen: Querschnitt 0,5-6,5 m/s und 0,5-9,0 m/s und Längsschnitt 0,5-6,5 m/s, aufgeführt für die unterschiedlichen histopathologischen Diagnosen der Läsion, sowie die für Gesamtanzahl. In Klammern ist die jeweilige Fallzahl der Histopathologien (n) angegeben. Für die Differenzierung von Läsion und Schilddrüsengewebe anhand der Scherwellengeschwindigkeiten sind in den einzelnen Histopathologien die p-Werte angegeben. Fettgedruckte p-Werte stellen signifikante Werte dar. Datenerhebung am Siemens Acuson S3000 Ultraschallgerät und Auswertung des Endkollektivs. Universitätsklinikum Ulm, 12/2012 - 06/2013. MikrofolliStrumaFollikulärPapilläres kuläres Gesamtanzahl knoten es Adenom Karzinom Adenom (n=53) (n= 30) (n=7) (n=6) (n=10) Mittelwert ± STD; Median (Wertebereich) Quer- Läsion 3,3 ± 0,9 2,9 ± 0,7 2,8 ± 0,4 3,6 ± 1,5 3,2 ± 0,9 (m/s) 3,1 (1,6-6,0) 2,7 (2,0-4,2) 2,8 (2,1-3,6) 3,6 (1,8-6,1) 2,9 (1,6-6,1) 2,7 ± 0,7 2,5 ± 0,6 2,9 ± 0,8 3,3 ± 0,6 2,8 ± 0,7 2,5 (1,5-4,2) 2,4 (1,6-3,6) 2,7 (2,0-4,1) 3,3 (2,6-4,0) 2,6 (1,5-4,2) p- Wert 0,0046 0,3506 0,8709 0,7313 0,0101 Läsion 3,6 ± 1,3 3,0 ± 1,0 2,8 ± 0,5 4,0 ± 2,4 3,4 ± 1,3 3,1 (1,5-7,5) 3,0 (1,9-4,8) 2,8 (2,1-3,8) 3,7 (1,8-8,4) 3,0 (1,5-8,4) 2,9 ± 1,0 2,4 ± 0,5 2,7 ± 0,7 3,7 ± 1,1 2,9 ± 1,0 2,7 (1,7-7,0) 2,3 (1,8-3,5) 2,6 (2,0-4,6) 3,3 (2,7-5,5) 2,7 (1,7-7,0) p- Wert 0,0320 0,2661 0,7171 0,7865 0,0280 Läsion 3,4 ± 1,1 2,6 ± 0,8 2,9 ± 1,0 3,3 ± 1,9 3,2 ± 1,2 3,1 (1,2-6,3) 2,9 (1,1-3,2) 2,8 (1,8-5,6) 2,5 (1,6-6,1) 2,9 (1,1-6,6) 2,5 ± 0,5 2,4 ± 0,4 2,6 ± 0,6 2,9 ± 0,5 2,6 ± 0,5 2,5 (1,7-3,6) 2,3 (1,8-3,0) 2,6 (1,8-3,7) 2,7 (2,4-3,5) 2,6 (1,7-3,7) 0,0010 0,6288 0,4815 0,5660 0,0010 schnitt Schild- 0,5-6,5 drüse m/s (m/s) Quer- (m/s) schnitt Schild- 0,5-9,0 drüse m/s (m/s) Längs- (m/s) schnitt Schild- 0,5-6,5 drüse m/s (m/s) p- Wert 118 Anhang Tabelle 19: Diagnostische Werte (Mittelwert, Standardabweichung (STD), Median, Wertebereich) der Scherwellengeschwindigkeiten in Meter pro Sekunde (m/s) im gesunden Schilddrüsengewebe und in den Läsionen, die sich im gesunden Schilddrüsengewebe befinden, aufgeführt nach Schnittebene und Skaleneinstellung: Querschnitt 0,5-6,5 m/s und 0,5-9,0 m/s und Längsschnitt 0,5-6,5 m/s. Die Fallzahl ist in den Gruppen in Klammern (n) angegeben. Die letzte Spalte gibt den berechneten p-Wert für die Differenzierung des Schilddrüsengewebes und der Läsion anhand der Scherwellengeschwindigkeit an. Fettgedruckte p-Werte sind signifikante Werte. Datenerhebung am Siemens Acuson S3000 Ultraschallgerät und Auswertung der Subanalyse des Endkollektivs mit ausschließlich gesundem Schilddrüsenparenchym. Universitätsklinikum Ulm, 12/2012 - 06/2013. Gesundes SchilddrüsenKnoten (n=34) gewebe (n= 34) Mittelwert ± STD, Median (Wertebereich) Querschnitt 2,9 ± 0,7 3,1 ± 1,0 0,5-6,5 m/s 2,7 (1,9-4,1) 2,8 (1,6-6,1) Querschnitt 3,0 ± 1,1 3,3 ± 1,5 0,5- 9,0 m/s 2,7 (2,0-7,0) 2,8 (1,5-8,4) Längsschnitt 2,6± 0,5 3,0 ± 1,2 0,5-6,5 m/s 2,6 (1,7-3,7) 2,8 (1,1-6,3) p-Wert 0,0101 0,0280 0,0010 119 Anhang Tabelle 20: Diagnostische Werte (Fallzahl (n), Mittelwert, Standardabweichung (STD), Median, Wertebereich) der Scherwellengeschwindigkeiten in Meter pro Sekunde (m/s) der benignen und malignen Läsionen, sowie der Gesamtanzahl der Läsionen aufgeführt nach den unterschiedlichen Histologien des Schilddrüsengewebes: Gesundes Gewebe, Chronische Thyreoiditis und Hashimoto-Thyreoiditis. Die Scherwellengeschwindigkeiten wurden in den drei Schnittebenen und Skaleneinstellungen Querschnitt 0,5-6,5 m/s und 0,5-9,0 m/s und Längsschnitt 0,5-6,5 m/s am Siemens Acuson S3000 Ultraschallgeräte für das Endkollektiv erhoben. Die letzte Spalte gibt die errechneten p-Werte für eine Differenzierung der benignen und malignen Läsionen anhand ihrer Scherwellengeschwindigkeiten an. Universitätsklinikum Ulm, 12/2012 - 06/2013. Benigne Maligne Gesamt- Histologie Schilddrüse Gesund (m/s) Querschnitt Chronische 0,5-6,5 (m/s) m/s Thyreoiditis (n=6) (n=53) Knotenanzahl n, Mittelwert ± STD, Median (Wertebereich) p-Wert n=31 3,0 ± 0,9 2,8 (1,6-6,0) n=3 3,4 ± 2,3 2,3 (1,8-6,1) n=34 3,1 ± 1,0 2,8 (1,6-6,1) 0,5848 n=11 3,4 ± 0,8 3,3 (2,1-4,6) n=3 3,8 ± 0,4 3,9 (3,3-4,1) n=14 3,5 ± 0,8 3,5 (2,1-4,6) 0,5334 n=0 Gesund (m/s) n=31 3,2 ± 1,2 2,9 (1,5-7,5) n=3 4,2 ± 3,7 2,3 (1,8-8,4) n=34 3,3 ± 1,5 2,8 (1,5-8,4) 0,5848 n= 11 3,6 ± 1,0 3,3 (2,1-5,2) n=3 3,9 ± 0,4 4,0 (3,4-4,3) n=14 3,6 ± 0,9 3,7 (2,1-5,2) 0,5334 0,5-9,0 (m/s) Thyreoiditis Hashimoto-Thyreoiditis (m/s) n= 5 3,6 ± 1,1 3,1 (3,0-5,6) n=0 n=5 3,6 ± 1,1 3,1 (3,0-5,6) Gesund (m/s) n=31 2,9 ± 1,0 2,8(1,1-6,3) n=3 3,2 ± 2,5 2,0 (1,6-6,1) n=34 3,0 ± 1,2 2,8 (1,1-6,3) Längs- m/s (n=47) n=5 3,3 ± 0,7 3,1 (2,7-4,4) Chronische 0,5-6,5 anzahl n=5 3,3 ± 0,7 3,1 (2,7-4,4) schnitt schnitt Läsion Hashimoto-Thyreoiditis (m/s) Quer- m/s Läsion n=11 n=3 n=14 (m/s) 3,8 ± 1,3 3,1 (2,0-5,6) 3,4 ± 1,7 2,9 (2,0-5,4) 3,7 ± 1,3 3,1 (2,0-5,6) Hashimoto-Thyreoiditis (m/s) n=5 3,2 ± 0,6 3,3 (2,4-4,0) n=0 n=5 3,2 ± 0,6 3,3 (2,4-4,0) Chronische Thyreoiditis 0,5042 0,7552 120 Anhang Tabelle 21: Diagnostische Werte (Mittelwert, Standardabweichung (STD), Median, Wertebereich und 95%–Intervalle) der Scherwellengeschwindigkeiten in Meter pro Sekunde (m/s) für Schilddrüsengewebe mit benignen und Schilddrüsengeweben mit einer malignen Läsion, sowie für die Gesamtanzahl der Schilddrüsengewebe. Angegeben in Klammern ist die jeweilige Fallzahl der Gruppe (n): Erhoben sind die Daten in den drei unterschiedlichen Schnittebenen und Skaleneinstellungen: Querschnitt 0,5-6,5 m/s und 0,5-9,0 m/s und Längsschnitt 0,5-6,5 m/s am Siemens Acuson S3000 Ultraschallgerät für das Endkollektiv. In der letzten Spalte sind die p-Werte für die Differenzierung zwischen den Schilddrüsengeweben anhand der Scherwellengeschwindigkeiten angegeben. Fettgedruckte p-Werte stellen signifikante Werte dar. Universitätsklinikum Ulm, 12/2012 - 06/2013. Schilddrüsengewebe Schilddrüsengewebe Gesamt mit benigner Läsion mit maligner Läsion (n=53) (n=47) m/s (n= 6) m/s m/s Mean ± STD; Median (Wertebereich); 95%-Intervall Querschnitt 2,7 ± 0,7 3,3 ± 0,6 0,5-6,5 m/s 2,5 (1,5-4,2) 3,3 (2,6-4,0) (m/s) 2,5-2,9 2,7-4,0 Querschnitt 2,8 ± 0,9 3,7 ± 1,1 0,5-9,0 m/s 2,6 (1,7-7,0) 3,3 (2,7-5,5) (m/s) 2,5-3,1 2,5-5,0 Längsschnitt 2,5 ± 0,5 2,9 ± 0,5 0,5-6,5 m/s 2,5 (1,7-3,7) 2,7 (2,4-3,5) (m/s) 2,4-2,7 2,3-3,4 2,8 ± 0,7 2,6 (1,5-4,2) 2,9 ± 1,0 2,7 (1,7-7,0) 2,6 ± 0,5 2,6 (1,7-3,7) p-Wert 0,0365 0,0306 0,1089 121 Anhang Vergleichsstudien Tabelle 22: Studien, deren Material und Methodik und Ergebnis, die einen Vergleich der Realtime-Elastografie (RTE) und der Strain-Ratio (SR) an einem Hitachi Ultraschallgerät durchführten. Aufgeführt sind Studienerstautor, Publikationsjahr, Studientitel, Gesamtknotenanzahl, Anzahl der malignen Knoten, das verwendete Einteilungsschema der RTE, die gewählte Berechnung der SR und wenn angegeben, gewählte Schnittebene, Druck und Messtiefe. Im Ergebnisteil stehen die diagnostischen Werte Sensitivität (Sen) und Spezifität (Spe) der RTE und der SR mit berechnetem Cut-off-Punkt. (TA=Transverse Axis; LA=Longitudinal Axis; SCM= M. sternocleidomastoideus; SD=Schilddrüse) Studie Kagoya et al. (2010) Utility of elastography for differential diagnosis of benign and malignant thyroid nodules.[41] Cakir et al. (2011) Diagnostic value of elastosonographically determined strain index in the differential diagnosis of benign and malignant thyroid nodules.[14] Xing et al. (2011) Differentiation of benign from malignant thyroid lesions: calculation of the strain ratio on thyroid sonoelastography.[87] Ning et al. (2012) The value of strain ratio in differential diagnosis of thyroid solid nodules. [57] Material und Methodik Knotenanzahl gesamt: 47 Maligne Knoten: 11 RTE: 1,2/3,4 SR= Knoten/SCM RTE: Sen=73% Spe=64% SR: Cut-off-Punkt=1,5 Sen=90% Spe= 50% Knotenanzahl gesamt: 391 Maligne Knoten: 125 Druck: 3-4 RTE: 1,2,3/4,5 SR= SD-Parenchym/Knoten RTE: Sen=58,4% Spe=71,0% SR: LA Cut-off-Punkt=16,709 Sen=73,4% Spe= 70,0% TA Cut-off-Punkt= 8,817 Sen=61,3% Spe=63,5% Knotenanzahl gesamt: 98 Maligne Knoten: 45 Druck: 2-3 RTE: 1,2/3,4 SR= SD-Parenchym/ Knoten (auf gleicher Höhe gemessen) Knotenanzahl gesamt: 99 Maligne Knoten: 32 Druck: 2-4 SR= Knoten/SD-Parenchym (auf gleicher Höhe gemessen) Ünlütürk et al. (2012) Ultrasound elastography is not superior to grayscale ultrasound in predicting malignancy in thyroid nodules.[80] Knotenanzahl gesamt: 194 Maligne Knoten: 58 LA, Druck: 3-4 RTE: 1/2,3 (1. Subgruppe) 1,2/3 (2. Subgruppe) SR= SD-Parenchym/Knoten (keine Angabe zur Messtiefe) Cakal et al. (2014) Elastography in the Differential Diagnosis of Thyroid Nodules.[13] Refaat et al. (2014) Can real-time ultrasound elastography using the color score and strain ratio differentiate between benign and malignant solitary thyroid nodules?[66] Ergebnis RTE: Sen=88,8% Spe=81,1% SR: Cut-off-Punkt=3,79 Sen=97,8% Spe= 85,7% RTE: Cut-off-Punkt=3,5 Sen=82,4% Spe=71,6% SR: Cut-off-Punkt=4,225 Sen= 81,8% Spe= 82,9% RTE: 1. Subgruppe: Sen=78% Spe=44% 2. Subgruppe: Sen=67% Spe=78% SR: Cut-off-Punkt=2,1 Sen=69% Spe=67% Knotenanzahl gesamt: 601 Maligne Knoten: 29 RTE: 1,2,3/4,5 SR= SD-Parenchym/Knoten (keine Angabe zur Messtiefe) RTE: Sen=76% Spe=96% SR: Cut-off-Punkt=3,75 Sen= 83% Spe= 95% Knotenanzahl gesamt: 35 Maligne Knoten: 14 Druck: 3 RTE: 1,2,3/4,5 SR= SD-Parenchym/Knoten (Messung nicht auf gleicher Höhe) RTE: Sen=78,6% Spe=78,9% SR: Cut-off-Punkt: 2,20 Sen=85,7% Spe=90,5% 122 Anhang Tabelle 23: Studien, deren Material und Methodik und Ergebnis, die einen Vergleich der Realtime-Elastografie (RTE) und der Strain-Ratio (SR) an einem Toshiba Ultraschallgerät durchführten. Aufgeführt sind Erstautor, Publikationsjahr, Studientitel, die Gesamtknotenanzahl, die Anzahl der malignen Knoten, das verwendete Einteilungsschema der RTE, Berechnung der SR und wenn angegeben, die gewählte Messtiefe und Schnittebene. Im Ergebnisteil stehen die diagnostischen Werte Sensitivität (Sen) und Spezifität (Spe) der RTE und der SR mit berechnetem Cut-off-Punkt. (Kn=Knoten; TA=Transverse Axis) (*Nachträgliche Berechnung der Werte aus den Angaben in der Arbeit) Studie Ciledag et al. (2012) The utility of ultrasound elastography and MicroPure imaging in the differentiation of benign and malignant thyroid nodules. [18] Material und Methodik Knotenanzahl gesamt: 74 Maligne Knoten: 9 RTE: 1,2,3/4,5 SR= Kn/Muskel Knotenanzahl gesamt: 168 Comparison of strain ratio with elastography score system in differentiating malignant from benign thyroid nodules. [81] Maligne Knoten: 52 RTE: 1,2,3/4,5 SR= SD-Parenchym/Kn (in gleicher Tiefe gemessen) Comparison of muscle-to-nodule and parenchyma-to-nodule strain ratios in the differentiation of benign and malignant thyroid nodules: which one should we use? [3] RTE*: Sen 88,9% Spe 95,4% SR: Cut-off-Punkt= 2,31 Sen=85,7% Spe=82,1% (in gleicher Tiefe gemessen) Wang et al. (2013) Aydin et al. (2014) Ergebnis Knotenanzahl gesamt: 106 Maligne Knoten: 23 TA RTE: 1,2/3,4 SR 1= SD-Parenchym/Kn SR 2= Muskel/Kn (in gleicher Tiefe gemessen) RTE: Sen 84,6% Spe 78,5% SR: Cut-off-Punkt= 3,86 Sen=80,8% Spe=91,4% RTE: Sen=95,6%, Spe=50,6% SR 1: Cut-off-Punkt= 3,14 Sen=95,6% Spe=93,4% SR 2: Cut-off-Punkt= 1,85 Sen=95,6% Spe=92,8% 123 Anhang Tabelle 24: Studien, deren Material und Methodik und Ergebnis, die einen Vergleich der Programme Virtual Touch™ Imaging (VTI) und Virtual Touch™ Quantification (VTQ) durchführen. Aufgeführt sind Erstautor, Publikationsjahr, Studientitel, die Gesamtknotenanzahl, die Anzahl der malignen Knoten (mal. Kn), das verwendete Einteilungsschema und die Farbgebung der VTI, die gewählten Cut-off-Punkte der VTQ und die diagnostischen Werte Sensitivität (Sen) und Spezifität (Spe) von VTI und VTQ. Studie Calvete et al. (2014) Acoustic radiation force impulse imaging for evaluation of the thyroid gland. [15] Liang et al. (2014) Binary logistic regression anlysis of solid thyroid nodules imaged by highfrequency ultrasonography, acousitc radiation force impulse, and contrastenhanced ultrasonography. [46] Material und Methodik Knotenanzahl gesamt: 157 Maligne Knoten: 28 VTI: 1,2,3/4,5 (lila-rot) VTQ Knotenanzahl gesamt: 80 Maligne Knoten: 22 VTI: 1,2,3/4,5 (schwarz-weiß) VTQ: 1. Cut-off-Punkt für maligne Knoten 2. Cut-off-Punkt für benigne Ergebnis VTI: Sen=97,67% Spe=82,14% VTQ: 1. Cut-off-Punkt=2 m/s Sen=89,3% Spe=79,0% 2. Cut-off-Punkt=2,5 m/s Sen=85,7%, Spe=96,0% VTI: Sen=81,8%% Spe=82,8%% VTQ: 1. Cut-off-Punkt= 3,65 m/s 2. Cut-off-Punkt= 2,01 m/s Sen=77,3% Spe=55,5%% Knoten Xu et al. (2014) Conventional US, US elasticity imaging, and acoustic radiation force impulse imaging for prediction of malignancy in thyroid nodules. [88] Zhang et al. (2014) The value of virtual touch tissue image (VTI) and virtual touch tissue quantification (VTQ) in the differential diagnosis of thyroid nodules.[90] Knotenanzahl gesamt:441 Maligne Knoten: 116 VTI: 1,2,3/4,5,6 (schwarz-weiß) VTQ VTI: Sen=80,0% Spe=93,8% VTQ: Cut-off-Punkt=2,87 m/s Sen=71,6% Spe= 83,4% Knotenanzahl gesamt: 113 Maligne Knoten: 46 VTI: 1,2/3,4 (schwarz-weiß) VTQ VTI: Sen=95,6% Spe=89,6% VTQ: Cut-off-Punkt=2,9 m/s Sen=91,3% Spe= 85,1% Tabelle 25: Diagnostische Werte (Sensitivität, Spezifität, Positiver Vorhersagewert, Negativer Vorhersagewert) in Prozent der Arbeit von Bojunga et al. für die Realtime-Elastografie (RTE) und die ARFI basierte Scherwellenelastografie (ARFI= Acoustic Radiation Force Impulse). Bei der RTE wurden die Elastografiescores 1 und 2 als benigne und 3 und 4 als maligne definiert (1,2/3,4). Der gewählte Cut-off-Punkt der ARFI-Scherwellengeschwindigkeit beträgt 2,57 Meter pro Sekunde (m/s). Bojunga et al. (2012) Acoustic radiation force impulse imaging for differentiation of thyroid nodules. [9] RTE ARFI 1,2/3,4 Cut-off-Punkt=2,57 m/s Sensitivität (%) 76 57 Spezifität (%) 72 85 Positiver Vorhersagewert (%) 30 38 Negativer Vorhersagewert (%) 95 93 Diagnostische Werte 124 Anhang Tabelle 26: Studien, die die Scherwellengeschwindigkeit von Schilddrüsenparenchym, benignen und malignen Knoten untersucht haben. Genannt sind der Erstautor, das Publikationsjahr in Klammern und der Titel der Studie. Die mittleren Scherwellengeschwindigkeiten sind in Meter pro Sekunde (m/s) für das Schilddrüsenparenchym, benigne und maligne Knoten angegeben. Gu et al. und Grazhdani et al. führen für das Schilddrüsenparenchym zwei Geschwindigkeiten auf: die erste steht für das Schilddrüsenparenchym, das benigne Knoten enthält (benigne Kn), die zweite für Schilddrüsenparenchym mit malignen Knoten (maligne Kn). Studie Schilddrüsenparenchym Benigne Knoten Maligne Knoten Mittlere Scherwellengeschwindigkeit (m/s) Bojunga et al. (2012) Acoustic radiation force impulse imaging for differentiation of thyroid nodules. [9] 1,76 1,90 2,69 2,01 3,94 2,04 1,70 3,39 1,98 2,02 4,3 1,64 1,88 2,69 2,14 3,75 Gu et al. (2012) Preliminary study on the diagnostic value of acoustic radiation force impulse technology for differentiating between benign and malignant thyroid nodules. [32] 1,97 (benigne Kn)/ 2,07 (maligne Kn) Calvete et al. (2014) Acoustic radiation force impulse imaging for evaluation of the thyroid gland. [15] Friedrich-Rust et al. (2011) Acoustic Radiation Force Impulse-Imaging for the evaluation of the thyroid gland: a limited patient feasibility study. [27] Fukuhara et al. (2014) Phantom experiment and clinical utility of quantitative shear wave elastography for differentiating thyroid nodules. [29] Grazhdani et al. (2014) Prospective evaluation of acoustic radiation force impulse technology in the differentiation of thyroid nodules: accuracy and interobserver variability assessment. [31] 2,04 (benigne Kn)/ 2,10 (maligne Kn) 125 Danksagung Die Danksagung wurde aus Gründen des Datenschutzes entfernt. Lebenslauf Der Lebenslauf wurde aus Gründen des Datenschutzes entfernt.