Amenorrhö und andere Zyklusstörungen
Werbung
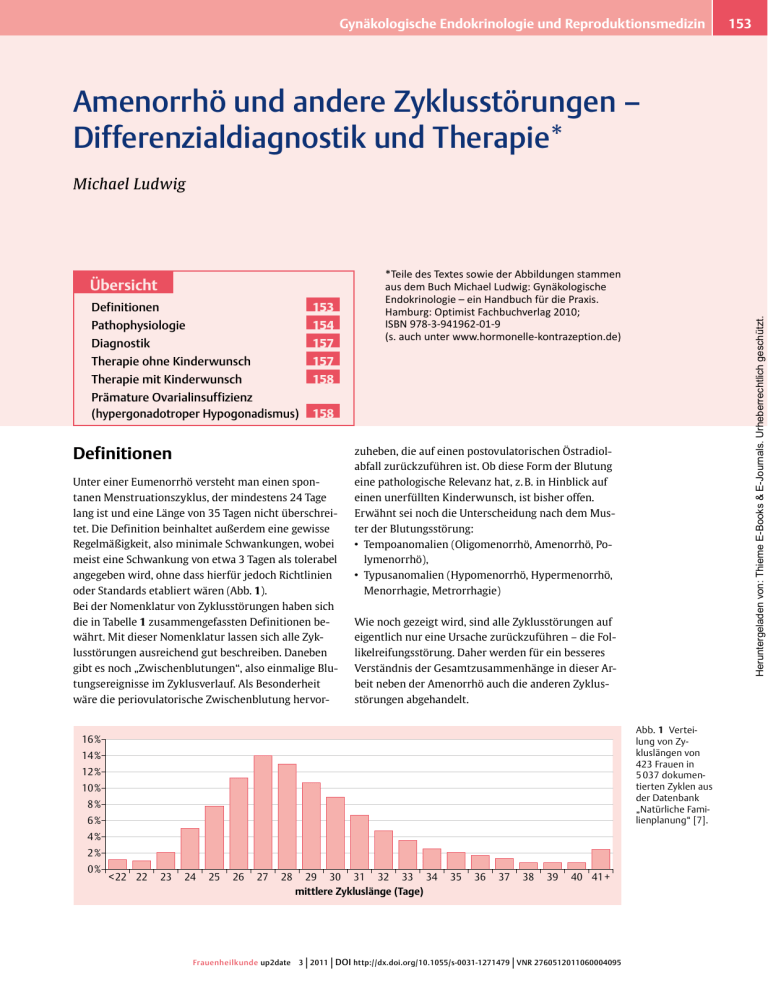
Gynäkologische Endokrinologie und Reproduktionsmedizin 153 Amenorrhö und andere Zyklusstörungen – Differenzialdiagnostik und Therapie* Michael Ludwig Definitionen 153 Pathophysiologie 154 Diagnostik 157 Therapie ohne Kinderwunsch 157 Therapie mit Kinderwunsch 158 *Teile des Textes sowie der Abbildungen stammen aus dem Buch Michael Ludwig: Gynäkologische Endokrinologie – ein Handbuch für die Praxis. Hamburg: Optimist Fachbuchverlag 2010; ISBN 978-3-941962-01-9 (s. auch unter www.hormonelle-kontrazeption.de) Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Übersicht Prämature Ovarialinsuffizienz (hypergonadotroper Hypogonadismus) 158 Definitionen zuheben, die auf einen postovulatorischen Östradiol­ Unter einer Eumenorrhö versteht man einen spon­ eine pathologische Relevanz hat, z. B. in Hinblick auf tanen Menstruationszyklus, der mindestens 24 Tage einen unerfüllten Kinderwunsch, ist bisher offen. abfall zurückzuführen ist. Ob diese Form der Blutung lang ist und eine Länge von 35 Tagen nicht überschrei­ Erwähnt sei noch die Unterscheidung nach dem Mus­ tet. Die Definition beinhaltet außerdem eine gewisse ter der Blutungsstörung: Regelmäßigkeit, also minimale Schwankungen, wobei •• Tempoanomalien (Oligomenorrhö, Amenorrhö, Po­ meist eine Schwankung von etwa 3 Tagen als tolerabel angegeben wird, ohne dass hierfür jedoch Richtlinien oder Standards etabliert wären (Abb. 1). lymenorrhö), •• Typusanomalien (Hypomenorrhö, Hypermenorrhö, Menorrhagie, Metrorrhagie) Bei der Nomenklatur von Zyklusstörungen haben sich die in Tabelle 1 zusammengefassten Definitionen be­ Wie noch gezeigt wird, sind alle Zyklusstörungen auf währt. Mit dieser Nomenklatur lassen sich alle Zyk­ eigentlich nur eine Ursache zurückzuführen – die Fol­ lusstörungen ausreichend gut beschreiben. Daneben likelreifungsstörung. Daher werden für ein besseres gibt es noch „Zwischenblutungen“, also einmalige Blu­ Verständnis der Gesamtzusammenhänge in dieser Ar­ tungsereignisse im Zyklusverlauf. Als Besonderheit beit neben der Amenorrhö auch die anderen Zyklus­ wäre die periovulatorische Zwischenblutung hervor­ störungen abgehandelt. Abb. 1 Vertei­ lung von Zy­ kluslängen von 423 Frauen in 5 037 dokumen­ tierten Zyklen aus der Datenbank „Natürliche Fami­ lienplanung“ [7]. ��� ��� ��� ��� �� �� �� �� �� ��� �� �� �� �� �� �� �� �� �� �� �� �� �� ��������������������������� | | �� �� �� �� | �� �� ��� Frauenheilkunde up2date 3 2011 DOI http://dx.doi.org/10.1055/s-0031-1271479 VNR 2760512011060004095 Amenorrhö und andere Zyklusstörungen – Differenzialdiagnostik und Therapie* Die Follikelreifungsstörung ist eigentlich in allen Fällen der ursächliche Grund von Zyklusstörungen. Hormonelle Ursachen von Zyklusstörungen •• eingeschränkte Ovarreserve •• zentrale Regulationsstörung Tabelle 1 •• Hyperandrogenämie (inkl. Hyperkortisolismus) Definition von Zyklusstörungen. •• Hyperprolaktinämie Störung Charakteristik •• Schilddrüsenfunktionsstörung Polymenorrhö Zykluslänge < 24 Tage Oligomenorrhö Zykluslänge > 35 Tage •• seltene endokrine Störungen (z. B. Akromegalie) Amenorrhö Ausbleiben der Menstruation für länger als 3 Monate (nach anderen Definitionen > 6 Monate) Hypomenorrhö zu schwache Menstruation •• organische Ursachen Organische Ursachen von Zyklusstörungen Hypermenorrhö zu starke Menstruation •• Uterus myomatosus Menorrhagie zu lange dauernde Menstruation (7 – 10 Tage) •• Endometriumpolyp Metrorrhagie Blutungsdauer > 10 Tage, kein Zyklus erkennbar •• Endometriumkarzinom •• extra-endometriale Blutung •• Zervixektopie Pathophysiologie •• Endometriose Die Nomenklatur ist insofern wichtig, als ein stabi­ ler und regelmäßiger Zyklus ohne prämenstruelle Auf­ fälligkeiten (prämenstruelles Spotting) eine regelmä­ ßige Ovulation im fertilen Alter hochwahrscheinlich macht (> 99 %) und damit die Diagnostik, z. B. bei Kin­ derwunschpatientinnen, deutlich verkürzen und ver­ einfachen kann [13]. Zyklusstörungen lassen sich auf wenige Ursachen zu­ rückführen, wobei man prinzipiell Probleme der en­ dokrinen Steuerung von organischen Ursachen un­ terscheiden muss. Insofern sollte jede Abklärung von Zyklusstörungen zumindest einmalig mit einer Trans­ vaginalsonografie zur Darstellung von Uterus und Ad­ nexen einhergehen, um entsprechende Pathologien erkennen zu können. Gegebenenfalls muss auch eine invasive Diagnostik gewählt werden, wenn die Sono­ grafie zur Diagnostik allein nicht ausreicht (Hystero­ skopie, ggf. Laparoskopie, Histologie). Die Abklärung jeder Zyklusstörung sollte eine Transvaginalsonografie beinhalten, da damit organische Ursachen erkannt und die Pathophysiologie mit geklärt werden kann. Die endokrinen Störungen lassen sich durch eine ge­ zielte Blutentnahme in Hauptgruppen einordnen; ggf. sind im 2. Schritt Funktionstests notwendig, um die Situation eindeutig differenzialdiagnostisch klären zu können. Hauptgruppen endokriner Störungen ■■ Hypogonadotroper Hypogonadismus Der hypogonadotrope Hypogonadismus zeichnet sich durch niedrige Gonadotropine aus und kann organisch bedingt sein (Hypophyseninfarkt im Rahmen eines Sheehan-Syndroms, Tumore), iatrogen (z. B. Radiatio des Schädels) oder angeboren (z. B. Kallmann-Syndrom). Daneben existiert der idiopathische hypogonadotrope Hypogonadismus. Wenn niedrige Gonadotropine, ins­ besondere ein niedriges LH, nicht durch eindeutige Ur­ sachen (Hyperprolaktinämie etc.) erklärbar sind, so muss ein GnRH-Test erfolgen, um die Stimulierbarkeit der Gonadotropine nachzuweisen. Wenn sich die Gona­ dotropine nicht adäquat stimulieren lassen, so ist eine bildgebende Diagnostik indiziert, um raumfordernde Prozesse intrakraniell nicht zu übersehen. Typisch sind die niedrigen Konzentrationen von LH und FSH. Fazit für die Praxis Bei einem hypogonadotropen Hypogonadismus müssen die Ursachen abgeklärt werden. Wenn keine eindeutigen Ursachen erkennbar sind (z. B. eine Hyperprolaktinämie oder Essstörung), ist ein GnRH-Test indiziert. Bei pathologischem GnRHTest muss eine bildgebende Diagnostik zum Ausschluss raumfordernder Prozesse erfolgen! | Frauenheilkunde up2date 3 2011 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 154 Gynäkologische Endokrinologie und Reproduktionsmedizin GnRH-Test Die Indikation besteht bei auffällig niedrigen Gonadotropinen zum Ausschluss organischer Ursachen, bzw. zur Differenzierung zwischen hypophysärer Ursache (kein Anstieg der Gonadotropine) und hypothalamischer Ursache (Anstieg der Gonadotropine). •• Blutentnahme für LH und FSH vor der Gabe des Medikaments •• Gabe von 0,1 mg GnRH i. v. (Relefact LH-RH 0,1 mg); die Patientin muss nicht nüchtern sein; der Test kann tageszeitunabhängig durchgeführt werden Essstörungen, Leistungssport oder Stress können ­Störungen hervorrufen, die dem hypogonadotropen Hypogonadismus gleichen. ■■ Hypergonadotrope Ovarfunktionsstörung Bei einer hypergonadotropen Ovarfunktionsstörung (prämature Ovarialinsuffizienz) finden sich hohe Go­ nadotropine als Ausdruck einer verminderten Fol­ likelzahl im Ovar. Die Messung von AMH zeigt ei­ nen niedrigen Spiegel. Die Situation ist häufig idiopa­ thisch, darüber hinaus kann es organische Ursachen im Bereich des Ovars geben (postoperativ, z. B. im Rahmen einer Endometriose, Radiatio des Unter­ bauchs) [12]. Postmenopausal ist die hypergonado­ •• Blutentnahme für LH und FSH nach 30 Minuten trope Ovarialinsuffizienz physiologisch. Typisch ist Es sollte sich ein Anstieg der Gonadotropine zeigen. Das Ausmaß des Anstiegs bei einem hypogonadotropen Hypogonadismus wird in der Literatur unterschiedlich wiedergegeben und schwankt zwischen dem mindestens 3-Fachen des Ausgangswerts bis zu einem Wert von 20 IE/l für LH. also das hohe FSH bei niedrigem Östradiol. LH kann Kontraindikationen bestehen bei Hypophysenadenomen und dem Risiko eines Hypophysenapoplex sowie in Schwangerschaft und Stillzeit. Ursache einer Amenorrhö können schließlich auch or­ normal oder erhöht sein. Weitere Ausführungen zur hypergonadotropen Ovarfunktionsstörung folgen weiter unten im Text. ■■ Organische Veränderungen ganische Veränderungen sein (Hymenalatresie, En­ dometriumatrophie im Sinne eines Ashermann-Syn­ droms nach Kürettagen, Endometriumatrophie nach ■■ Hypothalamisch-hypophysäre Dysfunktion Eine zentrale Regulationsstörung (hypothalamisch-hy­ pophysäre Dysfunktion) kann unterschiedlichste Ursa­ chen haben. Differenzialdiagnostisch geklärt werden müssen folgende Störungen: Radiatio des Unterbauchs, u. a.). Bei organisch beding­ ten Amenorrhöen zeigen sich keinerlei hormonelle Auffälligkeiten, solange die Ovarien intakt sind (an­ sonsten s. o. unter hypogonadotroper Ovarfunktions­ störung). Überlegungen zur Systematik der Einleitung •• Hyperandrogenämie inkl. Hyperkortisolismus ■■ •• Hyperprolaktinämie Die WHO hat vor vielen Jahren die Amenorrhöen in •• Schilddrüsenfunktionsstörung •• seltenere endokrine Erkrankungen, wie z. B. Akro­ megalie [4] Daneben existiert die idiopathische zentrale Regula­ tionsstörung ohne weitere endokrine Auffälligkeit, die sich gelegentlich durch einen erhöhten LH-Tonus oder durch auffällig niedrige LH-Spiegel äußert. Niedrige LH-Spiegel sind typisch für eine durch Stress induzierte zentrale Regulationsstörung oder eine solche, die ver­ ursacht wird durch Essstörungen bzw. Leistungssport. Diese 3 Belastungen (Essstörungen, Leistungssport, Stress) können zu einer endokrinen Konstellation füh­ ren, die dem hypogonadotropen Hypogonadismus gleicht. Funktionell gehören diese Störungen jedoch in die Gruppe der hypothalamisch-hypophysären Dys­ funktion. Eine typische Hormonkonstellation gibt es 155 unterschiedliche Typen unterteilt, die im Wesentli­ chen die hier wiedergegebene Einteilung widerspie­ geln (Tab. 2). Die WHO hat allerdings die hyperprolak­ tinämisch bedingte Amenorrhö in 2 zusätzliche Grup­ pen eingeteilt: •• Hyperprolaktinämie mit Prolaktinom •• Hyperprolaktinämie ohne Prolaktinom Funktionell handelt es sich um nichts anderes als eine hypothalamisch-hypophysäre Dysfunktion wie bei ei­ ner Schilddrüsenfunktionsstörung oder Hyperandro­ genämie auch. Funktionell gehört die Hyperprolaktinämie zur hypothalamisch-hypophysären Dysfunktion und nicht in eine separate Kategorie. nicht, insbesondere kann das LH niedrig, normal oder Der hypogonadotrope Hypogonadismus spielt nur bei erhöht sein. Daneben finden sich die ggf. verursachen­ der Abklärung der Amenorrhö eine Rolle. Andere der den Störungen (Hyperandrogenämie etc.). in Tabelle 1 genannten Zyklusstörungen werden da­ | Frauenheilkunde up2date 3 2011 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Amenorrhö und andere Zyklusstörungen – Differenzialdiagnostik und Therapie* durch nicht verursacht. Neben den verantwortlichen Funktionell handelt es sich bei Blutungen um eine der Regulationsstörungen (Tab. 2) kann man die Abklä­ beiden folgenden Formen: rung der Zyklusstörungen auch formal pathogenetisch •• Abbruchblutungen oder betrachten. Bei regelmäßigem Zyklus sind Probleme •• Durchbruchblutungen in der Blutungsstärke, insbesondere bei einer Hyper­ menorrhö, in aller Regel der Fälle organisch bedingt. Abbruchblutungen. Sie können nur nach einer Ovu­ Bei unregelmäßigen Zyklen können auch andere Ur­ lation mit nachfolgender Transformation des Endome­ sachen, wie die Anovulation, verantwortlich sein. Die triums auftreten. Auch im Rahmen einer Amenorrhö unterschiedlichen formalpathogenetischen Wege sind kann es zu Abbruchblutungen kommen, wenn nach in Tabelle 3 den verschiedenen Zyklusstörungen zuge­ mehrmonatiger ovarieller Funktionsruhe doch eine ordnet. Follikelreifung und konsekutiv eine Ovulation stattfin­ den mit Transformation des Endometriums und kon­ Follikelreifungsstörung. Unter einer Follikelreifungs­ sekutiver Menstruation. störung versteht man dabei z. B. eine hyperandrogen­ ämische Situation, eine Hyperprolaktinämie oder an­ Durchbruchblutungen. Alle anderen kausal pathoge­ dere Umstände, die dazu führen, dass der Follikel netischen Faktoren (Follikelpersistenz, Anovulation, keine adäquate Östrogenisierung in adäquatem Zeit­ Lutealphaseninsuffizienz) verursachen Durchbruch­ raum produziert. Auch die hypergonadotrope Ovarial­ blutungen, da die zur Verfügung gestellten Steroidhor­ insuffizienz kann dafür verantwortlich sein. monkonzentrationen nicht ausreichen, um das Endo­ metrium über ausreichend lange Zeit stabil zu halten. Anovulation. Bei einer Anovulation kommt es zwar zur Follikelreifung, der Follikel persistiert, eine Ovula­ tion läuft aber nicht ab. Lutealphaseninsuffizienz. Die Lutealphaseninsuffi­ Tabelle 2 Einteilung der Amenorrhöen nach der Klassifikation der WHO. zienz beschreibt ein relatives Progesterondefizit. Die Art der Amenorrhö Klassifikation Ovulation läuft ab, das Corpus luteum produziert je­ hypogonadotroper Hypogonadismus WHO I doch für das individuelle Endometrium zu wenig Pro­ hypothalamisch-hypophysäre Dysfunktion WHO II gesteron, um eine vollständige Transformation ausrei­ hypergonadotroper Hypogonadismus WHO III organische Ursachen WHO IV hyperprolaktinämisch bedingt WHO V/VI chend lange zu gewährleisten. Dies kann (!) sich in zu niedrigen Progesteronspiegeln (< 8 ng/ml) äußern. Bei der Lutealphaseninsuffizienz können auch völlig nor­ male Progesteronspiegel wiederholt gemessen werden bei dennoch bestehendem prämenstruellen Spotting. In diesen Fällen besteht ein wahrscheinlich endomet­ Tabelle 3 likelreifung in der 1. Zyklusphase, da das Corpus lu­ Formale Pathogenese von Zyklusstörungen. In der Tabelle ist bei der Menorrhagie und Metrorrhagie auch die Lutealphaseninsuffizienz aufgeführt. Bei exakter Klassifikation ist dies nicht korrekt, da bei einer Menorrhagie und Metrorrhagie die (postmenstruelle) Blutungsdauer verlängert ist. Klinisch kann die Falschdiagnose einer Lutealphaseninsuffizienz gestellt werden, wenn die z. B. 8 – 1 0 Tage lang andauernde Blutung in den ersten 3 – 4 Tagen als prämenstruell und in den restlichen Tagen als postmenstruell gedeutet wird. teum ein Produkt des gereiften und ovulierten Folli­ Polymenorrhö Follikelreifungsstörung Anovulation Lutealphaseninsuffizienz Menorrhagie, Metrorrhagie Follikelreifungsstörung Anovulation (ggf. Follikelpersistenz) (Lutealphaseninsuffizienz) Oligomenorrhö, Amenorrhö Follikelreifungsstörung rialer Rezeptordefekt, sodass höhere Progesterondosen am Endometrium notwendig sind, um das Endomet­ rium zu stabilisieren. Dies wurde bereits bei anderen Pathologien nachgewiesen [16]. Im Rahmen einer ver­ muteten Lutealphaseninsuffizienz bedarf es nicht nur einer Abklärung der Progesteronspiegel in der 2. Zyk­ lusphase, sondern unbedingt einer Abklärung der Fol­ kels ist. Eine Lutealphaseninsuffizienz ist, wie bereits oben angemerkt, bei einem stabilen, regelmäßigen, unauffälligen Zyklus extrem selten [13]. Wenn man die Ursachen der Zyklusstörungen inkl. der Amenorrhö genau betrachtet, dann lassen sich sämt­liche Formen auf Follikelreifungsstörungen zurückführen – auch die Anovulation und Lutealphaseninsuffizienz. | Frauenheilkunde up2date 3 2011 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 156 Gynäkologische Endokrinologie und Reproduktionsmedizin Diagnostik Da sich, wie dargestellt, formalpathogenetisch Follikel­ Die Diagnostik ergibt sich aus den Überlegungen der schiedensten Blutungsstörungen äußern können, ist Pathophysiologie. Die Diagnostik von Zyklusstörungen die einmalige komplette Abklärung in jedem Fall in­ sollte immer frühfollikulär erfolgen, zwischen Tag 3 diziert. 157 reifungsstörungen unterschiedlicher Ursache in ver­ und 5 des Zyklus, um eine optimale Aussage mit einer einmaligen Blutentnahme zu gewährleisten. Ggf. kann es hilfreich sein, während einer Blutungsstörung (z. B. Aus der Form und Klinik der Blutungsstörung kann sich eine Ursache in aller Regel der Fälle nicht ableiten lassen. im Rahmen einer Dauerblutung, Metrorrhagie) eine Blutentnahme durchzuführen, um zusätzlich zu dem sonografischen Bild eine Ursachenklärung kurzfristig Therapie ohne Kinderwunsch herbeizuführen (z. B. Durchbruchblutungen bei Folli­ Sobald eine therapierbare Ursache zu finden ist, sollte kelpersistenzen). diese auch behandelt werden (z. B. Hyperprolaktinä­ rogenämie). Viele Ursachen allerdings lassen sich nicht Fazit für die Praxis Zentrale Maßnahme zur Abklärung von Blutungsstörungen ist die frühfollikuläre Blutentnahme bzw. die Blutentnahme in der ovariellen Funktions­ ruhe. Dazu gehören die folgenden Parameter: kausal therapieren, so z. B. die hypergonadotrope Ova­ rialinsuffizienz oder die ovarielle Hyperandrogenämie. Tipp für die Praxis •• Östradiol Die kausale Therapie einer Blutungsstörung ist •• LH die beste Lösung. Wenn die kausale Therapie nicht möglich ist, ist meist ein kombiniertes ora- •• FSH les Kontrazeptivum die Therapie der Wahl. •• Testosteron •• DHEAS Die einfachste Therapie von Blutungsstörungen – in­ •• Prolaktin sofern nicht internistische oder andere Risiken dage­ •• TSH gen sprechen – besteht nach wie vor in der Gabe eines •• ggf. Androstendion kombinierten oralen Kontrazeptivums. Grundsätzlich •• ggf. Kortisol könnte man teilweise auch auf eine zyklische Gesta­ Die beiden letzten Parameter können, müssen aber gengabe zurückgreifen, dies ist jedoch in der Anwen­ nicht unbedingt hilfreich bei der Abklärung sein. dung komplizierter, da die Patientin in jedem Zyklus an die vorab festgelegten Einnahmezeiträume denken In Tabelle 4 sind die einzelnen Ursachen der Blutungs­ muss. Wenn man sich z. B. bei Hypermenorrhöen oder störungen mit den damit verbundenen, ggf. patholo­ Polymenorrhöen dennoch für eine Gestagentherapie gischen Parametern aufgelistet. Da bisweilen parallel entscheidet, ist die Dosierung des Gestagens zur Endo­ verschiedene Ursachen bestehen können bzw. verän­ metriumtransformation wichtig. Die Dosen und Prä­ derte Werte nicht unbedingt einen kausalen Zusam­ parate entsprechen denjenigen der zyklischen Gesta­ menhang bedeuten, sollte vor allem bei längerfristig gentherapie in der Perimenopause (Tab. 5). bestehenden Zyklusstörungen immer einmalig eine komplette Abklärung erfolgen. Tabelle 4 Auffällige Hormonparameter bei den verschiedenen Ursachen der Zyklusstörungen. Ursache Hormonparameter eingeschränkte Ovarreserve Östradiol, FSH, ggf. AMH zentrale Regulationsstörung Östradiol, FSH, LH Hyperandrogenämie (inkl. Hyperkortisolismus) Testosteron, DHEAS, ggf. Androstendion, ggf. Kortisol Hyperprolaktinämie Prolaktin Schilddrüsenfunktionsstörung TSH Bei der Wahl des Kontrazeptivums sollte Einphasenpräparaten mit 20 – 30 µg Ethinylöstradiol der Vorzug gegeben werden. Randomisierte Studien zu der Frage, ob einzelne Ges­ tagene vorteilhaft bei bestimmten Blutungsstörungen sind, gibt es nicht. Insofern sollte sich die Auswahl des Gestagens orientieren an den Bedürfnissen der Patien­ tin (z. B. antiandrogen). Eine Oligo- oder Amenorrhö perimenopausal bedarf kei­ ner Therapie, da es sich um eine physiologische Situ­ ation handelt. Ausgenommen davon sind v. a. überge­ wichtige Patientinnen mit einer Endometriumhyperpla­ | Frauenheilkunde up2date 3 2011 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. mie, Schilddrüsendysfunktionen, adrenale Hyperand­ Amenorrhö und andere Zyklusstörungen – Differenzialdiagnostik und Therapie* sie, bei denen eine dauerhafte Gestagentherapie (z. B. fig nur die ovarielle Stimulation zur Optimierung der 5 mg MPA 1 × täglich) zur Sicherstellung einer Endo­ Follikelreifung. Dies geht auch aus Tabelle 3 hervor, metriumtransformation vorteilhaft ist. Alternativ käme die zeigt, dass Follikelreifungsstörungen bzw. Anovu­ auch hier eine zyklische Gestagentherapie in Betracht. lationen für die meisten der Blutungsstörungen ver­ Prämenopausale Patientinnen mit einer Oligomenor­ antwortlich sind. Auch eine Lutealphaseninsuffizienz rhö oder Amenorrhö sollten mit einem kombinierten wird sich durch eine ovarielle Stimulation verbessern, oralen Kontrazeptivum therapiert werden, um folgen­ da ihre Ursachen ebenfalls in aller Regel in der Folli­ des sicherzustellen: kelphase liegen, sodass mit besserer Follikelreifung •• die regelmäßige Endometriumtransformation auch weniger Lutealphasenprobleme auftreten. Für •• eine ausreichende chronische Östrogenisierung (v. a. die meisten Zyklusstörungen ist eine Clomifentherapie bei hypothalamischen Amenorrhöen) ideal [15]. Wenn eine Patientin auf Clomifen nicht an­ spricht oder darunter z. B. eine suboptimale Endome­ Therapie mit Kinderwunsch triumentwicklung zeigt, wäre eine Gonadotropinsti­ mulation sinnvoll. Bei einem vorhandenen Kinderwunsch entfällt – ver­ ständlicherweise – die Möglichkeit des kombinierten oralen Kontrazeptivums. Auch eine zyklische Gesta­ gensubstitution wird symptomatisch, aber nicht kau­ Bei den meisten Zyklusstörungen ist die Clomifenstimulation bei bestehendem Kinderwunsch die erste Therapie. Konsekutiv kann man Gonadotropine einsetzen. sal, d. h. fertilitätssteigernd, wirken. Kausale Therapie sollte wo immer möglich erfolgen, so z. B. bei: •• Hyperprolaktinämie → Prolaktinhemmer •• Schilddrüsendysfunktionen → L-Thyroxin bzw. Thy­ reostatika •• adrenaler Hyperandrogenämie → Dexamethason Prämature Ovarialinsuffizienz (hypergonadotroper Hypogonadismus) •• ovarieller Hyperandrogenämie im Rahmen eines PCO-Syndroms und bestehender Adipositas → Met­ Die prämature Ovarialinsuffizienz (Premature ovarian formin im individuellen Heilversuch Insufficiency, POI) soll an dieser Stelle gesondert ab­ gehandelt werden, da sie differenzialdiagnostische Be­ Organische Ursachen für Blutungsstörungen müssen sonderheiten hat. Ferner muss man als Therapeut zu­ beseitigt werden. In allen anderen Fällen bleibt häu­ sätzliche Punkte bedenken. Tabelle 5 Möglichkeiten der zyklischen Gestagentherapie (mit freundlicher Genehmigung des optimist Fachbuchverlag, Hamburg, aus [11]). Gestagen Präparat Dosis und Dauer spezielle Indikation/Anmerkungen Medroxy­ progesteronacetat MPA Gyn 5 mg 5 mg für 12 Tage (= 1 Tablette) bei Follikelpersistenzen eher 10 mg für 10 Tage geben Dydrogesteron Duphaston 10 mg für 14 Tage (= 1 Tablette) Wenn ein möglichst natürliches Gestagen gewünscht wird bzw. medizinisch notwendig erscheint (kardiovaskuläre Problematik?). Für Follikelpersistenzen aufgrund schlechter hypophysärer Rückkoppelung ungeeignet. Chlormadinon­acetat Chlormadinonacetat 2 mg Jenapharm 2 mg für 12 Tage (= 1 Tablette) antiandrogen (allerdings bei zyklischer Therapie nur suboptimal antiandrogen wirksam) Cyproteronacetat Androcur 10 2,5 mg für 12 Tage (= ¼ Tablette) antiandrogen (allerdings bei zyklischer Therapie nur suboptimal antiandrogen wirksam) Progesteron (mikronisiert) Utrogest, Crinone 4 %, 8 % 2 Kps. Utrogest (à 100 mg) für 12 Tage oder Crinone 8 % für 12 Tage Für Therapie von Follikelpersistenzen aufgrund schlechterer hypophysärer Rückkoppelung eher nicht geeignet. Bei kontinuierlich kombinierter Therapie mit maximal 50 µg Östradiol transdermal oder 1 mg Östradiol oral sind 1 Kps. Utrogest bzw. Crinone 4 % täglich ausreichend. Norethisteron­acetat kein zugelassenes Präparat in Deutschland, nur per Rezeptur (5 mg) 5 mg über 12 Tage gut geeignet für Therapie von Follikelpersis­ tenzen (10 mg über 10 Tage) | Frauenheilkunde up2date 3 2011 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 158 Gynäkologische Endokrinologie und Reproduktionsmedizin Definition Unter einer prämaturen Ovarialinsuffizienz versteht man die vor dem 40. Lebensjahr spontan aufgetretene, häufig immunologisch bedingte oder iatrogen indu­ zierte (Chemotherapie, Radiatio, Operation) Einschrän­ kung der Eierstockfunktion mit hypergonadotropen Werten. Der ovarielle Follikelpool ist so stark reduziert, dass eine regelrechte Follikelreifung nicht mehr oder nur eingeschränkt ablaufen kann. Das klinische Bild ist das einer Amenorrhö mit den Problemen des Östro­ genmangels (relative Hyperandrogenämie, Hitzewal­ lungen etc.). Alternative Bezeichnungen wie „präma­ ture Menopause“ oder „frühzeitige Menopause“ bzw. „Klimakterium praecox“ oder „prämatures Ovarial­ versagen“ treffen die Situation nur unzureichend bzw. sind falsch und sollten vermieden werden [19]. Die Prävalenz eines POI liegt bei 10 – 28 % bei primä­ rer Amenorrhö und bei 4 – 18 % bei sekundärer Ame­ norrhö. Die Inzidenz beträgt 0,1 % bis zum Alter von 30 Jahren und 1 % bis zum Alter von 40 Jahren. Das ab­ solute Risiko liegt bei 10 : 100 000 Frauen in der Alters­ gruppe von 15 – 29 Jahren und bei 76 : 100 000 Frauen in der Altersgruppe von 30 – 39 Jahren [1, 6]. „Idiopathische“ prämature Ovarialinsuffizienz Ein Großteil der Fälle einer prämaturen Ovarialinsuffi­ zienz kann nicht aus der Anamnese (Operationen, En­ dometriose, Radio- oder Chemotherapie) erklärt wer­ den. Selten kann eine Oophoritis z. B. durch Mumps­ viren verantwortlich sein. Eine Chromosomenanalyse zum Ausschluss struktureller oder numerischer Ursa­ chen muss empfohlen werden. In den idiopathischen Fällen spielen häufig, wenn nicht sogar immer, immu­ nologische Vorgänge eine Rolle. Diese immunologi­ schen Ursachen können neben der Destruktion des Fol­ likelpools auch andere endokrine Organe betreffen, v. a. •• die Schilddrüse, •• das Pankreas und 159 Bei einer prämaturen Ovarialinsuffizienz muss alle 3 Jahre die Kontrolle von TSH, Kortisol sowie eines Nüchtern-Blutzuckers zum Ausschluss von Begleitendokrinopathien erfolgen. Die wichtigste Diagnostik ist der Ausschluss der Ne­ bennierenrindeninsuffizienz. Bis zu 10 % der Patien­ tinnen mit einer prämaturen Ovarialinsuffizienz kön­ nen einen Morbus Addison (Nebennierenrindeninsuf­ fizienz) entwickeln [5]. Die Prävalenz eines Diabetes mellitus bei Diagnose der prämaturen Ovarialinsuffizi­ enz liegt bei 2,5 % [3, 9]. Im Übrigen können selbstver­ ständlich auch Patientinnen mit einem Morbus Addi­ son häufiger eine prämature Ovarialinsuffizienz ent­ wickeln. Man geht von ebenfalls etwa 10 % aus [5]. Diagnostik einer prämaturen Ovarialinsuffizienz Die Wahrscheinlichkeit einer prämaturen Ovarialin­ suffizienz muss bei frühfollikulärer Blutentnahme und Östradiol < 50 pg/ml bei hohem FSH (> 20 IE/l) in Be­ tracht gezogen werden. Dies sollte aus der aktuellen Blutprobe mittels Messung von AMH validiert werden. Mindestens eine weitere Blutprobe in der frühen Fol­ likelphase oder der ovariellen Funktionsruhe sollte die Verdachtsdiagnose bestätigen. Dies dient v. a. dem Ausschluss einer Probenverwech­ selung. Im Anschluss sollte bei leerer Anamnese bzgl. eines ty­ pischen Auslösers die o. g. endokrinologische Differen­ zialdiagnostik erfolgen, um schwerwiegende Begleit­ endokrinopathien nicht zu übersehen. Folgen einer prämaturen Ovarialinsuffizienz ■■ Familienplanung Neben den hormonellen Folgen einer prämaturen Ovarialinsuffizienz kommt es zu einer hochgradigen •• die Nebennierenrinde. psychischen Belastung der betroffenen Patientin. Sie Daher müssen diese Organsysteme bei Diagnosestel­ stockfunktion maximal eingeschränkt ist – was insbe­ lung einer prämaturen Ovarialinsuffizienz durch eine sondere die weitere Familienplanung erschwert bzw. adäquate Analytik abgeklärt werden. Danach ist diese unmöglich macht. Die Praxis zeigt, dass man den Pa­ muss sich damit auseinandersetzen, dass ihre Eier­ Diagnostik alle 3 Jahre empfohlen, um später auftre­ tientinnen die Diagnose und die Folgen mehrmals aus­ tende Hormonausfälle frühzeitig erkennen und ggf. einandersetzen und detailliert erklären muss, bevor gegensteuern zu können. Abgeklärt werden sollten: sich ein komplettes Verständnis für die Problematik •• TSH, entwickelt hat. •• Kortisol, Bezüglich eines Kinderwunsches sind zahlreiche The­ •• optimal oGTT, alternativ (weniger aussagekräftig, rapien versucht worden, die allesamt keine relevante aber in der Praxis einfacher durchführbar) Nüch­ Steigerung der Schwangerschaftschancen erzielt ha­ tern-Blutzucker und HbA1c. ben. Erfolgversprechend zur Steigerung der Schwan­ | Frauenheilkunde up2date 3 2011 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Amenorrhö und andere Zyklusstörungen – Differenzialdiagnostik und Therapie* Kasuistik zum fallorientierten Lernen Eine 24-jährige amenorrhoische Pa- schießende Insulinsekretion mit man- gestartet (10 mg für 14 Tage). Als tientin mit einem Body-Mass-Index gelhaftem Abfall nach 2 Stunden. Die Alternative wäre aufgrund seiner von 35 kg/m² stellt sich zur Abklärung Glukosewerte sind grenzwertig patho- antiandrogenen Potenz z. B. auch in der Sprechstunde vor. Die Patien- logisch, der 2-Stunden-Wert erreicht Chlormadinonacetat 2 mg über tin berichtet, dass das Gewicht seit knapp das Niveau einer gestörten Glu- 12 Tage im Monat möglich gewesen. der Pubertät zugenommen habe. Fer- kosetoleranz. Hätte gleichzeitig die Notwendigkeit ner leide sie unter einer ausgeprägten Die Laboranalysen und die Klinik der einer Kontrazeption bestanden, so Akne sowie einem Hirsutismus. Seit ein paar Monaten habe sie zunehmend Schweißausbrüche gehabt. Patientin scheinen schlüssig zusam- hätte man über eine Hormonspi- menzupassen. In diesem Fall allerdings rale diskutieren können. Auch ein bestand eine prämature Ovarialisuffi- kombiniertes Kontrazeptivum wäre Aufgrund des Erscheinungsbildes der zienz – parallel zu dem PCO-Syndrom – infrage gekommen. Dann allerdings Patientin denken Sie an ein PCO-Syn- mit hypergonadotropen Werten: hätte die Patientin über das erhöhte drom und die Differenzialdiagnosen •• FSH 38 IE/l •• LH 26 IE/l der Hyperandrogenämie, insbesondere an einen 21-Hydroxylase-Mangel, sowie einen Hyperkortisolismus. Die Pati- •• Östradiol 47 pg/ml entin bringt bereits eine Laboruntersu- Zyklusstörungen, inkl. der Amenorrhö, chung mit, die in einer anderen Praxis sind unspezifische Folgen unterschied- vor wenigen Tagen durchgeführt wor- licher Formen der Follikelreifungsstö- den war: rung. Anhand der Zyklusstörung lässt •• Testosteron 0,9 ng/ml (< 0,6 ng/ml) sich die Ursache nicht eindeutig fest- •• Androstendion 5,2 ng/ml (< 3,5 ng/ml) •• DHEA-Sulfat 3 266 µg/l (< 3 500 µg/l) legen. Eine einmalige komplette Diagnostik ist daher unbedingt notwendig und sinnvoll. kardiovaskuläre Risiko aufgeklärt werden müssen. •• Trotz der Adipositas und des einmalig gemessenen Östradiols kann bei der Patientin kein chronischer Östrogenmangel ausgeschlossen werden. Insofern wurde konsequenterweise zu einer niedrig dosierten transdermalen Östrogenisierung geraten (50 µg Östradiol einmal pro Woche transdermal als Pflaster). Alternativ wäre auch ein Gel möglich gewesen •• Kortisol 128 ng/ml (< 195 ng/ml) Die Therapie in dem vorliegenden Fall (1 Hub Estreva/Gynokadin Gel pro Aufgrund dieser Hormonkonstellation bestand in verschiedenen Ansätzen: Tag). Ein chronischer Östrogenman- hatte man die Patientin bereits extern •• Wegen der bestehenden Insulin- gel lässt sich auch bei einer Adiposi- darüber aufgeklärt, dass es sich mit resistenz erhielt die Patientin „off tas nicht ausschließen, gelegentliche label“ im individuellen Heilversuch Laboranalysen sind nicht aussa- Metformin (2 × 1 000 mg/ Tag) nach gekräftig, um Schwankungen der dem Ausschluss von Kontraindika- Östradiolspiegel und damit einen Ferner vermuten Sie, dass die Schweiß- tionen. Parallel dazu wurde eine Mangel sicher auszuschließen. ausbrüche auf eine Hyperinsulinämie Ernährungsberatung begonnen mit Die prämature Ovarialinsuffizienz und zurückzuführen sind. Tatsächlich wird dem Ziel einer Kaloriennormalisie- das PCO-Syndrom stehen in keinem dies durch einen oGTT mit 75 g Glu- rung und Kohlenhydratreduktion. kose und eine Insulinbestimmung be- kausalen Zusammenhang. Die Insu- Die Patientin wurde motiviert, sich legt: ausreichend körperlich zu bewe- linresistenz wird die Patientin ihr Le- hoher Wahrscheinlichkeit um eine ovarielle Hyperandrogenämie auf dem Boden eines PCO-Syndroms handeln wird. nüchtern Glukose (ng/ml) 98 Insulin (mIE/l) 20 60 Mi­ nuten 120 Mi­ nuten 178 139 279 gen. •• Im Ultraschallbild fand sich ein hoch 225 ben lang begleiten, sodass eine Ernährungsumstellung sinnvoll ist. Bei sich entwickelndem Kinderwunsch kann aufgebautes Endometrium, passend die Patientin nur über eine Auslands- zu einer chronischen Östrogenisie- therapie (Eizellspende) aufgeklärt wer- rung bei bestehender Anovulation den. Eine Therapie im homologen Sys- und Amenorrhö. Daher wurde tem – d. h. unter Verwendung der Der HOMA-IR ist mit 4,35 bereits er- ein stoffwechselneutrales Gesta- eigenen Eizellen – ist nicht sinnvoll höht (> 2,5). Zudem besteht eine über- gen – Dydrogesteron – zyklisch und erfolgversprechend. | Frauenheilkunde up2date 3 2011 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 160 Gynäkologische Endokrinologie und Reproduktionsmedizin gerschaftschancen ist einzig eine Eizellspende, die auf­ grund der Gesetzgebung in Deutschland (Embryonen­ schutzgesetz) nicht möglich ist. Eizellspende. Bei einer Eizellspende wird eine meist junge Spenderin mit Gonadotropinen stimuliert, so­ dass mehrere Eizellen heranreifen. Diese Eizellen werden operativ gewonnen und mit den Spermien des Partners der Patientin zusammengeführt. Die so befruchteten Eizellen werden intrauterin trans­ feriert. Zur Vorbereitung der Empfängerin und zur Synchronisierung mit der Spenderin wird meist ein kombiniertes Hormonschema mit Östradioltabletten und Gesta­genpräparaten eingesetzt. Die Synchroni­ sierung ist notwendig, damit die betroffene Patientin ein Endometrium entwickelt, das zur Zeit des Emb­ ryotransfers – gesteuert durch exogene Gestagene – in einem „postovulatorischen“ Zustand mit offenem Einnistungsfenster ist: Das Einnistungsfenster ist zeitlich zu verstehen und beschreibt den Zeitraum, den ein Embryo zum Beginn seiner Implantation in das Endometrium nutzen kann. Die Eizellspende wird in unterschiedlichen europäischen Ländern an­ geboten. Spontankonzeption. Da eine Restovarfunktion häu­ fig noch vorliegt, kann eine Patientin mit prämaturer Ovarialinsuffizienz auch spontan schwanger werden. Dies gilt auch für die amenorrhoische Patientin, da am Ende einer Amenorrhö eine Ovulation mit konseku­ tiver Blutung – oder eben konsekutiver Schwanger­ schaft – stehen kann. Die Wahrscheinlichkeit für eine spontane Schwangerschaft liegt bei etwa 5 %. ■■ Östradiolmangel Das gesundheitlich schwerwiegendste Problem mit den langfristigsten Folgen ist der Östradiolmangel durch die reduzierte Ovarfunktion. Dies betrifft klini­ sche Beschwerden wie z. B. •• Hitzewallungen und •• Verlust an Knochendichte. Darüber hinaus besteht gelegentlich ein relativer Andro­ genüberschuss durch den Wegfall der Östradiolwirkung. Das klinische Hauptproblem einer Patientin mit prämaturer Ovarialinsuffizienz ist der Östradiolmangel mit Auswirkungen auf die Knochengesundheit und das Herz-Kreislauf-System. Es ist zu beachten, dass Patientinnen mit p ­ rämaturer Ovarialinsuffizienz sowohl eine Hyperandrogenämie [2] als auch einen Androgenmangel [18] aufweisen können. Insofern muss ein kombiniertes Kontrazepti­ vum auf den individuellen Bedarf der Patientin abge­ stimmt werden. In dem einen Fall sind eher antiandro­ gen wirksame Gestagene (Chlormadinonacetat, Cypro­ teronacetat, Dienogest, Drospirenon), in dem anderen androgen wirksame einzusetzen (Norethisteron, Le­ vonorgestrel). In aller Regel der Fälle wird die Östro­ genkomponente eines kombinierten Kontrazeptivums für die Therapie der Hormonausfallerscheinungen und für den Schutz des Knochens ausreichen. In individuellen Fällen beobachtet man allerdings trotz einer theoretisch ausreichend hohen Potenz des zu­ geführten Ethinylöstradiols ein Fortbestehen der Be­ schwerden. Wo in diesen Einzelfällen die Ursachen lie­ gen, ist bis heute nicht eindeutig geklärt. Möglicher­ weise bestehen Östrogenrezeptor-Polymorphismen, Kinderwunsch und prämature Ovarialinsuffizienz: Die spontane Schwangerschaftsrate liegt bei 5 %, eine aktive Kinderwunschbehandlung ist nur mit einer Eizellspende sinnvoll. 161 die zu einer unterschiedlichen Aktivität der verschie­ denen Östrogene im Gewebe führen. Tipp für die Praxis Wichtig ist die Beratung der Patientin im Hinblick Möchte eine Patientin noch die Möglichkeit einer auf die Knochengesundheit und die Protektion Konzeption nutzen, so sind hormonelle Kontrazep­ des kardiovaskulären Systems. tiva nicht indiziert. In dem Falle wäre eine kombi­ nierte Hormontherapie mit Gestagenen, die keine Dass die Knochendichte von einer Hormontherapie Ovulations­hemmung verursachen, vorzuziehen. Da­ mit Östrogenen profitiert, ist in der Literatur mittler­ bei sollte man Präparate bevorzugen, die ein östrogen­ weile unbestritten. Fraglich ist die Abwägung gegen­ freies Intervall haben, um die ovarielle Rückkopplung über potenziellen Risiken. Aus der Hormontherapie in auf die Hypophyse möglichst gering zu halten (z. B. der Perimenopause ist bekannt, dass eine frühzeitige ­Cycloprogynova N, Cyclo-Oestrogynal, Klimonorm, Therapie das kardiovaskuläre System schützt und Fol­ ­Sisare). Ob dies allerdings tatsächlich die Konzeptions­ geerkrankungen mindert [8, 10, 14, 17]. chancen weniger stark einschränkt als andere zykli­ Kritisch für die Hormontherapie ist der frühzeitige sche Präparate, die keine östrogenfreie Phase haben, Beginn nahe am Zeitpunkt der Menopause. Insofern ist wissenschaftlich nicht belegbar. kann man davon ausgehen, dass die jüngere Patien­ | Frauenheilkunde up2date 3 2011 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Amenorrhö und andere Zyklusstörungen – Differenzialdiagnostik und Therapie* tin mit prämaturer Ovarialinsuffizienz ebenso profi­ tieren wird, auch wenn ihr kardiovaskuläres System Tipp für die Praxis keine stoffwechselbedingten Veränderungen aufweist. Der Vorteil eines kombinierten Kontrazepti- Zusammengefasst sollte zur Entscheidung, ob eine Pa­ vums ist zweierlei: Zum einen kann die Patien- tientin mit prämaturer Ovarialinsuffizienz ein kombi­ tin ­sicher verhüten, sofern sie nicht schwan- niertes Kontrazeptivum erhält oder ein Hormonthera­ ger w ­ erden möchte. Zum anderen wird sie mit pie-Präparat, die individuelle Situation der Patientin ­einem altersentsprechenden Hormonpräparat berücksichtigt werden. behandelt und nicht durch die Einnahme ­eines Hormontherapie-Präparates nach außen hin Für die kardiovaskuläre Situation und die Osteoprotektion haben nach heutigem Wissensstand Hormontherapie-Präparate und kombinierte Kontrazeptiva dieselben Vorteile. �������������������������� ������ ���������� stigmatisiert. Abbildung 2 zeigt ein Schema zur Aufklärung der Pati­ entin mit prämaturer Ovarialinsuffizienz. ���������������������������������� �������������������� ����������� ������������������ ������������� ������������������ ��������� ����������������������� ������������������� ������������������� ����������� ��������������� ������������� ������������������������� ���������������� ������ ��������������������� ������������������� ������������������ �������� ������������������� ���������������� ����������������� ������������ ���������������� �������� �������������� �������� ��������� ������������ ������������ ��������������������������������������������� ��������������������������������� Abb. 2 Aufklärung der Patientin mit prämaturer Ovarialinsuffizienz. Weitere Endokrinopathien sind abzuklären: Nebennieren­ rinde (Kortisol), Schilddrüse (TSH), Diabetes mellitus Typ 1 (Glukose nüchtern, HbA1c, OGTT). (Abbildung mit freundlicher ­Genehmigung des optimist Fachbuchverlag Hamburg aus [11]). Über den Autor Kernaussagen Die Ursache von Zyklusstörungen sind Follikelreifungsstörungen unterschiedlicher Genese. Man kann sich die unterschiedlichen Formen der Zyklusstörung als Ausdruck des Schweregrades einer Follikelreifungsstörung denken. Die kausale Therapie ist die sinnvollste, sie ist jedoch nicht immer möglich. Im Falle einer non-kausalen Therapie ist bei der Amenorrhö die ausreichende Östrogenisierung im Fokus des Interesses. Ggf. besteht auch bei der Amenorrhö – wie bei anderen Zyklusstörungen – die Notwendigkeit einer Sicherstellung der ausreichenden Endometriumtransformation. Michael Ludwig Prof. Dr. med. Facharztausbildung an der Universität zu Lübeck (Prof. Dr. med. Klaus Diedrich). 2000 – 2 002 Leitung des Bereichs Gynäkologische Endokrinologie und Reproduktionsmedizin an der Universitätsfrauenklinik Lübeck. 2003 – 2 010 Endokrinologikum Hamburg. Seit 2011 amedes, dort klinische Tätigkeit als gynäkologischer Endokrinologe in Hamburg. Autor von über 100 wissenschaftlichen Arbeiten und zahlreichen Buchkapiteln; Autor verschiedener Bücher, u. a. zur ovariellen Stimulation, hormonellen Kontrazeption und gynäkologischen Endokrinologie. | Frauenheilkunde up2date 3 2011 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 162 Gynäkologische Endokrinologie und Reproduktionsmedizin Korrespondenzadresse Prof. Dr. med. Michael Ludwig Facharzt für Frauenheilkunde und Geburtshilfe Gynäkologische Endokrinologie und Reproduktionsmedizin amedes Zentrum für Endokrinologie – Kinderwunsch – Pränatale Medizin im Barkhof Mönckebergstraße 10 20095 Hamburg E-Mail: [email protected] Homepage: www.amedes-barkhof.de Literatur 1 Anasti JN. Premature ovarian failure: an update. Fertil Steril 1998; 70: 1 – 15 2 Bachelot A, Meduri G, Massin N et al. Ovarian steroidogenesis and serum androgen levels in patients with premature ovarian failure. J Clin Endocrinol Metab 2005; 90: 2391 – 2396 3 Belvisi L, Bombelli F, Sironi L, Doldi N. Organ-specific autoimmunity in patients with premature ovarian failure. J Endocrinol Invest 1993; 16: 889 – 892 4 Benker G, Epe M, Schulte HM, Ludwig M. Metabolische und endokrinologische Ursachen von Blutungsstörungen. Gynäkol Endokrinol 2007; 5: 80 – 86 5 Betterle C, Volpato M, Pedini B et al. Adrenal-cortex autoantibodies and steroid-producing cells autoantibodies in patients with Addison‘s disease: comparison of immunofluorescence and immunoprecipitation assays. J Clin Endocrinol Metab 1993; 84: 618 – 622 6 Coulam CB, Adamson SC, Annegers JF. Incidence of premature ovarian failure. Obstet Gynecol 1986; 67: 604 – 6 06 7 Frank-Herrmann P, Baur S, Gnoth C, Freundl G. 28 Tage sind nicht die Regel. ÄP Gynäkologie 2005: 30 – 32 163 8 Hsia J, Criqui MH, Herrington DM et al. Conjugated equine estrogens and peripheral arterial disease risk: the Women’s Health Initiative. Am Heart J 2006; 152: 170 – 176 9 Kim TJ, Anasti JN, Flack MR et al. Routine endocrine screening for patients with karyotypically normal spontaneous premature ovarian failure. Obstet Gynecol 1997; 89: 777 – 779 10 LaCroix AZ, Chlebowski RT, Manson JE et al. Health outcomes after stopping conjugated equine estrogens among postmenopausal women with prior hysterectomy: a randomized controlled trial. J Am Med Assoc 2011; 305: 1305 – 1314 11 Ludwig M. Gynäkologische Endokrinologie – Ein Handbuch für die Praxis. Hamburg: optimist Fachbuchverlag; 2010 12 Ludwig M, Jacobeit JW, Schroer A, Schulte HM. Prämature Ovarialinsuffizienz. Gynäkol Endokrinol 2004; 2: 227 – 239 13 Malcolm CE, Cumming DC. Does anovulation exist in eumenorrheic women? Obstet Gynecol 2003; 102: 317 – 318 14 Manson JE, Allison MA, Rossouw JE et al. Estrogen therapy and coronary-artery calcification. N Engl J Med 2007; 356: 2591 – 2602 15 Nawroth F. Anwendung von Clomifen zur ovariellen Stimulation. Gynäkol Endokrinol 2007; 5: 39 – 4 8 16 Pisarska MD, Carson SA, Casson PR et al. A mutated progesterone receptor allele is more prevalent in unexplained infertility. Fertil Steril 2003; 80: 651 – 653 17 Rossouw JE, Prentice RL, Manson JE et al. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. J Am Med Assoc 2007; 297: 1465 – 1477 18 van der Stege JG, Groen H, van Zadelhoff SJ et al. Decreased androgen concentrations and diminished general and sexual well-being in women with premature ovarian failure. Menopause 2008; 15: 23 – 31 19 Welt CK. Primary ovarian insufficiency: a more accurate term for premature ovarian failure. Clin Endocrinol (Oxf) 2008; 68: 499 – 509 | Frauenheilkunde up2date 3 2011 Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. Amenorrhö und andere Zyklusstörungen – Differenzialdiagnostik und Therapie* CME – Fragen 1 Welche Definition ist nicht korrekt? A B C D E 2 Welche Aussage ist korrekt? A B C D E 3 Eine Radiatio des Schädels kann zu einem hypogonadotropen Hypogonadismus führen. Eine Radiatio des Endometriums kann zu einer organischen Amenorrhö führen. Eine Radiatio der Ovarien kann einen hypergonadotropen Hypogonadismus zur Folge haben. Chemotherapien können, müssen aber nicht, zu einem hypergonadotropen Hypogonadismus führen. Chemotherapien führen weniger zu hypergonadotropen Störungen als vielmehr zur hypothalamisch-hypophysären Dysfunktion. Welche Hormonkonstellationen sind nicht typisch für die hypothalamisch-hypophysäre Dysfunktion? A B C D E 5 Ein prämenstruelles Spotting ist typisch für Metrorrhagien. Eine Zwischenblutung nennt man auch Metrorrhagie. Ovulationen treten bei Amenorrhöen niemals auf. Bei einem stabilen regelmäßigen Zyklus ohne prämenstruelles Spotting kann man von ovulatorischen Zyklen ausgehen. Blutungsdauern von bis zu 10 Tagen charakterisieren die Metrorrhagie. Welche Aussage zu onkologischen Therapien und Zyklusstörungen ist nicht korrekt? A B C D E 4 Unter einer Oligomenorrhö versteht man u. a. einen 6-wöchigen Zyklus. Blutungslängen von 8 – 9 Tagen fallen unter den Begriff „Menorrhagien“. Sehr starke Blutungen werden als „Metrorrhagie“ definiert. Bei Blutungen nur 2-mal pro Kalenderjahr handelt es sich um eine „Amenorrhö“. Die „Eumenorrhö“ bezeichnet den unauffälligen und regelmäßigen Zyklus. Hyperandrogenämie Schilddrüsendysfunktion Hyperprolaktinämie Gonadotropinmangel mit pathologischem GnRH-Test Hyperkortisolismus Was lässt sich über eine Lutealphaseninsuffizienz korrekterweise nicht sagen? A B C D E Das Progesteron kann, muss aber nicht < 8 ng/ml liegen. Das Progesteron ist immer niedrig, auch in der Mitte der Lutealphase. Die Ursache liegt meist in der Follikelphase. Differenzialdiagnostisch muss an organische Ursachen der Blutung gedacht werden. Es tritt ein prämenstruelles Spotting auf. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 164 Gynäkologische Endokrinologie und Reproduktionsmedizin – CME-Fragen Welche Zuordnung ist korrekt? A B C D E 7 Welchen Parameter benötigt man primär nicht bei der Abklärung einer Zyklusstörung? A B C D E 8 adrenale Hyperandrogenämie → Kortikosteroide Hyperprolaktinämie → Prolaktinhemmer prämature Ovarialinsuffizienz → Kortikosteroide Hypothyreosen → L-Thyroxin ovarielle Hyperandrogenämie → Clomifen Welche Aussage ist nicht korrekt? Die prämature Ovarialinsuffizienz . . . A B C D E 10 Östradiol FSH LH Prolaktin IGF1 Verschiedene Therapien bieten sich bei Kinderwunschpatientinnen mit Zyklusstörungen an. Welche Zuordnung ist nicht korrekt? A B C D E 9 Abbruchblutungen = Blutungen aus der Anovulation heraus Durchbruchblutungen = Blutungen aus dem transformierten Endometrium Amenorrhö = klassische Typusanomalie Metrorrhagie = klassische Tempoanomalie Oligomenorrhö = Folge einer Follikelreifungsstörung ist gekennzeichnet durch ein hohes FSH. geht einher mit einem Östrogenmangel. bedeutet eine absolute Sterilität. muss zur Abklärung von Begleitendokrinopathien führen. bedarf einer Hormontherapie bis zum mittleren Menopausenalter. Welche zyklische Gestagentherapie ist nicht sinnvoll? A B C D E 5 mg Medroxyprogesteronacetat über 12 Tage 10 mg Dydrogesteron über 14 Tage 2,5 mg Cyproteronacetat über 12 Tage 1 Kapsel mikronisiertes Progesteron (100 mg) über 8 – 10 Tage 2 mg Chlormadinonacetat über 12 Tage Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 6 165

