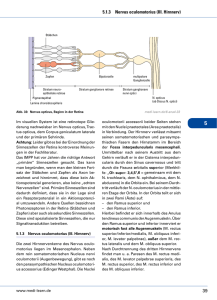
Einfluss einer Optical Coherence Tomograph-gesteuerten
Werbung

Aus der Klinik für Augenheilkunde mit Poliklinik der Friedrich-Alexander-Universität Erlangen-Nürnberg Direktor: Prof. Dr. Friedrich E. Kruse Einfluss einer Optical Coherence Tomograph-gesteuerten Referenzebene auf die semiautomatische Glaukomdiagnose des Heidelberg Retina Tomographen - ein Methodenvergleich. Inaugural-Dissertation zur Erlangung der Doktorwürde der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg vorgelegt von Mareike Steinhäuser aus Bamberg Gedruckt mit Erlaubnis der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg Dekan: Prof. Dr. med. Dr. h.c. Jürgen Schüttler Referent: Prof. Dr. Christian Mardin Korreferent: Prof. Dr. Friedrich E. Kruse Tag der mündlichen Prüfung: 13.03.2013 Meinen Eltern Luitgard und Gerhard Steinhäuser Inhaltsverzeichnis 1 Zusammenfassung 2 Abstract 3 Einleitung 3.1 Das Glaukom 3.1.1 Definition und Epidemiologie 3.1.2 Die Papille 3.2 Diagnostik 3.3 Fragestellung S.1 S.3 S.5 S.5 S.5 S.6 S.7 S.7 4 Methodik und Material 4.1 Patienten 4.1.1 Einteilung in Gruppen 4.1.2 Ausschlusskriterien 4.2 Heidelberg Retina Tomograph 4.2.1 Funktionsweise 4.2.2 Referenzebene 4.3 Spectralis-Domain Optical Coherence Tomograph 4.4 Vorgehensweise 4.5 Statistische Auswertung S.10 S.10 S.10 S.11 S.11 S.11 S.15 S.16 S.18 S.21 5 Ergebnisse 5.1 Messungen 5.2 Referenzhöhe 5.3 Randsaumfläche 5.4 Randsaumvolumen 5.5 Third moment 5.6 Exkavationsfläche 5.7 Exkavationsvolumen S.23 S.24 S.25 S.26 S.29 S.34 S.35 S.39 6 Diskussion 6.1 Die verschiedenen Referenzebenen 6.1.1 „Curved surface“ 6.1.2 320μm Referenzebene 6.1.3 Standard-Referenzebene 6.1.4 Moorfields Referenzebene 6.1.5 Experimentelle Referenzebene 6.1.6 OCT-gesteuerte Referenzebene 6.2 Mögliche Fehlerquellen 6.2.1 Konturlinie im HRT 6.2.2 Bildauswahl im SD-OCT 6.2.3 Messung im SD-OCT-Bild S.44 S.44 S.44 S.45 S.46 S.47 S.48 S.49 S.53 S.53 S.54 S.54 7 Ausblick 8 Literaturverzeichnis 9 Abkürzungsverzeichnis 10 Danksagung 11 Lebenslauf S.56 S.57 S.63 S.64 S.65 1 1 Zusammenfassung Hintergrund: Der Heidelberg Heidelberg) Retina findet Glaukomdiagnostik. Tomograph häufigen Die Lage (HRT, Einsatz der in Heidelberg der Engineering, morphometrischen Referenzebene beeinflusst als stereometrische Bezugsebene wesentlich die Berechnung der Parameter, die die topographischen Verhältnisse des Sehnervenkopfes beschreiben. Dementsprechend wichtig ist ihre exakte Position. Es wurde untersucht, welchen Einfluss eine OCT-gesteuerte Referenzebene mit Festlegung auf eine unverrückbare anatomische Grundlage auf die semiautomatische Glaukomdiagnose des HRT hat. Methode: Von 237 Augen, davon 89 Normale, 43 Okulär Hypertensive, 39 Präperimetrische Glaukome und 66 Perimetrische Glaukome, wurden HRTund SD-OCT-Aufnahmen (Spectralis Domain OCT, Heidelberg Engineering, Heidelberg) durchgeführt. Auf den OCT-Bildern wurde der temporale Abstand zwischen der retinalen Oberfläche und der Bruch´schen Membran als Bezugsebene gemessen. Mit Hilfe dieser Werte wurde die Referenzebene auf der HRT-Aufnahme korrigiert und die durch das HRT neu berechneten Parameter mit den Werten der Standardreferenzebene verglichen. Ergebnisse: Einige Parameter weisen gegenüber den Ausgangswerten eine höhere AUC und höhere Sensitivitäten auf. Vergrößerte korrigierte Werte tauchen insgesamt am häufigsten beim Randsaumvolumen auf (superior, Kontrollen vs. Präperimetrische: AUC 66% vs. 72%, Sensitivität 38% vs. 46%). Die höchsten Werte beobachtet man beim Vergleich der Normalen mit den Perimetrischen im inferioren Papillensegment (Randsaumvolumen: AUC 89% vs. 91%, Sensitivität 70% vs. 79%). Allerdings sind die Abweichungen der korrigierten Werte nur mäßig groß und nicht immer findet sich eine Zunahme der AUC im Vergleich zu den Standard-Werten (Exkavationsvolumen: 88% vs. 88%, Sensitivität 66% vs. 63%). 2 Schlussfolgerung: Durch die angewandte Methode kann keine eindeutige Verbesserung der Diskriminierungsfähigkeit des HRT zwischen Normalen und Glaukomen erreicht werden. Zukünftige Arbeiten müssen zeigen, ob in der Verlaufsbeobachtung die OCT-gesteuerte Referenzebene stabiler als der Standard ist. 3 2 Abstract Background: Scanning Laser Tomography (HRT, Heidelberg Engineering, Heidelberg) is a frequently used device in the diagnosis of glaucoma. Localization of the retinal surface derived reference plane heavily influences the calculation of parameters that describe topographical proportions of the optic disc. Purpose of this study was to evaluate the influence of an OCT guided reference plane which is fixed to a determined anatomical region on HRT´s semi-automatic diagnosis of glaucoma. Methods: 237 eyes including 89 healthy controls, 43 eyes with ocular hypertension, 39 preperimetric and 66 perimetric glaucomas were scanned with HRT and SD-OCT (Spectralis Domain Optical Coherence Tomograph, Heidelberg Engineering, Heidelberg). Temporal distance between retinal surface and Bruch´s membrane was measured on OCT images. With these values standard reference plane of HRT evaluation was modified and new HRT parameters were calculated. Differences of values for rim area, rim volume, third moment, cup area and cup volume were statistically analyzed using paired T-test or Wilcoxon test for subgroups and ROC curves. Results: For several parameters result higher AUC and an increased sensitivity in comparison to standard values. Overall the greatest values for new calculated parameters appear most frequent for rim volume (superior sector, controls vs. preperimetric glaucoma: AUC 66% vs. 72%, sensitivity 38% vs. 46%). Highest values are found when controls are compared with perimetric glaucoma for the inferior sector (rim volume: AUC 89% vs. 91%, sensitivity 70% vs. 79%). However, there are just moderate variations of corrected values and AUC is not always increasing in comparison to standard values (cup volume: 88% vs. 88%, sensitivity 66% vs. 63%). 4 Conclusion: OCT guided reference plane influences the calculation of topographical parameters of the optic disc, but there is no definite evidence for improved ability of HRT to separate normals from different glaucoma subgroups. Future studies have to show whether OCT guided reference plane is more stable versus standard reference plane in follow-up examinations. 5 3 Einleitung 3.1 Das Glaukom 3.1.1 Definition und Epidemiologie Das Glaukom ist eine Erkrankung des Auges, die mit einem spezifischen, fortschreitenden Nervenfaserverlust des N.opticus einhergeht und unbehandelt mit der Erblindung des betroffenen Auges endet. 2 bis 3% der Bevölkerung über dem 40.Lebensjahr und bis zu 7% über dem 70.Lebensjahr leiden weltweit an einer Glaukomerkrankung. In Deutschland leben mehr als 500.000 betroffene Menschen, wobei es sich bei 90% um ein sogenanntes Offenwinkelglaukom handelt. Weltweit leiden etwa 5 Millionen Menschen an einer glaukombedingten beidseitigen Blindheit (19; 34; 43; 47; 54). Das Glaukom stellt damit weltweit eine der häufigsten Ursachen für eine Erblindung dar. Man unterscheidet primäre und sekundäre Glaukome. Bei letzteren liegen spezifische äußere Einflüsse vor. Dazu gehören Verletzungen und Entzündungen des Auges, medikamentöse Therapien und bestimmte Grunderkrankungen wie Diabetes mellitus. Die sekundären Glaukome werden nach ihren ätiologischen Faktoren eingeteilt, die hier nicht einzeln aufgeführt werden (47). Bei den primären Glaukomen liegt die Ursache eher im Zusammenspiel mehrerer Faktoren. Die Erhöhung des Augeninnendruckes stellt dabei den Hauptrisikofaktor dar, wobei diese nicht bei allen Glaukompatienten nachgewiesen werden kann, so beim Normaldruckglaukom, und umgekehrt auch bei Menschen ohne glaukomatöse Veränderungen vorkommen kann. Man spricht dann von einer okulären Hypertension. Der normale Augeninnendruck liegt zwischen 10 und 21mmHg. Ab einem wiederholt gemessenen Wert von 22mmHg besteht bereits Glaukomverdacht. Weitere Formen sind das chronische Offenwinkelglaukom, der Glaukomanfall bzw. das akute Winkelblockglaukom und das chronische Winkelblockglaukom. Endstrecke in der Pathogenese aller Glaukome ist eine irreversible Atrophie des Sehnervs durch Untergang der retinalen Ganglienzellen mit peripher beginnenden Gesichtsfeldausfällen (15; 47). 6 3.1.2 Die Papille Die Papille (Papilla nervi optici, Sehnervenkopf) unterliegt beim Glaukom verschiedenen morphologischen Veränderungen. Schon in einem sehr frühen Stadium zeigen sich bei der Ophthalmoskopie parapapillär Ausfälle in der Nervenfaserschicht (47). Es kommt zu einem progredienten Nervenfaserund Perizytenverlust mit folgender Vergrößerung der Papillenexkavation, sodass die hinter der Papille befindliche Lamina cribrosa zunehmend sichtbar wird. Daher wird die Cup/Disc-Ratio, das Verhältnis von Exkavation zur Papillenfläche, als ein Faktor in der Glaukomdiagnostik angesehen. Von weiterer Bedeutung ist der fortschreitende Verlust des neuroretinalen Randsaumes, der nach Jonas klassifiziert und in die Evaluation einbezogen wird (22). Insgesamt kommt es zu einer Reduktion der Nervenfaserschichtdicke mit unterschiedlicher Ausprägung in einzelnen Sektoren. So konnte gezeigt werden, dass die Abgrenzung von gesunden Augen und Glaukomen mittels Raster-Tomographie präziser wird, wenn obere und untere Papillensegmente betrachtet werden, als wenn der globale Papillenrand oder einzelne temporale Sektoren einbezogen werden (12). Zudem verlagern sich die papillären Gefäße von zentral und knicken schließlich am Papillenrand ab (47). Auch Papillenrandblutungen können auftreten. Da die Papille beim Glaukom den Hauptort der pathologischen Prozesse darstellt, steht sie im besonderen Fokus aller Früherkennungsmaßnahmen und Verlaufskontrollen. Abb.1: Die Papille bei Glaukomprogression. Links: zentrale Exkavation mit noch normalen Gefäßen; Mitte links: tiefere Exkavation, die Lamina cribrosa wird stärker sichtbar, bogenförmiger Gefäßverlauf; Mitte rechts: dezentrierter Gefäßstamm und abgeknickte Gefäße; Rechts: randständige Exkavation mit Halo glaucomatosus. (nach 47) 7 3.2 Diagnostik Aufgrund der Symptomfreiheit zu Beginn der Erkrankung sowie der umfangreichen früh einsetzbaren Behandlungsmöglichkeiten nach Diagnosestellung erlangen vor allem Früherkennungsprogramme enorme Bedeutung. Mittels Untersuchung an der Spaltlampe kann die Beurteilung der Tiefe der Vorderkammer schon auf einen möglicherweise engen Kammerwinkel hinweisen. Dieser kann auch durch die Gonioskopie beurteilt werden. Entscheidend ist die Messung des Augeninnendrucks beispielsweise mit dem Applanationstonometer nach Goldmann und der Tonographie. Um einen bereits manifesten Glaukomschaden objektivieren zu können, wird die Perimetrie durchgeführt. Häufige Verwendung findet das Kugelperimeter nach Goldmann, bei dem die Empfindlichkeit für verschiedene Farben getestet wird. Dadurch können relativ bald Gesichtsfeldausfälle aufgedeckt werden, die der Patient selbst oft noch nicht wahrnimmt. Sie spielt eine entscheidende Rolle für die Verlaufskontrollen (47). Allerdings sind bereits 40 bis 50% der retinalen Strukturen um den Sehnervenkopf verloren gegangen, ehe die Perimetrie Auffälligkeiten zeigt (35; 42). Eine frühere Erkennung bieten beispielsweise der Frequenzverdopplungstest (FDT) und die BlauGelb-Perimetrie, sowie der Heidelberg Retina Tomograph (30; 34). Um die Papille selbst einsehen zu können, führt man die Ophthalmoskopie oder Fundoskopie durch. Durch eine Kontaktglasuntersuchung kann die Fundusperipherie beurteilt werden (21; 47). 3.3 Fragestellung Das Glaukom erzeugt klinisch detektierbare Veränderungen im Erscheinungsbild des Sehnerven und der Nervenfaserschicht aufgrund des Schadens, den es auf die retinalen Ganglienzellen ausübt. Das Bestreben, bereits einen frühen strukturellen Schaden und minimale Veränderungen in kurzen Intervallen zu entdecken, führte zur Entwicklung von BildanalyseSystemen, die die Topographie Nervenfaserschicht wiedergeben. des Sehnervenkopfes und der 8 Während früher vor allem fotographische Verfahren wie das Papillenstereofoto und die Nervenfaserschichtfotographie zur Anwendung kamen, um Sehnerv und Nervenfaserschicht im Verlauf objektiv beurteilen zu können, kommen heute zusätzlich hochentwickelte Geräte zum Einsatz, die nichtinvasiv mit Lasern minimale Strukturveränderungen am Augenhintergrund feststellen und in digitaler Form darstellen können (11; 46). Einen wesentlichen Fortschritt stellt die Laser-Scanning-Tomographie dar, die eine mikroskopische Darstellung in vivo und eine dreidimensionale Rekonstruktion der abgebildeten Strukturen ermöglicht. Die Topometrie, die dreidimensionale Nervenfaserschicht, Strukturanalyse liefert von quantitative Papille und Parameterdaten, retinaler mit denen morphologische Veränderungen beim Glaukom besser eingeordnet werden können und ein Fortschreiten der Erkrankung im Verlauf objektiviert werden kann (26). Der Heidelberg Retina Tomograph (HRT) hat sich damit bereits als Routineverfahren in der Glaukomfrüherkennung etabliert (18; 39). Mit der optischen Kohärenztomographie (OCT) wurde ein weiteres modernes Untersuchungsverfahren zur zwei- und dreidimensionalen Abbildung des Augenhintergrundes entwickelt. Es konnte gezeigt werden, dass diese Untersuchungsmethode eine starke Korrelation zwischen den abgebildeten Strukturen und den tatsächlichen funktionellen Verhältnissen aufweist (20; 28). Zudem zeichnet es sich durch gute Reproduzierbarkeit und geringe Variabilitäten zwischen verschiedenen Untersuchern und verschiedenen Untersuchungen aus (9; 57). Beide Untersuchungsmethoden liefern sowohl quantitative Daten zur Dicke der Nervenfaserschicht, als auch topographische Parameter des Sehnervenkopfes. Berechnungen von Parametern ohne festen Bezugswert können allerdings nur vage Auskunft über die anatomischen Verhältnisse geben. Daher wird eine Referenzebene benötigt, zu der alle weiteren gemessenen Parameter in Relation gesetzt werden können. 9 Dieser Referenzwert erleichtert den Vergleich von Bildern, die sich über die Zeit verändern und erlaubt multiple Messungen basierend auf einer einzigen Untersuchung, die in Kombination zu einem genaueren Ergebnis führen. Die Lage der Referenzebene muss dabei so gewählt sein, dass sie stabil gegenüber pathologischen Veränderungen ist. Die Diagnosestellung des HRT beruht auf der semiautomatischen Ermittlung einer Referenzebene, die das Einzeichnen einer Konturlinie durch den Untersucher erfordert. Sie ist keinesfalls fehlerfrei und stellt daher ein viel diskutiertes Thema in der Fachliteratur dar (3; 5; 7; 41; 44; 52; 53). Schon das Einzeichnen der Konturlinie nach subjektivem Ermessen stellt eine Fehlerquelle dar, auf der die Berechnung der Referenzebene und damit vieler stereometrischer Parameter beruht. Zudem setzt die Berechnung der Referenzebene nicht an einer anatomisch stabilen Struktur an, was unter bestimmten Bedingungen falsch positive und falsch negative Ergebnisse erzeugt. Die Standard-Referenzebene des HRT liegt definitionsgemäß im Bereich eines temporalen 6°-Sektors 50µm unterhalb der Konturlinie. Netzhaut und Papillenrand verlieren jedoch im Verlauf an Höhe, so dass die Referenzebene nicht stabil ist. Somit könnte vor allem in der Frühphase der Erkrankung eine Abweichung vom Normalzustand unterschätzt werden. Dies führte zu der Überlegung, ob durch nachträgliche Korrektur der Referenzebene eine bessere Differenzierung zwischen gesunden und glaukomatösen Papillen durch das HRT erreicht werden kann. Für möglichst zuverlässige Werte ist hierfür eine sehr genaue, quasi histologische Darstellung der Papille notwendig wie man sie bei dem SD-OCT vorfindet. Der Elschnig´sche Skleralring und das Ende der Bruch´schen Membran sind stabile Ankerstrukturen, die erstmalig mit der OCT-Technik in vivo darstellbar sind und damit in ihrer Lage zur Oberfläche messbar. Anhand dieser Bilder können anatomische Fixpunkte festgelegt werden, die zu einer genaueren Berechnung der Referenzebene führen. Ziel der Arbeit war es also herauszufinden, ob die Diskriminierung von „normal“ zu „pathologisch“ mit dem HRT mit Hilfe einer OCT-gesteuerten Referenzebene erhöht werden kann. 10 4 Methodik und Material 4.1 Patienten 4.1.1 Einteilung in Gruppen In die Studie wurden insgesamt 237 gesunde Probanden und Glaukompatienten eingeschlossen, wobei jeweils ein Auge ausgewählt wurde. Die Daten der Glaukompatienten stammen aus dem Erlanger Glaukomregister des Sonderforschungsbereiches 539 für Glaukom der Universitäts-Augenklinik Erlangen. Die gesunden Kontrollen waren zu einem Teil Patienten, die wegen Liderkrankungen oder anderen nicht Glaukom bedingten Beschwerden stationär in der Augenklinik waren, zum anderen Teil stammen sie ebenfalls aus der Liste der Normalprobanden des Glaukomregisters. Bedingung war die zeitnahe Untersuchung der Patienten mittels HRT (Heidelberg Retina Tomograph) und dem SD-OCT (Spectralis-Domain Optical Coherence Tomograph), bzw. unveränderte morphologische und klinische Ausprägung des Glaukoms bei längerem Zeitintervall zwischen den beiden Untersuchungsmethoden. Es wurden vier Untergruppen gebildet: 1. Gesunde Kontrollen, 2. Patienten mit okulärer Hypertension (OHT) ohne weitere glaukomatöse Veränderungen bei einem wiederholt gemessenen Intraokulardruck von mehr als 21mmHg, 3. Präperimetrische Glaukome, d.h. Glaukome ohne nachweisbare Gesichtsfeldausfälle Gesichtsfeld, aber in einem mit automatischen veränderter, 30° pathologischer weiß-weiß Papillen- morphologie, 4. Perimetrische Glaukome mit typischen Gesichtsfeldausfällen und glaukomatös veränderter Papille. 11 4.1.2 Ein- und Ausschlusskriterien Alle Patienten wurden standardgemäß untersucht mit Spalt- lampenbiomikroskopie, Applanationstonometrie, Fundoskopie, Gonioskopie, Hornhautpachymetrie, Perimetrie, HRT und SD-OCT. Ausgeschlossen wurden Patienten mit Diabetes mellitus und anderen systemischen Erkrankungen mit Augenbeteiligung. Der sphärische Refraktionsfehler beträgt zwischen -5,0 Dpt und +5,0 Dpt, der zylindrische weniger als 3 Dpt, der Visus mehr als 0,7. Die Werte (Gesichtsfeld Mean Defect) der Perimetrie betragen für die einzelnen Gruppen: Kontrollen 0,380 ± 0,774; OHT -0,597 ± 1,584; Präperimetrische Glaukome -0,053 ± 1,149; Perimetrische Glaukome 7,693 ± 6,428. Bei den gesunden Kontrollen war der Augendruck immer normal und lag auch zum Zeitpunkt der Untersuchung unter 21mmHg; es lag keine drucksenkende Medikation vor. Die Papille war vital und die Gesichtsfelder normal. Die familiäre Anamnese bzgl. Glaukom ist bei den Okulär Hypertensiven wie bei den Kontrollen leer. Alle Teilnehmer gaben ihr Einverständnis zu den genannten Untersuchungen. 4.2 Heidelberg Retina Tomograph 4.2.1 Funktionsweise Alle Augen wurden mit dem HRT (Heidelberg Retina Tomograph, Heidelberg Engineering, Dossenheim, Version 2.01), dem Vorläufermodell des HRT II untersucht. Abb.2: HRT, Augenklinik Erlangen 12 Hiermit können zwei- und dreidimensionale Bilder der Retina entworfen werden, die Aufschluss über mögliche Papillenveränderungen geben. Die in Studien beobachtete gute Reproduzierbarkeit und Korrelation mit perimetrischen Untersuchungen begründen den hohen Stellenwert, den das HRT in der Glaukomdiagnostik einnimmt (11; 26; 27; 36; 45; 56). Das Gerät arbeitet mit der sogenannten konfokalen Laser-Scan-Technik und verwendet einen Diodenlaser der Klasse I. Laser ist die Abkürzung für light amplification by stimulated emission of radiation, Lichtverstärkung durch stimulierte Emission. Hierbei werden nahezu parallele Lichtstrahlen mit extrem hoher Energiedichte ausgesandt (17). Der eingesetzte Laser sendet von der Kamera des HRT einen Lichtstrahl mit einer Wellenlänge von 675nm aus. Gleichzeitig enthält die Kamera einen Detektor, der die von Retinaoberfläche und Sehnervenkopf reflektierten Lichtstrahlen registriert. Die Reflexion am Augenhintergrund erfolgt auf einer Fokalebene, die durch das Gewebe bewegt wird, sodass mehrere Schnittbilder entstehen, die dann ein geschichtetes, dreidimensionales Bild ermöglichen. Für die zweidimensionalen Bilder kann ein Sichtwinkel von 10° x 10°, 15° x 15° oder 20° x 20° mit einer Auflösung von 256 x 256 Pixeln gewählt werden. Das entspricht einer Pixelgröße von 10μm – 26μm. Feinfokussierung und Scantiefe werden manuell eingestellt. Durch die Stärke des reflektierten Lichtes kann die Höhe der Retina berechnet werden. Je stärker die Reflexion in einem Areal ist, desto heller erscheint es im Reflektivitätsbild. Es entspricht einem Fundusfoto und kann für das Einzeichnen der Konturlinie hilfreich sein. Das Topographiebild enthält zusätzlich Informationen über die Höhe der abgebildeten Oberfläche, die es falschfarbencodiert anzeigt. Das heißt, dass den Helligkeitsstufen eines Farbtons verschiedene Farbwerte zugeordnet werden, um geringe Nuancen deutlicher darzustellen. Helle weiße oder gelbe Areale liegen tiefer und dunkle rote Areale höher. 13 Abb.3: HRT-Aufnahmen, links Reflektivitäts-Bild, rechts Topographie-Bild Zusätzlich wird ein Höhenprofil der Retinaoberfläche entlang der Konturlinie angezeigt, das von temporal nach superior-nasal-inferior-temporal verläuft und normalerweise eine zweigipflige Form annimmt, da die Nervenfaserschicht temporal oben und temporal unten am dicksten ist. Beim Glaukom flacht die Kurve dagegen ab, da v.a. superior und inferior atrophe Veränderungen stattfinden. Allerdings gibt es auch individuelle Variationen (6; 10; 11; 46). Mit Hilfe einer speziellen Software werden noch weitere Daten gesammelt und verarbeitet, sodass die Beurteilung der Papille nicht nur durch die visuelle Darstellung, sondern auch durch verschiedene Parameter erfolgt. Vor allem Papillenfläche, Exkavationsfläche und -volumen, Randsaumfläche und -volumen, mittlere Nervenfaserschichtdicke und cup/disc-ratio sind hier von Bedeutung. Da glaukomatöse Veränderungen nicht an jeder Stelle gleich ablaufen, wird der Sehnervenkopf in vier Sektoren unterteilt, sodass auch die Parameter einzelner Abschnitte im Verlauf beurteilt werden können. Nach Jonas nehmen der temporale Sektor 64°, der nasale 116° und der superiore und inferiore jeweils 90° ein (siehe Abb.4) (22). Neben der Berechnung der stereometrischen Parameter wird das Auge mit Hilfe der Mikelberg-Formel als „Normal“ oder „Glaukom“ klassifiziert (37). Hierfür werden Abweichungen von den Normwerten für Randsaumvolumen, Höhenvariation der Kontur und Exkavationsform herangezogen (55). 14 Abb.4: HRT-Parameter Die Software des HRT zeigt dennoch einige Schwachstellen, besonders wenn man die Sensitivität für morphologische Veränderungen mit der klinischen Beurteilung durch Experten vergleicht (38). Es kommt beispielweise vor, dass besonders große Papillen mit steiler Exkavation und hoher cup/disc-ratio irrtümlich als glaukomatös eingestuft werden. Grund ist die in der Mikelberg-Formel unberücksichtigte Papillengröße. So wird die Sensitivität des HRT reduziert (31; 32). Verbesserungen der Algorithmen für eine noch präzisere Differenzierung zwischen normalen und glaukomatösen Papillen sowie eine Vereinfachung bei der Festlegung der Konturlinie werden angestrebt und konnten teilweise mit dem HRT II bereits realisiert werden (11). 15 4.2.2 Referenzebene Die Referenzebene ist ein zentraler Parameter zur Beurteilung der Papille, denn sie liegt parallel zur Retinaoberfläche und trennt die somit definierte unterhalb liegende Exkavation vom oberhalb befindlichen neuroretinalen Randsaum. Die Fläche und das Volumen der Exkavation und des Randsaumes als Kriterien für die Diagnosestellung und als Marker für ein Fortschreiten der Glaukomerkrankung sind damit stark abhängig von der Referenzebene. Beim HRT liegt die Referenzhöhe, die Höhe der Referenzebene, stets 50μm unterhalb des Papillenrandes. Die Berechnung erfordert vorher das manuelle Einzeichnen einer Konturlinie um die Außengrenze des Sehnervenkopfes, das heißt den Innenrand des Elschnig´schen Skleralringes, durch einen erfahrenen Untersucher, sodass die Höhe des Papillenrandes gemittelt werden kann. Temporal Contour line Contour line 50 µm Nasal Reference plane Rim Cup Abb.5: Schematisches Bild der Lage der Referenzebene im HRT. Hellgrüne Pfeile: Lage der Konturlinie; Rote Linie: Standard-Referenzebene; schraffierte Flächen darüber: Randsaum; schraffierte Fläche unten: Exkavation. (freundlich zur Verfügung gestellt von Prof. Mardin) Ausgangspunkt ist jedoch nicht der gesamte Papillenrand, sondern nur der Bereich des Papillomakular-Bündels (350-356° bzw. -10° bis -4°). Dies hat den Hintergrund, dass hier zwar schon in frühen Stadien eine Abnahme der Nervenfaserschichtdicke stattfindet, die morphologischen Veränderungen im Verlauf einer Glaukomerkrankung jedoch am wenigsten ins Gewicht fallen, da der temporale Bereich von vornherein relativ dünn ist. So kann die Referenzebene von einem möglichst konstanten Punkt aus berechnet werden (11; 24). 16 Abb.6: HRT-Aufnahmen. Links: 6°-Sektor temporal; Rechts: eingezeichnete Konturlinie. (freundlich zur Verfügung gestellt von Prof. Mardin) Im Falle einer Reduktion der Nervenfaserschichtdicke in diesem Bereich bei Glaukompatienten nimmt der neuroretinale Randsaum fälschlicherweise zu hohe Werte an. Die Folge ist, dass das Auge möglicherweise als „Normal“ klassifiziert wird. 4.3 Spectralis-Domain Optical Coherence Tomograph Zusätzlich wurden alle Augen mit dem Spectral-Domain-OCT der Firma Heidelberg Engineering, Deutschland, untersucht. Vorgängermodell ist das Stratus-OCT oder TD-OCT (Time-Domain Optical Coherence Tomograph). Das neue Gerät kombiniert Heidelberg Retina Angiograph (HRA) und SDOCT Technologie (Spectralis-Domain Optical Coherence Tomograph). Es stellt ein weiteres Verfahren zur Darstellung des Augenhintergrundes dar. Im Vergleich zum TD-OCT konnten z.T. höhere Korrelationen zwischen Struktur und Funktion gefunden werden (28). Wie schon der Name sagt, werden ebenfalls Schnittbilder der Retina angezeigt, die auf vielfältige Weise visualisiert und verarbeitet werden können (25). Nach dem Prinzip der Weißlichtinterferometrie wird niedrig kohärentes Licht zur Entfernungsmessung genutzt (48). Als Lichtquelle dienen auch hier Diodenlaser, deren Lichtstrahl in zwei Anteile (Referenzstrahl und Messstrahl) gespalten wird. Ein Anteil des Lichtes wird von der Oberfläche des Augenhintergrundes reflektiert, der andere von einem Spiegel. 17 Die reflektierten Lichtstrahlen werden wieder aufgenommen, miteinander verglichen und in A-Scans umgerechnet (25). Abb.7: Spectralis-OCT, Augenklinik Erlangen So können unterschiedliche Tiefen, Dicken und Reflektivitäten der Retina wiedergegeben werden. Ähnlich dem B-Scan beim Ultraschall werden mehrere A-Scans aneinandergereiht und als Schnittbild der Retina angezeigt (55). Während sich beim Stratus-OCT der reflektierende Spiegel möglichst schnell mechanisch bewegt, um maximal 400 Scans pro Sekunde zu erreichen, können bei dem neuen Gerät mittels komplexer mathematischer Algorithmen, der sog. Fourier-Transformation, gleichzeitig alle Wellenlängen des von verschiedenen Schichten der Retina reflektierten Lichtstrahls durch ein Spektrometer aufgenommen und verarbeitet werden. So erfasst es nicht den zeitlichen Vergleich zwischen Referenz- und Messstrahl, sondern die Interferenz der einzelnen spektralen Komponenten (48). Damit ist die Bildaufnahme bis zu 100-mal schneller, d.h. es werden maximal 40.000 Scans pro Sekunde durchlaufen, was weniger Artefakte sowie eine höhere Auflösung zur Folge hat und dreidimensionale Darstellungen ermöglicht. Die optische Auflösung beträgt axial 7μm, die digitale 3,5μm. Im Gegensatz zum TD-OCT ist hier keine Mydriasis für eine bessere Aufnahmequalität mehr notwendig. 18 Abb.8: OCT-Aufnahmen: oben normale Papille, unten perimetrisches Glaukom (1:1µm Abbildung) Zur Reduktion von Artefakten kommt zusätzlich die sogenannte Eye Tracking Technologie zum Einsatz. Sie gewährleistet, dass mehrere Scans von der exakt gleichen Position aufgenommen und gemittelt werden und so Augenbewegungen des Patienten als Störfaktor wegfallen (25). 4.4 Vorgehensweise Zunächst wurden anhand des Erlanger Glaukomregisters geeignete Patienten und Normalprobanden ausgewählt, die die oben genannten Kriterien erfüllten. Es wurde eine Untersuchung mittels OCT durchgeführt und - sofern keine aktuelle Untersuchung vorlag - mittels HRT. 19 Pro Patient wurde ein Auge ausgewählt, bei dem die bessere Bild-Qualität erzielt wurde oder welches im Glaukomregister als „Auswahlauge“ vermerkt war. HRT-Untersuchung: Der Patient hält den Kopf auf einer Kopf- und Kinnstütze gerade und blickt geradeaus, indem er mit dem Auge das Lasersignal der Kamera im HRT fixiert. Das Gerät wird so eingestellt, dass das Licht zentral die Pupille erreicht und der Sehnervenkopf erfasst wird. Auf dem Monitor können die aktuellen Bilder des Augenhintergrundes verfolgt werden. Das Bild sollte gleichmäßig ausgeleuchtet sein; die individuelle Feinfokussierung und Scantiefe werden manuell eingestellt. Es erfolgen jeweils drei Aufnahmen mit einem Sichtwinkel von 10 x 10°. Jeder Scanprozess erzeugt Bildserien mit bis zu 64 Einzelbildern, entsprechend den Fokalebenen, die auf dem Monitor dargestellt und bei guter Qualität gespeichert werden. OCT-Untersuchung: Der Patient wird angehalten, das Auge möglichst still zu halten und während der Untersuchung nicht zu blinzeln. Von jedem Auge erfolgen je nach Qualität mindestens drei Aufnahmen. Jeweils 25-30 aufeinanderfolgende horizontale B-Scans (3,4mm Durchmesser, 768 A-Scans), die im Sehnervenkopf zentriert werden, werden automatisch gemittelt. Gleichzeitig kompensiert das Eye Tracking System geringe Augenbewegungen. Es wurden jeweils 3 HRT-Aufnahmen gemittelt, wobei die sog. Mean Standard Deviation (msd) kleiner als 40µm sein sollte (10). Sie ist ein Maß für die Bildqualität. Zu jedem Pixel der drei Einzelbilder wird eine Standardabweichung ermittelt und der Durchschnitt als MSD angegeben. Je besser die Bilder übereinander liegen, desto kleiner ist die MSD und desto höher die Bildqualität (46). In den gemittelten Bildern wurde eine Konturlinie festgelegt, bei manchen Patienten konnte die Konturlinie aus früheren Aufnahmen übernommen und bei Bedarf überarbeitet werden. Sie soll als Papillenbegrenzung entlang der inneren Zone des Elschnig´schen Skleralringes liegen (10). 20 Wie in Studien gezeigt wurde, erhöht sich die Reproduzierbarkeit der Referenzebene, wenn die Konturlinie nicht frei eingezeichnet, sondern durch Addition von mehreren kleinen Kreisen bestimmt wird (3). So entsteht ein glatterer Verlauf der festgelegten Papillenaußengrenze. Dieses Verfahren, sowie die Nutzung der auch als vorteilhaft erwiesenen Export/ImportFunktion aus früheren Aufnahmen wurden daher angewandt (44). Die im HRT gemessenen und errechneten Parameter (im Folgenden als StandardWerte benannt) wurden exportiert und in Excel-Dateien gespeichert. Das jeweils qualitativ beste OCT-Bild der Patienten wurde ausgedruckt und manuell vermessen. Der Umrechnungsfaktor von mm in µm betrug 17,39 bzw. 18,07 (nach einem Update der OCT-Software änderte sich das Format der Ausdrucke). Gemessen wurde der temporale Abstand vom papillennahen Ende des Retinalen Pigmentepithels (RPE) zur Retina-Oberfläche. Eine Messung erfolgte senkrecht zur Gesamtaufnahme der Papille („korrigierter Wert 1“), die zweite erfolgte senkrecht zur Ebene des RPE („korrigierter Wert 2“). Die zweite Messung ist notwendig, da es häufig schwierig ist eine Papille bei der Aufnahme gerade zu erfassen. 1 2 Abb.9: Messungen im OCT-Bild. 1: erste Messung, 2: zweite Messung. 21 Um mit den gemessenen Werten neue Parameter durch das HRT zu ermitteln, wurden von der Standard-Referenzhöhe 50μm subtrahiert und die neuen Werte addiert. Diese Werte wurden im HRT als neue Referenzhöhe manuell eingegeben und wiederum exportiert. Für jede Gruppe bestand somit eine Excel-Datei mit den StandardParametern sowie den korrigierten Parametern. 4.5 Statistische Auswertung Für die statistische Auswertung wurden die Excel-Dateien in einer SPSSDatei zusammengefügt. Die Auswertung erfolgte mittels SPSS SoftwareVersion 14. Die Parameter wurden mit dem Kolmogorov-Smirnov-Anpassungstest auf Normalverteilung getestet. Von einer Normalverteilung kann man ausgehen, wenn der Test einen höheren Wert als 0,05 annimmt. Bei bestehender Normalverteilung werden signifikante Unterschiede der zu vergleichenden Werte mit dem T-Test bei gepaarten Stichproben geprüft, andernfalls verwendet man den Wilcoxon-Test. Dabei werden jeweils der korrigierte Wert 1 mit dem Standard-Wert und der korrigierte Wert 2 mit dem Standard-Wert verglichen. Bei einer Signifikanz liegen die Ergebnisse der Tests unterhalb des festgelegten Signifikanzniveaus α=0,05, d.h. p≤0,05, sodass die Irrtumswahrscheinlichkeit weniger als 5% beträgt. Signifikanzen sind durch * bzw. ** markiert. Letztere werden bei einem p≤0,01 als hochsignifikant bezeichnet. Zusätzlich wurde die Sensitivität bei 90% Spezifität berechnet. Die Sensitivität stellt die Empfindlichkeit des HRT für glaukomatöse Veränderungen dar, während mit der Spezifität der Anteil der als normal Erkannten an den tatsächlichen Normalen beschrieben wird. Mit Hilfe von ROC-Kurven (Receiver Operating Characteristic) wird dargestellt, inwieweit sich die Unterscheidungsfähigkeit des HRT zwischen Normalen und Glaukomen durch die neuen Parameter verändert. 22 Eine Area Under the Curve (AUC) von 100% steht für eine perfekte Diskrimination des HRT zwischen zwei Gruppen, während ein Wert von 50% einer reinen Ratewahrscheinlichkeit entspricht. Die AUC wurden wiederum verglichen und mit Hilfe einer speziellen Software die Signifikanzen untereinander bestimmt (8). In den Tabellen sind die jeweils herausragenden Werte fettgedruckt und zusätzlich im Text erläutert. 23 5 Ergebnisse Das Alter der eingeschlossenen Personen liegt zwischen 21 und 78 Jahren, das mittlere Alter betrug zum Zeitpunkt der Untersuchung 57 Jahre. 70 65 60 Alter in 55 Jahren 50 45 40 Abb.10: Säulendiagramm zur Altersverteilung im Gruppenvergleich. Der Anteil der Frauen beträgt 41% (97 von 237). Es wurden 119 rechte und 118 linke Augen eingeschlossen. Die Gruppen sind folgendermaßen bezeichnet: Gruppe 0 = Kontrollen Gruppe 1 = OHT Gruppe 2 = Präperimetrische Glaukome Gruppe 3 = Perimetrische Glaukome Gruppe 4 = Kontrollen + OHT Gruppe 5 = Präperimetrische + Perimetrische Glaukome Die Gruppen setzen sich zusammen aus 89 Kontrollen, 43 Okulär Hypertensiven, 39 Präperimetrischen Glaukomen und 66 Perimetrischen Glaukomen. Für die folgenden Parameter wurden bei allen Gruppen die Standard-Werte mit den beiden korrigierten Werten verglichen, wobei der globale Wert und die einzelnen Sektorenwerte (temporal, superior, nasal, inferior) gesondert betrachtet werden. Die Maßeinheit entspricht µm bzw. mm² bei den Flächen und mm³ bei den Volumina. Einige Werte wie die Sensitivitäten wurden der Übersichtlichkeit halber auf ganze Zahlen gerundet. 24 Die Papillenfläche unterschied sich zwischen den einzelnen Gruppen nicht signifikant (Gruppe O: 2,81 ± 0,68; Gruppe 1: 2,96 ± 0,85; Gruppe 2: 2,77 ± 0,49; Gruppe 3: 2,86 ± 0,66). 5.1 Messungen Die Messungen anhand der OCT-Bilder ergaben folgende Mittelwerte, die im Kolmogorov-Smirnov-Anpassungstest normalverteilt sind. Gruppen Kontrollen OHT Präperimetrische Perimetrische Insgesamt Wert 1 Wert 2 Mittelwert 226 231 N 89 89 Standardabweichung 52 45 Minimum 130 139 Maximum 480 416 Mittelwert 218 225 N 43 43 Standardabweichung 50 52 Minimum 126 108 Maximum 357 365 Mittelwert 188* 192* N 39 39 Standardabweichung 48 51 Minimum 108 108 Maximum 334 343 Mittelwert 158* 165* N 66 66 Standardabweichung 69 70 Minimum 0 0 Maximum 307 307 Mittelwert 199 205 N 237 237 Standardabweichung 63 62 Minimum 0 0 Maximum 480 416 Tab.1: Mittelwerte OCT-Messungen (in µm) Die Werte der Prä- und Perimetrischen sind im T-Test bei unabhängigen Stichproben signifikant kleiner als die der Kontrollen. 25 5.2 Referenzhöhe Eine Normalverteilung besteht für Standard- und korrigierte Werte in allen Gruppen. Standard Referenzhöhe Korrigierte Referenzhöhe 1 Korrigierte Referenzhöhe 2 Mittelwert 270 442 451 N 89 89 89 Standardabweichung 97 94 98 Minimum 11 213 222 Maximum 495 685 694 Mittelwert 295 462 470 N 43 43 43 Standardabweichung 94 109 112 Gruppen Kontrollen OHT Präperimetrische Perimetrische Insgesamt Minimum -1 211 211 Maximum 462 643 646 Mittelwert 283 420 425 N 39 39 39 Standardabweichung 73 89 92 Minimum 119 226 226 Maximum 460 557 566 Mittelwert 271 374 386 N 66 66 66 Standardabweichung 94 118 112 Minimum -16 0 108 Maximum 463 609 618 Mittelwert 277 423 432 N 237 237 237 Standardabweichung 92 108 108 Minimum -16 0 108 Maximum 495 685 694 Tab.2: Mittelwerte Referenzhöhe (in µm) Die korrigierten Werte unterscheiden sich in allen Gruppen jeweils signifikant von den Standard-Werten. 26 5.3 Randsaumfläche Die Werte der Randsaumfläche waren laut Kolmogorov-Smirnov- Anpassungstest normalverteilt. RF temporal RF temporal 1 RF temporal 2 RF superior RF superior 1 RF superior 2 RF global 2 RF global 1 RF global 0,16 0,08 0,16 0,07 0,13 0,07 0,10 0,06 0,14 0,07 0,26 0,07 0,25 0,08 0,21 0,10 0,16 0,10 0,22 0,09 0,26 0,07 0,25 0,08 0,21 0,10 0,17 0,10 0,22 0,09 0,37 0,09 0,35 0,09 0,30 0,10 0,21 0,11 0,31 0,12 0,41 0,09 0,40 0,10 0,35 0,12 0,25 0,13 0,35 0,13 0,41 0,09 0,40 0,10 0,35 0,12 0,25 0,13 0,35 0,13 Gruppe 1,44 1,66 1,67 Mittelwert Standardabw. ,34 ,34 ,34 1,43 1,71 1,72 Mittelwert OHT Standardabw. ,32 ,37 ,38 1,21 1,47 1,48 Mittelwert Präperimetr. Standardabw. ,34 ,40 ,40 0,87 1,11 1,12 Mittelwert Perimetr. Standardabw. ,36 ,44 ,44 1,24 1,49 1,49 Mittelwert Insgesamt Standardabw. ,42 ,46 ,46 Tab.5a: Mittelwerte Randsaumfläche (RF in mm²) Kontrollen RF inferior RF inferior 1 RF inferior 2 RF nasal 2 RF nasal 1 RF nasal 0,35 0,10 0,37 0,10 0,29 0,12 0,18 0,09 0,30 0,13 0,41 0,10 0,44 0,11 0,36 0,12 0,24 0,12 0,36 0,14 0,42 0,10 0,44 0,11 0,36 0,12 0,25 0,12 0,36 0,14 Gruppe 0,55 0,58 0,58 Mittelwert Standardabw. 0,12 0,12 0,12 0,56 0,62 0,62 Mittelwert OHT Standardabw. 0,13 0,13 0,14 0,49 0,55 0,55 Mittelwert Präperimetr. Standardabw. 0,13 0,12 0,12 0,38 0,45 0,45 Mittelwert Perimetr. Standardabw. 0,16 0,16 0,16 0,49 0,55 0,55 Mittelwert Insgesamt Standardabw. 0,15 0,15 0,15 Tab.5b: Mittelwerte Randsaumfläche (RF in mm²) Kontrollen Sowohl im T-Test als auch im Wilcoxon-Test zeigen sich hier für alle Gruppen und alle Sektoren signifikante Unterschiede. 27 Gepaarte Differenzen Signifikanz (2-eitig) 95% Konfidenzintervall der Differenz Standardfehler des Mittelwertes Standardabweichung Mittelwert Untere Obere Kontrollen 1) RF_global - RF_global_1 -,23 ,12 ,01 -,25 -,20 2) RF_global - RF_global_2 -,23 ,13 ,01 -,26 -,21 3) RF_temporal - RF_temporal_1 -,09 ,04 ,00 -,10 -,08 4) RF_temporal - RF_temporal_2 -,09 ,04 ,00 -,10 -,09 5) RF_superior - RF_superior_1 -,04 ,03 ,00 -,05 -,03 6) RF_superior - RF_superior_2 -,04 ,03 ,00 -,05 -,03 7) RF_nasal - RF_nasal_1 -,03 ,04 ,00 -,04 -,02 8) RF_nasal - RF_nasal_2 -,03 ,04 ,00 -,04 -,02 9) RF_inferior - RF_inferior_1 -,06 ,05 ,01 -,07 -,05 10) RF_inferior - RF_inferior_2 -,07 ,05 ,01 -,08 -,05 OHT 1) RF_global - RF_global_1 -,27 ,16 ,02 -,32 -,22 2) RF_global - RF_global_2 -,28 ,17 ,03 -,33 -,23 3) RF_temporal - RF_temporal_1 -,09 ,06 ,01 -,11 -,07 4) RF_temporal - RF_temporal_2 -,10 ,06 ,01 -,11 -,08 5) RF_superior - RF_superior_1 -,05 ,04 ,01 -,06 -,04 6) RF_superior - RF_superior_2 -,05 ,04 ,01 -,06 -,04 7) RF_nasal - RF_nasal_1 -,06 ,07 ,01 -,08 -,04 8) RF_nasal - RF_nasal_2 -,06 ,07 ,01 -,09 -,04 9) RF_inferior - RF_inferior_1 -,07 ,05 ,01 -,08 -,05 10) RF_inferior - RF_inferior_2 -,07 ,05 ,01 -,08 -,05 Präperimetrische 1) RF_global - RF_global_1 -,26 ,17 ,03 -,31 -,20 2) RF_global - RF_global_2 -,26 ,17 ,03 -,32 -,21 3) RF_temporal - RF_temporal_1 -,08 ,06 ,01 -,10 -,06 4) RF_temporal - RF_temporal_2 -,08 ,06 ,01 -,10 -,07 5) RF_superior - RF_superior_1 -,04 ,04 ,01 -,06 -,03 6) RF_superior - RF_superior_2 -,04 ,04 ,01 -,06 -,03 7) RF_nasal - RF_nasal_1 -,07 ,07 ,01 -,09 -,05 8) RF_nasal - RF_nasal_2 -,07 ,07 ,01 -,09 -,05 9) RF_inferior - RF_inferior_1 -,06 ,04 ,01 -,08 -,05 10) RF_inferior - RF_inferior_2 -,06 ,04 ,01 -,08 -,05 Perimetrische 1) RF_global - RF_global_1 -,24 ,18 ,02 -,28 -,19 2) RF_global - RF_global_2 -,25 ,19 ,02 -,30 -,20 3) RF_temporal - RF_temporal_1 -,07 ,06 ,01 -,08 -,05 4) RF_temporal - RF_temporal_2 -,07 ,06 ,01 -,09 -,06 5) RF_superior - RF_superior_1 -,04 ,04 ,00 -,05 -,03 6) RF_superior - RF_superior_2 -,04 ,04 ,00 -,05 -,03 7) RF_nasal - RF_nasal_1 -,06 ,07 ,01 -,08 -,05 8) RF_nasal - RF_nasal_2 -,07 ,07 ,01 -,09 -,05 9) RF_inferior - RF_inferior_1 -,06 ,06 ,01 -,08 -,05 10) RF_inferior - RF_inferior_2 -,07 ,06 ,01 -,08 -,05 Tab.6: Signifikanzen Randsaumfläche im T-Test bei gepaarten Stichproben T -17,66 -17,63 -19,98 -20,26 -11,31 -11,29 -7,91 -7,95 -11,93 -12,00 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* -10,91 -10,69 -10,61 -10,61 -8,31 -8,11 -6,21 -6,21 -8,30 -8,27 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* -9,33 -9,47 -8,85 -8,94 -6,11 -6,23 -5,99 -6,08 -9,71 -9,61 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* -10,56 -10,93 -8,90 -9,21 -9,12 -9,27 -8,03 -8,31 -8,27 -8,50 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* 28 Kontrollen Z Asymptot. Signifikanz (2-seitig) (1) (2) (3) (4) (5) (6) (7) (8) (9) (10) -8,15 -8,15 -8,15 -8,15 -7,87 -7,87 -7,12 -7,12 -7,91 -7,91 ,000* ,000* ,000* ,000* ,000* ,000 ,000* ,000* ,000* ,000* -5,65 -5,65 -5,65 -5,65 -5,51 -5,51 -5,37 -5,37 -5,58 -5,58 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* -5,44 -5,44 -5,44 -5,44 -5,37 -5,37 -5,37 -5,37 -5,37 -5,37 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* -6,74 -6,48 -6,53 -6,62 -6,70 ,000* ,000* ,000* ,000* ,000* OHT Z Asymptot. Signifikanz (2-seitig) Präperimetrische Z Asymptot. Signifikanz (2-seitig) Perimetrische Z -6,79 -6,82 -6,63 -6,70 -6,67 Asymptot. Signifikanz ,000* ,000* ,000* ,000* ,000* (2-seitig) Tab.7: Signifikanzen Randsaumfläche im Wilcoxon-Test Die höchsten AUC-Werte und Sensitivitäten zeigen sich beim Vergleich der Randsaumfläche zwischen Kontrollen und perimetrischen Glaukomen, v.a. im inferioren Segment, wobei die AUC bei den korrigierten Werten niedriger ist, die Sensitivität jedoch höher (Standard-Wert: 89,5%, S 61%; korrigierter Wert 1: 86,3%, S 71%; korrigierter Wert 2: 86,1%, S 71%). Global und nasal ist die Abnahme der AUC sogar hoch signifikant, signifikant ist sie auch beim Vergleich der Kontrollen und OHT mit allen Glaukomen. Auch beim Vergleich der Kontrollen mit den Präperimetrischen nimmt die AUC signifikant ab. Eine signifikante Zunahme der AUC auf Seite der korrigierten Werte zeigt sich lediglich beim Vergleich zwischen Kontrollen und OHT im nasalen Segment. 0-1 0-2 0-3 4-5 2-3 Global Standard 49,5 / 5 67,6 / 31 88,5 / 67 80,9 / 59 76,4 / 42 Global korr. Wert 1 51,8 / 7 65,1 / 33 84,0** / 59 77,5* / 52 73,6 / 39 Global korr. Wert 2 51,8 / 7 65,5 / 31 83,8** / 59 77,5* / 41 72,9 / 36 Inferior Standard 55,7 / 2 65,4 / 26 89,5 / 61 81,6 / 54 78,4 / 47 Inferior korr. Wert 1 54,3 / 9 66,2 / 31 86,3 / 71 79,4 / 57 74,7 / 45 Inferior korr. Wert 2 54,1 / 9 66,3 / 31 86,1 / 71 79,3 / 57 74,2 / 44 Superior Standard 56,2 / 16 69,2 / 36 84,9 / 65 77,7 / 54 72,4 / 53 Superior korr. Wert 1 54,3 / 12 68,0 / 36 83,0 / 62 76,4 / 52 70,6 / 47 Superior korr. Wert 2 54,1 / 12 68,0 / 36 82,6 / 61 76,1 / 51 70,2 / 29 Nasal Standard 50,3 / 7 63,8 / 48 79,8 / 48 74,3 / 47 69,0 / 35 Nasal korr. Wert 1 56,4* / 2 * 56,5 / 39 75,2** / 39 70,0* / 34 71,0 / 32 Nasal korr. Wert 2 56,6* / 2 56,5* / 39 74,5** / 39 69,8* / 33 69,9 / 32 Temporal Standard 52,7 / 21 63,6 / 33 79,1 / 56 72,4 / 43 64,2 / 18 Temporal korr. Wert 1 53,5 / 16 66,6 / 36 76,5 / 58 71,9 / 49 63,5 / 24 Temporal korr. Wert 2 53,2 / 16 67,2 / 44 76,4 / 59 72,1 / 49 62,7 / 26 Tab.8: AUC Randsaumfläche / Sensitivität bei 90% Spezifität (in %) 29 5.4 Randsaumvolumen Mit Ausnahme des temporalen Wertes in Gruppe 0 und des temporalen und inferioren Wertes in Gruppe 4 waren alle Werte normalverteilt. RV global RV global 1 RV global 2 RV temporal RV temporal 1 RV temporal 2 RV superior RV superior 1 RV superior 2 Mittelwert ,37 ,64 ,65 ,01 ,05 ,05 ,09 ,16 ,17 Standardabw. ,14 ,21 ,21 ,01 ,03 ,03 ,04 ,06 ,06 Mittelwert ,34 ,61 ,62 ,01 ,05 ,05 ,09 ,15 ,15 Standardabw. ,16 ,21 ,22 ,01 ,02 ,02 ,05 ,06 ,06 Mittelwert ,27 ,46 ,47 ,01 ,04 ,04 ,07 ,12 ,12 Standardabw. ,15 ,24 ,24 ,01 ,03 ,03 ,05 ,07 ,07 Mittelwert ,17 ,29 ,30 ,01 ,03 ,03 ,05 ,08 ,08 Standardabw. ,14 ,21 ,21 ,01 ,03 ,03 ,04 ,06 ,06 Mittelwert ,29 ,51 ,52 ,01 ,04 ,04 ,08 ,13 ,13 Standardabw. ,17 ,26 ,26 ,01 ,02 ,03 ,05 ,07 ,07 Gruppen Kontrollen OHT Präperimetr. Perimetr. Insgesamt Tab.9a: Mittelwerte Randsaumvolumen (RV in mm³) RV nasal RV nasal 1 RV nasal 2 RV inferior RV inferior 1 RV inferior 2 Mittelwert ,17 ,27 ,27 ,09 ,16 ,16 Standardabw. ,07 ,09 ,09 ,04 ,06 ,06 Mittelwert ,15 ,25 ,25 ,09 ,16 ,16 Standardabw. ,08 ,10 ,10 ,04 ,06 ,06 Mittelwert ,12 ,19 ,20 ,06 ,11 ,11 Standardabw. ,08 ,10 ,11 ,04 ,06 ,06 Mittelwert ,08 ,13 ,13 ,04 ,06 ,06 Standardabw. ,07 ,09 ,09 ,04 ,05 ,05 Mittelwert ,13 ,21 ,22 ,07 ,12 ,13 Standardabw. ,08 ,11 ,11 ,05 ,07 ,07 Gruppen Kontrollen OHT Präperimetr. Perimetr. Insgesamt Tab.9b: Mittelwerte Randsaumvolumen (RV in mm³) Auch hier unterscheiden sich im T-Test und im Wilcoxon-Test die StandardWerte signifikant von den korrigierten Werten in allen Sektoren und in allen Gruppen. 30 Kontrollen (1) (2) (3) (4) (5) (6) (7) (8) (9) (10) Z Asymptot. Signifikanz (2-seitig) -8,19 -8,19 -8,19 -8,19 -8,19 -8,19 -8,19 -8,19 -8,19 -8,19 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* -5,71 -5,71 -5,71 -5,71 -5,71 -5,71 -5,71 -5,71 -5,71 -5,71 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* -5,44 -5,44 -5,45 -5,45 -5,44 -5,44 -5,44 -5,44 -5,44 -5,44 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* Z -6,75 -6,80 -6,79 -6,84 -6,76 Asymptot. Signifikanz ,000* ,000* ,000* ,000* ,000* (2-seitig) Tab.10: Signifikanzen Randsaumvolumen im Wilcoxon-Test -6,82 -6,67 -6,74 -6,68 -6,75 ,000* ,000* ,000* ,000* ,000* OHT Z Asymptot. Signifikanz (2-seitig) Präperimetrische Z Asymptot. Signifikanz (2-seitig) Perimetrische 31 Kontrollen Gepaarte Differenzen Signifikanz (2-seitig) 95% Konfidenzintervall der Differenz Standardabweichung Obere ,10 ,10 ,02 ,02 ,03 ,03 ,04 ,04 ,03 ,03 ,01 ,01 ,00 ,00 ,00 ,00 ,00 ,00 ,00 ,00 -,30 -,31 -,04 -,04 -,07 -,07 -,11 -,11 -,07 -,08 -,25 -,26 -,03 -,04 -,06 -,07 -,09 -,10 -,06 -,06 -25,11 -25,89 -18,48 -18,96 -25,79 -26,55 -26,59 -27,30 -23,47 -24,26 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* -,27 -,28 -,04 -,04 -,06 -,07 -,10 -,10 -,07 -,07 ,09 ,10 ,02 ,02 ,03 ,03 ,03 ,03 ,02 ,03 ,01 ,01 ,00 ,00 ,00 ,00 ,00 ,01 ,00 ,00 -,29 -,31 -,04 -,04 -,07 -,08 -,11 -,11 -,07 -,08 -,24 -,25 -,03 -,03 -,06 -,06 -,09 -,09 -,06 -,06 -19,05 -19,07 -14,17 -14,42 -16,70 -16,83 -20,34 -20,14 -18,10 -18,19 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* -,19 -,20 -,03 -,03 -,05 -,05 -,07 -,08 -,05 -,05 ,10 ,11 ,02 ,02 ,03 ,03 ,04 ,04 ,03 ,03 ,02 ,02 ,00 ,00 ,00 ,00 ,01 ,01 ,00 ,00 -,23 -,24 -,03 -,03 -,06 -,06 -,09 -,09 -,06 -,06 -,16 -,17 -,02 -,02 -,04 -,04 -,06 -,06 -,04 -,04 -11,69 -11,54 -8,67 -8,69 -11,19 -11,09 -12,76 -12,61 -10,75 -10,67 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* 1) RV global - RV global_1 -,12 ,10 ,01 -,15 -,10 2) RV global - RV global_2 -,13 ,11 ,01 -,16 -,10 3) RV temporal - RV temporal_1 -,02 ,02 ,00 -,02 -,01 4) RV temporal - RV temporal_2 -,02 ,02 ,00 -,02 -,01 5) RV superior – RV superior_1 -,03 ,03 ,00 -,04 -,02 6) RV superior – RV superior_2 -,03 ,03 ,00 -,04 -,02 7) RV nasal – RV nasal_1 -,05 ,04 ,00 -,06 -,04 8) RV nasal – RV nasal_2 -,05 ,04 ,01 -,06 -,04 9) RV inferior – RV inferior_1 -,03 ,02 ,00 -,03 -,02 10) RV inferior – RV inferior_2 -,03 ,02 ,00 -,03 -,02 Tab.11: Signifikanzen Randsaumvolumen im T-Test bei gepaarten Stichproben -9,45 -9,85 -8,14 -8,48 -8,92 -9,11 -9,59 -10,03 -8,92 -9,28 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* Standardfehler des Mittelwertes Mittelwert Untere -,27 -,29 -,04 -,04 -,07 -,07 -,10 -,10 -,07 -,07 1) RV global - RV global_1 2) RV global - RV global_2 3) RV temporal - RV temporal_1 4) RV temporal - RV temporal_2 5) RV superior - RV superior_1 6) RV superior - RV superior_2 7) RV nasal - RV nasal_1 8) RV nasal - RV nasal_2 9) RV inferior - RV inferior_1 10) RV inferior - RV inferior_2 T OHT 1) RV global - RV global_1 2) RV global - RV global_2 3) RV temporal - RV temporal_1 4) RV temporal - RV temporal_2 5) RV superior – RV superior_1 6) RV superior – RV superior_2 7) RV nasal – RV nasal_1 8) RV nasal – RV nasal_2 9) RV inferior – RV inferior_1 10) RV inferior – RV inferior_2 Präperimetrische 1) RV global - RV global_1 2) RV global - RV global_2 3) RV temporal - RV temporal_1 4) RV temporal - RV temporal_2 5) RV superior – RV superior_1 6) RV superior – RV superior_2 7) RV nasal – RV nasal_1 8) RV nasal – RV nasal_2 9) RV inferior – RV inferior_1 10) RV inferior – RV inferior_2 Perimetrische Wie bei der Randsaumfläche sind auch hier die AUC-Werte am größten beim Vergleich zwischen Kontrollen v.a. inferioren Segment im und perimetrischen (Standard-Wert: 89,5%, korr. Wert 1: 91,1%, S 79%; korr. Wert 2: 91,2%, S 79%). Glaukomen, S 70%; 32 Eine signifikante Zunahme der AUC durch die OCT-gesteuerten Werte zeigt sich beim Vergleich der Kontrollen und OHT mit allen Glaukomen global und temporal, hoch signifikant superior und nasal. Auch beim Vergleich der Kontrollen mit den Präperimetrischen findet sich eine signifikante Zunahme global und inferior und eine hoch signifikante Zunahme im superioren Sektor. Die korrigierten Werte führen beim Vergleich der Gruppen 0-2, 0-3, sowie beim Vergleich der Kontrollen plus OHT mit allen Glaukomen (4-5) zu höheren AUC-Werten in allen Segmenten. Beim Vergleich 4-5 inferior, sowie 2-3 global, nasal und temporal unterscheiden sich jeweils die beiden korrigierten Werte untereinander signifikant. 0-1 0-2 0-3 4-5 2-3 Global Standard 56,2 / 19 70,5 / 44 88,4 / 74 Global korr. Wert 1 54,3 / 9 80,5 / 61 72,8 / 32 74,7* / 41 90,4 / 73 83,6* / 61 Global korr. Wert 2 73,7 / 38 53,9 / 12 75,0* / 41 89,9 / 73 83,5* / 61 72,7* / 33 Inferior Standard 50,3 / 9 68,8 / 31 89,5 / 70 82,1 / 60 77,1 / 29 Inferior korr. Wert 1 51,0 / 12 72,6* / 44 91,1 / 79 84,5 / 64 76,3 / 38 Inferior korr. Wert 2 51,5 / 12 73,1* / 44 91,2 / 79 84,6* / 66 75,8 / 38 Superior Standard 57,4 / 23 66,1 / 38 84,2 / 67 75,6 / 43 71,4 / 36 Superior korr. Wert 1 57,7 / 19 71,5** / 46 86,7 / 68 79,5** / 58 72,1 / 51 Superior korr. Wert 2 57,1 / 16 71,9** / 46 86,2 / 65 79,4** / 58 71,5 / 51 Nasal Standard 59,4 / 26 69,1 / 41 85,1 / 62 76,7 / 51 65,5 / 20 Nasal korr. Wert 1 56,3 / 19 71,6 / 51 88,1 / 68 80,5** / 60 69,7 / 35 Nasal korr. Wert 2 56,1 / 16 71,7 / 51 87,8 / 68 80,5** / 62 68,9* / 30 Temporal Standard 55,3 / 9 65,8 / 31 77,9 / 53 72,7 / 45 62,6 / 18 Temporal korr. Wert 1 53,2 / 16 70,7 / 51 81,3 / 59 76,5* / 56 64,5 / 35 Temporal korr. Wert 2 53,0 / 16 71,1 / 49 81,1 / 59 76,5* / 53 63,3* / 32 Tab.12: AUC Randsaumvolumen / Sensitivität bei 90% Spezifität (in %) 33 34 5.5 Third moment Das Third moment ist ein Maß für die Schiefe einer Verteilung. Eine Verteilung ist schief, wenn sie asymmetrisch ist, d.h. wenn das arithmetische Mittel entweder kleiner oder größer als Modus und Median ist. Die Kurve ist dann links- oder rechtsgipflig. Bei symmetrischen Verteilungen ist die Schiefe Null (13). Das Third moment beschreibt bei der Papille die Steilheit der Exkavation und verändert sich bei Verlegung der Referenzebene nicht. Demzufolge sind alle Standard-Werte und korrigierten Werte gleich. Es nimmt normalerweise negative Werte an; je positiver es ist, desto steiler ist die Exkavation (49). Gruppen Kontrollen OHT Präperimetr. Perimetrische Insgesamt TM global TM temporal TM superior TM nasal TM inferior Mittelwert -,18* -,08* -,17* -,23* -,11* Standardabw. ,08 ,08 ,11 ,14 ,11 Mittelwert -,16 -,06 -,10* -,20 -,12 Standardabw. ,08 ,10 ,11 ,09 ,09 Mittelwert -,08* -,03* -,02* -,16* -,00* Standardabw. ,07 ,09 ,11 ,14 ,10 Mittelwert -,03* ,01* ,03* -,09* ,04* Standardabw. ,08 ,12 ,12 ,13 ,08 Mittelwert -,12 -,04 -,07 -,17 -,05 ,10 ,10 ,14 ,14 ,12 Standardabw. Tab.13: Mittelwerte Third Moment Es liegt in allen Bereichen eine Normalverteilung vor. Das dritte Moment der Kontrollen unterscheidet sich in allen Sektoren signifikant zu den Werten der Prä- und Perimetrischen und im superioren Sektor zum dritten Moment der OHT. Relativ hohe AUC-Werte tauchen global und in den unteren und oberen Segmenten beim Vergleich der Kontrollen mit den Perimetrischen und beim Vergleich der Kontrollen plus OHT mit allen Glaukomen auf. 0-1 Global Inferior Superior Nasal Temporal Tab.14: AUC Third moment 0-2 0-3 88 / 63 57 / 11 80 / 51 88 / 70 51 / 12 77 / 43 88 / 56 67 / 25 83 / 37 57 / 28 65 / 20 76 / 47 53 / 15 65 / 12 74 / 21 / Sensitivität bei 90% Spezifität (in %) 4-5 2-3 84 / 54 85 / 64 82 / 42 71 / 29 70 / 17 67 / 21 65 / 31 61 / 18 64 / 28 62 / 18 35 5.6 Exkavationsfläche Alle Werte mit Ausnahme des nasalen Sektorwertes in Gruppe 0 sind normalverteilt (Kolmogorov-Smirnov-Test). EF global EF global 1 EF global 2 EF temporal EF temporal 1 EF temporal 2 EF superior EF superior 1 EF superior 2 Mittelwert ,59 ,37 ,36 ,20 ,11 ,10 ,14 ,10 ,09 Standardabw. ,47 ,42 ,42 ,11 ,10 ,09 ,12 ,11 ,11 Gruppen Kontrollen OHT ,59 ,25 ,16 ,16 ,22 ,17 ,17 ,47 ,46 ,12 ,12 ,12 ,13 ,12 ,12 Mittelwert 1,20 ,94 ,94 ,30 ,22 ,21 ,29 ,25 ,25 Standardabw. ,62 ,58 ,58 ,12 ,13 ,13 ,15 ,15 ,15 Mittelwert 1,60 1,36 1,35 ,34 ,27 ,27 ,40 ,36 ,36 Standardabw. ,77 ,75 ,75 ,14 ,15 ,14 ,21 ,21 ,21 Mittelwert 1,02 ,78 ,77 ,26 ,18 ,18 ,25 ,21 ,21 Standardabw. ,72 ,70 ,69 ,13 ,14 ,14 ,19 ,19 ,19 EF inferior 2 Insgesamt ,60 ,50 EF inferior 1 Perimetr. ,87 EF inferior Präperimetr. Mittelwert Standardabw. ,15 ,13 ,21 ,12 ,31 ,15 ,45 ,18 ,27 ,19 ,09 ,11 ,14 ,11 ,25 ,15 ,38 ,18 ,21 ,18 ,09 ,10 ,14 ,11 ,25 ,15 ,38 ,18 ,21 ,18 Tab.15a: Mittelwerte Exkavationsfläche (EF in mm²) EF nasal 2 EF nasal 1 EF nasal Gruppen ,10 ,07 ,07 Mittelwert Standardabw. ,15 ,13 ,13 ,19 ,12 ,12 Mittelwert OHT Standardabw. ,17 ,14 ,14 ,30 ,23 ,23 Mittelwert Präperimetr. Standardabw. ,25 ,21 ,21 ,41 ,35 ,34 Mittelwert Perimetr. Standardabw. ,28 ,26 ,26 ,24 ,18 ,18 Mittelwert Insgesamt Standardabw. ,25 ,22 ,22 Tab.15b: Mittelwerte Exkavationsfläche (EF in mm²) Kontrollen Wiederum zeigen T-Test und Wilcoxon-Test signifikante Unterschiede der Standard-Werte zu den korrigierten Werten in allen Gruppen und in allen Sektoren. 36 Gepaarte Differenzen Standardfehler des Mittelwertes Signifikanz (2-seitig) Standardabweichung 95% Konfidenzintervall der Differenz Mittelwert T Untere Obere ,23 ,23 ,09 ,09 ,04 ,04 ,03 ,03 ,06 ,07 ,12 ,13 ,04 ,04 ,03 ,03 ,04 ,04 ,05 ,05 ,01 ,01 ,00 ,00 ,00 ,00 ,00 ,00 ,01 ,01 ,20 ,21 ,08 ,09 ,03 ,03 ,02 ,02 ,05 ,05 ,25 ,26 ,10 ,10 ,05 ,05 ,04 ,04 ,07 ,08 17,66 17,63 19,98 20,26 11,31 11,29 7,91 7,95 11,93 12,00 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,27 ,28 ,09 ,10 ,05 ,05 ,06 ,06 ,07 ,07 ,16 ,17 ,06 ,06 ,04 ,04 ,07 ,07 ,05 ,05 ,02 ,03 ,01 ,01 ,01 ,01 ,01 ,01 ,08 ,01 ,22 ,23 ,07 ,08 ,04 ,04 ,04 ,04 ,05 ,05 ,32 ,33 ,11 ,11 ,06 ,06 ,08 ,09 ,08 ,08 10,91 10,69 10,60 10,61 8,31 8,11 6,21 6,21 8,30 8,27 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,26 ,26 ,08 ,08 ,04 ,04 ,07 ,07 ,06 ,06 ,17 ,17 ,06 ,06 ,04 ,04 ,07 ,07 ,04 ,04 ,03 ,03 ,01 ,01 ,01 ,01 ,01 ,01 ,01 ,01 ,20 ,21 ,06 ,07 ,03 ,03 ,05 ,05 ,05 ,05 ,31 ,32 ,10 ,10 ,06 ,06 ,09 ,09 ,08 ,08 9,33 9,47 8,85 8,94 6,11 6,23 5,99 6,08 9,71 9,61 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* 1) EF_global– EF_global_1 ,24 ,18 ,02 ,19 ,28 2) EF_global– EF_global_2 ,25 ,19 ,02 ,20 ,30 3) EF_temporal – EF_temporal_1 ,07 ,06 ,01 ,05 ,08 4) EF_temporal – EF_temporal_2 ,07 ,06 ,01 ,06 ,09 5) EF_superior – EF_superior_1 ,04 ,04 ,00 ,03 ,05 6) EF_superior – EF_superior_2 ,04 ,04 ,00 ,03 ,05 7) EF_nasal – EF_nasal_1 ,06 ,07 ,01 ,05 ,08 8) EF_nasal – EF_nasal_2 ,07 ,07 ,01 ,05 ,09 9) EF_inferior – EF_inferior_1 ,06 ,06 ,01 ,05 ,08 10) EF_inferior – EF_inferior_2 ,07 ,06 ,01 ,05 ,08 Tab.17: Signifikanzen Exkavationsfläche im T-Test bei gepaarten Stichproben 10,56 10,93 8,90 9,21 9,12 9,27 8,03 8,31 8,27 8,50 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* Kontrollen 1) EF_global – EF_global_1 2) EF_global – EF_global_2 3) EF_temporal – EF_temporal_1 4) EF_temporal – EF_temporal_2 5) EF_superior – EF_superior_1 6) EF_superior – EF_superior_2 7) EF_nasal – EF_nasal_1 8) EF_nasal – EF_nasal_2 9) EF_inferior – EF_inferior_1 10) EF_inferior – EF_inferior_2 OHT 1) EF_global– EF_global_1 2) EF_global– EF_global_2 3) EF_temporal – EF_temporal_1 4) EF_temporal – EF_temporal_2 5) EF_superior – EF_superior _1 6) EF_superior – EF_superior_2 7) EF_nasal – EF_nasal_1 8) EF_nasal – EF nasal_2 9) EF_inferior – EF_inferior_1 10) EF_inferior – EF_inferior_2 Präperimetrische 1) EF_global– EF_global_1 2) EF_global– EF_global_2 3) EF_temporal – EF_temporal_1 4) EF_temporal – EF_temporal_2 5) EF_superior – EF_superior_1 6) EF_superior – EF_superior_2 7) EF_nasal – EF_nasal_1 8) EF_nasal – EF_nasal_2 9) EF_inferior – EF_inferior_1 10) EF_inferior – EF_inferior_2 Perimetrische 37 (1) (2) (3) (4) (5) (6) (7) (8) (9) (10) -8,15 -8,15 -8,15 -8,15 -7,87 -7,87 -7,12 -7,12 -7,91 -7,91 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* -5,65 -5,65 -5,65 -5,65 -5,51 -5,51 -5,37 -5,37 -5,58 -5,58 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* -5,44 -5,44 -5,44 -5,44 -5,37 -5,37 -5,37 -5,37 -5,37 -5,37 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* Z -6,79 -6,82 -6,63 -6,70 -6,67 Asymptot. Signifikanz ,000* ,000* ,000* ,000* ,000* (2-seitig) Tab.16: Signifikanzen Exkavationsfläche im Wilcoxon-Test -6,74 -6,48 -6,53 -6,62 -6,70 ,000* ,000* ,000* ,000* ,000* Kontrollen Z Asymptot. Signifikanz (2-seitig) OHT Z Asymptot. Signifikanz (2-seitig) Präperimetrische Z Asymptot. Signifikanz (2-seitig) Perimetrische Die größten AUC-Werte erscheinen auch hier beim Vergleich der Kontrollen mit den perimetrischen Glaukomen im inferioren Segment (Standard-Wert: 90,6%, S 77%; korr. Wert 1: 90,4%, S 74%; korr. Wert 2: 90,4%, S 73%). Am stärksten nimmt die AUC zu, wenn die Werte des temporalen Segmentes zwischen den Kontrollen und den präperimetrischen Glaukomen verglichen werden (Standard-Wert: 72,9%, S 30%; korr. Wert 1: 75,3%, S 36%; korr. Wert 2: 75,7%, S 37%). Beim Vergleich dieser Gruppen sind die korrigierten AUC-Werte für alle Segmente höher als die der Standard-Werte, allerdings finden sich keine signifikanten Unterschiede. Lediglich die korrigierten Werte unterscheiden sich untereinander signifikant beim Vergleich Prä- und Perimetrische global, nasal und temporal. Global Standard Global korr. Wert 1 0-1 67,7 / 26 66,6 / 20 0-2 79,3 / 43 80,4 / 40 0-3 87,9 / 67 87,6 / 64 4-5 81,2 / 50 81,8 / 48 2-3 65,3 / 18 66,4 / 15 Global korr. Wert 2 67,0 / 22 80,5 / 40 87,7 / 64 82,0 / 47 65,9* / 15 Inferior Standard Inferior korr. Wert 1 64,1 / 18 64,9 / 26 78,7 / 46 81,1 / 48 90,6 / 77 90,4 / 74 84,5 / 48 84,7 / 51 72,0 / 41 71,2 / 28 Inferior korr. Wert 2 65,1 / 27 81,1 / 46 90,4 / 73 84,7 / 48 70,8 / 28 Superior Standard Superior korr. Wert 1 70,0 / 36 69,9 / 26 79,5 / 40 80,5 / 47 86,7 / 58 86,6 / 55 80,1 / 46 80,5 / 41 66,4 / 18 66,5 / 15 Superior korr. Wert 2 70,0 / 27 80,6 / 46 86,4 / 55 80,5 / 39 66,2 / 15 Nasal Standard Nasal korr. Wert 1 66,7 / 25 66,3 / 39 77,5 / 43 78,6 / 49 86,1 / 74 85,3 / 54 78,9 / 43 79,7 / 43 62,9 / 28 63,5 / 13 Nasal korr. Wert 2 66,3 / 39 85,1 / 48 79,6 / 40 63,1* / 10 Temporal Standard Temporal korr. Wert 1 64,3 / 18 64,1 / 22 78,8 / 47 72,9 / 30 75,3 / 36 80,3 / 51 81,8 / 47 73,6 / 29 75,8 / 36 58,4 / 23 61,4 / 15 Temporal korr. Wert 2 64,1 / 24 75,7 / 37 81,8 / 47 75,9 / 36 60,7* / 18 Tab.18: AUC Exkavationsfläche / Sensitivität 90% Spezifität (in %) 38 39 5.7 Exkavationsvolumen Eine Normalverteilung fehlte bei allen Sektorenwerten in Gruppe 0, sowie beim nasalen Sektor in Gruppe 1 und 3. EV temporal EV temporal 1 EV temporal 2 EV superior EV superior 1 EV superior 2 ,02 ,02 ,04 ,05 ,06 ,07 ,08 ,08 ,05 ,06 ,02 ,02 ,04 ,05 ,06 ,07 ,08 ,08 ,04 ,06 ,04 ,06 ,08 ,07 ,11 ,10 ,17 ,13 ,10 ,10 ,02 ,04 ,05 ,06 ,08 ,09 ,13 ,11 ,07 ,09 ,02 ,04 ,05 ,06 ,08 ,09 ,13 ,11 ,07 ,09 EV nasal 1 EV inferior EV inferior 1 EV inferior 2 ,04 ,04 ,06 ,06 ,10 ,10 ,15 ,10 ,08 ,09 ,02 ,03 ,04 ,05 ,07 ,09 ,11 ,09 ,06 ,08 ,02 ,03 ,04 ,05 ,07 ,09 ,11 ,09 ,05 ,08 EV global 2 ,04 ,04 ,07 ,06 ,09 ,08 ,11 ,08 ,07 ,07 EV global 1 EV global ,08 ,07 ,13 ,13 ,17 ,16 ,21 ,21 ,28 ,28 ,36 ,36 ,43 ,42 ,38 ,38 ,23 ,22 ,31 ,31 (EV in mm³) Gruppen ,15 Mittelwert Standardabw. ,20 ,28 Mittelwert OHT Standardabw. ,25 ,41 Mittelwert Präperimetr. Standardabw. ,39 ,58 Mittelwert Perimetr. Standardabw. ,44 ,33 Mittelwert Insgesamt Standardabw. ,37 Tab.19a: Mittelwerte Exkavationsvolumen Kontrollen EV nasal 2 EV nasal Gruppen ,03 Mittelwert Standardabw. ,07 ,06 Mittelwert OHT Standardabw. ,07 ,10 Mittelwert Präperimetr. Standardabw. ,13 ,15 Mittelwert Perimetr. Standardabw. ,15 ,08 Mittelwert Insgesamt Standardabw. ,12 Tab.19b: Mittelwerte Exkavationsvolumen Kontrollen ,02 ,02 ,05 ,05 ,03 ,03 ,05 ,05 ,07 ,07 ,12 ,12 ,11 ,11 ,13 ,12 ,06 ,06 ,10 ,10 (EV in mm³) Für alle Gruppen und Sektoren zeigen T-Test und Wilcoxon-Test Signifikanzen zwischen den Standard- und den korrigierten Werten. 40 Kontrollen Gepaarte Differenzen Signifikanz (2-seitig) 95% Konfidenzintervall der Differenz Standardfehler des Mittelwertes Standardabweichung Mittelwert Untere Obere 1) EV_global – EV_global_1 ,08 ,07 ,01 ,06 ,09 2) EV_global – EV_global_2 ,08 ,08 ,01 ,06 ,09 3) EV_temporal – EV_temporal_1 ,02 ,02 ,00 ,02 ,03 4) EV_temporal – EV_temporal_2 ,02 ,02 ,00 ,02 ,03 5) EV_superior – EV_superior_1 ,02 ,02 ,00 ,01 ,02 6) EV_superior – EV_superior_2 ,02 ,02 ,00 ,02 ,02 7) EV_nasal – EV_ nasal_1 ,01 ,02 ,00 ,01 ,02 8) EV_nasal – EV_ nasal_2 ,01 ,02 ,00 ,01 ,02 9) EV_inferior – EV_inferior_1 ,02 ,02 ,00 ,02 ,02 10) EV_inferior – EV_inferior_2 ,02 ,02 ,00 ,02 ,02 OHT 1) EV_global – EV_global_1 ,11 ,06 ,01 ,09 ,13 2) EV_global – EV_global_2 ,11 ,06 ,01 ,09 ,13 3) EV_temporal – EV_temporal_1 ,03 ,02 ,00 ,03 ,04 4) EV_temporal – EV_temporal_2 ,03 ,02 ,00 ,03 ,04 5) EV_superior – EV_superior_1 ,03 ,02 ,00 ,02 ,03 6) EV_superior EV_superior_2 ,03 ,02 ,00 ,02 ,04 7) EV_nasal – EV_nasal_1 ,02 ,02 ,00 ,02 ,03 8) EV_nasal – EV_nasal_2 ,02 ,02 ,00 ,02 ,03 9) EV_inferior – EV_inferior_1 ,03 ,01 ,00 ,02 ,03 10) EV_inferior – EV_inferior_2 ,03 ,02 ,00 ,02 ,03 Präperimetrische 1) EV_global – EV_global_1 ,13 ,07 ,01 ,11 ,15 2) EV_global – EV_global_2 ,13 ,07 ,01 ,11 ,16 3) EV_temporal – EV_temporal_1 ,03 ,01 ,00 ,03 ,04 4) EV_temporal – EV_temporal_2 ,03 ,02 ,00 ,03 ,04 5) EV_superior – EV_superior_1 ,03 ,02 ,00 ,03 ,04 6) EV_superior – EV_superior_2 ,03 ,02 ,00 ,03 ,04 7) EV_nasal – EV_nasal_1 ,03 ,03 ,00 ,02 ,04 8) EV_nasal – EV_nasal_2 ,03 ,03 ,00 ,02 ,04 9) EV_inferior – EV_inferior_1 ,03 ,02 ,00 ,03 ,04 10) EV_inferior – EV_inferior_2 ,04 ,02 ,00 ,03 ,04 Perimetrische 1) EV_global – EV_global_1 ,14 ,12 ,01 ,11 ,17 2) EV_global – EV_global_2 ,15 ,12 ,02 ,12 ,18 3) EV_temporal – EV_temporal_1 ,03 ,02 ,00 ,02 ,03 4) EV_temporal – EV_temporal_2 ,03 ,02 ,00 ,02 ,04 5) EV_superior – EV_superior_1 ,04 ,03 ,00 ,03 ,05 6) EV_superior – EV_superior_2 ,04 ,03 ,00 ,03 ,05 7) EV_nasal – EV_nasal_1 ,04 ,04 ,00 ,03 ,05 8) EV_nasal – EV_nasal_2 ,04 ,04 ,00 ,03 ,05 9) EV_inferior – EV_inferior_2 ,04 ,03 ,00 ,03 ,05 10) EV_inferior – EV_inferior_2 ,04 ,03 ,00 ,04 ,05 Tab.21: Signifikanzen Exkavationsvolumen im T-Test bei gepaarten Stichproben T 9,86 9,84 13,52 13,43 9,02 9,05 5,76 5,77 9,83 9,83 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* 11,98 11,55 12,73 12,30 11,82 11,53 7,55 7,42 11,48 11,05 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* 11,58 11,60 13,41 13,42 11,55 11,59 7,38 7,36 11,49 11,43 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* 9,60 9,93 10,37 10,73 8,87 9,20 7,93 8,11 10,62 10,98 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* 41 Kontrollen Z Asymptot. Signifikanz (2-seitig) (1) (2) (3) (4) (5) (6) (7) (8) (9) (10) -7,96 -7,96 -7,96 -7,96 -7,53 -7,53 -6,79 -6,79 -7,67 -7,67 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* -5,58 -5,58 -5,58 -5,58 -5,51 -5,51 -5,30 -5,30 -5,51 -5,51 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* -5,37 -5,37 -5,38 -5,37 -5,37 -5,38 -5,37 -5,37 -5,37 -5,37 ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* ,000* -6,63 -6,50 -6,53 -6,68 -6,76 ,000* ,000* ,000* ,000* ,000* OHT Z Asymptot. Signifikanz (2-seitig) Präperimetrische Z Asymptot. Signifikanz (2-seitig) Perimetrische Z -6,68 -6,74 -6,61 -6,67 -6,55 Asymptot. Signifikanz ,000* ,000* ,000* ,000* ,000* (2-seitig) Tab.20: Signifikanzen Exkavationsvolumen im Wilcoxon-Test Beim Vergleich der Kontrollen mit den perimetrischen Glaukomen sind wiederum die AUC-Werte im inferioren Segment am größten (Standard-Wert: 88%, S 66%; korr. Wert 1: 88%, S 63%; korr. Wert 2: 88%, S 64%). Die AUC nimmt nur beim Vergleich der Kontrollen plus OHT mit allen Glaukomen im temporalen Segment signifikant zu (Standard-Wert: 70,1%, S 29%; korr. Wert 1: 73%, S 32%; korr. Wert 2: 73,2%, S 33%). Die Sensitivitäten variieren nur geringfügig und nehmen beim Vergleich der Kontrollen mit den OHT zum Teil Werte um 0% an. Unter den korrigierten Werten treten Signifikanzen auf beim Vergleich 0-2 nasal und temporal, sowie beim Vergleich 2-3 global, superior und nasal. 0-1 0-2 0-3 4-5 2-3 Global Standard 68,7 / 26 78,1 / 42 85,1 / 51 78,1 / 39 62,3 / 15 Global korr. Wert 1 67,1 / 25 78,6 / 40 85,8 / 58 78,9 / 42 63,5 / 18 Global korr. Wert 2 67,1 / 25 78,9 / 40 85,7 / 52 78,9 / 44 62,8* / 13 Inferior Standard 66,3 / 21 78,9 / 47 88,0 / 66 81,1 / 44 66,4 / 28 Inferior korr. Wert 1 65,2 / 0 79,1 / 48 88,0 / 63 81,0 / 51 66,4 / 20 Inferior korr. Wert 2 65,2 / 0 79,4 / 47 88,0 / 64 81,1 / 52 65,9 / 20 Superior Standard 71,0 / 24 78,4 / 44 84,5 / 49 77,5 / 36 62,3 / 15 Superior korr. Wert 1 69,9 / 33 78,6 / 38 85,5 / 49 78,3 / 35 63,8 / 15 Superior korr. Wert 2 70,0 / 33 78,9 / 39 85,3 / 52 78,2 / 35 63,2* / 15 Nasal Standard 66,9 / 31 77,1 / 46 83,4 / 58 77,2 / 40 60,8 / 26 Nasal korr. Wert 1 65,2 / 0 76,6 / 47 83,8 / 51 77,7 / 42 62,3 / 10 Nasal korr. Wert 2 65,3 / 0 76,9* / 47 83,8 / 53 77,8 / 44 61,8* / 10 Temporal Standard 66,4 / 20 73,0 / 36 77,5 / 36 70,7 / 29 57,1 / 10 Temporal korr. Wert 1 66,0 / 26 74,3 / 35 80,1 / 40 73,0* / 32 58,7 / 15 Temporal korr. Wert 2 65,7 / 26 74,8* / 34 80,1 / 40 73,2* / 33 58,3 / 13 Tab.22: AUC Exkavationsvolumen / Sensitivität bei 90% Spezifität (in%) 42 Zusammenfassend zeigen sich also signifikante Unterschiede der neu berechneten Referenzebenen zur Standard-Referenzebene. Die größten AUC-Werte und Sensitivitäten erscheinen bei allen Parametern für das inferiore Papillensegment bei der Unterscheidung zwischen Normalen und perimetrischen Glaukomen. Allerdings zeigen hier die auf OCT-Messungen beruhenden korrigierten Werte nur mäßige Abweichungen zu den Standard-Werten. Auch in anderen Sektoren und beim Vergleich anderer Gruppen zeigen die neuen Werte keine starken Abweichungen. Bei den Parametern der Exkavation lassen sich im Gegensatz zum Randsaum kaum Veränderungen finden. Während bei den Parametern des Randsaumes die Sensitivitäten überwiegend ansteigen, kommt es bei Exkavationsvolumen und –randsaum auch häufig zu niedrigeren Werten. Lediglich beim Vergleich der Kontrollen und OHT mit allen Glaukomen besteht für das Exkavationsvolumen im temporalen Segment eine signifikante Zunahme der AUC. Vergrößerte korrigierte AUC-Werte tauchen insgesamt am häufigsten beim Randsaumvolumen auf. Hier nimmt die AUC beim Vergleich der Kontrollen mit den Präperimetrischen und beim Vergleich der Kontrollen und OHT mit allen Glaukomen signifikant zu, während sich beim Vergleich der Kontrollen mit den Perimetrischen keine signifikanten Unterschiede feststellen lassen. 43 Die höchsten Sensitivitäten finden sich durchweg für alle Parameter beim Vergleich der Kontrollen mit den Perimetrischen im inferioren Segment und nehmen durch die korrigierten Werte am stärksten für die Randsaumfläche zu. Für die Randsaumfläche besteht eine Tendenz zu niedrigeren korrigierten AUC-Werten. Hier finden sich global und nasal signifikante Abnahmen. Die AUC-Werte beim Vergleich zwischen Normal und OHT sind insgesamt am niedrigsten und zeigen auch keine Zunahme bei Anwendung der OCT-basierten Referenzebene. Der Vergleich der Prä- und Perimetrischen führt Hier ebenfalls weisen nicht eher Abweichungen auf. die zu signifikant korrigierten unterschiedlichen Werte untereinander AUC-Werten. signifikante 44 6 Diskussion 6.1 Die verschiedenen Referenzebenen Schon mehrmals wurde versucht, die Lage der Referenzebene im HRT zu optimieren. Um einen Überblick über die bisher in der Literatur diskutierten Ergebnisse zu geben, werden im Folgenden die unterschiedlichen Ansätze dargestellt. 6.1.1 „Curved Surface“ Die sogenannte „höhenmodulierte Oberfläche“ war die erste Referenzebene, die im HRT verwendet wurde. Ein Referenzring mit einem äußeren Durchmesser von 240 Pixel (2,7mm; 94% der Bildgröße) und einer Dicke von 8 Pixel (0,15mm) wird ohne Interaktion des Untersuchers automatisch auf jedes Topographiebild projiziert. Er ist in der Peripherie um die Papille lokalisiert. Die durchschnittliche Höhe aller Pixel im Referenzring wird dann als Bildebene oder Fokalebene festgelegt, wobei die absolute Tiefenposition variiert, d.h. es resultieren positive Werte bei Myopie, negative Werte bei Hyperopie. Parameter und andere Referenzebenen werden im Verhältnis zum Referenzring angegeben. Es ergeben sich negative Werte bei Erhebungen, positive Werte bei Vertiefungen (41). Abb.11: curved surface 45 Um die „höhenmodulierte Oberfläche“ als Referenzebene nutzen zu können, muss der Untersucher eine Konturlinie um den Elschnig-Skleralring der Papille einzeichnen. Die mittlere Höhe dieser Konturlinie stellt den zentralen Höhenwert der curved surface dar, von dem aus eine lineare Verbindung zu jedem Pixel der Konturlinie besteht, sodass eine Grenzfläche zwischen Exkavation und Randsaum entsteht (6). Darüber liegende Areale werden grün, darunter befindliche rot dargestellt. Allerdings wird mit dieser Methode die Exkavation häufig zu groß eingeschätzt, da die Referenzebene relativ hoch liegt (5). 6.1.2 320μm Referenzebene Um eine bessere Abgrenzung von Randsaum und Exkavation herbeizuführen, wurde eine Referenzebene entwickelt, die auf Höhe der Exkavationsgrenze liegen soll. Basierend auf der Auswertung von 300 gemittelten Topographie-Bildern ergab sich als geeignete Lokalisation der Referenzebene ein Abstand von 320μm unterhalb des Referenzringes. Areale unterhalb werden rot, Areale zwischen Referenzebene und „curved surface“ blau und oberhalb liegende Areale grün dargestellt. Abb.12: 320μm Referenzebene Diese Referenzebene ist sehr stabil und fehlerhaft eingezeichnete Konturlinien fallen nicht so sehr ins Gewicht (5; 41). In einer Studie wies sie eine geringere Variabilität Standard-Referenzebene (51). der Randsaumfläche auf, als die 46 Allerdings zeigte sich keine gute Sensitivität bei der Unterscheidung verschiedener Glaukomstadien (52). Besteht bei fortgeschrittenem Glaukom bereits peripapillär ein Schaden, so wird aufgrund der tieferen Lage des Referenzringes der Randsaum überschätzt, die Exkavation hingegen unterschätzt. 6.1.3 Standard-Referenzebene Die Standard-Referenzebene zeigt dagegen eine größere Fähigkeit die Glaukomstadien voneinander zu trennen (52). Sie liegt – wie bereits beschrieben – 50μm unterhalb der mittleren Höhe der Konturlinie im temporalen Bereich von 350° bis 356° bzw. -10° bis -4°. Grundüberlegung hierbei ist, dass dieses Areal der Papille beim Glaukom erst spät betroffen ist und der Nervenfaserverlust eher gering bleibt (11; 41; 49). Somit soll es innerhalb eines Auges als stabiler Anhaltspunkt für die Lage der Referenzebene dienen, der aber im Gegensatz zur vorher beschriebenen 320μm Referenzebene die individuellen Unterschiede in der Topographie berücksichtigt. An 180 gesunden Probanden wurden die Höhendifferenzen zwischen 180° auseinander liegenden Bildpunkten entlang der Konturlinie gemessen, wobei die größten Differenzen als mittlerer Neigungswinkel der Papillenoberfläche definiert wurden. Der durchschnittliche Neigungswinkel lag bei -7° ± 3° unterhalb des horizontalen Meridians. Somit wurde das Konturliniensegment von -10° bis -4° ausgewählt. Die mittleren Standardabweichungen der Höhenmessungen in diesem Bereich betrugen 16μm bei den Kontrollen und 23μm bei Glaukomen. Um sicherzustellen, dass die Referenzebene hinter der Grenze des Sehnervenkopfes, also hinter der Konturlinie liegt, wurden zur Höhe der Konturlinie 2 bzw. 3 Standardabweichungen addiert. So kommt man auf den Abstand von 50μm, der zwischen Konturlinie und Standard-Referenzebene besteht (5). 47 Abb.13: Standard-Referenzebene Die Standard-Referenzebene ist hinsichtlich individueller Unterschiede in der Topographie flexibel und unabhängig von der parapapillären Retinaoberfläche. Betrachtet man die Ergebnisse für den Randsaum so besteht eine signifikante Korrelation zwischen der HRT-Analyse mit Hilfe der Standard-Referenzebene und der Planimetrie (23). Allerdings besteht die Gefahr, dass bei Glaukom bedingter nasaler Abflachung die Oberfläche des Sehnervenkopfes Referenzebene liegt. Zudem zeigt eine OCT-Studie, Papillomakularbündel beim Glaukom morphologische unterhalb der dass auch das Veränderungen aufweist und stellt damit die Genauigkeit der Standard-Referenzebene in Frage (7). Bei einem temporal abgeflachten Sehnervenkopf liegt die Referenzebene zu tief und das Randsaumvolumen wird überschätzt. 6.1.4 Moorfields Referenzebene Diese Referenzebene kombiniert die Standard- mit der 320μm Referenzebene. Im Basisbild liegt sie 50μm unterhalb der Konturlinie. Der hier ermittelte Abstand zum Referenzring wird dann in den Folgebildern beibehalten. Zu den Eigenschaften einer guten Referenzebene gehört eine hohe Sensitivität für Veränderungen bei gleichzeitig geringer Variabilität. Diesbezüglich schnitt die Moorfields-Referenzebene im Vergleich zu anderen Referenzebenen 320μm gut Referenzebene ab. Sie mit verbindet der die Stabilität Anpassungsfähigkeit der der Standard-Referenzebene. Vor allem temporal superior und inferior zeigt sie eine hohe Messreproduzierbarkeit. 48 Im Vergleich zur 320µm Referenzebene war sie empfindlicher für Veränderungen (1; 41). Abb.14: Moorfields-Referenzebene 6.1.5 Experimentelle Referenzebene In einer weiteren Studie wurde eine experimentelle Referenzebene vorgestellt. Sie wurde besonders im Hinblick auf die Randsaumfläche mit der Standard- und der 320μm Referenzebene verglichen, da dieser Parameter zum Standard für die Beschreibung glaukomatöser Morphologie zählt und als sinnvoller Marker für das Fortschreiten der Erkrankung gilt (46; 51). Als Voraussetzung für den neuen Ansatz galt, dass die Referenzebene immer unterhalb der Grenze des Sehnervenkopfes liegen soll, der Abstand zu dieser Grenze für jedes Auge festgelegt ist und auf dieser Ebene die Variabilität der Randsaumfläche möglichst klein ist. Die Berechnung der neuen Referenzebene sieht folgendermaßen aus: Ref_neu = MHC + Low 5% + R. MHC steht für die mittlere Höhe der Konturlinie in Relation zum Referenzring. Im Abstand von 1° wurden auf der Konturlinie 360 Höhenwerte gemessen, von denen die niedrigsten 5% als Mittelwert (Low 5%) in die Berechnung einfließen. R ist die Distanz zwischen Low 5% und der neuen Referenzebene und beträgt in der Studie 100μm. 49 Abb.15: Experimentelle Referenzebene – modifiziert nach (52) Der Wert wurde durch Serienuntersuchungen an gesunden Probanden ermittelt. Er ist so gewählt, dass Ref_neu immer unterhalb der Konturlinie liegt und die Variabilität der Randsaumfläche minimal ist. Daraus resultiert eine signifikant geringere Variabilität der Randsaumfläche im Vergleich zur Standard- und 320μm Referenzebene, wobei die Werte der Randsaumfläche insgesamt höher lagen. Auch nacheinander geschaltete Untersuchungen an einem Patienten und wechselnde Untersucher beeinflussten die Variabilität nicht (52; 53). Als Hauptgrund für die verminderte Variabilität wird die Tatsache gesehen, dass die experimentelle Referenzebene Lageveränderungen zum Sehnervenkopf kompensiert (50). 6.1.6 OCT-gesteuerte Referenzebene Park et alumni entwickelten ähnlich der eigenen Studie eine OCT-gesteuerte Referenzebene (40). Sie maßen an frühen Glaukomstadien, Glaukomen mit Myopie und gesunden Augen die mittlere Dicke der retinalen Nervenfaserschicht (RNFL) mit dem Time-Domain-OCT und definierten die neue Höhe der Referenzebene im HRT als Ergebnis aus der mittleren Höhe der Konturlinie abzüglich der gemessenen RNFL-Dicke. Dem liegt die Annahme zugrunde, dass die Distanz zwischen der Retina-Oberfläche und dem Skleralrand am Rand des Sehnervenkopfes der RNFL-Dicke entspricht. Diese wurde jeweils an 100 Punkten auf einem Kreis nahe der Grenze des Sehnervenkopfes bestimmt und gemittelt. Bei den Glaukomen war sie signifikant kleiner (106µm vs. 145µm). 50 Auch bei Randsaumfläche, Randsaumfläche-Papillenflächen-Quotient und Randsaumvolumen zeigten sich signifikant kleinere Werte bei den Glaukomen, wobei sich die Werte höher signifikant mit der neuen Referenzebene darstellten. Die AUC für die genannten Parameter war für die neue Referenzebene größer, jedoch nicht signifikant. Die stärksten Unterschiede waren beim Vergleich der myopen Glaukome mit den Normalen zu erkennen. Tatsächlich war hier die AUC für dieselben Parameter signifikant größer. Ein Nachteil der Studie ist die geringe Probandenzahl von 50 Glaukomen, davon 25 mit Myopie und 40 gesunden Augen. Desweiteren könnte die Mittelung der RNFL-Dicke dazu führen, dass lokalisierte Defekte sich nicht ausreichend in der Berechnung widerspiegeln. Die RNFL-Dicke korreliert zudem negativ mit dem Alter, sodass alterskorrigierte Werte einbezogen werden sollten (4). Die Tatsache, dass entlang der gesamten Papillengrenze gemessen wurde widerspricht der Bedingung der Standard-Referenzebene, dass im temporalen Bereich die kleinsten morphologischen Veränderungen stattfinden, was v.a. bei den Glaukomen die Ergebnisse verzerren könnte. In jedem Fall lässt die Studie eine Tendenz zur besseren Diskrimination zwischen Glaukom und gesunden Papillen erkennen, wenn die Referenzebene des HRT mithilfe des Stratus-OCT modifiziert wird. Interpretation der eigenen Ergebnisse In der eigenen Untersuchung wurde neben dem HRT statt des TD-OCT das höher auflösende SD-OCT verwendet. Die Probandenzahl lag bei 237 und setzt sich zusammen aus 89 Normalen, 43 Okulär Hypertensiven, 39 Präperimetrischen und 66 Perimetrischen Glaukomen. Es erfolgten jeweils zwei Messungen des temporalen Abstandes zwischen der retinalen Oberfläche und der Bruch´schen Membran. Der erste Wert wurde auf einer vertikalen Linie durch das Bild gemessen, der zweite senkrecht zur Ebene des RPE. Daraus erfolgte die Berechnung zweier korrigierter Referenzhöhen und neuer HRT-Parameter, die mit den Standard-Werten verglichen wurden. 51 Ziel war es herauszufinden, ob das HRT mit den durch das OCT modifizierten Daten genauer zwischen gesunden und glaukomatösen Augen unterscheiden kann. Eine Pilotstudie der Augenklinik Erlangen an 11 Kontrollen und 11 Glaukomen hatte eine Tendenz zur besseren Diskriminierungsfähigkeit des HRT mit Hilfe dieser Methode gezeigt (2). Dabei fanden sich beim Vergleich der Kontrollen mit den Glaukomen steilere ROC-Kurven für alle Parameter. Am stärksten wirkte sich dies auf das Randsaumvolumen aus (AUC 77% vs. 92%). Die erwartete Verbesserung kann allerdings in dieser Untersuchung an einem größeren Kollektiv nicht ohne weiteres bestätigt oder zumindest nicht auf alle Parameter übertragen werden. Wie bereits bei der Pilotstudie, so können in allen Gruppen - mit Ausnahme der OHT - und in allen Sektoren Unterschiede bezüglich des Randsaumvolumens beobachtet werden. Das heißt, dass die OCT-gesteuerte Referenzebene auf diesen Parameter den stärksten Einfluss hat. Alle AUC-Werte sind mit der neuen Methode höher als im Standardverfahren. Dagegen besteht für die Randsaumfläche eher eine Tendenz zu geringeren AUC-Werten, die zum Teil signifikant sind. Insgesamt zeigt die OCT-gesteuerte Referenzebene nur geringe Auswirkungen auf die Parameter der Exkavation. Dies spiegelt sich auch in den Sensitivitäten wider, die beim Randsaum zunehmen, bei der Exkavation hingegen gleich bleiben oder abnehmen. Dies könnte unter anderem damit erklärt werden, dass das Volumen des neuroretinalen Randsaums von der Papillengröße weitgehend unabhängig ist (30). Dass die AUC beim Vergleich der Kontrollen mit den OHT Werte um 50% annehmen und die Sensitivitäten sehr gering sind ist verständlich. So liegen beim OHT per definitionem keine morphologischen Veränderungen der Papille vor. Vergleich man lediglich die RNFL-Dicke, so finden sich deutliche Unterschiede zwischen Glaukomen und Normalen bzw. OHT, aber nicht zwischen OHT und Normalen (29). Dies zeigen auch die eigenen OCTMessungen, da die Werte der Kontrollen und der OHT sich nicht signifikant unterschieden. Demnach erwartet man vom HRT, dass es nicht zwischen Normalen und OHT unterscheiden kann bzw. dass es die OHT als Normal klassifiziert. 52 Natürlich kann hier auch die OCT-gesteuerte Referenzebene keine neuen Erkenntnisse bringen, sodass die AUC-Werte sich kaum von den Standard-Werten unterscheiden. Es ist jedoch auffällig, dass beispielsweise beim Exkavationsvolumen höhere Werte auftauchen. Hier beträgt die AUC für das superiore Segment 71%. Es ist denkbar, dass sich dort doch schon geringe Veränderungen befinden, die eine Abgrenzung zwischen OHT und Normalen ermöglichen. Allerdings ist auch hier die Sensitivität gering. Beim Vergleich zwischen Normalen und präperimetrischen Glaukomen liegen die AUC und die Sensitivitäten für fast alle neu berechneten Parameter höher als für die Standard-Werte. Scheinbar führt in diesem Fall die modifizierte Referenzebene zu besseren Ergebnissen. Die Zunahme ist aber nur mäßig. Vergleicht man dagegen die Normalen mit den perimetrischen Glaukomen, so zeigen sich für die korrigierten Werte sowohl höhere als auch niedrigere AUC-Werte. Dies legt zunächst nahe, dass die OCT-gesteuerte Referenzebene für die Perimetrischen keinen diagnostischen Gewinn bringt. Allerdings ist zu beachten, dass beim Vergleich der beiden Gruppen schon mit den Standard-Werten relativ hohe AUC-Werte erreicht werden. Das HRT kann also schon grundsätzlich besser zwischen Normalen und Perimetrischen unterscheiden als zwischen Normalen und Präperimetrischen, was auch den Ergebnissen einer früheren Studie von Mardin et alumni entspricht (33). Zudem erreicht man beim Vergleich der zwei Gruppen für alle Parameter im inferioren Segment die höchsten Sensitivitäten, bis zu 79% beim Randsaumvolumen. Dennoch bleibt festzuhalten, dass der Einsatz des OCT mit Hilfe der angewandten Methode bei den Perimetrischen nicht generell eine genauere Differenzierung herbeiführt. Die Gegenüberstellung Normale plus OHT und Prä- plus Perimetrische erbringt v.a. für das Randsaumvolumen signifikant höhere AUC-Werte und Sensitivitäten bis zu 66% (im inferioren Segment), sodass man mit Hilfe dieses Parameters einen Vorteil in der Glaukomdiagnostik erzielen könnte. 53 Beim Vergleich der Prä- und Perimetrischen wiederum zeigt sich mit der angewandten Methode kein Benefit, da die AUC-Werte annähernd gleich bleiben. Die zum Teil auftretenden signifikanten Unterschiede zwischen den beiden korrigierten Werten müssen außerdem an Messungenauigkeiten denken lassen. Insgesamt kann also keine klare Verbesserung der Unterscheidungsfähigkeit des HRT zwischen den einzelnen Glaukomstadien und den Normalen beobachtet werden. Auch wenn sich bei einigen Parametern und Sektoren höhere AUC-Werte ermitteln lassen, so stellt sich doch die Frage, ob dieses Ergebnis reproduzierbar ist, inwiefern es auf den einzelnen Patienten übertragbar ist und welche klinische Relevanz es hat. So zeigten sich in der vorliegenden Untersuchung allgemein keine sehr hohen AUC-Werte, sodass es fraglich ist, ob eine geringe Verbesserung der Unterscheidungsfähigkeit des HRT von großem Nutzen wäre. Es sollten freilich auch mögliche Fehlerquellen bei der Datenerhebung bedacht werden, auf die im Folgenden eingegangen wird. 6.2 Mögliche Fehlerquellen 6.2.1 Konturlinie im HRT Es wurde bereits beschrieben, dass die Festlegung der Konturlinie ein wichtiger Faktor ist, der auf die Berechnung der Parameter großen Einfluss nehmen kann. Sie sollte daher möglichst von erfahrenen Untersuchern präzise am inneren Rand des Elschnig-Skleralringes eingezeichnet werden. Die falschfarbenkodierten Bilder können dabei hilfreich sein, papilläre Strukturen besser zu erkennen, da sie dem ophthalmoskopischen Bild ähneln und häufig den Skleralring deutlicher darstellen; es sollte jedoch bedacht werden, dass sie gegenüber dem schwarz-weiß Bild keine zusätzlichen Informationen enthalten (6). Verschiedene Arbeiten verdeutlichen den Einfluss der Konturlinie. So zeigt eine Studie, dass die Position der Referenzebene im HRT bei mehrmaligem Einzeichnen der Konturlinie in dasselbe Bild schwankt. 54 Die Abweichungen werden dabei geringer, wenn die Form der Konturlinie durch Addition mehrerer Kreise bestimmt wird, als durch freies Einzeichnen (3). In Zweifelsfällen sollte die Konturlinie eher größer als zu klein ausfallen, da es so zu geringeren Abweichungen kommt (18). Weiterhin beschreibt ein Artikel, dass auch zwischen Experten untersucherabhängige Unterschiede der Evaluation von HRT-Bildern bestehen (16). Diese waren besonders hoch bei kleinen Papillen mit einem kleinen Verhältnis von Exkavationszu Papillenfläche (Cup/disc area ratio). Als eine entscheidende Stellgröße wird auch hier die Konturlinie erwähnt. Andere Autoren vertreten wiederum die Meinung, dass die Evaluation der HRT-Bilder nur geringfügig von der Konturlinie beeinflusst wird (14; 44). Sie fanden, dass die Reproduzierbarkeit der Parameter bei Anwendung größerer Konturlinien sowie bei Nutzung der Export/Import-Funktion zunimmt. Dies trifft jedoch nur in geringem Maße für gesunde Augen, nicht für Glaukome zu. Als Ursache werden hier die topographischen Verhältnisse gesehen, da beim Glaukom der Randsaum abgeflacht ist und die Lage der Konturlinie weniger stark abweichen kann als bei einer normalen Papille. Obwohl versucht wurde, die Konturlinie exakt zu platzieren mit Nutzung der Export/Import-Funktion und durch Addieren mehrerer Kreise, kann also nicht abschließend versichert werden, dass sie in jedem Bild die optimale Lage hat. 6.2.2 Bildauswahl im SD-OCT Von den drei aufgenommenen OCT-Bildern, die aus 25-30 B-Scans gemittelt werden, wurde jeweils ein Bild pro Auge mit der subjektiv besten Qualität ausgewählt und vermessen. Möglicherweise handelt es sich aber nicht bei jedem dieser Bilder um ein repräsentatives Abbild der realen Verhältnisse. Bei manchen Bildern ist es zudem aufgrund eingeschränkter Kontrastverhältnisse schwierig, die Strukturen ganz präzise zu erfassen. 6.2.3 Messung im SD-OCT-Bild Wie bereits beschrieben, wurde jedes Bild zweimal vermessen. 55 Für den ersten Wert wurde eine vertikale Linie durch den temporalen Rand der Bruch´schen Membran gezogen und der Abstand zwischen dieser und der retinalen Oberfläche gemessen. Für den zweiten Wert wurde eine gerade Verbindung zwischen dem temporalen und nasalen retinalen Pigmentepithel gezogen und der gleiche Abstand senkrecht zu dieser Linie gemessen. Die zweite Messung soll falsche Werte bei leicht schrägen Papillenaufnahmen verhindern. Alle Messungen erfolgten manuell mit dem Lineal. Minimale Messfehler sind nicht gänzlich auszuschließen, besonders bei Bildern von nicht optimaler Qualität. Hier wäre eine zuverlässige automatische Strukturerkennung mit digitaler Vermessung durch das OCT selbst präziser. 56 7 Ausblick Durch die angewandte Querschnittsuntersuchung Methode keine kann im eindeutige Rahmen Verbesserung einer der Diskriminierungsfähigkeit des HRT zwischen Normalen und Glaukomen erreicht werden. Wirkungsvoller ist eine Kombination mehrerer Parameter in Form einer Diskriminanzanalyse (33; 37). Mit den Nachfolgemodellen des HRT konnten bereits zum Teil Verbesserungen der Algorithmen für eine präzisere Differenzierung zwischen normalen und glaukomatösen Papillen sowie eine Vereinfachung bei der Festlegung der Konturlinie realisiert werden (11). Zukünftige Studien können zeigen, ob sich die OCT gesteuerte Referenzebene im Langzeitverlauf stabiler gegenüber dem Standard erweist. Die Messwerte belegen, dass sich die Referenzhöhe mit dem Fortschreiten der Erkrankung verringert, sodass Vorteile bei Langzeituntersuchungen angenommen werden. In jedem Fall sollten Diagnosevorschläge des HRT nicht unkritisch übernommen werden. Erstrebenswert ist letztendlich immer das Einbringen ärztlicher Expertise, sowie die Zusammenschau verschiedener klinischer Untersuchungsverfahren, die sich gegenseitig ergänzen und somit Schwachstellen einzelner diagnostischer Methoden kompensieren können. Noch gibt es keine konkreten Untersuchungspfade, die evidenzbasiert empfohlen werden können, wie verschiedene Übersichtsarbeiten zeigen (35; 55). Dies ist jedoch Gegenstand klinischer Studien und wird möglicherweise in Zukunft die Diagnose und Therapie des Glaukoms erleichtern. 57 8 Literaturverzeichnis 1. Asaoka R, Strouthidis NG, Kappou V, Gardiner SK, Garway-Heath DF. HRT-3 Moorfields reference plane: effect on rim area repeatability and identification of progression. Br J Ophthalmol. Nov 2009, 93(11), S. 15101513. 2. Baleanu D, Tornow R, Lämmer R, Kruse FE, Horn FK, Mardin CY. OCT guided reference plane for Scanning Laser Tomography measurements of the optic disc in normals and glaucomas. Poster ARVO 2008 & Poster EGS 2008. 3. Bartz-Schmidt KU, Jonescu-Cuypers CP, Thumann G, Frucht J, Krieglstein GK. Zum Einfluss der Konturlinie auf die Exkavationsfläche beim Heidelberg Retina Tomograph. Klin Monatsbl Augenheilkd. 1996, 209, S. 292-297. 4. Bendschneider D, Tornow RP, Horn FK, Laemmer R, Roessler CW, Juenemann AG, Kruse FE, Mardin CY. Retinal nerve fiber layer thickness in normals measured by spectral domain OCT. J Glaucoma. Sep 2010, 19(7), S. 475-482. 5. Burk ROW, Vihanninjoki K, Bartke T, Tuulonen A, Airaksinen PJ, Völcker HE, König JM. Development of the standard reference plane for the Heidelberg retina tomography. Graefe´s Arch Clin Exp Ophthalmol. 2000, 238, S. 375-384. 6. Burk ROW, Rohrschneider K, Noack H, Völcker HE. Volumetrische Papillenanalyse mit Hilfe der Laser-Scanning-Tomographie. Klin Monatsbl Augenheilkd. 1991, 198, S. 522-529. 7. Chen E, Gedda U, Landau I. Thinning of the papillomacular bundle in the glaucomatous eye and its influence on the reference plane of the Heidelberg retinal tomograph. J Glaucoma. 2001, 10, S. 386-389. 8. Chile, StAR. Pontificia Universidad Católica de. StAR. [Online] Molecular Bioinformatics Laboratory, 2007. [Zitat vom: 11. Jun 2010.] http://protein.bio.puc.cl/cardex/servers/roc/home.php. 9. Cremasco F, Massa G, Goncalves Vidotti V, Pedroso de Carvalho Lupinacci A, Costa VP. Intrasession, intersession, and interexaminer variabilities of retinal nerve fiber layer measurements with spectral-domain OCT. Eur J Ophthalmol. 2011, 21(3), S. 264-270. 58 10. Fingeret, M. Bildaufnahme und Datenanalyse mit dem HRT II. [Hrsg.] Heidelberg Engeneering. HRT-Fibel. 2, S. 11-30. 11. Girkin, CA. Grundlagen der konfokalen Laser-Scan-Technik für den Arzt. [Hrsg.] Heidelberg Engeneering. HRT-Fibel. 1, S. 1-9. 12. Gundersen KG, Heijl A, Bengtsson B. Optic nerve head sector analysis recognizes glaucoma most effectively around disc poles. Acta Ophthalmol Scand. 1999, 77, S. 13-18. 13. Hartung J, Elpelt B, Klösener KH. Grundbegriffe der Wahrscheinlichkeitsrechnung. [Buchverf.] Hartung J. Statistik. Lehr- und Handbuch der angewandten Statistik. 14.Auflage. Oldenbourg : Oldenbourg Verlag, 2005, II, S. 118 (1004). 14. Hatch WV, Flanagan JG, Williams-Lyn DE, Buys YM, Farra T, Trope GE. Interobserver agreement of Heidelberg retina tomograph parameters. J Glaucoma. Aug 1999, 8(4), S. 232-237. 15. Hayreh, SS. Optic disc changes in glaucoma. Br J Ophthalmol. 1972, 56, S. 175-185. 16. Hermann MM, Garway-Heath DF, Jonescu-Cuypers CP, Burk ROW, Jonas JB, Mardin CY, Funk J, Diestelhorst M. Interobserver variability in confocal optic nerve analysis (HRT). Int Ophthalmol. 2005, 26, S. 143-149. 17. Hildebrandt, H. Pschyrembel. Klinisches Wörterbuch. [Hrsg.] O. Dornblüth. Berlin : De Gruyter Verlag, 2001. S. 1842. 18. Hoffmann EM, Lamparter J, Schmidt T, Schulze A. Glaukomdiagnostik und Verlaufskontrolle mit dem Heidelberg Retina Tomograph. Der Ophthalmologe. 2009, 106(8), S. 687-695. 19. Hoffmann, EM. Neue Möglichkeiten in der Glaukomdiagnostik. Ophthalmologe. 2009, 106, S. 674-675. 20. Horn FK, Mardin CY, Lämmer R, Baleanu D, Jünemann AM, Kruse FE, Tornow RP. Correlation between local glaucomatous visual field defects and loss of nerve fiber layer thickness measured with polarimetry and spectral domain OCT. Inv Ophthalmol Vis Sci. 2009, 50(5), S. 1971-1977. 21. Hoyt WF, Schlicke B, Eckelhoff RJ. Fundoscopic appearance of a nerve-fibre-bundle defect. Br J Ophthalmol. 56, S. 577-583. 22. Jonas JB, Gusek GC, Naumann GOH. Optic disc, cup and neuroretinal rim size, configuration and correlations in normal eyes. Invest Ophthalmol Vis Sci. 1988, 29, S. 1151-1158. 59 23. Jonas J, Mardin C, Grundler A. Comparison of measurements of neurretinal rim area between confocal laser scanning tomography and planimetry of photographs. Br J Ophthalmol. 1998, 82, S. 362-366. 24. Jonas JB, Fernández M, Stürmer J. Pattern of glaucomatous neuroretinal rim loss. Ophthalmology. 1993, 100, S. 63-67. 25. Kaiser, PK. The next step in OCT technology. Spectral domain provides unprecedented views of the retina. Retinal Physician. [Online] Jan 2008. [Zitat vom: 11.Juni 2009.]-------------------------------------------------------------------http://www.retinalphysician.com/article.aspx?article=101289. 26. Kamal DS, Viswanathan AC, Garway-Heath DF, Hitchings RA, Poinossawmy D, Bunce C. Detection of optic disc change with the Heidelberg retina tomograph before confirmed visual field change in ocular hypertensives converting to early glaucoma. Br J Ophthalmol. 1999, 83(3), S. 290-294. 27. Kruse FE, Burk RO, Völcker HE, Zinser G, Harbarth U. Reproducibility of topographic measurements of the optic head with laser tomographic scanning. Ophthalmology. 1. Sep 1989, 96(9), S. 1320-1324. 28. Lee JR, Jeoung JW, Choi J, Choi JY, Park KH, Kim YD. Structurefunction relationships in normal and glaucomatous eyes determined by timeand spectral-domain optical ceherence tomography. Invest Ophthalmol Vis Sci. 2010, 51(12), S. 6424-6430. 29. Mansoori T, Viswanath K, Balakrishna N. Quantification of retinal nerve fiber layer thickness in normal eyes, eyes with ocular hypertension, and glaucomatous eyes with SD-OCT. Ophthalmic Surg Lasers Imaging. 2010, 41, S. S50-57. 30. Mardin CY, Horn FK, Budde WM, Jonas JB. Morphometrische Querschnitssverlaufsbeobachtung der Papille mit dem HRT in Augen mit morphologischer Progression der glaukomatösen Atrophie der Papille des Nervus opticus. Klin Monatsbl Augenheilkd. 2000, 217, S. 82-87. 31. Mardin CY, Horn FK. Influence of optic disc size on the sensitivity of the Heidelberg Retina Tomograph. Graefes Arch Clin Exp Ophthalmol. Sep 1998, 236(9), S. 641-645. 32. Mardin CY, Horn FK, Viestenz A, Lämmer R, Jünemann A. Normale Papillen mit großer Exkavation - eine diagnostische Herausforderung bei Glaukomen. Klin Monatsbl Augenheilkd. 2006, 223, S. 308-314. 60 33. Mardin CY, Horn FK, Jonas JB, Budde WM. Preperimetric glaucoma diagnosis by confocal scanning laser tomography of the optic disc. Br J Ophthalmol. 1999, 83, S. 299-304. 34. Michelson G, Hornegger J, Lausen B. Die Papille als ScreeningParameter auf Glaukom. [Hrsg.] G.K. Krieglstein. Glaukom 2007. Die Papille beim Glaukom. Heidelberg : Springer Medizin Verlag, 2008, 11, S. 137-149. 35. Michelson G, Hornegger J, Wärntges S, Lausen B. Die Papille als Screening-Parameter für die Früherkennung des Glaukoms. Dtsch Ärztebl. 2008, 105(34-35), S. 583-589. 36. Mikelberg FS, Wjisman K, Schukzer M. Reproducibility of topographic parameters obtained with the Heidelberg Retina Tomograph. J Glaucoma. 1993, 2, S. 101-103. 37. Mikelberg FS, Parfitt CM, Swindale NV. Ability of Heidelberg Retina Tomograph to detect early glaucomatous visual field loss. J Glaucoma. 1995, 4, S. 242-247. 38. O´Leary N, Crabb DP, Mansberger SL, Fortune B, Twa MD, Lloyd MJ, Kotecha A, Garway-Heath DF, Cioffi DA, Johnson CA. Glaucomatous progression in series of stereoscopic photographs and Heidelberg retina tomograph images. Arch Ophthalmol. 2010, 128(5), S. 560-568. 39. Pache M, Funk J. Hightech in der Glaukomdiagnostik. Klin Montasbl Augenheilkd. 2006, 223, S. 503-508. 40. Park KH, Caprioli J. Development of a Novel Reference Plane for the Heidelberg retina tomography with optical coherence tomography measurements. J Glaucoma. 2002, 11, S. 385-391. 41. Poli A, Strouthidis NG, Ho TA, Garway-Heath DF. Analysis of HRT Images: Comparison of Reference Planes. Ophthalmol Vis Sci. 2008, 49, S. 3970-3975. 42. Quigley HA, Addicks EM, Green WR. Optic nerve damage in human glaucoma III. Quantitative correlation of nerve fiber loss and visual field defect in glaucoma, ischemic optic neuropathy, papilledema and toxic neuropathy. Arch Ophthalmol. 1982, 100, S. 135-146. 43. Quigley, A. Number of people with glaucoma worldwide. Br J Ophthalmol. 1996, 80, S. 389-393. 61 44. Roff EJ, Hosking SL, Barnes DA. The influence of contour line size and location on the reproducibility of topographic measurement with Heidelberg Retina Tomograph. Ophthal Physiol Opt. 2001, 21, S. 173-181. 45. Rohrschneider K, Burk RO, Kruse FE, Völcker HE. Reproducibility of the optic nerve head topography with a new laser tomographic scanning device. Ophthalmology. 1995, 101, S. 1044-1049. 46. Saarela V, Falck A, Airaksinen PJ, Tuulonen A. The sensitivity and specifity of Heidelberg Retina Tomograph parameters to glaucomatous progression in disc photographs. Br J Ophthalmol. 2010, 94, S. 68-73. 47. Sachsenweger, M. Vorderkammer und Glaukom. [Hrsg.] A Bob und K Bob. Augenheilkunde. 2. Auflage. Stuttgart : Georg Thieme Verlag, 2003, 12, S. 210-238 (443). 48. Schulze A, Lamparter J, Hoffmann EM. Neue Möglichkeiten der hochauflösenden optischen Kohärenztomographie in der Glaukomdiagnostik. Ophthalmologe. 2009, 106, S. 702-708. 49. Schwenn, O. Laser-Scanning-Tomographie - Indikationen und kritische Befundinterpretation. [Hrsg.] G.K. Krieglstein. Glaukom 2007. Die Papille beim Glaukom. Heidelberg : Springer Medizin Verlag, 2008, 4, S. 37-50. 50. Sharma K, Tan JCH, Hitchings RA. Sources of variability in threedimensional optic nerve head quantitative analysis. Inv Ophthalmol Vis Sci. 2001, 42(4), S. 134. 51. Tan JCH, Garway-Heath DF, Hitchings. Variability across the optic nerve head in scanning laser tomography. Br J Ophthalmol. 2003, 87, S. 557-559. 52. Tan JCH, Hitchings RA. Reference plane definition and reproducibility in optic nerve head images. Inv Ophthalmol Vis Sci. 2003, 44, S. 1132-1137. 53. Tan JCH, White E, Poinoosawmy D, Hitchings RA. Validity of Rim Area Measurements by different Reference Planes. J Glaucoma. 2004, 13, S. 245-250. 54. Thylefors B, Negrel AD. The global impact of glaucoma. Bull WHO. 1994, Bd. 72, S. 323-326. 55. Vass, C. Moderne diagnostische Verfahren bei Glaukomverdacht und Glaukom. Klin Monatsbl Augenheilkd. 2004, 221, S. 227-246. 62 56. Weinreb RN, Shakiba S, Sample PA. Association between quantitative nerve fiber layer measurements and visual field loss in glaucoma. Am J Ophthalmol. 1995, 120, S. 732-738. 57. Wu H, de Boer JF, Chen TC. Reproducibility of retinal nerve fiber layer thickness measurements using spectral domain tomography. J Glaucoma. 2011, 20(8), S.470-476. optical coherence 63 9 Abkürzungsverzeichnis AUC Area under the Curve Dpt Dioptrien EF Exkavationsfläche EV Exkavationsvolumen HRT Heidelberg Retina Tomograph MHC Mean Height of Contour Line Msd Mean Standard Deviation N Anzahl der untersuchten Augen OCT Optical Coherence Tomograph OHT Okulär Hypertensive Ref_neu Neue Referenzebene RF Randsaumfläche RNFL Retinal Nerve Fiber Layer ROC Receiver Operating Characteristic RPE Retinales Pigmentepithel RV Randsaumvolumen S Sensitivität SD-OCT Spectral Domain Optical Coherence Tomograph SPSS Statistical Package for the Social Sciences StAR Statistical Analysis of Roc Curves TD-OCT Time Domain Optical Coherence Tomograph TM Third Moment 64 10 Danksagung Ganz herzlich möchte ich mich bei meinem Doktorvater Herrn Prof. Dr. Mardin für die freundliche Überlassung des Themas und für die gute Betreuung bedanken. Ein ganz besonderer Dank geht an Frau Dr. Bendschneider für die intensive Begleitung und Beratung, die jederzeit ansprechbar war und ausführliche Hilfestellung leistete, so auch bei der ophthalmologischen Untersuchung der Patienten. Für die Hilfe bei der Planung der Statistik bedanke ich mich bei Herrn Dipl.-Ing. Dr. Horn. Frau Monczak danke ich für die freundliche Unterstützung bei der EDV-Aufbereitung. Abschließend möchte ich mich bei meiner Familie bedanken, die mich in allen Schritten unterstützt und motiviert hat.