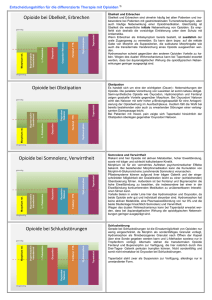
Allgemeine und Klinische Pharmakologie häufig verwendeter oral
Werbung

1. Jahrgang, April 2007, 17-30 ---Erstausgabe--- Allgemeine und Klinische Pharmakologie häufig verwendeter oral verfügbarer Opioide Bedeutung der Unterschiede für die ambulante Schmerztherapie - Teil 2 - Nebenwirkungen Schmerztherapie Klinische Prüfung Neue Strategien Fortbildungstelegramm Pharmazie 2007;1:17-31 Pharmakologie häufig verwendeter oral verfügbarer Opioide - 18 - Inhaltsverzeichnis Zusammenfassung 3 Teil 1 - Allgemeiner Teil 4 Einleitung 4 Wirkungsmechanismus der Opioidanalgetika 5 Pharmakokinetik der Opioidanalgetika 8 Zentral vermittelte Wirkungen der Opioidanalgetika 10 Peripher vermittelte Wirkungen der Opioidanalgetika 14 Literatur 16 Teil 2 - Spezieller Teil 20 Nebenwirkungen bei der Therapie mit Opioidanalgetika 20 Grundlagen zur Schmerztherapie mit Opioidanalgetika 22 Einfluss der Darreichungsform auf die Therapie mit Opioidanalgetika 23 Klinische Prüfung von Opioidanalgetika 23 Auswahl der Opioidanalgetika für die Schmerztherapie 24 Opioidrotation 25 Langfristige analgetische Therapie mit Opioiden 26 Therapie mit Opioidanalgetika in der Schwangerschaft 27 Neue Strategien zur Verbesserung der Schmerztherapie mit Opioidanalgetika 27 Literatur 30 Titelbild : Universitätsbibliothek New York , Urheber : Photoprof , Lizenz : Fotolia Fortbildungstelegramm Pharmazie 2007;1:17-31 Pharmakologie häufig verwendeter oral verfügbarer Opioide - 19 - Zusammenfassung Opioide sind Liganden an Rezeptoren, die endogen gebildete Endorphine binden und deren Wirkungen vermitteln. Obwohl Opioide sehr gut analgetisch wirken, sind sie nicht bei jeder Form von Schmerz gleichermaßen effektiv. Außerdem zwingen auch die Gefahren der Dauerbehandlung zum Einsatz von adjuvanten Therapien. Die kurzfristige Behandlung ist im Allgemeinen unproblematisch, wenn gut bekannte Nebenwirkungen wie Atemdepression, Erbrechen, Blutdruckabfall, Urtikaria und Pruritus beachtet werden. Die häufigste Nebenwirkung ist die Obstipation. Sie verstärkt und verlängert die Symptome der postoperativen Darmatonie und verursacht eine deutliche Einschränkung der Lebensqualität. Hier kann sich die gleichzeitige orale Gabe von Naloxon als fixe Kombination günstig auswirken. sich Arzt und Apotheker durch eine koordinierte Zusammenarbeit gut ergänzen. Retardierte Arzneiformen werden heute bevorzugt, denn sie weisen wichtige Vorteile wie konstante Plasmaspiegel und ein bequemes Dosierungsintervall auf und ermöglichen daher eher die insgesamt vorteilhafte und empfohlene „around the clock“-Dosierung. Die Langzeitbehandlung chronischer nicht Tumor-assoziierter Schmerzen hat in den letzten Jahren deutlich zugenommen. Obwohl zu vermuten ist, dass sich dadurch insgesamt die Versorgung mit einer adäquaten analgetischen Therapie verbessert hat, sind die klinischen Evidenzen hierfür gering. Auch deshalb müssen bei dieser Art der Opioidtherapie strenge Richtlinien eingehalten werden, damit die Therapie sicher und effektiv bleibt. Es hat sich gezeigt, dass die Langzeittherapie chronischer nicht Tumor-assoziierter Schmerzen mit Neurotoxizität, Hyperalgesie, Wirkungen auf das Hormonsystem, Immunsuppression und der Gefahr einer Suchtentwicklung verbunden sein kann. Die Richtlinien sehen neben einem besonderen ärztlichen Sachverstand auch eine Reihe von Kontrollen zur Vermeidung von Fehlverhalten und eigenmächtiger Einnahme seitens des Patienten sowie eine genaue Dokumentation des Therapieverlaufs vor. Hierbei können Fortbildungstelegramm Pharmazie 2007;1:17-31 Pharmakologie häufig verwendeter oral verfügbarer Opioide Nebenwirkungen bei der Therapie mit Opioiden Grundsätzlich sind alle Wirkungen der Opioide mit Ausnahme der Analgesie als Nebenwirkungen zu betrachten. Manche dieser Wirkungen, z.B. die Euphorie, kann jedoch auch therapeutisch wertvoll sein. Wie in Tab. 1 dargestellt, sind die - 20 Unterschiede zwischen den einzelnen Opioiden im Wesentlichen auf die Häufigkeit beschränkt. Jedoch kann dies im Einzelfall durchaus variieren, z.B. wenn das Opioid wegen nachlassender Wirksamkeit oder Unverträglichkeit ausgetauscht werden muss (siehe auch Opioidrotation). Nebenwirkungen oraler Opioide im Vergleich Buprenorphin Hydromorphon Häufigkeit Morphin Oxycodon Psyche sehr häufig (>10%) Stimmungsschwankungen (Euphorie, Dysphorie) Stimmungsschwankungen (Euphorie, Dysphorie, Angst, Depression) häufig (>1%-<10 %) Aktiviertheitsänderungen (meist Dämpfung, auch Steigerung) Aktiviertheitsänderungen (meist Dämpfung, auch Steigerung) Denkstörungen Denkstörungen Halluzinationen Verwirrtheit Schlaflosigkeit Stimmungsschwankungen (Euphorie und Dysphorie) Verwirrtheit Verwirrtheit gelegentlich (>0,1%-<1%) Wahrnehmungsstörungen Wahrnehmungsstörungen StimmungsschwanStimmungsschwankungen (Euphorie kungen (Euphorie, und Dysphorie) Dysphorie, Unruhe, Depression), Halluzinationen, Psychosen Häufigkeit Nervensystem sehr häufig (>10%) Müdigkeit, Schlaf häufig (>1%-<10 %) Benommenheit Kopfschmerzen Asthenie Schwindel Kopfschmerzen Kopfschmerzen Schwindel Schwindel Somnolenz Asthenie Kopfschmerzen Hyperästhesie Zittern, Krämpfe, fehlende Muskelkoordination Tremor oder unwillkürliche Muskelkontraktionen Koordinationsstörungen Schwindel Sedierung gelegentlich (>0,1%-<1%) verwaschene Sprache Tremor oder unwillkürliche Muskelkontraktionen Parästhesie Koma Häufigkeit gelegentlich (>0,1%-<1%) Augen (Miosis ist typische Begleiterscheinung) Sehstörungen (Doppeltsehen) Sehstörungen (Verschwommensehen) Sehstörungen Konjunktivitis Tab. 1: Sehr häufig bis gelegentlich auftretende Nebenwirkungen der Opioidtherapie, Teil 1 [Angaben aus (1-4)] Fortbildungstelegramm Pharmazie 2007;1:17-31 Pharmakologie häufig verwendeter oral verfügbarer Opioide - 21 - Nebenwirkungen oraler Opioide im Vergleich Buprenorphin Hydromorphon Morphin Oxycodon Häufigkeit Gastrointestinaltrakt (Obstipation ist typischer Begleiteffekt) sehr häufig (>10%) Erbrechen häufig (>1%-<10 %) gelegentlich (>0,1%-<1%) Übelkeit Erbrechen Erbrechen Appetitlosigkeit Appetitabnahme Übelkeit Mundtrockenheit Erbrechen Mundtrockenheit Übelkeit Dyspepsie Dyspepsie Geschmacksstörung Schluckauf Übelkeit und Mundtrockenheit (dosisabhängig!) Gallenkoliken Appetitlosigkeit Bauchschmerzen Dyspepsie Dyspepsie Diarrhoe Mundgeschwüre Mundtrockenheit Zahnfleischentzündungen Häufigkeit Haut und allergische Reaktionen sehr häufig (>10%) häufig (>1%-<10 %) Flatulenz Pruritus Schwitzen Pruritus Pruritus Schwitzen Schwitzen Hautausschlag (selten: Photosensibilität) Urtikaria (auch durch Farbstoff Gelborange Allergie möglich) gelegentlich (>0,1%-<1%) Hautausschlag Urtikaria (auch Blässe) Urtikaria Pruritus Häufigkeit Herz-Kreislaufsystem häufig (>1%-<10 %) Hypotonie Hypotonie gelegentlich (>0,1%-<1%) Hypertonie Tachykardie Blutdrucksenkung (selten mit Folgesymptomen) Abfall und Anstieg Vasodilatation von Blutdruck und Pulsbeschleunigung Herzfrequenz (klinisch bedeutsam) Tachykardie Bradykardie (AV-Block) Zyanose Häufigkeit Nieren und Harnwege häufig (>1%-<10 %) gelegentlich (>0,1%-<1%) Harnverhalten, vermehrter Harndrang Blasenentleerungsstörungen Beeinträchtigungen beim Wasserlassen Miktionsbeschwerden Häufigkeit Atemwege sehr häufig (>10%) Hypoventilation häufig (>1%-<10 %) Dyspnoe, Apnoe gelegentlich (>0,1%-<1%) Dyspnoe vermehrtes Husten Stimmveränderung Tab. 1: Sehr häufig bis gelegentlich auftretende Nebenwirkungen der Opioidtherapie, Teil 2 [Angaben aus (1-4)] Fortbildungstelegramm Pharmazie 2007;1:17-31 Pharmakologie häufig verwendeter oral verfügbarer Opioide Beachtenswert ist in jedem Fall, dass zu Beginn der Therapie manche der Nebenwirkungen zu akuten Unverträglichkeiten führen können, während sie bei länger dauernder Therapie durchaus toleriert werden. Dies gilt u.a für Blutdruckabfall mit Synkopen, Erbrechen, oder Urtikaria. Auch deshalb kann aus der durchschnittlichen vom Hersteller angegebenen Häufigkeit nicht auf die therapeutische Sicherheit geschlossen werden (zur Suchtgefahr siehe oben). Dennoch fällt auf, dass Hydromorphon und Buprenorphin deutlich (ca. 10-fach) seltener Stimmungsschwankungen wie Euphorie oder Dysphorie auslösen. Ein solcher Unterschied kann sich sowohl therapeutisch günstig als auch nachteilig auswirken. So könnte die Euphorie auslösende Wirkung von Morphin und Oxycodon einem Patienten nutzen, der durch seine Erkrankung psychisch stark belastet ist. Auch wenn akute Unverträglichkeiten bei einer Dauertherapie oft nachlassen, können andere Nebenwirkungen in den Vordergrund treten, die die Sicherheit und Effektivität der Opioidtherapie beeinträchtigen. Hierzu zählen eine Verminderung von Fertilität, Libido und Antrieb, eine Immunsuppression, sowie eine Hyperalgesie (5,6). Solche Effekte komplizieren die Therapie vor allem, wenn es sich nicht um die palliative Behandlung Todkranker handelt, sondern wenn die Verbesserung der Lebensqualität chronisch Kranker im Vordergrund steht. Schließlich hat sich in den letzten Jahren gezeigt, dass Opioide einen Komplex von meist exzitatorischen Effekten auslösen können, die unter dem Begriff Neurotoxizität zusammengefasst werden (7). Diese Effekte treten vor allem nach hoher Dosierung und Langzeitgabe sowie bei Patienten mit Niereninsuffizienz und leichten Störungen der Wahrnehmung in der Anamnese auf. Die Symptomatik umfasst Hyperalgesie, Halluzinationen, Delirium, Koma, Myoklonien, schwere Sedation, zerebrale Krämpfe (GrandMal) und Störungen der Wahrnehmung. Diese Effekte sind bislang vor für allem Morphin beschrieben worden (7). In solchen Fällen kann eine Reduktion der - 22 Dosis oder eine Opioidrotation (siehe unten) versucht werden. Grundlagen zur Schmerztherapie mit Opioidanalgetika Die gute Wirksamkeit der Opioide zur Behandlung starker Schmerzen ist unumstritten. Die Wirkstärke eines Analgetikums wird allerdings auch von der dem Schmerz zugrunde liegenden Pathogenese bestimmt. So spricht z.B. Schmerz durch Entzündungen teilweise besser auf nichtsteroidale Antiphlogistika wie Diclofenac oder Indometecin an, denn diese NSAR greifen im Gegensatz zu Opioiden direkt in die Pathogenese der Schmerzentstehung ein und hemmen das dem Schmerz zugrunde liegende entzündliche Geschehen. Ein gutes Beispiel hierfür ist der Rheumaschmerz. Stufenschema der WHO Stufe I Nicht-Opioid (ASS, Paracetamol,NSAR) ± Adjuvantien Stufe II Leicht-mittelstarkes Opioid (z.B. Codein, Dihydrocodein) ± Nicht Opioid ± Adjuvantien Stufe III Mittelstark-starkes Opioid (z.B. Morphin, Oxycodon Hydromorphon, Buprenorphin) ± Nicht Opioid ± Adjuvantien Diese Unterschiede sowie die Gefahr einer Suchtentwicklung sind die Basis der Idee des WHO-Stufenschemas. Auch wenn dieses eine gute und einfache Richtschnur für Behandlung ist, gibt es eine Reihe von Ausnahmesituationen, in welcher unter Umgehung der ersten beiden Stufen direkt Opiate verwendet werden (8). Trotzdem bleibt das Schema ein unschätzbares Werkzeug für die Behandlung von Tumorschmerz in der ambulanten Versorgung (9). Für die Therapie mit Opioiden sind eine Reihe von Richtlinien entwickelt worden, Fortbildungstelegramm Pharmazie 2007;1:17-31 Pharmakologie häufig verwendeter oral verfügbarer Opioide die den verschiedenen klinischen Situationen Rechnung tragen. Hierzu gehören Richtlinien zur Behandlung von akutem Schmerz (postoperativ, Trauma), von Tumorschmerz, von nicht malignen chronischen Schmerzen und von Schmerzen bei Kindern (10). Als wichtige Grundlage gilt, dass die Therapie wenn möglich oral, jedoch immer nach einem festen Schema erfolgen sollte. Eine ausschließlich bedarfsorientierte Schmerztherapie ist zu vermeiden (zu Neuen Strategien siehe unten). Zur Behandlung des postoperativen Schmerzes werden Opioide oft als Monotherapeutika eingesetzt und nach einem festen Dosierungsschema appliziert. Dies dient einer konstanten Unterdrückung des Schmerzes und führt insgesamt zu einer Reduktion des Opioidverbrauches. Es kann davon ausgegangen werden, dass bei kurzfristiger Anwendung von Opioiden zu Behandlung des postoperativen Schmerzes die Suchtinzidenz sehr gering ist. Einfluss der Darreichungsform auf die orale Therapie mit Opioidanalgetika Abgesehen von dem Arzneistoff selbst ist auch die galenische Formulierung von Bedeutung für das Ziel, eine möglichst ununterbrochene Analgesie bei Tumorund chronischem Schmerz durch andere Erkrankungen zu gewährleisten. Eine solche Strategie lässt sich mit Ausnahme von Levomethadon wegen der kurzen Halbwertszeiten der Opioide (Tab. 2) nur durch eine Retardierung erreichen. Die Retardierung führt zu einer langsameren Freisetzung der Wirkstoffe bei der Magen-Darm Passage. Damit verbunden sind einige wichtige Vorteile für die Therapie: • bequemeres Dosierungsintervall • konstantere Plasmaspiegel • Vermeidung unnötig hoher Opioidspiegel im Plasma (weniger Nebenwirkungen) • Vermeidung unwirksam niedriger Opioidspiegel im Plasma (weniger Schmerzepisoden) - 23 Diese Vorteile führen zu einer Verbesserung von Therapiesicherheit, Compliance und Wirksamkeit der oralen Therapie mit Opioiden (11). Dadurch ist eine Verbesserung der Schmerztherapie erreichbar, die den Patienten sehr zugute kommt. Klinische Prüfung von Opioidanalgetika Die klinische Prüfung von Analgetika ist vor allem deshalb problematisch, weil Schmerzintensität ein individueller und subjektiver Endpunkt ist, der durch sehr viele Faktoren beeinflusst wird. Darüber hinaus gibt es kaum zusätzlich messbare objektive Parameter. Weiterhin wird die Erfassung der Wirkung über einen längeren Zeitraum hinweg, z.B. mehrere Monate, auch dadurch erschwert, dass sich nie genau sagen lässt, ob ein Opioid wegen Toleranz, Verschlimmerung der Schmerzintensität oder anderer Faktoren an Wirkung verliert. Typischerweise sind es vor allem psychosoziale Faktoren einschließlich persönlicher Beziehungen, Angstzustände, destruktive Denkweisen, Depressionen, Schlafstörungen und viele andere Änderungen im Leben eines chronisch kranken Patienten, die seine Schmerzempfindung und damit auch die Wirkung der Opioide beeinflussen können und damit bei klinischen Prüfungen berücksichtigt werden sollten. Wie eine kürzliche systematische Übersicht am Beispiel der Tumortherapie mit Opioiden jedoch gezeigt hat, ist dies nur selten der Fall. Die Autoren fanden für die Opioide Morphin, Oxycodon und Hydromorphon in den wichtigsten medizinischen Datenbanken zwischen 1980 und 2005 insgesamt nur 34 randomisierte kontrollierte Studien (12)! Keine dieser Studien war Placebokontrolliert, obwohl gut bekannt ist, dass bei der Prüfung analgetischer Wirkungen z.T. hohe Placeboeffekte gefunden werden und deshalb eine entsprechend aussagekräftige Studie eigentlich nicht auf Placebo verzichten kann. Angesichts dieser Situation betonen Bell et al. die schwache Studienlage am Beispiel des Morphins (12) und eine systematische Übersicht der Cochrane Database kommt zum selben Ergebnis (13). Dabei sind ethische Gründe nur Fortbildungstelegramm Pharmazie 2007;1:17-31 Pharmakologie häufig verwendeter oral verfügbarer Opioide teilweise stichhaltig, um einen Placeboarm auszuschließen. Bell et al. führen aus, dass Patienten mit Schmerzen, die nach Stufe 2 des WHO Stufenplans behandelt werden, durchaus für die Dauertherapie ein Placebo bekommen könnten, wenn der Gebrauch von schnell freisetzenden Präparaten (rescue medication) erlaubt bleibt. Immerhin waren fast die Hälfte der 34 kontrollierten Studien mit solchen Patientengruppen durchgeführt worden. Selbst die wenigen randomisierten kontrollierten klinischen Studien mit Morphin, Hydromorphon und Oxycodon sind oft nicht Placebokontrolliert. Die Studien untersuchen nicht warum Opioide manchen Patienten nicht helfen oder warum Patienten auf nur auf ein bestimmtes Opioid reagieren, nicht aber auf ein anderes. Die meisten der Studien vergleichen verschiedene Opioide und testen daher nicht die Wirksamkeit per se. Hier bleibt der Aussagewert angesichts der geringen Kontrolle psychosozialer Faktoren begrenzt. Dennoch kann nicht bezweifelt werden, dass Morphin, Hydromorphon und Oxycodon bei der Therapie von Tumorschmerz und chronischem nicht malignen Schmerz wirksam und therapeutisch wertvoll sind. Eine weitere Schwäche der 34 Studien war das Studiendesign. Die Studien waren nicht auf die Untersuchung der Wirksamkeit eines Opioids sondern auf den Vergleich verschiedener Opioide oder verschiedener Zubereitungen eines Opioids ausgerichtet. In solchen Studien ist das gleiche Ergebnis in beiden Gruppen nur schwer interpretierbar, denn es könnten neben gleicher Wirksamkeit auch gleiche Unwirksamkeit oder nicht adäquate statistische und methodische Genauigkeit zugrunde liegen. Insbesondere angesichts der geringen Kontrolle der psychosozialen - 24 Faktoren, bleibt der Aussagewert der Ergebnisse begrenzt. Trotz dieser Probleme, wird selbst in kritischen Übersichten nicht bezweifelt, dass Morphin (13), Hydromorphon (14) und Oxycodon (15) stark wirksame Analgetika sind. So kommen auch andere ausführliche Übersichten zur Behandlung von Tumorschmerz und chronischem nicht malignem Schmerz zu dem Schluss, dass diese drei Opioide als Therapeutikum geeignet sind (5-7). Anders sieht es bei Buprenorphin aus, welches u.a. wegen der Möglichkeit der Auslösung von Entzugserscheinungen als zweite Wahl für die Behandlung von Tumorschmerz gilt (7) und auch bei der Behandlung chronischer Schmerzen nicht im Vordergrund steht (5). Dagegen kommt eine mehrmals aktualisierte systematische Übersicht zu dem Schluss, dass Buprenorphin zur Behandlung des Opioidentzugs Vorteile gegenüber Levomethadon hat (16). So erweist sich gerade der für die Schmerztherapie als eher weniger vorteilhaft eingeschätzte partielle Agonismus an µ-Rezeptoren vorteilhaft für die Entzugsbehandlung. Auswahl der Opioidanalgetika für die Schmerztherapie Angesichts der derzeitigen Studienlage erscheint es sinnvoll, bei der Auswahl des Opioids mehr auf Unterschiede zwischen den einzelnen Arzneistoffen und ihren Darreichungsformen zu achten als auf die meist unsicheren Ergebnisse klinischer Studien. Solche Unterschiede sind evident und betreffen: • Voller oder partieller Agonist • Metabolismus • Elimination • Wirkdauer • Nebenwirkungspotenzial • Missbrauchspotenzial • Interaktionspotenzial Das früher als „Goldstandard“ klassifizierte Morphin, ob nun retardiert oder als schnell freisetzende Form, wird heute nicht mehr so häufig verwendet. Der Arzneistoff hat klinisch relevante Fortbildungstelegramm Pharmazie 2007;1:17-31 Pharmakologie häufig verwendeter oral verfügbarer Opioide Nachteile, wobei hier vor allem die Risiken durch Intoxikation mit aktiven Metaboliten zu nennen sind. Dies gilt vor allem bei Patienten mit Nierenfunktionsstörungen oder auch bei Patienten mit schwer kontrollierbarem Gebrauch, z.B. bei der Behandlung von chronischem Schmerz (7). Weiterhin sollte bedacht werden, dass die variable und insgesamt geringe Bioverfügbarkeit zu Schwankungen der analgetischen Wirksamkeit führen kann. Dies kann zu zwischenzeitlichen Schmerzepisoden führen und damit die Grundforderung aller Richtlinien nach einer effektiven „around-the-clock“-Therapie verletzen (5,7,10). In der Folge könnte beispielweise der Beigebrauch von unretardiertem Morphin steigen, was mit stark schwankenden Plasmaspiegeln und damit möglicherweise auch verstärkten Nebenwirkungen verbunden wäre. Wichtige Kriterien sind auch die Komedikation des Patienten. So müssen bei AIDS-Patienten Interaktionen zwischen Ritonavir und Buprenorphin beachtet werden. Andererseits wird das Missbrauchspotenzial von Buprenorphin gering eingeschätzt. Levomethadon, welches in Deutschland häufig in der Substitutionsbehandlung bei Abusus von Opioiden verwendet wird, weist bei Dauertherapie eine sehr lange (12-16 h) und oft schlecht vorhersagbare Halbwertzeit auf. Damit besteht bei eigenmächtiger zusätzlicher Einnahme von mehr als einer Dosis pro Tag, welche bei Schmerztherapie nicht unüblich ist, die Gefahr der Akkumulation mit gefährlich hohen Plasmaspiegeln. Dagegen scheint Methadon gut bei bestehender Opioidtoleranz zu wirken. Opioidrotation Unter Opioidrotation versteht man die Umstellung eines Patienten von einem Opioid auf ein anderes. Dies kann erforderlich werden, wenn mit dem ursprünglich verwendeten Opioid kein ausreichender analgetischer Effekt mehr erreicht wird, oder die für eine Analgesie benötigte Dosis wegen Nebenwirkungen wie beispielsweise Neurotoxizität nicht mehr toleriert wird. Nicht nur klinische Erfahrungen sondern auch molekulare Aspekte sprechen für einen solchen - 25 Ansatz (6,10). So ist gut bekannt, dass die Kreuztoleranz zwischen Opioiden nur bedingt ausgeprägt ist und dies lässt sich vor dem Hintergrund der Diversität der Subtypen von Opioidrezeptoren (µ, κ), die vermutlich durch alternatives Splicing oder Heterodimerisierung (siehe oben) entstehen, auch molekular erklären. Opioidrotation beinhaltet den abrupten Abbruch der Therapie mit dem nicht mehr wirksamen Opioid und den Beginn der Therapie mit einer äquianalgetischen Dosis eines alternativen Opioids (7). Bei Opioidrotation muss das richtige Opioid ausgewählt und vor allem eine Überdosierung vermieden werden. Übliche Startdosis für einige Opioide Opioid übliche Startdosis Morphin 15-30 mg, alle 3-4 h Oxycodon 5-10 mg alle 3-4 h Hydromorphon 2-6 mg alle 3-4 h Buprenorphin --- Tab. 2: Standarddosierungen für einige unretardierte orale Opioide (Erwachsene mit mehr als 50 kg Körpergewicht). Die Äquivalenzdosis bei Opioidrotation soll erst nach Auftitrierung erreicht werden, wobei z.B. mit der üblichen Startdosis begonnen wird (siehe Text). Die Dosierungen stammen aus Tabellen, die sich an Richtlinien orientieren (6,10). Hierbei ist also die Frage einer äquianalgetischen Dosierung von entscheidender Bedeutung. Da das alternative Opioid beispielsweise wegen geringer Kreuztoleranz üblicherweise wirksamer ist, sollte mit einer deutlich geringeren Dosierung begonnen werden. Empfohlen wird die übliche Startdosis bzw. die Hälfte der Dosis zu wählen, die dem zu ersetzenden Opioid äquivalent ist. Schwierig dabei ist, dass die zur Verfügung stehenden Tabellen zur Dosisäquivalenz teilweise stark variieren Fortbildungstelegramm Pharmazie 2007;1:17-31 Pharmakologie häufig verwendeter oral verfügbarer Opioide (6,10). Hinzu kommt, dass Tabellen, die Dosierungen für Opioide im Vergleich mit Morphin angeben (Tab. 2), nicht geeignet sind um solche Opioide untereinander zu vergleichen. Langfristige analgetische Therapie mit Opioidanalgetika Die langfristige Opioidtherapie hat im letzten Jahrzehnt deutlich zugenommen (5,6). Hierfür gibt es im Wesentlichen zwei Gründe. Zum einen sind die Fortschritte der Behandlung von Tumorerkrankungen zu nennen, die zu einer deutlichen Steigerung der Lebenserwartung geführt haben. Ein weiterer Grund ist die zunehmend häufigere Behandlung von Patienten mit chronischen Schmerzen, die nicht an Tumorerkrankungen leiden. Die klinische Erfahrung hat jedoch gezeigt, dass die wünschenswerte ausreichende Therapie starker Schmerzen mit einigen ernsthaften Problemen verbunden ist, die den therapeutischen Wert von Opioiden nicht nur einschränken sondern unter Umständen ganz zunichte machen können. Zu nennen sind hier die oben bereits erwähnte Entwicklung von neurotoxischen Effekten und einer Hyperalgesie, die Wirkungen auf das Hormonsystem, sowie die Entwicklung einer Sucht. So kommen Ballantyne und Mao zu dem Schluss, dass hohe Dosen von Opioiden bei der Behandlung chronischer nicht Tumor-assoziierter Schmerzen ineffektiv werden und dem Patienten Schaden zufügen können (6). Gleichzeitig wird vorgeschlagen, die unkritische Verordnung von Opioiden unbedingt zu vermeiden, auch und vor allem, wenn großer Druck seitens der Patienten ausgeübt wird, die Dosis zu erhöhen. Ganz ähnlich urteilen auch Trescot et al. bei ihrer Beschreibung der Richtlinien der „American Society of Interventional Pain Physicians" (ASIPP) für die Behandlung chronischer nicht Tumor-assoziierter Schmerzen (5). Diese Richtlinien wurden erarbeitet um die Qualität der Versorgung zu verbessern, die Verfügbarkeit für Patienten zu erleichtern, die Effektivität der Behandlung zu optimieren und die Kosten-Nutzen Relation zu verbessern. - 26 Es wird ausführlich darauf hingewiesen, dass die Effektivität von Opioiden bei nicht Tumor-assoziierten chronischen Schmerzen nach den bisherigen Studien nur als wenig evidenzbasiert einzustufen ist (Level IV). Dabei machen Sie vor allem den Umstand geltend, dass die insgesamt 42 randomisierten Studien, die ihrer Beurteilung zugrunde liegen, eine zu geringe Dauer aufweisen, um die Effektivität einer Langzeittherapie zu belegen. Untersucht wurden die Opioide Morphin, Oxycodon, Dihydrocodon, Hydromorphon, Codein, Fentanyl und Levomethadon bei chronischem Rückenschmerz, diabetischer Neuropathie, Osteoarthritis, neuropathischem Schmerz und Phantomschmerz. Die Richtlinien sehen daher vor, dass die Therapie mit Opioiden wichtigen Regeln folgen muss, damit die Effektivität der Therapie gewahrt und Schaden vom Patienten abgewendet wird. Hierzu gehören u.a.: • gutes Verständnis zur Pharmakologie der unterschiedlichen Opioide • ausführliche Evaluation des Patienten, einschließlich aller notwendigen (auch invasiven) diagnostischen Maßnahmen • die Formulierung klarer Therapieziele sowie kontrollierbare Vorgaben an den Patienten zur Beschaffung der Opioide (Zusammenarbeit mit Apotheken zur Vermeidung unkontrollierter Einnahme durch Mehrfachverordnung) • regelmäßige Kontrolle der Therapie (Untersuchung, Erfassung von Analgesie, Aktivität, Fehlverhalten und Nebenwirkungen) • ausführliche Dokumentation der Behandlung durch Arzt und Patient Schließlich betonen Trescot et al., dass die Richtlinien lediglich den momentanen Stand der wissenschaftlichen Evidenzen reflektieren und keineswegs als „Standard der Versorgung“ gelten sollen. Dennoch zeigen die genannten Schlussfolgerungen und Empfehlungen, dass die langfristige Therapie von chronischen Schmerzen besonderen ärztlichen Sachverstand und eine entsprechende Erfahrung erfordert, damit sie sicher und effektiv bleibt. Fortbildungstelegramm Pharmazie 2007;1:17-31 Pharmakologie häufig verwendeter oral verfügbarer Opioide Therapie mit Opioidanalgetika in der Schwangerschaft Im Allgemeinen wird die Anwendung von Opioiden wie Morphin, Oxycodon, Hydromorphon und Buprenorphin in der Schwangerschaft nicht empfohlen, weil zu wenige Erfahrungen und zu wenige Daten zur Sicherheit vorliegen (1-4). Zum gleichen Ergebnis kommt auch ein systematisches Review, nach welchem bis 2003 gerade einmal 6 Fallberichte zum Einsatz von Opioiden bei Frauen im Alter von 23-36 Jahren existierten, während die allermeisten Berichte die Substitutionsbehandlung von Opioidabhängigen Schwangeren beschreiben (17). An dieser Situation hat sich bis heute nicht viel geändert. Es wurde berichtet, dass die kontinuierliche Infusion von Morphin zur Kontrolle starken Schmerzes in der 27. Woche zur fetalen und plazentaren Vasokonstriktion führte und sich der Zustand des Fetus nach Umstellung auf Fentanyl besserte (18). Ein anderer Bericht beschreibt, dass nach Verwendung von Morphin während einer Schnittentbindung die erneute epidurale Gabe von 1,5 mg Morphin zentrale Krämpfe auslöste (19). Andererseits existieren eine Reihe von Berichten, die eine günstige NutzenRisiko-Relation bei epiduraler Applikation in der Schwangerschaft beschreiben. Hierzu zählt die analgetische Therapie bei QT-Syndrom (20), C1-INH-Defizienz (21), einer Dysfunktion der Symphyse des Schambeins (22) und dem Arnold Chiari Syndrom Typ I (23). Buprenophin (transdermal), Methadon und schnell freisetzendes Morphin zeigten im Rahmen einer randomisierten klinischen Studie an Schwangeren mit Opioid-Abhängigkeit keine Unterschiede hinsichtlich fetaler Bewegungsmuster und maternaler physiologischer Werte wie Blutdruck, Körpertemperatur oder Herzfrequenz (24). Ein weiterer Fallbericht beschreibt die sichere Anwendung von transdermalem Buprenorphin bei einer Schwangeren mit neuropathischen Schmerzen (25). - 27 - Neue Strategien zur Verbesserung der Schmerztherapie mit Opioidanalgetika Trotz der guten Wirksamkeit der Opioide bei der Behandlung starker Schmerzen, beeinträchtigen einige Nebenwirkungen ihren Wert im Hinblick auf die Verbesserung der Lebensqualität. Dies gilt vor allem für die Obstipation, welche bei längerer Behandlung bis zu 90 % der Patienten betreffen kann und damit die bei weitem wichtigste Nebenwirkung der Opioide darstellt. Die Obstipation durch Opioide erfordert nahezu immer die gleichzeitige Verordnung bzw. Selbstmedikation mit Laxantien (10). Dennoch wird eine solche Zusatzmedikation nach Einschätzung der Deutschen Gesellschaft für Schmerz-therapie e.V. nur bei ca. 30 % der ambulant versorgten Patienten vom Arzt verordnet, sodass sich vermutlich viele Patienten selbst Laxantien beschaffen. Dadurch könnten zusätzliche Gefahren wie Elektrolytverluste entstehen und sich beispielsweise unbemerkt eine Hypokaliämie entwickeln. Eine Opioid-induzierte Obstipation ist durch harten Stuhl, frustrane Anstrengungen beim Stuhlgang und unvollständige Darmentleerung gekennzeichnet. Die Patienten fühlen sich daher sehr unwohl. Schmerzhafte Krämpfe im Unterbauch, Blähungen und Koliken sind nicht selten. Chronische Obstipation kann zu Übelkeit und Erbrechen führen sowie ernste Komplikationen wie Kotsteinbildung, Peritonitis und (Sub-) Ileus auslösen. Die Obstipation durch Opioide ist auch bei der postoperativen Schmerztherapie ein erhebliches Problem, denn sie verstärkt die postoperative Darmatonie und führt damit zu einer schmerzhaften und kostenintensiven Beeinträchtigung der Patienten (26). Die bei der postoperative Darmatonie vorliegende Beeinträchtigung der Peristaltik tritt bei fast allen Patienten nach chirurgischen Eingriffen, vor allem im Bereich des Abdomens, auf. Obwohl nur wenig über die Pathophysiologie bekannt ist, wird eine Verschiebung des Gleichgewichtes bei der Steuerung der Motilität über das autonome Nervensystem vermutet. Fortbildungstelegramm Pharmazie 2007;1:17-31 Pharmakologie häufig verwendeter oral verfügbarer Opioide Danach kommt es zu einer Steigerung der durch Noradrenalin vermittelten hemmenden Wirkung des sympathischen Nervensystems, während die Aktivität der parasympathischen Neuronen, die die Motilität fördern, abnimmt. Hierbei wird der Stimulation von Opiatrezeptoren eine tragende Rolle zugeschrieben (siehe Teil 1, Abb. 7). Bei der postoperativen Darmatonie addieren sich dabei die Effekte der durch die OP vermehrt freigesetzten endogene Opioide (Endorphine, siehe oben) und der therapeutisch eingesetzten Opioide (27). Morphin und andere Opiate bewirken eine Hemmung der Ausschüttung von Acetylcholin aus den parasympathischen Neuronen des Plexus myentericus in der Darmwand. Dadurch B 150 Placebo 1 mg ADL 8-2698 6 mg ADL 8-2698 100 50 150 Zeit (Median) bis zum ersten Stuhlgang [ h ] 200 100 P<0.01 50 0 0 D C 100 Angabe maximaler Übelkeit [ mm ] kommt es zu einer Erhöhung des Muskeltonus im Dickdarm und gleichzeitig zu einer Verminderung der propulsiven Darmperistaltik (spastische Obstipation). Dies hat für die Patienten unangenehme bis schmerzhafte Folgen. So entwickeln sich nicht nur abdominelle Beschwerden, sondern auch Übelkeit und Erbrechen, welches aufgrund der frischen Operationsnarbe besonders schmerzhaft sein kann. Darüber hinaus benötigen die Patienten einen längeren Zeitraum bis sie wieder feste Nahrung zu sich nehmen können. Deshalb verursacht die postoperative Darmatonie auch eine Verlängerung des Klinikaufenthaltes, was mit entsprechend hohen Kosten verbunden ist. 75 50 25 0 P<0.02 Zeit bis zur Entlassung [ h ] Morphinsulfatverbrauch [ mg ] A - 28 - 150 100 P<0.001 50 0 Abb. 1: Wirkung des Opiatrezeptorblockers ADL 8-2698 (Alvimopan) auf (A) den Opiatverbrauch, (B) die Zeit bis zum ersten Stuhlgang, (C) die Angabe max. Übelkeit und (D) die Zeit bis zur Entlassung aus dem Krankenhaus bei Patienten nach Hysterektomie (n=63) oder partieller Kolonresektion (n=15). Bei den Medianwerten in (B) und (D) wurde auf die Darstellung der Streuungen verzichtet. Die P-Werte zeigen signifikante Unterschiede [Abb. aus: (28)]. Fortbildungstelegramm Pharmazie 2007;1:17-31 Pharmakologie häufig verwendeter oral verfügbarer Opioide Die neue Strategie zur Vermeidung bzw. Verringerung der Obstipation durch Opioide bedient sich der Unterschiede bei der Pharmakokinetik der Liganden am Opioidrezeptor (siehe oben). So wurde kürzlich in Deutschland ein Kombinationspräparat aus Oxycodon und Naloxon für die orale Behandlung starker bis sehr starker Schmerzen vorläufig zugelassen. Dabei dient der Anteil von Naloxon der Therapie und/oder Prophylaxe einer opioidinduzierten Obstipation (28). Naloxon (siehe oben) ist ein gut untersuchter und häufig klinisch eingesetzter Opioidantagonist mit bekanntem Sicherheitprofil und ist nach oraler Gabe nur sehr wenig bioverfügbar. Auf der Basis bisheriger Erkenntnisse ist zu erwarten, dass diese nun verfügbare neue Kombination zu einer Verbesserung der analgetischen Therapie bei Patienten mit starken bis sehr starken Schmerzen führt, die sich vor allem durch eine Erhöhung der Lebensqualität auswirken dürfte. - 29 - Die Validität dieses Konzeptes erfährt durch eine Neuentwicklung auf dem Arzneimittelmarkt, die nach Aussage des Entwicklers Adolor, Exton, PA, USA, in den USA kurz vor der Zulassung steht, eine klinische Bestätigung. Es wurde ein neuer µ-Rezeptorantagonist entwickelt, dessen orale Bioverfügbarkeit so niedrig ist, dass bei oraler Gabe nur die µRezeptoren im Darm blockiert werden. Die neue Substanz heißt Alvimopan. Die klinische Prüfung von Alvimopan zeigte (Abb. 1), dass Patienten, die nach einer Hysterektomie oder einer Kolonresektion bis zur Entlassung mit 6 mg vor der OP und danach zweimal täglich behandelt wurden weder mehr Opioide benötigten noch mehr Schmerzen hatten (Abb. 1). Dagegen waren die Zeit bis zum ersten Stuhlgang, die Inzidenz von Übelkeit und die Verweildauer in der Klinik signifikant reduziert (29). Dieses Ergebnis wurde erst kürzlich in zwei weiteren klinischen Studien bestätigt (30,31). Fortbildungstelegramm Pharmazie 2007;1:17-31 Pharmakologie häufig verwendeter oral verfügbarer Opioide - 30 - Literatur 1. Mundipharma GmbH MST 10/30/60/100/200 mg MundipharmaR . Fachinformation 2006; 2. Essex Pharma GmbH TemgesicR. Fachinformation 2003; 3. Mundipharma GmbH OxygesicR 10 mg/20 mg/40 mg/80 mg. Fachinformation 2004; 4. Mundipharma GmbH PalladonR retard 4, 8, 16, 24 mg. Fachinformation 2006; 5. Trescot AM, Boswell MV, Atluri SL, et al. Opioid guidelines in the management of chronic noncancer pain. Pain Physician 2006;9:1-39. 6. Ballantyne JC, Mao J. Opioid therapy for chronic pain. N Engl J Med 2003;349:1943-1953. 7. Bruera E, Kim HN. Cancer pain. JAMA 2003;290:2476-2479. 8. Gartner J, Voltz R, Golla H, Ostgathe C. Pain and symptom management in palliative care. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2006;.: 9. Ballantyne JC Chronic pain following treatment for cancer: the role of opioids. Oncologist 2003;8:567575. 10. Brunton LL, JS Lazo, KL Parker: Goodman & Gilman's The Pharmacological Basis of Therapeutics. New York, McGraw-Hill, Medical Publishing Division, 2006, pp 1-2021 11. Amabile CM, Bowman BJ. Overview of oral modified-release opioid products for the management of chronic pain. Ann Pharmacother 2006;40:1327-1335. 12. Bell RF, Wisloff T, Eccleston C, Kalso E. Controlled clinical trials in cancer pain. How controlled should they be? A qualitative systematic review. Br J Cancer 2006;94:1559-1567. 13. Wiffen PJ, Edwards JE, Barden J, McQuay HJ. Oral morphine for cancer pain. Cochrane Database Syst Rev 2003;CD003868. 14. Quigley C Hydromorphone for acute and chronic pain. Cochrane Database Syst Rev 2002;CD003447. 15. Edwards JE, Moore RA, McQuay HJ. Single dose oxycodone and oxycodone plus paracetamol (acetominophen) for acute postoperative pain. Cochrane Database Syst Rev 2000;CD002763. 16. Gowing L, Ali R, White J. Buprenorphine for the management of opioid withdrawal. Cochrane Database Syst Rev 2006;CD002025. 17. Wunsch MJ, Stanard V, Schnoll SH. Treatment of pain in pregnancy. Clin J Pain 2003;19:148-155. 18. Collins LR, Hall RW, Dajani NK, Wendel PJ, Lowery CL, Kay HH. Prolonged morphine exposure in utero causes fetal and placental vasoconstriction: a case report. J Matern Fetal Neonatal Med 2005;17:417-421. 19. Shih CJ, Doufas AG, Chang HC, Lin CM. Recurrent seizure activity after epidural morphine in a postpartum woman. Can J Anaesth 2005;52:727-729. 20. Al Refai A, Gunka V, Douglas J. Spinal anesthesia for Cesarean section in a parturient with long QT syndrome. Can J Anaesth 2004;51:993-996. 21. Griffiths RJ, O'Sullivan G. C1-esterase inhibitor deficiency and elective caesarean section. Int J Obstet Anesth 2005;14:263-264. 22. Scicluna JK, Alderson JD, Webster VJ, Whiting P. Epidural analgesia for acute symphysis pubis dysfunction in the second trimester. Int J Obstet Anesth 2004;13:50-52. Fortbildungstelegramm Pharmazie 2007;1:17-31 Pharmakologie häufig verwendeter oral verfügbarer Opioide - 31 - 23. Kuczkowski KM Spinal anesthesia for Cesarean delivery in a parturient with Arnold-Chiari type I malformation. Can J Anaesth 2004;51:639. 24. Jones HE, Johnson RE, Jasinski DR, Milio L. Randomized controlled study transitioning opioiddependent pregnant women from short-acting morphine to buprenorphine or methadone. Drug Alcohol Depend 2005;78:33-38. 25. Ebner E, Wiedmann M. [Transdermal buprenorphine during pregnancy]. Schmerz 2006;20:334-337. 26. Kojda G Ein neuer Opiatrezeptorblocker mit selektiver Wirkung auf den Darm. Apothekenmagazin 2001;19:4-5 ( kostenlos unter http://www.uni-duesseldorf.de/kojdapharmalehrbuch/apothekenmagazin/Editorials.html ). 27. Steinbrook RA An opioid antagonist for postoperative ileus. N Engl J Med 2001;345:988-989. 28. Mundipharma GmbH Targin R. Fachinformation 2006; 29. Taguchi A, Sharma N, Saleem RM, et al. Selective postoperative inhibition of gastrointestinal opioid receptors. N Engl J Med 2001;345:935-940. 30. Viscusi ER, Goldstein S, Witkowski T, et al. Alvimopan, a peripherally acting mu-opioid receptor antagonist, compared with placebo in postoperative ileus after major abdominal surgery: results of a randomized, double-blind, controlled study. Surg Endosc 2006;20:64-70. 31. Herzog TJ, Coleman RL, Guerrieri JP, Jr., et al. A double-blind, randomized, placebo-controlled phase III study of the safety of alvimopan in patients who undergo simple total abdominal hysterectomy. Am J Obstet Gynecol 2006;195:445-453. Autor: Prof. Dr. Georg Kojda Fachpharmakologe, Fachapotheker für Arzneimittelinformation Fortbildungsbeauftragter Apothekerkammer Nordrhein, Apothekerverband Köln e.V. Weiterbildungsbeauftragter Apothekerkammer Nordrhein Institut für Pharmakologie und Klinische Pharmakologie, Universitätsklinikum, Heinrich-Heine-Universität, Moorenstr. 5, 40225 Düsseldorf Den Fortbildungsfragebogen zur Erlangung eines Fortbildungspunktes zum Fortbildungstelegramm Pharmazie* finden Sie hier: http://www.uni-duesseldorf.de/kojda-pharmalehrbuch/Fortbildungstelegramm%20Pharmazie/index.html (*hier finden Sie auch Informationen zum Fortbildungstelegramm Pharmazie, einem universitären und anzeigenfreien Angebot für eine unabhängige pharmazeutische Fortbildung.) Fortbildungstelegramm Pharmazie 2007;1:17-31