Die Entwicklung des Thalamus – das Tor zum Bewusstsein
Werbung

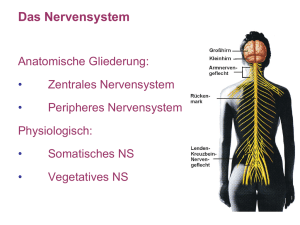
607_659_BIOsp_0610.qxd 22.09.2010 10:15 Uhr Seite 639 639 Ontogenese des Gehirns Die Entwicklung des Thalamus – das Tor zum Bewusstsein DANIELA PEUKERT, STEFFEN SCHOLPP INSTITUT FÜR TOXIKOLOGIE UND GENETIK (ITG), KARLSRUHER INSTITUT FÜR TECHNOLOGIE (KIT) Das Wissen über die Entwicklung des Thalamus ist lückenhaft. Das Zusammenspiel zwischen dem Signalfaktor Shh und dem bHLH-Protein Her6 steuert einen fundamentalen Schritt der Thalamusentwicklung. The development mechanism leading to the thalamus formation is largely unknown. Here, we describe the function of the signalling factor Shh and the bHLH protein Her6 orchestrating the thalamic regionalization process. ¯ Abb. 1: A, B, Vergleichende Anatomie des Thalamus (rot, A, B) und dessen Kerngebiete (A’, B’) in Mensch und Zebrafisch Danio rerio. C, Koronalschnitt durch das Gehirn des Zebrafischs, angefärbt mittels einer Doppel-in situ-Hybridisierung. Die Expression von Shh im zentralen Zwischenhirn-Organisator (MDO) ist in Rot dargestellt. Die blaue Färbung zeigt den Thalamus-Marker Lhx9. D, Mittels einer DiI-Markierung lassen sich afferente Projektionen anfärben, welche den Thalamus, analog zu den thalamo-cortikalen Fasern im Menschen, mit dem Telencephalon verbinden (gelber Pfeil). A: anteriorer Nukleus (N.); CP: zentral-posteriorer N.; DM: dorsal-medialer N.; DL: dorso-lateraler N.; DP: dorso-posteriorer N.; LG: latero-geniculater N.; MG: medio-geniculater N.; Pul: pulvinarer N.; RTN: retikulärer thalamischer N.; Th: Thalamus; VA: ventral-anteriorer N.; VL: ventrolateraler N.; VPL: ventro-posterioro-lateraler N.; ZLI: Zona limitans intrathalamic; hpf: Stunden nach Fertilisation. BIOspektrum | 06.10 | 16. Jahrgang ó In den letzten zwei Jahrzehnten wurde besonders die Entwicklung von Mittelhirn und Hinterhirn intensiv untersucht, während die Entwicklung des Vorderhirns, nicht zuletzt wegen seiner großen neuronalen Diversität und komplexen Organisation, bis heute nur unzureichend verstanden ist. Der Schwerpunkt unserer Forschungsarbeit ist die Entschlüsselung der Grundmechanismen die zur Bildung eines Teils des Vorderhirns, des Thalamus, führen (Abb. 1A, B). Obwohl wir nur Teilaspekte der Thalamusentwicklung kennen, existiert jedoch ein detailliertes Wissen über dessen Anatomie und Funktion: Im Gehirn fungiert der Thalamus als die große Schaltzentrale. Er sammelt Informationen der Sinnesorgane und leitet diese an die Großhirnrinde weiter. Bereits vor 190 Jahren zeigte Karl Friedrich Burdach, dass sich der Thalamus in einzelne Kerngebiete (Nuklei) unterteilen lässt. Heute sind über 30 verschiedene thalamische Nuklei bekannt (Abb. 1A’, B’), die sich aufgrund ihrer spezifischen Projektion unterscheiden lassen (Abb. 1C, D). Jede dieser thalamischen Kerngruppen ist hauptsächlich für die koordinierte Weiterleitung und Verschaltung bestimmter sensorischer Impulse (z. B. Hören, Schmecken oder Sehen), sensibler Impulse (z. B. Berührungsempfinden, Temperaturempfinden oder Schmerz) oder motorischer Signale aus dem Nervensystem zuständig. So werden z. B. fast alle optischen Informationen über den Sehnerv in den Sehkern des Thalamus – Corpus geniculatum laterale – geleitet. Diese 607_659_BIOsp_0610.qxd 640 22.09.2010 10:15 Uhr Seite 640 W I S S E N SCH AFT · S P E C I A L : I M AG I NG ¯ Abb. 2: Der Zwischenhirn-Organisator (MDO) am Beispiel des Zebrafischs Danio rerio. A, Shh (rot) im MDO definiert die Expression von Markern im Präthalamus (orange) sowie im rostralen Thalamus (lila) und im caudalen Thalamus (blau). B–B’’, Klonale Expression von Shh (grün) in einer Blastomere im 32-Zell-Stadium (B) erzeugt eine sich vergrößernde Zellpopulation im 1.000-Zell-Stadium (B’) bis zum 16-Somiten-Stadium (B’’, weiße Pfeile), welche die Expression von Neurogenin1 im Thalamus stimuliert (C–C’’, gelbe Pfeile). D–D’’, Shh-Signalweg-Agonist Purmorphamin bewirkt ebenfalls eine Aktivierung von Neurog1 (D’), wobei Behandlung mit dem Shh-Antagonisten Cyclopamin eine Reduzierung von Neurog1 bewirkt (D’’). cTh: caudaler Thalamus; ETh: Epithalamus; HyTh: Hypothalamus; rTh: rostraler Thalamus; PTec: Prätectum; Tec: Tectum; Tel: Telencephalon; Th: Thalamus; ZLI: Zona limitans intrathalamica; hpf: Stunden nach Fertilisation. Impulse werden dort auf thalamische Neurone übertragen, welche diese in die optischen Zentren der Großhirnrinde (dem visuellen Cortex) weiterleiten. Der Thalamus stellt für die Wahrnehmung der Außenwelt somit die wichtigste Relais-Station dar und wird deshalb auch als das „Tor zum Bewusstsein“ bezeichnet [1]. Wird dieser Prozess der Verschaltung gestört, z. B. durch eine Verletzung des Thalamus in Form eines Schlaganfalls oder durch einen Tumor, kann dies zu Einschränkungen im Seh- und Empfindungsvermögen führen. Etwa acht Prozent der Schlaganfallpatienten leiden unter dem zentralen Thalamusschmerz, einer chronischen Form des Nervenschmerzes. Die afferenten Signale aus den Sinnesorganen werden nicht eins zu eins an die Großhirnrinde weitergegeben [2], sondern zunächst im Thalamus moduliert. Unter Umständen können die Signale aus den Sinnesorganen im Thalamus sogar ganz blockiert werden. Der Thalamus bildet somit eine Art „Aufmerksamkeits-Schaltzentrale“, die entscheidet, ob Informationen aus der Umwelt wichtig oder irrelevant sind. Diese Filtrierung der Information im Thalamus wird durch das Zusammenspiel von zwei chemischen Botenstoffen ermöglicht: den Neu- rotransmittern Glutaminsäure (Glutamat) und γ-Aminobuttersäure (GABA). Lange Axone der Nervenzellen des caudalen Thalamus projizieren in entsprechende Areale der Großhirnrinde und setzen dort den exzitatorischen Aminosäuretransmitter Glutamat frei. Der caudale Thalamus wird zusätzlich von einer netzartigen Struktur überzogen, dem rostralen Thalamus, dessen Hauptkern vom retikulären Nukleus (RTN, Abb. 1) gebildet wird. Der RTN ist durch kurze Axone gekennzeichnet, die tief in den caudalen Thalamus projizieren. Durch das Ausschütten des inhibierenden Botenstoffes GABA werden spezifische, caudale Neurone (oder ganze Kerngebiete) gehemmt und damit die Reizweiterleitung von den Sinnesorganen zum Cortex inhibiert. Während Anatomie und Funktion des Thalamus weitgehend bekannt sind, ist noch immer unklar, auf welchen Mechanismen die Bildung von rostralem und caudalem Thalamus beruht. Gleichermaßen ist es unbekannt, welches komplexe Zusammenspiel von Faktoren der Bildung der spezifischen thalamischen Kerngruppen zugrunde liegt, oder wie den verschiedenen Neuronengruppen spezifische Funktionen (z. B. visuell oder auditorisch) zugewiesen werden? Lokale Organisatoren etablieren die Thalamusregion Zellgruppen, die Signalmoleküle ausschütten und ganze embryonale Entwicklungsprozesse beeinflussen, werden als Organisator bezeichnet. Im Gehirn liegt solch ein lokaler Organisator zwischen dem Mittelhirn und Hinterhirn. Der sogenannte Mittelhirn-Hinterhirngrenzen-Organisator beeinflusst direkt das Schicksal der Zellen in den angrenzenden Regionen, dem Tectum und dem Cerebellum. Unsere Arbeitsgruppe konnte kürzlich am Beispiel des Zebrafischs Danio rerio eine weitere Zellgruppe als Organisator identifizieren, den zentralen Zwischenhirn-Organisator (mid-diencephalic organiser, MDO), der an der Grenze zwischen Präthalamus und Thalamus, der Zona limitans intrathalamica (ZLI), liegt (Abb. 2A). Der MDO ist für die Entwicklung und Regionalisierung des thalamischen Komplexes von entscheidender Bedeutung. Wichtige Signalmoleküle dieses Organisators sind Mitglieder der Familien Sonic hedgehog (Shh), Wingless related (Wnt) und Fibroblast growth factor (FGF) [3]. All diese Faktoren steuern die Etablierung des zentralen Zwischenhirns (Diencephalon), wobei sich Shh als das Hauptsignal des MDO für die Thalamusentwicklung herauskristallisiert hat. BIOspektrum | 06.10 | 16. Jahrgang 607_659_BIOsp_0610.qxd 642 22.09.2010 10:15 Uhr Seite 642 W I S S E N SCH AFT · S P E C I A L : I M AG I NG oder Ascl1 unerlässlich ist und damit die zelluläre Identität des Thalamus definiert. Dennoch bleibt die Frage offen, wie die exakte Regionalisierung von rostralem und caudalem Thalamus erfolgt. Die Entwicklung des retikulären thalamischen Nukleus ˚ Abb. 3: Her6 definiert den retikulären thalamischen Nukleus im Zebrafisch. A, B, Für die Elektroporation wird der Fischembryo (26 Stunden nach Fertilisation) in einem Agarosetropfen eingebettet und dorsal orientiert. Die Kathode (-) wird direkt in Ringer-Medium getaucht, während sich die Anode (+) in der Injektionskapillare befindet, die mit einer Lösung eines fluoreszenzmarkierten Morpholino-Oligonukleotids gefüllt wurde. Die Morpholino-Oligonukleotidlösung (grün) wird durch einen elektrischen Impuls in die thalamische Zelle eingeschleust, wobei sich auch der III. Ventrikel mit dieser Lösung füllt. Wird ein fluoreszenzmarkiertes Morpholino-Oligonukleotid gegen Her6 (grün) in Zellen des rostralen Thalamus eingebracht, bewirkt dies eine zellautonome Induktion von Neurog1 (D, D’; rot, blaue Pfeile), wobei ein Kontrollmorpholino keinen Effekt zeigt (C, C’). E, E’, Ektopische Induktion von Her6 im caudalen Thalamus (rot, Stern) bewirkt die Expression des rostralen Thalamus-Markers Tal1 (grün, blaue Pfeile, E’). F, Shh induziert im Her6-positiven rostralen Thalamus Ascl1, welches zur Ausdifferenzierung GABA-erger Interneurone führt. Im Her6-negativen caudalen Thalamus induziert das gleiche Signal (Shh) die Expression von Neurog1 und führt somit zur Entwicklung von Glutamat-ergen Relais-Neuronen. A: anterior; cTh: caudaler Thalamus; MB: Mittelhirn; MDO: Zwischenhirn-Organisator; rTh: rostraler Thalamus; P: posterior; PTh: Präthalamus; PTec: Prätectum; Tel: Telencephalon; III.: dritter Gehirnventrikel, hpf: Stunden nach Fertilisation. Shh bestimmt die zelluläre Identität der Thalamusregion [3]. Wird die Expression von Shh im Thalamus z. B. ektopisch induziert (misexpression) (Abb. 2B), vergrößert sich der Bereich, in dem thalamische Marker wie z. B. Neurogenin1- (Neurog1; Abb. 2C) oder Achaete-scute complex-Gen (Ascl1, auch bekannt als Mash1) exprimiert werden [3–4]. Neurog1 und Ascl1 sind proneurale Faktoren. Neurog1 wird in der Anlage des caudalen Thalamus gebildet und markiert neuronale Vorläuferzellen, die später zu Glutamat-ergen Neuro- nen ausdifferenzieren. Ascl1 hingegen, ist in der Anlage des rostralen Thalamus exprimiert, der hauptsächlich aus GABA-ergen Neuronen besteht. Wird der Shh-Signalweg blockiert, resultiert dies in einem Verlust der Expression dieser proneuralen Faktoren (Abb. 2D–D’’, [3]). Das Fehlen dieser Faktoren führt zum Ausbleiben der Spezifizierung dieser Zellen und schlussendlich zum Verlust des gesamten Thalamus. Wir können daraus schließen, dass Shh des MDOs für die Induktion von thalamischen Markern wie z. B. Neurog1 Mitglieder der Hes/Her-Familie können die Bildung von proneuralen Faktoren beeinflussen. Unsere Forschungsarbeit konzentrierte sich insbesondere auf ein Mitglied dieser Familie, den bHLH-Repressor Her6 (hairylike factor 6, [4]). Her6 – das orthologe Gen von Hes1 der Maus – wird ab dem Neuralplatten-Stadium in der gesamten ThalamusAnlage exprimiert. Während der thalamischen Regionalisierungsphase wird die Expression jedoch auf einen Ascl1-positiven Streifen nahe am MDO reduziert. Ascl1 markiert überwiegend eine Zellpopulation im rostralen Thalamus. Der durch ein antisenseRNA-Analog (Morpholino-Oligonukleotid) erzeugte globale Knock-down von Her6, induziert die Expression von Neurog1 im gesamten Thalamus und reduziert die Expression von Shh. Um sekundäre Effekte aus der frühen Entwicklungsphase zu verhindern, führten wir einen zeitlich und regional spezifischen Knock-down von Her6 durch. Hierfür wurden fluoreszenzmarkierte MorpholinoOligonukleotide gegen Her6, mittels Elektroporation in vivo in thalamische Zellen eingebracht (Abb. 3A, B). Nach zwölf Stunden war bereits eine Induktion von Neurog1 in den elektroporierten Zellen im RTN erkennbar (Abb. 3D, D’). Das bedeutet, dass durch die Inhibition von Her6 proneurale Vorläuferzellen im rostralen Thalamus zellautonom umprogrammiert wurden und nun das Schicksal von Zellen des caudalen Thalamus annehmen. Daraus ergibt sich die Frage, ob Her6 somit die zelluläre Identität des Thalamus regulieren kann? Wird Her6 ektopisch im caudalen Thalamus exprimiert, sehen wir in der Tat den gegenteiligen Effekt. Ein Marker für ausdifferenzierte Neuronen im RTN, Tal1, wird in den Zellen des caudalen Thalamus exprimiert, die ektopisch Her6 bilden (Abb. 3E, E’). Wir können daraus schlussfolgern, dass Her6 die neuronale Identität innerhalb des Thalamus definiert und darüber entscheidet, welche Zellen zu inhibierenden GABA-ergen Neuronen oder zu erregenden Glutamat-ergen Neuronen differenzieren (Abb. 3F). Damit konnten wir einen vierten Nukleus, den retikulären thalamischen Nukleus, im Gehirn des Zebrafischs definieBIOspektrum | 06.10 | 16. Jahrgang 607_659_BIOsp_0610.qxd 22.09.2010 10:15 Uhr Seite 643 ren (RTN, Abb. 1B’). Die richtige Regionalisierung von rostralem und caudalem Thalamus beeinflusst die Funktion der Informationsverarbeitung. Erst die richtige Balance zwischen erregenden und inhibierenden thalamischen Nervenzellen ermöglicht eine spezifische Reizweiterleitung und somit letztendlich eine fokussierte Sinneswahrnehmung. Danksagung Für konstruktive Vorschläge zum Manuskript möchten wir uns bei Dr. C. Blattner (KIT) und der ganzen ScholppGruppe bedanken. Unsere Forschung wird durch ein DFG Emmy-Noether-Forschungsstipendium (SCHO 847/2) und durch das KIT ermöglicht. ó Literatur [1] Jones EG (2007) The Thalamus. 2. Aufl., Vol 1 + 2. Cambridge University Press, New York [2] Sherman SM, Guillery RW (2001) Exploring the Thalamus. Academic Press, San Diego [3] Scholpp S, Lumsden A (2010) How to build a bridal chamber or about the development of the thalamus. Trends in Neurosci 33:373–380 [4] Scholpp S, Delogu A, Gilthorpe J et al. (2009) Her6 regulates the neurogenetic gradient and neuronal identity in the thalamus. Proc Natl Acad Sci USA 47:19895–19900 Korrespondenzadresse: Dr. Steffen Scholpp Institut für Toxikologie und Genetik (ITG) Karlsruher Institut für Technologie (KIT) Hermann-von-Helmholtz-Platz 1 D-76021 Karlsruhe Tel.: 07247-82-8597 Fax: 07247-82-3557 [email protected] AUTOREN Daniela Peukert Jahrgang 1982. 2002–2005 Biotechnologiestudium (Dipl. Ing.) an der BA-Riesa. 2006–2009 Wissenschaftliche Mitarbeiterin am MRC Centre of Developmental Neurobiology, King’s College London. Seit 2009 Doktorandin in der Scholpp-Gruppe am Institut für Toxikologie und Genetik am Karlsruher Insititut für Technologie (KIT). Steffen Scholpp Jahrgang 1972. 1992–1998 Biologiestudium an der Universität Karlsruhe. 2003 Promotion an der Universität Heidelberg. 2003– 2009 Wissenschaftlicher Mitarbeiter am Max-Planck-Institut für Zellbiologie und Genetik, Dresden, und am MRC Centre for Developmental Neurobiology, King’s College London. Seit 2009 DFG-Emmy-NoetherGruppenleiter am Institut für Toxikologie und Genetik am Karlsruher Institut für Technologie (KIT). BIOspektrum | 06.10 | 16. Jahrgang