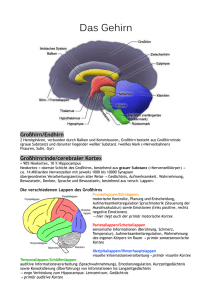
Skript - Physiologie II
Werbung

Julius-Maximilians-Universität Würzburg Philosophische Fakultät III Psychologie Physiologie II Skript auf Grundlage der Vorlesung und Folien SS 2002 von PD Prof. Wischmeyer, sowie „Biologische Psychologie“ von Birbaumer & Schmidt von Valentin Fließ [email protected] 1 1. Einführung • Neurowissenschaften: * Erforschung des Gehirns und des Nervensystems mit wissenschaftlichen Methoden * Molekulare Neurobiologie * Verhaltensneurobiologie * „Cognitive Sciences“ • Biopsychologie: Erforschung biologischer Anteile der Psychologie * Physiologische Psychologie (Zusammenhang von Gehirnprozesse und Verhalten, invasiv; z.B. Wundt) * Psychopharmakologie (Experimentelle Manipulation mittel psychoaktiver Substanzen) * Neuropsychologie (Zusammenhang von Hirnschäden beim Menschen und Verhalten; z.B. Broca, Wernicke) * Psychophysiologie (Zusammenhang von Gehirnprozessen und Verhalten, nicht-invasiv) * Vergleichende Psychologie (Vergleich des Verhaltens verschiedener Spezies, Verhaltensbiologie) 2. Methoden • Optische Methoden, Färbetechniken: • • • • • • Hierbei wird entweder der Zellkörper oder die Verbindungen zwischen Zellen sichtbar gemacht. Hierfür müssen die Strukturen fixiert (z.B. durch Formalin) und gefärbt werden. Je nach Färbemethode werden entweder Zellkörper (Nissl-Färbung), Myelinscheiden oder Zellmembran (Golgi-Färbung). Durch Elektronenmikroskopie kann die Struktur nun mehr also 1500fach vergrößert sichtbar gemacht werden. Autoradiographie, in-situ-Hybridisierung: Bei der Autoradiographie werden radioaktiv-markierte Stoffe gespritzt. Diese werden in die aktiven Zellen aufgenommen. Nachfolgend kann man beim Tier die zu untersuchenden Areale entnehmen und photografisch entwickeln (auf dem Film sind die radioaktiv markierten Strukturen als schwarze Punkte zu erkennen) oder beim Menschen mit einer PET-Kamera sichtbar machen. Bei der in-situ-Hybridisierung werden Proteine und Peptide sichtbar gemacht. Hierzu wird die Sequenz der mRNA, die zur Synthese der Proteine von Zellkern zum Ribosom wandert, radioaktiv markiert. Das produzierte Protein ist nun ebenfalls markiert. Stereotaktische Reizung und Läsion mit anschließenden neuropsychologischen Tests: Stereotaktische Apparate erlauben ortsgenaue und punktförmige Eingriffe (Läsionen, Reizungen) oder Registrierungen aus der Tiefe des Gehirns. Der Eingriff ist invasiv und damit mit ethischen Problemen verbunden. Mittels eines stereotaktischen Atlassen lassen sich gewisse Strukturen lokalisieren und ausschalten. Eine nachfolgende neuropsychologische Untersuchung erlaubt indirekte Schlüsse über Funktionsbeziehungen. Durch eine Ableitung von Potentialen durch den stereotaktischen Apparat gekoppelt mit Verhaltenstests lassen sich ebenfalls Ergebnisse erzielen. Studium traumatische Verletzungen mit Verhaltenänderungen: Da aus ethischen Gründen eine experimentelle Läsion des menschlichen Gehirns nicht vertretbar ist, werden bereits aufgetretene Hirnverletzungen mit Verhaltensänderungen untersucht. Hierbei ist allerdings kein experimenteller Zugang möglich. Elektrische, magnetische und chemische Reizung einzelner Hirngebiete: Des weiteren besteht die Möglichkeit der elektrischen Reizung über ins Gehirn eingebrachte Elektroden, die Möglichkeit der nicht-invasiven Erzeugung eines Stromes im Gehirn durch eine magnetische Reizung mit einer äußerlichen Magnetspule und die Möglichkeit der chemischen Reizung über eine ins Gehirn eingebrachte Mikropipette. Elektroenzephalogramm (EEG), Magnetenzephalogramm (MEG): EEG und MEG erlauben ein präzise Zeitmessungen mentaler Prozesse durch die Aufzeichnung der elektischen, bzw. magnetischen Aktivität des Gehirns. Deshalb und weil sie nicht-invasiv und damit ethisch unproblematisch sind, sind sie mit die wichtigsten methodischen Zugänge bei der Erforschung der Zusammenhänge zwischen Hirnaktivität und Verhalten. Bei diesen Verfahren werden über am Kopf angebrachte Elektroden elektrische, bzw. magnetische Potentiale aus dem Kortex abgeleitet. Diese weisen bestimmte charakteristische Frequenzen und Amplituden auf, die für verschiedene Bewußtseinszustände typisch sind. Allerdings lassen sich so nur die oberen Schichten der Gehirns untersuchen und die genaue Lokalisierung ist nicht genau möglich. Eine kombinierte horizontale und vertikale Messung schafft Abhilfe. Ereigniskorellierte Hirnpotentiale (EKP) und langsame Hirnpotentiale (slow brain waves, LP): Die Messung von EKPs erfolgt mit den Methoden des EEG oder MEG. Hier werden allerdings allerdings nicht die dauernd vorhandenen EEG-Wellen gemessen, sondern nach kleinen Amplituden, die vor, während und nach einem sensorischen, motorischen oder psychischen Ereignis auftauchen, gesucht. Diese werden durch die Mittelung mehrerer Messungen extrahiert. Mit steigender Zahl von Messungen und Elektroden lassen sich genauere Ergebnisse erzielen. 2 Es lassen sich durch dieses Verfahren auch langsame Hirnpotentiale finden (slow brain potentials, LP), die selten schneller als 200 ms reagieren und sich langsam in elektrisch negative oder positive Richtung verschieben. Sie geben die Erregungsschwellen bestimmter Zellensembles im Kortex wieder (Negativierung bedeutet Senkung der Schwellen, Positivierung eine Anhebung). Sie werden mit der Planung und Mobilisierung, nicht mit der Ausführung, von skopeutischem (zielgerichtetem) Handeln in Verbindung gebracht. • Bildgebende Verfahren (CAT, MRT, PET, fMRT): Bildgebende Verfahren machen die Struktur und den Stoffwechsel sichtbar und sind nicht-invasiv. Auch tiefere Gehirnregionen können durch die effektiv untersucht werden. Hierzu gibt es verschiedene Verfahren: * Computer-Axial-Tomographie (CAT): Ein Röntgenstrahler und ein Röntgendetektor sind gegenüberliegend in einem drehbaren Ring angebracht. Der Kopf des Patienten wird auf einer Ebene durch mehrere Röntgenaufnahmen vermessen. Ein dreidimensionales Bild ergibt sich durch ein Messung auf mehreren Ebenen. Die Methode erlaubt eine Analyse der Strukturen des Gehirns, allerdings keine Darstellung der Aktivität. Der Patient ist bei dieser Methode einer Strahlenbelastung ausgesetzt. * Magnetresonanz-/Kernspin-Tomographie (MRT): Dieses Verfahren nutzt die Tatsache aus, dass alle Protonen unterschiedliche magnetische Eigenschaften haben. Der Patient wird hierbei kurzen intensiven Feldimpulsen ausgesetzt. Diese richten die H+-Atome aus, die besonders in gut durchbluteten Gebieten vorhanden sind, worauf diese schwache hochfrequente Radiowellen abgegeben. Diese werden aufgezeichnet. Durch ihre Analyse läßt sich ein Bild der Sauerstoffverteilung im Gehirn und damit Informationen über seine Struktur ableiten. Die MRT hat keine bekannten Belastungen auf den Menschen, ist aber sehr teuer. * Positronen-Emmisions-Tomographie (PET): Die PET erlaubt die Messung verschiedener Stoffwechselprodukte im lebenden Gehirn des Menschen. Das zu untersuchende Stoffwechselprodukt wird hierfür radioaktiv markiert und dem Patienten injiziert. Mit einem Ring von Strahlendetektoren wird nun gemessen, wo im Gehirn sich diese Stoffwechselprodukte nun aufhalten. Durch verkettete Messungen im Sekundenabstand lassen sich nun funktionelle Veränderungen sichtbar machen. Zur radioaktiven Markierung braucht man schnell zerfallende Radioisotope. Diese werden in einem Zyklotron erzeugt, was dieses Verfahren teuer macht. Es besteht eine Strahlenbelastung für den Patienten. Dafür ist die Auflösung von 4 - 8 mm sehr hoch. * funktionelle Magnetresonanz-Tomographie (fMRT o. engl. FNMR): Die fMRT folgt den Prinzipien der MRT. Durch wiederholte Messungen in engen Zeitabständen lassen sich nun auch schnelle funktionelle Veränderungen in der Gehirnaktivität messen. 3. Anatomie ZNS • Einteilung der Körperachsen: rostral ventral dorsal rostral dorsal ventral caudal schnauzenwärts rückenwärts bachwärts schwanzwärts medial lateral zur Mitte hin von der Mitte weg anterior frontales Ende superior Schwanzende caudal Schnitte durch das Gehirn: * sagital Stirn-Scheitel-Richtung * coronar / frontal Scheitel-Schläfen-Richtung * traversal Stirn-Schläfen-Richtung • frühe Entwicklung des ZNS (bis 2. Woche nach Befruchtung): Stadium 1: Neuralplatte Stadium 2: Neuralspalte Stadium3: Neuralrohr Die ursprüngliche Struktur besteht aus Endoderm (unten), Mesoderm (mitte), Ectoderm (oben) und Neuralplatte. Diese faltet sich im Laufe der Entwicklung auf. Das Neuralrohr bildet bildet sich nun ausgelöst vom mesodermalen Organisator aus, indem sich die Neuralplatte auffaltet.(bestimmte Proteine, z.B. Noggin, Follistatin) die Innenseite des Neuralrohrs. Bei der Ausbildung des Gehirn bestimmen 3 sogenannte Transskriptionfaktoren, welcher Teil der DNA, also welches Gen aktiviert wird. Sie sorgen also dafür, dass die richtige Struktur an der richtigen Stelle erzeugt wird. Eine weitere Differenzierung ergibt sich aus der induktiven Interaktion des Mesoderms auf das Ectoderm. • Weitere Entwicklung des ZNS (ab 2. Woche nach Befruchtung): Wenige Wochen nach der Befruchtung hat sich das Neuralrohr schon ausgebildet und läßt sich in drei Teile einteilen. Dieses Stadium nennt man Drei-Blasen-Stadium. Eine weitere Entwicklung ergibt sich durch Ein- oder Ausstülpung des Neuralrohrs. Das Drei-Blasen-Stadium geht über ins Fünf-BlasenStadium. Das ZNS wird immer differenzierter, Wachstumsfaktoren steuern hierbei wandernde Zellen (z.B. differenzieren die Gliazellen durch PDGF in Oligodenrozyten und Astrozyten) und Homöobox-Gene, sorgen für eine Entwicklung bestimmter Organe. Neurone wandern aus der Ventrikularschicht aus und bilden in einer bestimmten Kortexschicht ein postmitotisches Neuron. Es gibt das sogenannte „Geburtstagsprinzip“: Neuronen aus späteren Stadien wandern in höhere Schichten des Kortex, als die aus frühen Stadien. Der Weg den sie zurücklegen ist früh determiniert und endlang spezifischer Gliazellen (Radialglia). Bestimmte Oberflächenmoleküle (CAMs) bei Zell-Zell-Kontakten sorgen dafür, dass die Zellen ihren Platz finden. Jede Zelle hat also ihre eigene Zellline (cell-linage), die erklärt, woher sie kommt. Natürlich kann es bei der Entwicklung des ZNS auch zu Störungen kommen, die Fehlentwicklungen zur Folge haben. Ein Beispiel, bei dem bestimmte Zellen ihren Platz nicht gefunden haben, ist die spina bifida (offener Rücken). Hierbei hat sich das Neuralrohr nicht ganz geschlossen. Heutzutage ist diese Fehlentwicklung aber meist korrigierbar. • Unterteilungen des ZNS im embryonalen und ausgereiften Zustand: Drei-Blasen-Stadium 1. Vorderhirn 2. Mittelhirn 3. Rautenhirn 4. caudaler Teil des Neuralrohrs Fünf-Blasen-Stadium ausgereifter Zustand 1. Großhirnrinde, Basalganglien, Hippocampus, Amygdala, Bulbus Olfactoris 1a. Endhirn dazugehöriger Hohlraum Seitenventrikel 1b. Zwischenhirn 2. Thalamus, Hypothalamus, Subthalamus, Epithalamus, Retinae, dritter Ventrikel Sehnerven, Sehbahnen 2. Mittelhirn 3. Mittelhirn Aquaeductus Cerebri 4. Pons 3a. Hinterhirn 5. Cerebellum 3b. Nachhirn vierter Ventrikel 6. Medulla oblangata 4. caudaler Teil des Neuralrohrs 7. Rückenmark • Grundlegende Eigenschaften des Gehirns: Zentralkanal * Lokalisationismus: Jedes Verhalten ist in einem eng umgrenzten Gehirngebiet lokalisiert. * Äquipotenzialität: Alle Teile des Gehirns können alle Leistungen übernehmen. * Konnektivismus: Leistungen des Gehirns ergeben sich aus den Verknüpfungen der Zellen. • Organisationprinzipien des Gehirns: * Das Gehirn ist in verschiedene Systeme aufgeteilt. * Jedes System setzt sich aus verschiedenen Bahnen zusammen (z.B. gibt es im auditiven System für Frequenz und Lautstärke eine eigene Bahn). * Jede Bahn ist topographisch organisiert, das heißt, was im Körper beieinander liegt, tut dies auch im Gehirn. * Die meisten Bahnen kreuzen die Mediosagitalebene, die linke Hirnhälfte ist also weitgehend für die rechte Körperhälfte zuständig und umgekehrt. • Überblick über die verschiedenen Teile des Gehirns: 4 Prämotorischer Cortex Augenbewegung, Bewegungsentwurf Motorischer Cortex Steuerung von Muskelkontraktion Präfrontaler Cortex Aufmerksamkeit, Handlungskontrolle, Gedächtnis Dorsolateraler Cortex Handlungsplanung und -kontrolle Insula Geschmacksverarbeitung Mediofrontaler Cortex Motivation Frontallappen Nucleus Accumbens “Lustzentrum” Temporallappen verbale Funktionen, Hören, Kategorisierung und Speicherung sensorischer Reize Großhirn (Neocortex) Orbiofrontaler Cortex Kontrolle von emotionalem und sozialem Verhalten Parietallappen * anterior: Verarbeitung somatosensorischer Information * posterior: räumliche Verarbeitung, links-rechts-Unterscheidung Occipitallappen Farb-, Form- und Bewegungswahrnehmung Globus Pallidus Basalganglien Endhirn (Telencephalon) Nucleus Caudatus Bewegungsplaung und -ausführung, kognitive Funktionen, Aufmerksamkeit Putamen Limbisches System Amgydala Verbindung zwischen Stammhirn und Neocortex, Emotionen, Steuerung von Verhaltens- und Denkprozessen Vorderhirn Hirn (Encephalon) Emotionale Einfärbung, Auswertung viszeraler Reize Hippocampus Tor zum Gedächtnis Mammilarkörper Hypothalamus Integration von autonomen und endokrinen Funktionen Ziwschenhirn (Diencephalon) Thalamus Gyrus Cingulus Fornix Tor zum Thalamus, Aufmerksamkeitssteuerung Verbindung zum Cortex Chiasma Opticus Verbindung zum Cortex Septum Kreuznug der Sehnerven Bulbus olfactoris Geruchssinn Tegmentum Mittelhirn (Mesencephalon) Tectum Pons Hirnstamm Hinterhirn (Metencephalon) Rautenhirn (Rhombencephalon) Schaltstelle zwischen Klein- und Großhirn Kleinhirn (Cerebellum) Motorik, Bewegungsteuerung Nachhirn (Myencephalon) Medulla oblangata Übergang von Rückenmark zu Hirn • Windungen und Furchen im Kortex: Gyrus Hirnwindung (z.B. Gyrus Prae-/Postcentralis) Suclus Hirnfurche (z.B. Sulcus Centralis) Fissura tiefe Hirnfurche (z.B. Sylvische Fruche = Fissura Lateralis) • Ventrikel: Das Gehirn ist von vier Ventrikeln durchzogen, den beiden Seitenventikeln (laterale Ventrikel), sowie dem dritten und dem vierten Ventrikel. In den Ventrikeln wir der Liqor Cerebrospinalis gebildet, der sowohl Schutz vor mechanischen Einwirkungen bietet, als auch dem Stoffwechsel dient. Die Ventrikel sind mit Epithelzellen (flache Gewebsschichten) ausgekleidet. • Hirnhäute: Das Gehirn wird von drei Hirnhäuten (Meninges) umgeben. Die dicke und undehnbare harte Hirnhaut (Dura Mater) ist die äußerste. Darunter liegt die Spinnenhaut (Arachnoidea) an. Unter der Spinnenhaut fließt der Liquor. Die innerste Hirnhaut ist die weiche Hirnhaut (Pia Mater), die dem Gehirn eng anliegt. • Vergleich des menschlichen NS mit dem anderer Spezies: Der Mensch hat den größten Neuhirn-Anteil im Vergleich zur Körpermasse. Darüber hinaus ist das menschliche Hirn auch stärker gefurcht (Ausnahme Delphin). Der Unterschied zwischen Mensch und Menschenaffe ist auf den ersten Blick sehr gering, da 98,5 % des Genoms (also der DNS) gleich sind. Betrachtet man allerdings das Transcriptom (Welche Teile der DNS werden benutzt?) und das Proteom (Gesamtheit der Proteine), erkennt man große Unterschiede. 4. Das vegetative Nervensystem • Das vegetative Nervensystem besteht aus den beiden Rückenmarksnerven Sympathicus und Parasympathicus, sowie dem Darmnervensystem. • Unterteilung des Rückenmarks: Abschnitt Lage Sympatische Verknüpfungen Parasympathische Verknüpfungen 5 Mesenzephalon ZNS - Auge Pons ZNS - Tränen- & Speicheldrüsen Medulla oblongata ZNS - Lunge, Herz, Magen, Pankreas, Dünndarm cranial - - Halsmark Auge, Tränen- & Speicheldrüsen, Lunge, Herz, thoracal Leber, Magen, Pankreas, Dünndarm, Nebennierenmark, Dickdarm, Rectum Brustmark • - Lendenmark lumbal Dickdarm, Rectum, Blase, Genitalorgane - Kreuzmark sacral - Dickdarm, Rectum, Blase, Genitalorgane Aufbau des Rückenmarks: Hinterhorn Hinterwurzel dorsal Ganglion Rückenmarkskanal laterales Horn Vorderwurzel Vorderhorn ventral * Hinterwurzel: somatosensorisch, afferent * Vorderwurzel: motorisch, efferent • Ganglionäre Verschaltung: Die Endstrecken von Sympathicus und Parasympathicus sind jeweils aus einer zweizelligen Neuronenkette aufgebaut: Ein Neuron, dass innerhalb des NS liegt wird über ein und ein Neuron, dass ein Ganglion bildet. Das Neuron mit Ursprung innerhalb des NS wird deshalb auch präganglionär genannt und das Neuron mit seinem Ziel im entsprechenden Erfolgsorgan (=Effektor) wird postganglionär genannt. Bei der Verschaltung gibt es zwei Fälle. Entweder, ein präganglionäres Neuron ist auf mehrere postganglionäre Neurone verschaltet (Divergenz), oder mehrere präganglionäre Neurone sind auf ein postganglionäres Neuron verschaltet (Konvergenz). • Der Sympathicus: Die Zellkörper aller präganglionären sympathischen Neuron liegen im Brustmark und im oberen Lendenmark. Sie verlassen das Rückenmark über die Vorderwurzel und gehen von dort zu den außerhalb des ZNS liegenden Ganglien. Diese Ganglien sind zu einem Großteil paarweise links und rechts der Wirbelsäule angeordnet und untereinander verbunden. Man nennt diese Ganglienketten linker, bzw. rechter Grenzstrang. Nervenfasern präganglionär postganglionär B-Fasern C-Fasern Myelisierung myelinisiert unmyelinisiert Durchmesser 3 µm 1 µm 20 m/s 1 m/s Typ Leitungsgeschwindigk eit Bei der sypmpatischen Übertragung ist das präganglionäre Neuron kurz und das postganglionäre lang. Der Sympaticus liegt thoracolumbal, benannt nach ihren Eintritts- und Austrittsstellen aus dem Rückenmark. Seine Erfolgsorgane des Sympathicus sind die glatte Muskulatur aller Organe (Gefäße, Eingeweide, Sexualorgane, Ausscheidungsorgane, Pupillen), Drüsen (Schweiß-, Speichel, Verdauungsdrüsen), Fettzellen, Leberzellen und lymphatische Gewebe (Thymus, Milz, Lymphknoten). • Der Parasympathicus: Die Zellkörper aller präganglionären parasympathischen Neuron liegen im Kreuzmark und im Hirnstamm. Sie ziehen sich in speziellen Nerven zum Erfolgsorgans und werden erst in dessen Nähe auf das 6 postganglionäre Ganglion umgeschaltet. Die präganglionären parasympathischen Neuron sind also sehr lang. Die postganglionären Neurone sind entsprechend kurz. Alle Neurone für den gesamten Brust- und den oberen Bauchraum sind im Nervus Vagus gebündelt. Der Parasympathicus innerviert die glatte Muskulatur und Drüsen (Magen-Darm-Trakt, Sexualorgane, Ausscheidungsorgane, Lunge), die HerzVorhöfe, die Tränen- und Speicheldrüsen und die inneren Augenmuskel. • Transmitter im vegetativen Nervensystem: Folgende Überträgerstoffe kommen im sympathischen, bzw. parasympathischen System vor: Neuron Sympathicus Parasympathicus Überträgerstoff Membranrezeptoren präganglionär Acetylcholin nikotinerg postganglionär Noradrenalin noradrenerg (α, β) präganglionär Acetylcholin nikotinerg postganglionär Acetylcholin muskarinerg • Überblick Sympathicus / Parasympathicus: sympathisch parasympathisch Mesenzephalon III IX, VII Lunge Halsmark us Tränen-, Speicheldrüsen vu sv X ag Auge ne r Pons Medulla oblangata thoracal Herz Leber Magen Brustmark zervical Pankreas Dünndarm Nebennierenmark Lendenmark Dickdarm, Rectum lumbal Blase Kreuzmark sakral Genitalorgane • Übertragung des Aktionspotentials auf das Erfolgsorgan durch Varikositäten: Das postganglionäre Neuron bildet im Effektororgan zahlreiche Verzweigungen, so dass eine Art Netz entsteht. Im Abstand von wenigen Mikrometern bilden die langen und dünnen Axone Verdickungen, die sogenannten Varikositäten aus. Diese ersetzten die Synapsen und sind für die Transmission auf das Erfolgsorgan zuständig. Sie sind bis zu 10 cm lang und übertragen das Aktionspotential oftmals mittels mehrerer Transmitter auf die sogenannten Synzytien (funktionell miteinander gekoppelte Gewebe, z.B. glatte Muskelzellen im Herz). Wird eine bestimmte Reizschwelle überschritten, wird eine Aktion im Erfolgsorgen (z.B. Vasodilation bei VIP, oder Sekretion bei ACh) bewirkt. In den Varikositäten gibt es eine präsynaptische Hemmung, die den Ausschüttungsvorgang nach der Ausschüttung durch eine negative Rückkopplung hemmt (die Varikosität besitzt also selbst Rezeptoren für den ausgeschütteten Transmitter, z.B. α2-Rezeptoren für NA). • Die Katecholaminwirkung: Einen Sonderfall innerhalb des vegetativen NS bildet das Nebennierenmark. Das Nebennierenmark ist eine sympathisch gesteuerte endokrine Drüse und ersetzt das postganglionäre Neuron. Wird das Nebennierenmark durch das präganglionäre Neuron gereizt, gibt es Katecholamine (80% Adrenalin und 20% Noradrenalin in die Blutbahn ab). Dies sorgt für eine schnelle Bereitstellung von Brennstoffen wie Sauerstoff und Glukose. Die nähere Wirkung ist im BIRBAUMER&SCHMIDT S. 154 zu finden. • Spinale Reflexbögen: Die synaptische Verschaltung zwischen Afferenzen und vegetativen Efferenzen auf spinaler segmentaler Ebene wird vegetativer Reflexbogen genannt. Diese sind disynaptisch, das heißt, es werden mehrere (in diesem Fall mindestens drei) Synapsen durchlaufen. Folgende Reflexbögen, die sich auch therapeutisch 7 nutzen lassen, gibt es: 1) viszerokutaner Reflex 2) viszerosomaischer Reflex 3) kutiviszeraler Reflex 4) intestinointestinaler Reflex Rückenmarkshinterhorn erenzen z en fer Ef m zu ale Aff zz ur H a ut r fe Ef z en rm zer Ef fe rn Da vis en nz re affe H au t zu Mu ske l Haut Darm Bauc h gang lion Muskel • Supraspinale Kerne: Die supraspinalen Teile des VNS, also Medulla Oblangata, Pons und Mesencephanlon, haben die Aufgabe, die spinalen Systeme in ihrer Tätigkeit auf einander abzustimmen (z.B. Regulierung des Blutdruck durch die Koordination des Vasokonstriktorsystems der Ateriolen mit der sympathischen Innervierung des Herzens und des Nebennierenmarks). Die Kontrolle läuft über deszendierende (absteigende) Bahnen. • Das enterische Nervensystem (Darmnervensystem): Das Darmnervensystem hat in etwa genauso viele Nervenzellen wie das Rückenmark (10 8). Seine Aufgaben bestehen in Regulation von Transport, Resorption und Sekretion der aufgenommenen Nahrung. Es umgibt Magen, Dünn- und Dickdarm in einem dichten Netz. Es besteht sowohl aus sensorischen Neuronen, motorischen Neuronen und Interneuronen. Da es eigenständige sensomotorische Programme zur Steuerung aller beteiligten Effektorsysteme beinhaltet, funktioniert es auch autonom ohne zentralnervöse Beeinflussung. Es enthält allerdings auch Verbindungen zum ZNS und VNS. Die Defäkation wird durch den Parasympathicus vom sakralen Rückenmark geregelt, unterliegt aber einer supraspinalen Kontrolle und ist somit willentlich triggerbar. • Der Hypothalamus: Der Hypothalamus ist Teil des Zwischenhirns und liegt zwischen Thalamus und Chiasma Opticus. Er hält im vegetativen NS eine maßgebliche Position inne. Er ist hier vor allem für die Aufrechterhaltung homöostatischer Funktionen (Körpertemoperatur, Flüssigkeitsvolumen, Hunger,...) zuständig. Er teilt sich auf in den Hypothalamus Lateralis und Hypothalamus Medialis und ist unmittelbar mit der Hypophyse verbunden. Die Hypophyse produziert 8 lebenswichtige Hormone und kann diese gesteuert vom Hypothalamus lagern oder freisetzen. Der Hypothalamus ist ein „Ausgang“ des limbischen Systems, besitzt aber auch einen großen Teil an Selbständigkeit bei der Steuerung von vegetativen Funktionen. Er kann dabei sowohl in das endokrine System, das vegetative NS oder und das somatische NS eingreifen. Folgende Hormone produziert die Hypophyse: Hormon Klassifikation Wirkung auf... Funktion GH, STH Wachstumshormon alle Körperzelllen Unterstützt Knochenwachstum, Proteinsynthese, Zellteilung, Lipolyse und Glykogenolyse ACTH Adenokortikotropes Hormon Nebennierenrinde Sorgt für die Ausschüttung von Cortisol aus der Nebennierenrinde TSH Thyreoideastimulierendes Hormon Schilddrüse Wirkt auf die Schilddrüse ein (Proteinsynthese, Wachstum, Hirnreifung) Prolaktin MilchsyntheseHormon alle Körperzelllen Verantwortlich für die Produktion von Muttermilch FSH, LH Geschlechtshormone Gonaden Testosteron-Ausschüttung (u.a. Aggressivität), Spermabildung ( ), Menstruation & Follikelbildung ( ), Entwicklung des Geschlechtes ADH, Antidiuretisches Vasopressin Hormon Niere Einfluß auf Wasserhaushalt und Kreislauf Oxytozin Uterus, Brust ( Geschlechtshormon ) Kontraktion des Uterus bei Geburt, Freisetzung von Muttermilch, Bindungsverhalten Der Hypothalamus hat folgende Funktionen und bei einer Läsion kommt es zu folgenden Störungen: Funktion Schlaf-Wach-Rhythmus, Thermoregulation, endokrine Regulation, Wahrnehmung, kalorischer Haushalt, Flüssigkeitshaushalt, Bewußtsein 8 Akute Läsion Chronische Läsion Schlaflosigkeit, Hyperthermie, Diabetes Insipidus, endokrine Störungen, Nacholepsie (=Schlafsucht), emotionale Störungen, vegetative Störungen, Poikilothermie (fehlende Anpassung der Körpertemperatur) Schlaflosigkeit, endokrine Störungen (z.B. Pubertas Praecox = verfrühte Ausreifung der sekundären Geschlechtsmerkmale), Gedächtnisstörungen bis -verlust, emotionale Störungen, Fettsucht o. Abmagerung, kein Durstgefühl, vegetative Störungen, Poikilothermie 5. Allgemeine Sinnesphysiologie • Definitionen: Empfindung ein adäquater (also auf den Rezeptor passender) Reiz, der eine Sinnesleistung auslöst Wahrnehmung Deutung einer Sinnesempfindung (beruhend auf Erfahrung) ESP extra sensory perception (Empfindung an der Sensorik vorbei; Mechanismen ungeklärt) • Abgrenzung objektive Sinnesphysiologie von Wahrnehmungspsychologie: Die objektive Sinnesphysiologie beschäftigt sich mit allen Mechanismen auf dem Weg von einem Phänomen in der Umwelt bis zur sensorischen Verarbeitung im ZNS. Ab hier greift der Forschungsbereich der Wahrnehmungspsychologie, der die Mechanismen der Verarbeitung der objektiven Daten aus dem sensorischen ZNS hin zu einer subjektiven Wahrnehmung. • Klassifikation der Rezeptoren zur Wahrnehmung: * Exterozeptoren (= 5 Sinne) * Propriozeptoren (Daten über Stellungen der Muskeln) * Enterozeptoren (Daten über viszerale Afferenz) Die Modalität erfaßt hierbei den einzelnen Sinn (z.B. hören, reichen,...), währen die Qualität angibt, was mit diesem Sinn erfaßt wird (z.B. Farben, Töne,...). Nachfolgend sind alle Sensorsysteme außer der Enterozeption mit ihrer Modalität zusammengefaßt: haptisch propriozeptiv olfaktorisch gustatorisch auditiv visuell Berührung, Schmerz, Temperatur Proprioception (Muskel- und Sehnenspindel) Riechen Schmecken Hören, Gleichgewicht Sehen • Transduktion und Transformation: Unter Transduktion versteht man den Prozeß, der einen adäquaten Reiz in eine Änderung des Membranpotential einer passenden Sinneszelle übersetzt (für jedes Sinnesorgan gibt es Reize, auf die es optimal reagiert), also die Umwandlung des Reizes in ein lokales Sensorpotential. Meist wird der Reiz dabei verstärkt. Der Reiz trifft also auf einen geeigneten Rezeptor, woraufhin dieser mechanisch oder spannungsaktivierte K+-Kanäle öffnet. Daraufhin wird die Zelle depolarisiert. Aber erst wenn der Reiz eine bestimmt Schwelle übersteigt, wird ein Aktionspotential ausgelöst („Alles-oder-nichts-Prinzip“). Die Umkodierung des Sensorpotentials in fortgeleitete Aktionspotentiale wird als Transformation bezeichnet. Bei die Grundspannung, aus der die Aktionspotentiale herausstechen, ist das Generatorpotential. • Reiz-Adaption: • Trifft ein gleichbleibender Reiz mehrfach auf einen Sinnesrezeptor auf, nimmt die Erregung dieses Sensors ab. Dieser Effekt heißt Adaption. • Codierung der Reizstärke: Die Stärke des Reizes (Quantität) wird nicht in der Stärke der Spannung der Aktionspotentiale codiert, sondern in der Frequenz, mit der die (immer mit etwa der gleichen Spannung auftretenden) Aktionspotentiale auftauchen. Hierfür muß allerdings eine bestimmte Schwelle überschritten werden. Ab einer gewissen Stärke des Reizes nimmt die Frequenz der Aktionspotentiale nicht mehr zu. Die Sensorzelle ist maximal erregt und damit in der Sättigung. Eine Nervenzelle weißt bei einer Reizung entweder ein eher tonisches (lang anhaltend) oder ein eher phasisches (kurz anhaltendes) Antwortverhalten auf. • Intermodaler Intensitätsvergleich: Bei einem intermodalen Intensitätsvergleich wird die Stärke eines Reizes in Abhängigkeit mit der wahrgenommenen Empfindung gemessen. Da sich die VPn beim Ausdrücken der Stärke der Empfindung auf einer Zahlenskala schwer tun, weicht man auf andere Methoden aus. Die VP soll z.B. um so stärker auf einen Kraftmesser drücken, um so stärker sie den Reiz empfindet. Aus den gewonnen Daten rechnet man einen Quotienten aus, der angibt, wie sensitiv der Mensch auf die getestete Modalität ist. Anschließend lassen sich die Quotienten der unterschiedlichen Modalitäten vergleichen. Hierbei gilt, um so größer der Quotient, desto empfindlicher reagiert man auf Unterschiede (z.B. ist der Quotient auf einer doppelt logarithmischen Skala für durch elektrischen Strom hervorgerufenen Schmerz 2,13, während er für die Helligkeitsintensität von weißem Licht nur 0,21 beträgt). Bei Modalitäten, die in einem großen 9 • • • • • • Spektrum vorkommen (z.B. Helligkeit, Lautstärke,...) ist der Mensch also auf Unterschiede weniger sensitiv. Integrierende Sinnesphysiologie: Bei der integrierenden Sinnesphysiologie vergleicht man objektive neuronale Schwellen (also Schwellen zur Weiterleitung eines Aktionspotentials) mit der subjektiven Wahrnehmungsschwelle. Es zeigt sich, dass beide Schwellen nicht immer gleich sind. Es kann vorkommen, dass ein anderer Verlauf wahrgenommen wird, als er neuronal vorliegt. Die Empfindlichkeitsschwellen hängen dabei nicht nur von den Sensoren ab, sondern auch von der Art der Übertragung in der Sinnesbahn. Rezeptive Felder: Auf ein sensorisches Neuron sind mehrere Sensoren geschaltet. Die Gesamtheit der Sensoren, die auf ein Neuron geschaltet sind nennt man primäres rezeptives Feld. Dieses kann unterschiedliche Größe haben (z.B. 0,02 mm2 im visuellen Feld und damit sehr klein). Die Sensoren eines rezeptiven Feldes können unterschiedlich verschaltet sein. Durch eine laterale Inhibition kann eine Kontrastverstärkung erzielt werden. Durch hemmende Interneurone wird hierbei der einzelne Reiz besser von seiner Umgebung abgegrenzt und aus der gesamten Sinnesinformation extrahiert. Die zentralen sensorischen Neurone haben also oft komplexe rezeptive Felder mit erregenden und hemmenden Anteilen (teils nebeneinander, teils konzentrisch umeinander gelegen). Innerhalb eines rezeptiven Feldes kann es zu Konvergenzen (Zusammenschaltung mehrerer Neurone auf eine Synapse) und Divergenzen (Aufteilung eines Neurons auf mehrere Synapsen) kommen. Absteigende Inhibition in aufsteigenden afferenten Nervenbahnen: Um sich vor einer Überflutung mit unwichtigen Informationen zu schützen, gibt es in den sensorischen Bahnen nicht nur aufsteigende afferente Bahnen, sondern auch absteigende hemmende Bahnen zur Kontrolle des afferenten Zustroms (Transmitter: GABA). Durch diese absteigende Hemmung kann die Empfindlichkeit des sensorischen Systems moduliert werden, es gibt also eine zentrale Kontrolle der Sensorischen Übermittlung. Die absteigenden Hemmsysteme haben teils post-, teils präsynaptische Angriffspunkte. Unspezifische Bahn: Die gewonnen sensorischen Informationen werden auf zwei verschiedenen Bahnen zu den entsprechenden Hirnkernen geleitet: Zum einen die spezifische Bahn (bei der Art, Stärke und Ort der Erregung mit übertragen werden) und die unspezifische Bahn. Die unspezifische Bahn überträgt eine Zusammenfassung der einzelnen Erregungen ohne genau nach Art, Stärke oder Ort zu differenzieren. Sie verbindet den Thalamus und die Formatio Reticularis mit allen Sinnessystemen. Ihre Tätigkeit führt zum Aufwachen, bzw. Einstellen eines bestimmten Wachheitsgrades, sowie zu Aufmerksamkeits- und Hinwendungsreaktionen. Die unspezifsche Bahn ist außerdem mit dem limbischen System verknüpft. Psychophysik vs. physiologische Psychologie: * Interessengebiet der Psychophysik: Reiz Empfindung * Interessengebiet der physiologischen Psychologie: Reiz Reizverarbeitung Empfindung Weber-Regel und Weber-Quotient: Die Weber-Regel besagt, dass die Unterschiedsschwelle ein konstanter Bruchteil der Ausgangsreizintensität ist: ∆E = k * ∆S/S ; (∆E = Unterschiedschwelle, ∆S/S = relativer Reizzuwachs) Bei großen Reizen braucht es also einer größere Änderung des Reizes, um einen Unterschied wahrzunehmen, als bei kleinen. Die Sinne sind also Meßapparaturen mit automatischer, von der Meßgröße abhängiger Empfindlichkeitseinstellung. Der Weber-Quotient gibt die Beziehung zwischen Ausgangsgröße und Reizzuwachs für die Unterschiedsschwellle an. • Fechner-Gesetz: Das Fechner-Gesetz besagt, dass einem linearen Zuwachs in Empfindungsstärke ein logarithmischer Zuwachs der Reizstärke entspricht: E = k * log S ; (E = Reizempfindung, S = Gesamtreizintensität) Dieses Gesetz ist auch das psychopyhsikalische Grundgesetz. Da z.B. mit einer Verdopplung des Reizes nicht eine Verdopplung der Empfindung einher geht, ist die Meßempfindlichkeit bei schwachen Reizen hoch, bei starken geringer. Ein großes Spektrum bleibt somit gewahrt. • Stevens-Funktion: Die Stevens-Funktion besagt, dass Reizstärke und Empfindungstärke über eine Potenzfunktion miteinander verbunden sind: 10 E = k * (S - S0)n ; (E = Reizempfindung, S = Gesamtreizintesität, S0 =Schwellenreizstärke, n = spezifischer Exponent) Bei n = 1 stimmt die Reiz- mit der Wahrnehmungsintensität überein, bei n < 1 ist die Änderungsintensität kleiner als die Wahrnehmungsintensität, das heißt, die tatsächlichen Änderungen sind feiner als die Wahrnehmung. 6. Das visuelle System • Sichtbares Licht: • • • • • • Das für den Menschen sichtbare Licht liegt in einem Bereich zwischen 400 nm (violet) und 700 nm (rot), also im Bereich zwischen UV-Strahlung und infraroter Strahlung. Aufbau des Auges: Der Aufbau eines Auges ist mit dem einer Fotokamera zu vergleichen. Allerdings ist die physikalisch optische Qualität des Auges im Vergleich nicht besonders gut. Die Rolle Objektiv übernimmt ein zusammengesetztes System aus Hornhaut, vorderer Augenkammer, Iris und Linse. Dieses Objektiv wird über den Zillarmuskel, der die Linse dehnen oder entspannen kann, in der Schärfe eingestellt (Akkomodation), während die Iris die Aufgabe der Blende übernimmt. Es wirft ein umgedrehtes Bild auf die an der Augenrückwand befindliche Retina (Netzhaut). Diese ist ein neuronales Netzwerk bestehend aus Stäbchen, Zapfen und verschiedenen Neuronen. Die Axone der Ganglien bilden den Sehnerv und gleichzeitig einen blinden Fleck. Entwicklungsgeschichtlich hat es sich ergeben, dass die Lichtstrahlen, bevor sie auf die Photosensoren treffen, erst durch die gesamte Neuronenschicht müssen. Nur an der Fovea sind die Neuronen beiseite geschoben und das Licht trifft direkt auf. In der Fovea stehen die Zapfen besonders dicht, sie ist damit die Stelle des schärfsten Sehens. Eine genau Fixation auf ein Objekt besteht darin, das Auge so auszurichten, dass das Licht auf die Fovea fällt. Sehfehler: Ist der Augapfel zu lang kommt es zu einer Myopie (Kurzsichtigkeit), ist er zu kurz kommt es zu einer Hyperopie (Weitsichtigkeit). Transduktion bei Photosensoren: Bei Lichteinfall auf ein Außenglied eines der Photosensoren zerfällt der in diesen gespeicherte Sehfarbstoff. Durch diesen Zerfall wird die Transduktion eingeleitet. Na+-Kanäle schließen sich und es kommt zu einer Hyperpolarisation. Dies ist eine Besonderheit des visuellen Systems, da die Sensoren in anderen Systemen depolarisiert werden. Beim visuellen System verhält es sich umgekehrt, trifft kein Licht auf die Zelle ein, ist sie depolarisiert und es fließt ein Dunkelstrom (-30 mV). Trifft Licht ein, kommt es durch die Schließung der Na+-Kanäle zu einer Verschiebung in Richtung K +-Gleichgewichtspotential (-70 mV), sie wird hyperpolarisiert, der Dunkelstrom versiegt und es kommt zu üblichen Sensorpotential. Stäbchen (Helligkeit): Die Stäbchen sind für die Wahrnehmung von Helligkeit zuständig. Die Zapfen sind nicht gleichmäßig über die Netzhaut verteilt, sondern befinden sich am außerhalb der Fovea in höchster Dichte und nehmen dann nach außen hin ab. Es gibt ca. 20x mehr Stäbchen als Zapfen. Der Sehfarbstoff bei den Stäbchen ist das Rhodopsin (Sehpurpur), das in Membraneinfaltungen gelagert wird. Er zerfällt, sobald ein Photon auf ihn trifft. Durch eine cGMP-Kette werden Na+-Kanäle geöffnet, es kommt zur Hyperpolarisation und einem entsprechenden Sensorpotential. Das zerfallene Rhodpsin muß nach dem Zerfall unter Energieaufwand wieder aufgebaut werden. Für eine bestimmte Helligkeit sind die Prozesse von Zerfall und Aufbau im Gleichgewicht. Bei großer Helligkeit hingegen ist das Rhodopsin nahezu ausgebleicht, die Stäbchen also kaum noch lichtempfindlich, bei Dunkelheit, regeneriert sich der Sehpurpur zu einer Maximalkonzentraion hin. Zapfen (Farbwahrnehmung): Die Zapfen sind für die Wahrnehmung von Farben zuständig. Man unterscheidet drei Typen, die ihre Wahrnehmungsmaxmia jeweils bei rot, grün oder blau haben. Aus diesen drei Grundfarben können alle anderen Farben gemischt werden. Die Zapfen sind nicht gleichmäßig über die Netzhaut verteilt, sondern befinden hauptsächlich in der Fovea, ansonsten findet man sie nur in geringer Dichte. Dies ist auch der Grund, warum das Auge nach außen hin nur noch schwarz-weiß sieht. Die Transduktion erfolgt in gleicher Weise wie bei den Stäbchen, wird kein Rhodopsin verwendet, sondern jeder Zapfen-Typus hat seinen eigenen Sehfarbstoff, der bei der für das Stäbchen charakteristischen Farbe am leichtesten zerfällt. Der Aufbau eines Zapfen ist im BIRBAUMER&SCHMIDT S. 389 zu sehen. Signalverarbeitung in der Netzhaut: Zwischen den Photosensoren als Eingang und den Ganglienzellen als Ausgang der Netzhaut liegen drei weitere neuronale Zellentypen, die Horizontalzellen, die Bipolarzellen und die Amakrinen. Es gibt in diesem neuronalen Netzwerk zwei Hauptflußrichtungen, nämlich ersten die Verschaltung von Photosensoren über Bipolarzellen auf die Ganglienzellen und zweitens ein quer dazu verlaufender 11 Signalfluß in Horizontalzellen und Amakrinen. Die neuronale Signalverarbeitung läuft in der Netzhaut nicht über Aktionspotentiale, sondern über langsame lokale Membranpotentiale. Dies ist eine Besonderheit des visuellen Systems. In der Verarbeitung ist eine starke Konvergenz zu beobacheten: Auf etwa 125 Millionen Photosensoren kommen nur ca. 1 Millionen Ganglien. Diese Konvergenz erlaubt eine komplexe Verknüpfung der Neurone und damit schon auf Ebene der Retina eine erhebliche Aufarbeitung der Signale. Die Ganglienzellen bilden als einzige in der Netzhaut Aktionspotentiale aus, die über den Sehnerv in Gehirn getragen werden. Die Signalverarbeitung erfolgt über rezeptive Felder, die aus einem kleinen inneren Kreis (RF-Zentrum) und einem konzentrisch darum gelagerten äußeren Feld (RF-Peripherie) bestehen. Diese Felder können auf drei verschiedene Arten von Neuronen verschaltet sein. Zuerst soll auf das Hell-Dunkel-Sehen der Stäbchen eingegangen werden. Entweder bewirkt ein Lichtreiz auf das RF-Zentrum ein Anhebung der Entladung des Neuron und ein Lichtreiz auf die RF-Peripherie eine Senkung der Entladung. Diese Neurone nennt man On-Zentrum-Neurone. Oder es verhält sich umgekehrt, so dass ein Lichtreiz auf das Zentrum für weniger Entladungen und die Peripherie für mehrere Entladungen sorgt. Diese Neurone sind Off-Zentrum-Neurone. Als dritte Gruppe gibt es die On-Off-Zentrum-Neurone. Diese werden bei einer Belichtungsänderung kurz aktiviert und sind besonders wichtig für die Bewegungswahrnehmung. Beim Farbsehen gibt es parallel zum Hell-Dunkel-Antagonismus einen Rot-Grün und einen Gelb-BlauAntagonismus, die dem selben Prinzip folgen. • Photopisches vs. skotopisches Sehen: Photopisches Sehen wird bei genug Helligkeit (z.B. Tageslicht) durch die Zapfen vermittelt. Es ist farbig und scharf. Bei schlechten Lichtverhältnissen wird auf das skotpische Sehen umgeschaltet, das nur von den Stäbchen vermittelt wird und eine funktionelle Farbenblindheit darstellt. • Signalverarbeitung in subkortikalen visuellen Zentren: Jedes Auge nimmt ein Bild aus beiden Gesichtshälften auf. Die Sehnervenfasern beider Augen sind nun so verschaltet, dass jeweils die Fasern für die linke Gesichtshälfte aus beiden Augen zusammenlaufen und in die rechte Gehirnhälfte laufen und umgekehrt. Die notwendige Kreuzung der Sehbahnen geschieht im Chiasma Opticus. Die Sehbahnen kreuzen sich kurz hinter dem Chiasma Opicus und ein kleiner Teil läuft in die Colliculi Superiores, die die Bewegung der Augen steuern. Die andern laufen in einen Kern des Thalamus, den Corpus Geniculatum Laterale Dieser ist die erste und einzige Schaltstelle zwischen Netzhaut und Kortex. Die Verschaltung im Corpus Geniculatum Laterale erfolgt in sechs Neuronenschichten, die abwechselnd dem ipsilateralen (gegenüberliegenden) Auge zugeordnet sind. Von dort aus geht es in den visuellen Kortex. • Signalverarbeitung im visuellen Kortex: Die Daten über die Lichtimpulse gelangen letztendlich in die primäre Sehrinde des visuellen Kortex im Occipitallappen. Diese ist topologisch (also retinotrop) organisiert, das heißt, das Gesehene wird genauso auf die Sehrinde abgebildet. Allerdings kommt es hierbei zu Verzerrungen, denn die kleine (aber wichtige) Fovea nimmt genausoviel Platz in Anspruch wie die restliche Retina. Die primäre Sehrinde ist in sechs Schichten aufgeteilt und heißt deshalb auch Aria Striata. Die Informationsverarbeitung findet in sogenannten Dominanzsäulen verarbeitet, die jeweils die Verarbeitung eines Gebiets eines Auges übernehmen. Die Säulen sind ebenfalls retinotrop und wechseln sich für jedes Auge ab. Die Dominanzsäulen sind weiter in Orientierungssäulen unterteilt. Die Nervenzellen in den Orientierungssäulen reagieren besonders empfindlich auf bewegte Kontrastgrenzen bestimmter Orientierung. Zwischen den Orientierungssäulen gibt es größere Bereiche, die nicht auf die Orientierung, sondern auf farbige Reize empfindlich sind. Diese rezeptiven Feldeigenschaften der Sehrinde ermöglichen die Struktur, Bewegung und Farbe eines visuellen Reizes zu erkennen. • Motorik der Augen: * Mikrotremor: Vermeidung der Adaption auf einen Reiz durch ein leichtes Zittern des Auges * Sakkade: sprunghafte Augenbewegung * Nystagmus: Wechsel zwischen Augenfolgebewegung und Sakkade * Vergenzbewegung: Zoom nah/fern, fern/nah 7. Das auditive System • Schalldruck: Eine Schallwelle wird bei der Weiterleitung durch die Luft durch Stellen hoher, bzw. niedriger Kompression abgebildet. Die Hörschwelle liegt bei 3,2 x 10 -5 Pa und die Schmerzgrenze bei 63 Pa. Um der Wahrnehmung der Lautstärke gerechter zu werden, wird der Schalldruck aber nicht in linearen Pascal [Pa], sondern in logarithmischen Dezibel [db] kordiert. Nachfolgend einige Beispiele für Lautstärken: Ländliche Ruhe 20 db Normales Gespräch 60 db 12 Lauter Straßenlärm 80 db Donner 120 db Startendes Flugzeug 140 db • Aufbau des Ohrs: • • • • Außenohr Mittelohr Innenohr Ohrmuschel, Gehörgang Trommelfell, Gehörknöchelchen (Hammer, Amboß, Steigbügel), Muslcus Tensor Tympani, Musculus Stapedius Ovales Fenster, Rundes Fenster, Cochlea (Schnecke) Der Schall wird von der Ohrmuschel eingefangen und über den Gehörgang auf das Trommelfell übertragen. Vom Trommelfell wird die Schwingung durch die Gehörknöchelchen auf die Cochlea übertragen (der Steigbügel liegt direkt auf der Cochlea auf). Durch Anspannung der beiden Mittelohrmuskeln wird die Kette der Gehörknöchelchen versteift, so dass der Schall etwas gedämpft wird. Der Sinneszellen des auditiven Systems sitzen in der Cochlea. Aufbau der Cochlea: Die Cochlea liegt im Felsenbein des Schädels verborgen. Sie ist am einen Ende eingerollt und macht 2,5 Windungen. Die Cochlea ist im Inneren in drei Etagen aufgeteilt, von oben nach untern sind dies die Scala Vestibuli, die Scala Media und die Scala Tympani. Die beiden äußeren Skalen (Vestibuli, Tympani) sind mit Perilymphe gefüllt und am hinteren Ende der Cochlea am sogenannten Helicotrema verbunden, die Scala Media hingegen ist mit Endolymphe gefüllt. Die Wand zwischen Scala Vestibuli und Media wird Reissner-Membran genannt und zwischen Media und Tympani wird Basiliarmembran genannt. Aufbau des sensorischen Apparates: Der eigentliche sensorische Apparat sitz in der Skala Media auf der Basiliarmembran auf. Es ist das sogenannte Corti-Organ. Im Corti-Organ befinden sich die Hörsensoren, die Haarzellen. Die Haarzellen tragen sehr kleine haarförmige Fortsätze, die man Stereozilien nennt. Es gibt drei Reihen äußere Haarzellen und eine Reihe innere Haarzellen. Diese Haarzellen sind sekundäre Sinneszellen, das heißt, sie bilden selbst keine Nervenfortsätze aus, sondern werden durch ein Ganglion versorgt, das in der Cochlea liegt und über seine Bipolarzellen Haarzellen mit Gehirn verbindet. Auf den Stereozilien liegt die Tektorialmembran auf. Sie ist auf der inneren Seite der Scala Media befestigt. Innervierung der Haarzellen: Die äußeren und die inneren Haarzellen werden getrennt innerviert. Während jede innere Haarzelle von einer eigenen Nervenfaser innerviert wird, müssen sich viele äußere Haarzellen eine Nervenfaser teilen. Obwohl es also weniger innere Haarzellen gibt, sind sie mit 90% der afferenten Nervenfasern, die aus dem Corti-Organ laufen verbinden. Zusätzlich gibt es noch eine kleine Zahl efferenter Nervenfasern, die hauptsächlich mit den äußeren Haarzellen verbunden sind. Diese können die Erregbarkeit der Haarzellen modulieren. Transduktion im auditiven System: Trift nun eine Schallwelle auf das Trommelfell auf, wird die über die Gehörknöchelchen durch die Wand der Cochlea am ovalen Fenster auf die Skala Vestibuli übertragen. Die Perilymphe innerhalb der Scala Vestibula ist unelastisch, so dass ein Druckausgleich innerhalb der Cochlea nötig wird. Dieser erfolgt über das runde Fenster. Der Schall breitet sich in der Cochlea wellenförmig aus und so bilden sich entlang der Scala Media Wanderwellen aus, die je nach Frequenz an verschiedenen Stellen Maxima ausbilden. Ein komplexer Schall wird also nach Frequenz aufgespreizt, wobei hohe Frequenzen eher Maxima in der Nähe des Steigbügel ausbilden und tiefe Frequenzen eher am Helicotremas. Dies nennt man Ortsprinzip. Die Haarzellen werden in erster Linie an Stellen von Schwingungsmaxima erregt. Die Wanderwellen erzeugen eine Relativbewegung der Basiliar gegenüber der Tektorialmembran. Dadurch werden die Stereozilien verbogen (abgeschoren), was in der Haarzelle ein Sensorpotential auslöst. Der für dieses Sensorpotential nötige K +-Einstrom (einzigartig, nicht Na+) wird nicht etwa durch einen Rezeptor erreicht, sondern die Kanäle werden mechanisch gereizt. Dies funktioniert über kleine Verbindungen (Tip Link) von einer Stereozilie zu einem K+-Kanal der hinterstehenden Stereozilie. Die Endolymphe ist positiv (85 mV) geladen, so dass der Einstrom ein sogenanntes Mikrophonpotential auslöst. Das Mikrophonpotential folgt dem Reiz ohne Latenz, besitzt keine Refraktärzeit und keine meßbare Schwelle. Das Sensorpotential wird am Ende der Haarzelle über eine Synapse weitergegeben. Die äußeren Haarzellen können sich zusätzlich weiter aus- oder einfahren. Dadurch wird an den inneren Haarzellen eine bis zu 100fache Verstärkung erreicht, außerdem wird eine bessere Differenzierung einzelner Frequenzen möglich. Das Motorprotein der Stereozilien ist Aktin. • Signalverarbeitung im Kortex: In den Hörnervenfasern wird durch die Frequenz der Aktivierung und die Verschaltung auf frequenzspezifische Haarzellen der Schall kodiert. Das so verschlüsselte Schallereignis wird über mindestens fünf 13 • Synapsen in den auditorischen Kortex beider Hirnhälften weitergegeben. Auf dem Weg dorthin werden im sogenannten Olivenkomplex schon erste Vergleiche zwischen den Signalen von den unterschiedlichen Ohren vorgenommen. Durch die Verarbeitung von Laufzeitunterschieden wird Aufschluß über den Ort, von dem das Signal ausgestrahlt wurde, gewonnen. Der primäre auditive Kortex besteht aus sechs Schichten, in denen die Verarbeitung des Signals stattfindet. Die Verarbeitung ist tonotrop organisiert, das heißt der auditive Kortex ist topographisch nach der Frequenz aufgebaut. Vom primären gibt es eine Verbindung zum sekundären auditiven Kortex. Dieser ist auf die Erkennung von Sprachlauten spezialisiert. Es zeigt sich, dass die Neurone der Hörrinde häufig auf bestimmte Schallmuster spezialisiert sind. Diagnostik-Verfahren bei Hör-Defekten: Webber & Rinne 8. Das vestibuläre System • Aufgaben des vestibulären Systems: • • • • • • Das vestibuläre System entspricht dem Gleichgewichtssinn. Es ist also für die Wahrnehmung der Körperstellung im Raum zuständig. Es reagiert auf Schwerkraft, sowie positive und negative lineare Beschleunigungen aller Art. Darüber hinaus vermag es auch Drehbeschleunigung um alle drei Achsen des Raumes wahrzunehmen. Da sich das vestibuläre System im Kopf befindet kann es natürlich nur Ausagen über die Stellung des Kopfes im Raum sagen. Diese Daten werden aber mit Daten über die Stellung des Kopfes zum Körper abgeglichen, so dass sich ein Information über die Stellung des ganzen Körpers im Raum ergibt. Aufbau des vestibulären Systems: Das vestibuläre Labyrinth sitzt auf dem oberen Teil der Cochlea. Seine drei Bogengänge (horizontaler, vorderer vertikaler und hinterer vertikaler Bogengang) stehen praktisch senkrecht aufeinander und ihre Cupulaorgane messen Drehbeschleunigungen um alle drei Raumachsen. Unter den Bogengängen befinden sich die beiden Maculaorgane oder Statolithenorgane, die Macula Utriculi und die Macula Sacculi, die auf Linear- und Translationsbeschleunigung spezialisiert sind. Der von diesen Teilen umschlossene Teil der Labyrinths ist mit Endolymphe umgeben und mit Perilymphe gefüllt. Die Sensorzellen des vestibulären Systems: Bei den Sensorzellen des vestibulären Systems handelt es sich parallel zu den Hörsensorzellen sowohl um Haarzellen, als auch um sekundäre Nervenzellen. An ihre Oberfläche finden sich ebenfalls Stereozilien, sie haben allerdings ein zusätzliches großes Kinozilium. Die Haarzellen des vestibulären Systems werden sowohl über afferente, als auch über efferente Nervenfasern innerviert. Die efferenten Nervenfasern verstellen hierbei die Empfindlichkeit der Haarzelle. Die Transduktion funktioniert wie bei den Hörsensoren, allerdings besitzen die Haarzellen des vestibulären Systems eine hohe Ruheaktivität und sie sind stark richtungssensitiv, das heißt, eine Abscherung in Richtung zum Kinozilium bewirkt eine Erhöhung, in Richtung gegen das Kinozilium eine Verminderung der Aktivität. Aufgaben der Maculae: Die Zilien der Macula Utriculi und die Macula Sacculi liegen in einer gallertartigen Masse. Diese enthält kleine Calciumcarbonat-Kristalle, die Otolithen, und wird deshalb auch Otholithenmembran genannt. Die Otholithemembran hat eine höhere Dichte als die Endolymphe. Wirkt also eine Beschleunigungskraft auf sie ein, verschiebt sie sich zur Endolymphe und rutscht dadurch einen kleinen Betrag über die Haarzellen hinweg. Die Maculae sind also für Registrierung von linearen Beschleunigungen zuständig. Bei aufrechter Körperhaltung liegen die Maculae Utriculi in etwa waagrecht im Schädel, sie sind dadurch für lineare Beschleunigung in der waagrechten Ebene besonders empfindlich. Auch bei KippBewegungen geben sie Aktionspotentiale weiter. Die Maculae Sacculi sind senkrecht angeordnet und unterliegen im Ruhezustand der Gravitationsbeschleunigung. Sie reagieren auf Kippen des Kopfes und sämtliche senkrechten Beschleunigungen und bringen somit ebenfalls wichtige Daten zu Stellung des Kopfes im Raum. Aufgaben der Cupulae: Die Cupulae sind jeweils an einem Ende der Bogengänge zu finden. Die sie umgebende gallertartige Masse hat überall die gleiche Dichte und ist damit unempfindlich für lineare Beschleunigung. Ihre Aufgabe liegt in der Wahrnehmung von Drehbeschleunigungen. Bei Drehbeschleunigungen bleibt die Endolymphe wegen ihrer Trägheit zunächst in Ruhe, so dass sie sich relativ zu den Cupulae verschiebt. Da die drei Bogengänge senkrecht aufeinander stehen lassen sich so alle möglichen Drehungbeschleunigungen im Raum registrieren. Das zentrale vestibuläre System: Die Haarzellen des vestibulären Systems sind mit den vestibulären Kernen im Cerebellum verbunden. Diese Kerne erhalten außerdem zahlreiche andere sensorische Afferenzen (z.B. visuelle oder propriozeptive) und können so eine eindeutige Information über die Stellung des Körpers im Raum gewinnen. Ihre Aufgabe liegt dem entsprechend auch in der Aufrechterhaltung des Gleichgewichts über die Stützmotorik, sowie die Abstimmung von Kopf- und Augenbewegung. Vestibulookoläre Reflexe: 14 Durch die enge Verschaltung von vestibulären und visuellem System kommt es zu Reflexen zwischen beiden festgestellter Änderung der Stellung des Kopfes und der Stellung der Augen. So kommt es zu einem Nystagmus. Dies ist eine Fixation auf einen Punkt, auch wenn der Körper sich wegdreht (z.B. versucht man durch Drehung der Augen die Fixation auf einem Punkt zu lassen, auch wenn man auf einem Drehstuhl weggedreht wird). 9. Der Geruchssinn • Lage und Bau der Riechzellen: Die Sensoren des olfaktorischen Systems heißen Riechzellen und befinden sich tief in der Nasenhöhle im sogenannten Riechepithel. Das Riechepithel besteht aus Riechzellen, Basalzellen und Stützzellen, außerdem noch Bowman-Drüsen, die das Riechepithel feucht halten. Die Riechzellen sind bipolare primäre Sinneszellen, die am einen Ende Zilien in die Schleimhaut der Nasenhöhle ausbilden und am anderen Ende über ein unmyelinisiertes Axon, der Fila Olfactoria, verfügen. Diese treten durch die kleinen Löcher des Siebbeins, um als Nervus Olfactorius zusammengefaßt zum Bulbus Olfactorius zu laufen. Die Riechzellen haben nur eine Lebensdauer von ca. 60 Tagen, dann werden sie aus den Basalzellen neu nachgebildet. Sie sind die einzigen Nervenzellen, die zu Zellteilung fähig sind. Jede neue Riechzelle muß ihren Dendriten in die Schleimhaut und ihr Axon zum Bulbus olfactorius ausbilden. Der Mensch hat insgesamt ca. 50 Millionen Reichzellen. • Transduktion in den Riechzellen: Die Transduktion wird eingeleitet, indem sich Riechstoffmoleküle in der Schleimschicht an spezielle Rezeptormoleküle der Zilienmembran binden. Geschieht dies werden in der Riechzelle über eine intrazelluläre Kaskade Ionen-Kanäle für Na+ und K+ geöffnet. Die intrazelluläre Kaskade läuft über ein GProtein, das dafür sorgt, das ATP in cAMP (klassischer Second Messenger) gewandelt wird. Das cAMP wieder öffnet die Ionen-Kanäle. Durch diese Kasakde wird ein großer Verstärkungsfaktor erreicht. Es hat sich gezeigt, dass es für Tausende verschiedene Spezialisten für alle möglichen Riechstoffmoleküle gibt, die sich alle in der Art ihrer Rezeptoren (7-Helix-Rezeptoren) unterscheiden. Es wird also kein einfacher Reizübertragen, sondern der Geruch wird in einem Reizprofil kodiert. • Verarbeitung der Reize im Bulbus Olfactorius: Die Neurone des Bulbus Olfactorius sind in vier Schichten angeordnet. Es folgen nacheinander die Schicht der Glomeruli, die äußere plexiforme Schicht, die Schicht der Mitralzellen und die Schicht der Körnerzellen (innere plexiforme Schicht). Die wesentlichen Merkmale der Informationsverarbeitung in Bulbus Olfactorius sind eine starke Konvergenz der Riechzellaxone auf die Mitralzellen, ausgeprägte Hemmechanismen und eine efferente Kontrolle der afferenten Information. Etwa 1000 Axone der Riechzellen werden auf einem großen Glomeruli (synaptische Kontaktstelle der Mitralzellen) zusammengefaßt. In der äußeren plexiformen Schicht findet eine erste Verarbeitung durch die periglomulären Zellen statt. In der äußeren plexiformen Schicht findet man die Körnerzellen. Diese stehen unter starker efferenter Kontrolle und wirken hemmend auf Mitralzellen und Glomeruli. Von dort wird die Information weiter in den höhere Zentren weitergetragen. • Weitere Verarbeitung: Vom Bulbus Olfactorius gelangt die Information über den Thalamus zum NeoKortex. Darüber hinaus gibt es direkte Verbindungen limbischen System und von dort zum Hypothalamus und zur Formation Reticularis. Durch die direkte Verbindung zum limbischen System kommt es zu einer starken emotionalen Einfärbung der Gerochenen. Duftstoffe haben wichtige Signalfunktionen zwischen Individuen und Gruppen und beeinflussen, denn jeder Mensch verfügt über einen genetisch determinierten Eigengeruch. Auch das Fortpflanzungsverhalten und die hormonelle Steuerung werden von bestimmten Duftstoffen (Aldosteron im männlichen Schweiß beeinflußt weiblichen Zyklus) beeinflußt.. 10. Der Geschmackssinn • Geschmacksqualitäten: Es gibt vier Geschmacksqualitäten. Diese werden durch bestimmte chemische Moleküle ausgelöst. Die vier Grundgeschmacksqualitäten sind süß (Zucker), sauer (Säure), salzig (Kochsalz) und bitter (Chinin). Des weiteren gibt es drei Nebenqualitäten, nämlich metallisch, alkalisch und der Umami-Geschmack. Für jede dieser Qualitäten gibt es eigene Sinneszellen auf der Zunge (metallisch und alkalisch wurden die Rezeptoren noch nicht gefunden!), wobei sie über die ganze Zunge, also nicht topographisch, verteilt sind. Lediglich Bittergeschmack hat eine große Häufung am Zungenhintergrund. Die Wahrnehmungsschwellen liegen für bittere und saure Stoffe besonders niedrig. • Gustatorische Sensorzellen: Die Sinneszellen für die Reizwahrnehmung sind zu Geschmacksknospen zusammengelagert. Diese wiederum finden sich in Pilz-, Blätter- oder Wallpapillen auf der Zunge. Darüber hinaus gibt es eine Papillen-Sorto, die für die Aufnahme von mechanischen Reizen (wichtiger Faktor in der 15 Geschmacksempfindung) zuständig ist. Die Papillen erneuern sich in etwa alle 10 Tage. Die Transduktion funktioniert bei Kontakt mit einem Geschmacksstoff je nach Geschmacksrichtung unterschiedlich: * sauer: direktes Kanalgating durch H+-Ionen (Bei Kontakt mit H+ schließt sich ein K+-Kanal und die Zelle wird depolarisiert.) * salzig: direktes Kanalgating durch Na+-Ionen (Bei salzigen Stoffen erhöht sich die Na+-Konzentration außerhalb der Zelle. Es strömt durch einen kationenpermeablen Kanal ein und depolarisiert die Zelle.) * bitter: direktes Kanalgating über Bitterstoffe (Ca2+-Kanal wird geöffnet) oder indirektes Kanalgating über Bitterrezeptoren und second messenger (der Rezeptor aktiviert ein G-Protein, dieses sorgt dafür dass über eine Kaskade IP3 gebildet wird, welches Ca2+-Lager in der Zelle öffnet, so dass sich die Ca2+-Konzentration in der Zelle erhöht); Ca2+ sorgt direkt für den Ausstoß von Transmittern * süß: indirektes Kanalgating über Süßrezeptoren (G-Protein sorgt über die AC für die Umwandlung von ATP in cAMP, dieses sorgt für die Öffnung von Ionen-Kanälen). * umami: direktes Kanalgating über Aminosäuren (Glutamat, Argingin,... öffnen Ca2+-Kanal) • Verschaltung der Nervenzellen: Jede Schmeckzelle ist für mehrere, oft alle Geschmacksqualitäten empfindlich. Da sie aber an unterschiedliche afferente Nervenfasern angebunden sind, ergibt sich für jede Nervenfaser ein bestimmtes Impulsmuster oder Geschmacksprofil, auf das sie reagiert. Die einzelnen Nervenfasern werden im Nucleus Tractus Solitari verschaltet und gelangen von hier entweder über die Pons in limbische System und den Hypothalamus (diese Bahn ist wichtig für die affektive Bewertung), oder über den Thalamus in die Insula und den Gyrus Postcentralis in der Hirnrinde. Bei der subjektiven Wahrnehmung spielt der Geruchseindruck auch eine sehr große Rolle (70 - 80 %). • Funktionen des Geschmachssinnes: * Prüfung der Nahrung auf unverdauliche oder giftige Stoffe * Steuerung der Sekretion der Verdauungsdrüsen * Funktion für instrumentelles Lernen 11. Rhythmik & Schlaf • Endogene Rhythmen: Endogene Oszillatoren sind angeborene Rhythmusgeber, die nur eine begrenzte Flexibilität durch Umweltreize aufweisen. Rhythmen mit einer Frequenz von 1/25 h kommen besonders häufig vor und werden zirkadiane Rhythmen genannt. Die Frequenz läßt sich durch Umweltreize in gewissen Größenordnungen verändern, so wird sie meist von Zeitgebern aus der Umwelt (z.B. Hell-DunkelRhythmus) syncronisiert, dass heißt ein endogener Rhythmus von 1/25 h wird durch Tag und Nacht auf 1/24 gebracht. Wird der endogene Rhythmus entkoppelt, fällt er wieder in seine ursprüngliche Frequenz zurück. Es gibt mehrere endogene Oszillatoren, die zum Teil untereinander oder mit dem Erfolgsorgan rückgekoppelt sind. • Der Nucleus Suprachiasmaticus (SCN): Der SCN ist der zentrale zirkadiane Schrittmacher und damit der wichtigste Oszillator. Er liegt in der Nähe der Thalamuskerne direkt über dem Chiasma Opticus und ist nur einige 10.000 Zellen groß. Er ist eng mit dem visuellen System verbunden und erhält so Licht-Dunkel-Informationen. Er wird von hellem Licht während des Schlafes im Dunkeln mitgenommen. Seine Zellen besitzen aber auch wenn er von allen anderen Strukturen abgeschnitten ist eine rhythmische Aktivität. Diese Aktivität wird durch zelluläre Proteine beeinflußt. Das Ticken der neuronalen Uhr wird dabei von einem angeborenen negativen Rückemeldekreis zweier Proteine (PER, TIM) im Zellkern gesteuert. Nach Läsionen des SCN ist die Zirkadianrhytmik aufgehoben. Er zwingt anderen Strukturen durch gepulste Freisetzung von Hormonen, sowie über rhythmische Entladungen seinen Rhythmus auf. Nachfolgend einige Beispiele: Projektionsfeld Basales Vorderhirn / Medialer Thalamus Paraventrikulärer Kern Präoptischer anteriorer Thalamus Tuberal-posteriorer Hypothalamus Funktion Autonome Regulation, Gedächtnis Melatonin-Ausschüttung, HypophysenNebennieren-Achse Themperatur-Regulation Schlaf-Wach-Zylen, GHAusschüttung • Melatonin: Das Hormon Melatonin wird von SCN kontrolliert und nur in der Dunkelheit ausgeschüttet. Es hat einen syncronisierenden Einfluß auf endogene Rhythmen und vermag eventuell auch entkoppelte Rhythmen wieder ein zu koppeln. Es zeigt sich, dass es durch die Ausschüttung von Melatonin außerdem zu einer von der Tageszeit abhänigigen Aktivierung unterschiedlicher zellulärer Signalwege kommt. • Genetischer Einfluß von auf endogene Rhythmen: 16 Es hat sich gezeigt, dass einen zwischen den Individuen unterschiedlichen Einfluß der Gendisposition auf die endogenen Rhythmen gibt. Bei Hamstern entscheidet z.B. die τ-Mutante, ob ein Durchlauf 20 der 24 Stunden dauert. So gibt es wohl bei jeder Spezies ein Kontrollgen für den Tagesrhythmus. • Stadien des Schlafes: Der Schlaf unterscheidet sich nur quantitativ von einer Bewußtlosigkeit oder dem Tod. Die Aktivität der Körpers wird dabei gesenkt, der Körper regeneriert sich. Über ein EEG (Messung der Hirnstörme) lassen sich die verschiedenen Grade des Wachseins (angespannt bis entspannt), sowie verschiedene Arten des Schlafes unterscheiden. Grundsätzlich gilt, um so syncronisierter die vom EEG abgeleiteten Stadien beim Schlaf sind, um so tiefer ist der Schlaf. Folgende Schlafstadien werden unterschieden: Schlafstadium Aktivität Vorstadium Übergang vom Wachsein zum Einschlafen Stadium I Einschlafen und leichter Schlaf Stadium II Leichter Schlaf Stadium III Mittlerer Schlaf Stadium IV Tiefschlaf REM-Schlaf „Traumschlaf“ (Rapid Gesamtschlafes Eye Movement), ca. 20 % des Im Schlaf wird die Ausführung motorischer Programme unterdrückt. Ist die nicht der Fall kommt es zum Schlafwandeln. Einen Sonderfall des Schlafen haben Delfine entwickelt: Sie schlafen nur jeweils mit einer Gehirnhälfte. • Der REM-Schlaf und Traum: In der Phase des REM-Schlafes läßt sich eine starke Bewegung der Augäpfel beobachten. Die nichtREM- wechseln sich mit den REM-Phasen ab, wobei diese im Verlauf des Schlafes immer länger werden, eine Phase dauert hierbei im Schnitt ca. 90 Minuten und wird Basic-Rest-Activity-Cycle (BRAC) genannt, da diese Wechsel zwischen Aktivierung und Ruhezustand wahrscheinlich auch im Wachzustand vorliegt. Der REM-Schlaf ist die Phase, in der der Mensch träumt. In dieser Phase treten auch die ponto-geniculooccipitalen Kortex-Wellen (PGOs) auf, die als visueller Eindruck während des Traumes gedeutet werden können. Während des REM-Schlafes kommt es zu einem verstärkten Aufbau neuronaler Strukturen, das Träumen steht also im Verdacht, für die Konsolidierung von Gedächtnisinhalten verantwortlich zu sein. • Schlafbedürfnis: Interindividuelle Unterschiede im Schlafbedürfnis sind genetisch determiniert. Schlaf ist physiologisch notwendig und bei Schlafentzug kommt es nach 3 Tagen zu Halluzinationen und nach 10 Tagen zur Bewußtlosigkeit. Es hat sich aber gezeigt, dass auch nach längerem Schlafentzug eine Schlafperiode für die vollständige Regeneration ausreicht. Physiologisch notwendig ist eine Schlafdauer von 3 - 4 Stunden pro Tag. Alles darüber wird als Füllschlaf bezeichnet. Seine Aufgabe ist unklar. Im Alter nimmt das allgemeine Schlafbedürfnis ab, ebenso ändert sich der relative Anteil des REMSchlafes. Während ein Säugling 13 - 16 Stunden pro Tag schläft, reichen im Alter 6 Stunden aus. Der relative REM-Schlaf-Anteil liegt bei Säuglingen bei ca. 45 % und pendelt sich ab einem Alter von etwa 5 Jahren auf um die 20% ein. • Neurobiologie des Schlafes: Es gibt im Gehirn des Menschen sogenannte Schlafzentren, die in den unterschiedlichen Wach- und Schlafzuständen dynamisch unterschiedliche Neuromodulatoren (ACH, Noradrenalin, Serotonin) ausschütten. Diese Schlafzentren liegen in der Pons, im Hypothalamus und im Thalamus. Im Thalamus fungieren die thalamocorticalen Neuronen als Interneurone, so dass er Oszillationen produziert, die für die Schlafrhythmik wichtig sind. Der Thalamus unterliegt aber auch einer Beeinflussung durch das Stammhirn. Als weiterer Zeitgeber hat der SCN einen großen Einfluß. 12. Lernen & Gedächtnis • Formen des Lernens: Form des Lernens Beziehungen zwischen Ereignissen 17 Bewertung Was wird gelernt? einfaches nicht assoziatives Lernen assoziatives Lernen höhere Formen assoziativen Lernens Habituation ein Stimulus wiederholt sich der Stimulus hat keine Bedeutung als Hinweissignal ein bestimmter Stimulus existiert, der bedeutungslos ist Sensitierung ein starker Stimulus erhöht allgemeine Reaktionsbereitschaft gerichtete Aufmerksamkeit; der Stimulus informiert über der allgemeinen Verhaltenskontext Nachwirkung wenig spezifischer Anregung in einem Verhaltenskontext klassische (Pavlov'sche) Konditionierung ein „neutraler Stimulus“ (CS) wird mit einem bedeutungsvollen (US) gepaart US als Belohner oder Bestrafer Assoziation zwischen CS und US operante (instrumentelle) Konditionierung eigene Aktionen führen zu bewertenden Stimuli ein Stimulus hat die Qualität eines Verstärkers (Belohner / Bestrafer) Hierarchie von Assoziationen im Verlauf von Appetenzverhalten treten neue Stimuli auf, auf die die Aufmerksamkeit gerichtet wird unbekannt (innerer Zustand des Beobachtens, Tuns, Übens) Hierarchie zwischen Stimuli und Appetenzverhalten Appetenzverhalten im sozialen Kontext, sensitive Entwicklungsphase unbekannt (Zusammenspiel zwischen Genen und Umwelt) Hierarchie zwischen Stimuli und Appetenzverhalten Konflikt in Appetenzverhalten unbekannt (innere Repräsentanz des angestrebten Zustands) Räumliche und logische Beziehungen zwischen Stimuli Orientierungslerrnen, beobachtendes Lernen, spielendes Lernen Prägungslernen einsichtiges Lernen • Verschaltung von Neuronen beim Lernen: HEBB hat herausgefunden, dass sich beim Lernen neue synaptische Verbindungen bilden, die Neurone, die beim Lernprozeß aktiviert werden, verbinden. Engramme (ein einem bestimmten Gedächtnisinhalt zugrunde liegender Prozeß) werden zunächst reverberatorisch gespeichert, das heißt, die Information zirkuliert erst einmal in einem oder mehreren Erregungskreisläufen (Zusammenschlüsse sind Zellensembles). Wird diese Zirkulation nicht gestört, kommt es zu einer Konsolidierung, was bedeutet, dass die aktivierten Verbindungen zwischen den Neuronen stärker werden, unter Umständen sogar neue Verbindungen geschaffen werden. Nach der Stabilisierung dieser Verbindungen reicht die Aktiverung eines der Neurone aus, um alle verknüpften zu aktivieren. Die Neurone sind assoziiert, der Gedächtnisinhalt ist gespeichert. • Zelluläre Korrelate des Lernens: Die Änderungen in den Nervenzellen beim Lernen läßt sich besonders leicht bei der Meerschnecke Aplysia nachvollziehen, da diese ein extrem einfaches Nervensystem hat, aber dennoch assoziatives und nicht assoziatives Lernen zeigt. Die Aplysia zeigt einen Reflex, dass sie bei einer Reizung ihres Saugrohres, die Kiemen einzieht. Dieser vorerst unkonditionierte Reflex habituiert, sensibilisiert und läßt sich klassisch über eine Reizung des Schwanzes als CS konditionieren. Bei der Habituation und Sensibilisierung wird die normale Signalkette von sensorischem Neuron des Saugrohrs zum Motoneuron des Kiemens durch hemmende und verstärkende Interneurone ergänzt. Es ist eine durch Abnahme des Ca2+-Stroms verursachte Ausschüttung von Transmittern des Sensorneurons an der Synapse des Motoneurons zu beobachten. Diese wird durch Serotonin (5-HT) bewirkt, das an einen geeigneten Rezeptor bindet und damit über ein G-Protein eine mehrstufige Kaskade (cAMP) auslöst. Bei der klassischen Konditionierung über eine Reizung des Schwanzen als CS bauen sich in den Signalweg von Sensorneuron des Saugrohrs und Motoneuron des Kiemens neue Verbindungen von den Sensorneuronen des Schwanzes ein, die über verstärkende Interneurone mit den Motoneuronen des Kiemens verbunden sind. Der klassischen Konditionierung der Aplysia liegt eine verstärkte Aktivierung vorhandener, aber stiller neuronaler Verbindungen zugrunde. Diese Veränderungen betreffen allerdings nur das Sensor- und nicht das Motoneuron. • Arten von Gedächtnisinhalten: Man unterscheidet zwei unterschiedliche Arten von Wissen: deklaratives (explizites Wissen) Fakten, Ereignisse prozedurales (implizites) Wissen Erwartungen, Fertigkeiten, Gewohnheiten, Konditionierung, nicht-assoziatives Lernen • Aufbau des Gedächtnisses: 18 Information Sensorisches Gedächtnis Dauer: < 1 s Kurzzeitgedächtnis Vergessen durch Verblassen Primäres Gedächtnis Dauer: Sekunden bis Minuten Vergessen durch neue Information Für das deklarative wissen wird ein Kurzzeit- oder Arbeitsgedächtnis unterschieden. Damit ein Gedächtnis-inhalt ins Langzeitgedächtnis vordringen kann, muß er konsolidiert werden, das heißt, solange wiederholt werden, bis eine kritische Schwelle zum Langzeit-gedächtnis überschritten ist. Für die Konsolidierung im Langzeitgedächtnis muß die Genexpression und Proteinbiosynthese (für Strukturproteine) aktiviert werden. Sekundäres Gedächtnis Dauer: Minuten bis Jahre Vergessen durch proaktive und retroaktive Interferenz Langzeitgedächtnis Tertiäres Gedächtnis Dauer: permanent • Der Hippocampus (Neuropsychologie der Konsolidierung): Der Hippocampus befindet sich im Temporallappen in der Nähe des limbischen Systems. Er bildet mit den ihn umgebenden cortikalen und subcortikalen Strukturen ein ausgedehntes System zur dynamischen assoziativen Verknüpfung von Erlebnisinhalten. Nach einem Ausfall dieses Systems ist der Patient nicht mehr fähig neues deklaratives Wissen aufzunehmen und wiederzugeben. Prozedurales Wissen und Wissen, dass vor dem Ausfall aufgenommen wurde, wird davon nicht beeinträchtigt. Der Verdacht liegt also Nahe, dass der Hippocampus für die Konsolidierung im Langzeitgedächtnis zuständig ist. Der Hippocampus bildet also das Tor ins Langzeitgedächtnis. Ist dieses zerstört, kann auf das alte Wissen zwar zugegriffen werden, neues Wissen jedoch wird nicht mehr gespeichert und verflüchtigt sich wieder. Der Hippocampus knüpft bei der Darbietung oder Wiederholung von Lernmaterial assoziative Verbindungen (zeitlich und örtlich), zu bereits gespeichertem Wissen. Sobald diese neuen Inhalte assoziativ verkettet sind, genügt zu einem späteren Zeitpunkt ein kleiner Ausschnitt, um den gesamten Inhalt zu aktivieren. • Langzeitpotenzierung (LTP) vs. Langzeitdepression (LDP): LTP und LTD sind mögliche physiologische Mechanismen für Speicherung und Vergessen, bzw. laterale Hemmung von Inhalten des Kurzzeitgedächtnisses. Für die Speicherung sind beiden LTPs zuständig, das Vergessen wird über LDPs gesteuert. Es kommen folgende Arten vor: Mechanismus Zelle A Zelle B Homosynaptische LTP Hochfrequente Reizung - Erhöhte Antwortfrequenz auf spätere Reize Assoziative LTP Hochfrequente Reizung Niederfrequente Reizung Verstärkung der Verbindung zwischen den Zellen Heterosynaptische LTD Hochfrequente Reizung - Abschwächung der Verbindung zwischen den Zellen Assoziative LTD Hochfrequente Reizung Niederfrequente, asyncrone Reizung Abschwächung der Verbindung zwischen den Zellen Niederfrequente Reizung - Abschwächung der Verbindung zwischen den Zellen Homosynaptische LTD Konsequenz Nach einer LTP ist eine Zelle also leichter zu „erreichen“, nach einer LDP schwerer. Der zelluläre Ablauf bei einer LTP ist wie folgt: Die Zelle wird durch die ankommenden Reize über die Aktivierungsschwelle für die Ca2+-Ionen gereizt, diese strömen ins Zellinnere, da eine Mg2+-Blockade die NMDA-Rezeptoren öffnet (Aktivierung von second messengern). 13. Somatosensorik • Mechanorezeption: Die Haut ist die Grundlage für die Mechanorezeption. An ihr lassen sich die vier Grundqualitäten der Mechanorezeption ableiten: Druck-, Berührungs-, Vibrations- und Kitzelempfindungen lassen sich von einander abgrenzen. VON FREY war der erste, der die Empfindungsschwellen für mechanische Hautreize untersuchte. Es zeigte sich, dass die Haut nicht auf ihrer ganzen Fläche, sondern nur punktförmig (Tastpunkte) mechanosensibel ist. Das räumliche Auflösungsvermögen läßt sich mit einem Tastzirkel bestimmen. Es 19 ist an den Fingerkuppen und an der Zunge besonders hoch (unter 10 mm) und an Oberschenkel, Oberarmen und am Rücken sehr niedrig (bis 70 mm). Eine Prüfung der Empfindungschwellen ergab, das sich mit Eindellung der Haut ab 0,01 mm Berührungsempfindungen auslösen lassen. Es können bereits einzelne Impulse zu einer bewussten Empfindung führen. Die Intensitätfunktion der Mechanosensibilität (Als wie stark wird der Reiz empfunden?) unterliegt großen interindividuellen Schwankungen. Die Schwelle für die Wahrnehmung von Vibrationen liegt bei 150 - 300 Hz. Es gibt insgesamt sechs verschiedene Arten von Mechanosensoren in der Haut, wobei behaarte sich teilweise von unbehaarter Haut unterscheidet. Nachfolgend ein Überblick: Sensortyp Adaption Schicht (Nr.) unbeh. beh. Empfindlich für... Pacini-Körper sehr schnell Subkutis (3) X X Beschleunigung eines Druckreizes (Vibration) Meissner-Körper mittelschnel l Korium (2) X - Geschwindigkeit eines Druckreizes (Berührung) Haarfollikel-Rezeptor mittelschnel l Korium (2), Epidermis (1) - X Geschwindigkeit eines Druckreizes (Berührung) Ruffini-Körper langsam Korium (2) X X Intensität eine Druckreizes (Druck) Merkel-Zelle langsam Korium (2) X - Intensität eine Druckreizes (Druck) Tastscheibe langsam Epidermis (1) - X Intensität eine Druckreizes (Druck) Alle Mechanosensoren sind mit schnellen A-Fasern (~ 55 m/s) verbunden und in rezeptiven Feldern organisiert. Die Kitzelempfindung rührt wahrscheinlich von mechanosensiblen freien Nervenendigungen der Haut her. • Thermorezeption: Die Thermorezeptoren sind ebenfalls (ungleichmäßig) in der Haut angesiedelt. Für die beiden Qualitäten Kälte- und Wärmesinn finden sich jeweils eigene Rezeptoren. Diese adaptieren bei konstanter Hauttemperatur vollständig in der sogenannten Indifferenzone (31 - 36°C). Darüber und darunter kommt es zu dauernden Warm-, bzw. Kaltempfindungen. Die Entladungsfrequenz der Wärme- und Kältesensoren folgt charakteristischen Kurven mit ihren Maxima bei ca. 26°C, bzw. 44°C. Die Warm-, bzw. Kaltschwellen sind von der Ausgangsthemperatur der Haut abhängig. Bei kalter Haut dauert es länger, bis es bei einer Erwärmung zu einer Wärmempfindung kommt (erst Zwischenschritt: weniger kalt), und umgekehrt. Durch Menthol kann eine künstliche Kälteempfindung durch Reizung der entsprechenden Rezeptoren geschaffen werden. • Viszerozeption: In den Eingeweidenerven sind 30 - 90 % der Nervenfasern afferent. Die von ihren Sensoren stammende Information wird für die homöostatische Kontrolle des inneren Millieus genutzt. Folgende Tabelle gibt einen Überblick über die einzelnen Sensoren: Gebiet Organisches Korrelat Sensoren Kardiovaskuläres System Herz, Blutgefäße Mechanosensoren Blutdruck Kontrollfunktion Mechanosensoren Rhythmischen Aktivität Pulmonales System Gastro-intestinales System Renales System Lunge Magen, Darm Harnleiter, Harnblase Chemosensoren Sauer- & Kohlenstoff-Niveau Nozizeptoren Ausstoß schädlicher Stoffe (durch Husten) Mechanosensoren Nahrungsaufnahme, Ausscheidung Thermosensoren Temperatur Mechanosensoren Füllung der Harnblase Nozizeptoren Pathologische Veränderungen • Propriozeption: Über die Propriozeption oder Tiefensensibilität nehmen wir ständig folgendes wahr: Qualität Wahrnehmung Sensoren Stellungssinn Stellung der Glieder zueinander Muskelsensoren, Gelenksensoren Bewegungssinn Richtung und Geschwindigkeit einer Bewegung Gelenksensoren, Hautsensoren Kraftsinn Ausmaß der für eine Bewegung notwenigen Muskelkraft, Widerstand Muskelsensoren 20 Hierfür stehen drei verschiedene Arten an Sensoren zu Verfügung: Sensor Beschreibung Gelenksensor Ähnliche Zusammensetzung wie Hautsensoren (unterschiedliche Fasern mit 1 - 55 m/s Übertragung Geschwindigkeit) Muskelsensor Umschlingen die Muskelspindeln und messen die Länge des Muskels, Sehnenorgane messen seine Dehnung Hautsensor Vermittelt über Dehnung und Stauchung der Haut, spielen nur kleine Rolle • Zentrale Verarbeitung: Die anfallenden Daten werden zum Rückenmark weitergegeben. Dies gibt die Daten wie folgt an höhere Kerne weiter: Ort Sinn Hinterstrang Mechanorezeption, Thermorezeption Vorderseitenstrang Thermorezeption, Schmerz, Viszerozeption Über den Hirnstamm und den Thalamus gelangen die Daten aus der Somatosensorik in den primären somatosensorischen Kortex. Dieser sitzt im Gyrus Postcentralis. Hier werden die Daten topographisch, wenn auch mit Verzerrungen (z.B. nimmt die Verarbeitung der Daten aus den Händen mehr Platz in Anspruch als die der Daten aus dem Rumpf) verarbeitet. • Integration verschiedener Sinne: Konstrukt Sinne Räumliche Tastwelt Propriozeption + Mechanorezeption + Thermorezeption Stellung im Raum, Körperschema Propriozeption + Gleichgewichtssinn 14. Schmerz • Einführung: Schmerz hat eine wichtige Funktion für den Körper. Seine Sensoren haben eine so hohe Schwelle, dass sie durch gewebsschädigende und bedrohende Reize erregt werden. Sie dienen dann Antrieb für Vermeidungsreaktionen. Es gibt in Einzelfällen Menschen, die keinen Schmerz empfinden, diese haben aber durch den Wegfall dieser Schutzfunktion keine hohe Lebenserwartung. Der Fachbegriff von Schmerzempfindung ist Nozizeption (lat. noxa = der Schaden). Nozizeptoren, die Sensoren der Schmerzempfindung, sind einzigartige Sensoren mit eigenen Bahnen, die eine eigene Sinnesempfindung auslösen. • Komponenten des Schmerzes: 21 Sensorisch-diskriminante Komponente (sensorische Sinnesempfindung über Lokalisation und Dauer) Kognitive Komponente Affektive (emotionale) Komponente noxischer Reiz Aufnahme, Weiterleitung und Verarbeitung (Schmerzbewertung) (Auslösung lust- oder unlustbetonter Gefühle abhängig von Ausgangslage und Umständen) Vegetative, autonome Komponente (Reflektorische Reaktionen über das VNS, z.B. Schweißausburch, Übelkeit,...) Psycho-motorische Komponente (Schmerzbewertung) Motorische Komponente (Resultierende Bewegungen, Muskelverspannungen) • Arten des Schmerzes: Oberflächenschmerz 1. Schmerz Somatischer Schmerz Haut 2. Schmerz Muskeln, Knochen, Gelenke, Bindegewebe Tiefenschmerz Viszeraler Schmerz Innere Organe Neuropathischer Schmerz Ganzer Körper Psychogener Schmerz Psyche • Eigenschaften des Schmerzes: Die Bewertung eines Schmerzes hängt stark damit zusammen, ob und mit welchen Konsequenzen der Schmerz schon einmal auftrat (Schmerzgedächtnis). Es ist keine Adaption zu beobachten. • Nozizeptoren: Die bisher gefundenen Nozizeptoren sind polymodal, das heißt, die reagieren auf unterschiedliche Reize. In der Haut wurden zum Beispiel Nozizeptoren gefunden, die auf mechanische (z.B. Nadelstich, Quetschen), thermische (Hitze, Kälte) und chemische Reize (z.B. Bradykinin, Prostaglandin) reagieren. Sie liegen als nicht-korpuskuläre, freie Nervenendigungen in der Haut oder viszeral vor. Nozizeptoren können durch intensive Reize direkt erregt werden, oder über eine Kette von Zell- und Gewebsreaktionen, an deren Ende die Ausschüttung von einem oder mehreren Stoffen (Noxen) steht, die den Nozizeptor erregen. Die Erregbarkeitsschwelle eines Nozizeptors ist flexibel, sie können z.B. bei Entzündungen sensibilisiert (Senkung der Schwelle) oder desensibilisert werden (Anhebung der Schwelle). Die Sensor- und Generatorpotentiale sind zu fein für die heutige Meßtechnik, es können aber Aktionspotentiale in den angeschlossenen Nerven gemessen werden. • Nervenfasern: Je nach Art des Schmerzes wird er in verschiedenen Nervenfasern weitergeleitet: Fasertyp Myelinisierun g Durchmesser Leitungsgeschwindigkeit Art des Reizes Transmitter Art des Schmerzes Aδ X ~ 4,0 µm ~ 21 m/s mechano- & thermosensitiv Glutamat schneller „stechender Schmerz“ C - ~ 0,8 µm < 2 m/s mechano-, chemo& thermosensitiv Glutamat, Substanz P, Peptide langsamer, dumpfer Schmerz Beim Oberflächenschmerz läßt sich so der sogenannte 1. und der 2. Schmerz erklären: Der 1. Schmerz besteht aus den Aktionspotentialen der erregten Propriozeptoren und denen aus den Nozizeptoren mit Aδ-Faser-Anschluß und wird sehr schnell übertragen. Der 2. Schmerz kommt aus den Nozizeptoren mit C-Faser-Anschluß und kommt wegen seiner langsameren Weiterleitung merklich später an. Viele Nozizeptoren sind sind hochschwellig mechanosensitiv, das heißt, bei leichtem Druck reagieren nur die Propriozeptoren, bei z.B. einem Nadelstich reagieren auch die Nozizeptoren. • Weiterleitung des Schmerzes: Die Weiterleitung von Schmerzen (Schmerzmediation) erfolgt über eine Vielzahl zellulärer Prozesse. Auf dem Weg zum Rückenmark sind Ateriolen („Calcitonin-gene related peptide“, NO), Venolen (Substanz P, Neurokinin A), Mastzellen (Histamin, 5-HT), Immunzellen (Bradykinin) und Neuronale Endigungen 22 • • • • (Prostaglandin E2) beteiligt. Die nozizeptiven Afferenzen gelangen über das Hinterhorn in Rückenmark. Dort werden sie direkt auf Neurone geschaltet, die in motorische oder vegetative Reflexe eingebunden sind, und / oder über den Hirnstamm in den Thalamus und von dort in den Kortex weitergeleitet. Regulation des Schmerzes: * Afferenze Regulation (Schmerztheorie von MALZACK und W ALL): Diese auch Gate-Control-Theorie genannte Annahme postuliert, dass die den Schmerz projizierenden Hinterhornneurone (Projektionsneurone) durch dicke nicht-nozizeptive Afferenzen gehemmt (Gate closed) und durch dünne nicht-nozizeptive Afferenzen aktiviert (Gate open) würden. Dies wurde allerdings nie bewiesen und teilweise sogar widerlegt. * Efferente Regulation: Auf absteigenden Bahnen kommen Efferenzen aus dem Kortex oder dem PAG (Periaquäduktales Grau), die die Interneurone bei der Weiterleitung der Schmerzreize im Rückenmark hemmen können und für eine langsamere Entladung der Schmerzzellen sorgen. Schmerzprojektionen: Akute oder chronische Aktivierung von Axonen afferenter nozizeptorischer Nervenfasern kann zu projizierten oder neuralgischem Schmerz führen. Projizierter Schmerz taucht auf, wenn zum Beispiel eine Nervenbahn gereizt wird, das Gehirn aber als Ort der Reizung das Ende der Nervenbahn annimmt (z.B. Schlag auf Ellbogen folgt Kribbeln im kleinen Finger). Neuralgischer Schmerz wird durch Schädigung von Nervenendigungen durch fortgesetzte Reizung verursacht. Hierbei kommt es zu spontanen Schmerzen an anderen Stellen. Noxische Reizung der inneren Organe wird häufig nicht nur dort als Schmerz empfunden, sondern auch als übertragener Schmerz an zugeordneten Gebieten der Haut (Head-Zonen). Bei einem Herzinfakt z.B schmerzt der Arm. Pathophysiologische Schmerzempfindung: * Hypoalgesie, Analgesie, Anästhesie: Verringerte oder fehlende Schmerzempfindlichkeit (z.B. durch fehlende Neurone) * Hyperalgesie, Hyperästhesie: Erhöhte Schmerzempfindlichkeit (durch Sensibilisierung der Afferenzen oder zentraler Neurone), bzw. Berührungsempfindlichkeit * Allodynie: Schmerzauslösung durch nicht-noxische Reize bei Verletzungen und Entzündungen (z.B. Berühung bei Sonnenbrand) Schmerztherapie: Es gibt die Möglichkeit einer kausalen Therapie (Ursache wird bekämpft) und einer sympthomatischen Therapie (Weiterleitung wird gehemmt). Dies kann durch Opioide, Analgethika oder auch physikalische Methoden wie Vereisung geschehen. 15. Motorik • Aufbau der Skelettmuskulatur: Die Skelettmuskulatur (quergestreifte Muskulatur) besteht aus einzelnen Muskeln, die über Sehnen mit dem Skelett verbunden sind. Ein Muskel besteht aus vielen Fasern, die sich über die ganze Länge des Muskels erstrecken. Die Muskelfasern bestehen aus Muskelzellen und zu 10% aus Myofibrillen - und Aktinfilamenten. Die Myofibrillen sind Eiweißstrukturen und bestehen aus Myosin-Molekülen. Diese sind zu mehreren zusammengelagert und mit Aktinfilamenten verbunden. Bei einer Erregung kontrahieren sich die Myosfibrillen und bilden damit die Minimotoren des Skeletts. Der Verbund von mehreren Aktinfilamenten mit mehren Myosin-Molekülen wird Sakomer genannt und ist die kleinste Betriebseinheit des Muskels. Es gibt drei unterschiedliche Typen von Muskelfasern: Fasertyp Slow (S) Fatigue Resitant (FR) Fast Fatigable (FF) Geschwindigkei t langsam mittelschnell schnell Farbe rot rot blass Stoffwechsel aerob gemischt aerob / anaerob anaerob Ermüdbarkeit schwer schwer schnell Aufgabe Rumpfmuskulatur Rumpfmuskulatur ballistische Bewegungen • Motoneurone: Es werden über ein Motoneuron immer mehrere bis viele Muskelfasern innerviert. Die Erregung wird vom Motoneuron über eine spezielle Synapse, motorische Endplatte genannt, auf die Muskelfaser übertragen. 23 Bei einer Erregung werden im Inneren der Muskelzelle gespeicherte Ca2+-Ionen freigegeben, dadurch wird ATP in ADP umgebaut und mit der freiwerdenden Energie die Kontraktion durchgeführt. Die Regeneratin des ATP erfolgt entweder aerob (unter Sauerstoffverbrauch) oder für kurzfristige Höchstleistungen anaerob (unter Verbrauch von Glukose). Es gibt zwei verschiedene Arten Motoneurone: Typ α-Motoneurone γ-Motoneurone Lage außerhalb von Muskelspindeln (extrafusal) innerhalb von Muskelspindeln (intrafusal) Durchmesser 15 µm 5 µm Leitungsgeschwindigkeit 100 m/s 20 m/s Unter einer motorischen Einheit versteht man alle Muskelfasern, die von einem Axon innerviert werden. Da sich die Muskelfaser nur zusammen ziehen können, selbstständig aber nicht mehr in die normale Position kommen, findet sich meist ein zweiter Muskel als Gegenspieler (z.B. Bizeps vs. Trizeps). Die Bewegungen der Skelettmuskulatur werden über das somatische motorische System möglich gemacht, also einer Kombination aus Motoneuronen und Skelettmuskulatur. • Verschaltung im Rückenmark, Reflexe: Die α-Motoneurone haben ihren Ursprung im Vorderhorn des Rückenmarks und verlassen dieses über die Vorderwurzel. Auf der Ebene des Rückenmarks funktionieren auch die vielen Reflexe des motorischen Systems. Eine Reflexkette hat dabei immer die gleichen fünf Elemente: Sensor Afferenz zentrales Neuron Effektor Efferenz Die Afferenzen werden im motorischen System über Ia-Fasern übertragen, die Efferenzen über α-Fasern. Man unterscheidet Eigenreflexe (die Afferenzen kommen aus dem selben Muskel) und Fremdreflexe (Afferenzen auf anderem Muskel). Häufig sind Agonist und Antagonist reflektorisch gekoppelt, so dass sich immer nur einer von beiden kontrahieren kann. Nachfolgend soll auf einige Reflexe eingegangen werden: * Monosynaptischer Dehungsreflex: Wird eine Muskelspindel von außerhalb gedehnt, sendet sie ein Signal ins Rückenmark, das wiederum über efferente Fasern den Muskel kontrahiert, um so die Dehnung wieder auszugleichen. Wenn wir zum Beispiel etwas tragen, wird über diesen Reflex die Konstanthaltung der Muskellänge gewährleistet. Ein weiteres Beispiel ist der Kniesehnenreflex. Sein Name ist irreführend, da die Sehne nur eine passive Funktion bei der Dehnung des angebundenen Muskels übernimmt. Er wird daher auch T-Reflex genannt. Der Kniesehnenreflex taucht auf, wenn man einen mechanischen Reiz auf die Stelle unter der Kniescheibe (also auf die Kniesehne) ausübt. Die für die Streckung des Beines verantwortliche Muskelpartie wird dadurch gedehnt und mit kleiner Verzögerung reflektorisch erregt und kontrahiert. Dieser Reflex soll vor Stolpern bewahren. * γ-Scheife: Man unterscheidet infusale (γ, in der Muskelspindel gelegen) und extrafusale (α, außerhalb der Muskelspindel gelegen) Motoneuronen. Diese sind über die γ-Schleife verbunden. Werden die intrafusalen Neurone kontrahiert, sorgt diese dafür, dass sich auch die extrafusale Muskulatur kontrahiert. Es handelt sich dabei also um einen Folge-Servomechanismus, der der Unterstützung der Bewegung dient. * Gekreuzter Streckreflex: Dieser Reflex betrifft die Beine. Wird ein Bein abgeknickt, versteift sich das andere, was größe Bedeutung für die Geh- und Stehmotorik hat. Verschiedene Teile des Rückenmarks innervieren verschiedene Muskelgruppen: 24 zervikal Arme thoracal Rumpf lumbal sakral Beine Es zeigt sich, dass diese Regionen zum Teil über eigene automatische Programme verfügen, die auch bei durchtrenntem Rückenmark noch funktionieren. In diesem Fall ist aber keine Koordination untereinander mehr möglich. • Bewegungstypen: Typ Haltungs- und Stützmotorik (Reflexe) Automatisierte, rhythmische Bewegungen Willkürmotorik Aufgabe Körperhaltung, Gleichgewicht Atmung, Mimik, Gehen, Laufen z.B. Feingriff Die Muskulatur kann dabei tonisch (ständig) oder phasisch (zeitlich abgestimmt) aktiviert sein. • Gehen: Wie bereits erwähnt ist der gekreuzte Steckreflex sehr wichtig für das Gehen, aber nur ein Teil. Durch posturale Synergien (Kette von muskulären Reaktionen in Rumpf- und Beinmuskulatur) wird das Gleichgewicht gehalten. Dies erfolgt reflektorisch. Auf spinaler Ebene gibt es zusätzlich Rhythmusgeneratoren, die die zeitliche Abfolge der Bewegungen koordinieren. Diese werden allerdings von supraspinalen Bereichen kontrolliert. • Ablauf von Willkürbewegungen: Damit eine willkürliche Bewegung stattfinden kann, erfordert es die folgenden Schritte: Entschluß Programmierung Durchführung Handlungsantrieb, Entwicklung einer Strategie Erstellung eines Bewegungsprogramms Selektion von Neronensystemen, Bewegung Assoziationskortex,kortikale und subkortikale Motivationsareale Cerebellum, Basalganglien, Motorkortex Stammhirn, Rückenmark, Motorkortex Sensorik Bis auf bei schnellen, ballistischen Bewegungen spielt die Sensorik eine große Rolle. Bei gezielten Willkürbewegungen wie dem z.B. dem Zielgriff sind eine Vielzahl von kleinen Bewegungen (z.B. Armbewegung, Öffnung der Hand) in ihrer Geschwindigkeit, Beschleunigung und Abfolge zu koordinieren. Die Einstellung dieser Parameter erfolgt proaktiv (auf Grund des sensomotorischen Gedächtnisses). • Überblick supraspinale Verarbeitung: Hirnstamm Ort Aufgabe Medulla Oblangata, Pons, Mesencephalon Unwillkürliche Kontrolle der Körperstellung im Raum Mediales System retikulär vestibulär Haltungskontrolle Gleichgewicht Automatisierte Bewegungen (Atmung, Mimik, Gleichgewicht, Gehen, Laufen) Basalganglien Nucleus Caudatus, Putamen, Globus Pallidus, Nucleus Subthalamicus, Substantia Nigra Motorische Schaltstation, Selektion und Initiation von Willkürbewegungen, Umsetzen des Bewegungsprogram ms in Impulsmuster • Verschaltung über das Cerebellum: 25 Motorkortex Cerebellum Koordination von Haltung mit Bewegung, motorisches Lernen Primärer Motorkortex vor allem im Gyrus Praecentralis (topographisch organisiert) Erstellung von komplexen Bewegungsprogram men, Kontrolle Feinmotorischer Bewegungen Alle Efferenzen vom und Afferenzen zu höheren motorischen Zentren senden eine Efferenzkopie, bzw, Afferenzkopie zum Cerebelllum. Dieses gleicht beide ab und meldet etwaige Differenzen als Fehler in den Kortex. 50% aller Nervenzellen liegen im Zerebellum. GABA ist ein sehr wichtiger Transmitter innerhalb des Cerebellums. • Pathologische Veränderungen: * Periphere Nervendurchtrennungen: Diese führen zu schlaffen Lähmungen. * Parkinson: Verursacht durch Läsionen in den Basalganglien, genauer Degenerationen dopaminerger Neurone in der Substantia Nigra). Es kommt zu einem Dopamin-Mangel in den motorischen Zentren. Der Patient leidet unter Rigor (erhöhter Muskeltonus, „wächserner Widerstand“), Akinese (motorische Gebundenheit) und Tremor (Zittern, aber nicht während Zielbewegungen). 16. Hunger & Durst • Überblick Durst: Wassermangel (Verluste durch Harn, Schweiß, Atemluftfeuchtigkeit) Zelluläre Austrockung Hypervolämie Weniger Speichelsekretion (Abnahme des Blutvolumens) Volumensenoren Sensoren für Druck- und Volumensänderungen (in Herznähe) (in der Niere) Renin-Ausschüttung (aus der Niere) Osmosensoren (im Hypothalamus und im 3. Ventrikel) Angiotensin II-Bildung (im Gefäßsystem) ADHAschüttung Zentralnervöse Erregung (aus Hypophysenvorderlappen) Subfornicalorgan (im 3. Ventrikel) Hypothalamus Durst Bei Durst gibt der Hypothalamus das Hormon Vasopressin frei. Dieses sorgt dafür, dass kein Wasser mehr von der Niere abgegeben wird. Trinkt man, verschwindet der Durst antizipatorisch, also bevor das Wasser den Sollwert im Gewebe erreicht hat (dies dauert eine Weile). Normalerweise sollten die Zellen in einer isotonischen (gleiche Konzentration an osmotisch aktiven Teilchen) Lösung eingebettet sein. Bei Wasserentzug wird die Extrazellulärflüssigkeit hypertonisch (außen höhere Teilchenkonzentration). Dies führt zu einem osmotischen Druck, der Wasser aus den Zellen zieht. Wird nun Wasser zugegeben, wird die Extrazellulärflüssigkeit hypotonisch (niedrigere Teilchenkonzentration) und durch einen erneuten osmotischen Druck, allerdings mit umgekehrter Richtung, wird das Wasser wieder in die Zellen gedrückt. • Überblick Hunger: Hunger wird primär durch abnehmende Verfügbarkeit von Glukose ausgelöst. Die Verfügbarkeit wird durch Glukosesensoren in Hypothalamus, Hirnstamm und Leber überprüft. Entdecken diese eine zu große Abweichung vom Sollwert (die Produktion, nicht die Konzentration werden gemessen), schicken sie ein Signal über den Nervus Vagus ans Gehirn. Der Hypothalamus ist die oberste Schalt- und Integrationsstruktur für Hunger und Sättigung. Läsionen im dortigen „Eßzentrum“ (hier sorgt Neropedtid Y zur Nahrungsaufnahme) führen zu Appetittverlust, im „Sattigungszentrum“ (5-HT wirkt hier als Appetitzügler) zu Heißhunger. Wird über die Sättigung hinaus Nahrung aufgenommen, wird die überschüssige Energie in Fettdepots gespeichert. Diese Depots können dann bei Bedarf wieder Energie abgeben. Auf beim Hunger tritt schon während der Nahrungsaufnahme antizipatorisch eine Sättigung ein, obwohl die Sollwerte im Körper noch nicht erreicht worden sind: 26 Hunger Nahrungsaufnahme präresorptiv Kaubewegungen Sensoren (Nase, Mund,Rachen & Speisröhre) Mechanosensoren (Magen) Chemosensoren (Magen-Darm-Trakt) Zentrale Gluko-, Thermo- & LipoSensoren resorptiv Zentrale Informationsverarbeitung (vor allem im Hypothalamus) Gefühl der Sattheit Das Neuropeptid Choletysttokinin (CCK) führt bei Gabe durch Stimulation von CCK-Rezeptoren im Thalamus zur Sättigung. Darüber hinaus reduziert auch Leptin die Nahrungsaufnahme. Es gibt Mäusearten, denen das für die Leptin-Produktion zuständige OB-Gen fehlt und damit zur Obesitas (Fettsucht) neigen. 27