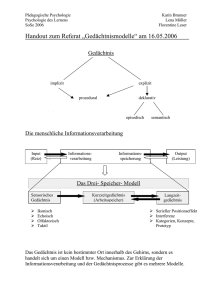
Einfluss der intravenösen Hochdosiskortisontherapie bei der
Werbung

Universitätsklinikum Ulm Klinik für Neurologie Prof. Dr. med. A. C. Ludolph Einfluss der intravenösen Hochdosiskortisontherapie bei der Multiplen Sklerose auf neuropsychologische Funktionsparameter Dissertation zur Erlangung des Doktorgrades der Medizin der Medizinischen Fakultät der Universität Ulm vorgelegt von Sabine Müller geb. in Backnang 2012 Amtierender Dekan: Prof. Dr. rer. nat. T. Wirth 1. Berichterstatter: Prof. Dr. med. H. Tumani 2. Berichterstatter: Prof. Dr. med. H. Gündel Tag der Promotion: 12.12.2013 I Inhaltsverzeichnis Inhaltsverzeichnis…………………………………………………………………… I Abkürzungsverzeichnis……………………………………………………………. III 1. Einleitung………………………………………………………………………….. 1 1.1. Einführung in die Fragestellung…………………………………………….. 1 1.2. Multiple Sklerose………………………………………………………………. 2 1.2.1. Epidemiologie, Ätiologie, Pathophysiologie………………………………… 2 1.2.2. Klinik……………………………………………………………………………. 4 1.2.3. Krankheitsverlauf und Prognose…………………………………………….. 7 1.2.4. Differentialdiagnostische Überlegungen und Diagnosesicherung……….. 8 1.2.5. Therapie………………………………………………………………………… 12 1.2.5.1. Verlaufsmodifizierende und symptomatische Therapie………………… 12 1.2.5.2. Behandlung eines akuten Schubes mit Glukokortikoiden……………… 13 1.3. Auswirkungen von Glukokortikoiden auf die kognitiven Leistungen .. 14 1.3.1. Mechanismus und Ausmaß der Beeinflussung kognitiver Funktion durch Glukokortikoide……………………………………………………………….. 15 1.3.1.1. Einfluss endogener Glukokortikoide auf die Kognition……………………16 1.3.1.2. Einfluss exogener Glukokortikoide auf die Kognition…………………… 17 1.4. Gedächtnis aus neuropsychologischer Sicht…..................................... 1.4.1. Gedächtnis als zeitabhängiger Prozess……………………………………. 1.4.2. Gedächtnis als inhaltsabhängiger Prozess………………………………… 1.4.2.1. Das deklarative Gedächtnis……………………………………………….. 1.4.3. Neuroanatomie des Gedächtnisses………………………………………… 1.4.4. Der Hippokampus…………………………………………………………….. 1.4.5. Synaptischer Speichermechanismus für das deklarative Gedächtnis ….. 18 18 19 19 20 21 22 1.5. Zusammenfassung und Fragestellungen…………………………………. 23 2. Material und Methodik…………………………………………………………… 25 2.1. Studiendesign…………………………………………………………………… 25 2.2. Stichprobe………………………………………………………………………. 26 2.3. Versuchsablauf………………………………………………………………… 2.3.1. Erfassung der Aufmerksamkeit und Verarbeitungsgeschwindigkeit…….. 2.3.2. Untersuchung des Gedächtnisses………………………………………….. 2.3.2.1. Arbeitsgedächtnis…………………………………………………………… 2.3.2.2. Deklaratives Gedächtnis…………………………………………………… 2.3.2.3. Implizites Gedächtnis………………………………………………………. 2.3.3. Untersuchung der exekutiven Funktionen………………………………….. 2.3.4. Allgemeine kognitive Leistungsfähigkeit……………………………………. 2.3.5. Selbstbeurteilungsskalen…………………………………………………….. 27 28 30 30 31 33 33 34 35 2.4. Statistische Datenanalyse……………………………………………………. 39 II 3. Ergebnisse..................................................................................................... 39 3.1. Soziodemographische Daten………………………………………………… 39 3.2. Klinische Daten der beiden Patientengruppen…………………………… 40 3.3. Leistung der Patienten und Kontrollen zum Zeitpunkt 0……………….. 41 3.3.1. Arbeitsgedächtnis……………………………………………………………… 41 3.3.2. Deklaratives Gedächtnis……………………………………………………… 42 3.3.3. Implizites Gedächtnis…………………………………………………………. 43 3.3.4. Exekutive Funktionen…………………………………………………………. 44 3.3.5. Aufmerksamkeit…………………………………………………………………44 3.3.6. Depression, Euphorie, Ängste, Gedächtnisleistungen im Alltag…………. 45 3.3.7. Allgemeine Intelligenz………………………………………………………… 46 3.4. Kognitive Leistungen der Kontrollpersonen im Verlauf………………… 47 3.4.1. Arbeitsgedächtnis…………………………………………………………….. 47 3.4.2. Deklaratives Gedächtnis……………………………………………………… 48 3.4.3. Implizites Gedächtnis…………………………………………………………. 49 3.4.4. Exekutive Funktionen…………………………………………………………. 50 3.4.5. Aufmerksamkeit……………………………………………………………….. 50 3.4.6.Depression, Euphorie, Ängste, Gedächtnisleistungen im Alltag…………. 51 3.5. Auswirkungen der Methylprednisolonbehandlung auf die kognitiven Leistungen der Patienten………………………………………………………….. 3.5.1. Ergebnisse der Patienten zu den drei Untersuchungszeitpunkten… 3.5.1.1. Arbeitsgedächtnis…………………………………………………………… 3.5.1.2. Deklaratives Gedächtnis…………………………………………………… 3.5.1.3. Implizites Gedächtnis……………………………………………………… 3.5.1.4. Exekutive Funktionen………………………………………………………. 3.5.1.5.Aufmerksamkeit…………………………………………………………….. 3.5.1.6. Depression, Euphorie, Ängste, Gedächtnisleistungen im Alltag………. 53 53 53 54 56 56 57 58 3.5.2. Dosiseffekt………………………………………………………………………60 3.5.2.1. Arbeitsgedächtnis…………………………………………………………… 60 3.5.2.2. Deklaratives Gedächtnis…………………………………………………… 61 3.5.2.3. Implizites Gedächtnis…………………………………………………………63 3.5.2.4. Exekutive Funktionen…………………………………………………………63 3.5.2.5. Aufmerksamkeit……………………………………………………………… 64 3.5.2.6.Depression, Euphorie, Ängste, Gedächtnisleistungen im Alltag…………66 3.5.3. Interaktion zwischen „Dosis“ und „Untersuchungszeitpunkt“…….. 67 3.6. Zusammenfassung der zentralen Ergebnisse……………………………. 68 4. Diskussion………………………………………………………………………… 69 5. Zusammenfassung………………………………………………………………. 75 6. Literaturverzeichnis……………………………………………………………… 77 III Abkürzungsverzeichnis MS Multiple Sklerose ZNS Zentrales Nervensystem N Nervus INO Internukleäre Ophtalmoplegie OKB Oligoklonale Banden CIS clinically isolated syndrome MRT Magnetresonanztomographie GK Glukokortikoide RRMS relapsing-remitting MS SPMS secondary-progressive MS PPMS primary-progressive MS HHN Hypothalamus-Hypophysen-Nebennierenrindenachse PTSD Posttraumatische Belastungsstörung LPT Langzeitpotenzierung NMDA N-Methyl-D-Aspartat EDSS Expanded Disability Status Scale VEP Visuell evozierte Potientiale MP Methylprednisolon HAWIE-R Hamburg-Wechsler-Intelligenztest für Erwachsene MVGT Münchner Verbaler Gedächtnistest PAL Paarassoziationslerntest MT Mosaiktest BDI Beck-Depressions-Inventar M Arithmetischer Mittelwert SD Standardabweichung IV 1. Einleitung 1.1. Einführung in die Fragestellung Die Multiple Sklerose (MS) ist eine chronisch-entzündliche Erkrankung des zentralen Nervensystems (ZNS), deren Symptomatik und Verlauf höchst variabel und im Einzelfall nur schwer vorhersagbar sind. Die Betroffenen leiden - je nach Dauer und Schwere der Erkrankung - an einzelnen neurologischen Symptomen bis hin zu schwerwiegenden, zu dauerhafter Behinderung führenden Beeinträchtigungen. Die Symptomatik beschränkt sich nicht nur auf körperliche, sondern beinhaltet auch kognitive Einschränkungen. Als Mittel der Wahl für die Behandlung eines akuten Schubes einer MS gilt die Verabreichung von hochdosierten, intravenösen Glukokortikoiden. Aktuell wird die intravenöse Verabreichung von 500-1000 mg Methylprednisolon täglich über 5 Tage empfohlen (Myhr u. Mellgren 2009); es liegen allerdings auch Untersuchungen vor, welche eine bessere Wirksamkeit einer Dosierung von 2000 mg pro Tag zeigen (Oliveri et al. 1998; Fierro et al. 2002). Glukokortikoide beeinflussen jedoch in bedeutendem Maße die Regulation von affektiven und Untersuchungen kognitiven zeigen, Prozessen dass (Fietta insbesondere et al. 2009). Störungen des Verschiedene deklarativen Gedächtnisses auftreten (Newcomer 1994; de Quervain 2000). Obwohl MS-Patienten häufig schon zu Beginn ihrer Erkrankung kognitive Defizite aufweisen und die Therapie mit Glukokortikoiden häufig mehrmals in einem Krankheitsverlauf durchgeführt wird, liegen bisher nur wenige Daten über die kognitiven Auswirkungen dieser Therapie bei MS-Patienten vor (Oliveri et al. 1998). Im Rahmen der vorgestellten Studie wurde der Einfluss der zur Behandlung eines akuten Schubes einer MS eingesetzten synthetischen Glukokortikoide auf neuropsychologische Funktionsparameter, insbesondere mnestische Funktionen, an insgesamt 30 MS-Patienten mit Studiendesign untersucht. 1 einem randomisierten, doppelblinden 1.2. Multiple Sklerose 1.2.1. Epidemiologie, Ätiologie, Pathophysiologie Die Multiple Sklerose ist die häufigste neurologische Erkrankung, die im jungen Erwachsenenalter zu bleibender Behinderung und vorzeitiger Berentung führt. Es handelt sich um eine immunvermittelte, chronisch-entzündliche Erkrankung des zentralen Nervensystems, die histopathologisch in unterschiedlicher Ausprägung zu Demyelinisierung und axonalem Schaden führt. Bei der Mehrzahl der Patienten manifestiert sich die Erkrankung im Alter zwischen 20 und 40 Jahren (Amato u. Ponziani 2000), wobei das mittlere Alter bei Krankheitsbeginn bei Frauen etwas niedriger ist (Goodkin et al. 1989). Das Verhältnis von erkrankten Frauen zu erkrankten Männern geschlechtsspezifischen beträgt etwa Unterschiede 2:1. sind nicht Die klar; Ursachen dieser vermutlich spielen Sexualhormone und deren Beeinflussung der Immunantwort eine Rolle. Die geographische Verteilung der MS-Erkrankung ist inhomogen. Schätzungen zufolge dürften etwa 2,5 Millionen Menschen weltweit betroffen sein, in Deutschland ca. 122 000 (Hein u. Hopfenmüller 2000; Pugliatti et al. 2006). In Äquatornähe ist die Erkrankung selten; in Richtung der Pole nimmt sie zu. Offenbar ist die MS häufiger in den Gebieten, die ein gemäßigtes Klima haben und wirtschaftlich gut entwickelt sind. Eine Migration vor dem 15. Lebensjahr in Gebiete mit niedrigem Erkrankungsrisiko reduziert das Risiko, an MS zu erkranken, während die Migration nach dem 15. Lebensjahr keinen Einfluss auf das Krankheitsrisiko hat. Neuere Untersuchungen legen dar, dass die Prävalenz der Erkrankung vor allem bedingt durch ein längeres Überleben der Patienten zunimmt; allerdings scheint auch eine echte Zunahme der Inzidenz von MS-Erkrankungen, speziell bei Frauen, vorzuliegen (Koch-Henriksen u. Sørensen 2010). Es wird vermutet, dass bei der Entstehung der MS ein exogener Faktor beteiligt ist, der in der Kindheit oder Adoleszenz erworben wird und nach einer unterschiedlich langen Latenzzeit zur Erkrankung führt. Die genaue Ätiologie der Erkrankung ist noch immer unbekannt, bezüglich der Pathogenese gelten genetische Faktoren sowie Umweltfaktoren als gesichert (Compson u. Coles 2002). Man geht von einer genetischen Prädisposition für die Entwicklung einer MS aus, beispielsweise beträgt die Erkrankungswahrscheinlichkeit für einen monozygoten Zwilling ca. 31 %. Dabei ist allerdings ein einfacher auslösender Gendefekt nicht erkennbar, 2 vielmehr geht man davon aus, dass es sich um eine multifaktorielle, polygene Erkrankung handelt. Durch Veränderung in mehreren Genen (hier gelten beispielsweise die sog. „MHC Klasse II Gene“ als stark beteiligt) entsteht eine genetische Prädisposition, die unter Beteiligung von Umweltfaktoren die Wahrscheinlichkeit einer Erkrankung steigert. Zudem werden spezifische Auslöser, wie etwa virale Infektionen (z. B. Epstein-Barr-Virus, Humanes Herpesvirus 6) diskutiert, allerdings gibt es dafür keine sicheren Belege. Hinweise gibt es auf Einflüsse von Zigarettenrauchen, EBV-Infektion, Sonnenexposition, Vitamin-D Mangel und sonstige Ernährung (Mechelli et al. 2010). Traditionell wird die MS als eine Autoimmunerkrankung angesehen, bei der autoreaktive T-Zellen, die gegen Myelinbestandteile des Zentralvervensystems gerichtet sind, einen Entzündungsprozess induzieren, der zu einer sekundären Makrophagen-Rekrutierung mit daraus folgender Myelindestruktion führt. Neuere Daten sprechen dafür, dass die Immunpathogenese der MS komplizierter ist, als bisher angenommen, was angesichts der bekannten klinischen, radiologischen, genetischen und morphologischen Heterogenität der Erkrankung nicht überrascht. MS könnte demnach eine Bezeichnung für verschiedene Krankheiten sein, welchen gemeinsam ist, dass Myelin und Oligodendrozyten durch verschiedene toxische Immunmodulatoren angegriffen werden. Dafür spricht, dass die Mechanismen der Gewebsschädigung bei der MS fundamental unterschiedlich zwischen einzelnen Subgruppen von Patienten sind (Pittock u. Lucchinetti 2007). Morphologisch manifestiert sich die Multiple Sklerose durch Entzündung, Demyelinisierung, Verlust von Axonen und Gliose. Die entzündlichen Herde sind charakterisiert durch eine massive Infiltration von verschiedenen zellulären und löslichen Mediatoren (T-Zellen, B-Zellen, Makrophagen, Cytokine, Chemokine, Antikörper und Mikroglia), die zur Demyelinisierung führen. Das Auftreten solcher Läsionen ist verbunden mit klinischen Schüben der Erkrankung; dabei lassen sich die klinischen Symptome der Patienten teilweise durch die Entmarkung, teilweise jedoch auch durch die daraus folgende Axonschädigung erklären (Brück 2005). Die Läsionen sind im gesamten ZNS zu finden mit einer Prädilektion für die Sehnerven, den Hirnstamm, das Rückenmark, das Kleinhirn und die periventrikuläre weiße Substanz. 3 1.2.2. Klinik Die Symptomatik der MS ist vielgestaltig. Als typische Symptome gelten Paresen, Sensibilitätsstörungen, psychiatrische Visusstörungen, Auffälligkeiten, Fatigue, Ataxie, kognitive Schmerzen Einschränkungen, sowie Blasen- und Mastdarmstörungen und Einschränkungen der Sexualfunktion. Allerdings gibt es kein Symptom, das für die MS spezifisch wäre. Bei ca. 20 % der Patienten ist die Optikusneuritis Erstsymptom, bei bis zu 50 % tritt sie zu irgendeinem Zeitpunkt der Erkrankung auf (Chen u. Gordon 2005). Bei Herden am Eintritt des Nervus opticus in die Retina stellt sich die Papille unscharf, vergrößert und ödematös dar (Papillitis). Bei im Verlauf des N. opticus auftretenden Herden (Retrobulbärneuritis) finden sich im Anfangsstadium Schleier- bzw. Verschwommensehen und frühzeitig eine deutliche Visusminderung bis hin zu erloschener Sehkraft. Zudem treten Bulbusschmerzen und Lichtsensationen auf. Auch Chiasma, Tractus opticus und Sehstrahlung können durch Plaques geschädigt werden und es kommt zu typischen Gesichtsfelddefekten, die auf die Lokalisation der Läsion schließen lassen. Im Prinzip können alle bekannten Augenbewegungsstörungen auftreten. Die häufigsten sind Doppelbilder (zu Erkrankungsbeginn bei 7 % der Patienten, im Verlauf der Erkrankung bei ca. einem Drittel der Patienten nachweisbar), Nystagmus (bei ca. zwei Dritteln der Patienten im Verlauf auftretend) und eine internukleäre Ophtalmoplegie (INO). Die INO tritt bei 34-53 % der Patienten v. a. in späteren Erkrankungsstadien auf. Eine bilaterale INO gilt annähernd als pathognomonisch für die MS (Roodhooft 2009; Barnes u. McDonald 1992). Motorische Symptome werden v. a. durch Pyramidenbahnläsionen hervorgerufen. Die Patienten bemerken rasche Ermüdbarkeit, Schwäche und Kraftlosigkeit. Vor allem die unteren Extremitäten sind betroffen; es treten Gangstörungen auf. Bei fortgeschrittener MS besteht häufig eine spastische Paraparese. Sensibilitätsstörungen treten in Form von Parästhesien und Hitze- oder Kältegefühl auf. Am häufigsten finden sich Sensibilitätsstörungen an den unteren Extremitäten, meistens betreffen diese den Vibrations- und Lagesinn. Schmerzen werden von bis 4 zu 40 % der Patienten angegeben (Solaro u. Messmer 2010). Das LhermitteZeichen (schmerzhaftes, elektrisierendes Gefühl bei Kopfbeugung, welches für Beteiligung des Halsmarks spricht) ist nicht spezifisch für die MS, hat jedoch als Einzelsymptom in der Diagnosestellung der MS vor allem bei jüngeren Patienten Bedeutung. Bei zerebellären Herden treten Koordinationsstörungen in Form von Dysmetrie, Dyssynergie und Dysdiadochokinese auf, zudem Schwindel und Gleichgewichtsstörungen, teilweise auch Übelkeit. Koordinationsstörungen der Sprachmuskulatur führen zur Dysarthrie, häufig kommt es zu einer skandierenden Sprache. Verschiedene Tremorformen treten auf, v. a. der Intentionstremor. Der Nervus trigeminus ist in 7 % der Fälle geschädigt. Es finden sich Hypästhesie, Kribbeln und Kältegefühl sowie ein herabgesetzter Kornealreflex. Oft ist der Geschmackssinn beeinträchtigt. Im jugendlichen Alter ist die MS die häufigste Ursache für eine nicht lokal erklärbare Trigeminusneuralgie. Eine periphere Parese des Nervus facialis findet sich bei 5-8 % der Patienten, sie bildet sich häufig rasch zurück. Bei 7 % der Patienten findet sich eine zentrale Facialisparese. Heiserkeit und Schluckstörungen sowie verwaschene Sprache können auftreten, ebenso tonische Hirnstammanfälle. 75 % der MS-Patienten haben im Krankheitsverlauf Blasenstörungen, v. a. durch Infektionen. Je nach Ort der Schädigung treten auch verschiedene neurogene Blasenstörungen auf. Sexualstörungen im Sinne von Erektionsschwäche bei Männern und Libidoverlust bei Frauen treten durch Läsionen im Sakralmark auf (Schmidt u. Hoffmann 2002). Bis zu 90 % der MS-Patienten leiden unter einer Fatigue, die sie in Form von Erschöpfung, Mangel an Energie, erhöhter Ermüdbarkeit und Verschlechterung von MS-Symptomen, besonders bei Aktivität und Temperaturerhöhung (UhthoffPhänomen) wahrnehmen (Vucic et al. 2010). Kognitive Beeinträchtigungen liegen bei 40-65 % der MS-Patienten vor und können ein Hauptgrund für berufliche und soziale Beeinträchtigung sowie verminderte 5 Lebensqualität sein (Amato et al. 2008). Zumeist sind Gedächtnis, Aufmerksamkeit, Verarbeitungsgeschwindigkeit und die exekutiven Funktionen beeinträchtigt (Rogers u. Panegyres 2007). Die häufig schon zu Krankheitsbeginn auftretenden kognitiven Defizite der MS-Patienten können als Folge eines „multiplen Diskonnektionssyndroms“ aufgefasst werden. Dabei führt ein räumlich disseminiertes und zeitlich aufeinanderfolgendes, kortexnahes Entmarkungsmuster langfristig zu multiplen Unterbrechungen kortiko-kortikaler Verbindungen und stört damit den netzwerkartigen Informationsverarbeitungsmodus des kognitiven Systemgefüges empfindlich. Eine Kompensation scheint nur bis zu einem bestimmten Läsionsausmaß möglich, weshalb von einem „Schwellenmodell“ ausgegangen wird, in dem zunehmende kognitive Defizite das Resultat eines Ausfalls in der Rekrutierung alternativer funktioneller Netzwerke zu sein scheinen (Calabrese u. Penner 2007). Psychiatrische Symptome treten bei mehr als der Hälfte der an Multipler Sklerose erkrankten Patienten auf; dabei ist unklar, inwieweit diese Folge der psychosozialen Auswirkungen der Erkrankung sind oder aber Symptome der pathologischen Prozesse selbst (José Sá 2008). Depressionen, v. a. während Schüben der Erkrankung, sind häufig; diese können eine primär vorliegende Fatigue oder primär vorliegende kognitive Einschränkungen noch verstärken. Unter Ängsten leiden Patienten häufig kurz nach Diagnosestellung. Andere psychiatrische Erkrankungen wie die bipolar affektive Störung oder Psychosen kommen bei der MS weniger häufig vor (Fazzito et al. 2009). Psychiatrische Störungen bei MS-Patienten können zudem durch die Behandlung der Erkrankung ausgelöst werden: Z. B. können Depressionen durch die Verabreichung von Interferonen angestoßen oder verstärkt werden. Kortikosteroide können eine Hypomanie oder eine Depression, seltener auch psychotische Störungen verursachen (Goeb et al. 2006). 6 1.2.3. Krankheitsverlauf und Prognose Der Krankheitsverlauf der MS ist höchst variabel und im Einzelfall nur schwer vorhersagbar. Das Spektrum reicht von einem einzigen Schub ohne nennenswertes neurologisches Defizit bis hin zu einem raschen, progredienten Verlauf mit schwerer Behinderung. Allgemein anerkannt und anhand einer internationalen Erhebung bei 215 in der MS-Forschung und –Therapie erfahrenen Klinikern bestätigt sind folgende Verlaufsformen (Lublin u. Reingold 1996): Der schubförmige remittierende Verlauf (relapsing-remitting MS, RRMS) ist definiert durch klare Schübe mit vollständiger Restitution oder verbleibenden Residuen, wobei in den Intervallen zwischen den Schüben keine Krankeitsprogression zu verzeichnen ist. In der Frühphase der MS überwiegt diese Verlaufsform mit einer Häufigkeit von etwa 85-90 %. Derprimär chronisch-progrediente Verlauf (primary-progressive MS, PPMS)kommt wahrscheinlich bei den übrigen 10-15 % der Patienten vor und ist charakterisiert durch eine progrediente Zunahme der Symptomatik von Krankheitsbeginn an, wobei gelegentlich Plateaus und geringfügige Verbesserungen möglich sind. Der sekundär chronisch-progrediente Verlauf (secondary-progressive MS, SPMS) zeigt initiale Schübe gefolgt von einer Phase der progressiven Zunahme der Symptomatik mit oder ohne gelegentliche Schübe, geringfügige Remissionen oder Plateaus. Nach einer mittleren Krankheitsdauer von 10-15 Jahren geht etwa die Hälfte der zu Krankheitsbeginn schubförmigen Verlaufsformen in die sekundär chronisch-progrediente Verlaufsform über (Flachenecker u. Hartung 1996a,b). Etwa 50 % der MS Patienten benötigen nach 15 Jahren zumindest eine Gehhilfe; im Median dauert es 24 Jahre, bis ein Rollstuhl benötigt wird. 10 % der Erkrankten bleiben jedoch selbst nach 25 Jahren ohne wesentliche Behinderung. Patienten mit einer „benignen“ MS weisen trotz der Diagnose einer MS über viele Jahre bis Jahrzehnte kaum nennenswerte neurologische Defizite auf (Kantarci u. Weinshenker 2005). Maligne Verläufe mit Erkrankungsprogressionen über Monate 7 und Tod innerhalb von wenigen Jahren sind sehr selten. Lebensbedrohliche Situationen entstehen insbesondere bei großen Läsionen in den oberen Zervikalsegmenten oder im Hirnstamm. Die Todesursachen von MS-Patienten sind meist sekundäre Komplikationen wie Pneumonie, Lungenembolie, Urosepsis, Dekubitus, Aspiration und Dehydratation. Statistisch ist die Lebenserwartung von MS-Kranken gegenüber Gesunden etwa um 10 Jahre verkürzt; wobei sich dieser Abstand durch verbesserte medizinische Möglichkeiten in den letzten Jahren verringerte (Bronnum-Hansen et al. 2004). Suizide bei MS-Patienten sind 2 bis 7,5mal so häufig wie in der Normalbevölkerung und liegen 30 % aller MS-Todesfälle zugrunde (Sadovnick et al 1991; Brønnum-Hansen et al. 2005). Als prognostisch ungünstig gelten männliches Geschlecht, ein spätes Erkrankungsalter, motorische, zerebelläre oder Beteiligung von Schließmuskeln als Erstsymptomatik, ein chronisch-progredienter Verlauf, eine hohe Anzahl früher Schübe, kurz aufeinanderfolgende Schübe und relevante, früh auftretende, bleibende Behinderung (Bergamaschi 2007). Bezüglich der paraklinischen Faktoren wie evozierte Potentiale und Liquorbefunde gibt es unterschiedliche Ergebnisse. Nach Flachenecker und Hartung (1996a,b) korrelieren diese nicht mit der Prognose der Erkrankung; allenfalls lässt sich bei klinisch gesicherter MS eine schwache Korrelation zwischen zunehmender MRT-Aktivität und der Zunahme des neurologischen Defizits nachweisen. Untersuchungen von Amato und Ponziani weisen auf einen wichtigen prognostischen Wert der Liquor- und der MRTUntersuchungen hin (2000). 1.2.4. Differentialdiagnostische Überlegungen und Diagnosesicherung Aufgrund der vielfältigen klinischen Symptome der MS und des unterschiedlichen Verlaufs müssen bei differentialdiagnostischen Überlegungen zahlreiche Erkrankungen berücksichtigt werden. Abzugrenzen sind ZNS-Erkrankungen als Folge von systemischen Autoimmunerkrankungen, vaskulären und metabolischen Erkrankungen und Infektionen. Ebenfalls zu unterscheiden sind genetische Syndrome, neoplastische Erkrankungen, Prozesse der hinteren Schädelgrube und des Rückenmarks, chronische Intoxikationen, psychiatrische Erkrankungen, andere demyelisierende Erkrankungen wie z. B. die Neuromyelitis optica (Devic-Syndrom) und Befunde, welche die Diagnose einer MS zweifelhaft erscheinen lassen (Miller 8 u. Compston 2006). Bei der Diagnosestellung der Multiplen Sklerose ist der Nachweis einer topischen (DIS, „dissemination in space“) und zeitlichen Dissemination (DIT, „dissemination in time“) der Entmarkungsherde ausschlaggebend. International etabliert hat sich eine Diagnostik nach den sogenannten „McDonald-Kriterien“, welche 2001 im Original erschienen sind und 2005 sowie 2010 revidiert wurden. So gilt eine MS-Diagnose nach den neuen Kriterien bereits als gesichert, wenn wenigstens eine T2-hyperintense Läsion in wenigstens 2 von 4 charakteristischen Regionen (periventrikulär, juxtakortikal, infratentoriell, spinal) nachweisbar ist (Swanton et al. 2006). Bezüglich der zeitlichen Dissemination kann nun schon eine einzige MRT-Untersuchung ausreichend sein, wenn gleichzeitig Gadoliniumanreichernde und nicht-anreichernde Läsionen nachweisbar sind (Klotz et al. 2011). Nach wie vor kann die Diagnose rein klinisch gestellt werden, wenn mindestens 2 Schubereignisse (Schub = Episode neurologischer Störungen, mindestens 24 h anhaltend, bei denen die ursächliche(n) Läsion(en) wahrscheinlich entzündlich und demyelinisierend ist/sind, nicht im Rahmen von Infektionen, mehr als 30 Tage nach vorausgegangenen Schüben) vorliegen und mindestens 2 Läsionen objektivierbar sind. Zur Diagnose einer MS vom primär chronischprogredienten Verlaufstyp ist die Beobachtung einer klinischen Progression über mindestens 1 Jahr erforderlich sowie der Nachweis der örtlichen Dissemination zerebral durch mindestens eine T2-Läsion periventrikulär, juxtakortikal oder infratentoriell. Zudem ist der Nachweis der örtlichen Dissemination spinal durch mindestens 2 spinale T2-Läsionen erforderlich oder ein positiver Liquorbefund zusätzlich zum Nachweis der örtlichen Dissemnination zerebral oder spinal (s. Abbildung 1). Die Diagnose ist zu stellen, wenn die vorliegenden neurologischen Symptome „durch nichts besser als durch das Vorliegen einer MS“ erklärt werden können (Gold et al., KKNMS-Leitlinien 2012). Der charakteristische Liquorbefund bei der MS umfasst bei dem Großteil der Patienten eine mäßige Pleozytose aus Lymphozyten und Monozyten (<50 Zellen/µl), eine autochthone Immunglobulinproduktion (IgG-Index nach Link und Tibbling >0,7) sowie die Anwesenheit oligoklonaler IgG-Banden (OKB) in der isoelektrischen Fokussierung als Hinweis für die persistierende Sekretion von Antikörpern durch einzelne Plasmazellklone. Etwa 95 % der Patienten mit klinisch 9 sicherer MS haben positive OKB, allerdings findet man diese ebenfalls bei anderen entzündlichen Erkrankungen, z. B. der Neuroborreliose oder der Neurosarkoidose (Wiendl et al. 2006; Tumani et al. 2009). Neben der Kernspintomographie und der Liquoruntersuchung spielen die neurophysiologischen Untersuchungen speziell in der Frühdiagnostik eine wichtige Rolle, da sie nachzuweisen geeignet und somit sind, eine klinisch Polytopie „stumme“ der Demyelinisierungsherde Entzündung zu belegen. Demyelinisierende Läsionen mit Remyelinisierung bzw. axonale Degeneration von zentralen markscheidenhaltigen Nervenfasern führen zu Störungen in der Impulsübertragung, die durch Ableitung der evozierten Potentiale (EP) bzw. der Hirnstammreflexe objektiviert werden können. Zum Einsatz kommen die visuell evozierten Potentiale (VEP), die frühen akustisch evozierten Potentiale (FAEP), die somatosensorisch evozierten Potentiale (SSEP) und die motorisch evozierten Potentiale (MEP). Im Rahmen der Hirnstammdiagnostik werden der Blinkreflex und der Masseterreflex untersucht (Schüler u. Hoffmann 2002). Bei 85-90 % der Patienten äußert sich die MS initial als CIS (clinically isolated syndrome) z. B. in Form einer Optikusneuritis oder in Form eines isolierten Hinstamm- oder Rückenmarkssyndroms. 60-80 % der Patienten mit einem CIS und MRT-Läsionen entwickeln im Verlauf eine definitive Multiple Sklerose (Dalton et al. 2004). Die Adaptation der McDonald-Kriterien 2010 hat dazu geführt, dass die Diagnose MS nun schon beim Auftreten eines ersten Schubes gestellt werden kann, wenn sich im Erst-MRT Hinweise für eine räumlich und zeitlich disseminierte Krankheitsaktivität ergeben. Somit kann eine frühere Behandlung erfolgen, welche das Ausmaß des irreversiblen axonalen Schadens vermindern kann (Tintoré 2009; Polman et al. 2011). 10 1.2.5. Therapie der Multiplen Sklerose In Ermangelung einer kurativen Therapie der Erkrankung sind gegenwärtig folgende Hauptziele von Bedeutung: - Möglichst vollständige Rückbildung schubassoziierter Symptome - Vorbeugung weiterer Krankheitsschübe - Unterbindung bzw. Verlangsamung der Entwicklung dauerhafter neurologischer Defizite (Krankheitsprogression) - Bei eingetretenen dauerhaften Ausfällen eine Stabilisierung der funktionellen Einschränkung auf möglichst niedriger Beeinträchtigungsstufe (symptomatische Therapie z. B. durch Physiotherapie oder multidisziplinäre Rehabilitationsverfahren) 1.2.5.1. Verlaufsmodifizierende Therapie der schubförmigen MS Die Bedeutung immunmodulatorischer Therapiestrategien zur Behandlung der MS ist in den letzten Jahren kontinuierlich gewachsen. Zu den in Studien erfolgreichen und inzwischen etablierten immunmodulatorischen Therapieprinzipien bei der MS gehören das Typ-I Interferon (Interferon-beta 1a: Avonex®, Rebif®, Interferon-beta 1b: Betaferon®, Extavia®), das Polypeptidgemisch Glatirameracetat (Copaxone®) sowie die intravenösen Immunglobuline. Nicht-selektive Immunsuppressiva oder Chemotherapeutika, die seit einigen Jahren in der MS-Therapie Cyclophosphamid und verwendet werden, Methotrexat. Diese sind Mitoxantron, Azathioprin, Medikamente wurden aus der Tumortherapie oder der Transplantationsmedizin für den Einsatz bei MS adaptiert und werden v. a. zur Eskalationstherapie eingesetzt. Die immunspezifische Behandlung mit Natalizumab (Tysabri®), einem humanisierten Antikörper, ist aufgrund von Fällen mit Progressiver Multifokaler Leukenzephalopathie (PML), die teilweise tödlich verliefen, nur für Patienten mit besonders rasch fortschreitender Erkrankung bzw. bei Nichtansprechen auf Interferonpräparate zugelassen. Ähnlich ist das Indikationsspektrum für das oral verabreichbare Fingolimod (Gilenya®). Die autologe und allogene Knochenmarkbzw. Stammzelltransplantation sowie 12 verschiedene andere medikamentöse Behandlungen werden aktuell auf experimenteller Basis erprobt (Gold et al., KKNMS-Leitlinien 2012). 1.2.5.2. Behandlung des akuten Schubes einer MS mit Glukokortikoiden Glukokortikoide (GK) sind die Behandlung der ersten Wahl bei Erstmanifestation einer MS sowie zur Behandlung von Schüben einer schubförmigen MS (RRMS) oder schubförmigen Auflagerungen bei sekundär progredienter MS (SPMS) oder primär chronisch progredienter Verlaufsform (PPMS). GK sind in der Unterdrückung und Verhütung von entzündlichen Reaktionen äußerst wirksam und werden seit Jahrzehnten als Standardtherapie bei einer Vielzahl von entzündlichen Erkrankungen eingesetzt wie z. B. Asthma, systemischem Lupus erythematodes, Vaskulitis, entzündlichen Darmerkrankungen, Myastenia gravis und rheumatoider Arthritis (Frohman et al. 2007). Neben dem antiödematösen Effekt und der Restauration der Blut-Hirnschranke steht dabei v. a. die immunsuppressive Wirkung im Vordergrund, die sich auf humorale und zelluläre Immunprozesse erstreckt. Bezüglich der molekularen Wirkmechanismen kennt man einerseits spezifische, intrazellulär über den zytosolischen GK-Rezeptor vermittelte Effekte und andererseits unspezifische Membraneeffekte. Über die erfolgende Entkoppelung der Atmungskette wird die Aktivierung von Immunzellen verhindert; möglicherweise werden auch apoptotische Signale vermittelt. Die exogene Zufuhr von GK führt bereits nach 4-6 Stunden zu Veränderungen auf zellulärer Ebene und durch Inhibition von Arachidonsäuremetaboliten wie der Prostaglandine und Leukotriene, Abnahme der Gefäßdilatation, des Ödems, der Fibrinablagerung und Migration von Entzündungszellen in das Gewebe zu einem entzündungshemmenden Effekt und somit zu einem Rückgang der klinischen Symptomatik (Wiendl u. Kieseier 2010). Im Hinblick auf die MS hat sich eine intravenöse Hochdosis-Pulstherapie mit GK etabliert. Aktuell wird empfohlen, möglichst innerhalb von 3-5 Tagen nach Beginn der klinischen Symptomatik mit einer Dosierung von 1 g Methylprednisolon pro Tag an 3-5 aufeinanderfolgenden Tagen zu behandeln. Bei ungenügender Besserung erfolgt eine erneute intravenöse Pulstherapie, ggf. auch mit erhöhter Dosis von bis zu 5x2 g Methylprednisolon. Falls auch hierunter keine Rückbildung einer schwerwiegenden Schubsymptomatik eintritt, sollte die Option einer Plasmapherese innerhalb von max. 4-6 Wochen in einem MS-Zentrum in Betracht gezogen werden. Bei 13 kontinuierlicher Verschlechterung der Symptomatik während einer fünftägigen GKTherapie kann eine Plasmapherese-Behandlung auch anstelle einer Wiederholung der Pulstherapie in Erwägung gezogen werden (Gold et al., KKNMS-Leitlinien 2012). Während die Effekte der GK auf die Rückbildung der Schübe konsistent belegt sind, gibt es derzeit nicht ausreichend Hinweise dafür, dass die GKPulstherapie eine Langzeitwirkung auf den natürlichen Verlauf der MS hätte (Myhr u. Mellgren 2009; Ciccone et al. 2008). Bei der Hochdosis-Pulstherapie mit Methylprednisolon ist auf eine Thromboseprophylaxe und einen Magenschutz zu achten. Weitere unerwünschte Nebenwirkungen der Therapie sind Elektrolytveränderungen (Kaliummangel), eine erhöhte Infektanfälligkeit, Blutzuckererhöhungen, Hypertonie, fetale Missbildungen in den ersten drei Schwangerschaftsmonaten, Ruhelosigkeit und Schlafstörungen sowie Konzentrations- und Gedächtnisstörungen. Die Vulnerabilität für affektive und psychotische Störungen ist erhöht. Mehr als 3 Zyklen einer HochdosisPulstherapie im Jahr sollten nicht durchgeführt werden (Leary et al. 2005). Eine längerfristige Behandlung mit Glukokortikoiden kann vielfältige weitere unerwünschte Begleiterscheinungen nach sich ziehen, z. B. Atherosklerose, Hautatrophie, Fettleibigkeit, Diabetes mellitus, Ulkuskrankheit, Pankreatitis, Fettleber, Blutbildveränderungen und Augenkrankheiten (Warrington and Bostwick 2006). 1.3. Auswirkung von Glukokortikoiden auf Stimmung, Affekt und die kognitiven Leistungen Stimmungslabilität, Angstsymptome, Beeinträchtigung der kognitiven Funktionen, Verhaltensauffälligkeiten oder Kombination und auftreten psychotische werden Züge traditionell können unter alleine dem oder Begriff in einer „Steroidpsychose“ zusammengefasst. Die Effekte des Kortisons auf Stimmung und Affekt scheinen dosisabhängig zu sein; z. B. hat eine vorübergehende, moderate Erhöhung der (physiologischen) Menge an Kortisol im Blut einen schützenden Effekt auf die Stimmung in kritischen Situationen. Wird Kortison dem Organismus exogen zugeführt, so werden bei kurzfristigen Gaben eher manische Symptome beobachtet, bei länger dauernder Behandlungszeit depressive; auch Suizidalität wurde berichtet (Fietta et al 2009). 14 Nach dem Modell von Roozendaal (2002) verbessern Glukokortikoide die Konsolidierung von Gedächtnisinhalten, während sie die Abrufleistungen verschlechtern. Lupien und Mitarbeiter gehen davon aus, dass exogene Glukokortikoide das Gedächtnis in einer Art umgekehrt U-förmigen Kurve beeinflussen, also das Gedächtnis in Zeiten niedriger physiologischer Kortisonspiegel (am Nachmittag) verbessern und in Zeiten hoher Kortisonspiegel (am Morgen) verschlechtern (Lupien u. JMcEwen 1997). Untersuchungen zur Gedächtniskonsolidierung im Schlaf zeigen, dass der Tiefschlaf in der ersten Schlafhälfte mit einer Hemmung der Kortisolfreisetzung einhergeht, während die Kortisolspiegel in der zweiten Schlafhälfte stark ansteigen. Deklarative Gedächtnisinhalte scheinen eher in der ersten Schlafhälfte konsolidiert zu werden, während non-deklarative, prozedurale Gedächtnisinhalte stärker von der zweiten Schlafhälfte zu profitieren scheinen. Der konsolidierungsfördernde Effekt des frühen Schlafs auf deklarative Gedächtnisinhalte kann durch experimentelle Erhöhung des Kortisolspiegels vollständig gehemmt werden (Born und Plihal, 1999). 1.3.1. Mechanismus und Ausmaß der Beeinflussung kognitiver Funktionen durch Glukokortikoide GK werden unter physiologischen Bedingungen in der Nebennierenrinde produziert; die Produktion und Freisetzung ist durch den Regelkreis aus Hypothalamus-Hypophysen-Nebennierenrindenachse (HHN) gesteuert. Der Hippokampus und die angrenzenden Gebiete des limbischen Systems haben eine besonders hohe Dichte an Glukokortikoidrezeptoren. Die Typ I-Rezeptoren (Mineralokortikoidrezeptoren) binden endogene Glukokortikoide (Kortisol) und Mineralokortikoide; die Typ II-Rezeptoren (Glukokortikoidrezeptoren) binden v. a. synthetische Glukokortikoide. Bei mittleren Glukokortikoidkonzentrationen werden v. a. Typ I-Rezeptoren besetzt und die Langzeitpotenzierung in hippokampalen Neuronen wird gefördert. Die Typ II-Rezeptoren werden erst bei höheren Glukokortikoidkonzentrationen (z. B. bei exogener Zufuhr oder stressbedingter Ausschüttung) besetzt und führen zu einer Unterdrückung der Langzeitpotenzierung. Auch zu niedrige Spiegel führen zu einer Störung der 15 Einspeicherung von Gedächtnisinhalten (Forget et al 2000; Jacobson u. Sapolsky 1991). Tierexperimentelle Studien zeigen, dass chronisch erhöhte Kortisolspiegel durch neuronalen Zelltod in der CA 3-Region des Hippokampus strukturell schädigend wirken (McEwen et al. 1986; Li et al. 2009). Bei längerdauernder, pathologisch erhöhter Aktivität der HHN-Achse wurde eine Reduktion des hippokampalen Volumens festgestellt (Bremner et al. 2000). Wie genau eine erhöhte Kortisolkonzentration zu einer funktionellen bzw. strukturellen Abnahme der Aktivität des Hippokampus und angrenzender Strukturen, die für die Einspeicherung von Gedächtnisinhalten wesentlich sind, führt, ist bisher noch unklar. Angenommen wird eine Hemmung des Glukosetransports an der Nervenzelle bzw. eine Involution des dendritischen Prozesses durch Glukokortikoide sowie eine Reduktion der Glukoseutilisation (Horner et al. 1990; Wolkowitz et al. 1997). Verschiedene Befunde weisen darauf hin, dass die Wirkung des Kortisols Alterungsprozesse beschleunigt oder verstärkt (van Nierkerk et al. 2001; Michaud et al. 2009). 1.3.1.1. Einfluss endogener Glukokortikoide auf die Kognition Beispiele für eine pathologisch gesteigerte Aktivität der HHN-Achse und somit einer erhöhten Konzentration an körpereigenem Kortisol sind das Cushing-Syndrom, die Major Depression und die Posttraumatische Belastungsstörung (PTSD). Untersuchungen der kognitiven Leistungsfähigkeit ergaben bei Cushing-Patienten ein allgemein vermindertes kognitives Leistungsniveau, insbesondere in den Bereichen der selektiven Aufmerksamkeit und visuellen Informationsverarbeitung; zudem ließ sich eine bilaterale Hippokampusatrophie nachweisen (Starkman u. Schteingart 1992). Patienten mit Major Depression weisen häufig kognitive Defizite qualitativer und quantitativer Art auf. MRT-Untersuchungen ergeben im Vergleich zu gesunden Kontrollpersonen ebenfalls eine bilaterale Hippokampusatrophie; dabei ist das Ausmaß der Atrophie umso größer, je häufiger und schwerer die Patienten depressiv erkrankt waren (Eker u. Gonul 2010; Colla et al. 2007). Auch Patienten mit einer PTSD zeigen in MRT-Untersuchungen eine Verminderung der Volumina von Hippokampus, Amygdala und präfrontalem Kortex. Obwohl Patienten 16 mit PTSD ebenfalls wie andere Personen, die chronischem Stress ausgesetzt sind, vermehrt Glukokortikoide in der Nebennierenrinde synthetisieren, wird paradoxerweise häufig eine verminderte Kortisolkonzentration in Urin oder Plasma gemessen. Das könnte evtl. an einer verstärkten negativen Rückkopplung der HPA-Achse liegen. Interessanterweise haben prospektive Studien gezeigt, dass niedrige Kortisolspiegel zum Zeitpunkt eines Traumas eine spätere PTSD voraussagen können; somit zeigte sich auch eine Behandlung mit Kortison nach einer traumatischen Erfahrung in einigen Untersuchungen als präventiv bezüglich der Entwicklung einer PTSD (Heim u. Nemeroff 2009). 1.3.1.2. Einfluss exogener Glukokortikoide auf die Kognition Vor allem nach länger andauernder und hoch dosierter Kortisontherapie kommt es zu ausgeprägten neuropsychologischen Funktionsbeeinträchtigungen bis hin zu Psychosen und demenzähnlichen Symptomen (Varney u. Alexander 1984; Arndt et al. 2004). Meist sind diese Störungen nach Beendigung der Kortisontherapie rasch rückläufig, sie können jedoch auch über Monate bis Jahre nachweisbar sein. Bereits die Verabreichung eines niedrig dosierten Glukokortikoids kann zu signifikanten kognitiven Defiziten führen, v. a. im Bereich des deklarativen Gedächtnisses (Newcomer et al. 1994), aber auch Störungen des Arbeitsgedächtnisses und der Aufmerksamkeit wurden berichtet (Lupien et al. 1999; Born et al. 1987). Untersuchungen von Olivieri und Mitarbeitern (1998a) an MS-Patienten weisen auf eine reversible, selektive Verschlechterung des deklarativen Gedächtnisses unter der Therapie mit Glukokortikoiden hin. De Quervain und Mitarbeiter untersuchten erstmals die Auswirkungen einer Kortisongabe auf die verschiedenen Phasen der Gedächtnisbildung, indem sie gesunden Versuchspersonen jeweils 1 Stunde vor der Lernphase (Aneignung einer Wortliste), direkt nach der Lernphase und 1 Stunde vor der Abrufphase 25 mg Kortison verabreichten. Kortisoninduzierte Defizite im Sinne einer Verschlechterung der freien Abrufleistung ergaben sich nur bei der Gruppe, die vor der Abrufphase das Kortison erhalten hatte (de Quervain et al. 2000). In einer Metastudie von Het und Mitarbeitern (2005) wurden systematisch die Unterschiede zwischen einer Kortisongabe vor der Lernphase bzw. vor der Abrufphase untersucht. Zudem wurde geprüft, ob sich am Morgen verabreichtes Kortison ähnlich auf die mnestischen Leistungen auswirkt wie am Nachmittag verabreichtes Kortison. 17 Kortisongaben vor der Abrufleistung führten zu einer deutlichen Verschlechterung der Abrufleistung; Kortisongaben vor der Lernleistung hatten keinen signifikanten Effekt. Kortisongaben am Morgen hatten eine deutliche Verschlechterung der Gedächtnisleistung zur Folge, Kortisongaben am Nachmittag eine leichte Verbesserung. Bildgebende Untersuchungen stützen auch bei exogener Kortisongabe die Bedeutung der Rolle der Hippokampusregion. Brown und Mitarbeiter (2004) wiesen in einer Untersuchung an 17 langjährig kortisonbehandelten Patienten im Vergleich zu 15 unbehandelten Kontrollen ein niedrigeres Volumen des Hippokampus unter Kortisonbehandlung nach. De Quervain und Mitarbeiter (Quervain et al. 2003) konnten mittels H(2)(15) OPositronen Emissions-Tomographie nach Kortisongabe eine signifikante Abnahme der regionalen Blutversorgung im rechten medialen Temporallappen, im linken visuellen Kortex und im Zerebellum nachweisen, wobei die ausgeprägteste Minderung des Blutflusses den Gyrus parahippokampalis betraf. 1.4. Gedächtnis aus neuropsychologischer Sicht Versuche, das Gedächtnis zu beschreiben, lassen sich im Wesentlichen zwei Hauptansätzen zuordnen: einem eher prozessorientierten Ansatz, bei dem Gedächtnis entlang einer Zeitachse definiert wird und einem primär inhaltlich orientierten Ansatz, der stark auf neuroanatomische Bezüge fokussiert. 1.4.1. Gedächtnis als zeitabhängiger Prozess Legt man den Ansatz der traditionellen Gedächtnisforschung zugrunde, der von einem seriellen System der Informationsverarbeitung ausgeht, so wird zwischen Ultrakurzzeitgedächtnis (Speicherung im Zeitraum von Millisekunden), Kurz- bzw. Primärgedächtnis (Speicherung im Zeitraum von Sekunden bis Minuten) und Langzeit- bzw. Sekundärgedächtnis (Speicherung über lange, möglicherweise unbegrenzte Zeiträume) unterschieden (Markowitsch 1999). Allerdings gibt es immer wieder Befunde von Patienten, die substantielle Beeinträchtigungen im Bereich des Kurzzeitgedächtnisses Einschränkungen des nach aufweisen, dieser ohne unter Auffassung bedeutsamen nachgeordneten Sekundärgedächtnisses zu leiden (Basso et al. 1982). Daher wurde das Konzept eines einheitlichen Kurzzeitgedächtnisses durch ein Mehrkomponentenmodell des Arbeitsgedächtnisses ersetzt: Ein visuell-räumlicher Notizblock dient demnach für 18 die kurzfristige Speicherung visueller Informationen; ein phonologischer Notizblock für die Speicherung von verbalem Material. Die zentrale Exekutive fungiert als Kontrollsystem und Schnittstelle zwischen dem Langzeitspeicher und den o. g. Subsystemen (Baddeley 2001). 1.4.2. Gedächtnis als inhaltsabhängiger Prozess Werden nicht zeitliche, sondern inhaltliche Gesichtspunkte zugrunde gelegt, ergibt sich die Aufteilung des Sekundärgedächtnisses in ein deklaratives (explizites) Gedächtnis, dessen Inhalte allgemein dem Bewusstsein zugänglich und somit verbalisierbar sind („knowing that“) und in ein nondeklaratives (implizites, prozedurales) Gedächtnis, welches sich auf motorische und mechanische Fertigkeiten und Handlungsabläufe („knowing how“) bezieht und weitgehend unbewusst abläuft. Auch Assoziationen („Priming“), Konditionierungsvorgänge und habituelles Lernen fallen unter den Bereich des nondeklarativen Gedächtnisses (s. Abbildung 2). 1.4.2.1. Deklaratives Gedächtnis Das deklarative Gedächtnis ist ein Gedächtnis für Ereignisse, Fakten, Gesichter, Musik; für alle Dinge, die im Laufe des Lebens als Erfahrungen und Kenntnisse gesammelt werden. Das Wissen kann potentiell erklärt bzw. kundgetan, also deklariert werden: d. h. als verbale Konstruktion oder als Bild ins Gedächtnis gerufen werden. Beim deklarativen Gedächtnis wird unterschieden zwischen dem episodischen und dem semantischen Gedächtnis. Letzteres repräsentiert unser im Laufe des Lebens erworbenes (Welt-) Wissen und dient dem Erlernen, Verstehen und der Organisation kontext-unabhängiger Informationen. Das episodische Gedächtnis dagegen ist Speicherort für autobiographische, singuläre Ereignisse, die nach Raum und Zeit bestimmbar sind und die bewusst und reflektiert wahrgenommen werden (Squire u. Kandel 1999). 19 Langzeitgedächtnis deklarativ (explizit) episodisch nondeklarativ (implizit) semantisch Fähigkeiten Priming Klassisches Konditionieren Abbildung 2: Taxonomie des Langzeitgedächtnisses: Deklaratives und nondeklaratives Gedächtnis. Angelehnt an Baddeley A.: The concept of episodic memory. Phil Trans R Soc Lond (2001) 256:1345-1350. 1.4.3. Neuroanatomie des Gedächtnisses Morphologisch ist die Funktion des Gedächtnisses durch eine Vielzahl von netzwerkartig miteinander in Verbindung stehenden anatomischen Strukturen gekennzeichnet. Auf molekularer Ebene finden multiple biochemische und elektrische Prozesse statt, durch welche Gedächtnisinhalte aufgenommen, verarbeitet, konsolidiert und wieder abgerufen werden. Die Verarbeitung nondeklarativer Gedächtnisinhalte erfolgt überwiegend in den Basalganglien sowie im Zerebellum. Die Amygdala spielt für die Speicherung von emotional bedeutsamen Inhalten eine wichtige Rolle. Der präfrontale Kortex wird als Sitz des Arbeitsgedächtnisses gesehen. Von dort erfolgt eine top-down Rückkopplung, die Informationen in den sensorischen Kortexarealen über eine Verzögerungsperiode hinweg aufrechterhält, um diese dann im Arbeitsgedächtnis zu speichern. 20 1.4.4. Der Hippokampus Die Einspeicherung von Informationen in das deklarative Gedächtnis und deren Konsolidierung werden im Wesentlichen über das limbische System vermittelt, welches den medialen Temporallappen, das mediale Dienzephalon sowie das basale Vorderhirn umfasst. Wichtigster Bestandteil dieses Systems für die Überführung von Informationen in das Langzeitgedächtnis ist der Hippokampus. Aufgrund seiner großen Anzahl an Glukokortikoidrezeptoren nimmt er in der Frage nach der Auswirkung einer exogenen Glukokortikoidzufuhr auf mnestische Funktionen eine herausragende Position ein. Die zentrale Bedeutung des medialen Temporallappens für die Einprägung deklarativer Gedächtnisinhalte wurde v. a. durch Läsionsbefunde an Patienten und tierexperimentelle Studien bestätigt. Einen herausragenden Einfluss auf jegliche Untersuchungen in diesem Bereich haben die Untersuchungen des Patienten H. M., der im Jahr 2008 im Alter von 82 Jahren starb. Im Jahr 1952 wurden ihm aufgrund einer schweren Epilepsie die medialen Strukturen beider Temporallappen entfernt. Die epileptischen Anfälle wurden deutlich seltener, jedoch trug der Patient eine schwere, überdauernde, anterograde Amnesie davon. Nicht bzw. vergleichsweise wenig beeinträchtigt waren Intelligenz, Wissen und Fertigkeiten, Wahrnehmungsfunktionen und das Arbeitsgedächtnis. Bis zum Jahr 2002 hatten sich fast 100 Untersucher mit diesem Patienten beschäftigt und die Bedeutung der Hippokampusregion insbesondere für die deklarativen Gedächtnisfunktionen unterstrichen (Corkin 2002). Die Befunde wurden an weiteren Patienten validiert. So wiesen Scoville und Milner (2002) an 9 Fällen von Patienten mit bilateraler medialer Temporallappenresektion teilweise eine schwere, anhaltende anterograde Amnesie bei gleichzeitiger relativ intakter Erinnerung an länger zurückliegende Ereignisse und impliziter Gedächtnisleistung nach. Dabei war die Schwere des Gedächtnisverlusts abhängig von der Größe der entfernten, gedächtnisrelevanten Strukturen. Der Hippokampus scheint somit lediglich ein vorübergehender Speicherort für Langzeiterinnerungen zu sein, d. h. das mediale Temporallappensystem wird für einen längeren, gleichwohl begrenzten Zeitraum benötigt (5-10 Jahre), ist jedoch vermutlich nicht der endgültige Speicherort für Langzeiterinnerungen. Diese Speicherung der erfolgreich konsolidierten deklarativen Informationen erfolgt vermutlich kortikal in den Assioziationsarealen (Schmidtke u. Vommer 1997). 21 Der Hippokampus kommuniziert wechselseitig über multiple Faserverbindungen unter anderem mit dem entorhinalen Kortex, dem perirhinalen Kortex und dem parahippokampalen Kortex. Dabei entspringen die wichtigsten Projektionen in den Hippokampus im entorhinalen Kortex. Dieser wiederum empfängt Informationen von anderen Kortexregionen. Eine direkte Schädigung der perirhinalen und parahippokampalen Kortices beeinträchtigt das Gedächtnis noch stärker als eine Schädigung der hippokampalen Region selbst. Je größer die Schädigung des medialen Temporallappensystems ist, desto schwerer ist die Gedächtnisbeeinträchtigung. Man geht davon aus, dass die verschiedenen Strukturen des medialen Temporallappens verschiedene Aufgaben erfüllen, jedoch mit zunehmender Schädigung immer weniger Möglichkeiten zur Einspeicherung von Gedächtnisinhalten zur Verfügung stehen. In tierexperimentellen Studien wurde demnach nachgewiesen, dass eine isolierte Zerstörung des Hippokampus noch keine schwere Amnesie verursacht und erst durch zusätzliche Läsionen im perirhinalen und parahippokampalen Kortex massive Gedächtnisverluste nachgewiesen werden (Squire 1992). Studien mit bildgebenden Verfahren wiesen bei expliziten Gedächtnisleistungen eine erhöhte neuronale Aktivität im Hippokampus nach; bei impliziten Gedächtnisleistungen war dagegen keine neuronale Aktivität im Hippokampus nachweisbar (Schacter et al. 1996). 1.4.5. Synaptischer Speichermechanismus für das deklarative Gedächtnis Auf molekularer Ebene beruht der Lernprozess auf der Plastizität von Neuronen v. a. im Kortex, Hippokampus und den limbischen Regionen. Das heißt z. B., dass Synapsen verstärkt werden können, wenn prä- und postsynaptische Nervenzellen in einem gleichen, sehr engen Zeitfenster aktiv sind („Hebbsche Regel“). Kurzfristige Lernvorgänge im Bereich des Ultrakurzzeit- und des Arbeitsgedächtnisses erfolgen vermutlich im Wesentlichen durch bioelektrische Veränderungen, z. B. Änderungen der Leitfähigkeit von Kaliumionen. Dagegen ist die Langzeitspeicherung vermutlich mit dauerhaften Änderungen in der Neuronenmorphologie und der Proteinbiosynthese verbunden (Squire u. Kandel 1999). Eine besonders hohe synaptische Verstärkung wird als Langzeitpotenzierung (LPT) bezeichnet. Sie entsteht z. B. durch hochfrequente Reizung der CA 3-Fasern (Schaffer-Kollateralen) im Hippokampus und kann Stunden bis Tage stabil bleiben. Äußerst wichtig für die Induktion dieses Prozesses 22 ist der N-Methyl-D-Aspartat (NMDA) Rezeptor, ein Subtyp des Glutamatrezeptors. Wird dieser Rezeptor blockiert (z. B. durch Medikamente oder genetische Veränderungen), so verschlechtert sich die Aufnahme von hippokampusabhängigen Lerninhalten (Bliss u. Collingridge 1993; Shapiro 2001). Molekularbiologische Studien weisen darauf hin, dass Kortisol maßgeblich mit Neurosteroiden (z. B. Pregnenolon, Prengnenolonsulfat, Progesteron) interagiert und somit einen mittelbaren Einfluss auf deren Wirkung an Oberflächenrezeptoren von Nervenzellen wie z. B. GABA-A und NMDA in gedächtnisrelevanten Bereichen haben könnte (Wolkowitz et al. 2009). 1.5. Zusammenfassung und Fragestellungen Die Hochdosis-Glukokortikoidtherapie gilt bei der Behandlung eines akuten Schubes einer MS als etablierte Standardtherapie, wobei zunehmend auch ultrahohe Dosen eingesetzt werden. Der Einfluss hoher Dosen Glukokortikoide auf das kognitive Leistungsniveau der MS-Patienten ist jedoch bislang nur unzureichend geklärt, obwohl bei MS-Patienten schon in frühen Stadien der Erkrankung per se kognitive Defizite vorliegen und somit die Gefahr einer Verschlechterung der vorbestehenden Beeinträchtigungen gegeben ist. Zu Beginn der vorliegenden Untersuchung lagen lediglich Daten aus einer Studie von Oliveri und Mitarbeitern (1998) vor, die an 14 Patienten die Auswirkungen einer Kortisonbehandlung auf kognitive Leistungen untersuchten und eine reversible, dosisunabhängige Verschlechterung der deklarativen Gedächtnisleistung fanden. Auch wenn diese Befunde damit erstmals auf einen Zusammenhang von Kortisonbehandlung und Kognition bei MS-Patienten verwiesen, war die Verwertbarkeit dieser Ergebnisse aufgrund der kleinen Fallzahl, stark variierender Dosierung (3 Dosisgruppen: 4 Patienten mit 2,5 g über 5 Tage, 5 Patienten mit 5 g über 7 Tage, 5 Pat mit 10 g über 5 Tage verteilt) und einer vergleichsweise begrenzten neuropsychologischen Testbatterie (7 Verfahren) beschränkt. Ziel der vorliegenden Untersuchung war es daher, eine breitere empirische Basis zu erhalten und weitere neuropsychologische Funktionsparameter Kortisontherapie bei MS-Patienten systematischer zu untersuchen. 23 unter Konkret ergaben sich für die vorliegende Arbeit folgende Fragestellungen: 1. Führt die Hochdosis-Glukokortikoidtherapie bei Patienten mit einem akuten Schub einer Multiplen Sklerose zu einer Abnahme der kognitiven Leistungen, insbesondere der deklarativen Gedächtnisleistung? 2. Sind die Beeinträchtigungen reversibel? 3. Sind die Effekte dosisabhängig? Um diese Fragestellungen zu beantworten, wurden mittels eines Prä-Post-Settings die Auswirkungen der Hochdosis-Glukokortikoidtherapie mit Methylprednisolon (MP) in zwei unterschiedlichen Dosen (500 versus 2000 mg/Tag, jeweils intravenös über 5 Tage) auf die kognitiven Leistungen von MS-Patienten untersucht. 24 2. Material und Methodik 2.1. Studiendesign Die Untersuchung erfolgte als explorative, randomisierte und doppelblinde Dosisvergleichsstudie. Untersucht wurden die Auswirkungen der HochdosisKortikosteroidtherapie mit Methylprednisolon (MP) in zwei unterschiedlichen Dosen (500 mg versus 2000 mg) auf kognitive Funktionsparameter. Es wurden 30 Patienten beiderlei Geschlechts mit einer Erstmanifestation einer Multiplen Sklerose bzw. schubförmig verlaufender MS in frühem Krankheitsstadium untersucht. Ausschlusskriterien Beeinträchtigungen, psychiatrische begleitende Erkrankungen, waren oder eine der visuelle oder vorbestehende akuten handmotorische neurologische Episode und vorausgegangene Behandlung mit Kortikosteroiden in den letzten 12 Monaten oder ein Substanzmissbrauch in der Vorgeschichte. Die 10 gesunden, unbehandelten Kontrollpersonen waren hinsichtlich Alter, Geschlecht und intellektuellem Ausgangsniveau den Patienten vergleichbar. Oben genannte Ausschlusskriterien galten auch für die Gruppe der Kontrollpersonen. Die Patienten wurden nach dem Zufallsprinzip gleichmäßig den beiden Dosisgruppen zugeteilt. Die Randomisierung erfolgte durch eine Mitarbeiterin der Abteilung Biometrie der Universität Ulm. Weder die Versuchsleiterin, welche die neuropsychologischen Untersuchungen durchführte, noch der behandelnde Arzt oder der betroffene Patient hatten Kenntnis über die jeweilige Höhe der von einem nicht an der Studie beteiligten Arzt verabreichten Dosis MP. Bei Nichtteilnahme an der Studie wurde den Patienten die reguläre Behandlung mit 1000 mg Methylprednisolon/Tag über 5 Tage angeboten. Die geplante Untersuchung wurde von der Ethikkommission der Universität Ulm geprüft; die Begutachtung wurde mit einem positiven Votum abgeschlossen (Schreiben vom 13.03.2001; Antrag Nr. 231/2000). 25 2.2. Stichprobe Die Patienten wurden über die Multiple-Sklerose-Sprechstunde sowie über den stationären Bereich der Neurologischen Universitätsklinik Ulm rekrutiert. Nachdem die Verdachtsdiagnose einer Erstmanifestation oder eines Schubes einer Multiplen Sklerose durch den behandelnden Arzt gestellt worden war, wurden die Patienten über das Ziel und den Verlauf der Studie sowie die Freiwilligkeit der Teilnahme aufgeklärt. Ausführlich wurde mit dem Patienten die doppelblinde, randomisierte Versuchsanordnung mit den Dosisarmen 500 mg Methylprednisolon/Tag versus 2000 mg Methylprednisolon/Tag sowie die reguläre Behandlung mit 1000 mg Methylprednisolon/Tag bei Nichtteilnahme an der Studie diskutiert. Eine schriftliche Information wurde ausgehändigt, die Einwilligung erfolgte ebenfalls mündlich und schriftlich. Um die Gefahr einer Konfundierung mit bereits bestehenden kognitiven Defiziten gering zu halten, wurden in die Patientengruppe nur solche Patienten eingeschlossen, die in der vor Behandlungsbeginn durchgeführten neuropsychologischen Baseline-Untersuchung in wenigstens 2/3 der Verfahren normwertige Leistungen zeigten. Es wurden 30 Patienten im Alter von 18 bis 62 Jahren in die Studie eingeschlossen, davon 16 für den Therapiearm 500 mg/d MP, 14 für den Therapiearm 2000 mg/d MP. Die Untersuchung einer neurologisch unauffälligen Kontrollgruppe sollte mögliche Übungseffekte bei der zweiten neuropsychologischen Untersuchung aufgrund des geringen Zeitabstandes zur ersten Untersuchung kontrollieren und ermöglichen, das Ausgangsniveau zwischen Patientengruppe und Kontrollgruppe zu vergleichen. Kontrollpersonen waren stationäre Patienten der orthopädischen Abteilung bzw. Freiwillige aus dem Bekanntenkreis der Studienbeteiligten. Da diese Gruppe kein Medikament erhielt, wurde im Aufklärungsgespräch nur auf den Verlauf und das Ziel der Studie sowie die Freiwilligkeit der Teilnahme hingewiesen. Die Einwilligung erfolgte mündlich und schriftlich. Bei den Kontrollpersonen neuropsychologische Untersuchungen im Abstand von 5 Tagen statt. 26 fanden zwei 2.3. Versuchsablauf Die Patienten wurden vor Behandlungsbeginn klinisch-neurologisch (incl. Erhebung der „Expanded Disability Status Scale“, EDSS) und neuropsychologisch untersucht. Eine zweite neuropsychologische Untersuchung erfolgte nach Abschluss der Methylprednisolontherapie, d. h. nach 5 Tagen; eine dritte nach 2 Monaten. Eine kernspintomographische Untersuchung wurde im Rahmen der standardmäßigen Behandlung durchgeführt, die Aufnahmen wurden im Rahmen der Studie hinsichtlich Lage, Anzahl und Größe der MS-typischen Läsionen beurteilt. Zu allen drei Messzeitpunkten fanden Blutentnahmen statt; zum einen zur Bestimmung der Methylprednisolonplasmakonzentration, zum anderen als Basis für weiterführende neuroimmunologische Untersuchungen. Die Bestimmung der visuell evozierten Potentiale (VEP) erfolgte ebenfalls im Rahmen der Standarddiagnostik bei fast allen Patienten. Bei einem Großteil der Patienten erfolgte – ebenfalls im Rahmen der Standarddiagnostik – eine Liquoruntersuchung. Tabelle 1: Versuchsablauf Tag -1 Patienten Kontrollen Stationäre Aufnahme, Untersuchungen Einwilligung der zur Diagnosesicherung (körperliche Kontrollperson. Untersuchung, MRT, Liquorpunktion). Vorstellung der Studie, Einwilligung des Patienten. Tag 0 1. Neuropsychologische Untersuchung. 1. Neuropsychologische Untersuchung. Tag 1 – Tag 5 Tägliche Verabreichung des Methyl- Keine Medikamentengabe. Prednisolons (500 vs 2000 mg). Tag 1, 3, 5: Blutentnahme unmittelbar vor und 2 Std. nach Gabe Methylprednisolon. Tag 6 2. Neuropsychologische Untersuchung. 2. Neuropsychologische Untersuchung. Tag 60 3. Neuropsychologische Untersuchung, körperliche Untersuchung, Blutentnahme, evtl. VEP/MRT. 27 Im Hinblick auf die schon im Frühstadium der MS regelhaft zu beobachtenden Defizite v. a. im Bereich des Gedächtnisses, der Aufmerksamkeit und der exekutiven Funktionen standen im Zentrum der kognitiven Untersuchung die ausführliche Evaluation des verbalen und nonverbalen Arbeitsgedächtnisses, des deklarativen (Lernen, Abruf und Wiedererkennung für verbale und visuelle Modalität) sowie des impliziten Gedächtnisses (Priming). Als weitere Funktionsparameter wurden verschiedene Aufmerksamkeitsmaße (Verarbeitungsgeschwindigkeit, selektive und geteilte Aufmerksamkeit), exekutive Funktionen (Planen, Problemlösen) sowie das allgemeine intellektuelle Leistungsniveau erhoben. Zusätzlich wurden Selbst- und Fremdeinschätzungen der psychischen Befindlichkeit (Depression, Manie, Angst) eingeholt und das Ausmaß der subjektiven Gedächtnisbeeinträchtigung erfragt. Die Untersuchungen erfolgten in Form von standardisierten, an Gesunden normierten psychometrischen Tests, zum Teil Papier-Bleistift-Tests, zum Teil PCgestützte Verfahren. Die Untersuchungen dauerten jeweils ca. 3 Stunden mit 2 Pausen von jeweils 10-15 Minuten. Um mögliche Lerneffekte durch wiederholte Testdarbietung während der Verlaufskontrollen zu minimieren, wurden, soweit verfügbar, Parallelversionen eingesetzt, die ausbalanciert für die sechs möglichen Kombinationen ABC, ACB, BCA, BAC, CAB und CBA randomisiert vorgegeben wurden. Im Einzelnen wurden folgende Untersuchungen durchgeführt: 2.3.1. Erfassung der Aufmerksamkeit und Verarbeitungsgeschwindigkeit Die Erfassung der Aufmerksamkeit erfolgte mit der Testbatterie zur Aufmerksamkeitsprüfung (Fimm u. Zimmermann 1993). Es handelt sich um eine computergestützte Aufmerksamkeitstestbatterie. Im Rahmen der vorgestellten Untersuchung wurden für den Bereich der Aufmerksamkeit die Subtests „Alertness“, „geteilte Aufmerksamkeit“ und „Inkompatibilität“ angewandt. 28 a) Alertness Unter Alertness ist zunächst der allgemeine Wachzustand zu verstehen, der es einer Person erlaubt, schnell und angemessen auf konkrete Anforderungen zu reagieren. Es ist die Voraussetzung für ein adäquates Handeln und stellt insofern die Basis jeder Aufmerksamkeitsleistung dar. In dem angewandten Test wurde die Reaktionszeit unter zwei Bedingungen untersucht. Zum einen als einfache Reaktionszeitmessung, bei der in zufällig variierenden Intervallen ein Kreuz auf dem Bildschirm erscheint, auf das so schnell wie möglich mit einem Tastendruck reagiert werden soll, zum anderen nach vorheriger Präsentation eines Warntones. b) Geteilte Aufmerksamkeit Im Alltag kommt es häufig darauf an, mehrere Dinge gleichzeitig im Auge behalten oder beachten zu müssen. Dies erfordert die Fähigkeit zur Teilung der Aufmerksamkeit auf simultan ablaufende Prozesse. Geprüft wurde die geteilte Aufmerksamkeit mittels "dual-task" Aufgaben, in denen gleichzeitig zwei Reizdarbietungen beachtet werden mussten. In diesem Test wurde dies durch eine optische und eine akustische Aufgabe gewährleistet. Der Proband sollte eine Taste drücken, wenn er entweder einen tiefen oder einen hohen Ton zweimal hintereinander gehört hatte (Bedingung 1). Zudem sollte er die Taste drücken, wenn eine bestimmte Figur (4 Kreuze bilden ein Quadrat) auf dem Bildschirm erschien (Bedingung 2). Erfasst wurden Reaktionsgeschwindigkeit, Summe der Fehler und Auslassungen. c) Inkompatibilität Inkompatibilität tritt in einer Konfliktsituation auf, bei der verschiedene Reizinformationen parallel verarbeitet werden und dabei eine Interferenz zwischen verschiedenen Reaktionstendenzen ausgelöst wird. Bei dem hier applizierten TAPUntertest wurden auf dem Bildschirm links oder rechts von einem Fixationspunkt Pfeile gezeigt, die nach rechts oder nach links zeigten. Die Versuchsperson sollte je nach Pfeilrichtung mit der rechten oder linken Hand reagieren, und zwar unabhängig von der Seite der Präsentation auf dem Bildschirm. 29 2.3.2. Untersuchung des Gedächtnisses Untersucht wurden das Arbeitsgedächtnis, das deklarative Gedächtnis und das implizite Gedächtnis. 2.3.2.1. Untersuchung des Arbeitsgedächtnisses Die Gedächtnisspanne gibt Hinweise auf die Kapazität des Primärgedächtnisses, d. h. die Menge an Information, die eine Person kurzfristig, „am Stück“, speichern kann. Einschränkungen der Kapazität des Primärgedächtnisses setzen den Möglichkeiten der Informationsverarbeitung deutliche Grenzen. Die Untersuchung erfolgt mit der Methode des unmittelbaren seriellen Reproduzierens. Dabei wird Information im Sekundentakt dargeboten, die anschließend vom Probanden in der gleichen Reihenfolge zu reproduzieren ist. a) HAWIE-R: Zahlen nachsprechen vorwärts Beim HAWIE-R handelt es sich um die Neubearbeitung des Hamburg-WechslerIntelligenztests für Erwachsene in Anlehnung an die Wechsler Adult Intelligence Scale-R von Wechsler (Tewes 1991). Im Subtest „Zahlen nachsprechen vorwärts“ wird dem Probanden eine Abfolge mehrerer Zahlen im Sekundenabstand vorgelesen, die der Proband unmittelbar danach in der gleichen Reihenfolge reproduzieren soll. Die Untersuchung beginnt mit einer Dreiersequenz und steigert sich bei richtiger Wiedergabe fortlaufend um eine Ziffer bis zur Neunersequenz, wobei jeweils zwei Durchgänge pro Zahlenspanne erfolgen. Der Test wird beendet, wenn der Proband eine bestimmte Itemlänge auch beim zweiten Mal (mit jeweils neuen Zahlen) nicht korrekt wiederholen kann. Als Maß für die Zahlen- bzw. Gedächtnisspanne diente in der vorliegenden Untersuchung die Anzahl der Items der längsten noch richtig reproduzierten Sequenz. b) HAWIE-R: Zahlen nachsprechen rückwärts Eine vom Versuchsleiter vorgesprochene Zahlensequenz muss in umgekehrter Reihenfolge wiedergegeben werden. Die Anzahl richtig reproduzierter Items liefert Hinweise auf mögliche Beeinträchtigungen beim gleichzeitigen Halten und Verarbeiten von Information. 30 c) TAP: Arbeitsgedächtnis Dieser Subtest aus der Testbatterie zur Aufmerksamkeitsprüfung erfordert ebenfalls wie der Subtest „Zahlen nachsprechen rückwärts“ aus dem HAWIE-R das gleichzeitige Halten und Verarbeiten von Information. Auf dem Bildschirm erscheinen in kurzer Folge Zahlen. Der Proband muss durch eine kontinuierliche Kontrolle des Informationsflusses durch den Kurzzeitspeicher immer dann reagieren, wenn die jeweils vorletzte Zahl wiederholt wird. Gemessen werden die Reaktionszeit sowie die Anzahl der Fehler. c) Block-Tapping-Test von P. Corsi (Milner 1971) Mittels eines standardisierten Block-Boards, auf dem 9 Holzblöcke unregelmäßig verteilt sind, wird die Gedächtnisspanne für visuell-räumliche Information (unmittelbare Blockspanne) bestimmt. Der Versuchsleiter tippt eine Reihe von Blöcken auf dem Block-Board an, der Proband soll unmittelbar danach diese Sequenz auf dem Block-Board korrekt reproduzieren. Das weitere Vorgehen und das Abbruchkriterium entsprechen dem bei der Bestimmung der Zahlenspanne. Die Blockspanne eines Probanden liegt meistens 1 Item unter der Zahlenspanne. 2.3.2.2. Deklaratives Gedächtnis Geprüft wurden verbale und nonverbale Modalität; zum Einsatz kamen der Wortpaarassoziationslerntest, der Münchner Verbale Gedächtnistest, der Subtest „Gedächtnis“ aus dem Wilde Intelligenz Test sowie der Benton-Test. a) Wortpaarassoziationslerntest (Schuri 1988) Im hier verwendeten Wortpaarassoziationslerntest (Wort-PAL) werden acht semantisch nur schwach assoziierte Wortpaare insgesamt viermal in jeweils anderer zeitlicher Abfolge (z. B. wird ein im ersten Durchgang an erster Stelle genanntes Wortpaar an dritter Stelle genannt) mit der Aufforderung präsentiert, sich die Begriffe gut einzuprägen. Nach jedem Lerndurchgang wird jeweils das erste Wort eines Paares vorgegeben und der Proband soll den zweiten, dazugehörigen Begriff nennen. Als Maß für die Lernleistung gilt die Summe aller richtigen Antworten (max. RW=32). Um die längerfristige Behaltensleistung zu prüfen, wurde zusätzlich ein freier Abruf des Wort-PAL nach 90 Minuten durchgeführt. Es liegen drei parallele Versionen vor. 31 b) Revidierter Münchner Verbaler Gedächtnistest MVGT (Steidl 1999) Der MVGT wurde in Anlehnung an den California Verbal Learning Test (Delis et al., 1987, zitiert nach Lezak, 1995) von Ilmberger (1998; zitiert nach Steidl, 1999) für den deutschen Sprachraum konzipiert und hier in seiner revidierten Form verwendet. Der in 3 Parallelversionen vorliegende Gedächtnistest ermöglicht eine gleichzeitige Untersuchung von Qualität und Quantität der verbalen Lern- und Gedächtnisleistung. Der Proband soll 15 Wörter in 5 Lerndurchgängen nach dem Vorlesen durch den Versuchsleiter frei reproduzieren. Anschließend erfolgt einmalig eine freie Reproduktion einer Interferenzliste, danach ist die zuerst gelernte Wortliste nochmals zu reproduzieren. Der Abruf dieser Liste erfolgt dabei sowohl frei ohne weitere Hilfen (umittelbarer freier Abruf) als auch unter vorheriger Vorgabe von kategorienspezifischen Hinweisreizen (unmittelbarer gestützter Abruf). Ein weiterer freier und gestützter Informationsabruf schließt sich nach 30 Minuten an, gefolgt von einer Wiedererkennungsaufgabe, bei dem die zu identifizierenden Items in eine Liste von Distraktoren eingestreut und zu benennen sind. Um darüber hinaus auch die längerfristige Behaltensleistung jenseits einer Stunde zu prüfen, wurde in der hier verwendeten Versuchsanordnung zusätzlich zum Standardprotokoll ein nochmaliger freier bzw. gestützter Informationsabruf nach 90 Minuten durchgeführt. Als Maße für die Lern- und Behaltensleistung wurden dementsprechend die Summe der richtig reproduzierten Items in den fünf Lerndurchgängen (max. RW=75) sowie die Anzahl der korrekt erinnerten Worte in den einzelnen Abruf- und Wiedererkennungsbedingungen (jeweils max. RW=15) erfasst. c) Wilde Intelligenz Test (Jäger u. Althoff 1983) Aus dem Wilde Intelligenz Test (WIT) von Jäger und Althoff wurde der Subtest „Gedächtnis“ zur Überprüfung der längerfristigen Merkfähigkeit relativ einfacher Sachverhalte herangezogen, wobei die Informationen in Textform vorgelegt wurden. Der Proband soll sich innerhalb von 3 Minuten den Lebenslauf einer fiktiven Person aneignen. Das Gedächtnismaterial besteht sowohl aus verbalen Informationen (Namen, Adressen, Telefonnummern usw.) als auch aus Portraitaufnahmen verschiedener Personen. Nach ca. 45 Minuten sind Einzelheiten wiederzuerkennen bzw. frei zu reproduzieren. Um über die zwei vorliegenden Parallelformen des Originaltests hinaus eine dritte parallele Version zu erhalten, wurde abweichend vom 32 ursprünglichen Testprotokoll, das auf zwei Lebensläufen basiert, jeweils nur der Lebenslauf einer Person verwendet. d) Benton-Test (Benton 1995) Der Benton-Test ist ein non-verbales Verfahren zur Überprüfung der kurzfristigen Behaltensleistung visueller Information; in der Zeichenform geht auch die visuokonstruktive Koordination in die Leistung ein. Der Test besteht aus 10 Serien mit graphischen Stimuluskarten, die jeweils eine bis drei einfache geometrische Figuren enthalten, die vom Probanden nachgezeichnet werden. Dem Probanden wird jeweils eine Stimuluskarte für 10 Sekunden gezeigt; die Figur der Karte soll in der hier gewählten Version nach einer kurzen Wartezeit von 15 Sekunden so genau wie möglich nachgezeichnet werden. Bei der Auswertung werden die Anzahl der richtigen Reproduktionen und die Anzahl der einzelnen Fehler bestimmt. Es existieren drei Parallelserien von je 10 Stimuluskarten (C, D, E). 2.3.2.3. Implizites Gedächtnis a) Bielefelder Affektiver Wörtertest (Fujiwara und Markowitsch, unveröffentlicht) Dem Probanden werden 15 Karten mit jeweils einem deutschen Substantiv vorgelegt, die hinsichtlich des subjektiven Erlebens in die Kategorien „positiv“, „neutral“ oder „negativ“ eingeteilt werden sollen. Nach 30 Minuten wird der Proband aufgefordert, möglichst viele dieser Substantive aus dem Gedächtnis zu erinnern. Da dem Probanden in der Akquisitionsphase nicht mitgeteilt wird, dass es sich um einen Gedächtnistest handelt und er die gesehenen Wörter reproduzieren soll, kann so der implizite Lernvorgang (Encodierung und Abspeicherung) überprüft werden; der Abruf erfolgt jedoch explizit. 2.3.3. Exekutive Funktionen Mittels der exekutiven Funktionen steuert das Individuum zielgerichtet seine Handlungen und reguliert sein Verhalten. Eine Beeinträchtigung der Leistung in den exekutiven Funktionen wird assoziiert mit Läsionen im Frontallappen. Zur Beurteilung der exekutiven Funktionen wurde hier die kognitive Flexibilität („Denkflüssigkeit“) überprüft. 33 a) Five-point Test (Regard et al. 1982) In dieser “figural fluency”- Aufgabe erhält der Proband die Aufgabe, innerhalb von 3 Minuten auf einem DIN-A-4 Bogen mit 35 Quadraten, die jeweils 5 symmetrisch angeordnete Punkte enthalten, durch Verbinden dieser Punkte eine Figur zu zeichnen. Ziel ist, möglichst viele unterschiedliche Figuren zu zeichnen. Ausgewertet wird die Summe aller gezeichneten Figuren abzüglich der Wiederholungen. Erfasst wird so die spontane, figurale Ideenproduktion. b) Controlled Oral Word Association Test (COWAT; Benton und Hamsher 1976) In dieser “verbal fluency” – Aufgabe sollen in jeweils einer Minute möglichst viele deutsche Substantive (keine Eigennamen) genannt werden, die mit dem gleichen Buchstaben beginnen (zunächst: F, dann A, dann S), wobei Perseverationen (auch identische Wortstämme) vermieden werden sollten. Gezählt wird die Summe aller gültigen Wörter in 3 Minuten. So wird die spontane, verbale Ideenproduktion erfasst. c) Supermarkt (Kessler, Denzler und Markowitsch 1999) Untertest des Demenztests der o. g. Autoren und ebenfalls eine „verbal fluency“Aufgabe, bei welcher der Proband innerhalb von 3 Minuten möglichst viele Dinge aufzählen soll, die man im Supermarkt kaufen kann. 2.3.4. Allgemeine kognitive Leistungsfähigkeit a) HAWIE-R: Mosaiktest (MT) Der Mosaiktest ist ein Subtest des Hamburg-Wechsler-Intelligenztests für Erwachsene (HAWIE-R). Der Proband soll 6 bzw. 9 rot-weiße Würfel zu einer vorgegebenen Gesamtfigur zusammensetzen. Wechsler bezeichnet den MT als geeignetes Verfahren zur Erfassung der allgemeinen Intelligenz, wobei insbesondere die Fähigkeit zum problemlösenden Denken erfasst wird. Klinisch besitzt der Mosaiktest eine hohe Sensitivität für räumlich-konstruktive Störungen; zusätzlich erfasst der MT indirekt die Fähigkeit zur Größentransformation, da die Vorlage genau ¼ der Größe der aus Würfeln zusammengesetzten Figur hat. b) Wortschatztest (WST; Schmidt und Metzler 1992) Mittels des WST ist es möglich, eine rasche Einschätzung des verbalen Intelligenzniveaus vorzunehmen und das Sprachverständnis zu beurteilen. Zudem 34 kann das prämorbide Intelligenzniveau bei leichten bis mittelschweren hirnorganisch bedingten Beeinträchtigungen abgeschätzt werden und eine Verlaufsbeurteilung bei Demenzen vorgenommen werden. Die Versuchsperson soll 40 Aufgaben zur Wiedererkennung von Wörtern lösen. Eine Testaufgabe besteht aus einem Zielwort und 5 Distraktoren. Die Versuchsperson soll das Zielwort in jeder Zeile durchstreichen. Die Schwierigkeit ist im Verlauf des Tests ansteigend. 2.3.5. Selbstbeurteilungsskalen a) Fragebogen zur Erfassung von Gedächtnisleistung im Alltag (Bennett-Levi und Powell 1980) Bei dem hier verwendeten Fragenbogen zur Selbsteinschätzung der Gedächtnisleistung im Alltag (FEGA) handelt es sich um eine unveröffentlichte deutsche Übersetzung des „subjective Memory Questionnaire (SQM)“ von BennettLevi und Powell. Ihrer Meinung nach sei es nicht möglich, durch traditionelle, objektive Tests adäquate Informationen über die tatsächliche Beeinträchtigung eines Probanden im Alltag zu erhalten. Insgesamt umfasst der Fragebogen 40 Fragen bezüglich Gedächtnisproblemen in alltäglichen Situationen, die vom Patienten durch eine vierstufige Ratingskala beantwortet werden sollen. b) Beck-Depressions-Inventar (BDI; Beck 1961, deutsche Version Hautzinger et al. 1994) Das Beck-Depressions-Inventar erfasst unabhängig von einer spezifischen Depressionstheorie wesentliche Symptome einer Depression und ermöglicht so eine Unterscheidung zwischen depressiven und nicht-depressiven Probanden bzw. gibt einen Hinweis auf die Schwere der Depression. Die Symptome werden vom Probanden hinsichtlich ihres Auftretens in den letzten 2 Wochen und ihrer Intensität angegeben. Jedes Item wird in vier Feststellungen erfasst, welche die unterschiedliche Schwere des Symptoms ausdrücken. Den Statements ist ein Punktwert zwischen 0 (nicht vorhanden) bis 3 (starke Ausprägung) zugewiesen. Die Punkte werden zu einem Gesamtscore (max. 63) aufaddiert, der Auskunft gibt über die Schwere der depressiven Symptomatik. 9-13 Punkte verweisen auf eine minimale, 14 bis 19 Punkte auf eine leichte, 20-28 Punkte auf eine mittelschwere und mehr als 29 Punkte auf eine schwere depressive Symptomatik. 35 c) Neuropsychiatrisches Inventar (NPI; Cummings 1994) Das Neuropsychiatrische Inventar listet Häufigkeit, Schweregrad und Belastung von Patient und Umgebung durch Verhaltensauffälligkeiten auf. Erfasst werden Wahnvorstellungen, Halluzinationen, Erregung, Aggression, Depression/Dysphorie, Angst, Euphorie, Apathie, Enthemmung, Reizbarkeit, Abweichen der Motorik, Schlafstörungen, Appetit und Essstörungen. Das NPI wird gewöhnlich von Bezugspersonen der Betreffenden ausgefüllt. In unserer Untersuchung basierte die Beurteilung auf Berichten der Betreffenden selbst und dem klinischen Eindruck des Untersuchers. Es wurden die Subskalen Depression, Euphorie und Angst verwendet. Tabelle 2: Ablauf der neuropsychologischen Untersuchung Test Untersuchte Funktion Aufgabe Bielefelder Affektiver Wörtertest Implizites Gedächtnis Abruf einer Liste von 15 Wörtern (BAWT) 30 min nach Präsentation. Bei der Präsentation wurden die Wörter in Kategorien eingeteilt, aber nicht bewusst gelernt. Wortpaarassoziationslernen Deklaratives Gedächtnis (verbal) (PAL) Lernen einer Liste von 8 Wortpaaren (4 Durchgänge) und Abruf nach 90 Minuten nach Präsentation des ersten Wortes jeden Paares. Zahlen nachsprechen vorwärts Arbeitsgedächtnis (verbal) und rückwärts (HAWIE-R) Block-Tapping-Test (Corsi) Wiederholung von Zahlenfolgen vorwärts/rückwärts. Arbeitsgedächtnis (non-verbal, Wiedergabe der gezeigten Sequenz visuell-räumlich) auf dem „Block-Board“. Benton Visual Retention Test Deklaratives Gedächtnis (non- Verzögerte Wiedergabe von 10 (BVRT) verbal) visuell präsentierten Zeichnungen. Revidierter Münchner Verbaler Deklaratives Gedächtnis (verbal) Lernen einer Liste mit 15 Wörtern Gedächtnistest (MVGT) (5 Durchgänge) und sofortige und Wiedergabe, dazwischen Lernen einer Interferenzliste. Alertness (TAP) Verarbeitungsgeschwindigkeit Reaktionsgeschwindigkeit auf einen visuellen Reiz; mit und ohne Warnton. 36 Geteilte Aufmerksamkeit (TAP) Geteilte Aufmerksamkeit Reaktionsgeschwindigkeit auf simultan präsentierte visuelle und akustische Reize. Arbeitsgedächtnis (TAP) Arbeitsgedächtnis (verbal) Reaktionsgeschwindigkeit auf die Präsentation der jeweils vorletzten Zahl. MVGT Deklaratives Gedächtnis (verbal) Freie Wiedergabe der Wörterliste nach 30 Minuten. Inkompatibilität (TAP) Selektive Aufmerksamkeit, Reaktionsgeschwindigkeit auf links Interferenz oder rechtsseitig gerichtete visuelle Reize, die mit der Seite der Präsentation auf dem Bildschirm interferieren. Wilde Intelligenz Test (WIT), Deklaratives Gedächtnis (verbal) Aneignung Lernen von Einzelheiten einer komplexen Geschichte innerhalb von 3 Minuten. Controlled Oral Word Exekutive Funktionen: kognitive Nennen von möglichst vielen Association Test (COWAT) Flexibilität, Wortflüssigkeit Substantiven, die mit dem gleichen Buchstaben beginnen. Jeweils 1 Minute Zeit für einen Buchstaben (F, A, S). Five-Point Test Exekutive Funktionen: Entwerfen von möglichst vielen Kognitive Flexibilität, unterschiedlichen Figuren aus 5 Spontane figurale Ideenproduktion Punkten innerhalb von 3 Minuten. Exekutive Funktionen: Nennen von möglichst vielen Kognitive Flexibilität, Dingen, die man im Supermarkt Wortflüssigkeit einkaufen kann. Zeit: 3 Minuten. Fragebogen zur Erfassung von Selbstbeurteilung der Beantwortung von 40 Fragen bzgl. Gedächtnisleistung im Alltag Gedächtnisleistung: Gedächtnisproblemen in alltäglichen (FEGA) „Alltagsgedächtnis“ Situationen auf einer vierstufigen Supermarkt Ratingskala. Beck-Depressions-Inventar (BDI) Depression Selbstbeurteilungsskala bezüglich depressiver Symptome, 21 Fragen, 4-stufige Skala. 37 Neuropsychiatrisches Inventar Depression, Manie, Angst Beurteilung von Verhaltens- (NPI); Subskalen Depression, auffälligkeiten durch Pat. selbst, Euphorie, Angst Untersucher und ggf. Pflegekraft. Wilde Intelligenz Test (WIT), Deklaratives Gedächtnis (verbal) Beantwortung von 17 Multiple- Abruf Choice-basierten Fragen zur 45 Minuten zuvor gelernten Geschichte. MVGT Deklaratives Gedächtnis (verbal) Freie und gestützte Wiedergabe der Wörterliste nach 90 Minuten. Wortpaarassoziationslerntest Deklaratives Gedächtnis (verbal) Freie Wiedergabe nach 90 Minuten. Allgemeine Intelligenz, Zusammensetzen von 6, später 9 insbesondere Fähigkeit zum rot-weißen Würfeln zu einer auf problemlösenden und räumlich- einer Zeichnung vorgegebenen konstruktiven Denken. Gesamtfigur; Erfassung der Zeit. (PAL) Mosaiktest (HAWIE-R) Verwendung nur in erster Untersuchung. Wortschatztest (WST) Verbales, prämorbides Identifikation eines jeweils korrekten Intelligenzniveau. Wortes aus 40 Serien von Wörtern. 2.4. Statistische Datenanalyse Die statistische Auswertung der Daten erfolgte mit SPSS (Statistical Package für Social Sciences), Version 10.0 für Windows. Zum Vergleich der soziodemographischen Charakteristika von Patienten und Kontrollpersonen wurden Chi-Quadrat-Test und T-Test für unverbundene Stichproben eingesetzt, letzterer zudem zur Beurteilung der Frage, ob sich beide Gruppen möglicherweise in ihren Testleistungen unterscheiden. Mittels T-Tests für verbundene Stichproben wurde geprüft, ob sich die kognitiven Leistungen der Kontrollpersonen im Verlauf verändern, mittels Paarvergleichen Varianzanalyse (ANOVA) Methylprednisolonbehandlung mit wurden auf die Messwiederholungen mögliche kognitiven und post-hoc Auswirkungen Leistungen der der Patienten untersucht. Ergebnisse wurden als statistisch signifikant angesehen im Fall von p≤0,0 38 3. Ergebnisse 3.1. Soziodemographische Daten 3.1.1. Patienten und Kontrollen Die Kontrollgruppe bestand aus 8 Frauen und 2 Männern im Alter von 18-52 Jahren. Sechs Kontrollpersonen hatten das Abitur absolviert, drei die Mittlere Reife und eine Person hatte einen Hauptschulabschluss. Tabelle 3: Vergleich der soziodemographischen Daten der Patienten- und Kontrollgruppe. M: Mittelwert, SD: Standardabweichung. Patientengruppe (n=30) M (SD) Kontrollgruppe (n=10) M (SD) T-Test¹ Chi-Quadrat-Test² Alter 35,7 (10,77) 32,4 (12,64) p=0,427¹ Geschlecht w m 20 10 8 2 p=0,693² Schulbesuchsjahre 10,66 (1,72) 11,70 (1,70) p=0,109¹ Zwischen Patienten und Kontrollen ergab sich kein statistisch signifikanter Unterschied in Bezug auf das Alter (p=0,427), Geschlecht (p=0,693) und Schulbesuchsjahren (p=0,233). 3.1.2. Patienten: Gruppe 500 mg versus Gruppe 2000 mg In der Patientengruppe befanden sich 20 Frauen und 10 Männer im Alter zwischen 18 und 62 Jahren. 11 Patienten hatten das Abitur, 8 die Mittlere Reife und 10 den Hauptschulabschluss absolviert. Tabelle 4: Vergleich der soziodemographischen der beiden Patientengruppen. M: Mittelwert, SD: Standardabweichung. (Pat-) Gruppe 1 (500 mg MP, n=16) M (SD) (Pat-) Gruppe 2 (2000 mg MP, n=14) M (SD) T-Test¹ Chi-Quadrat-Test² Alter 35,88 (11,56) 35,5 (10,21) p=0,912¹ Geschlecht w m 8 8 12 2 p=0,058² Schulbesuchsjahre 10,56 (1,750) 10,79 (1,762) p=0,731¹ 39 Bezüglich Alter (p=0,912), Geschlecht (p=0,058) und Schulbesuchsjahren (p=0,731) ergaben sich keine signifikanten Unterschiede zwischen den zwei Dosisgruppen. 3.2. Klinische Daten der beiden Patientengruppen Zum Zeitpunkt des Einschlusses in die Studie waren 16 Patienten an einer unilateralen Optikusneuritis oder Retrobulbärneuritis erkrankt, 11 hatten vor allem sensorische und 6 vor allem motorische Defizite. Eine Ersterkrankung lag bei 11 Patienten vor. Tabelle 5: Klinische Daten der beiden Patientengruppen. T1: Längsrelaxation im MRT, T2: Querrelaxation, Gd: Gadolinium, EDSS: Expanded Disability Status Scale, MP: Methylprednisolon, M: Mittelwert, SD: Standardabweichung. (Pat-) Gruppe 1 (500 mg MP, n=16) M (SD) (Pat-) Gruppe 2 (2000 mg MP, n=14) M (SD) T-Test¹ Chi-Quadrat-Test² Anzahl der Krankheitsschübe 1,7 1,6 p=0,379² T1-Läsionen 0,86 (1,50) 1,76 (3,24) p=0,343¹ T2-Läsionen 5,73 (4,90) 8,53 (6,89) p=0,222¹ Gd-Läsionen (T1) 1,42 (3,17) 1,33 (1,55) p=0,926¹ EDSS Tag 0 2,59 (0,664) 2,89 (1,723) p=0,525¹ EDSS Tag 60 2,17 (0,651) 1,50 (0,879) p=0,046¹ Der durchschnittliche Wert der Expanded Disability Status Scale (EDSS) betrug 2,85 (SD: 0,718); das entspricht einer milden allgemeinen Behinderung, wie sie auch für den Studieneinschluss gefordert wurde. Bei 24 Patienten wurde zum Zeitpunkt der Aufnahme eine Liquoruntersuchung durchgeführt; bei 18 (11 aus Gruppe 1; 7 aus Gruppe 2) zeigten sich oligoklonale Banden. Bei 5 Patienten (2 aus Gruppe 1; 3 aus Gruppe 2) waren in Voruntersuchungen oligoklonale Banden nachgewiesen und die Liquordiagnostik nicht wiederholt worden. 5 Patienten zeigten einen normalen Liquorbefund (2 aus Gruppe 1; 3 aus Gruppe 2). Bei einer Patientin lag keine Liquoruntersuchung vor (Gruppe 2). Visuell evozierte Potentiale wurden bei 27 Patienten abgeleitet und zeigten in 21 Fällen (13 aus Gruppe 1; 8 aus Gruppe 2 verlängerte Latenzzeiten. 40 Die Anzahl der Krankheitsschübe, die Anzahl der MS-typischen Läsionen in der MRT-Untersuchung und der klinische Status (EDSS) zum Zeitpunkt Tag 0 zeigten keine statistisch signifikanten Unterschiede zwischen den beiden Dosisgruppen. Signifikant war der Unterschied in der klinischen Untersuchung (EDSS) am Tag 60; hier zeigte die Patientengruppe, die 2000 mg MP erhielt, einen geringeren Grad der Behinderung, was auf eine bessere klinische Wirksamkeit der höheren Dosierung von MP hinweist. 3.3. Leistung der Patienten und Kontrollen zum Zeitpunkt 0 Mittels T-Test für unverbundene Stichproben wurde geprüft, ob sich in der BaselineUntersuchung zum Zeitpunkt Tag 0, also vor der ersten Gabe von Methylprednisolon, bereits Unterschiede zwischen der Patienten- und Kontrollgruppe zeigen. 3.3.1. Arbeitsgedächtnis Tabelle 6: Vergleich der Patienten- und Kontrollgruppe zum Zeitpunkt 0: Arbeitsgedächtnis. HAWIE-R: Hamburg-Wechsler-Intelligenztests für Erwachsene, M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Patienten (n=30) M (SD) Kontrollen (n=10) M (SD) T-Test Arbeits- HAWIE-R: Zahlen 6,03 (1,033) 6,90 (1,197) p=0,033 gedächtnis nachspr. vorw. 4,43 (1,278) 5,30 (1,160) p=0,065 662,63 (248,328) 537,15 (119,567) p=0,134 2,33 (2,820) 1,30 (2,452) p=0,308 2,67 (2,869) 0,70 (1,252) p=0,044 HAWIE-R: Zahlen nachspr. rückw. Arbeitsgedächtnis, Median in msec. Arbeitsgedächtnis, ∑ Auslassungen Arbeitsgedächtnis, ∑ Fehler 41 Block-Tapping-Test 5,17 (0,699) 6,20 (0,789) p=0,000 (Corsi) Im Bereich des Arbeitsgedächtnisses erzielten die Kontrollen in 3 von 6 Untertests signifikant bessere Ergebnisse (HAWIE-R: Zahlen nachsprechen vorwärts: p=0,033, Arbeitsgedächtnis, ∑ Fehler: p=0,044, Block-Tapping-Test: p=0,000). 3.3.2. Deklaratives Gedächtnis Tabelle 7: Vergleich der Patienten- und Kontrollgruppe zum Zeitpunkt 0: Deklaratives Gedächtnis. Wort-PAL: Wortpaarassoziationslerntest, MVGT: Münchner Verbaler Gedächtnistest, M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Patienten (n=30) M (SD) Kontrollen (n=10) M (SD) T-Test Deklaratives Wort- PAL 19,00 (9,177) 26,40 (6,518) p=0,025 Gedächtnis ∑ Lernleistung 5,21 (2,889) 7,40 (0,843) p=0,022 59,30 (7,321) 65,90 (4,557) p=0,002 6,13 (1,737) 5,20 (1,135) p=0,063 12,50 (2,224) 13,80 (1,549) p=0,053 12,63 (2,266) 13,80 (1,874) p=0,151 12,87 (2,240) 14,40 (1,265) p=0,048 Wort- PAL, freie Reproduktion nach 90 min. MVGT ∑ Lernleistung MVGT ∑ Lernspanne MVGT, freie Wiedergabe unmittelbar MVGT, gestützte Wiedergabe unmittelbar MVGT, freie Wiedergabe nach 30 min. 42 12,87 (2,240) 14,40 (1,265) p=0,010 MVGT, Wiedererkennen 14,07 (1,837) 14,90 (0,316) p=0,023 MVGT, freie Wiederg. 12,67 (2,316) 14,60 (1,265) p=0,004 MVGT, gestützte Wiedergabe nach 90 min. 12,75 (2,132) 14,60 (1,265) p=0,004 Wilde Intelligenz Test 12,97 (4,979) 14,90 (2,846) p=0,253 8,00 (2,171) 8,80 (1,135) p=0,275 2,31 (2,661) 1,50 (1,434) p=0,367 MVGT, gestützte Wiedergabe nach 30 min. nach 90 min. (WIT), ∑ Benton Visual Retention Test, Summe Richtige Benton Visual Retention Test , Summe Fehler Im Bereich des deklarativen Gedächtnisses erzielten die gesunden Kontrollpersonen in 8 von 14 Untertests signifikant bessere Ergebnisse (Wort-PAL ∑ Lernleistung: p=0,025; Wort-PAL, freie Reproduktion nach 90 min.: p=0,022; MVGT ∑ Lernleistung: p=0,002; MVGT, freie Wiedergabe nach 30 min.: p=0,048; MVGT, gestützte Wiedergabe nach 30 min.: p=0,010; MVGT, Wiedererkennen: p=0,023; MVGT, freie Wiedergabe nach 90 min.: p=0,004; MVGT, gestützte Wiedergabe nach 90 min.: p=0,004). 3.3.3. Implizites Gedächtnis Tabelle 8: Vergleich der Patienten- und Kontrollgruppe zum Zeitpunkt 0: Implizites Gedächtnis. BAWT: Bielefelder Affektiver Wörtertest, M= Mittelwert, SD= Standardabweichung. Untersuchte Funktion Variable Patienten (n=30) M (SD) Kontrollen (n=10) M (SD) T-Test Implizites Gedächtnis BAWT, ∑ 5,10 (2,155) 6,20 (1,814) p=0,156 43 Die bei Patienten und Kontrollen gemessenen impliziten Gedächtnisleistungen unterschieden sich nicht signifikant (p=0,156). 3.3.4. Exekutive Funktionen Tabelle 9: Vergleich der Patienten- und Kontrollgruppe zum Zeitpunkt 0: Exekutive Funktionen. COWAT: Controlled Oral Word Association Test, M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Patienten (n=30) M (SD) Kontrollen (n=10) M (SD) T-Test Exekutive Funktionen COWAT 30,30 (9,883) 40,60 (9,935) p=0,007 Supermarkt 27,33 (6,784) 31,22 (9,744) p=0,182 Figural Fluency 33,72 (11,535) 44,00 (16,707) p=0,037 In den exekutiven Funktionen ergaben sich erneut signifikante Unterschiede zwischen den beiden Gruppen. So erzielten die Kontrollen in 2 von 3 Untertests bessere Ergebnisse als die Patienten (COWAT, Rohwert: p=0,007; Figural Fluency, Rohwert: p=0,037). 3.3.5. Aufmerksamkeit Tabelle 10: Vergleich der Patienten- und Kontrollgruppe zum Zeitpunkt 0: Aufmerksamkeit. M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Patienten (n=30) M (SD) Kontrollen (n=10) M (SD) T-Test Aufmerksamkeit Alertness ohne Warnton, Median in msec. 245,20 (38,013) 231,80 (51,389) p=0,383 Alertness mit 238,42 233,00 p=0,702 Warnton, Median in (35,867) (45,908) Geteilte 691,38 658,30 Aufmerksamkeit, (82,962) (52,289) Geteilte 1,90 1,40 Aufmerksamkeit, (1,698) (1,174) msec. p=0,246 Median in msec. ∑ Auslassungen 44 p=0,399 Geteilte 2,53 2,20 Aufmerksamkeit, (4,592) (1,687) Inkompatibilität, 448,32 437,75 Median in msec. (85,665) (84,544) Inkompatibilität, 5,17 4,10 ∑ Fehler (3,752) (2,283) p=0,825 ∑ Fehler p=0,737 p=0,404 Die Aufmerksamkeitsleistung von Patienten und Kontrollen unterschied sich zum Zeitpunkt 0, d.h. vor Medikamentengabe, nicht signifikant. 3.3.6. Depression, Euphorie, Ängste, Gedächtnisleistungen im Alltag Tabelle 11: Vergleich der Patienten- und Kontrollgruppe zum Zeitpunkt 0: Affekt, Ängste, Gedächtnisleistungen im Alltag. FEGA: Fragebogen zur Erfassung von Gedächtnisleistung im Alltag, M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Patienten (n=30) M (SD) Kontrollen (n=10) M (SD) T-Test Affekt Beck-DepressionsInventar (BDI) 5,80 (4,845) 2,00 (2,108) p=0,022 Neuropsychiatr. 2,48 (3,975) 0,00 (0,000) p=0,296 0,26 (1,347) 0,00 (0,000) p=0,745 2,04 (3,674) 0,00 (0,000) p=0,353 26,74 (12,937) 21,50 (8,784) p=0,246 Inventar, ∑ Depression Neuropsychiatr. Inventar, ∑ Euphorie Ängste Neuropsychiatr. Inventar, ∑ Angst Gedächtnis- FEGA leistung im Alltag 45 Im Beck-Depressions-Inventar wiesen die Patienten höhere Depressionswerte als die Kontrollen auf (p=0,022). Die Werte für Euphorie, Ängste und Gedächtnisleistungen im Alltag (Selbstbeurteilungsskala) unterschieden sich nicht signifikant. 3.3.7. Allgemeine Intelligenz Tabelle 12: Vergleich der Patienten- und Kontrollgruppe zum Zeitpunkt 0: Allgemeine Intelligenz. HAWIE-R: Hamburg-Wechsler-Intelligenztests für Erwachsene, M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Patienten (n=3) M (SD) Kontrollen (n=10) M (SD) T-Test Allgemeine Wortschatztest 28,40 (6,015) 33,00 (4,876) p=0,035 Intelligenz (WST), Rohwert 35,53 (10,425) 35,80 (8,664) p=0,942 HAWIE-R: Mosaiktest, Rohwert Bezüglich der allgemeinen Intelligenz fanden sich im Wortschatztest signifikant bessere Leistungen der Kontrollen (p=0,035). Im Mosaiktest, der das räumlichfigurale Denken abbildet, fanden sich keine Unterschiede. Zusammenfassung der Ergebnisse der Patienten und Kontrollen zum Zeitpunkt 0: In den meisten Gedächtnisleistungen zeigten die Kontrollen bessere Ergebnisse als die Patienten (n=11721; range: p=0,048 to p=0,000). Höhere Leistungen der Kontrollen wurden auch im Wortschatztest (p=0,035) und in der verbalen und figuralen Denkflüssigkeit (p=0,007 und p=0,037) gefunden. Wie erwartet, war der Rohwert im BDI geringer in der Kontrollgruppe (p=0,022), was auf eine höhere affektive Belastung der Patientengruppe hinweist. 46 3.4. Kognitive Leistungen der Kontrollpersonen im Verlauf Mittels T-Test für verbundene Stichproben wurde geprüft, ob sich die Ergebnisse der Kontrollpersonen zu den beiden Testzeitpunkten unterscheiden, was auf einen Übungseffekt hinweisen könnte. 3.4.1. Arbeitsgedächtnis Tabelle 13: Unterschiede der Ergebnisse der Kontrollpersonen zu beiden Testzeitpunkten: Arbeitsgedächtnis. HAWIE-R: Hamburg-Wechsler-Intelligenztests für Erwachsene, M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Kontrollen Zeitpunkt 1 M (SD) Kontrollen Zeitpunkt 2 M (SD) T-Test Arbeits- HAWIE-R: Zahlen 6,90 (1,197) 7,40 (0,699) p=0,177 gedächtnis nachspr. vorw. 5,30 (1,160) 5,70 (2,003) p=0,399 537,15 (119,576) 536,30 (116,551) p=0,985 1,30 (2,452) 0,80 (1,033) p=0,381 0,70 (1,252) 0,40 (0,516) p=0,468 6,20 (0,798) 6,00 (0,471) p=0,509 HAWIE-R: Zahlen nachspr. rückw. Arbeitsgedächtnis, Median in msec. Arbeitsgedächtnis, ∑ Auslassungen Arbeitsgedächtnis, ∑ Fehler Block-Tapping-Test (Corsi) Im Bereich des Arbeitsgedächtnisses fanden sich keine signifikanten Unterschiede zwischen Testzeitpunkt 1 und Testzeitpunkt 2. 47 3.4.2. Deklaratives Gedächtnis Tabelle 14: Unterschiede der Ergebnisse der Kontrollpersonen zu beiden Testzeitpunkten: Deklaratives Gedächtnis. Wort-PAL: Wortpaarassoziationslerntest, MVGT: Münchner Verbaler Gedächtnistest. M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Kontrollen Zeitpunkt 1 M (SD) Kontrollen Zeitpunkt 2 M (SD) T-Test Deklaratives Wort- PAL 26,40 (6,518) 29,80 (3,120) p=0,084 Gedächtnis ∑ Lernleistung 7,40 (0,843) 7,60 (0,516) p=0,555 65,90 (4,557) 67,60(4,858) p=0,063 13,80 (1,549) 14,70 (0,483) p=0,068 13,80 (1,549) 14,70 (0,483) p=0,108 14,40 (1,265) 14,80 (0,422) p=0,269 14,40 (1,265) 14,80 (0,422) p=0,269 14,60 (1,265) 14,80 (0,422) p=0,555 14,60 (1,265) 14,80 (0,422) p=0,555 Wort- PAL, freie Reproduktion nach 90 min MVGT ∑ Lernleistung MVGT, freie Wiedergabe unmittelbar MVGT, gestützte Wiedergabe unmittelbar MVGT, freie Wiedergabe nach 30 min. MVGT, gestützte Wiedergabe nach 30 min. MVGT, freie Wiederg. nach 90 min. MVGT, gestützte Wiedergabe nach 90 min. 48 Wilde Intelligenz Test 14,90 (2,846) 15,10 (1,853) p=0,794 8,80 (1,135) 8,80 (1,033) p=1,000 1,50 (1,434) 1,20 (1,033) p=0,604 (WIT), ∑ Benton Visual Retention Test, Summe Richtige Benton Visual Retention Test , Summe Fehler Die Untersuchung des deklarativen Gedächtnisses der Kontrollpersonen ergab keinen signifikanten Unterschied zwischen Testzeitpunkt 1 und Testzeitpunkt 2. 3.4.3. Implizites Gedächtnis Tabelle 15: Unterschiede der Ergebnisse der Kontrollpersonen zu beiden Testzeitpunkten: Implizites Gedächtnis.M: Mittelwert, SD: Standardabweichung Untersuchte Funktion Variable Kontrollen Zeitpunkt 1 M (SD) Kontrollen Zeitpunkt 2 M (SD) T-Test Implizites Bielefelder Affektiver 6,20 (1,814) 7,10 (1,370) p=0,054 Gedächtnis Wörtertest (BAWT), Summe Bezüglich des impliziten Gedächtnisses zeigte sich kein statistisch signifikanter Unterschied zwischen den beiden Testzeitpunkten der Kontrollpersonen. 49 3.4.4. Exekutive Funktionen Tabelle 16: Unterschiede der Ergebnisse der Kontrollpersonen zu beiden Testzeitpunkten: Exekutive Funktionen. COWAT: Controlled Oral Word Association Test, M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Kontrollen Zeitpunkt 1 M (SD) Kontrollen Zeitpunkt 2 M (SD) T-Test Exekutive COWAT 40,60 (9,935) 43,70 (9,440) p=0,342 Supermarkt 31,22 (9,744) 33,56 (7,748) p=0,461 Figural Fluency 44,00 (16,707) 48,60 (16,854) p=0,007 Funktionen Im Bereich der exekutiven Funktionen zeigt sich lediglich in der figuralen Flüssigkeit eine signifikante Verbesserung der Kontrollpersonen von Testzeitpunkt 1 zu Testzeitpunkt 2 (p=0,007). 3.4.5. Aufmerksamkeit Tabelle 17: Unterschiede der Ergebnisse der Kontrollpersonen zu beiden Testzeitpunkten: Aufmerksamkeit. M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Kontrollen Zeitpunkt 1 M (SD) Kontrollen Zeitpunkt 2 M (SD) Aufmerk- Alertness ohne 231,80 232,10 samkeit Warnton, Median in (51,389) (29,179) Alertness mit Warnton, 233,00 229,65 Median in msec. (45,908) (43,646) Geteilte 648,44 620,16 Aufmerksamkeit, (44,533) (65,238) T-Test p=0,970 msec. (TAPA-m) p=0,605 (TAPA+m) Median in msec. (TAPGAM) 50 p=0,106 Geteilte 1,40 0,60 p=0,070 Aufmerksamkeit, (1,174) (0,699) 2,20 (1,687) 0,30 (0,483) p=0,003 437,75 (84,544) 418,50 (68,190) p=0,080 4,10 (2,283) 2,80 (1,619) p=0,128 Summe Auslassungen (TAPGASA) Geteilte Aufmerksamkeit, Summe Fehler (TAPGASF) Inkompatibilität, Median in msec. (TAPIKM) Inkompatibilität, Summe Fehler (TAPIKSF) Signifikante Differenzen zeigten sich lediglich in einer von sieben Aufmerksamkeitsprüfungen (Summe Fehler „geteilte Aufmerksamkeit“: p=0,003). 3.4.6.Depression, Euphorie, Ängste, Gedächtnisleistungen im Alltag Tabelle 18: Unterschiede der Ergebnisse der Kontrollpersonen zu beiden Testzeitpunkten: Depression, Euphorie, Ängste, Gedächtnisleistungen im Alltag. M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Kontrollen Zeitpunkt 1 M (SD) Kontrollen Zeitpunkt 2 M (SD) T-Test Depression Beck-Depressions- 2,00 (2,108) 1,60 (1,713) p=0,443 0,00 (0,000) 0,00 (0,000) 1) 0,00 (0,000) 0,00 (0,000) 1) Inventar (BDI) Neuropsychiatr. Inventar, Summe Depression (NPIDESU) Euphorie Neuropsychiatr. Inventar, Summe Euphorie (NPIEUSU) 51 Ängste Neuropsychiatr. 0,00 (0,000) 0,00 (0,000) 1) 21,50 (8,874) 17,00 (7,803) p=0,006 Inventar, Summe Angst (NPIANSU) Gedächtnis- Fragebogen zur leistungen Erfassung von im Alltag Gedächtnisleistung im Alltag (FEGA) 1) Korrelation und T können nicht berechnet werden, da der Standardfehler der Differenz gleich 0 ist. Keine Unterschiede zwischen den beiden Untersuchungszeitpunkten ergaben sich bezüglich Depressivität, Euphorie und Ängsten. Die Selbsteinschätzung der Gedächtnisleistungen im Alltag fiel zum Untersuchungszeitpunkt 2 signifikant besser aus (p= 0,006). Zusammenfassung der Ergebnisse der Kontrollpersonen zu beiden Untersuchungszeitpunkten: Die meisten der erhobenen kognitiven Leistungen zeigen keine statistisch bedeutsame Veränderung von Zeitpunkt 1 zu Zeitpunkt 2, so dass ein relevanter Übungseffekt nicht anzunehmen ist. Lediglich im FEGA (p=0,006), in der figuralen Flüssigkeit (p=0,007) Aufmerksamkeit“ und (p=0,003) bezüglich fanden der sich Untersuchungszeitpunkt 2. 52 Fehlerrate signifikante in der TAP „geteilte Verbesserungen zum 3.5 Auswirkungen der Methylprednisolonbehandlung auf die kognitiven Leistungen der Patienten Um die Auswirkungen der Methylprednisolonbehandlung auf die kognitiven Funktionsparameter zu Meßwiederholungen überprüfen, gerechnet. wurde Dabei eine wurde als zweifaktorielle ANOVA mit Within-Subject-Faktor der Untersuchungszeitpunkt (Tag 0, Tag 6, Tag 60) und als Between-Subject-Faktor die Dosis (500 versus 2000 mg MP) angesehen. 3.5.1. Ergebnisse der Patienten zu den drei Untersuchungszeitpunkten 3.5.1.1. Arbeitsgedächtnis Tabelle 19: Unterschiede der Ergebnisse der Patienten zu den drei Testzeitpunkten: Arbeitsgedächtnis. HAWIE-R: Hamburg-Wechsler-Intelligenztests für Erwachsene. M: Mittelwert, SD: Standardabweichung. ¹ Signifikante Differenzen zwischen Tag 0 und Tag 6, ²: Signifikante Differenzen zwischen Tag 0 und Tag 60, ³: Signifikante Differenzen zwischen Tag 6 und Tag 60. Untersuchte Funktion Variable Pat. Tag 0 M (SD) Pat. Tag 6 M (SD) Pat. Tag 60 M (SD) Arbeits- HAWIE-R: Zahlen 6,03 6,00 6,27 gedächtnis nachsprechen vorwärts (1,033) (1,102) (1,081) HAWIE-R: Zahlen 4,43 4,43 5,03² ³ nachsprechen (1,278) (1,135) (0,850) Arbeitsgedächtnis, 662,63 616,73 621,72 Median in msec. (248,328) (218,393) (202,833) Arbeitsgedächtnis, 2,33 1,93 1,47 ² Summe Auslassungen (2,820) (2,982) (2,255) Arbeitsgedächtnis, 2,67 2,17 1,80 Summe Fehler (2,869) (2,817) (2,747) ANOVA Hauptfaktor „Untersuchungszeitpunkt“ p-Wert F-Wert 0,311 1,192 (2/54) 0,006 5,628 (2/56) rückwärts 0,275 1,321 (2/56) (TAPAGM) 0,020 4,209 (2/56) (TAPAGSA) (TAPAGSF) 53 0,305 1,213 (2/56) Im Bereich Block-Tapping-Test 5,17 5,30 5,73 ² ³ (Corsi) (0,699) (0,915) (1,081) des Arbeitsgedächtnisses ergaben sich 0,003 6,569 (2/56) keine signifikanten Veränderungen der Gedächtnisleistung der Patienten zwischen Tag 0 und Tag 6. Zwischen Tag 0 und Tag 60 ergaben sich signifikante Verbesserungen in 3 von 6 Untertests (HAWIE-R: Zahlen nachsprechen rückwärts, Arbeitsgedächtnis Summe Auslassungen, Block-Tapping-Test). Zwischen Tag 6 und Tag 60 ergaben sich signifikante Verbesserungen in 2 von 6 Untertests (HAWIE-R: Zahlen nachsprechen rückwärts, Block-Tapping-Test). 3.5.1.2. Deklaratives Gedächtnis Tabelle 20: Unterschiede der Ergebnisse der Patienten zu den drei Testzeitpunkten: Deklaratives Gedächtnis. Wort-PAL: Wortpaarassoziationslerntest, MVGT: Münchner Verbaler Gedächtnistest, M: Mittelwert, SD: Standardabweichung, ¹ Signifikante Differenzen zwischen Tag 0 und Tag 6, ²: Signifikante Differenzen zwischen Tag 0 und Tag 60, ³: Signifikante Differenzen zwischen Tag 6 und Tag 60. Untersuchte Funktion Variable Pat. Tag 0 M (SD) Pat. Tag 6 M (SD) Pat. Tag 60 M (SD) ANOVA Hauptfaktor „Untersuchungszeitpunkt“ p-Wert F-Wert 0,042 3,355 Deklaratives Wort- PAL 19,00 17,66 21,66 ³ Gedächtnis ∑ Lernleistung (9,177) (10,560) (8,273) Wort- PAL, freie Reproduktion nach 5,21 (2,889) 4,56 (2,886) 5,57 (2,483) 0,211 1,616 (2/40) MVGT 59,30 56,13 ¹ 60,83 ² 0,000 9,714 ∑ Lernleistung (7,321) (9,741) (7,901) MVGT, freie 12,50 11,97 13,13 ³ Wiedergabe unmittelbar (2,224) (2,697) (2,315) (2/54) 90 min 54 (2/56) 0,020 4,218 (2/56) MVGT, gestützte 12,63 12,03 13,37 ² ³ Wiedergabe unmittelbar (2,266) (2,735) (2,141) MVGT, freie 12,87 11,93 ¹ 13,33 ³ Wiedergabe nach 30 (2,240) (2,828) (2,023) MVGT, gestützte 12,87 11,87 ¹ 13,47 ³ Wiedergabe nach 30 (2,080) (2,874) (1,871) MVGT, 14,07 14,10 14,37 Wiedererkennung (1,873) (1,423) (1,189) MVGT, freie 12,67 11,42 ¹ 13,42 ² ³ Wiedergabe nach 90 (2,316) (2,824) (1,792) MVGT, gestützte 12,75 11,54 ¹ 13,63 ² ³ Wiedergabe nach 90 (2,132) (2,670) (1,715) 0,004 6,112 (2/56) 0,002 6,866 (2/56) min. 0,001 8,296 (2/56) min. 0,558 0,589 (2/56) 0,000 9,690 (2/44) min. 0,000 10,519 (2/44) min. Wilde Intelligenz Test 12,97 12,07 13,14 (WIT), ∑ (n=30/30/29) (4,979) (3,571) (3,281) Benton Visual Retention 8,00 7,45 7,93 Test, Σ Richtige (2,171) (2,515) (1,668) Benton Visual Retention 2,31 3,00 2,62 Test , Σ Fehler (2,661) (3,495) (2,227) 0,179 1,779 (2/54) 0,123 2,182 (2/54) 0,187 1,782 (2/54) Im Bereich des deklarativen Gedächtnisses verschlechterten sich die Patienten zwischen Tag 0 und Tag 6 in 5 von 13 Untertests (MVGT ∑ Lernleistung; MVGT, freie Wiedergabe nach 30 min.; MVGT, gestützte Wiedergabe nach 30 min.; MVGT, freie Wiedergabe nach 90 min.; MVGT, gestützte Wiedergabe nach 90 min.). Zwischen Tag 0 und Tag 60 verbesserten sich die Patienten signifikant in 4 von 13 Untertests (MVGT ∑ Lernleistung; MVGT, gestützte Wiedergabe unmittelbar; MVGT, 55 freie Wiedergabe nach 90 min.; MVGT, gestützte Wiedergabe nach 90 min.). Zwischen Tag 6 und Tag 60 verbesserten sich die Patienten in 7 von 13 Untertests (Wort- PAL ∑ Lernleistung; MVGT, freie Wiedergabe unmittelbar; MVGT, gestützte Wiedergabe unmittelbar; MVGT, freie Wiedergabe nach 30 min.; MVGT, gestützte Wiedergabe nach 30 min.; MVGT, freie Wiedergabe nach 90 min.; MVGT, gestützte Wiedergabe nach 90 min.) 3.5.1.3. Implizites Gedächtnis Tabelle 21: Unterschiede der Ergebnisse der Patienten mit Multipler Sklerose zu den drei Testzeitpunkten: Implizites Gedächtnis. M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Pat. Tag 0 M (SD) Pat. Tag 6 M (SD) Pat. Tag 60 M (SD) Implizites Bielefelder Affektiver 5,10 5,04 5,17 Gedächtnis Wörtertest (BAWT), (2,155) (2,341) (2,069) ANOVA Hauptfaktor „Untersuchungszeitpunkt“ p-Wert F-Wert 0,870 0,140 (2/56) Summe Keine signifikanten Unterschiede zwischen den 3 Untersuchungszeitpunkten ergaben sich im Bereich des impliziten Gedächtnisses. 3.5.1.4. Exekutive Funktionen Tabelle 22: Unterschiede der Ergebnisse der Patienten zu den drei Testzeitpunkten: Exekutive Funktionen. COWAT: Controlled Oral Word Association Test, M: Mittelwert, SD: Standardabweichung, ¹ Signifikante Differenzen zwischen Tag 0 und Tag 6, ²: Signifikante Differenzen zwischen Tag 0 und Tag 60, ³: Signifikante Differenzen zwischen Tag 6 und Tag 60. Untersuchte Funktion Exekutive Variable COWAT Funktionen Supermarkt Pat. Tag 0 M (SD) Pat. Tag 6 M (SD) Pat. Tag 60 M (SD) 30,30 33, 07¹ 32,93² (9,883) (10,491) (10,709) 27,33 26,87 27,47 (6,784) (7,104) (7,995) 56 ANOVA Hauptfaktor „Untersuchungszeitpunkt“ p-Wert F-Wert 0,038 3,463 (2/56) 0,807 0,216 (2/56) Figural Fluency 33,72 35,17 40,14² ³ (11,535) (11,136) (12,927) 0,000 15,997 (2/52) Bei den exekutiven Funktionen ergab sich im COWAT eine signifikante Verbesserung der Patienten zwischen Tag 0 und Tag 6, ebenso zwischen Tag 0 und Tag 60. In der Figural Fluency ergab sich zwischen Tag 0 und Tag 60 sowie zwischen Tag 6 und Tag 60 eine signifikante Verbesserung. 3.5.1.5. Aufmerksamkeit Tabelle 23: Unterschiede der Ergebnisse der Patienten zu den drei Testzeitpunkten: Aufmerksamkeit. M: Mittelwert, SD: Standardabweichung, ¹ Signifikante Differenzen zwischen Tag 0 und Tag 6, ²: Signifikante Differenzen zwischen Tag 0 und Tag 60, ³: Signifikante Differenzen zwischen Tag 6 und Tag 60. Untersuchte Funktion Variable Pat. Tag 0 M (SD) Pat. Tag 6 M (SD) Pat. Tag 60 M (SD) Aufmerk- Alertness ohne 245,20 251,75 247,88 samkeit Warnton, Median in (38,013) (35,109) (38,890) Alertness mit Warnton, 238,42 243,30 240,37 Median in msec. (35,867) (32,897) (38,260) Geteilte 691,38 660, 97¹ 660,08² Aufmerksamkeit, (82,962) (74,158) (73,610) Geteilte 1,90 1,40 1,73 Aufmerksamkeit, (1,698) (1,380) (2,970) ANOVA Hauptfaktor „Untersuchungszeitpunkt“ p-Wert F-Wert 0,339 1,102 (2/56) msec. (TAPA-m) 0,543 0,618 (2/56) (TAPA+m) 0,005 5,951 (2/56) Median in msec. (TAPGAM) Σ Auslassungen (TAPGASA) 57 0,623 0,477 (2/54) Geteilte 2,53 1,60 0,93³ Aufmerksamkeit, (4,593) (2,010) (1,081) Inkompatibilität, Median 448,32 447,90 440,47 in msec. (85,665) (92,746) (129,67) Inkompatibilität, Summe 5,17 4,33 7,17 Fehler (3,752) (4,611) (9,882) 0,033 3,633 (2/56) Summe Fehler (TAPGASF) 0,824 0,195 (2/56) (TAPIKM) 0,227 1,522 (2/56) (TAPIKSF) In einem von 7 Untertests zur Aufmerksamkeitsprüfung (geteilte Aufmerksamkeit, Median in msec.) ergab sich eine signifikante Verbesserung zwischen Tag 0 und Tag 6. Im selben Untertest ergab sich eine signifikante Verbesserung zwischen Tag 0 und Tag 60. Zwischen Tag 6 und Tag 60 ergab sich bei der geteilten Aufmerksamkeit (Summe Fehler) eine signifikante Verbesserung. 3.5.1.6. Depression, Euphorie, Ängste, Gedächtnisleistungen im Alltag Tabelle 24: Unterschiede der Ergebnisse der Patienten zu den drei Testzeitpunkten: Depression, Euphorie, Ängste, Gedächtnisleistungen im Alltag. M: Mittelwert, SD: Standardabweichung, ²: Signifikante Differenzen zwischen Tag 0 und Tag 60, ³: Signifikante Differenzen zwischen Tag 6 und Tag 60. Untersuchte Funktion Depression Variable Pat. Tag 0 M (SD) Pat. Tag 6 M (SD) Pat. Tag 60 M (SD) Beck-Depressions- 5,80 6,20 5,57 Inventar (4,845) (6,604) (6,623) Neuropsychiatr. 2,48 2,37 1,33² ³ Inventar, Summe (3,975) (4,507) (3,698) ANOVA Hauptfaktor „Untersuchungszeitpunkt“ p-Wert F-Wert 0,681 0,387 (2/56) (BDI) Depression (NPIDESU) 58 0,012 4,847 (2/50) Euphorie Neuropsychiatr.. 0,26 1,03 0,40 Inventar, Summe (1,347) (2,399) (1,545) Neuropsychiatr. 2,04 2,30 1,00² ³ Inventar, Summe Angst (3,674) (4,044) (2,704) 0,608 0,503 (2/50) Euphorie (NPIEUSU) Ängste 0,033 3,660 (2/50) (NPIANSU) Gedächtnis- Fragebogen zur 26,74 26,42 26,28 leistungen Erfassung von (12,937) (13,497) (18,474) im Alltag Gedächtnisleistung im 0,492 0,720 (2/48) Alltag (FEGA) Bezüglich Depression und Ängsten ergab sich im Neuropsychiatrischen Inventar eine Reduktion dieser Affekte im signifikanten Bereich zwischen Tag 0 und 60 sowie 6 und 60. Bezüglich der Selbsteinschätzung der Gedächtnisleistungen im Alltag ergaben sich keine Unterschiede zwischen den drei Untersuchungszeitpunkten. Zusammenfassung der Ergebnisse der Patienten zu den drei Untersuchungszeitpunkten: Im Unterschied zu den Kontrollen zeigte das deklarative Gedächtnis der Patienten starke Unterschiede hinsichtlich des Hauptfaktors „Untersuchungszeitpunkt“. So ergab sich zwischen Tag 0 und Tag 6 – also nach Verabreichung von Methylprednisolon - eine signifikante Verschlechterung der Gedächtnisleistung insbesondere beim MVGT (freie und gestützte Wiedergabe). Im Bereich des Arbeitsgedächtnisses ergaben sich teilweise Verbesserungen zwischen Tag 6 und 60 bzw. zwischen Tag 0 und Tag 60. Eine Verschlechterung der Leistungen des Arbeitsgedächtnisses zwischen Tag 0 und Tag 6 war nicht nachzuweisen. Bezüglich der exekutiven Funktionen zeigte sich ebenfalls in 2 Untertests eine Verbesserung zwischen veränderten den sich Untersuchungszeitpunkten. nicht. Im Bereich der Implizite Gedächtnisleistungen Aufmerksamkeit ergaben sich Verbesserungen im Bereich der geteilten Aufmerksamkeit. Depressive und ängstliche Symptome, untersucht via Neuropsychiatrischem Inventar, nahmen im Untersuchungszeitraum ab, der BDI dagegen veränderte sich nicht signifikant. 59 3.5.2. Dosiseffekt 3.5.2.1. Arbeitsgedächtnis Tabelle 25: Dosiseffekte zu den drei Testzeitpunkten: Arbeitsgedächtnis. HAWIE-R: Hamburg-WechslerIntelligenztests für Erwachsene, M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Arbeits- HAWIE-R: Zahlen gedächtnis nachsprechen vorwärts Dosis 500 mg (n=16) M (SD) Dosis 2000 mg (n=13) M (SD) Tag 0 5,88 (0,806) 6,21 (1,251) Tag 6 5,75 (1,000) 6,31 (1,182) Tag 60 6,13 (0,957) 6,43 (1,222) Tag 0 4,44 (1,263) 4,43 (1,342) Tag 6 4,44 (1,031) 4,43 (1,284) Tag 60 5,05 (0,854) 5,00 (0,877) Tag 0 682,06 (66,592) 702,04 (100,039) Tag 6 667,156 (54,118) 653,893 (93,741) Tag 60 653,22 (61,768) 667,93 (86,952) Tag 0 1,69 (1,740) 3,07 (3,626) Tag 6 1,25 (1,880) 2,71 (3,811) Tag 60 0,94 (1,692) 2,07 (2,702) Tag 0 2,19 (2,949) 3,21 (2,778) Tag 6 1,94 (2,839) 2,43 (2,875) Tag 60 1,50 (2,000) 2,14 (3,461) ANOVA Hauptfaktor „Dosis“ p-Wert F-Wert 0,285 1,190 (1/27) HAWIE-R: Zahlen nachsprechen rückwärts 0,937 0,006 (1/28) Arbeitsgedächtnis, Median in msec. (TAPAGM) 0,579 0,314 (1/28) Arbeitsgedächtnis, Summe Auslassungen (TAPAGSA) 0,156 2,126 (1/28) Arbeitsgedächtnis, Summe Fehler (TAPAGSF) 60 0,378 0,803 (1/28) Block-Tapping-Test (Corsi) Tag 0 5,31 (0,704) 5,00 (0,679) Tag 6 5,38 (0,085) 5,21 (0,975) Tag 60 5,81 (0,911) 5,64 (1,277) 0,448 0,593 (1/28) Bei der Untersuchung des Arbeitsgedächtnisses ergaben sich keine signifikanten Dosiseffekte. 3.5.2.2. Deklaratives Gedächtnis Tabelle 26: Dosiseffekte zu den drei Testzeitpunkten: Deklaratives Gedächtnis. Wort-PAL: Wortpaarassoziationslerntest, MVGT: Münchner Verbaler Gedächtnistest, M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Deklaratives Wort- PAL Gedächtnis ∑ Lernleistung Dosis 500 mg (n=16) M (SD) Dosis 2000 mg (n=13) M (SD) Tag 0 20,75 (8,676) 16,85 (9,660) Tag 6 19,31 (9,728) 15,62 (11,565) Tag 60 23,50 (6,501) 19,38 (9,836) Tag 0 5,77 (2,619) 4,55 (3,174) Tag 6 5,08 (2,629) 4,10 (3,247) Tag 60 6,31 (1,888) 4,60 (2,914) Tag 0 59,63 (6,065) 58,93 (8,766) Tag 6 56,81 (10,028) 55,36 (9,716) Tag 60 62,31 (8,081) 59,14 (7,624) Tag 0 12,56 (2,279) 12,43 (2,243) Tag 6 12,38 (2,630) 11,50 (2,794) Tag 60 13,13 (2,778) 13,14 (1,748) ANOVA Hauptfaktor „Dosis“ p-Wert F-Wert 0,202 1,712 (1/27) Wort- PAL, freie Reproduktion nach 90 min 0,228 1,543 (1/20) MVGT ∑ Lernleistung 0,537 0,391 (1/28) MVGT, freie Wiedergabe unmittelbar 61 0,667 0,189 (1/28) MVGT, gestützte Wiedergabe unmittelbar Tag 0 12,75 (2,436) 12,50 (2,139) Tag 6 12,38 (2,964) 11,64 (2,499) Tag 60 13,31 (2,469) 13,43 (1,785) Tag 0 12,94 (2,294) 12,79 (2,259) Tag 6 12,13 (3,117) 11,71 (2,555) Tag 60 13,38 (2,247) 13,29 (1,816) Tag 0 14,38 (1,544) 13,71 (2,128) Tag 6 14,25 (1,483) 13,93 (1,385) Tag 60 14,25 (1,483) 14,50 (0,760) Tag 0 13,38 (1,502) 11,82 (2,857) Tag 6 12,15 (2,853) 10,55 (2,697) Tag 60 13,85 (1,819) 12,91 (1,700) Tag 0 13,31 (1,601) 12,09 (2,548) Tag 6 12,23 (2,743) 10,73 (2,453) Tag 60 14,00 (1,732) 13,18 (1,662) Tag 0 12,44 (2,555) 13,57 (6,858) Tag 6 13,13 (2,500) 10,86 (4,276) Tag 60 14.06 (2,407) 12,00 (3,916) Tag 0 8,69 (1,302) 7,15 (2,734) Tag 6 8,31 (1,352) 6,38 (3,203) Tag 60 8,31 (1,250) 7,46 (2,025) 0,709 0,142 (1/28) MVGT, freie Wiedergabe nach 30 min. 0,779 0,080 (1/28) MVGT, Wiedererkennung 0,550 0,367 (1/28) MVGT, freie Wiedergabe nach 90 min. 0,090 3,151 (1/22) MVGT, gestützte Wiedergabe nach 90 min. 0,110 2,767 (1/22) Wilde Intelligenz Test (WIT), ∑ Richtige 0,304 1,096 (1/27) Benton Visual Retention Test, Σ Richtige 62 0,043 4,528 (1/27) Benton Visual Retention Test, Σ Fehler Tag 0 1,50 (1,826) 3,31 (3,225) Tag 6 1,88 (1,746) 4,38 (4,574) Tag 60 2,38 (2,247) 2,92 (2,253) 0,087 3,144 (1/27) Bei der Untersuchung des deklarativen Gedächtnisses ergab sich abgesehen von einem Untertest (Benton Test, Summe Richtige, p=0.043, F=4.528) kein Unterschied zwischen Niedrigdosisgruppe und Hochdosisgruppe. 3.5.2.3. Implizites Gedächtnis Tabelle 27: Dosiseffekte zu den drei Testzeitpunkten: Implizites Gedächtnis. M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Implizites Bielefelder Affektiver Gedächtnis Wörtertest (BAWT), Dosis 500 mg (n=16) M (SD) Dosis 2000 mg (n=13) M (SD) ANOVA Hauptfaktor „Dosis“ p-Wert F-Wert 0,213 1,622 Summe Tag 0 5,50 (1,966) 4,64 (2,341) Tag 6 5,69 (1,852) 4,29 (2,673) Tag 60 5,38 (1,628) 4,93 (2,526) (1/28) Hinsichtlich des impliziten Gedächtnisses untersucht mittels BAWT ergab sich kein Dosiseffekt. 3.5.2.4. Exekutive Funktionen Tabelle 28: Dosiseffekte zu den drei Testzeitpunkten: Exekutive Funktionen. COWAT: Controlled Oral Word Association Test, M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Dosis 500 mg (n=16) M (SD) Dosis 2000 mg (n=13) M (SD) Exekutive COWAT, Rohwert Funktionen Tag 0 31,81 (9,138) 28,57 (10,747) Tag 6 34,69 (9,279) 31,21 (11,801) Tag 60 35,44 (9,886) 30,07 (11,249) 63 ANOVA Hauptfaktor „Dosis“ p-Wert F-Wert 0,264 1,300 (1/28) Supermarkt, Rohwert Tag 0 28,06 (7,019) 26,50 (6,665) Tag 6 27,00 (7,554) 26,71 (6,832) Tag 60 28,69 (6,374) 26,07 (9,579) Tag 0 34,00 (9,381) 34,00 (10,954) Tag 6 36,19 (11,548) 38,77 (14,839) Tag 60 41,25 (11,619) 27,00 (7,706) 0,560 0,349 (1/28) Figural Fluency, Rohwert 0,719 0,132 (1/26) Bei der Untersuchung der exekutiven Funktionen ergab sich kein Unterschied zwischen Hochdosis- und Niedrigdosisgruppe. 3.5.2.5. Aufmerksamkeit Tabelle 29: Dosiseffekte zu den drei Testzeitpunkten: Aufmerksamkeit. M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Variable Aufmerk- Alertness ohne samkeit Warnton, Median in Dosis 500 mg (n=16) M (SD) Dosis 2000 mg (n=13) M (SD) ANOVA Hauptfaktor „Dosis“ p-Wert F-Wert 0,254 1,358 msec. (TAPA-m) Tag 0 241,66 (31,501) 249,25 (45,226) Tag 6 246,34 (31,916) 257,93 (38,695) Tag 60 236,38 (34,380) 261,04 (40,752) Tag 0 232,97 (29,463) 244,64 (42,306) Tag 6 235,72 (26,051) 251,96 (38,464) Tag 60 228,28 (32,352) 254,18 (40,896) Tag 0 682,06 (66,592) 702,04 (100,039) Tag 6 667,156 (54,118) 653,893 (93,741) Tag 60 653,22 (61,768) 667,93 (86,952) (1/28) Alertness mit Warnton, Median in msec. (TAPA+m) 0,137 2,347 (1/28) Geteilte Aufmerksamkeit, Median in msec. (TAPGAM) 64 0,784 0,077 (1/28) Geteilte Aufmerksamkeit, Σ Auslassungen (TAPGASA) 1,56 (1,413) 2,31 (1,974) Tag 0 1,25 (1,390) 1,57 (1,399) Tag 6 1,06 (0,029) 2,50 (4,183) Tag 0 1,75 (1,390) 3,43 (6,572) Tag 6 1,31 (1,352) 1,93 (2,586) Tag 60 0,88 (1,088) 1,00 (1,109) Tag 0 433,94 (63,106) 464,75 (105,973) Tag 6 427,03 (72,543) 471,75 (109,399) Tag 60 406,03 (77,078) 479,82 (165,906) Tag 0 4,81 (2,713) 5,57 (4,751) Tag 6 3,56 (4,016) 5,21 (5,221) Tag 60 8,63 (13,195) 5,50 (3,368) 0,079 3,327 (1/27) Tag 60 Geteilte Aufmerksamkeit, Summe Fehler (TAPGASF) 0,334 0,968 (1/28) Inkompatibilität, Median in msec. (TAPIKM) 0,166 2,022 (1/28) Inkompatibilität, Summe Fehler (TAPIKSF) 0,886 0,021 (1/28) Bei der Untersuchung der Aufmerksamkeit ergab sich kein Unterschied hinsichtlich der beiden Dosierungen. 65 3.5.2.6. Depression, Euphorie, Ängste, Gedächtnisleistungen im Alltag Tabelle 30: Dosiseffekte zu den drei Testzeitpunkten: Depression, Euphorie, Ängste, Gedächtnisleistungen im Alltag. M: Mittelwert, SD: Standardabweichung. Untersuchte Funktion Depression Variable Dosis 500 mg (n=16) M (SD) Dosis 2000 mg (n=13) M (SD) ANOVA Hauptfaktor „Dosis“ p-Wert F-Wert 0,802 0,064 Beck-DepressionsInventar (BDI) Tag 0 6,25 (5,791) 5,29 (3,625) Tag 6 6,50 (7,127) 5,86 (6,200) Tag 60 5,56 (7,393) 5,57 (5,919) Tag 0 1,21 (2,455) 3,85 (4,879) Tag 6 2,00 (3,983) 2,79 (5,162) Tag 60 1,06 (3,336) 1,64 (4,181) Tag 0 0,50 (1,871) 0,00 (0,000) Tag 6 1,06 (2,351) 1,00 (2,542) Tag 60 0,31(1,250) 0,50 (1,871) Tag 0 0,79 (2,007) 3,38 (4,592) Tag 6 2,44 (3,759) 2,14 (4,487) Tag 60 0,63 (2,500) 1,43 (2,954) Tag 0 24,14 (11,831) 29,54 (13,950) Tag 6 26,36 (14,194) 26,50 (13,263) Tag 60 25,81 (20,354) 26,85 (16,668) (1/28) Neuropsychiatr. Inventar, Summe Depression (NPIDESU) Euphorie 0,108 2,778 (1/25) Neuropsychiatr. Inventar, Summe Euphorie (NPIEUSU) Ängste 0,959 0,003 (1/25) Neuropsychiatr. Inventar, Summe Angst (NPIANSU) Gedächtnis- Fragebogen zur leistungen Erfassung von im Alltag Gedächtnisleistung im 0,151 2,190 (1/25) Alltag (FEGA) 66 0,394 0,752 (1/24) Bei der Untersuchung nach Zeichen von Depression, Euphorie und Ängsten sowie der Selbstbeurteilung von Gedächtnisleistungen im Alltag ergaben sich keine Unterschiede zwischen den beiden Dosierungen. Zusammenfassung der Ergebnisse bezüglich des Dosiseffekts: Mit einer Ausnahme [p=0.043, F=4.528 (1/27)], die auf eine bessere Leistung der Niedrigdosis-Gruppe im BVRT (M: 8.69 an Tag 0; 8.31 an Tag 6; 8.31 Tag 60) im Vergleich zur Hochdosis-Gruppe (M: 7.15 an Tag 0; 6.38 an Tag 6; 7.46 an Tag 60) hinweist, wurde für den Faktor „Dosis“ kein Haupteffekt gefunden. 3.5.3. Interaktion zwischen „Dosis“ und „Untersuchungszeitpunkt“ Neben der Frage, welche Auswirkungen „Untersuchungszeitpunkt“ und „Dosis“ auf die Kognition haben, interessiert natürlich auch, ob mögliche Wechselwirkungen zwischen diesen Faktoren bestehen. Dies hätte zur Folge, dass sich die Leistungen der beiden Dosisgruppen im Verlauf der Untersuchung unterschiedlich darstellen und nicht, wie bei einem fehlenden Interaktionseffekt, gleichsinnig. Signifikante Wechselwirkungen zwischen Dosis und Untersuchungszeitpunkt ergaben sich lediglich in Bezug auf die Leistung im WIT-Subtest „Gedächtnis“ [p=0,037, F=3,505 (2/54)] die bei den Patienten mit der Niedrigdosis bei Abschluss der Therapie am Tag 6 signifikant anstieg (M=12,44 am Tag 0 vs. M=13.13 am Tag 6), bei den mit 2000 mg MP behandelten Patienten dagegen abnahm (M=13,57 am Tag 0 vs. M=10.86 am Tag 6; siehe auch Tabelle 26). 67 4. Diskussion Bei der Behandlung eines akuten Schubes einer Multiplen Sklerose ist die intravenöse Verabreichung hoher Dosen Kortikosteroide eine anerkannte und wirksame Therapie (Oliveri et al, 1998; Martinelli et al. 2009). Allerdings zeigt eine Vielzahl tierexperimenteller und humanwissenschaftlicher Studien, dass sowohl endogen erhöhte Glukokortikoidspiegel als auch exogen zugeführte Kortikoide - abhängig von Dosis und Dauer der Einwirkung - milde, vorübergehende bis schwere, längerfristige Beeinträchtigungen von Affektivität und kognitiven Leistungen hervorrufen können (Keenan et al. 1996; Fietta et al. 2009). Erklärt werden diese Effekte vor allem durch die hohe Kortikoidrezeptordichte des Hippokampus und seine Funktion als zentraler Ort für die Einspeicherung deklarativer Gedächtnisinhalte sowie in Verbindung mit Septum und Amygdala maßgeblichen Beteiligung an der Modulation von Affekten und Emotionen. Erhöhte endogene Kortisonspiegel, wie sie z. B. bei PTSD, Morbus Cushing oder Depression auftreten, gehen mit schlechteren Gedächtnisleistungen, v. a. im Bereich des deklarativen Gedächtnisses sowie Hippokampusatrophie einher. Es besteht eine potentielle Reversibilität der Veränderungen z. B. durch eine operative Behandlung bei Morbus Cushing (Bourdeau 2005). Patienten, welche z. B. aufgrund einer entzündlichen Erkrankung exogen Kortison erhalten, zeigen ebenfalls eine Verschlechterung des deklarativen Gedächtnisses. Teilweise findet man lediglich eine Beeinträchtigung des freien Informationsabrufs; Informationserwerb und –konsolidierung sind häufig unbeeinträchtigt. Bildgebende Untersuchungen zeigen eine reduzierte Aktivität der Hippokampusregion sowie teilweise eine Hippokampusatrophie. Auch diese Veränderungen sind nach einer Beendigung der Kortisontherapie potentiell reversibel (Mc Even 1999). Da bereits früh im Verlauf einer MS krankheitsbedingt kognitive Defizite auftreten können (Hoffmann et al. 2007) und im Verlauf einer längeren Erkrankung meist häufiger Schubbehandlungen durchgeführt werden, ist es zur Abwägung der therapeutischen Optionen unerlässlich, das Ausmaß sowie die Persistenz der 69 Gedächtnisstörungen durch die Therapie mit Kortikosteroiden so genau wie möglich zu erfassen. Zu den Auswirkungen der Hochdosis-Kortisontherapie auf neuropsychologische Funktionsparameter speziell bei MS-Patienten lagen zum Zeitpunkt des Beginns der vorliegenden Untersuchung lediglich Daten aus der Studie von Oliveri und Mitarbeitern aus dem Jahr 1998 vor (Oliveri et al. 1998). Es wurden insgesamt 14 Patienten mit schubförmig verlaufender MS mit Methylprednisolon intravenös behandelt: 4 Patienten mit 500 mg pro Tag über 5 Tage, 5 Patienten mit 1000 mg pro Tag über 7 Tage und 5 Patienten mit 2000 mg pro Tag über 5 Tage. Die Erfassung der kognitiven Leistungsfähigkeit erfolgte vor der Behandlung, nach 7 und nach 60 Tagen. Die Ergebnisse zeigten eine dosisunabhängige, selektive Verschlechterung der deklarativen Gedächtnisleistung an Tag 7, welche sich an Tag 60 jedoch wieder vollständig auf das Ausgangsniveau vor Kortisongabe zurückbildete. Alle übrigen erfassten kognitiven Funktionen zeigten keine Veränderung unter der Kortisontherapie. Um eine breitere empirische Basis zu erhalten und um weitere neuropsychologische Funktionsparameter unter Kortisontherapie bei MS-Patienten systematischer zu untersuchen, wurden in der vorliegenden Untersuchung bei 30 Patienten neben der mnestischen Leistung auch die Konzentrations- und Aufmerksamkeitsleistung, exekutive Funktionen und Leistungen der verbalen und visuo-konstruktiven Intelligenz erhoben. Es ergab sich ebenfalls eine selektive Verschlechterung der deklarativen Gedächtnisleistung an Tag 6, die jedoch an Tag 60 vollständig reversibel war. Alle übrigen untersuchten kognitiven Funktionen (Arbeitsgedächtnis, implizites Gedächtnis, Aufmerksamkeit, exekutive Funktionen) zeigten unter MP-Therapie keine Verschlechterung (Uttner et al. 2005). Die Verbesserungen in Teilbereichen des Arbeitsgedächtnisses, der exekutiven Funktionen und der geteilten Aufmerksamkeit könnten auf einen Übungseffekt zurückzuführen sein. Auch bei den Kontrollen kam es im Bereich der exekutiven Funktionen und der geteilten Aufmerksamkeit zu einer Leistungsverbesserung zwischen Untersuchungszeitpunkt 1 und 2. 70 Das Ausmaß der kognitiven Defizite war - bis auf einen von 24 Untertests - nicht abhängig von der verabreichten MP-Dosis, was mit einem Deckeneffekt sehr hoher Glukokortikoid-Dosen auf die Gedächtnisfunktionen zusammenhängen könnte. Die „kritische Dosis“, ab der kognitive Beeinträchtigungen auftreten, liegt vermutlich deutlich unter 500 mg pro Tag. So zeigten in einer plazebokontrollierten Untersuchung von Kirschbaum und Mitarbeitern gesunde Personen nach der einmaligen Verabreichung von bereits 10 mg Kortison signifikante Defizite im deklarativen, nicht aber impliziten Gedächtnis (Kirschbaum et al. 1996). Zeitgleich zu der vorliegenden Studie untersuchten Brunner und Mitarbeiter 21 Patienten mit MS, acht davon mit schubförmig-remittierendem Verlauf, und weitere neun Patienten, die an einer akuten Optikusneuritis erkrankt waren (Brunner et al. 2005). Die Behandlung erfolgte mit 500 mg MP pro Tag über 5 Tage; die ausführliche neuropsychologische Untersuchung erfolgte vor Beginn der Therapie, nach deren Abschluss (Tag 5) sowie ein drittes Mal fünf Tage nach Therapieende. Die Ergebnisse zeigten einen signifikanten Leistungseinbruch im deklarativen Gedächtnis nach Abschluss der MP-Therapie am Tag 5 mit fast vollständiger Normalisierung zum Testzeitpunkt 3, womit deutlich wurde, dass diese zu einem deutlich früheren Zeitpunkt als bisher vermutet erfolgt. Ein Effekt der Glukokortikoidtherapie auf Arbeitsgedächtnis und Aufmerksamkeitsfunktionen war nicht nachweisbar. Die aufgeführten Untersuchungen tragen dazu bei, die kortisoninduzierten kognitiven Veränderungen besser einschätzen zu können. Anatomische und bildgebende Untersuchungen dienen u. a. dazu, die beteiligten Hirnstrukturen zu identifizieren. Über die Funktion der Beeinträchtigung von kognitiven Funktionen durch erhöhte Kortisonspiegel existieren unterschiedliche Überlegungen. Oliver T. Wolf führt in seinem Review aus, dass es von Vorteil sein könnte, wenn im Falle eines akuten Ereignisses negative Erinnerungen von früheren, ähnlichen Ereignissen blockiert würden, um eine überschießende negative emotionale Situation zu verhindern (Wolf 2009). Vorstellbar wäre lt. Wolf auch, dass eine vorübergehende Blockade des Abrufs von Gedächtnisinhalten dem Gehirn erlaubt, wichtige Inhalte der aktuellen Situation effizienter zu verschlüsseln und abzuspeichern. So wiesen Allen und Allen 71 z. B. nach, dass der Abruf von Gedächtnisinhalten mit der Verschlüsselung und der Abspeicherung derselben interferiert (Allan u. Allen 2005). Durch das Wissen um die kortisoninduzierten kognitiven Veränderungen ergeben sich vor allem in Bezug auf posttraumatische Störungen und das Thema Lernen vielfältige Optionen. So könnte z. B. die Gabe von Kortison rasch nach einem traumatischen Ereignis das Auftreten bzw. die Schwere einer posttraumatischen Störung reduzieren (Zohar et al. 2011). Das Wissen um die Verschlechterung von Gedächtnisleistungen durch stressbedingte Erhöhung von endogenen Kortisonspiegeln fließt in aktuelle pädagogische Konzepte ein. Für MS-Patienten, die regelmäßig Kortison erhalten, um akute Schübe der Erkrankung abzumildern, sind die Ergebnisse der genannten Untersuchungen für die Abwägung von Therapieoptionen, für die Aufklärung über die Nebenwirkungen der Therapie und die Begleitung während der Therapie von hoher Relevanz. Zwar kann aufgrund der Reversibilität in den meisten Fällen von einem Verzicht auf diese Therapie oder zusätzliche Maßnahmen, um die kognitiven Defizite abzumildern, abgesehen werden; gleichwohl ist z. B. vorstellbar, dass die Kortisontherapie massive, im klinischen Alltag auffällige kognitive Defizite hervorruft, die als mangelndes Ansprechen auf die Therapie fehlinterpretiert werden bzw. die Compliance des Patienten reduzieren könnten. Das Wissen über die Selektivität und Reversibilität der kognitiven Einschränkungen kann in diesen Fällen zu einem Fortführen und Akzeptieren der (wirksamen) Therapie verhelfen. Die Interferontherapie als immunmodulierende, längerfristig angewandte Therapie bei MS-Patienten scheint nach bisher vorliegenden Daten keine negativen Auswirkungen auf kognitive Parameter zu haben; vielmehr zeigen sich (zumindest kurzfristig) signifikant positive Effekte der IFN-β-Therapie (Fischer et al. 2000). Auch für Azathioprin, Glatirameracetat und Natalizumab wurde keine Verschlechterung kognitiver Leistungen nachgewiesen, vielmehr scheinen diese Therapien (vermutlich v. a. durch die Verringerung der Schubfrequenz und Schwere der MS-Symptome) einen tendenziell günstigen Effekt auf neuropsychologische Funktionsparameter zu haben (Uttner et al. 2007). 72 Einschränkungen der vorliegenden Untersuchung Obwohl die meisten der in vorliegende Untersuchung eingeschlossenen Patienten eine sehr kurze Krankheitsgeschichte aufwiesen, zeigten sie verglichen mit den nach Alter, Schulbildung und Geschlecht gepaarten Kontrollpersonen ein schlechteres Ausgangsniveau bzgl. kognitiver Leistungen, was darauf hinweist, dass Beeinträchtigungen der kognitiven Funktionen bereits in frühesten Stadien bzw. schon subklinisch auftreten können. Somit sind gesunde Personen im Prinzip keine adäquate Kontrollgruppe für MS-Patienten. Es kann nicht ausgeschlossen werden, dass krankheitsabhängige kognitive Defizite mit kortison-induzierten Effekten interferieren. Allerdings ändert diese Unsicherheit nichts an der Validität der Ergebnisse der Untersuchung: Die kortison-abhängige Verschlechterung der kognitiven Leistungsfähigkeit, die an Tag 6 auftrat, unterschied sich deutlich von der Leistung vor Beginn der Therapie. Dass die Gedächtnisleistung an Tag 60 komplett reversibel war, weist auf eine krankheitsunabhängige, medikamenten-induzierte Veränderung hin. Unterstützt wird diese Interpretation auch durch Untersuchungen an Patienten mit chronisch-entzündlichen Erkrankungen, die unabhängig vom zentralen Nervensystem sind (z. B. rheumatoide Arthritis). Hier zeigt sich unter Kortisonbehandlung ebenfalls eine signifikante Verschlechterung des deklarativen Gedächtnisses (Coluccia et al. 2008). Eine unbehandelte Patientengruppe wäre jedoch eine passendere Kontrollgruppe. Allerdings wäre es schwierig, eine genügende Anzahl von Patienten zu finden, die eine allgemein anerkannte und wirksame Therapie mit Kortikosteroiden ablehnen würde. Hinzu kommt, dass man diese Behandlung aus ethischen Gründen nicht vorenthalten würde. Ausblick und Fazit Die längerfristigen Auswirkungen multipler Schubtherapien auf die Gedächtnisfunktionen sind bisher wenig untersucht. Allerdings deuten bisher vorliegenden Daten darauf hin, dass wiederholte Kortisonbehandlungen im Sinne einer Toleranzentwicklung bzw. eines Gewöhnungseffektes einen abgeschwächten Effekt auf das deklarative Gedächtnis haben (Brown et al. 2006). Vor allem die Arbeitsgruppe um Brown beschäftigt sich in neueren Untersuchungen mit den Möglichkeiten der Vermeidung oder Abschwächung von kognitiven Defiziten und Stimmungsschwankungen unter Kortisontherapie. So fanden sich erste Anhaltspunkte für eine Abschwächung der Wirkung einer Kortisonbehandlung auf 73 das deklarative Gedächtnis für Lamotrigin, einem Antiepileptikum, welches zunehmend auch für die Behandlung von psychiatrischen Erkrankungen, beispielsweise der bipolaren Störung eingesetzt wird (Brown et al. 2008b). Auch für Memantin, einem Wirkstoff, der in der Behandlung der Parkinson-Erkrankung und der Alzheimer-Demenz Verwendung findet, wurde eine positive Wirkung auf das deklarative Gedächtnis von Patienten unter Kortisontherapie nachgewiesen (Brown et 2008a). al. Für Acetaminophen, schmerzlindernder Wirkung, einem welchem Wirkstoff auch mit fiebersenkender neuroprotektive und Eigenschaften zugesprochen werden (in Deutschland weithin bekannt als Paracetamol) konnte hingegen keine Abschwächung von kortisoninduzierten Stimmungsänderungen oder Gedächtnisdefiziten nachgewiesen werden (Brown et al. 2010). Die Ergebnisse der bisher vorliegenden Studien zur Kortisonbehandlung bei MSPatienten im Dosisbereich 500-2000 mg/Tag zeigen zusammenfassend eine dosisunabhängige, reversible Verschlechterung des hippokampusvermittelten deklarativen Gedächtnisses. Neuronales Korrelat sind Rezeptorveränderungen, Nervenzellschädigung sowie reduzierte Neurogenese; morphologisch als Atrophie des Hippokampus, in bildgebenden Verfahren als verminderte Aktivität der Hippokampusregion nachweisbar. Die Reversibilität der Veränderungen betrifft sowohl die Gedächtnisleistung als auch die morphologischen Veränderungen. Unklar ist, wie lange die Kortisoneinwirkung auf diese Weise toleriert wird und ab wann die Veränderungen - zumindest teilweise - irreversibel sind. Hierzu sind noch differenziertere Untersuchungen bzgl. akuter und chronischer kortisoninduzierter Veränderungen der Gedächtnisleistung notwendig. Bezüglich der Behandlung eines akuten Schubes einer MS mit einer HochdosisKortisontherapie ergibt sich durch die vorliegenden Ergebnisse ein besseres Verständnis der Wirkung der Therapie auf die Gedächtnisleistung der teilweise bereits krankheitsbedingt kognitiv beeinträchtigten Patienten und somit die Möglichkeit einer individuellen Therapieplanung, Aufklärung und Begleitung der MSPatienten. 74 5. Zusammenfassung Die Multiple Sklerose (MS) ist eine chronische, demyelinisierende Erkrankung des zentralen Nervensystems (ZNS), welche häufig in Schüben verläuft und von milden Beeinträchtigungen wie vorübergehenden Sehstörungen oder Sensibilitätsstörungen bis zu schwerwiegenden Behinderungen wie dauerhafter Einschränkung der Mobilität und Bettlägerigkeit führen kann. Die Behandlung erfolgt einerseits langfristig immunmodulierend; in akuten Erkrankungsphasen vorübergehend antientzündlich und immunsuppressiv, um die Schäden der akuten Entzündung möglichst gering zu halten. Die Hochdosis-Kortisontherapie ist eine wirksame und etablierte Therapie eines akuten Schubes einer Multiplen Sklerose; eine höhere Dosierung des Medikaments korreliert mit einer besseren Wirksamkeit der Therapie. Sowohl endogen erhöhte Kortisonspiegel wie etwa bei Morbus Cushing oder der Posttraumatischen Belastungsstörung, als auch exogen zugeführtes Kortison wie etwa bei der Behandlung der rheumatoiden Arthritis oder des Asthmas können neben vielfältigen körperlichen Nebenwirkungen sowohl psychische als auch kognitive Veränderungen hervorrufen. Betroffen ist hierbei vor allem das deklarative, explizite Gedächtnis als Speicherort für Ereignisse und Fakten, die im Laufe des Lebens erlernt wurden. Anatomisch ist diese Gedächtnisleistung v. a. in der Hippokampusregion verankert, zudem spielen multiple Faserverbindungen zu verschiedenen Kortexarealen eine wichtige Rolle. Die Wirkung der Kortikoide auf das deklarative Gedächtnis ist durch die hohe Zahl an Glukokortikoidrezeptoren in der Hippokampusregion zu erklären. Es kommt zu veränderter Genexpression und Proteinsynthese, Nervenzellschädigung, verminderter Neurogenese und Nervenzelluntergang; in bildgebenden Verfahren als verminderte (metabolische) Aktivität bzw. Atrophie nachweisbar. Bei MS-Patienten sind häufig schon in frühen Stadien der Erkrankung kognitive Defizite im Sinne von Gedächtnisstörungen, Störungen der Aufmerksamkeit, Verarbeitungsgeschwindigkeit und der exekutiven Funktionen nachweisbar. Umso 75 bedeutsamer erscheinen vor diesem Hintergrund die sorgfältige Abwägung der Therapieoptionen sowie die Aufklärung der Patienten vor einer Therapie mit Hochdosis-Kortikoiden. Zum Zeitpunkt des Beginns der vorliegenden Untersuchung lagen zur Wirkung der Hochdosis-Kortikoidtherapie auf neuropsychologische Funktionsparameter nur wenige Daten vor. Diese wiesen auf eine Reversibilität der festgestellten Verschlechterung der deklarativen Gedächtnisleistung hin. Ein möglicher Dosiseffekt war unklar bzw. nur an wenigen Patienten untersucht. Durchgeführt wurde eine explorative, doppelblinde, randomisierte Dosisvergleichsstudie an 30 MS-Patienten. Eine umfangreiche testpsychologische Untersuchung erfasste die ausführliche Evaluation des verbalen und nonverbalen Arbeitsgedächtnisses, des deklarativen sowie des impliziten Gedächtnisses. Zudem wurden verschiedene Aufmerksamkeitsmaße, exekutive Funktionen, der intellektuelle Status sowie Selbst- und Fremdeinschätzungen der psychischen Befindlichkeit und der subjektiven Gedächtnisbeeinträchtigung erhoben. Zehn unbehandelte Kontrollpersonen wurden zu zwei Testzeitpunkten untersucht. Die vorliegende Untersuchung ergab eine dosisunabhängige, reversible, selektive Verschlechterung im Abruf deklarativ-episodischer Gedächtnisinhalte unmittelbar nach der Kortikoidtherapie. Eine zeitgleich mit dieser Untersuchung durchgeführte Studie einer anderen Arbeitsgruppe mit ebenfalls 30 Patienten, jedoch ohne Dosisvergleich, kam zu entsprechenden Ergebnissen mit Hinweisen auf eine frühe Reversibilität der kognitiven Einschränkungen. Die Untersuchungsergebnisse führen zu mehr Wissen und Sicherheit in der Therapieplanung und Beratung von MS-Patienten bezüglich einer Kortikoidtherapie, wobei weiter untersucht werden muss, ab welcher Dosis bzw. Einwirkungsdauer die Reversibilität der Veränderungen evtl. nicht mehr gegeben ist. 76 6. Literaturverzeichnis Allan K, Allen R. Retrieval attempts transiently interfere with concurrent encoding of episodic memories but not vice versa. J Neurosci (2005) 25:8122-8130. Amato MP, Ponziani G. A prospective study on the prognosis of multiple sclerosis. Neurol Sci (2000) 21:831-838. Amato MP, Zipoli V, Portaccio E. Cognitive changes in multiple sclerosis, Expert Rev Neurother (2008) 8:1585-1596. Arndt M, Kunert HJ, Saß H, Norra C. Kognitive Störungen nach akzidenteller hoch dosierter Kortisontherapie. Nervenarzt (2004) 75:904-907. Baddeley A. The concept of episodic memory. Philos Trans R Soc Lond B Biol Sci (2001) 356:1345-1350. Barnes D, McDonald WI. The ocular manifestations of multiple sclerosis. 2. Abnormalities of eye movements. J Neurol Neurosurg Psychiatry (1992) 55:863-868. Basso A, Spinnler H, Vallar G, Zanobio ME. Left hemisphere damage and selective impairment of auditory verbal short-term memory. A case study. Neuropsychologia (1982) 20:263-274. Bennett-Levy J., Powell GE. The subjective memory questionnaire (SMQ). An investigation into the self-reporting of “real-life” memory skills. Br J Clin Psychol (1980) 19:177-188. Benton AL. Der Benton Test. 5. Auflage. Hans Huber Verlag Bern, 1981. Benton AL., de Hamsher KS. Multilingual aphasia examination. Manual revised, University of Iowa, Iowa City, 1976. Bergamaschi R. Prognostic factors in multiple sclerosis. Int Rev Neurobiol (2007) 79:423-447. Bliss TV, Collingridge GL. A synaptic model of memory: long-term potentiation in the hippocampus Nature (1993) 361:31-39. Born J, Kern W, Fehm-Wolfsdorf G, Fehm HL. Cortisol effects on attentional processes in man as indicated by event-related potentials. Psychophysiology (1987) 24:286-292. Born J, Plihal W. Memory consolidation in human sleep depends on inhibition of glucocorticoid release. Neuroreport (1999) 10:2741-2747. Bourdeau I, Bard C, Forget H, Boulanger Y, Cohen H, Lacroix A. Cognitive function and cerebral assessment in patients who have Cushing's syndrome. Endocrinol Metab Clin North Am. (2005) 34:357-369. 77 Bremner JD, Narayan M, Anderson ER, Staib LH, Miller HL, Charney DS. Hippocampal volume reduction in major depression. Am J Psychiatry (2000) 157:115-117. Brønnum-Hansen H, Koch-Henriksen N. Stenager E. Trends in survival and cause of death in Danish patients with multiple sclerosis. Brain (2004)127:844-850. Brønnum-Hansen H, Stenager E, Nylev Stenager E, Koch-Henriksen N. Suicide among Danes with multiple sclerosis.J Neurol Neurosurg Psychiatry (2005) 76:14571459. Brown ES, Beard L, Frol AB. Rush AJ. Effect of two prednisone exposures on mood and declarative memory. Nerobiol Learn Mem (2006) 86:28-34. Brown ES, Denniston D, Gabrielson B, Khan DA, Khanani S, Desai S. Randomized, double-blind, placebo-controlled trial of acetaminophen for preventing mood and memory effects of prednisone bursts. Allergy Asthma Proc (2010) 31:331-336. Brown ES, J Woolston D, Frol A, Bobadilla L, Khan DA, Hanczyc M, Rush AJ, Fleckenstein J, Babcock E, Cullum CM. Hippocampal volume, spectroscopy, cognition, and mood in patients receiving corticosteroid therapy. Biol Psychiatry (2004) 55:538-545. Brown ES, Vazques M, Nakamura A. Randomized, placebo-controlled, crossover trial of memantine for cognitive changes with corticosteroid therapy. Biol Psychiatry. (2008a) 64:727-729. Brown ES, Wolfshohl J, Shad MU, Vazques M, Osuji IJ. Attenuation of the effects of corticosteroids on declarative memory with lamotrigine. Neuropsychopharmacology (2008b) 33:2376-2383. Brück W. The pathology of multiple sclerosis is the result of focal inflammatory demyelination with axonal damage. J Neurol (2005) 252:3-9. Brunner R, Schaefer D, Hess K, Parzer P, Resch F, Schwab S. Effect of corticosteroids on short-term and long-term memory. Neurology (2005) 64:335-337. Calabrese P, Penner IK: Neuropsychologische Störungen bei MS. In: Calabrese P (Hrsg) Multiple Sklerose und Kognition, Thieme Verlag, 2007, S. 2-9. Chen L, Gordon LK. Ocular manifestations of multiple sclerosis. Current Opinion in Ophthalmology (2005)16:315-320. Ciccone A, Beretta S, Brusaferri F, Galea I, Protti A, Spreafico C. Corticosteroids for the long-term treatment in multiple sclerosis. Cochrane Database Syst Rev (2008) Jan 23:CD006264. Colla M, Kronenberg G, Deuschle M, Meichel K, Hagen T, Bohrer M, Heuser I. Hippocampal volume reduction and HPA-system activity in major depression. J Psychiatr Res (2007) 41:553-560. 78 Coluccia D, Wolf OT, Kollias S, Roozendaal B, Forster A, de Quervain DJ. Glucocorticoid therapy-induced memory deficits: acute versus chronic effects.J Neurosci (2008) 28: 3474-3478. Compson A, Coles A. Multiple Sclerosis. Lancet (2002) 359:1221-1231. Corkin S. What`s new with the amnesic patient H.M.? Nature Reviews (2002) 3:153160. Cummings JL. The Neuropsychiatric Inventory. Neurology (1994) 44:2308-2314. Dalton CM, Chard DT, Davies GR, Miszkiel KA, Altmann DR, Fernando K, Plant GT, Thompson AJ, Miller DH. Early development of multiple sclerosis is associated with progressive grey matter atrophy in patients presenting with clinically isolated syndromes, Brain (2004) 127:1101-110. Eker C, GonulAS. Volumetric MRI studies of the hippocampus in major depressive disorder: Meanings of inconsistency and directions for future research. World J Biol Psychiatry (2010) 11:19-35. Fazzito MM, Jordy SS, Tilbery CP. Psychiatric disorders in multiple sclerosis patients. Arq Neuropsiquiatr (2009) 67:664-667. Fierro B, Salemi G, Brighina F, Buffa D, Conte S, La Bua V, Piazza A, Savettieri G. A transcranial magnetic stimulation study evaluating methylprednisolone treatment in multiple sclerosis. Acta Neurol Scand (2002)105:152-157. Fietta Pierluigi, Fietta Pieranna, Delsante G. Central nervous system effects of natural and synthetic glucocorticoids. Psychiatry Clin Neurosci (2009) 63:613-622. Fischer JS, Priore RL, Jacobs LD, Cookfair DL, Rudick RA, Herndon RM, Richert JR, Salazar AM, Goodkin DE, Granger CV, Simon JH, Grafman JH, Lezak MD, O'Reilly Hovey KM, Perkins KK, Barilla-Clark D, Schacter M, Shucard DW, Davidson AL, Wende KE, Bourdette DN, Kooijmans-Coutinho MF. Neuropsychological effects of interferon beta-1a in relapsing multiple sclerosis. Ann Neurol (2000) 48:885-892. Flachenecker P, Hartung HP. Course of illness and prognosis of multiple sclerosis. 1: The natural illness course, Nervenarzt (1996a) 67:435-443. Flachenecker P, Hartung HP. Course of illness and prognosis of multiple sclerosis. 2: Predictive value of clinical and paraclinical factors. Nervenarzt (1996b) 67:444-451. Forget H, Lacroix A, Somma M, Cohen H. Cognitive decline in patients with Cushing`s syndrome. J Int Neuropsychol Soc (2000) 6:20-29. Frohman EM, Shah A, Eggenberger E, Metz L, Zivadinov R, Stüve O. Corticosteroids for Multiple Sclerosis: I. Application for treating exacerbations. Neurotherapeutics (2007) 4:618-626. Goeb JL, Even C, Nicolas G, Gohier B, Dubas F, Garré JB. Psychiatric side effects of interferon-beta in multiple sclerosis. Eur Psychiatry (2006) 21:186-193. 79 Gold R, Hemmer B, Wiendl H. DGN/KKNMS Leitlinie zur Diagnose und Therapie der MS. Online-Version, Stand 12.04.2012. GoodkinDE, Hertsgaard D, Rudick RA. Exacerbation rates and adherence to disease type in a prospectively followed-up population with multiple sclerosis. Implications for clinical trials. Arch Neurol (1989) 46:1107-1112. Hautzinger M, Bailer M, Worall H, Keller F. Beck-Depressions-Inventar (BDI). Hans Huber Verlag Bern, 1994. Heim C, Nemeroff CB. Neurobiology of Posttraumatic Stress Disorder. CNS Spectr (2009)14:13-24. Hein T, Hopfenmüller W. Projection of the number of multiple sclerosis patients in Germany. Nervenarzt (2000) 71:288-294. Het S, Ramlow G, Wolf OT. A meta-analytic review of the effects of acute cortisol administration on human memory. Psychoneuroendocrinology (2005) 30:771-784. Hoffmann S, Tittgemeyer M, von Cramon DY. Cognitive impairment in multiple sclerosis. Curr Opin Neurol. (2007) 3:275-280. Horner HC, Packan DR, Sapolsky RM. Glucocorticoids inhibit glucose transport in cultures hippocampal neurons and glia. Neuroendocrinology (1990) 52:57-64. Jacobson L, Sapolsky R. The role of the hippocampus in feedback regulation of the hypothalamic-pituitary-adrenocortical axis. Endocr Rev (1991) 12:118-134. Jäger AO, Althoff K. Der Wilde-Intelligenz-Test (WIT). Ein Strukturdiagnostikum. Deutsche Gesellschaft für Personalwesen e. V. Hogrefe Verlag, 1983. José Sá M. Psychological aspects of multiple sclerosis. Clinical Neurology and Neurosurgery (2008) 110:868-877. Kantarci OH, Weinshenker BG. Natural History of Multiple Sclerosis. Neurol Clin (2005) 23:17-38. Keenan PA, Jacobson MW, Soleymani RM, Mayes MD, Stress ME, Yaldoo DT. The effect on memory of chronic prednisone treatment in patients with systemic disease. Neurology (1996) 47:1396-1402. Kessler J, Denzler P, Markowitsch J. Demenz Test. Hogrefe Verlag, 2. Auflage, 1999. Kirschbaum C, Wolf OT, May M, Wippich W, Hellhammer DH. Stress and treatmentinduced elevations of cortisol levels associated with impaired declarative memory in healthy adults. Life Sci (1996) 58:1475-1483. Klotz L, Gold R, Hemmer B, Korn T, Zipp F, Hohlfeld R, Kieseier BC, Wiendl H. Diagnostik der Multiplen Sklerose 2010 Revision der McDonald-Kriterien. Nervenarzt (2011) 82:1302-1309. 80 Koch-Henriksen N, Sørensen PS. The changing demograhic pattern of multiple sclerosis epidemilology. Lancet Neurol (2010) 9:520-532. Leary SM, Porter B, Thompson AJ. Multiple sclerosis: diagnosis and the management of acute relapses, Postgrad Med J (2005) 81:302-308. Li Y, Ji YJ, Jiang H, Liu DX, Zhang Q, Fan SJ, Pan F. Effects of unpredictable chronic stress on behavior and brainderived neurotrophic factor expression in CA3 subfield and dentate gyrus of the hippocampus in different aged rats. Chin Med J (2009)122:1564-1569. Lublin FD, Reingold SC. Defining the clinical course of multiple sclerosis. Neurology (1996) 46:907-911. Lupien SJ, Gillin CJ, Hauger RL. Working memory is more sensitive than declarative memory to the acute effects of corticosteroids: a dose-response study in humans. Behav neurosci (1999) 113:420-430. Lupien SJ, McEwen BS. The acute effects of corticosteroids on cognition: integration of animal and human model studies. Brain Res Brain Res Rev (1997) 24:1-27. Markowitsch HJ. Gedächtnis als zeitabhängiger Prozess. In: Markowitsch HJ. Gedächtnisstörungen. Kohlhammer, 1999, S. 14-15. Martinelli V, Rocca MA, Annovazzi P, Pulizzi A, Rodegher M, Martinelli Boneschi F, Scotti R, Falini A, Sormani MP, Comi G, Filippi M. A short-term randomized MRI study of high-dose oral vs intravenous methylprednisolone in MS. Neurology (2009) 22:1842-1848. McEwen BS, De Kloet ER, Rostene W. Adrenal steroid receptors and actions in the nervous system. Physiol Rev (1986) 66:1121-1188. McEwen BS. Stress and hippocampal plasticity. Annu Rev Neurosci. (1999) 105-122. Mechelli R, Annibali V, Ristori G, Vittori D, Coarelli G, Salvetti M. Multiple sclerosis etiology: beyond genes and environmend. Expert Rev Clin Immunol (2010) 6:481490. Michaud K, Forget H, Cohen H Chronic glucocorticoid hypersecretion in Cushing`s syndrome exacerbates cognitive aging. Brain and Cognition (2009) 71:1-8. Miller D, Compston A. The differential diagnosis of MS. In: Compston A (Hrg.) McAlpine`s Multiple Sclerosis. Elsevier Churchill Livingstone New York, 2006, S. 389-437. Milner B. Interhemispheric differences in the localization of psychological processes in man. Br Med Bull (1971) 27:272-277. Myhr KM, Mellgren SI. Corticosteroids in the treatment of multiple sclerosis. Acta Neurol Scand Suppl (2009) 189:73-80. 81 Newcomer JW, Craft S, Hershey T, Askins K, Bardgett ME. Glucocorticoid-induced impairment in declarative memory performance in adult humans. J Neurosci (1994) 14:2047-2053. van Niekerk JK, Huppert FA, Herbert J. Salivary cortisol and DHEA: association with measures of cognition and well-being in normal older men, and effects of three months of DHEA supplementation. Psychoneuroendocrinology (2001) 26:591-612. Oliveri RL, Sibilia G, Valentino P, Russo C, Romeo N, Quattrone A. Pulsed methylprednisolone induces a reversible impairment of memory in patients with relapsing-remitting multiple sclerosis. Acta Neurol Scan (1998) 97:366-369. Oliveri RL, Valentino P, Russo C, Sibilia G, Aguglia U, Bono F, Fera F, Gambardella A, Zappia M, Pardatscher K, Quattrone A. Randomized trial comparing two different high doses of methylprednisolone in MS: a clinical and MRI study. Neurology (1998) 50:1833-1836. Pittock SJ, Lucchinetti CF. The Pathology of MS: New insights and potential clinical applications. The Neurologist (2007)13:45-56. Polman CH, Reingold SC, Banwell B, Clanet M, Cohen JA, Filippi M, Fujihara K, Havrdova E, Hutchinson M, Kappos L, Lublin FD, Montalban X, O'Connor P, Sandberg-Wollheim M, Thompson AJ, Waubant E, Weinshenker B, Wolinsky JS. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol (2011) 69:292-302. Pugliatti M, Rosati G, Carton H, Riise T, Drulovic J, Vécsei L, Milanov I. The epidemiology of multiple sclerosis in Europe. Eur J Neurol (2006) 13:700-722. de Quervain DJ, Henke K, Aerni A, Treyer V, McGaugh JL, Berthold T, Nitsch RM, Buck A, Roozendaal B, Hock C. Glucocorticoid-induced impairment of declarative memory retrieval is associated with reduced blood flow in the medial temporal lobe. Eur J Neurosci (2003) 17:1296-1302. de Quervain DJ, Roozendaal B, Nitsch RM, McGaugh JL, Hock C. Acute cortisone administration impairs retrieval of long-term declarative memory in humans. Nat Neurosci (2000) 3:313-314. Regard M, Strauss E, Knapp P. Five-Point Test (1982). In: Spreen O u. Strauss EA. Compendium of neuropsychological tests: Administration, norms, and commentary. NY. OxfordUniversity Press, 1998, S. 203-207. Rogers JM, Panegyres PK. Cognitive impairment in multiple sclerosis: evidencebased analysis and recommendations. J Clin Neurosci (2007) 14:919-927. Roodhooft JM. Ocular problems in early stages of multiple sclerosis Bull Soc Belge Ophtalmol (2009) 313:65-68. Roozendaal B. Stress and memory: opposing effects of glucocorticoids on memory consolidation and memory retrieval. Neurobiol Learn Mem (2002) 78:578-595. 82 Sadovnick AD, Eisen K, Ebers GC, et al. Cause of death in patients attending multiple sclerosis clinics. Neurology 1991;41:1193–1196. Schacter DL, Alpert NM, Savage CR, Rauch SL, Albert MS. Conscious recollection and the human hippocampal formation: Evidence from positron emission tomography, Proc Natl Acad Sci USA. (1996) 93:321-325. Schmidt KH, Metzler P. Wortschatztest (WST). Beltz Test GmbH, Weinheim, 1992. Schmidt RM, Hoffmann F. Blasenstörungen. In: Schmidt/Hoffmann. Multiple Sklerose. Urban & Fischer, 2002, S. 48. Schmidtke K, Vommer H. Retrograde amnesia: a study of its relation to anterograde amnesia and semantic memory deficits. Neuropsychologia (1997) 35:505-518. Schüler S, Hoffmann F. Neurophysiologische Untersuchungen zur Diagnostik. In: Schmidt/Hoffmann. Multiple Sklerose. Urban & Fischer, 2002, S. 162-180. Schuri U. Lernen und Gedächtnis. In: von Cramon D, Ziehl J (Hrsg). Neuropsychologische Rehabilitation: Grundlagen, Diagnostik, Behandlungsverfahren, Springer-Verlag, 1988, S. 215-274. Scoville WB, Milner B. Loss of recent memory after bilateral hippocampal lesions. J Neuropsychiatry Clin Neurosci (2000) 12:103-113. Shapiro M. Plasticity, hippocampal place cells, and cognitive maps. Arch Neurol (2001) 58:874-881. Sheline YI, Sanghavi M, Minun MA et al. Depression duration but not age predicts hippocampal volume loss in medically healthy women with recurrent major depression. J Neurosci (1999) 19:5034-5043. Solaro C, Messmer Uccelli M. Pharmocological management of pain in patients with multiple sclerosis. Drugs (2010) 9:1245-1254. Squire LR, Kandel ER. Das deklarative Gedächtnis. In: Gedächtnis: Die Natur des Erinnerns. Spekturm Akademischer Verlag, 1999, S. 76-89. Squire LR, Kandel ER. Ein synaptischer Speichermechanismus für das deklarative Gedächtnis. In: Gedächtnis: Die Natur des Erinnerns. Spekturm Akademischer Verlag, 1999, S. 120-137. Squire LR, Memory and the hippocampus: a synthesis from findings with rats, monkeys, and humans. Psychol Rev (1992) 99:195-231. StarkmanMN, SchteingartDE. Hippocampal formation volume, memory dysfunction, and cortisol levels in patients with Cushing`s syndrome. Biol Psychiatry (1992) 32:756-764. Steidl G. Neufassung und Normierung des Münchner Verbalen Gedächtnistests. Unveröffentliche Dissertation, Ludwig-Maximilians-Universität, München, 1999. 83 Swanton JK, Fernando K, Dalton CM, Miszkiel KA, Thompson AJ, Plant GT, Miller DH. Modification of MRI criteria for multiple sclerosis in patients with clinically isolated syndromes. J Neurol Neurosurg Psychiatry (2006) 77: 830-833. Tewes U. Hamburg-Wechsler Intelligenztest für Erwachsene, Revision. Handbuch und Testanweisung. Verlag Hans Huber, 1991. Tintoré M. New options for early treatment of multiple sclerosis. J Neurol Sci (2009) 277:9-11. Tumani H, Hartung HP, Hemmer B, Teunissen C, Deisenhammer F, Giovannoni G, Zettl UK; BioMS Study Group. Cerebrospinal fluid biomarkers in multiple sclerosis. Neurobiol Dis (2009) 35:117-127. Uttner I, Müller S, Zinser C, Maier M, Süssmuth S, Claus A, Ostermann B, Elitok E, Ecker D, Brettschneider J, Gold R, Tumani H. Reversible impaired memory induced by pulsed methylprednisolone in patients with MS. Neurology (2005) 64:1971-1973. Uttner I, Tumani H, Gold R. Einfluss von Immunsuppression und Immunmodulation auf die Kognition. In: Calabrese P (Hrsg). Multiple Sklerose und Kognition. Thieme Verlag, 2007, S. 10-17. Varney NR, Alexander B MacIndoe JH. Reversible steroid dementia in patients without steroid psychosis. Am J Psychiatry (1984) 141:369-372. Vucic S, Burke D, Kiernan MC. Fatigue in multiple sclerosis: mechanisms and management, Clinical Neurophysiology (2010) 121:809-817. Warrington TP, Bostwick JM. Psychiatric adverse effects of corticosteroids, Mayo Clin Proc (2006) 81:1361-1367. Wiendl H, Kieseier BC, Gold R, Hohlfeld R, Bendszus M, Hartung HP. Revision der neuen McDonald-Diagnosekriterien, Nervenarzt (2006) 77:1235-1245. Wiendl H, Kieseier BC. Experimentelle Behandlungen. In: Wiendl H, Kieseier BC. Multiple Sklerose. Kohlhammer, 2010, S. 106-110. Wiendl H, Kieseier BC. Gegenwärtige Therapiestrategien. In: Wiendl H, Kieseier BC. Multiple Sklerose. Kohlhammer, 2010, S. 80-106. Wolf OT, Convit A, McHugh PF, Kandil E, Thorn EL, De Santi S, McEwen BS, de Leon MJ. Cortisol differentially affects memory in young and elderly men. Behav Neurosci (2001) 115:1002-1011. Wolf OT. Stress and memory in humans: twelve years of progress? Brain Res (2009) 1293:142-154. Wolkowitz OM, Burke H, Epel ES, Reus VI. Glucocorticoids: Mood, memory, and mechanisms, Ann N Y Acad Sci (2009) 1179:19-40. 84 Wolkowitz OM, Reus VI, Canick J, Levin B, Lupien S. Glucocorticoid medication, memory and steroid psychosis in medical illness. Ann NY Acad Sci (1997) 823:8186. Zimmermann P, Fimm B. Testbatterie zur Aufmerksamkeitsprüfung (TAP). Herzogenrath: Psytest, 1993. Zohar J, Juven-Wetzler A, Sonnino R, Cwikel-Hamzany S, Balaban E, Cohen H. New insights into secondary prevention in post-traumatic stress disorder. Dialogues Clin Neurosci (2011) 13:301-309. 85 Danksagung und Lebenslauf wurden aus Gründen des Datenschutzes entfernt.