Generationswechsel Angiospermen (Bedecktsamer)
Werbung

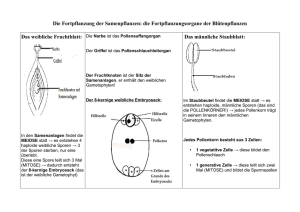
1 Generationswechsel – Angiospermen (Bedecktsamer) © Dr. VEIT M. DÖRKEN, Universität Konstanz, FB Biologie Der von freiem Wasser unabhängige Gymnospermen-Generationswechsel erlaubt erstmals die Besiedelung trockener Landstandorte. Die weiteren Verbesserungen des Generationswechsels in den Angiospermen zielen darauf ab, den Reproduktionserfolg unter fortlaufender Materialreduktion weiter zu maximieren. Abb. 1: Trochodendron aralioides, ursprünglich gestaltete Zwitterblüte; eine sterile Blütenhülle fehlt; die zahlreichen spiralig inserierenden Staub- und Fruchtblätter sind frei; Abb. 2: Drimys winteri, ursprünglich gestaltete Zwitterblüte; sterile Blütenhülle (Perigon) vorhanden; Perigonblätter alle gleich gestaltet; zahlreiche freie Staub- und Fruchtblätter; Abb. 3: Passiflora caerulea, stark abgeleitete Zwitterblüte; Blütenhülle in Kelch- und Kronblätter gegliedert; eine strahlenförmig gestaltete Nebenkrone verstärkt den Schauapparat; Abb. 4: Juglans regia, stark abgeleitete weibliche Blüten; Staubblätter vollständig reduziert; Perianth als Anpassung an die sekundäre Windblütigkeit bis auf den Kelch reduziert; In den Angiospermen sitzen die Makrosporophylle (Karpelle) und Mikrosporophylle (Staubgefäße) meist in zwittrigen Blüten. Ontogenetisch stehen die Samenanlagen, welche an den Karpellrändern inserieren, zunächst aufrecht oder sind nur leicht eingekrümmt. Das Makrosporangium, der Nucellus, ist in diesem frühen Stadium 2 noch nicht vollständig von den beiden Integumenten umhüllt. In der weiteren Entwicklung der Samenanlage kommt es dann zur Einkrümmung, sodass sie in die anatrope Form übergeht. Nur eine einzige Zelle differenziert sich im Makrosporangium zur Makrosporenmutterzelle und durchläuft eine Meiose. Aufgrund der Lage der Makrosporenmutterzelle lassen sich die Samenanlagen der Angiospermen grob in zwei Gruppen einteilen. Dies sind zum einen die tenuinucellaten Samenanlagen, bei denen die Makrosporenmutterzelle von nur einer Zellschicht Makrosporangiumgewebe umgeben ist, und zum anderen die crassinucellaten Samenanlagen, bei denen die Makrosporenmutterzelle tief im Makrosporangium von mehreren Zellschichten bedeckt liegt. Abb. 5: Lilium candidum, synkarpes Gynoeceum, das Abb. 6: Lilium candidum, Detail einer Samenanlage aus 3 verwachsenen Karpellen aufgebaut ist; die mit denen für Angiospermen typischen 2 Integumenten; Samenanlagen stehen zentralwinkelständig; Aus den drei Kernteilungen, die die Makrospore durchläuft, entstehen acht Kerne, die jedoch nur sieben Zellen bilden. Die größte dieser sieben Zellen enthält zwei Kerne und bildet das Makroprothallium aus. Aufgrund der sackartigen Struktur wird diese Zelle auch als Embryosackzelle bezeichnet, in der sich die ersten Schritte der Embryogenese des neuen Embryos abspielen. Die übrigen sechs Zellen sind in zwei Dreiergruppen aufgeteilt, welche vollständig innerhalb der Wand der Embryosackzelle liegen. Beide dieser Dreiergruppen können als ein auf zwei Zellen stark reduziertes Archegonium mit einer Eizelle aufgefasst werden, wobei nur die der Mikropyle zugewandte Gruppe ein funktionierendes Archegonium mit einer Eizelle darstellt. Die der Mikropyle gegenüberliegenden Kerne werden als Antipoden bezeichnet und sind steril. Die beiden seitlichen Zellen am Archegonium werden aufgrund einer unterstützenden Funktion bei der Befruchtung als Synergiden 3 bezeichnet. Die Embryosackzelle mit den in ihr liegenden Zellen heißt Embryosack. Die im Embryosack liegenden Zellen bleiben stets wandlos. In diesem Stadium der Embryosackentwicklung erfolgt später die Befruchtung durch den eindringenden Pollenschlauch. Abb. 7: Lilium candidum, Detail einer jungen Abb. 8: Lilium candidum, Detail eines Embryosacks im 8-kernigen Stadium; Samenanlage mit großer Embryosackmutterzelle; In den Pollensäcken (= Mikrosporangien) entwickeln sich einige, sog. primäre Archesporzellen, aus denen durch weitere Teilungen Pollenkornmutterzellen hervorgehen. Die Pollenkornmutterzellen sind zum Zeitpunkt der Meiose von einer Kallosehülle umgeben. Innerhalb des Mikrosporangiums beginnt unmittelbar nach Bildung der Sporenwand die Ausbildung des Mikroprothalliums mit einer ersten Teilung in eine generative und eine vegetative Zelle. Artspezifisch erfolgt die Teilung der generativen Zelle in zwei spermatogene Zellen noch im Mikrosporangium selbst oder erst, wenn der Pollen auf der Narbe gelandet ist. Abb. 9: Lilium candidum, Querschnitt durch ein Abb. 10: Lilium candidum, reife Pollenkörner mit einer Staubblatt; je zwei Pollensäcke bilden eine Theke; die vegetativen großen Pollenschlauchzelle und einer Pollensäcke entsprechen dem Mikrosporangium; kleineren generativen Zelle; 4 Das Pollenkorn keimt erst dann, wenn es auf der Narbe angekommen ist. Es bildet sich zunächst eine einzellige, unverzweigte, schlauchartige Struktur aus, der Pollenschlauch. Dieser wächst der Narbe entlang und weiter über das vom Karpellrand auf den Plazenten gebildete Pollenschlauchleitgewebe zu den Samenanlagen. Dort dringt er durch die Mikropyle in die Samenanlagen ein. Dieser Vorgang wird als porogame Befruchtung bezeichnet. Daraufhin öffnet sich der Pollenschlauch und entlässt die beiden generativen unbegeißelten Spermazellen. Von denen verschmilzt eine mit der Eizelle zur diploiden Zygote, die andere mit den zwei vorhandenen Kernen der Embryosackzelle und bildet dort einen triploiden Kern, den sekundären Embryosackkern. Aus ihm entwickelt sich das sekundäre, triploide Endosperm. Daher spricht man bei den Angiospermen auch von einer doppelten Befruchtung. Diese stellt eine wichtige Autapomorphie der Angiospermen dar. Die weitere Entwicklung des Endosperms beginnt mit einer Phase der freien Kernteilung. Später ist dieses Endosperm bei allen Angiospermen dann jedoch vollkommen zellig ausgebildet. Die Embryogenese ist wie bei den Gymnospermen auch durch die Bildung eines mehrzelligen, einzellreihigen Suspensors gekennzeichnet. Dieser endet mit einer einkernigen Basalzelle. Beides ist am keimungsfähigen Embryo jedoch nicht mehr erkennbar. Nach der Keimung der Samen entwickelt sich aus dem Embryo ein neuer Sporophyt. Abb. 11: Drimys winteri, mit sehr ursprünglich ausgebildeten Narben im Bereich der Verwachsungsnaht auf dem Karpellrücken; Abb. 12: Tilia tomentosa, 5 verwachsene Karpelle bilden einen Fruchtknoten mit einem Griffel und einem gemeinsamen pollenfangenden Gewebe (Narbe) aus; Bei den Gymnospermen übernehmen die Zapfenschuppen die Schutzfunktion der Samen. Daher müssen sich in einem Zapfen alle Zapfenschuppen voll entwickeln, 5 auch wenn nicht alle Samenanlagen erfolgreich befruchtet wurden. Ein großer Vorteil der Angiokarpie ist, dass kein Material mehr in nicht befruchtete Samenanlagen investiert wird. Die wesentlich wichtigere Neuerung im Generationswechsel der Angiospermen aber stellt ein rezeptives Pollenauffanggewebe, die Narbe, dar, die jeweils mehreren Samenanlagen dient. Entwicklung im Gynoeceum Entwicklung in der Anthere Gynoeceum Pollenkorn Zwitterblüte Anthere mit 2 Theken und 4 Sporangien Entwicklung auf der Narbe Keimling Same blühender Sporophyt Abb. 13: Übersicht über den Generationswechsel einer dikotylen Angiospermae. Weiterführende Literatur BECK, C. B. (2010): An Introduction to Structure and Development, Plant Anatomy for the Twenty-First Century, 2nd ed. – Cambridge University Press, Cambridge. GIFFORD, E. M. & FOSTER, A. S. (1996): Morphology and Evolution of Vascular Plants. 3rd ed. – Freeman and Company, New York. HESS, D. (1990): Die Blüte – eine Einführung in Struktur und Funktion, Ökologie und Evolution der Blüten. – Ulmer, Stuttgart. LEINS, P. & ERBAR, C. (2010): Flower and Fruit; Morphology, Ontongeny, Phylogeny; Function and Ecology. – Schweizerbart Science Publishers, Stuttgart. RUDALL, P. (2007): Anatomy of Flowering Plants, an Introduction to Structure and Development, 3rd ed. – Cambridge University Press, Cambridge. 6 WEBERLING, F. (1981): Morphologie der Blüten und der Blütenstände. – Ulmer, Stuttgart.