Exzellente Heilungsraten bei wenig aggressiver Therapie
Werbung

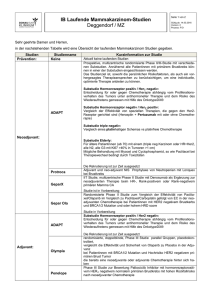
FRÜHES MAMMAKARZINOM Exzellente Heilungsraten bei wenig aggressiver Therapie Lokalbefund und molekularer Subtyp sind Basis der Konzepte für die Therapie. Bei luminalen Tumoren helfen Multigenassays, das Rezidivrisiko und das Ansprechen auf die Chemotherapie abzuschätzen. Über- und Untertherapie lassen sich zunehmend besser vermeiden. ber 90 Prozent der Patientinnen, bei denen heute in Deutschland ein Mammakarzinom neu diagnostiziert wird, haben ohne das Vorliegen von Fernmetastasen eine potenziell heilbare Erkrankung. Immer noch muss jede achte bis zehnte Frau im Laufe ihres Lebens damit rechnen, diese Diagnose zu erhalten; die Mortalität ist jedoch im Laufe der letzten Jahre gesunken. Der beobachtete Anstieg der Überlebensraten wird einerseits auf Früherkennung, anderseits aber auf die stetige Verbesserung der Systemtherapie zurückgeführt. Nach Diagnosesicherung sollte die Erstellung des Therapiekonzeptes interdisziplinär erfolgen – nicht für jede Patientin ist die primäre Operation die beste Möglichkeit, auch wenn der Wunsch nach einer raschen Tumorentfernung durchaus verständlich ist. Für manche Patientinnen kann jedoch eine primäre Systemtherapie das sinnvollere Vorgehen darstellen. Vor Beginn der Therapieplanung erfolgen zur Sicherung der Diagnose zunächst die klinische Untersuchung, eine Mammographie sowie eine Mammasonographie. Nur bei Patientinnen mit hohem Rückfallrisiko (zum Beispiel klinisch Nodalbefall) oder mit Symptomen ist ein primäres Staging erforderlich (1). Dieses sollte konsequenterweise dann präoperativ erfolgen, da bei nachgewiesenen Fernmetastasen die Systemtherapie im Vordergrund steht. Die Standardumgebungsuntersuchungen umfassen Oberbauchsonographie, Röntgen-Thorax und Skelettszintigraphie, aufgrund ihrer höheren Sensitivität können jedoch Computertomographie von Thorax und Abdomen im Einzelfall sinnvoller sein. Seit den grundlegenden Arbeiten von Perou und Sorlie vor etwa 15 Jahren (2, 3) wird das Mammakarzinom in vier therapierelevante molekulare Subtypen eingeteilt: Luminal A und B, HER2-enriched und basal-like. Diese Subtypen können entweder direkt durch einen Multigenassay (zum Beispiel Prosigna® oder Blueprint®) oder indirekt immunhistochemisch bestimmt werden. Mit Hilfe von Hormonrezeptorstatus (ER, PR), HER2-Status und Proliferationsrate Ki-67 kann eine annäherungsweise Unterteilung in die folgenden molekularen Subtypen erfolgen: ● Luminal-A-like Typ (Hormonrezeptorpositiv, HER2 negativ mit niedriger Proliferationsrate), 16 Foto: National Cancer Institute SPL Agentur Focus Ü Perspektiven der Onkologie 1/2015 | Deutsches Ärzteblatt ● Luminal-B-like Typ (Hormonrezeptor-positiv mit hoher Proliferationsrate), − HER2 negativ − HER2 positiv ● HER2-Typ non-Luminal (HER2-positiv und Hormonrezeptor-negativ) sowie ● Basal-like-Typ (Hormonrezeptor-negativ und HER2-negativ = „triple negative“). Nach dem Konsensus von St. Gallen im Jahr 2013 (4) wird die Systemtherapie anhand dieser Subtypen festgelegt. Auch der St. Gallen Konsensus in Wien 2015 hat diese Vorgehensweise bestätigt. Die Schwierigkeit, im Alltag anhand von dem methodisch noch nicht ausreichend standardisierten Ki-67 allein zwischen luminal A und B zu unterscheiden, wurde in der St.-Gallen-Diskussion 2015 nochmals bestätigt – dennoch gilt ein Ki67 ≤ 10 als niedrige Proliferation und Werte zwischen 20–29 Prozent wurden in Wien als Minimalgrenzwerte für eine hohe Proliferationsrate akzeptiert. Mittlere Ki-67-Werte zwischen zehn Prozent und 30 Prozent sollten aufgrund der fehlenden methodischen Standardisierung nicht als einziges Kriterium zur Therapieentscheidung verwendet werden. Das Therapiekonzept berücksichtigt die Wünsche der Patientin und richtet sich nach dem molekularen Subtyp und der lokoregionären Tumorausdehnung. Lokoregionäre Therapie Die lokoregionäre Therapie zeichnet sich durch eine schrittweise Rücknahme lokaler Aggressivität aus, insbesondere bei der operativen Therapie. Hier gilt eine Entfernung des Tumors mit einem minimalen gesunden Randsaum als ausreichend („no ink on tumor“) – dieser Grundsatz ist unabhängig vom molekularen Subtyp oder dem Vorliegen einer intradukalen Komponente. Auch bei der operativen Therapie der Axilla ist ein Rückgang an operativer Radikalität zu sehen: Aufgrund der Daten der Z0011-Studie (5) ist heute selbst bei einem oder zwei befallenen Sentinellymphknoten die nachfolgende Axilladissektion bei brusterhaltender Operation und geplanter Nachbestrahlung nicht mehr zwingend erforderlich. Ob bei klinisch freier Axilla überhaupt eine Sentinellymphknoetnentfernung sinnvoll ist, wird derzeit in der INSEMA-Studie untersucht (Prüfleitung: Prof. Gerber und Prof. Reimer, Rostock). Nach wie vor gilt die brusterhaltende Therapie mit Nachbestrahlung als gleichwertige Alternative zur Mastektomie. Für die Nachbestrahlung der Brust ist aufgrund der vorliegenden internationalen Daten (6) die hypofraktionierte Bestrahlung als gleichwertige Option in den AGO-Leitlinien bei Patientinnen ab 40 Jahren empfohlen (1). Bei einer neoadjuvanten Chemotherapie (NACT) ist die optimale lokoregionäre Therapie im Einzelfall heute oft schwierig festzulegen – hier fehlt derzeit die Evidenz für ein an den Erfolg der Systemtherapie angepasstes lokales Vorgehen, insbesondere für die Strahlentherapie. Während die operative Therapie bereits in den neuen Grenzen nach NACT erfolgen Perspektiven der Onkologie 1/2015 | Deutsches Ärzteblatt kann, gilt für die Strahlentherapie noch die Indikationsstellung anhand des prätherapeutischen klinischen Befundes. Ob dies im Einzelfall in Anbetracht der hohen pCR-Raten mancher neuer Systemtherapien bei bestimmten Subtypen auch wirklich so erforderlich ist, sollte dringend in Studien untersucht werden. Systemische Behandlungen Die häufigste Gruppe ist die der luminal Tumore (hormonrezeptor-positiv, HER2-negativ), bei denen die Indikation zur Chemotherapie noch von weiteren Tumoreigenschaften wie Proliferationsrate (Unterscheidung luminal A versus B-like), Grading oder Lymphknotenbefall, also dem Rezidivrisiko ab. Bei mittlerem Rückfallrisiko (pN0–1) können zusätzliche Tests wie der uPA/PAI-1-Proteintest (Femtelle®) oder Multigenassays (zum Beispiel Endopredict®, Mammaprint®, Oncotype DX®, Prosigna®) zur Abschätzung des Rezidivrisikos und des Ansprechens auf eine Chemotherapie eingesetzt werden. Bei hormonrezeptor-positiven Tumoren ist die adjuvante endokrine Therapie mit einer Dauer von fünf bis zehn Jahren Standard. Die Standardtherapie von prämenopausalen Patientinnen ist Tamoxifen 20 mg für fünf bis zehn Jahre. Bei prämenopausalen Patientinnen mit hohem Rückfallrisiko (zum Beispiel nach Chemotherapie oder ≤ 35 Jahre) kann nach den Daten der SOFT- und TEXT-Studien die zusätzliche Unterdrückung der Ovarialfunktion (OFS) vorteilhaft sein – auch der Einsatz eines Aromatasehemmers (+OFS) kann bei diesen Patientinnen erwogen werden (7, 8). Wichtig ist, dass der Vorteil von AI + OFS sich derzeit auf die Vermeidung von Rezidiven beschränkt, Gesamtüberlebensdaten aus diesen beiden Studien liegen noch nicht vor. Aus der ABCSG-12-Studie (9) gibt es Hinweise, dass der dreijährige Einsatz von AI + GNRH für das Gesamtüberleben gegenüber Tamoxifen + GNRH nachteilig war. Aus diesen Gründen hat die AGO hier nur eine „+/–“-Empfehlung ausgesprochen (1). Die Nebenwirkungsspektren beider Therapieansätze (AI + GnRH versus Tamoxifen) unterscheiden sich in der Prämenopause deutlich, die Indikationsstellung sollte daher nur nach ausführlicher Aufklärung der Patientin erfolgen. In der Postmenopause stehen AI und Tamoxifen als Therapieoptionen zur Verfügung, der Einsatz kann sequenziell oder upfront erfolgen. Bei postmenopausalen Patientinnen mit einem hohen Rezidivrisiko oder mit lobulärer Histologie stützen die vorliegenden Daten den upfront-Einsatz eines Aromatasehemmers. Patientinnen mit einem triple-negativen (TNBC) und diejenigen mit einem HER2-positiven Mammakarzinom haben unbehandelt ein hohes Rezidivrisiko. Es besteht daher in der Regel die Indikation für eine – meist neoadjuvante – Polychemotherapie, bei HER2-Positivität in Kombination mit Trastuzumab. Gründe für die Präferenz des neoadjuvanten Vorgehens bei diesen beiden Tumortypen liegen in der 17 GRAFIK Systemtherapie für Patientinnen mit frühem Mammakarzinom (modifiziert nach [10]) guten Korrelation zwischen pCR und Überleben (vor allem bei TNBC und HER2+ HR-) und der Möglichkeit der Studienteilnahme für die HochrisikononpCR-Patientinnen. Als Standardtherapie gilt heute die Anthrazyklinund Taxanhaltige Chemotherapie, in der Regel als Sequenztherapie (zum Beispiel 4 × EC – 12 × Paclitaxel weekly) durchgeführt. Auch die Kombination 6 × TAC ist möglich, erfordert aber eine G-CSF-Primärprophylaxe. Bei HER2-positiven Tumoren können auch Anthrazyklinfreie Schemata wie TCH (Docetaxel, Carboplatin, Trastuzumab) oder 12 × Paclitaxel weekly + Trastumab (bei pN0 bis zu 3 cm Tumorgröße) (11) zur Anwendung kommen. Bei triple-negativen Karzinomen ist die Anthrazyklin- und Taxanhaltige Chemotherapie ebenfalls Standard. Neuere Studien deuten darauf hin, dass der zusätzliche neoadjuvante Einsatz von Platin insbesondere für Patientinnen mit BRCA 1/2-Mutation die pCR-Rate verbessern kann. Da es für BRCA-Mutationsträgerinnen derzeit auch Studienkonzepte mit PARP Inhibitoren gibt (zum Beispiel OLYMPIA), ist eine Testung triple-negativer Patientinnen bereits bei Diagnosestellung sinnvoll. Ein mögliches Vorgehen kann die Testung während der ersten vier Zyklen (4 × EC) präoperativer Chemotherapie sein und die zusätzliche Platingabe (Carboplatin AUC5 q21) während der zwölf Zyklen Paclitaxel weekly. Über- und Untertherapie vermeiden Insgesamt hat sich die Therapie beim frühen Mammakarzinom in den letzten Jahren sehr gewandelt – aufgrund der heute guten Heilungschancen zeigt sich 18 ein Rückgang in der Therapieaggressivität sowohl für die lokoregionäre als auch für die systemische Therapie. Die Therapiekonzepte sollten von Anfang an multimodal und interdisziplinär festgelegt werden – nicht für jede Patientin ist die sofortige Entfernung des Tumors das sinnvollste Vorgehen. Die Therapiekonzepte richten sich heute nach dem Lokalbefund und dem molekularen Subtyp. Bei den luminalen Tumoren sind Multigenassays heute neben der konventionellen Histopathologie ein wichtiges und leitliniengestütztes Hilfsmittel für die Entscheidung für oder gegen eine adjuvante Chemotherapie geworden. Wichtig ist jedoch, auch in Anbetracht der Fortschritte ein soweit wie möglich evidenzbasiertes Vorgehen – die heute insgesamt exzellenten Heilungsaussichten sollten nicht durch den zu großzügigen Verzicht auf Standardtherapieschritte gefährdet werden. Aktuelle Studien wie INSEMA für den operativen Bereich oder ADAPT für die Tumorbiologie-basierte Systemtherapie bieten auch in Deutschland moderne Therapiekonzepte zur Vermeidung von Über- aber auch Untertherapie für viele Patientinnen in den Brustzen▄ tren an. DOI: 10.3238/PersOnko.2015.05.15.04 Prof. Dr. med. Nadia Harbeck Brustzentrum der Universität München, Universitätsfrauenklinik Interessenkonflikt: Die Autorin erhielt Beraterhonorare von den Firmen Celgene, Nanostring, GenomicHealth, Novartis und Roche. Außerdem erhielt sie Honorare für Vorträge oder Fortbildungsveranstaltungen von Nanostring, Novartis und Roche. @ Literatur im Internet: www.aerzteblatt.de/lit2015 Perspektiven der Onkologie 1/2015 | Deutsches Ärzteblatt FRÜHES MAMMAKARZINOM Exzellente Heilungsraten bei wenig aggressiver Therapie Lokalbefund und molekularer Subtyp sind Basis der Konzepte für die Therapie. Bei luminalen Tumoren helfen Multigenassays, das Rezidivrisiko und das Ansprechen auf die Chemotherapie abzuschätzen. Über- und Untertherapie lassen sich zunehmend besser vermeiden. LITERATUR 1. AGO Kommission Mamma: Diagnostik und Therapie primärer und metastasierter Mammakarzinome 2015. www.ago-online.de 2. Perou CM, Sørlie T, Eisen MB, van de Rijn M, Jeffrey SS, Rees CA, Pollack JR, Ross DT, Johnsen H, Akslen LA, Fluge O, Pergamenschikov A, Williams C, Zhu SX, Lønning PE, Børresen-Dale AL, Brown PO, Botstein D: Molecular portraits of human breast tumours. Nature 2000; 406: 747–52. 3. Sørlie T, Perou CM, Tibshirani R, Aas T, Geisler S, Johnsen H, Hastie T, Eisen MB, van de Rijn M, Jeffrey SS, Thorsen T, Quist H, Matese JC, Brown PO, Botstein D, Lønning PE, Børresen-Dale AL: Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci U S A 2001; 98: 10869–74. 4. Goldhirsch A, Winer EP, Coates AS, Gelber RD, Piccart-Gebhart M, Thürlimann B, Senn HJ; Panel members: Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013. Ann Oncol 2013; 24: 2206–23. 5. Giuliano AE, Hunt KK, Ballman KV, Beitsch PD, Whitworth PW, Blumencranz PW, Leitch AM, Saha S, McCall LM, Morrow M: Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial. JAMA 2011; 305: 569–75. 6. Haviland JS, Owen JR, Dewar JA, Agrawal RK, Barrett J, BarrettLee PJ, Dobbs HJ, Hopwood P, Lawton PA, Magee BJ, Mills J, Simmons S, Sydenham MA, Venables K, Bliss JM, Yarnold JR; START Trialists’ Group: The UK Standardisation of Breast Radiotherapy (START) trials of radiotherapy hypofractionation for treatment of early breast cancer: 10-year follow-up results of two randomised controlled trials. Lancet Oncol 2013; 14: 1086–94. 7. Pagani O, Regan MM, Walley BA, Fleming GF, Colleoni M, Láng I, Gomez HL, Tondini C, Burstein HJ, Perez EA, Ciruelos E, Stearns V, Bonnefoi HR, Martino S, Geyer CE Jr, Pinotti G, Puglisi F, Crivellari D, Ruhstaller T, Winer EP, Rabaglio-Poretti M, Maibach R, Ruepp B, Giobbie-Hurder A, Price KN, Bernhard J, Luo W, Ribi K, Viale G, Coates AS, Gelber RD, Goldhirsch A, Francis PA; TEXT and SOFT Investigators; International Breast Cancer Study Group: Adjuvant exemestane with ovarian suppression in premenopausal breast cancer. N Engl J Med 2014; 371: 107–18. 8. Francis PA, Regan MM, Fleming GF, Láng I, Ciruelos E, Bellet M, Bonnefoi HR, Climent MA, Da Prada GA, Burstein HJ, Martino S, Davidson NE, Geyer CE Jr, Walley BA, Coleman R, Kerbrat P, Buchholz S, Ingle JN, Winer EP, Rabaglio-Poretti M, Maibach R, Ruepp B, Giobbie-Hurder A, Price KN, Colleoni M, Viale G, Coates AS, Goldhirsch A, Gelber RD; SOFT Investigators; International Breast Cancer Study Group: Adjuvant ovarian suppression in premenopausal breast cancer. N Engl J Med 2015; 372: 436–46. 9. Gnant M, Mlineritsch B, Stoeger H, Luschin-Ebengreuth G, Heck D, Menzel C, Jakesz R, Seifert M, Hubalek M, Pristauz G, Bauernhofer T, Eidtmann H, Eiermann W, Steger G, Kwasny W, Dubsky P, Hochreiner G, Forsthuber EP, Fesl C, Greil R; Austrian Breast and Colorectal Cancer Study Group, Vienna, Austria: Adju- Perspektiven der Onkologie 1/2015 | Deutsches Ärzteblatt vant endocrine therapy plus zoledronic acid in premenopausal women with early-stage breast cancer: 62-month follow-up from the ABCSG-12 randomised trial. Lancet Oncol 2011; 12: 631–41. 10. Harbeck N, Salem M, Nitz U, Gluz O, Liedtke C: Personalized treatment of early-stage breast cancer: present concepts and future directions. Cancer Treat Rev 2010; 36: 584–94. 11. Tolaney SM, Barry WT, Dang CT, Yardley DA, Moy B, Marcom PK, Albain KS, Rugo HS, Ellis M, Shapira I, Wolff AC, Carey LA, Overmoyer BA, Partridge AH, Guo H, Hudis CA, Krop IE, Burstein HJ, Winer EP: Adjuvant paclitaxel and trastuzumab for node-negative, HER2-positive breast cancer. N Engl J Med 2015; 372: 134–41. 4