Forschungsschwerpunkte – Dr. Dorothee Dormann
Werbung

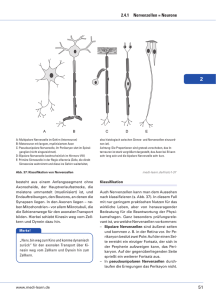
Forschungsschwerpunkte – Dr. Dorothee Dormann Dorothee Dormann ist Biochemikerin und erforscht die molekularen Mechanismen neurodegenerativer Erkrankungen. Ihr Forschungsschwerpunkt sind die Frontotemporale Demenz (FTD) und die Amyotrophe Lateralsklerose (ALS). Beide Krankheiten sind eng verwandt mit der Alzheimer-Krankheit. Da jedoch andere Nervenzellen vom Zelltod betroffen sind, kommt es anders als bei Alzheimer nicht zum Gedächtnisverlust, sondern zu einer fortschreitenden Veränderung der Persönlichkeit, des Sprachvermögens oder der Muskulatur. FTD und ALS sind bislang unheilbar und führen nach einigen Jahren unweigerlich zum Tode. Dorothee Dormann untersucht die molekularen Mechanismen, die zum Absterben der Nervenzellen führen, um neue Ansatzpunkte zur Behandlung dieser tödlichen Krankheiten zu finden. Auf molekularer Ebene beobachtet man bei verstorbenen FTD- und ALS-Patienten charakteristische Eiweißablagerungen in den betroffenen Gehirnarealen. Eines dieser Eiweiße ist ein Protein namens FUS. FUS liegt normalerweise im Zellkern vor, wo es ans Erbgut bindet und dessen Ablesen steuert. In den Nervenzellen von FTD- und ALS-Patienten verklumpt FUS jedoch außerhalb des Zellkerns – wie und wieso war bis vor Kurzem unbekannt. Dorothee Dormann konnte mit ihrer Forschung zeigen, dass ein fehlerhafter „Adresszettel“ am FUSProtein für die Ablagerung des Proteins am falschen Ort verantwortlich ist. Der Adresszettel wird normalerweise von einem Transportprotein erkannt, das an das FUS-Protein andockt und es in den Zellkern einschleust. In ALS- und FTD-Patienten ist der Adresszettel jedoch durch einen genetischen Defekt oder durch chemische Modifizierung so verändert, dass das Transportprotein ihn nicht mehr korrekt erkennt. Infolgedessen wird zu wenig FUS in den Zellkern hinein transportiert – es kann seine essenzielle Rolle im Zellkern nicht mehr ausüben und sammelt sich außerhalb des Zellkerns an. Dorothee Dormann fand heraus, dass das FUS-Protein außerdem besonders rasch verklumpt, wenn die empfindlichen Nervenzellen zusätzlichen Stressfaktoren, z. B. schädlichen Chemikalien, ausgesetzt werden. Unter diesen Bedingungen bilden sich in Zellen sogenannte Stressgranula, große Eiweißkomplexe, die die Stressantwort der Zelle optimieren sollen. Dorothee Dormann beobachtete, dass das fehllokalisierte FUS-Protein in diese Stressgranula hineingezogen wird und dass sich Bestandteile der Stressgranula in den schädlichen Eiweißablagerungen in FTD- und ALS-Patienten wiederfinden lassen. Diese Ergebnisse lassen darauf schließen, dass Stressgranula maßgeblich an der Bildung dieser Ablagerungen beteiligt sind – zellulärer Stress scheint also ein wichtiger Faktor in der Krankheitsentstehung zu sein. In der Zukunft möchte Dorothee Dormann das Verständnis der zellulären Funktionen von FUS und verwandten Proteinen noch weiter vertiefen, in der Hoffnung, dadurch die Entstehung von FTD, ALS und anderer neurodegenerativer Erkrankungen besser zu verstehen und neue Therapieansätze gegen diese Krankheiten zu entwickeln. Forschungsschwerpunkte – Heinz Maier-Leibnitz-Preis 2014 Dr. Dorothee Dormann Stand: März 2014 DFG