Stoffwechsel der Aminosäuren Grundzüge der Proteinverdauung
Werbung
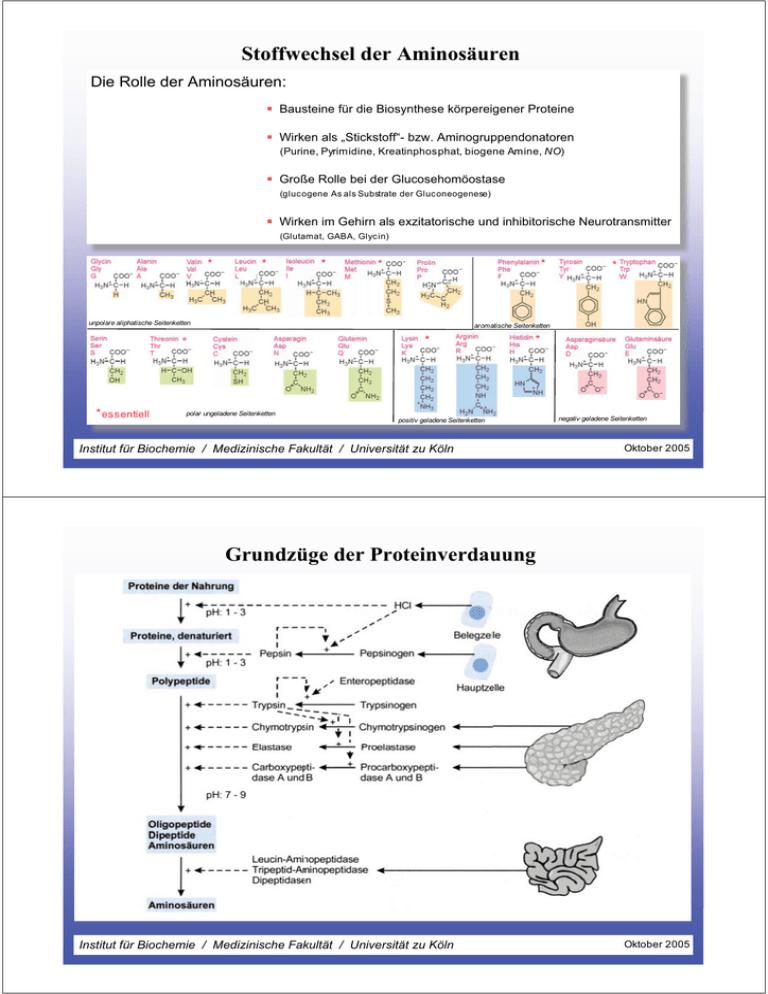
Stoffwechsel der Aminosäuren Die Rolle der Aminosäuren: Bausteine für die Biosynthese körpereigener Proteine Wirken als „Stickstoff“- bzw. Aminogruppendonatoren (Purine, Pyrimidine, Kreatinphosphat, biogene Amine, NO) Große Rolle bei der Glucosehomöostase (glucogene As als Substrate der Gluconeogenese) Wirken im Gehirn als exzitatorische und inhibitorische Neurotransmitter (Glutamat, GABA, Glycin) * * * * * unpolare aliphatische Seitenketten aromatische Seitenketten * * * essentiell * * polar ungeladene Seitenketten positiv geladene Seitenketten Institut für Biochemie / Medizinische Fakultät / Universität zu Köln negativ geladene Seitenketten Oktober 2005 Grundzüge der Proteinverdauung Institut für Biochemie / Medizinische Fakultät / Universität zu Köln Oktober 2005 Täglicher Aminosäureumsatz im Organismus Zufuhr von ca 30g Protein > Stickstoffgleichgewicht Tägliche Proteinzufuhr: ~ 100g durch Nahrung ~ 50-70g durch sezernierte Proteine und abgeschilferten Darmmucosazellen Gesamtkörperprotein: ~ 10.000g Tägliche Proteinbiosynthese: ~ 300g Ca. ein Viertel der resorbierten As gelangen in den Systemkreislauf Ausnahme: verzweigtkettige As (V, L, I) > Muskulatur As-Aufnahme durch Zellen über spez. Transporter (mind. 7) Gewebskonz. der meisten As entspricht der Konz. im Plasma Ausnahmen: G, A, D, E, Q (Q im Muskel 30-fach erhöht) Oktober 2005 Institut für Biochemie / Medizinische Fakultät / Universität zu Köln Zentrale Stellung der Leber im Aminosäurestoffwechsel Resorption und Verteilung der As im Organismus Großteil der resorbierten As wird aufgenommen Biosynthese von Proteinen (z.B. Albumin) As-Umwandlung in Ketocarbonsäuren unter Ammoniakabspaltung Ketocarbonsäuren: Liponeogenese Gluconeogenese Proteinbausteine Ammoniak: Biosynthese N-haltiger Verbindungen Entsorgung in Form von Harnstoff Proteinreiche Nahrung: As-spiegel im Portalblut Pufferfunktion nicht im Systemkreislauf Institut für Biochemie / Medizinische Fakultät / Universität zu Köln Oktober 2005 Zellulärer Abbau von Proteinen T1/2 von Proteinen variiert zwischen Minuten und Jahren Halbwertszeiten von Proteinen in Abhängigkeit von der N-terminalen As (Insulin im Plasma: 3-5min, IgG: ~21d, Crystallin: Jahre) Zellen synthetisieren kontinuierlich Proteine aus Aminosäuren (unter Energieverbrauch) und bauen sie (ebenfalls unter Energieverbrauch) wieder ab. ??? Energieverschwendung ??? 1. Eliminierung von abnormalen Proteinen (z.B. Oxidation, Mutation) 2. Generierung von antigenen Proteinfragmenten 3. Regulation des zellulären Metabolismus (Zellzyklus, Differenzierung, Entwicklung) 4. Regulatorische Proteine haben häufig kurze Halbwertszeit (schnelle Anpassung an veränderte Bedingungen) Oktober 2005 Institut für Biochemie / Medizinische Fakultät / Universität zu Köln Proteasomaler Proteinabbau (cytosolische und nucleäre Proteine) Ubiquitinylierung von Proteinen Institut für Biochemie / Medizinische Fakultät / Universität zu Köln Aufbau des Proteasoms Oktober 2005 Lysosomaler Proteinabbau (u.a. extrazelluläre und Membranproteine) Oktober 2005 Institut für Biochemie / Medizinische Fakultät / Universität zu Köln Abbau der Aminosäuren (1) Desaminierung - Transaminierung - oxidative Desaminierung - nichtdehydrierende Desaminierung (2) Abbau/Verwertung des Kohlenstoffgerüsts Transaminierung Aminosäure 1 + -Ketosäure 2 -Ketosäure 1 + Aminosäure 2 1 Akzeptoren: -Ketoglutarat 2 (Glutamat) Oxalacetat (Aspartat) Pyruvat (Alanin) 1 2 Katalyse durch Aminotransferasen (= Transaminasen) Coenzym: Pyridoxalphosphat (P[A]LP, Vit. B6 Derivat) Institut für Biochemie / Medizinische Fakultät / Universität zu Köln Oktober 2005 Transaminasereaktionen Glutamat-Pyruvat-Transaminase (GPT, oder Alanin-Aminotransferase) Alanin + -Ketoglutarat Pyruvat + Glutamat Transaminasen wie GOT oder GPT sind typische Leberenzyme > wichtig für Enzymdiagnostik im Serum Glutamat-Oxalacetat-Transaminase (GOT, Aspartat-Aminotransferase) Aspartat + -Ketoglutarat Oxalacetat + Glutamat Citratzyklus In der Leber oxidative Desaminierung zu -Ketoglutarat + NH 4+ Weitere Ammoniak-Quellen: nichtdehydrierende Desaminierug (Ser, Thr, Cys, His) hydrolyt. Freisetzung beim Abbau von Purinen und Pyrimidinen Aminosäureoxidasen Reaktionsmechanismus der Transaminasen. Hydrolyse der Schiff-Base aus der Ketiminform führt zur -Ketosöure und Hydrolyse aus der Aldiminform zur Aminosäure. R 1, R 2, Aminosäureseitenketten Oktober 2005 Institut für Biochemie / Medizinische Fakultät / Universität zu Köln Oxidative Desaminierung Glutamatdehydrogenase katalysierte Regeneration von -Ketoglutarat durch oxidative Desaminierung. Das Enzym kann NAD+ oder NADP+ als Oxidans nutzen. ADP und GDP sind positive, ATP und GTP sind negative Effektoren der Glutamatdehydrogenase. Harnstoffcyclus Institut für Biochemie / Medizinische Fakultät / Universität zu Köln Oktober 2005 Grundzüge des Ammoniakstoffwechsels Ammoniak ist essentiell, aber in freier Form schon in geringen Mengen toxisch > Ammoniakspiegel im Blut ca 30-40 M NH3 + H+ (gut Lipid-löslich) NH4+ (schlecht Zell-permeabel) pK´-Wert von Ammoniak/Ammoniumion ~9.1 > Bei pH 7 - 7,4 liegen ca 99% als NH4+ -Ion vor > Eine Alkalose verschiebt das Gleichgewicht nach links Fixierung von Ammoniak durch Glutamatdehydrogenase und Glutaminsynthetase (mitochondrial) Glutaminsynthetase ist in der Leber nur in einer Subpopulation von perivenösen Zellen nachweisbar, die Enzyme des Harnstoffzyklus in der gesamten Leber mit Ausnahme eben dieser Zellen. Institut für Biochemie / Medizinische Fakultät / Universität zu Köln Oktober 2005 Glutamat als Drehscheibe im Aminostickstoff-Stoffwechsel - Fixierung von NH3 mit -Ketoglutarat - Transfer der Aminogruppe auf Pyruvat unter Bildung von Alanin, dem wesentlichen Transportstoff im Plasma - Transaminierung auf Oxalacetat unter Bldg von Asp, wichtig für Biosynthesen und Harnstoffbildung - Fixierung von NH3 unter Gln-bildung, Gln ist ebenfalls Aminogruppendonator und Transportform im Plasma - Freisetzung von überschüssigem NH 3 durch Desaminierung >> Harnstoffbildung >> Nur wenige Organe besitzen die komplette Enzymausstattung für alle genannten Stoffwechselprozesse Die hydrolytische Spaltung von Glutamin zu Glutamat und NH4+ durch Glutaminase findet vor allem in der Niere statt, die Ammonium-Ionen des Harns stammen überwiegend aus dieser Reaktion. Institut für Biochemie / Medizinische Fakultät / Universität zu Köln Oktober 2005 Ammoniaktransport aus extrahepatischen Organen In allen Organen ein mehr oder minder intensiver Aminosäurestoffwechsel, aber ... nur in der Leber kann mit Hilfe des Harnstoffzyklus überschüssiges Ammoniak entgiftet werden!! Extrahepatische Organe können zwar Ammoniak fixieren, aber ... müssen dafür bei einem großen Angebot dem Citratzyklus -Ketoglutarat entziehen, ... während in der Leber zur Harnstoffsynthese nur Bicarbonat, Ammoniak und Energie benötigt werden !!! Ammoniaktransport aus peripheren Organen in Form von Alanin und Glutamin Plasmaaminosäurekonzentrationen im postabsorptiven Zustand (16h nach letzter Mahlzeit): Leu 112 M His 70 M Ala 344 M Gln 600-800 M Institut für Biochemie / Medizinische Fakultät / Universität zu Köln Oktober 2005 Glucose-Alanin-Cyclus Institut für Biochemie / Medizinische Fakultät / Universität zu Köln Oktober 2005 Der Harnstoffzyklus HCO3- + NH4+ + 3 ATP + Aspartat + 2 H2O Harnstoff + 2 ADP + AMP + 4 Pi + Fumarat Harnstoff: ungeladen, nicht toxisch, diffundiert leicht durch Membranen Institut für Biochemie / Medizinische Fakultät / Universität zu Köln Oktober 2005 Der Harnstoffzyklus HCO3- + NH4+ + 3 ATP + Aspartat + 2 H2O Harnstoff + 2 ADP + AMP + 4 Pi + Fumarat Bildung von ca 30g (~0.5mol)/24h (kann auf das 3-fache steigen) Beschreibung 1932 von Kurt Henseleit und Hans Krebs Vorgeschaltete Reaktion (Schüsselreaktion): Bildung des reaktiven Intermediats Carbamoylphosphat Gruppentransfer: Übertragung der Carbamoylgruppe auf die nicht proteinogene As Ornithin unter Bildung von Citrullin ATP-gekoppelte Synthese (C-N Verknüpfung): Bildung von Argininosuccinat aus Citrullin und Aspartat Spaltung der C-N Bindung: Bildung von Arginin und Fumarat (Verb. z. Citratzyklus) Hydrolyse einer Amidinogruppe: Bildung von Ornithin und Harnstoff (Verb. z. Citratzyklus) Die Harnstoffsynthese verbraucht 4 energiereiche Phosphatgruppen Hyperammonämie: Mangel oder Defekt der Argininosuccinase. Ohne Behandlung Akkumulation von NH4+ im Blut; Symtome wie Lethargie, Koma, irreversible ZNS-Schädigung, Diagnose möglich, kausale Therapie nicht, Diät aus proteinarmer Nahrung und Überschuss an freiem Arginin > Argininosuccinat fungiert als Harnstoffsubstitut. Institut für Biochemie / Medizinische Fakultät / Universität zu Köln Oktober 2005