Buprenaddict® Sublingualtabletten
Werbung

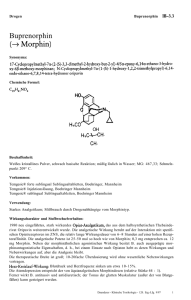
Fachinformation Buprenaddict® Sublingualtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Buprenaddict 0,4 mg Jede Tablette enthält 0,4 mg Buprenorphin (als Buprenorphinhydrochlorid). Sonstiger Bestandteil: 44,8 mg LactoseMonohydrat Buprenaddict 2 mg Jede Tablette enthält 2 mg Buprenorphin (als Buprenorphinhydrochlorid). Sonstiger Bestandteil: 73,2 mg LactoseMonohydrat Buprenaddict 8 mg Jede Tablette enthält 8 mg Buprenorphin (als Buprenorphinhydrochlorid). Sonstiger Bestandteil: 292,7 mg LactoseMonohydrat Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1. 3. DARREICHUNGSFORM Sublingualtablette Buprenaddict 0,4 mg Weiße bis cremefarbene, ovale Tabletten (8,0 x 4,0 mm) Buprenaddict 2 mg Weiße bis cremefarbene, ovale Tabletten mit beidseitiger Bruchkerbe (9,4 x 4,0 mm) Die Tabletten können in gleiche Hälften geteilt werden. Buprenaddict 8 mg Weiße bis cremefarbene, ovale Tabletten mit beidseitiger Bruchkerbe (13,5 x 6,6 mm) Die Tabletten können in gleiche Hälften geteilt werden. Stand: August 2012 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Substitutionstherapie bei Opioidabhängigkeit im Rahmen medizinischer, sozialer und psychotherapeutischer Maßnahmen. Die Therapie ist zur Behandlung Erwachsener und Jugendlicher ab 15 Jahren vorgesehen, die einer Suchtbehandlung zugestimmt haben. 4.2 Dosierung, Art und Dauer der Anwendung Die Behandlung muss unter Aufsicht eines Arztes erfolgen, der Erfahrung in der Behandlung Opiat-/Suchtabhängiger hat. len sollten alternative Behandlungsmöglichkeiten in Erwägung gezogen werden. Der Behandlungserfolg hängt ab von der verschriebenen Dosis und den kombinierten medizinischen, psychotherapeutischen, sozialen und erzieherischen Maßnahmen bei der Überwachung des Patienten. Besonders zu Beginn der Behandlung wird eine tägliche Ausgabe von Buprenorphin an den Patienten empfohlen. Später kann nach der Stabilisierung des Patienten ein Vorrat für mehrere Behandlungstage ausgegeben werden. Es wird jedoch empfohlen, die Menge des Arzneimittels auf maximal 7 Tage oder entsprechend den lokalen Bestimmungen zu begrenzen. Bei Einleitung einer Therapie mit Buprenorphin sollte sich der Arzt bewusst sein, dass Buprenorphin ein partiell agonistisches Wirkprofil besitzt und bei opioidabhängigen Patienten Entzugssymptome hervorrufen kann. Buprenorphin bindet an µ- und κ-Opiat-Rezeptoren. Die Anwendung erfolgt sublingual. Der Arzt muss den Patienten darüber informieren, dass die sublinguale Anwendung die einzige wirksame und sichere Art der Anwendung dieses Arzneimittels darstellt. Die Tablette wird bis zur Auflösung unter der Zunge gehalten. Dies dauert in der Regel 5-10 Minuten. Initialtherapie Die Anfangsdosis beträgt zwischen 0,8 und 4 mg als tägliche Einzeldosis. • Opioidabhängige Patienten ohne vorherigen Entzug: Eine Dosis Buprenorphin-Tablette(n) wird sublingual mindestens 6 Stunden nach der letzten Anwendung des Opioids angewendet oder wenn die ersten Anzeichen eines Entzugs auftreten. • Patienten, die Methadon erhalten: Vor Beginn der Buprenorphin-Therapie sollte die Methadon-Dosis auf maximal 30 mg pro Tag reduziert werden. Buprenorphin kann bei methadonabhängigen Patienten Entzugssymptome auslösen. Daher sollte Buprenorphin nicht früher als 24 Stunden nach der letzten Methadon-Dosis angewendet werden. Dosisanpassung und Erhaltungstherapie Die Dosis von Buprenorphin sollte entsprechend der klinischen Wirkung beim einzelnen Patienten schrittweise erhöht werden. Die mittlere Erhaltungsdosis beträgt 8 mg. Die Mehrheit der Patienten wird keine höhere Dosis als 16 mg pro Tag benötigen. Die Wirksamkeit und Sicherheit von Buprenorphin Tabletten wurden in klinischen Studien jedoch mit Dosen bis zu 24 mg pro Tag getestet. Die Dosierung wird entsprechend des klinischen Status und der allgemeinen Behandlung des Patienten eingestellt. Nicht ausreichende Stabilisierung mit 16 mg pro Tag kann mit einem möglichen Missbrauch oder psychiatrischer Komorbidität in Zusammenhang stehen. In diesen Fäl- 1 Seltenere als 1-mal tägliche Gabe Nach Erreichen einer zufriedenstellenden Stabilisierung kann die Dosierungshäufigkeit auf ein 2-Tages-Intervall herabgesetzt werden, wobei der Patient die doppelte individuell titrierte Tagesdosis erhält. Beispiel: Ein Patient, der auf eine Tagesdosis von 8 mg stabil eingestellt ist, kann demnach an jedem 2. Tag 16 mg erhalten. An den dazwischenliegenden Tagen erfolgen keine Dosisgaben. In bestimmten Fällen kann die Häufigkeit der Anwendung nach Erreichen einer zufriedenstellenden Stabilisierung auf eine 3-mal wöchentliche Gabe reduziert werden (z. B. montags, mittwochs und freitags). Die Montagsund die Mittwochs-Dosis sollten jeweils doppelt so hoch sein wie die individuell titrierte Tagesdosis. Die Freitags-Dosis sollte das 3-fache der individuell titrierten Tagesdosis betragen. An den übrigen Tagen erfolgen keine Dosisgaben. Allerdings sollte die Tagesdosis 24 mg nicht überschreiten. Für Patienten, die eine titrierte Tagesdosis über 8 mg benötigen, kann dieses Dosisschema nicht angemessen sein. Dosisreduktion und Beenden der Therapie Nach Erreichen einer zufriedenstellenden Stabilisationsphase kann die Dosis allmählich auf eine niedrigere Erhaltungsdosis reduziert werden; gegebenenfalls kann bei entsprechender Einschätzung durch den Arzt die Therapie bei manchen Patienten beendet werden. Die zur Verfügung stehenden Sublingualtabletten in den Dosisstärken 0,4 mg, 2 mg (teilbar in 2 x 1 mg) und 8 mg (teilbar in 2 x 4 mg) ermöglichen eine schrittweise Reduzierung der Dosis. Nach Beendigung der Buprenorphin-Therapie sollte der Patient überwacht werden, da die Möglichkeit eines Rückfalls besteht. Die Patienten müssen auch über den Verlust der Opioidtoleranz nach Beendigung der Therapie informiert werden, welcher im Falle eines Rückfalls eine gefährliche Auswirkung hat. Patienten mit Leberfunktionsstörungen Die Auswirkung einer Leberfunktionsstörung auf die Pharmakokinetik von Bupre- 51004802 1. BEZEICHNUNG DER ARZNEIMITTEL Buprenaddict® 0,4 mg Sublingualtabletten Buprenaddict® 2 mg Sublingualtabletten Buprenaddict® 8 mg Sublingualtabletten Fachinformation Buprenaddict® Sublingualtabletten norphin ist nicht bekannt. Da Buprenorphin extensiv metabolisiert wird, sind die Plasmaspiegel bei Patienten mit einer mittelschweren oder schweren Leberfunktionsstörung voraussichtlich höher. Da die Pharmakokinetik von Buprenorphin bei Patienten mit Leberinsuffizienz verändert sein kann, werden bei Patienten mit einer leichten bis mittelschweren Leberfunktionsstörung niedrigere Initialdosen und eine sorgfältige Dosistitration empfohlen. 4.3 Gegenanzeigen • Überempfindlichkeit gegen Buprenorphin oder einen der sonstigen Bestandteile • Kinder und Jugendliche unter 15 Jahren • schwere respiratorische Insuffizienz • schwere Leberinsuffizienz • akuter Alkoholismus oder Delirium tremens 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Warnhinweise Buprenorphin-Sublingualtabletten werden nur zur Behandlung der Opioidabhängigkeit empfohlen. Es wird außerdem empfohlen, dass die Therapie von einem Arzt verordnet wird, der eine umfassende Versorgung des drogenabhängigen Patienten sicherstellt. Besondere Risiken bei der Substitutionstherapie • Der Patient muss darüber informiert werden, dass bei Kombination von zentral dämpfenden Stoffen wie Alkohol, illegalen Opiaten, Benzodiazepinen oder Hypnotika mit Buprenorphin ein möglicherweise tödliches Risiko besteht. • Der Patient muss über die möglichen Risiken eines intravenösen Missbrauchs informiert werden: Atemstillstand, Schock, Thrombophlebitis, Embolie, Endokarditis, Sepsis, Leberschädigung. • Der Arzt sollte, insbesondere zu Beginn der Behandlung, das Risiko eines Missbrauchs bzw. nicht bestimmungsgemäßen Gebrauchs (z. B. i.v.-Anwendung) berücksichtigen. Aufgrund des Missbrauchsrisikos, insbesondere bei intravenöser Anwendung, und der Dosisanpassung sollte die Verschreibungsdauer besonders bei Behandlungsbeginn kurz sein. Wenn möglich, sollte eine kontrollierte oder partielle Abgabe erfolgen, um auch die Behandlungs-Compliance zu unterstützen. • Bei Anwendung hoher Dosen sind besondere Vorsichtsmaßnahmen erforderlich, um eine Entwendung des Arzneimittels zu vermeiden. • Bei gleichzeitig vorliegenden anderen Erkrankungen können aufgrund der analgetischen Wirkung von Buprenorphin die Symptome maskiert sein; daher ist eine entsprechende Überwachung erforderlich. • Atemdepression: Es wurden einige Todesfälle infolge einer Atemdepression berichtet, insbesondere bei kombinierter Anwendung von Buprenorphin mit Benzodiazepinen (siehe Abschnitt 4.5) oder wenn Buprenorphin nicht gemäß der Produktinformation angewendet wurde. • Hepatitis, hepatische Ereignisse: Schwerwiegende Fälle von akuten Leberschäden wurden im Zusammenhang mit einem Missbrauch (speziell intravenöse Anwendung) des Arzneimittels berichtet. Diese Leberschäden wurden hauptsächlich nach hohen Dosen beobachtet und könnten ihre Ursache in einer mitochondrialen Toxizität haben. Bereits bestehende oder erworbene Mitochondrienschäden [genetische Erkrankungen, Virusinfektionen (insbesondere chronische Hepatitis C), Alkoholmissbrauch, Anorexie, gleichzeitige Gabe von Mitochondrientoxinen (z. B. Acetylsalicylsäure, Isoniazid, Valproinsäure, Amiodaron, antiretrovirale Nukleosid-Analoga)] könnten das Auftreten von Leberschäden fördern. Diese CoFaktoren müssen vor der Verordnung und während der Behandlung mit Buprenorphin berücksichtigt werden. Bei Verdacht auf ein hepatisches Ereignis ist eine weitergehende physiologische und ätiologische Evaluierung erforderlich. Abhängig vom Befund kann das Arzneimittel vorsichtig abgesetzt werden, möglichst so, dass ein Entzugssyndrom oder die Rückkehr zur Drogenabhängigkeit vermieden wird. Bei Fortführung der Therapie ist die Leberfunktion engmaschig zu überwachen. Dieses Arzneimittel kann Opioid-Entzugssymptome auslösen, wenn es an Drogenabhängige weniger als 4 Stunden nach dem letzten Drogenkonsum verabreicht wird (siehe Abschnitt 4.2). • Das Absetzen der Behandlung kann zu einem Entzugssyndrom führen, das verzögert auftreten kann. • Dieses Arzneimittel kann zu Benommenheit führen, die durch andere zentral wirkende Mittel, wie z. B. Alkohol, Tranquilizer, Sedativa und Schlafmittel, verstärkt werden kann (siehe Abschnitt 4.5). • Dieses Arzneimittel kann eine orthostatische Hypotonie verursachen. Sowohl Tierstudien als auch klinische Erfahrungen haben gezeigt, dass Buprenorphin ein Abhängigkeitspotential hat, das allerdings geringer als bei Morphin ist. 2 Daher ist es wichtig, den Empfehlungen zur Therapieeinleitung, Dosisanpassung und Überwachung des Patienten zu folgen (siehe Abschnitt 4.2). Anwendung bei Kindern Für Kinder unter 15 Jahren stehen keine Daten zur Verfügung, daher sollte Buprenorphin bei Kindern unter 15 Jahren nicht angewendet werden. Vorsichtsmaßnahmen für die Anwendung Es ist Vorsicht geboten bei der Anwendung dieses Arzneimittels bei Patienten mit • Asthma oder respiratorischer Insuffizienz (Fälle von Atemdepression wurden unter Buprenorphin berichtet) • Niereninsuffizienz (30 % der verabreichten Dosis werden renal eliminiert; daher kann die Ausscheidung über die Nieren verlängert sein) • Leberinsuffizienz (der hepatische Metabolismus von Buprenorphin kann verändert sein). Wie bei anderen Opioiden ist bei der Anwendung von Buprenorphin Vorsicht geboten bei Patienten mit • Kopfverletzungen und erhöhtem Hirndruck • Hypotonie • Prostatahypertrophie und Harnröhrenstenose. Sportler sollten sich bewusst sein, dass es durch die Anwendung dieses Arzneimittels zu positiven „Dopingtests“ kommen kann. Dieses Arzneimittel enthält Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht anwenden. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Nicht empfohlene Kombinationen • Naltrexon: Risiko eines Entzugssyndroms • Alkohol: Alkohol verstärkt die sedative Wirkung von Buprenorphin, was das Führen von Fahrzeugen oder das Bedienen von Maschinen gefährlich macht. Mit Vorsicht anzuwendende Kombinationen • Die Kombination mit Benzodiazepinen kann aufgrund einer zentral bedingten Atemdepression zum Tod führen. Daher sollte die niedrigste Dosis angewendet werden; diese Kombination sollte bei Patienten mit Missbrauchsrisiko nicht angewendet werden (siehe Abschnitt 4.4). Eine angemessene ärztliche Überprüfung des Nutzen-Risiko-Verhältnisses sollte vor der Verordnung dieser Kombination durchgeführt werden. Fachinformation Buprenaddict® Sublingualtabletten • Andere zentral dämpfende Arzneimittel: andere Opioid-Derivate (Analgetika und Antitussiva), bestimmte Antidepressiva, H1-Rezeptor-Antagonisten mit sedierender Wirkung, Barbiturate, Benzodiazepine, andere Anxiolytika als Benzodiazepine, Neuroleptika, Clonidin und verwandte Substanzen: diese Kombinationen verstärken die dämpfende Wirkung auf das zentrale Nervensystem. Dies kann zu verminderter Aufmerksamkeit führen, welche beim Führen eines Fahrzeugs und beim Bedienen von Maschinen gefährlich sein kann. • MAO-Hemmer (MonoaminoxidaseHemmer): Mögliche Steigerung der Wirkungen von Opioiden, aufgrund der Erfahrungen mit Morphin. • CYP3A4-Inhibitoren: In einer Studie zur Wechselwirkung von Buprenorphin mit Ketoconazol (einem starken CYP3A4-Hemmer) wurden erhöhte Cmaxund AUC-Werte für Buprenorphin (ungefähr 70 % bzw. 50 %) und zu einem geringeren Grad für Norbuprenorphin gemessen. Patienten, die Buprenorphin in Kombination mit einem starken CYP3A4-Hemmer erhalten (z. B. Protease-Hemmer, wie Ritonavir, Nelfinavir oder Indinavir, bzw. Azol-Antimykotika, wie Ketoconazol oder Itraconazol) sind engmaschig zu überwachen; eine Dosisreduktion kann erforderlich sein. • CYP3A4-Induktoren: Die Wechselwirkung von Buprenorphin mit CYP3A4Induktoren wurde nicht untersucht. Daher wird empfohlen, Patienten, die Buprenorphin erhalten, engmaschig zu überwachen, wenn sie Enzym-Induktoren (wie z. B. Phenobarbital, Carbamazepin, Phenytoin, Rifampicin) erhalten werden. • Wirkungen von Buprenorphin auf andere Arzneimittel: Es hat sich gezeigt, dass Buprenorphin in vitro ein Inhibitor von CYP2D6 und CYP3A4 ist. Das Risiko einer Hemmung scheint bei therapeutischen Konzentrationen gering zu sein, kann jedoch nicht ausgeschlossen werden. Bei Kombination von Buprenorphin (vorwiegend bei hohen Dosen) mit Arzneimitteln, welche CYP2D6oder CYP3A4-Substrate sind, können die Plasmaspiegel dieser Arzneimittel ansteigen und dosisabhängige Nebenwirkungen können auftreten. CYP2C19 wird in vitro nicht gehemmt. Die Wirkung auf andere Arzneimittel metabolisierende Enzyme wurde nicht untersucht. Bisher wurde keine erkennbare Wechselwirkung von Buprenorphin mit Kokain beobachtet. 4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft Es liegen zurzeit keine ausreichenden Er- fahrungen vor, um eine potentiell missbildende oder fetotoxische Wirkung von Buprenorphin, wenn es in der Schwangerschaft angewendet wird, zu bewerten. Am Ende der Schwangerschaft können hohe Dosen auch nach kurzer Anwendungsdauer beim Neugeborenen Atemdepression hervorrufen. Während der letzten 3 Schwangerschaftsmonate kann eine Daueranwendung von Buprenorphin für ein Entzugssyndrom beim Neugeborenen verantwortlich sein. Daher wird die Anwendung von Buprenorphin während des 2. und 3. Trimesters der Schwangerschaft nicht empfohlen. Stillzeit Buprenorphin und seine Metaboliten gehen in die Muttermilch über. Untersuchungen an Ratten haben gezeigt, dass Buprenorphin die Laktation hemmt. Daher sollte während der Behandlung mit Buprenorphin nicht gestillt werden. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Buprenorphin kann Benommenheit ver- ursachen, insbesondere wenn es mit Alkohol oder zentral dämpfenden Arzneimitteln angewendet wird. Daher sollte dem Patienten abgeraten werden, Fahrzeuge zu führen oder Maschinen zu bedienen (siehe Abschnitt 4.5). 4.8 Nebenwirkungen Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: Sehr häufig (≥ 1/10) Häufig (≥ 1/100 bis < 1/10) Gelegentlich (≥ 1/1.000 bis < 1/100) Selten (≥ 1/10.000 bis < 1/1.000) Sehr selten (< 1/10.000) Die nach der Einnahme von Buprenorphin aufgetretenen Nebenwirkungen wurden in klinischen Studien und nach der Markteinführung beobachtet (siehe Tabelle unten). 4.9 Überdosierung Im Fall einer versehentlichen Überdosierung sind allgemeine supportive Maßnahmen einzuleiten, u. a. eine engmaschige Kontrolle des respiratorischen und kardialen Zustands des Patienten. Das Haupt- Systemorganklasse Nebenwirkungen Erkrankungen des Immunsystems Sehr selten anaphylaktischer Schock, Angioödem Psychiatrische Erkrankungen Sehr häufig Häufig Gelegentlich Insomnie Angst, Nervosität, Benommenheit Halluzinationen Erkrankungen des Nervensystems Häufig Schwindel, Kopfschmerzen Augenerkrankungen Häufig Tränenflussstörung Herzerkrankungen Häufig QT-Verlängerung Gefäßerkrankungen Häufig Ohnmacht, orthostatische Hypotonie Erkrankungen der Atemwege, des Brustraums und Mediastinums Häufig Gelegentlich Sehr selten Rhinitis Atemdepression Bronchospasmus Erkrankungen des Gastrointestinaltrakts Häufig Obstipation, Diarrhö, Übelkeit, Erbrechen, Bauchschmerzen Leber- und Gallenerkrankungen Gelegentlich Lebernekrose, Hepatitis* Erkrankungen der Haut und des Unterhautzellgewebes Häufig Schwitzen Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Asthenie, Entzugssyndrom Sehr häufig Rückenschmerzen, Schüttelfrost Häufig * In Fällen intravenösen Missbrauchs wurden lokale, mitunter septische Reaktionen und eine möglicherweise schwere akute Hepatitis berichtet (siehe Abschnitt 4.4). 3 Fachinformation Buprenaddict® Sublingualtabletten symptom, bei dem eine Intervention erforderlich ist, ist eine Atemdepression, die zum Atemstillstand und zum Tod führen könnte. Bei Erbrechen ist darauf zu achten, dass es nicht zu einer Aspiration des Erbrochenen kommt. Behandlung Intensivmedizinische Standardmaßnahmen und eine symptomatische Behandlung der Atemdepression sind einzuleiten. Offene Atemwege und eine unterstützende oder kontrollierte Beatmung müssen sichergestellt werden. Der Patient sollte in eine Einrichtung verbracht werden, die über eine komplette Ausrüstung zur Wiederbelebung verfügt. Die Anwendung eines Opioid-Antagonisten (d. h. Naloxon) wird empfohlen, trotz des möglicherweise mäßigen Effekts zur Behebung der Atemdepression durch Buprenorphin verglichen mit der Wirkung bei Opioid-Vollagonisten. Bei der Bestimmung der Dauer der Behandlung, die zur Behebung der Wirkungen einer Überdosis erforderlich ist, ist die lange Wirkdauer von Buprenorphin zu berücksichtigen. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Mittel zur Behandlung der Opiatabhängigkeit ATC-Code: N07BC01 Buprenorphin ist ein partieller OpioidAgonist/Antagonist, der an die µ (my)- und κ (kappa)-Rezeptoren des Gehirns bindet. Seine Wirksamkeit in der Opioid-Erhaltungstherapie beruht auf seiner langsamen reversiblen Bindung an die µ-Rezeptoren, die über einen längeren Zeitraum das Bedürfnis des abhängigen Patienten nach Drogen weitgehend reduzieren kann. Im Rahmen klinisch-pharmakologischer Studien bei Opiatabhängigen wurden bei einer Reihe von Parametern, darunter positive Stimmung, „gute Wirkung“ und Atemdepression, Ceiling-Effekte von Buprenorphin nachgewiesen. 5.2 Pharmakokinetische Eigenschaften Resorption Bei oraler Anwendung unterliegt Buprenorphin einem hepatischen First-PassMetabolismus, wobei es zu einer N-Dealkylierung und Glukuronidierung im Dünndarm und in der Leber kommt. Die orale Anwendung ist für dieses Arzneimittel daher ungeeignet. Die absolute Bioverfügbarkeit von Buprenorphin nach sublingualer Anwendung ist nicht genau bekannt, doch es wird angenommen, dass sie zwischen 15 und 30 % liegt. Plasmaspitzenkonzentrationen werden 90 Minuten nach sublingualer Anwendung erreicht. Das maximale Dosis-Konzentrations-Verhältnis ist zwischen 2 mg und 16 mg linear. Verteilung Der Resorption von Buprenorphin folgt eine rasche Verteilungsphase mit einer Halbwertszeit von 2-5 Stunden. Metabolismus und Ausscheidung Buprenorphin wird oxidativ durch 14-N-Dealkylierung über Cytochrom P450 CYP3A4 und durch Glukuronidierung des Stammmoleküls und des dealkylierten Metaboliten zu N-Dealkylbuprenorphin (auch Norbuprenorphin genannt) metabolisiert. Norbuprenorphin ist ein µ (my)-Agonist mit einer schwachen intrinsischen Aktivität. Die Eliminierung von Buprenorphin verläuft bi- oder triexponentiell mit einer langen terminalen Eliminationsphase von 20-25 Stunden. Dies ist teilweise durch eine Reabsorption von Buprenorphin nach hydrolytischer Spaltung des Konjugats im Darm und teilweise durch den ausgeprägten lipophilen Charakter des Moleküls bedingt. Buprenorphin wird durch biliäre Exkretion der glukuronidierten Metaboliten (70 %) hauptsächlich über die Fäzes ausgeschieden. Der Rest wird über den Urin ausgeschieden. 5.3 Präklinische Daten zur Sicherheit Die akute Toxizität von Buprenorphin nach oraler und parenteraler Gabe wurde bei Mäusen und Ratten untersucht. Die mediane letale Dosis (LD50) bei Mäusen betrug bei intravenöser, intraperitonealer bzw. oraler Verabreichung jeweils 26, 94 bzw. 261 mg/kg. Der LD50-Wert bei Ratten betrug bei intravenöser, intraperitonealer bzw. oraler Verabreichung jeweils 35, 243 bzw. 600 mg/kg. Nach einer 1-monatigen kontinuierlichen subkutanen Gabe bei Beagle-Hunden, nach 1-monatiger oraler Verabreichung an Rhesusaffen und nach 6 Monaten intramuskulärer Gabe bei Ratten und Pavianen führte Buprenorphin zu einer bemerkenswert geringen Gewebe- und biochemischen Toxizität. Aus teratologischen Studien an Ratten und Kaninchen wurde geschlossen, dass Buprenorphin nicht embryotoxisch oder teratogen ist und keine ausgeprägten Effekte auf die Entwöhnung hat. Bei Ratten wurden keine unerwünschten Wirkungen auf die Fertilität oder die allgemeine reproduktive Funktion festgestellt, dennoch führte die höchste intramuskuläre Dosis 4 (5 mg/kg/Tag) bei den Muttertieren zu Schwierigkeiten beim Gebären und zu einer hohen neonatalen Mortalität. Bei Hunden trat nach 52-wöchiger oraler Verabreichung von 75 mg/kg/Tag eine minimale bis mäßige Gallengangshyperplasie mit assoziierter peribiliärer Fibrose auf. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Citronensäure Lactose-Monohydrat Mannitol (Ph.Eur.) Natriumcitrat (Ph.Eur.) Natriumstearylfumarat (Ph.Eur.) vorverkleisterte Stärke (Mais) 6.2 Inkompatibilitäten Nicht zutreffend 6.3 Dauer der Haltbarkeit 18 Monate 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Für diese Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich. 6.5 Art und Inhalt des Behältnisses PVC/PVDC-Aluminium-Blisterpackungen Packungsgrößen 7, 10, 20, 24, 28, 30, 48, 49, 50 oder 70 Sublingualtabletten Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung Keine besonderen Anforderungen. 7. INHABER DER ZULASSUNGEN Sandoz Pharmaceuticals GmbH Raiffeisenstraße 11 83607 Holzkirchen 8. ZULASSUNGSNUMMERN 79920.00.00 79921.00.00 79922.00.00 9. DATUM DER ERTEILUNG DER ZULASSUNGEN 03.08.2011 10. STAND DER INFORMATION August 2012 11. VERKAUFSABGRENZUNG Verschreibungspflichtig, Betäubungsmittel Zusätzliche Angaben der Sandoz Pharmaceuticals GmbH zur Bioverfügbarkeit von Buprenaddict 0,4 mg Sublingualtabletten Eine im Jahr 2009 durchgeführte vergleichende Bioverfügbarkeitsuntersuchung (offen, cross-over, randomisiert) an 36 gesunden männlichen Probanden (20-45 Jahre) ergab nach Einmalgabe im Vergleich zum Referenzpräparat: Buprenorphin Testpräparat Referenzpräparat Cmax [pg/ml] maximale Plasmakonzentration 322 ± 110 334 ±129 tmax [h] Zeitpunkt der maximalen Plasmakonzentration 2,04 ± 0,873 2,24 ± 0,702 AUC0-t [pg/ml*h] Fläche unter der Konzentrations-Zeit-Kurve 2803 ± 885 2847 ± 1028 Angabe der Werte als arithmetische Mittelwerte und Streubreite (Standardabweichung). Mittlere Plasmaspiegelverläufe von Buprenorphin nach Einmalgabe von 1 Sublingualtablette Buprenorphin 0,4 mg im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm: 5 Zusätzliche Angaben der Sandoz Pharmaceuticals GmbH zur Bioverfügbarkeit von Buprenaddict 8 mg Sublingualtabletten Eine im Jahr 2009 durchgeführte vergleichende Bioverfügbarkeitsuntersuchung (cross-over, randomisiert, 2-Weg) an 34 gesunden männlichen Probanden (19-45 Jahre) ergab nach Einmalgabe im Vergleich zum Referenzpräparat: Buprenorphin Testpräparat Referenzpräparat Cmax [pg/ml] maximale Plasmakonzentration 3633 ± 1528 3555 ± 1337 tmax [h] Zeitpunkt der maximalen Plasmakonzentration 1,80 ± 0,518 1,80 ± 0,434 33670 ± 12080 33648 ± 11304 AUC0-t [pg/ml*h] Fläche unter der Konzentrations-Zeit-Kurve Angabe der Werte als arithmetische Mittelwerte und Streubreite (Standardabweichung). Mittlere Plasmaspiegelverläufe von Buprenorphin nach Einmalgabe von 1 Sublingualtablette Buprenorphin 8 mg im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm: 6