Biologische Eliminations- halbwertszeiten
Werbung

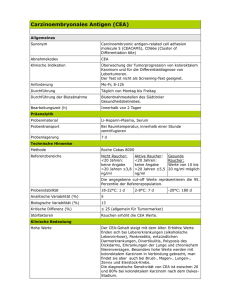
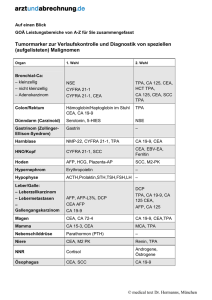
M E D I Z I N ZUR FORTBILDUNG len, welche Vorteile Früherkennung eines Rezidives durch Beobachtung eines Tumormarkeranstieges der betreffenden Patientin bringt. Biologische Eliminationshalbwertszeiten Von zentraler Bedeutung für einen effektiven und rationellen Einsatz von Tumormarkern ist die Kenntnis der biologischen Eliminationshalbwertszeiten. Die Kenntnis der biologischen Halbwertszeit ermöglicht es, po- Praxis nicht ohne weiteres möglich (idealerweise mittels engmaschig durchgeführter, postoperativer Bestimmungen bei kurativ operierten Patienten mit präoperativ erhöhten Tumormarkern!). Deshalb finden sich zum Beispiel für die Halbwertszeit von CEA in der Literatur sehr unterschiedliche Angaben. Die Gründe dürften einerseits in der Heterogenität der CEA-Isoantigene, andererseits in den unterschiedlichen Untersuchungsansätzen und Patientengruppen zu suchen sein, die zur Er- (bei höheren Konzentrationen im Linearitätsbereich etwa fünf Prozent). Bei der Beurteilung von individuellen Tumormarkerverläufen ist zusätzlich die individuelle biologische Varianz zu berücksichtigen (18). Für diese muß man gegebenenfalls deutlich höhere Schwankungsbreiten als für die analytische Präzision veranschlagen. Im Textkasten Verlaufsbeurteilung sind grobe Faustregeln zur Beurteilung der Signifikanz von Abweichungen gegenüber dem Vorwert angegeben. Tumormarker bei gastrointestinalen Tumoren Tumormarker bei gynäkologischen Tumoren Früherkennung AFP zur Früherkennung eines hepatozellulären Karzinoms bei: – chronisch aktiver Hepatitis (halbjährlich) – Leberzirrhose (halbjährlich) – Gesunden mit positivem HBsAg oder Anti-HCV (jährlich) Diagnostischer Einsatz – Verdacht auf hepatozelluläres Karzinom AFP – Verdacht auf neuroendokrinen Tumor (APUD) NSE Früherkennung Keine sinnvolle Anwendung von Tumormarkern! Therapieüberwachung und Rezidivfrüherkennung 1 1 Klinisch sinnvoll – Kolorektales Karzinom – Hepatozelluläres Karzinom – Neuroendokriner Tumor (APUD) Therapieüberwachung und Rezidivfrüherkennung CEA AFP NSE Klinischer Nutzen fraglich – Ösophaguskarzinom CEA + SCC – Magenkarzinom CA 72-4 + CEA + CA 19-9 – Gallenwegskarzinom CA 19-9 + CEA – Pankreaskarzinom CA 19-9 + CEA – Kolorektales Karzinom CEA + CA 19-9 – Analkarzinom CEA + SCC stoperative Folgebestimmungen in Abhängigkeit von der Höhe der Initialwerte vernünftig zu planen. Die tatsächlich beobachteten Halbwertszeiten sollten bei kurativen Tumorresektionen im Bereich beziehungsweise unterhalb der biologischen Halbwertszeit des betreffenden Markers liegen. Sie können außerdem bei Chemotherapien fortgeschrittener Tumorstadien prognostische Hinweise liefern (5, 10, 12). In Tabelle 2 sind neben den Richtwerten die Halbwertszeiten der unter dem Gesichtspunkt des klinischen Nutzens und der Nachfrage derzeit wichtigsten Tumormarker aufgeführt. Die Bestimmung biologischer Eliminationshalbwertszeiten ist in der Diagnostischer Einsatz Nur bei Vorliegen richtungsweisender Befunde (inspektorisch, Tastbefunde, Mammographie, Vaginalsonographie)! – Verdacht auf metastasiertes Mammakarzinom CA 15-3 – Verdacht auf Ovarialkarzinom (postmenopausal) CA 125 1 1 Klinisch sinnvoll – Mammakarzinom – Ovarialkarzinom CA 15-3 + CEA*) CA 125 **) Klinischer Nutzen fraglich – Zervixkarzinom – Corpuskarzinom SCC + CEA CA 125 + CA 19-9 *) + CA 125 bei Verdacht auf viszerale, pulmonale oder pleurale Metastasierung **) + CA 72-.4 und/oder + CA 19-9 bei CA 125-negativem Ovarialkarzinom mittlung der Halbwertszeit herangezogen wurden (unter anderem auch Patienten mit Zustand nach Lebermetastasenresektion!). Verlaufsbeurteilung mit Tumormarkern Bei der Planung von Verlaufskontrollen sind neben den Eliminationshalbwertszeiten auch die analytische und biologische Varianz sowie das verwendete Testbesteck zu berücksichtigen. Bezüglich der analytischen Präzision muß im Bereich der Entscheidungsgrenzen mit InterAssay-Variationskoeffizienten von bis zu 15 Prozent gerechnet werden Von großer praktischer Bedeutung ist die Beachtung des verwendeten Testbesteckes. Wenn zu unterschiedlichen Zeitpunkten im Verlauf unterschiedliche Testkits zur Bestimmung eines Tumormarkers eingesetzt werden, hat man bei signifikanten Abweichungen praktisch immer Probleme mit der Interpretation. Bei Angabe gleicher Cutoffs (zum Beispiel 37 U/ml für CA 19-9) und trotz Verwendung gleicher Antikörper liefern Testkits unterschiedlicher Hersteller für ein und dieselbe Serumprobe oft stark abweichende Ergebnisse von normalen bis zu hochpathologischen Werten. Dies gilt insbesondere – aber nicht nur – für die CA 19-9-Bestimmung. Selbst Deutsches Ärzteblatt 93, Heft 50, 13. Dezember 1996 (51) A-3349