Zirkulierende Tumormarker
Werbung

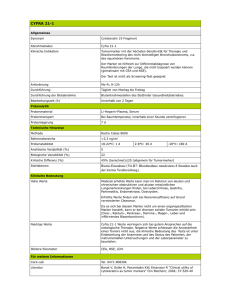
AUS DEM LABOR Zirkulierende Tumormarker und ihre Bedeutung im Klinischen Alltag Die Vorstellung, anhand von biologischen Substanzen im Plasma das Vorhandensein eines Tumors frühzeitig erkennen zu können, ist verlockend und wird seit mehr als einem halben Jahrhundert verfolgt. Die Tatsache, dass die meisten Marker auch von gesunden Zellen abgegeben werden, die geringe Freisetzung zu Beginn der Tumorerkrankung, der Mangel an Organspezifität sowie die Vielfalt der Tumorarten erschweren die Suche nach generell einsetzbaren krebsspezifischen Markern. Nichtsdestotrotz stellen die heute bekannten, zirkulierenden Tumor-assoziierten Marker nützliche Hilfsmittel bei der Therapie- und Verlaufskontrolle von malignen Erkrankungen dar. Voraussetzung ist aber eine detaillierte Kenntnis ihrer Leistungsfähigkeit. U nter dem Begriff „Tumormarker“ werden generell zelluläre und/ oder humorale flüssige Bestandteile des menschlichen Organismus verstanden, die auf ein Tumorleiden hinweisen. Sie können zur Charakterisierung des Tumors beitragen oder Hinweise zum Wachstum und Ansprechen auf eine Therapie geben. Für Tumorscreening und Primärdiagnose sind die derzeit verfügbaren Tumormarker grösstenteils ungeeignet. Dagegen ist eine Verlaufskontrolle und Rezidivüberwachung bei gesicherter Diagnose unter Zuhilfenahme von Tumormarkern sinnvoll, weil damit Änderungen im Krankheitsverlauf oft früher angezeigt werden als mit anderen Methoden. Tumormarker sollten nur bei kurativem Behandlungskonzept angewandt werden, bei palliativer Behandlung ist ihr Einsatz wenig sinnvoll. Die bis heute bekannten Tumormarker sind nicht spezifisch für malignes Wachstum. Sie werden auch bei benignen Erkrankungen und teilweise sogar beim Gesunden in erhöhter Konzentration gefunden. Man sollte deshalb korrekterweise eigentlich von Tumor-assoziierten Markern sprechen. Tumormarker können Glykoproteine und -lipide, die von der Oberfläche tumoröser Zellen abgeschilfert werden oder intrazelluläre Bestandteile, die aktiv sezerniert oder passiv freigesetzt, darstellen. Neuere Tumormarker umfas- Prof. Dr. Dr. h.c. Walter F. Riesen Diessenhofen sen genetische und epigenetische Veränderungen. Insbesondere können Mutationen von Onkogenen und Tumorsuppressorgenen (1), Gen-Rearrangements (2) und Genamplifikationen, Mikrosatellitenalterationen (3) sowie tumorassoziierte Hypermethylierungen regulatorischer Gensequenzen in DNA-Material aus zellfreiem Serum/Plasma analysiert werden. Beispielsweise gelang im Plasma von Patienten mit malignem Melanom im Stadium der regionären Metastasierung (Stadium III) der Nachweis tumorassoziierter Mikrosatelliten-DNA. Eine amerikanische Studie hat kürzlich gezeigt, dass die Präsenz solcher Mikrosatelliten-DNA im Plasma mit einer signifikant erhöhten Rezidivrate und einer verminderten Gesamtüberlebensrate einhergeht (4). Weiter gelang an Plasma-DNA von Patienten mit Prostatakarzinomen bei über 70 Prozent der Fälle der Nachweis einer tumorassoziierten Hypermethylierung spezifischer Gensequenzen. Vergleichbar hohe Anteile ergaben sich auch bei anderen soliden Tumoren. Bei einem Grossteil der untersuchten Blutproben wurden kritische Mutationen in Bereichen klassischer Onkogene und Tumorsuppressorgene (K-ras, N-ras, p53) gefunden (5–7). Der vorliegende Bericht befasst sich nur mit den im Plasma zirkulierenden, konventionellen Tumormarkern. Einflussgrössen auf Tumormarker Das Ausmass, in dem ein Tumormarker im Blut vorhanden ist, wird von zahlreichen Faktoren beeinflusst. Dazu gehören, die zelluläre Expression, die Freisetzung und Sekretion, die Tumordurchblutung, der Katabolismus der Tumormarker und ihre Ausscheidung. Bei _ 2014 _ der informierte arzt 2403 AUS DEM LABOR Störungen der Ausscheidung können folglich erhöhte Tumormarker-Werte auftreten, z.B. bei Nieren- und Leberinsuffizienz und insbesondere bei Cholestase (Choles­ tase allein kann eine CA 19.9-Serumkonzentration bis zu 30 000 U/ml erklären). Auch iatrogene Einflüsse können Tumormarker-Werte wesentlich beeinflussen. So z.B. die Erhöhung von PSA nach rektaler Untersuchung/Zystokopie/Prostatabiopsie/ Harnblasenkatheterisierung/Prostatainfarkt/ Urinretention. Die Tumormarkerkonzentration wird aber auch durch Medikamente mit Einfluss auf die Freisetzung beeinflusst. Bekannt ist ferner der Einfluss des Rauchens auf die CEA-Werte im Serum. Raucher können CEA-Werte im Serum bis zu 10 mg/ml oder selten sogar mehr aufweisen, obschon sie nicht tumorkrank sind. Neben diesen in-vivo-Störgrössen existieren auch in-vitro-Störgrössen. So beispielsweise die Lagerungsbedingungen der Probe, Hämolyse (insbesondere bei NSE) und analytische Interaktionen mit Medikamenten. Einsatz von Tumormarkern Tab. 1 Karzinome und die einsetzbaren Tumormarker im Serum Tumor Kolorektales CA Marker Screening Diagnose Verlaufs(Ersatz, Ergänzung) kontrolle – ± + CEA (CA 19-9) Prognose + Lungen-CA (kleinzellig) Lungen-CA (nicht kleinzellig) Magen-CA NSE – + + – – CYFRA 21-1 (CEA, SCC) CA 72-4 (CEA) – + + – – – – + – – Ösophagus-CA – – + – – Pankreas-CA CEA (SCC, CYFRA 21-1) CA 19-9 (CEA) – + + ± – Prostata-CA PSA (fPSA) – + + + – Leberzell-CA AFP + + – – Blasen-CA NMP-22 Risikogruppe – + + – – Mamma-CA – – + ± ± Ovarial-CA CA 15-3 (CEA, HER 2-neu) CA 125, HE4 – + + + – Schilddrüsen-CA HTG (CEA) – – + + – C-Zell-CA Calcitonin, CEA + + + – + Chorion-CA HCG – + + – – Cervix-CA SCC (CEA) – – + – – Keimzell-CA AFP, HCG, LDH Risikogruppe – – + + + + + – – + + + + + – – + – – Malignes S-100 Melanom Multiples Myelom Ig, freie LK, b2MG HNO-CA SCC (CYFRA 21-1, CEA) Tumormarker sind im Allgemeinen wenig organspezifisch. Eine Ausnahme bilden das PSA (Prostata-CA), das Thyreoglobulin (differenziertes Schilddrüsenkarzinom), Beta-HCG/AFP (Keimzelltumoren) und Calcitonin (medulläres Schilddrüsenkarzinom). Zur Tumorlokalisation sind diese Marker mit Ausnahme der genannten Marker sowie des Prolactins beim Prolactinom und des TSH bei Hypophysentumoren, unbrauchbar. Der Hauptanwendungsbereich aller Tumormarker ist die se­ rielle Bestimmung zur Verlaufsbeobachtung und der Kon­ trolle des Therapieansprechens (Operation und/oder Radiotherapie, Chemotherapie und Hormontherapie). Tumormarker eignen sich zum Nachweis einer Veränderung des Tumor-Status, die sie unter Umständen wesentlich früher als andere diagnostische Verfahren anzeigen können. Dabei ist die Tumormarker-Kinetik, d.h. die Konzentrationsänderung im zeitlichen Verlauf von Bedeutung. Die Tumormarker-Kinetik erlaubt möglicherweise auch eine Abgrenzung gegenüber benignen Erkrankungen. Diese zeigen im Gegensatz zu den malignen Erkrankungen entweder nur transitorisch erhöhte Werte oder aber konstant leicht erhöhte Werte. Eine wesentliche Voraussetzung ist dabei die strikte Beibehaltung einund derselben Messmethode (gleiche Reagenzien, gleiches Gerät). In Tabelle 1 sind die gängigen Tumormarker bei verschiedenen Karzinomen wiedergegeben. Aktuelle Empfehlungen für den Einsatz von Tumormarkern bei einzelnen Tumorerkrankungen (Keimzelltumoren, Prostatakarzinom, Kolonkarzinom, Brust- und Ovarialkarzinom) wurden von der National Academy of Clinical Biochemistry (NACB) zusammengestellt (9). Dabei wurden die Guidelines verschiedener Fachgesellschaften berücksichtigt und die Literatur nach evidenzbasierten Kriterien bewertet. der informierte arzt _ 03 _ 2014 Stadieneinteilung ± Labormethode von entscheidender Bedeutung Die Messwerte von Tumormarkern sind stark von den verwendeten Reagenzien abhängig. Die verwendeten Antikörperpaare und Unterschiede in der zu bestimmenden Epitopstruktur können zu erheblichen Unterschieden führen, die zu entsprechenden klinischen Massnahmen führen können. Eine Korrelation der Werte mit der alten und der neuen Messmethode sollte deshalb über den ganzen Messbereich durchgeführt werden. Vergleichswerte sollten zudem bei jedem einzelnen Patienten angestellt werden, da unter Umständen individuelle methodenbedingte Unterschiede auftreten können. wwProf. Dr. Dr. h.c. Walter F. Riesen B Literatur beim Verfasser Take-Home Message ◆Tumormarker (Tumor-assoziierte Marker) können eine wertvolle Hilfe bei der Differentialdiagnose von Tumorerkrankungen, beim Monitoring von Therapien und der Beurteilung der Therapiewirksamkeit, sowie bei der frühzeitigen Rezidiverkennung und zum Teil bei der Abschätzung der Prognose sein ◆Bei Verlaufsuntersuchungen sind relative Veränderungen der indivi­ duellen Ausgangswerte aussagekräftiger als die Referenzwert-basierte Interpretation ◆Testsystem und Methode sind möglichst beizubehalten. Methodenwechsel müssen am einzelnen Patienten überlappend dokumentiert werden ◆Der Nachweis von genetischen und epigenetischen Veränderungen lässt eine höhere Empfindlichkeit und Spezifität erwarten und wird die klassischen Serummarker ergänzen und möglicherweise ablösen 25