LMU
Werbung

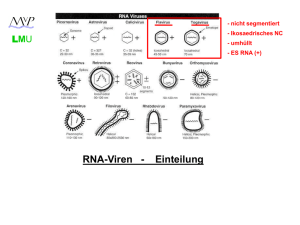
Picornaviren LMU - nicht segmentiert - Ikosaedrisches NC - umhüllt - ES RNA (+) RNA-Viren - Einteilung (+) Strang RNA-Viren LMU Picornaviridae: Enterovirus Rhinovirus Hepatovirus Aphthovirus Cardiovirus Parechovirus polio, coxsackie, echo human rhino hepatitis A foot-and-mouth disease encephalomyocarditis human parecho Caliciviridae: Norovirus norwalk-like, sapporo-like Hepatitis-E-likeviridae: Hepatitis-Evirus hepatitis E Togaviridae: Alphavirus Rubivirus sindbis, semliki-forest rubella Flaviviridae: Flavivirus Hepacivirus Pestivirus yellow fever, dengue, FSME hepatitis C classical swine fever Coronaviridae: Coronavirus human corona 229-E, SARS LMU Flaviviren mosquito.colostate.edu www.kcom.edu/.../Website/Lects/flav.gif 1902: Gelbfiebervirus Erstes humanpathogenes Virus, das als von Insekten (Aedes sp.)- übertragenes Agens für die Erkrankung (Gelbfieber) von Menschen verantwortlich gemacht werden konnte. flavus, lateinisch für “gelb” LMU Flaviviren (Flaviviridae) Arthropoden Flavivirus Gelbfieber Denguevirus Typ 1-4 FSME-Virus West-Nile-Virus Japanese-Encephalitis-Virus St.-Louis-Encephalitis-Virus Hepacivirus Hepatitis-C-Virus Pestivirus Classical-Swine-Fever-Virus (Klassische Schweinepest) Flaviviridae West-Nile-Virus; EM LMU Envelope Matrix Capsid ein Molekül infektiöse RNA, etwa 10.000 nt Virionen mit 40 – 50 nm Durchmesser lipidhaltige Hülle sphärisches Nukleokapsid pH-abhängige hämagglutinierende Eigenschaft Flaviviren LMU • Viele Flaviviren replizieren in Arthropoden und Vertebraten (Gattung: Flavivirus) Übertragung nur via Vektor (nicht Mensch - Mensch) Flaviviren LMU Übertragung von Mensch zu Mensch •beschrieben bei: - Organtransplantationen - Bluttransfusionen Daher: Keine Impfung mit Lebendimpfstoffen ab 4 Wochen vor einer Blut- bzw. Organspende • • Viele Flaviviren replizieren in Arthropoden und Vertebraten (Gattung: Flavivirus) Übertragung nur via Vektor (nicht Mensch - Mensch) Flaviviren LMU IRES IRES 5’ cap 5'-methyliertes cap oder IRES Kein polyadenyliertes 3’-Ende Strukturproteine am 5'-Ende kodiert Nicht-Strukturproteine (NS) am 3'-Ende Exkurs: Cap (allgemein) LMU RNA 5‘-5‘ Triphosphatase Guanylytransferase Manche Viren besitzen eigene Guanylyltransferase 2‘-O Methyltransferase Exkurs: Cap snatching (hier: Influenza A) LMU (-) Strang Hydrolyse einer 10-20 Nukleotid langen, zellulären mRNA (samt cap) durch eine Endonuklease-Aktivität der viralen RNA Polymerase (-) Strang Initiation der (+) Strang Synthese durch Einbau eines komplementären GTP an vorletztem C im (-) Strang Segment: Cap-primer abhängige Initiation ! (-) Strang (+) Strang Elongation durch sukzessiven Einbau komplementärer Nukleotide Exkurs: Cap versus IRES LMU Die 40 S Ribosomen Untereinheit und bestimmte eukaryotische (Translations-) Initiationsfaktoren (eIF‘s) binden an das 5‘ terminale m7GpppN (5‘ cap). Einige virale mRNAs besitzen internal ribosomal entry sites (IRES), üblicher Weise in der 5‘- UTR. Scanning der 5‘ untranslated region (UTR) nach dem ersten AUG (Start-) codon. Die Hepatitis C Virues IRES bindet direkt an die 40S Untereinheit. eIFs sind nicht notwendig. Anlagerung der 60 S Untereinheit führt zur Formation des 80 S Initiationskomplexes, der die initiator tRNA beinhaltet. Picornavirus IRES binden die 40S Untereinheit nicht direkt, sondern via hoch affine eIF4G-Bindestellen. Flaviviren (hier: HCV) LMU • Herstellung eines großen Polyproteins: Prozessierung durch virale Proteasen ( NS2 / NS3) und zelluläre Proteasen ( Signalase am ER) Flaviviren LMU Endozytose Verschmelzung der Virus- mit der Endosomenmembran Freisetzung via Golgi Vesikel Umhüllt ! IRES oder 5’-Cap Prozessierung des Polyproteins am ER (Signalasen / viral. Proteasen) Anlagerung von RNA Genomen und Budding ins ER Lumen (+) Strang RNA-Viren LMU Picornaviridae: Enterovirus Rhinovirus Hepatovirus Aphthovirus Cardiovirus Parechovirus polio, coxsackie, echo human rhino hepatitis A foot-and-mouth disease encephalomyocarditis human parecho Caliciviridae: Norovirus norwalk-like, sapporo-like Hepatitis-E-likeviridae: Hepatitis-Evirus hepatitis E Togaviridae: Alphavirus Rubivirus sindbis, semliki-forest rubella Flaviviridae: Flavivirus Hepacivirus Pestivirus yellow fever, dengue, FSME hepatitis C classical swine fever Coronaviridae: Coronavirus human corona 229-E, SARS Gelbfieber (Flavivirus) LMU Die offiziellen Zahlen belaufen sich auf ca. 200.000 Erkrankungen und ca. 30.000 Todesfälle pro Jahr weltweit (90 % in Afrika). Die Letaliät liegt bei 20-50%. Gelbfieber (Flavivirus) LMU • Reservoir: Mensch / Affe / Vögel • Pathogenese: - Infektion von Endothelzellen / Lymphozyten und Monozyten / Makrophagen an der Einstichstelle - Transport in Lymphknoten (Virämie) - Ausbreitung in andere Organe (v.a. Leber / aber auch Niere, Herz, Muskel etc.) - Zerstörung der Leberzellen: verminderte Produktion von Gerinnungsfaktoren • Klinik: biphasischer Krankheitsverlauf 1. Phase: - Inkubationszeit ca. 3-6 Tage: - Fieber bis 40°C (Schüttelfrost / Kopfschmerzen, Myalgien, Übelkeit…) - Nach 3-4 Tagen: Rückgang der Symptomatik Toxische Phase (Bei ca. 15 % der Erkrankten) - Heftiger Rückfall (Fieber > 40°C) - Hämorrhagien - Gelbsucht - Blutdruckabfall / Nierenversagen / Leberversagen / Schock - Letalität: 20-50 % Gelbfieber (Flavivirus) LMU Walter Reed (1851-1905) Gelbfieber bei amerik. Soldaten im SpanischAmerik. Krieg auf Kuba (1900). Experiment. Transmission durch Moskitos auf Mäuse (1902). Max Theiler (1899-1972) 1937: Virusvermehrung in Hühnerembryos Produktion attenuierter Viren 17 D Vakzine-Stamm (64 aa verändert, einmaliger „Züchtungserfolg“) [Lebendimpfstoff] Dengue Fieber (Flavivirus) LMU M Jährlich werden etwa 50 Millionen Menschen weltweit vom Dengue-Fieber befallen. Der Großteil der Infizierten (>90%) sind Kinder. Die Letalität liegt insgesamt zwischen 2 und 5 Prozent, bei Neugeborenen deutlich höher. Häufigste durch Insekten übertragene Virusinfektion des Menschen ! Dengue Fieber (Flavivirus) LMU • Reservoir: Mensch und Affe • 4 Typen (Typspezifische Immunität) • Pathogenese: - Infektion von Monozyten / Makrophagen - Evtl. Infektionsverstärkende Antikörper (Zweitinfektion mit versch. Typ) !!! - Aktivierung von DV-spezifischen T-Zellen - Massive Zytokinausschüttung (IL-1, IL-2, TNFalpha) - Permeabilitätsanstieg der Kapillaren (Ergüsse / Hämorrhagien / Schock) - Thrombopenie (Autoantikörper gegen Thrombozyten ?) Dengue Fieber (Flavivirus) LMU Infektionsverstärkende Antikörper • 1) Zweitinfektion mit unterschiedlichem Typ 3) Makrophagen / Monozyten verbreiten das Virus schnell im Organismus Dengue Virus (infektionsverstärkende Antikörper) M AK aus zurückliegenden Infektionen können Virus nicht neutralisieren… 2) Infektionsverstärkende AK 4) Cytokinproduktion (Cytokinsturm): - Komplementaktivierung - T-Zellaktivierung - Erhöhung der Gefäßpermeabilität Dengue Fieber (Flavivirus) LMU • Klinik: Klassisches Dengue Fieber Inkubationszeit ca. 1 Woche (3-14 Tage) Fieber / Ausschlag / Gliederschmerzen (Dengue Trias) Selbstlimitierend / Entfieberung und Genese am 7. Tag Letalität: fast 0 % Atypisches Dengue Fieber Kurze Dauer Milder Verlauf Hämorrhagisches Dengue Fieber Beginn wie klassisches DF; nach 2.- 5. Tag rasante Verschlechterung Blutungen und Schock V.a. bei Kindern (< 10 Jahre) und alten Menschen Letalität behandelt: 5 % / unbehandelt: 40 % Dengue Fieber (Flavivirus) LMU • Diagnostik: Immunfluoreszenz Test (IFT) auf IgG und IgM: - Virusinfizierte Zellen auf OT (kommerziell erhältlich) - Zugabe von Patientenserum - Immunfärbung mit fluoreszenzmarkiertem anti-IgG bzw. IgM FSME-Virus (Flavivirus) LMU Ixodes Ricinus Risikogebiet: FSME Inzidienz > 1:100.000 (letzte 5 Jahre) Risikogebiet: 1-5 % der Zecken sind durchseucht FSME (Flavivirus) LMU • Reservoir: kleine Nagetiere • Pathogenese: - Infektion von Endothelzellen und Monozyten / Makrophagen an der Bissstelle - Transport in Lymphknoten (Virämie) - Ausbreitung in andere (extraneurale) Organe (Bindegewebe, Muskelgewebe...) - Hämatogene (Makrophagen ???) Ausbreitung ins Gehirn; dort: - Ödeme / Blutungen / neurale Degeneration und Nekrosen (v.a. Motorneurone) • Klinik: - 70 % inapparent - in 30 %: biphasische Erkrankung: - Nach 1-2 Wochen: grippeähnliche Symptome; Danach Genesung. - Bei einem Drittel: ZNS-Beteiligung: - milde Form: Hirnhautentzündung (Meningitis) - Schwere Form: Gehirnentzündung (Enzephalitis) – Lähmungserscheinungen ! Letalität: 1 – 5 % 20 % der Überlebenden haben neurolog. Folgeerscheinungen • Vakzin vorhanden: Inaktivierte Viren [Totimpfstoff] FSME (Flavivirus) LMU • Diagnostik: ELISA (IgG / IgM): - Mikrotiterplatte mit FSME Antigen (kommerziell erhältlich) - Zugabe von Patientenserum - Zugabe von POX konjugierten anti-IgG bzw. IgM Sekundär-AK - Substratzugabe und Farbreaktion Serum / Liquor Quotient (IgG / IgM / IgA): - Reiberschema (beschreibt Blut-Hirn Schranke) 1) Normal 2) Schrankenstörung 3) Intrathekale IgG Synthese mit Schrankenstörung 4) Intrathekale IgG Synthese ohne Schrankenstörung - AK-Index (beschreibt intrathekale Ig Synthese) AK-Index = Q FSME Q IgG (Gesamt) = Konzentration FSME IgG (Liquor) Konzentration FSME IgG (Serum) Konzentration Gesamt IgG (Liquor) Konzentration Gesamt IgG (Serum) AK-Index >/= 1,5 Verdacht auf Beteiligung des Erregers an Pathogenese (+) Strang RNA-Viren LMU Picornaviridae: Enterovirus Rhinovirus Hepatovirus Aphthovirus Cardiovirus Parechovirus polio, coxsackie, echo human rhino hepatitis A foot-and-mouth disease encephalomyocarditis human parecho Caliciviridae: Norovirus norwalk-like, sapporo-like Hepatitis-E-likeviridae: Hepatitis-Evirus hepatitis E Togaviridae: Alphavirus Rubivirus sindbis, semliki-forest rubella Flaviviridae: Flavivirus Hepacivirus Pestivirus yellow fever, dengue, FSME hepatitis C classical swine fever Coronaviridae: Coronavirus human corona 229-E, SARS LMU Hepatitis C Virus (Hepacivirus) Verbreitung GF Hepatitis C Virus (Hepacivirus) LMU Genotypen 1b,1a,3a 2a,2b,1b 4 6a 1a,1b,3a 3a 5a HCV-Genotypen weisen etwa 65 % Nukleinsäure-Homologie auf. Hepatitis C Virus (Hepacivirus) LMU Pathogenese: - Parenterale Übertragung (Blut) – Transfusion / Nadelstichverletzung - Via infizierte Makrophagen Transport zur Leber - Leberentzündung mit Nekrosen - Zellschädigung durch Immunsystem Klinik: - Inkubationszeit: 7 – 140 Tage (Mittel: 50 Tage) - Sehr selten akute Verlaufsform (nur in ca. 25 %) - 60-80% der Infektionen werden chronisch - Etwa die Hälfte der chronisch infizierten entwickelt eine chronisch Lebererkrankung und etwa ein Viertel bekommt eine Zirrhose. - Bei ca. 4 % der Patienten mit Zirrhose entwickelt sich ein primäres Leberzellkarzinom (HCC) Hepatitis C Virus (Hepacivirus) LMU Serologie: 20-40 % 60-80 % in ca. 25 % akute Verlaufsform ! häufig unbemerkte Infektion ! Hepatitis C Virus (Hepacivirus) LMU Stadien der Leberschädigung (allgemein): HCC Hepatitis C Virus (Hepacivirus) LMU Therapie: - PEG Interferon alpha in Kombination mit Ribavirin - Proteaseinhibitoren in Erprobung - Ziel: kein HCV RNA Nachweis - 6 Monate nach Therapieende - Heilung in mehr als 60 – 80 % Faktoren assoziiert mit Interferon- / Ribavirintherapie: - Genotyp des HCV (am besten Typ 2 und 3 / am schlechtesten Typ 1) - Zahl der HCV Genome im Blut (je niedriger desto besser) - Leberhistologie (schlecht bei Zirrhose) - Dauer der HCV Infektion (je kürzer desto besser) - Lebensalter (je jünger desto besser) - Geschlecht (Frauen sprechen besser an) Monitoring und möglichst früher Therapiebeginn !!! Hepatitis C Virus (Hepacivirus) LMU • Diagnostik: ELISA (IgG ): Suchtest - Mikrotiterplatte mit HCV Antigen (kommerziell erhältlich) - Zugabe von Patientenserum - Zugabe von POX konjugierten anti-IgG Sekundär-AK - Substratzugabe und Farbreaktion Wenn positiv, dann…. Bestätigungstest Line Immunoassay (IgG ): Westernblot - Membran mit aufgesprühtem HCV Antigen (kommerziell erhältlich) - Zugabe von Patientenserum - Zugabe von anti-IgG Sekundär-AK - Substratzugabe und Farbreaktion Hepatitis C Virus (Hepacivirus) LMU • Diagnostik: PCR: - RT-PCR - quantitativ (Bestimmung der Viruslast und des Therapieerfolgs) - mit Sequenzierung (Bestimmug des Genotyps / Abklärung von Resistenzen) (+) Strang RNA-Viren LMU Picornaviridae: Enterovirus Rhinovirus Hepatovirus Aphthovirus Cardiovirus Parechovirus polio, coxsackie, echo human rhino hepatitis A foot-and-mouth disease encephalomyocarditis human parecho Caliciviridae: Norovirus norwalk-like, sapporo-like Hepatitis-E-likeviridae: Hepatitis-Evirus hepatitis E Togaviridae: Alphavirus Rubivirus sindbis, semliki-forest rubella Flaviviridae: Flavivirus Hepacivirus Pestivirus yellow fever, dengue, FSME hepatitis C classical swine fever Coronaviridae: Coronavirus human corona 229-E, SARS Togaviren (Togaviridae) LMU Arthropoden Alphavirus Sinsdbisvirus (Maus / Mensch) Western-Equine-Encephalitis-Virus (Pferd) Semliki-Forest-Virus (Nagetiere) Ross-River-Virus (Beuteltiere / Mensch) In Europa selten - häufig in Amerika, Afrika, Asien Replikation oft wenig wirtsspezifisch in Stechmücken, Vögeln, Pferden Rubivirus Rötelnvirus Togaviridae LMU ein Molekül infektiöse RNA, etwa 12.000 nt Virionen mit 60 – 70 nm Durchmesser lipidhaltige Hülle (EM: Toga) ikosaedrischer Aufbau Togaviridae LMU (+) (-) (+) 5'-methyliertes cap Polyadenyliertes 3’-Ende Strukturproteine am 3'-Ende kodiert Nicht-Strukturproteine (NS) am 5'-Ende Subgenomische mRNA (→ Strukturproteine) Polyprotein-Prozessierung durch Proteasen Togaviridae LMU Budding Komplexe an allen Membranen: ER, Golgi und (wie auf der Abbildung) CM !!! Induktion von Apoptose im Infektionsverlauf Rötelnvirus (Rubivirus) (German measles) LMU Pathogenese: - Tröpfcheninfektion - Primäre Replikation in den Epithelien des Oropharynx - Infektion von Makrophagen und Lymphozyten - Transport in Lymphknoten (Schwellung) - Virämie und Ausbreitung über ganzen Organismus - Persistenz in Synovial- (Gelenksspalt-) zellen ??? - Schwangerschaftsinfektion möglich (via Blut Plazenta Endothel) Rötelnvirus (Rubivirus) LMU (German measles) Klinik (Röteln - postnatal): - Relativ harmlose, wenig fieberhafte Erkrankung - Häufig inapparent - Auftreten des (uncharakteristischen) Exanthems ca. 1-2 Wochen nach Infektion - Ausschlag kleinfleckig und konfluiert nicht - Lymphknotenschwellungen im Halsbereich - Bei jungen Frauen häufig: Arthralgien (Gelenkentzündungen) - Selten: Autoimmunenzephalitis (1 : 6000); 20 % verlaufen letal Rötelnvirus (Rubivirus) LMU (German measles) Serologie: Virus im RSW IgM Infektiosität IgG Infektion Virus im Serum Symptome - 20 -5 0 5 14 - 21 Tage Rötelnvirus (Rubivirus) (German measles) LMU Klinik (Röteln - pränatal): - Gregg (1941): Zusammenhang zwischen Rötelinfektion in SS und Mißbildungen - Pränatale Infektion bis 17 SSW (Zeit der Organdifferenzierung): Aborte, Totgeburten, Mißbildungen - Gregg Syndrom (Trias): Herzmißbildungen, Augenschäden, Innenohrdefekte - Mutterschaftsrichtlinie: Test auf Rötelnimmunität (RHAH – Immunität ab 1:32) - Impfung (Lebendimpfstoff – MMR – 11.-14. Lebensmonat) - Infektion bis 17 SSW: Indikation für SS-Abruch !?! Rötelnvirus (Rubivirus) (German measles) LMU Klinik (Röteln - pränatal): - Gregg (1941): Zusammenhang zwischen Rötelinfektion in SS und Mißbildungen - Pränatale Infektion bis(bis 17 SSW (Zeit der Organdifferenzierung): Kein Immunschutz 17.SSW): - RHAH 1:32 bzw.Mißbildungen Röteln-ELISA < 15 IU/ml Aborte,<Totgeburten, -- bei Exposition (bis 5 Tage nach Exposition): - Gregg Syndrom (Trias): - sofort: IgG Gabe als Postexpositionspropylaxe (PEP) Herzmißbildungen, Augenschäden, Innenohrdefekte - normalerweise keine Gefahr – Virusausbreitung verhindert ! • - Mutterschaftsrichtlinie: auf Rötelnimmunität (RHAH – Immunität ab 1:32) FallsTest Frist zur PEP verstrichen: - Test des (Lebendimpfstoff Kindes (Fruchtwasser) bzw. der Mutter auf - Impfung – MMR – 11.-14. Lebensmonat) Rötelninfektion (via PCR !) - Infektion bis 17 SSW: Indikation für SS-Abruch !?! - Wenn positiv, dann Angebot der SS Unterbrechung Rötelnvirus (Rubivirus) LMU (German measles) • Diagnostik: ELISA (IgG ): - Mikrotiterplatte mit HCV Antigen (kommerziell erhältlich) - Zugabe von Patientenserum - Zugabe von POX konjugierten anti-IgG Sekundär-AK - Substratzugabe und Farbreaktion µ-capture ELISA (IgM ): - Mikrotiterplatte mit anti IgM AK (kommerziell erhältlich) - Zugabe von Patientenserum (Bindung von allen IgM) - Zugabe von Röteln Antigen - Zugabe von POX konjugiertem anti-Röteln AK - Substratzugabe und Farbreaktion Rötelnvirus (Rubivirus) LMU (German measles) • Diagnostik: RHAH (IgG und IgM): Hämaglutinationshemmtest (kommerziell erhältlich) - Vorlegen von Patientenserum - Zugabe von Rötelnvirus (Bindung von AK falls vorhanden) - Zugabe von Erythrozyten Positiv: Knopf Negativ: Teppich PCR: - v.a. bei Schwangerschaftsproblematik bei Mutter und Kind (Fruchtwasser) Contributors Armin Baiker, Max-von-Pettenkofer Institut, LMU München Email: [email protected]