Elektrochemische Solarzellen
Werbung
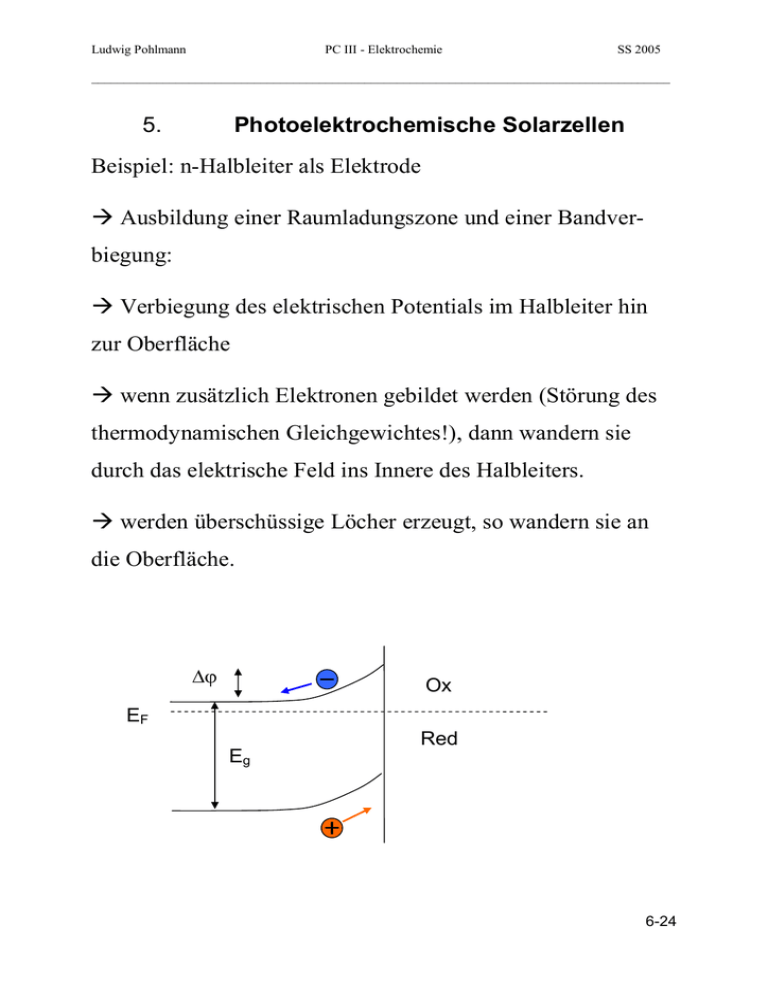
Ludwig Pohlmann PC III - Elektrochemie SS 2005 _________________________________________________________________________________________ 5. Photoelektrochemische Solarzellen Beispiel: n-Halbleiter als Elektrode Ausbildung einer Raumladungszone und einer Bandverbiegung: Verbiegung des elektrischen Potentials im Halbleiter hin zur Oberfläche wenn zusätzlich Elektronen gebildet werden (Störung des thermodynamischen Gleichgewichtes!), dann wandern sie durch das elektrische Feld ins Innere des Halbleiters. werden überschüssige Löcher erzeugt, so wandern sie an die Oberfläche. Ox EF Eg Red 6-24 Ludwig Pohlmann PC III - Elektrochemie SS 2005 _________________________________________________________________________________________ Wodurch kann dies passieren? Wenn die Halbleiteroberfläche mit Photonen bestrahlt wird, deren Energie größer als die Bandlücke Eg ist: dann werden immer Paare von Ladungsträgern erzeugt: Gitter + h e + h+ Elektronen im Leitfähigkeitsband Löcher im Valenzband Ox EF Eg h Red Was passiert weiter: 1. Rekombination von Löchern und Elektronen unter Bildung von Wärme (in Metallen fast augenblicklich, in 6-25 Ludwig Pohlmann PC III - Elektrochemie SS 2005 _________________________________________________________________________________________ Halbleitern aber durch die Bandlücke und Gitterschwingungen verzögert) 2. Wenn eine Bandverbiegung vorliegt: Räumliche Trennung entgegengesetzt geladener Ladungsträger, Rekombination ist nicht mehr möglich ein Teil der Ladungen wird durch die Bandverbiegung getrennt, positive Ladungen sammeln sich an der Oberfläche, negative im Volumen! Aufbau einer Potentialdifferenz, Ausbildung eines positiven Potentials an der Halbleiterelektrode. Eine Oxidation von Ionen auf der Lösungsseite (im reduzierten Zustande) wird möglich: Re n + + h + Ox ( n +1) + Photooxidation! Schlussfolgerung: beim Flachbandpotential ist dieser Vorgang nicht möglich! 6-26 Ludwig Pohlmann PC III - Elektrochemie SS 2005 _________________________________________________________________________________________ Nutzbarmachung dieses elektrochemischen Photoeffektes: In allen Fällen ist es notwendig, den Stromkreis zu schließen! R ee- Eg h Ox Ox Red Red e- Photovoltaische Zelle zur direkten Umwandlung von photonischer Energie in elektrischen Energie! Beispiel: n-CdSe/ Se2- / Se22- / Pt Prinzip: inerte Gegenelektrode, reversibles Redoxpaar, keine Trennung von Anoden- und Kathodenraum Sinnvoll: lichtdurchlässige Gegenelektrode: ITO-Glas (Indium Tin Oxide) oder SnO2:F-Glas 6-27 Ludwig Pohlmann PC III - Elektrochemie SS 2005 _________________________________________________________________________________________ Das Analoge ist auch für p-Halbleiter möglich: hier gelangen Überschusselektronen an die Oberfläche und können dort ein Redoxpaar reduzieren: Beispiel: p-MoS2/ Fe3+ / Fe2+ / Pt Photoreduktion! R e- eEg h Ox Red Ox Red e- 6-28 Ludwig Pohlmann PC III - Elektrochemie SS 2005 _________________________________________________________________________________________ Elektrochemie der n-Halbleiterelektrode unter Belichtung O R Gegenelektrode i Flachbandpotential +E -E Dunkelstrom R O Photostrom die Photooxidation passiert an Potentialen, welche weniger positiv als das Gleichgewichtspotential an einer inerten Elektrode wären: deshalb auch als „photoassistierte“ Elektrodenreaktionen bezeichnet! 6-29 Ludwig Pohlmann PC III - Elektrochemie SS 2005 _________________________________________________________________________________________ Andere Zelltypen: Photoelektrosynthetische Zellen: unterschiedliche Reaktionen an beiden Elektroden, Trennung beider Elektrodenräume, Ermöglichung von Reaktionen mit G > 0: Lichtenergie wird in chemische Energie umgewandelt Photokatalytische Zellen: wie oben, aber G < 0, jedoch sehr hohe Aktivierungsbarriere: hier wird die Photonenenergie verwendet, um die Aktivierungsenergie aufzubringen 6-30 Ludwig Pohlmann PC III - Elektrochemie SS 2005 _________________________________________________________________________________________ Die Farbstoffsolarzelle – der Weg zur praktischen Anwendung photoelektrochemischer Solarzellen „Grätzel-Zelle“ (Prof. Michael Grätzel, Lausanne, O’Regan und Grätzel 1991) Vorteile: kein Silizium, nur einfach zu erzeugende, umweltfreundliche Materialien, leicht zu produzieren, billig Idee: Aufteilung der Aufgaben einer elektrochemischen Halbleitersolarzelle auf verschiedene Materialien: TiO2: sehr große Bandlücke (3.0 eV), aber lässt sich nur durch UV anregen: 90% des Sonnenlichtes bleiben ungenutzt! Photoanregbarer Farbstoff: nutzt einen breiten Bereich des Sonnenspektrums (z.B. Ruthenium-Bipyridyl), injiziert die angeregten Elektronen in das TiO2. Realisierung: nanoporöse TiO2-Schicht, Korngröße 10 – 20 nm, darauf monomolekulare Farbstoffschicht plus IodidTriiodid-Elektrolyt: I-/I3- 6-31 Ludwig Pohlmann PC III - Elektrochemie SS 2005 _________________________________________________________________________________________ Aufbau: Funktionsweise (nach Grätzel): Photonen werden im Farbstoff S absorbiert und die angeregten Elektronen vom Zustand S* in das TiO2-Leitungsband inji6-32 Ludwig Pohlmann PC III - Elektrochemie SS 2005 _________________________________________________________________________________________ ziert. Das Iodid I- reduziert das im Farbstoff verbleibende Loch und diffundiert als Triiodid I3- zur Pt-Gegenelektrode. Bruttoreaktion des Redoxpaares: I 3 + 2e 3I 6-33











