Mycobacterium tuberculosis 04 14
Werbung

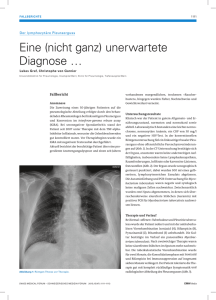
Mycobacterium tuberculosis Mycobacterium tuberculosis (ZIEHL-NEELSEN-Färbung) Allgemeine Angaben Name (Synonyma): Mycobacterium tuberculosis (Zopf 1883) Lehmann and Neumann 1896; Erstbeschreibung: Zopf, W. 1883. Die Spaltpilze, 1-110 [31]; Lehmann, K. B. & Neumann, R. 1896. Atlas und Grundriss der Bacteriologie und Lehrbuch der speziellen bacteriologischen Diagnostik, 1. Aufl. [19]. Synonyma: „Bacterium tuberculosis“ Zopf 1883, „Bacillus tuberculosis“ (Zopf 1883) Klein 1884; „Mycobacterium tuberculosis typus humanus“ Lehmann and Neumann 1907; „Mycobacterium tuberculosis var. hominis“ Bergey et al. 1934 [8]; Mycobacterium tuberculosis subsp. tuberculosis Aranaz et al. 1999 [1]. Etymologie: griech. mykes, Pilz (pilzähnliches Oberflächenwachstum in flüssiger Kultur, selten Bildung von verzweigten Stäbchen); lat. tuberculum, kleiner Knoten [Der Tuberkel (Tuberkuloseknötchen) ist die granulomatöse Reaktionsform der Tuberkulose, in der die Erreger quasi eingeschlossen sind.] [3, 21]. Pathovarietäten: avirulenter Stamm Mycobacterium tuberculosis H37Ra H37Rv = ATCC 27294 (Neotypstamm) [18] Typstamm: Risikogruppe: 3 Konsiliar-/Referenzlabor: Nationales Referenzzentrum für Mykobakterien, Forschungszentrum Borstel, Parkallee 18, D-23845 Borstel; Leitung: Frau Dr. S. Rüsch-Gerdes Molekularbiologie, Morphologie und Physiologie Genom: 65,6 mol% G+C (vollständiges Genom: Sequence Accession no. X58890) [21]; 4,4 Mb großes, zirkuläres Chromosom (4.411.529 bp), reich an repetitiver DNA und IS-Elementen und 3924 ORFs, keine definierten Pathogenitätsinseln bekannt [5]; M. tuberculosis H37Ra besitzt ein 4,4 Mb großes, zirkuläres Chromosom (4.419.977 bp) mit einem G+C Gehalt von 65,61 mol% und damit ein um 8445 bp größeres Genom als M. tuberculosis H37Rv [29]. Zelluläre und kulturelle Morphologie: unbewegliche, Gram-positive Stäbchenbakterien, 1-4 µm lang und 0,30,6 µm dick; keine Sporenbildung; aerob bis mikroaerophil (Zusatz von 5-10% CO2 wirkt wachstumsstimulierend [21]; die lipidreiche Zellwand [hoher Gehalt an Mykolsäuren (α-alkylβ-hydroxy-Fettsäuren), Cord-Faktor (Glykolipid: 6,6‘-Dimykolyltrehalose) und Wachsen] führt zu schlechter Darstellbarkeit in der GRAM-Färbung; Fuchsin wird aber unter Erhitzen gut aufgenommen und trotz Säurebehandlung (Bildung eines stabilen Fuchsin-MykolatKomplexes) nicht wieder abgegeben, was als für Mykobakterien charakteristische Säurefestigkeit bezeichnet wird (ZIEHL-NEELSEN-Färbung, in der die Stäbchen leuchtend rot erscheinen) [3, 21]; die Bakterien lagern sich z. T. zu zopfartigen Agglomeraten („CordBildung“) zusammen [2, 3, 21]. Physiologie: chemoorganoheterotroph; mesophil (Optimum 37°C), pH-Optimum 6,4-7,0; langsames Wachstum auf/in Spezialnährmedien, z. B. Eiernährböden (Eigelb zur Bereitstellung von Lipiden) wie LÖWENSTEIN-JENSEN-Medium (Generationszeit: 6-20 Stunden; Bildung von sichtbaren Kolonien auf festen Medien nach ca. 2-4(-8) Wochen), Nachweis von Wachstum in Flüssigmedien anhand mykobakterieller Stoffwechselaktivität nach durchschnittliche 2-3 Wochen [2, 3]. Charakteristische diagnostische Merkmale: im Vergleich zu vielen anderen Mykobakterien besonders ausgeprägte Säurefestigkeit (s. o.); Niacin-Test positiv (M. tuberculosis bildet Nikotinsäure im Gegensatz zu M. bovis und einigen anderen Mykobakterien); Nitratreduktionstest positiv (im Gegensatz zu M. bovis) [2, 3, 21]; 68°C Katalase-Test (M. tuberculosis verliert unter diesen Bedingungen Katalase-Aktivität) [21, 23]; Unterscheidung einzelner M. tuberculosis-Stämme durch RFLP-Analysen möglich (Detektion variabler Kopienzahl von IS6110, welches in allen M. tuberculosis-Stämmen vorkommt [23]. 1 Stand: 04/2014 Natürlicher Standort Nicht freilebend, obligat wirtsgebunden: fakultativ intrazellulär (Persistenz und Vermehrung in den Makrophagen des Wirtsorganismus [2, 3, 21, 23]. Wirtsbereich: Mensch sowie Nutz- (insbesondere Rinder), Haus- und gelegentlich Wildtiere [30]. Pathogenität Pathogen für: Menschen und verschiedene Wirbeltiere; hoch pathogen für Meerschweinchen, weshalb diese Tiere früher mit großem Erfolg für diagnostische Tierversuche verwendet wurden [21, 30]. Pathogenitätsfaktoren/Pathogenese: Die Pathogenität von Mycobacterium tuberculosis beruht auf dem Zusammenspiel zahlreicher Virulenzfaktoren. Zentrale Bedeutung für die Pathogenität kommt der Fähigkeit zu, in Makrophagen überleben und sich in ihnen vermehren zu können sowie die Fusion von Phagosom und Lysosom zu hemmen. Dabei spielen die für Mykobakterien charakteristische lipidreiche Zellwand, insbesondere deren Mykolsäuren und mykolsäurehaltigen Glykolipide [2, 3], darunter vor allem der sog. „Cordfaktor“ (Trehalose6,6-Dimykolat) = Mykosid (= Mykolsäure-haltiges Glykolipid der Zellwand), ebenso wie andere Glykolipide (Lipoarabinomannan) (immunmodulatorische Aktivität) eine besonders wichtige ursächliche Rolle [2]. Weiterhin zählen die Katalase-Peroxidase-Aktivität (katG-Gen) (schützt vor der Wirkung von in Phagozyten gebildetem H2O2), der sog. „Makrophagen-Kolonisations-Faktor“ (mce-Gen) (kodiert für integrale Membran-Proteine, die die Invasion in die Wirtszelle bewirken) und zahlreiche Phospholipasen, Lipasen, Esterasen und verschiedene Proteasen, die Zell- und Vakuolenmembranen zerstören können, zu den zusätzlichen Virulenzfaktoren [5]. Eine Hämolysin-Wirkung einer spezifischen Phospholipase [5] wird ebenso als Pathogenitätsfaktor diskutiert wie Eisenkomplexbildner (Mykobaktine), die mit eisenbindenden Substanzen des Wirtes (z. B. Transferrin) in Kompetition stehen. Ein zentraler Vorgang bei der Pathogenese der M. tuberculosis-Infektion ist die granulomatöse Entzündungsreaktion, die als Ausdruck der zellulären Immunabwehr auf die Aktivierung von Makrophagen durch T-Zellen zurückgeht und bei der es zu einem Wechselspiel zwischen T-Lymphozyten, MHC-vermittelter Antigenpräsentation und den Zytokinen Interferon-γ und Tumornekrosefaktor kommt [3]. Die zellulär-vermittelte chronische Entzündungsreaktion im Gefolge der mykobakteriellen Infektion führt im Rahmen nekrotisierender und fibrosierender Prozesse zur Gewebezerstörung. Ausgehend von nekrotischen Granulomen in der Lunge kann es zur Ausbreitung der Erreger im Wirt bzw. Besiedelung anderer Organe (z. B. Milz) kommen [2, 3]. Proteine bzw. Enzyme, die bei diesen Vorgängen (Zerstörung von Membranen und anschließende Ausbreitung der Erreger im gesamten Wirtsorganismus) eine wichtige Rolle einnehmen, gehören zu den Haupt-Virulenzfaktoren. Diese sind bei M. tuberculosis in der sog. RD1-Region (region of difference) lokalisiert und gehören zu einem 9 Gene umfassenden Sekretionssystem (ESX-1 locus), welches für die Sekretion der HauptvirulenzFaktoren ESAT-6 und CFP-10 zuständig ist. Die letzteren beiden Proteine sind hauptsächlich bei der Translokation der Mykobakterien vom Phagosom ins Zytosol und der anschließenden intrazellulären Ausbreitung beteiligt. Eine Deletion dieser Region liegt bei allen attenuierten M. bovis BCG-Impfstämmen zugrunde [20, 22, 25]. Neuere Untersuchungen deuten auf eine regulatorische Funktion des CFP10/ESAT6-Komplexes bei der Apoptose infizierter Makrophagen zu unterschiedlichem Infektionszeitpunkt hin [12]. Genetische Studien an dem attenuierten, avirulenten Stamm Mycobacterium tuberculosis H37Ra zeigten die Beteiligung weiterer zahlreicher essentieller Gene an der Pathogenese, da deren Mutation zu einem signifikanten Virulenzverlust führte. Für folgende Gene konnte eine Beteiligung an der Virulenz nachgewiesen werden: PE/PPE/PE-PGRS Gene kodieren Proteine, die für die Fibronectin-Bindung bzw. Oberflächen-Antigen-Variation verantwortlich sind; Gene, die für Stress-Proteine kodieren (mazG) und solche, die für die Regulation wichtiger Bioynthese-Gene zuständig sind (phoP – Transkriptionsaktivierung der Lipidbiosynthese, ilvD – Transkriptionsaktivierung der Aminosäure-Biosynthese, pks12 und nrp – Transkriptionsaktivierung der Polyketid-Biosynthese); weiterhin kommt Mutationen in 2 Stand: 04/2014 wichtigen Promotor-Bereichen eine Bedeutung zu, z. B. in Promotoren für den EnergieMetabolismus (lpdA-glpD2), Cofaktor-Biosynthese (pabB), Nukleotid Metabolismus (nrdH/nrdE/nrdF2), Lipid-Metabolismus (phoH2) und Protein-Degradation (ftsH) [29]. Zusätzlich an der Höhe der Virulenz beteiligt sind verschiedene Sigma-Faktor(σ)-Gene (sigA bzw. rpoV), die für die Transkription zahlreicher Gene verantwortlich sind und deren Mutation zur Attenuierung virulenter M. tuberculosis-Stämme führt [6, 29]; für SigC wird eine essentielle Beteiligung bei der Pathogenese diskutiert, da bei SigC-Mutationen die Ausbildung nekrotischer Granulome in Lunge und Milz ausbleibt [15, 26]. Ausprägung der Pathogenität: obligat pathogen; Menschen mit Beeinträchtigung der zellulären Immunität (z. B. AIDS-Patienten) sind besonders anfällig und neigen zu schweren bis fulminanten Krankheitsverläufen [2, 3]. Infektionsdosis: sehr niedrig: ≤10 (1 - 3) infektionstüchtige Erreger [27]! Allergenität: keine Allergenität im engeren Sinne; eine Infektion führt bei immunkompetenten Menschen aber zu einer Überempfindlichkeitsreaktion vom Spättyp (delayed type hypersensitivity reaction), die auch als „verzögerte allergische Reaktion“ bezeichnet wird. Die positive Tuberkulinreaktion ist Ausdruck einer solchen Überempfindlichkeitsreaktion vom Spättyp [3, 9]. Toxigenität: keine Exotoxinbildung [3]. Krankheit Bezeichnung: Tuberkulose: Lungentuberkulose, Miliartuberkulose, Lymphknotentuberkulose, Nierentuberkulose, Meningitis tuberculosa, Knochenund Gelenktuberkulose, Hauttuberkulose [2, 3]. Inkubationszeit: bei inhalativer Erregeraufnahme 2-3 Wochen bis zur Ausbildung eines tuberkulösen Primäraffektes in der Lunge (Primäraffekt und befallene regionäre Lymphknoten bilden den Primärkomplex); 2-3 Monate bis zur Entstehung von Granulomen am Ort des Primäraffektes, lokalisierten Streuherden (oft Spitzenherden) und – bei Immunschwäche, Kleinkindern – einer Miliartuberkulose [2, 3]; bei Inokulation (z. B. Sektionsverletzung) abhängig von eingebrachter Erregermenge, Ort der Inokulation und Abwehrlage des Infizierten. Symptome: uncharakteristische allgemeine Krankheitssymptome wie Fieber, Gewichtsverlust, Schwächegefühl und Nachtschweiß; bei Lungentuberkulose (>90% aller Fälle) Husten, Auswurf, Dyspnoe, häufig exsudative Pleuritis, später Hämoptysen (Auswurf mit Blutbeimengung) (Die primäre Lungeninfektion verläuft häufig symptomlos und heilt klinisch unter Zurücklassung röntgenologisch sichtbarer Narbenbildung und Verkalkungen ab, hinterlässt aber im Zentrum granulomatöser Läsionen offenbar lebenslang persistierende, vermehrungsfähige Tuberkuloseerreger!); bei Nierentuberkulose Dysurie, schmerzhafte Nierenlager, „sterile“ Leukozyturie, Hämaturie, im weiteren Verlauf Niereninsuffizienz; bei Meningitis tuberculosa Benommenheit, Kopfschmerzen, Schwindel, häufig Nackensteifigkeit, Ausfallerscheinungen der basalen Hirnnerven (weil die Schädelbasis bevorzugt befallen ist); bei Lymphknotentuberkulose schmerzhafte Lymphknotenschwellungen; bei Knochen- und Gelenktuberkulose Symptome abhängig von Lokalisation (häufig im Bereich der Wirbelsäule – Spondylodiscitis mit Rückenschmerzen und Bandscheibenvorfall-ähnlichen Beschwerden); bei Miliartuberkulose ggf. sepsisähnlicher Verlauf [2, 3]. Schwere, Verlauf und Prognose: Soweit sich der Primärkomplex – meist wegen hoher Infektionsdosen oder geschwächter Immunabwehr – nicht zurückbildet, kommt es zur Vergrößerung und Verflüssigung der Primärläsion und zur hämatogenen oder lymphogenen Streuung in unterschiedlichste Organsysteme (z. B. ZNS, Knochen, Haut, Nieren) und zur Ausbildung der entsprechenden Organtuberkulose. Bei Anschluss des nekrotischen Gewebes an das Bronchialsystem entsteht eine Kaverne, und es werden ggf. große Erregermengen über den Atemtrakt ausgeschieden (offene Lungentuberkulose mit höchster Ansteckungsgefahr!). Die Miliartuberkulose (lebensgefährlichste Verlaufsform) entwickelt sich durch Einbruch einer verkäsenden (nekrotischen) Läsion in eine Pulmonalvene mit unkontrollierter Erregeraussaat (bei kleinen Kindern oder Versagen der zellulären Immunabwehr aufgrund genetischer Defekte oder AIDS) [2,3]. Die Tuberkulose des Erwachsenen ist häufig Folge einer Reaktivierung alter, tuberkulöser Herde, so dass neben den oben angegebenen Inkubationszeiten Jahre bis Jahrzehnte bis zum Auftreten einer behandlungsbedürftigen Erkrankung vergehen können (Postprimärtuberkulose). Das Risiko, nach Infektion mit M. tuberculosis eine klinisch manifeste Tuberkulose zu entwickeln, ist in den ersten beiden Jahren nach Ansteckung am größten [2, 3]. Wichtigster Risikofaktor ist heute die HIV-Infektion; weitere Risikofaktoren sind Diabetes 3 Stand: 04/2014 mellitus, Silikose, Niereninsuffizienz, immunsuppressive Therapie, maligne hämatologische Erkrankungen, erhöhter Alkoholkonsum, Rauchen und Drogenabhängigkeit [10, 30]. Bei rechtzeitiger Diagnose, fehlender oder geringer Resistenz der Tuberkuloseerreger gegen Antituberkulotika und nicht völligem Versagen der zellulären Immunabwehr ist die Prognose der Tuberkulose heute im Allgemeinen gut. Miliartuberkulose oder tuberkulöse Meningitis sind aber weiterhin lebensbedrohende Erkrankungsformen; auch die Erkrankungen durch multiresistente Erregerstämme sind deutlich schwieriger auszuheilen und erfordern meist eine wesentlich längere Behandlungsdauer [2, 3, 27, 30]. Komplikationen/Folgekrankheiten: Wenn man den tuberkulösen Primärkomplex, der sich meist symptomlos zurückbildet, als primäre Infektionsfolge betrachtet, sind alle Formen der klinische manifesten, behandlungsbedürftigen Tuberkulose einschließlich der Postprimärtuberkulose mit ihren jeweiligen Organschäden als Komplikationen bzw. Folgekrankheiten anzusehen [2, 3]. Pathologie: Histologisch finden sich zwei Reaktionsformen: die exsudative und die produktive Reaktionsform. Die exsudative Reaktionsform entsteht als Folge einer Infektion bei einem Menschen (früher meist Kinder, heute auch Erwachsene), der vorher noch nicht mit M. tuberculosis in Kontakt gekommen war. Sie ist gekennzeichnet durch akute bis subakute Entzündungszeichen mit Exsudatbildung und Ansammlung polymorphkerniger Leukozyten. Die produktive (granulomatöse) Reaktionsform entwickelt sich als Ausdruck der aktivierten zellulären Immunabwehr bei Personen, die bereits einen Primärkomplex hinter sich haben. Die zugehörige Läsion ist der Tuberkel, der Makrophagen charakteristischer Morphologie, sogenannte Epitheloidzellen, enthält. Im Zentrum des Tuberkels verschmelzen diese Epitheloidzellen zu mehrkernigen LANGERHANSschen Riesenzellen [3]. Im nekrotischen Inneren der granulomatösen Herde entwickelt sich durch Zerfall der abgestorbenen Zellmasse eine amorphe, käsige Substanz, die sogenannte verkäsende Nekrose, die sich bei Freisetzung größerer Mengen hydrolysierender Enzyme verflüssigen kann und bei Anschluss an das Bronchialsystem ausgehustet wird, so dass sich ein Hohlraum, eine Kaverne, bildet, in der Tuberkelbakterien optimale Wachstumsbedingungen finden (s. o.) [2, 3]. Verkäsende Läsionen in der Lunge oder den regionären Lymphknoten können durch Fibrosierung und Verkalkung gegebenenfalls unter erheblicher Narbenbildung ausheilen, enthalten aber meist weiterhin vermehrungsfähige Erreger und bleiben im Röntgenbild lebenslang nachweisbar [2, 3]. Die Diagnose der Tuberkulose stützt sich auf bildgebende (z. B. Röntgenuntersuchung), Diagnose: immunologische sowie mikrobiologische Untersuchungsverfahren [3]. Eine detailliertere Beschreibung der Röntgendiagnostik der Tuberkulose geht über den Rahmen dieses Dossiers hinaus. Auf die Bedeutung von Kalkschatten in der Lunge und den Hiluslymphknoten für die Erkennung einer latenten Infektion mit M. tuberculosis wurde schon hingewiesen. Immunologische Diagnoseverfahren: Die Tuberkulinreaktion ist das klassische Verfahren zum Nachweis einer Auseinandersetzung des Immunsystems mit dem Tuberkuloseerreger und zugleich ein typisches Beispiel für eine Immunreaktion vom Spättyp [9]. Tuberkulin wird aus dem Überstand von Mykobakterienkulturen gewonnen und ist eine Mischung aus niedermolekularen Proteinen (heute als gereinigte Zubereitung: purified protein derivative – PPD). Zwei bis drei Tage nach Applikation des Tuberkulins kommt es an der Applikationsstelle zu einer Induration, nicht nur Hautrötung, wenn der entsprechende Patient mit M. tuberculosis in Kontakt getreten war (Der Test wird etwa 4 Wochen nach Erstinfektion positiv und bleibt es potentiell lebenslang unabhängig vom Verlauf der Krankheit!). Die Testung erfolgt heute weniger als TINE-Test (Applikation in die Haut mittels eines Stempels), sondern in der Regel als MENDEL-MANTOUX-Test (Applikation mittels einer feinen Nadel intrakutan) [2, 3, 11]. Ähnliche, aber spezifischere und empfindlichere diagnostische Aussagen erlauben die sogenannten IGRAs (Interferon-Gamma Release Assays) (weniger Kreuzreaktionen, auch nicht bei BCG-Geimpften!). Sie beruhen auf der durch spezifische M. tuberculosis-Antigene stimulierten Interferon-γ-Freisetzung aus sensibilisierten Lymphozyten von Patienten, deren Immunsystem auf den Tuberkuloseerreger reagiert hat. Das Prinzip ® kommt heute als QuantiFERON -TB Gold in-Tube- oder als T-SPOT.TB-Test zur Anwendung [4, 11, 14]. 4 Stand: 04/2014 Therapie: Mikrobiologische Nachweisverfahren: Diese umfassen mikroskopische, kulturelle und molekularbiologische Techniken [2, 3]. Da Tuberkuloseerreger langsam wachsen, im Untersuchungsmaterial oft nur in geringer Anzahl vorliegen bei gleichzeitig hoher Dichte schnell wachsender Bakterien der natürlichen Standortflora und da insbesondere Sputum häufig eine zäh-schleimige Beschaffenheit aufweist, wird den eigentlichen mikrobiologischen Untersuchungsschritten eine Vorbehandlung zur selektiven Dekontamination und Anreicherung vorgeschaltet (Behandlung mit NaOH zur Dekontamination, mit N-Acetylcystein zur Verflüssigung des Schleims und Zentrifugation zur Anreicherung). Bei primär sterilem Ausgangsmaterial entfällt die NaOHBehandlung [2, 3]. Der mikroskopische Erregernachweis stützt sich auf die genannte Säurefestigkeit: Die Mykobakterien werden mit Hilfe der ZIEHL-NEELSEN-Färbung oder einer Färbung mit Fluoreszenzfarbstoffen (z. B. Auramin) sichtbar gemacht, die beide auf demselben Prinzip der Säurefestigkeit beruhen. Die Erreger lassen sich allerdings nur zuverlässig auffinden, 4 wenn das Untersuchungsmaterial >10 Erreger/ml enthält. Bei geringerer Erregerdichte ist die Mikroskopie häufig falsch negativ. Außerdem erlaubt sie nur die Aussage „säurefeste Stäbchenbakterien“, eine Zuordnung zu einer Mykobakterienspezies lässt sich morphologisch nicht sicher vornehmen, auch wenn das Vorkommen zopfartiger Agglomerate („Cord-Bildung“) auf M. tuberculosis hinweist [3]. Der mikroskopische Nachweis von Tuberkulosebakterien im Sputum ist ein wichtiger Hinweis auf die Infektiosität des Patienten 4 (Erregerdichte ≥10 Bakterien/ml) [11]. Für den kulturellen Erregernachweis werden mindestens je ein fester Spezialnährboden und ein flüssiges Spezialmedium beimpft, denen Malachitgrün oder Antibiotika zur Unterdrückung der „Begleitflora“ zugesetzt sind, und die bis zu 8 Wochen bebrütet und dabei wöchentlich auf Wachstum überprüft werden. Flüssignährmedien, die einen Indikator zum Nachweis 14 14 mykobakteriellen Wachstums enthalten (z. B. C-markierte Fettsäuren, die zu CO2 metabolisiert werden, die in speziellen Detektionssystemen gemessen wird), haben eine kürzere Nachweisdauer als feste Nährböden und erlauben den Nachweis geringerer Erregerkonzentrationen. Geeignete Untersuchungsmaterialien sind Sputum, Trachealsekret, Bronchialspülflüssigkeit, bei Kleinkindern Magensaft, Urin (bei Nierentuberkulose), Stuhl (bei Darmtuberkulose), Liquor (bei tuberkulöser Meningitis), Biopsiematerial (z. B. bei Hauttuberkulose), operativ entnommene Lymphknoten, Blut oder Knochenmark (bei Miliartuberkulose) oder operativ gewonnenes Knochen- oder Gelenkmaterial [2, 3, 11]. Angezüchtete Mykobakterien werden anhand ihres Wachstumsverhaltens, ihrer Koloniemorphologie und bestimmter physiologischer Leistungen bis zur Speziesebene identifiziert, was einschließlich Primärkultur und Resistenzbestimmung 2-3 Monate dauern kann [2, 3]. Zur zuverlässigen Diagnose einer Lungentuberkulose sind mindestens 3 Morgensputumproben (nach Abhusten, kein Speichel!) zu untersuchen [11]. Molekularbiologische PCR-basierte Verfahren können sowohl den Direktnachweis von M. tuberculosis aus klinischem Untersuchungsmaterial als auch die Identifizierung aus der Kultur (nach Amplifikation des 16S-rRNA-Gens Nachweis der speziesspezifischen 16SrRNA-Signaturregion) erheblich beschleunigen. Allerdings ist der molekularbiologische Direktnachweis etwas unempfindlicher als die Kultur, was besonders bei Materialien mit geringer Erregerdichte ins Gewicht fällt. Bei allen Nachweisverfahren führt die Untersuchung mehrerer Proben zu einer deutlichen Steigerung der Nachweisempfindlichkeit [3]. Wegen des Vorkommens von Resistenzen gegen Antituberkulotika bis zur Multiresistenz hat die Empfindlichkeitsprüfung angezüchteter Tuberkuloseerreger, die gegenüber anderen Bakterien spezifische Besonderheiten aufweist, erhebliche praktische Bedeutung. Typische, gegen M. tuberculosis wirksame Chemotherapeutika sind: Isoniazid, Rifampicin, Pyrazinamid, Ethambutol, Streptomycin, Amikacin, Kanamycin, Capreomycin, Rifabutin, Rifapentin, Protionamid, Ethionamid, Cycloserin, p-Aminosalicylsäure (PAS) und neuere Fluorochinolone (Levofloxacin, Moxifloxacin) [2, 3, 24]. Als Antituberkulotika erster Wahl (Erstrangmedikamente) gelten Isoniazid, Rifampicin, Pyrazinamid und Ethambutol [24]; Reservetherapeutika (Zweitrangmedikamente) sind Protionamid, Ethionamid, Streptomycin, Kanamycin, Amikacin, Capreomycin, Rifabutin, Rifapentin, Cycloserin, p-Aminosalicylsäure und die Fluorochinolone Levofloxacin und Moxifloxacin [24]. Wegen der Gefahr des Auftretens resistenter Mutanten und wegen gewünschter synergistischer Wirkung wird eine Kombinationstherapie mit 3 bis 4 Pharmaka durchgeführt, die bei unkomplizierter Tuberkulose über 6 Monate fortgeführt werden muss. Standardtherapie der unkomplizierten Lungentuberkulose des Erwachsenen: Isoniazid, 5 Stand: 04/2014 Rifampicin, Pyrazinamid und Ethambutol für 2 Monate (Initialphase), gefolgt von einer 4monatigen Kontinuitätsphase mit Isoniazid und Rifampicin [24]. Bei extrapulmonalen Tuberkulosen, HIV-Koinfektion, Kindern und Patienten mit Grundkrankheiten anderer Art ist die Behandlungsdauer (Initial- und/oder Kontinuitätsphase) ggf. zu verlängern. Die Behandlung von Infektionen mit resistenten Stämmen erfordert viel Erfahrung und ein individuell adaptiertes Therapieschema und sollte deshalb speziellen Behandlungszentren vorbehalten bleiben [24]. Man unterscheidet Monoresistenz = Resistenz gegen ein einziges antituberkulöses Medikament; Polyresistenz = Resistenz gegen mehr als ein Medikament, jedoch nicht gegen Isoniazid und Rifampicin; Multiresistenz („multidrug-resistant tuberculosis“ – MDR-TB = Resistenz gegen die zwei Erstrangmedikamente Isoniazid und Rifampicin; und „extensively drug-resistant tuberculosis“ – XDR-TB = MDR-TB plus Resistenzen gegen eines der Fluorochinolone und mindestens eines der injizierbaren Reserveantituberkulotika (Amikacin, Capreomycin, Kanamycin) [30]. Prophylaxe (Prävention): Die Impfung mit einem attenuierten Mycobacterium-bovis-Stamm (BCG = Bacille CALMETTE-GUÉRIN) wird von der Ständigen Impfkommission (STIKO) beim Robert-KochInstitut seit 1998 nicht mehr empfohlen, da sie nur begrenzt wirksam ist und nennenswerte Nebenwirkungen vor allem bei erworbener oder angeborener Immundefizienz haben kann [3, 30]. Bei Personen, die mit einem Patienten mit ansteckungsfähiger Tuberkulose Kontakt hatten und daraufhin Tuberkulin-positiv wurden und ein erhöhtes Erkrankungsrisiko aufweisen (z. B. Kinder <4 Jahre, Immunsupprimierte, Alkoholiker), besteht die Indikation zu einer Chemoprävention (präventiven Therapie) mit Isoniazid als Monobehandlung für (6-) 9 Monate. Sie soll bei Tuberkulinkonvertern innerhalb der vergangenen 2-3 Jahre eine Effektivität von 60-80% aufweisen. Als Chemoprophylaxe wird die medikamentöse Behandlung nach Kontakt mit ansteckenden Tuberkulosepatienten bereits vor Nachweis einer latenten tuberkulösen Infektion bezeichnet und wird ebenfalls mit Isoniazid durchgeführt. Wenn 8-12 Wochen nach dem letzten Kontakt mit der Indexperson keine latente Tuberkulose nachweisbar ist (IGRA-negativ), kann die Prophylaxe beendet werden [3, 24]. Da heute in Mitteleuropa der Mensch mit ansteckungsfähiger Tuberkulose (offene Lungentuberkulose) praktisch die einzige Infektionsquelle darstellt, kommt der frühzeitigen Erkennung und Behandlung Erkrankter große Bedeutung für die Verhinderung von weiteren Infektionen zu. Dies gilt besonders auch für die Reaktivierungstuberkulosen alter Menschen, die häufig spät erkannt werden und für ihr familiäres Umfeld eine nennenswerte Bedrohung darstellen. Weitere wichtige präventive Maßnahmen sind die Umgebungsuntersuchung erkrankter Personen, die Tuberkulin/IGRA-Testung und/oder Röntgenuntersuchung von Kontaktpersonen sowie die Überwachung von Risikogruppen (z. B. Immigranten aus Entwicklungsländern, beruflich exponierten Personen) [30]. Erkrankte an offener Lungentuberkulose sind bis zum Negativwerden der Erregerausscheidung über das Sputum zu isolieren [27, 30]. Die Beobachtung, dass die Behandlung von Patienten mit rheumatoider Arthritis mit antiTumornekrosefaktor-Medikamenten [monoklonale Antikörper Adalimumab (ADA), Infliximab (INF) und Atanercept (RTA)] das Risiko, an Tuberkulose zu erkranken, erhöht, erfordert bei Exposition ebenfalls die Durchführung einer Chemoprävention oder Chemoprophylaxe [7, 24]. Epidemiologie Übertragungswege und Eintrittspforten: Die aerogene Erregerübertragung durch Einatmen von „Tröpfchenkernen“ (<5µm), welche der Erkrankte beim Husten, Niesen, Sprechen oder Singen freisetzt, ist der epidemiologisch wichtigste Übertragungsweg [30]. Die Tröpfchen selbst sedimentieren rasch oder werden von den Selbstreinigungsmechanismen der Atemwege eliminiert, so dass von ihnen nur eine geringe Infektionsgefahr ausgeht [3]. Auf Oberflächen angetrocknete, erregerhaltige Tröpfchen werden trotz der erheblichen Trocknungsresistenz von M. tuberculosis ebenfalls nicht als relevante Infektionsquelle angesehen [30]. Auch bei extrapulmonalen Tuberkulosen kann es zur Erregerausscheidung kommen, z. B. über Urin, Eiter oder erregerhaltiges Wundsekret, von denen selten infektiöse Aerosole ausgehen können [16, 27, 30]. Ausnahmsweise kann der Tuberkuloseerreger auch perkutan durch Inokulation übertragen werden, wenn es zu Verletzungen mit einem kontaminierten Gegenstand (z. B. mit einer Injektionsnadel oder einem Skalpell bei der Sektion oder Operation) gekommen ist [17]. Erregerreservoire: M. tuberculosis ist primär ein menschlicher Krankheitserreger und wenigstens in Mitteleuropa ist der erkrankte Mensch gegenwärtig praktisch das einzige epidemiologisch 6 Stand: 04/2014 bedeutsame Erregerreservoir [30]. Obwohl die Tuberkulose durch M. tuberculosis an sich eine Erkrankung des Menschen ist, können Tiere, vor allem Haus- und Nutztiere (s. o.), gelegentlich durch Kontakt mit kranken Menschen infiziert werden und dann als Infektionsquelle für andere Menschen dienen. Diese Form der Tuberkulose ist demnach eine Anthropozoonose [30]. Infektionsentstehung: Primärinfektion: exogen durch Inhalation oder – selten – Inokulation des Erregers; Tuberkulose des Erwachsenenalters: häufig endogen als Ausdruck einer Reaktivierung einer latenten Infektion [2, 3, 27, 30]. Inzidenz/Prävalenz: Weltweit gehört die Tuberkulose zusammen mit AIDS und Malaria zu den häufigsten Infektionskrankheiten. Laut WHO erkrankten 2010 8,8 Millionen Menschen neu an dieser Krankheit, 2011 waren es noch 8,7 Millionen (minus 2,2%) [28]. Für die WHO-Region Europa wurden folgende Zahlen berichtet: Prävalenz: 56/100.000; Inzidenz: 42/100.000 [28]. In Deutschland sind Inzidenz und Prävalenz niedrig und seit Jahren abnehmend: 4.330 gemeldete Fälle im Jahr 2010, was einer Inzidenz von 5,3 pro 100.000 Einwohner entspricht [13]; 96,3% dieser Fälle betrafen Erwachsene, 3,7% Kinder <15 Jahre. Überproportional hohe Inzidenzraten betreffen Personen, die aus Hochprävalenzländern stammen [30]. Mortalität/Letalität: Laut WHO lag die Zahl der Todesfälle an Tuberkulose 2011 weltweit bei 1,4 Millionen Menschen [28]. Für die WHO-Region Europa wird für 2011 eine Mortalität (ohne HIVKoinfektion) von 5/100.000 Einwohner (absolut 45.000 Todesfälle) angegeben. In Deutschland lag die Mortalität 2010 bei 0,17/100.000 Einwohner, die entsprechende Letalität betrug 3,1% [13]. Infektiosität/Kontagionsindex: Bis zu 17% der IGRA-positiven Erwachsenen entwickeln eine aktive Tuberkulose; bei deutlicher Immundefizienz liegt der Prozentsatz wesentlich höher. Bei Kindern steigt das Erkrankungsrisiko in Abhängigkeit vom Lebensalter auf mehr als 40% an [30]. Zoonose: Widerstandsfähigkeit - Tenazität Endosporenbildung: keine [21]. Resistenzen (Trockungs-, Chemo-, Thermo-, Strahlenresistenz ): ausgeprägte Widerstandsfähigkeit gegenüber zahlreichen äußeren Umwelteinflüssen durch hohen Lipidgehalt der Zellwand; höhere Resistenz gegenüber kationischen Detergentien und manchen Desinfektionsmitteln; hohe Austrocknungsresistenz (Überleben im Staub oft monatelang möglich) [2, 3, 21]. Resistenz gegen antituberkulöse Medikamente nimmt leider gerade in den entwickelten Ländern zu: In Deutschland betrug im Jahr 2010 die Multiresistenz 1,7%, andere Resistenzen fanden sich bei 12,6% der Stämme [13]. Weltweit erreichten MDR-TB-Stämme 2011 die Zahl von 60.000, in der WHO-Region Europa lag der Prozentsatz bei 15% für Neuinfektionen und bei 44% für Wiederbehandlungen [28]. 7 Stand: 04/2014 Arbeits- und Gesundheitsschutz/Gefährdungsbeurteilung Schutzstufe/Sicherheitsstufe: Schutzstufe 3 nach BioStoffV bzw. Sicherheitsstufe 3 nach GenTSV. Die mikroskopische Untersuchung von menschlichem Untersuchungsmaterial, der direkte molekularbiologische Erregernachweis sowie der Ansatz von diagnostischen Kulturen können unter Bedingungen der Schutzstufe 2 erfolgen (TRBA 100). Die Weiterverarbeitung positiver Kulturen muss dann in Schutzstufe 3 vorgenommen werden. Gefährdende Tätigkeiten/Expositionssituationen: häufiger und/oder längerer und/oder intensiver, ungeschützter Kontakt mit ansteckungsfähigen Patienten; gefährdende Tätigkeiten in medizinischen Einrichtungen: Sputuminduktion, Bronchoskopie, Intubation, Beatmung (Absaugen), Reanimation. Weitere Tätigkeitsbereiche mit erhöhtem Expositionsrisiko: Pathologie, Rechtsmedizin, bakteriologische Laboratorien, Betreuung von Risikogruppen (Obdachlose, Drogenabhängige, Häftlinge, HIV-Infizierte, Migranten aus Hochprävalenzländern) [27, 30]. Organisatorische und technische Maßnahmen: Isolierung von Patienten mit vermuteter oder bestätigter Tuberkulose bis zum Ausschluss bzw. für die Dauer ihrer Ansteckungsfähigkeit (keine Kohortenisolierung!); ausreichende Raumlüftung (häufige Fensterlüftung nach außen oder raumlufttechnische Anlage mit Unterdruck im Patientenzimmer, Schleuse für Patientenzimmer nicht erforderlich!); strikte Trennung von Patienten mit HIV-Infektion; ansteckungsfähige Patienten sollten ihr Isolierzimmer nicht verlassen oder beim Verlassen sowie bei Anwesenheit anderer Personen im Isolierzimmer einen Mund-Nasen-Schutz tragen. Bei geschlossener Lungentuberkulose und extrapulmonalen Formen ist eine Isolierung in der Regel nicht erforderlich; kontaminierte Bereiche umgehend mit gegen Mykobakterien wirksamem Desinfektionsmittel desinfizieren, sonst entsprechend Hygieneplan Flächen täglich desinfizierend reinigen; kontaminierte Gegenstände und Abfälle im Patientenzimmer in dicht verschließbaren Behältnisse zur Entsorgung sammeln [27, 30]. Spezielle tätigkeitsbezogene Schutzmaßnahmen: soweit möglich, Vermeidung von Expositionssituationen (s. o.) und Vermeidung von Aerosolbildung, Patienten zur Kooperationsbereitschaft anhalten („Hustenetikette“), Händedesinfektion auch bei Verwendung von Handschuhen [27, 30]! Persönliche Schutzausrüstung (PSA): bei Versorgung ansteckungsfähiger Patienten Tragen eines Atemschutzes, der die Kriterien einer FFP-2-Maske nach DIN EN 149 erfüllt (gilt auch für Reinigungs- und technisches Personal, Besucher); Schutzkittel (über der normalen Dienstkleidung) und Schutzhandschuhe tragen (bei hoher Kontaminationsgefahr Einwegkittel verwenden), die ebenfalls im Patientenzimmer zur Entsorgung gesammelt werden [27, 30]. Berufsbedingte Erkrankungen/gefährdete Personen und Berufsgruppen: Tuberkulose als Berufskrankheit: medizinisches Personal einschließlich Beschäftigte in der Pathologie, Rechtsmedizin und Mikrobiologie, Mitpatienten, Betreuer von Risikogruppen (s. o.), in der Geriatrie und Altenpflege Tätige, Beschäftigte im Rettungsdienst [27, 30]. Sofortmaßnahmen bei Unfällen/Erste Hilfe: desinfizierende Reinigung kontaminierter Bereiche, Händedesinfektion und Desinfektion kontaminierter anderer Hautoberflächen [27, 30]; bei mutmaßlicher Inhalation von erregerhaltigen Aerosolen nach Rücksprache mit dem D-Arzt oder Betriebsarzt evtl. Chemophrophylaxe [24]. Arbeitsmedizinische Vorsorge: § 4 und Anhang Teil 2 Abs.1 ArbMedVV. Andere gesetzliche Regelungen: Infektionsschutzgesetz (IfSG): Nach § 6 Abs. 1 Nr.1 IfSG sind vom feststellenden Arzt namentlich zu melden Erkrankung und Tod an einer behandlungsbedürftigen Tuberkulose, auch wenn ein bakteriologischer Nachweis nicht vorliegt. Gemäß § 9 Abs. 1 Nr. 10 IfSG sind der Meldung hinzuzufügen das Land, in dem die Infektion wahrscheinlich erworben wurde sowie Geburtsland und Staatsangehörigkeit des Patienten. Außerdem ist nach § 7 Abs. 1 Nr. 32 IfSG durch das untersuchende Laboratorium namentlich zu melden der direkte Nachweis von Mycobacterium tuberculosis/africanum, Mycobacterium bovis: „Meldepflicht für den direkten Erregernachweis sowie nachfolgend für das Ergebnis der Resistenzbestimmung; vorab auch für den Nachweis säurefester Stäbchen im Sputum“. 8 Stand: 04/2014 Literatur [1] [2] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] [18] [19] [20] Aranaz, A., Liébana, E., Gómez-Mampaso, E., Galán, J. C., Cousins, D., Ortega, A., Blázquez, J., Baquero, F., Mateos, A., Súarez, G., & Domínguez, L. 1999. Mycobacterium tuberculosis subsp. caprae subsp. nov.: a taxonomic study of a new member of the Mycobacterium tuberculosis complex isolated from goats in Spain. Int. J. Syst. Bacteriol. 49: 1263-1273. Bange, F.-C., Hahn, H., Kaufmann, S. H. E., & Ulrichs, T. 2012. 41 Mykobakterien, in: Suerbaum, S., Hahn, H., Burchard, G.-D., Kaufmann, S. H. E., & Schulz, Th. (Hrsg.): Medizinische Mikrobiologie und Infektiologie, 7. Aufl., pp. 341-355. Springer, Berlin-Heidelberg. Böttger, E. C. 2001. 4.22 Die Familie der Mycobacteriaceae, in: Köhler, W., Eggers, H. J., Fleischer, B., Marre, R., Pfister, H., & Pulverer, G. (Hrsg.): Medizinische Mikrobiologie, 8. Aufl., pp. 407-434. Urban & Fischer, München-Jena. Centers for Disease Control and Prevention. 2010. Updated Guidelines for Using Interferon Gamma Release Assays to Detect Mycobacterium tuberculosis Infection, United States. MMWR 59(No.RR-5). http://www.cdc.gov/mmwr/preview/mmwrhtml/rr5905a1.htm?s Cole, S.T, Brosch, R, Parkhill, J., Garnier, T., Churcher, C., Harris, D., Gordon, S.V., Eiglmeier, K., Gas, S., Barry, C.E. 3rd, Tekaia, F., Badcock, K., Basham ,D., Brown ,D., Chillingworth, T., Connor, R., Davies, R., Devlin, K., Feltwell, T., Gentles, S., Hamlin, N., Holroyd, S., Hornsby, T., Jagels, K., Krogh, A., McLean, J., Moule, S., Murphy, L., Oliver, K., Osborne, J., Quail, M.A., Rajandream, M.A., Rogers, J., Rutter, S., Seeger, K., Skelton, J., Squares, R., Squares, S., Sulston, J.E., Taylor, K., Whitehead, S., & Barrell, B.G. 1998. Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence. Nature 393. Collins, D.M. 1996. In search of tuberculosis virulence genes. Trends in Microbiol. 4 (11): 426-430. Dixon, W. G., Hyrich, K. L., Watson, K. D., Lunt, M., Galloway, J., Ustianowski, A., BSRBR Control Centre Consortium & Symmons, D. P. M., on behalf of the BSR Biologics Register. 2010. Drug-specific risk of tuberculosis in patients with rheumatoid arthritis treated with anti-TNF therapy: results from the British Society for Rheumatology Biologics Register (BSRBR). Ann. Rheum. Dis. 69(3): 522-528. Euzéby, J. F. 2012. List of Prokaryotic Names with Standing in Nomenclature. http://www.bacterio.cict.fr Fleischer, B., & Bröker, B. M. 2001. 1.2 Prinzipien der immunologischen Infektabwehr, in: Köhler, W., Eggers, H. J., Fleischer, B., Marre, R., Pfister, H., & Pulverer, G. (Hrsg.): Medizinische Mikrobiologie, 8. Aufl., pp. 17-60. Urban & Fischer, München-Jena. Götsch, U., & Bellinger, O. 2012. Tuberkulose in Großstädten: Untersuchung von Risikofaktoren am Beispiel Frankfurt am Main. Epid. Bull. Nr. 12/2012, pp. 101-102. Graber, P. 2012. Update Tuberkulose 2012. www.aerztekongress-arosa.ch/fileadmin/.../Tbc_Update_Handout.pdf. Guo, S., Xue, R., Li, Y., Wang, S.M., Ren, L., & Xu, J.J. 2012. The CFP10/ESAT6 complex of Mycobacterium tuberculosis may function as a regulator of macrophage cell death at different stages of tuberculosis infection. Med. Hypoth. 78 (3): 389-392. Haas, W. 2012. Welttuberkulosetag 2012 – Tuberkulose im Fokus. Epid. Bull. Nr. 11/2012, pp. 87-88. Hauer, B., & Loddenkemper, R. unter Mitarbeit von Detjen, A., Forßbohm, M., Haas, W., Loytved, G., Magdorf, K., Mauch, H., Nienhaus, A., Rieder, H. L., Sagebiel, D., & Schaberg, T. 2006. Interferon-γTests in der Tuberkulose-Diagnostik – Aktueller Stand. Pneumologie 60: 29-44. Karls, R.K., Guarner, J., McMurray, D.N., Birkness, K.A., & Quinn, F.D. 2006. Examination of Mycobacterium tuberculosis sigma factor mutants using low-dose aerosol infection of guinea pigs suggests a role for SigC in pathogenesis. Microbiol. 152: 1591-1600. Keijman, J., Tjhie, J., Olde Damink, S., & Alink, M. 2001. Unusual Nosocomial transmission of Mycobacterium tuberculosis. Eur. J. Clin. Microbiol. Infect. Dis. 20(11): 808-809. Kramer, F., Sasse, S. A., Simms, J. C., & Leedom, J. M. 1993. Primary cutaneous tuberculosis after a needle-stick injury from a patient with AIDS and undiagnosed tuberculosis. Ann. Intern. Med. 119: 594595. Kubica, G. P., Kim, T. H., & Dunbar, F. P. 1972. Designation of strain H37Rv as the neotype of Mycobacterium tuberculosis. Int. J. Syst. Bacteriol. 22(2): 99-106. Lehmann, K. B., & Neumann, R. 1896. Atlas und Grundriss der Bacteriologie und Lehrbuch der speziellen bacteriologischen Diagnostik, 1. Aufl. J. F. Lehmann, München. Lewis, K.N., Liao, R., Guinn, K.M., Hickey, M.J., Smith, S., Behr, M.A., & Sherman, D.R. 2003. Deletion of RD1 from Mycobacterium tuberculosis mimics Bacille Calmette-Guérin attenuation. J. Infect. Dis. 187 (1): 117-123. 9 Stand: 04/2014 AL [21] Magee, J. G., & Ward, A. C. 1012. Genus I. Mycobacterium Lehmann and Neumann 1896, 363 , in: Goodfellow, M., Kämpfer, P., Busse, H.-J., Trujillo, M. E., Suzuki, K.-i., Ludwig, W., & Whitman, W. B. nd (Eds.): Bergey’s Manual of Systematic Bacteriology, 2 Edition, Vol. 5: The Actinobacteria, Part A, pp. 312-375. Springer, New York-Dordrecht-Heidelberg-London. [22] Mahairas, G.G., Sabo, P.J., Hickey, M.J., Singh, D.C., & Stover, C.K. 1996. Molecular analysis of genetic differences between Mycobacterium bovis BCG and virulent M. bovis. J. Bacteriol. 178 (5): 1274-1282. [23] Saviola, B. & Bishai, W. 2006. The Genus Mycobacterium – Medical, in: Dworkin, M., Falkow, S., Rosenberg, E., Schleifer, K.-H. & Stackebrandt, E. (Eds.): The Prokaryotes, Vol. 3 part 6, pp. 919-933, Springer, New York. [24] Schaberg, T. 2012. Zur aktuellen Tuberkulose-Therapie in Deutschland. Epid. Bull. Nr. 11/2012, pp. 8992. [25] Stoop, E.J.M., Schipper, T., Rosendahl Huber, S.K., Nezhinsky, A.E., Verbeek, F.J., Gurcha, S.S., Besra, G.S., Vandenbroucke-Grauls, C.M.J.E., Bitter, W., & van der Sar, A.M. 2011. Zebrafish embryo screen for mycobacterial genes involved in the initiation of granuloma formation reveals a newly identified ESX-1 component. Dis. Models & Mechanisms 4: 526-536. [26] Sun, R., Converse, P.J., Ko, C., Tyagi, S., Morrison, N.E., & Bishai, W.R. 2004. Mycobacterium tuberculosis ECF sigma factor sigC is required for lethality in mice and for the conditional expression of a defined gene set. Mol. Microbiol. 52 (1): 25-38. [27] Wischnewski, N., & Mielke, M. 2006. Prävention der nosokomialen Übertragung der Tuberkulose – Übersicht über verschiedene nationale Empfehlungen. Hyg. Med. 31(3): 84-92. [28] World Health Organization. 2011. Global tuberculosis control: WHO report 2011, Geneva, Switzerland. WHO/HTM/TB/2012.6. [29] Zheng, H., Lu, L., Wang, B., Pu, S., Zhang, X., Zhu, G., Shi, W., Zhang, L., Wang, H., Wang, S., Zhao, G., & Zhang, Y. 2008. Genetic basis of virulence attenuation revealed by comparative genomic analysis of Mycobacterium tuberculosis strain H37Ra versus H37Rv. PLoS one 3(6): e2375. [30] Ziegler, R., Just, H.-M., Castell, S., Diel, R., Gastmeier, P., Haas, W., Hauer, B., Loytved, G., Mielke, M., Moser, L., Nienhaus, A., Richter, E., Rüden, H., Rüsch-Gerdes, S., Schaberg, T., Wischnewski, N., & Loddenkemper, R. 2012. Infektionsprävention bei Tuberkulose – Empfehlungen des DZK. Pneumologie 66: 269-282. [31] Zopf, W. 1883. Die Spaltpilze, pp. 1-100. Edward Trewendt, Breslau. 10 Stand: 04/2014